Shpesh formulat kimike të substancave përshkruhen në formë. Formulat kimike të substancave
2.1. Gjuha kimike dhe pjesët e saj
Njerëzimi përdor shumë gjuhë të ndryshme. Përveç gjuhët natyrore(Japonisht, anglisht, rusisht - më shumë se 2.5 mijë në total), ka gjithashtu gjuhë artificiale psh Esperanto. Ndër gjuhët artificiale spikat gjuhët të ndryshme shkencat. Pra, në kimi, njeriu përdor të vetin, gjuha kimike.
gjuha kimike- një sistem simbolesh dhe konceptesh të krijuara për regjistrimin dhe transmetimin konciz, konciz dhe vizual të informacionit kimik.
Një mesazh i shkruar në shumicën e gjuhëve natyrore ndahet në fjali, fjali në fjalë dhe fjalë në shkronja. Nëse fjalitë, fjalët dhe shkronjat i quajmë pjesë të gjuhës, atëherë mund të dallojmë pjesë të ngjashme në gjuhën kimike (Tabela 2).
Tabela 2.Pjesë gjuha kimike
Është e pamundur të zotërosh çdo gjuhë menjëherë, kjo vlen edhe për gjuhën kimike. Prandaj, tani për tani do të njiheni vetëm me bazat e kësaj gjuhe: mësoni disa "shkronja", mësoni të kuptoni kuptimin e "fjalëve" dhe "fjalive". Në fund të këtij kapitulli, do të njiheni me tituj kimikatet janë pjesë përbërëse e gjuhës kimike. Ndërsa studioni kiminë, njohuritë tuaja për gjuhën kimike do të zgjerohen dhe thellohen.
GJUHA KIMIKE.
1. Cilat gjuhë artificiale dini (përveç atyre të përmendura në tekstin e tekstit shkollor)?
2. Si ndryshojnë gjuhët natyrore nga ato artificiale?
3. A mendoni se është e mundur të bëhet pa përdorimin e gjuhës kimike kur përshkruhen dukuritë kimike? Nëse jo, pse jo? Nëse po, cilat do të ishin avantazhet dhe disavantazhet e një përshkrimi të tillë?
2.2. Simbolet e elementeve kimike
Simboli për një element kimik tregon vetë elementin ose një atom të atij elementi.
Çdo simbol i tillë është një emër i shkurtuar latin i një elementi kimik, i përbërë nga një ose dy shkronja të alfabetit latin (shih Shtojcën 1 për alfabetin latin). Simboli është me shkronjë të madhe. Simbolet, si dhe emrat rusë dhe latinë të disa elementeve, jepen në tabelën 3. Aty jepen edhe informacione për origjinën e emrave latinë. rregull i përgjithshëm shqiptimi i simboleve nuk ekziston, prandaj, tabela 3 tregon gjithashtu "leximin" e një simboli, domethënë se si lexohet ky simbol në një formulë kimike.
Është e pamundur të zëvendësohet emri i një elementi me një simbol në fjalimin gojor, por në tekstet e shkruara me dorë ose të shtypura kjo lejohet, por nuk rekomandohet. elementet kimike, 109 prej tyre kanë emra dhe simbole të miratuara nga Unioni Ndërkombëtar i Kimisë së Pastër dhe të Aplikuar (IUPAC).
Tabela 3 jep informacion vetëm për 33 elementë. Këto janë elementet që do të hasni së pari kur studioni kiminë. Emrat rusë (në rend alfabetik) dhe simbolet e të gjithë elementëve janë dhënë në Shtojcën 2.
Tabela 3Emrat dhe simbolet e disa elementeve kimike
Emri |
||||
latine |
Shkrimi |
|||
| - | Shkrimi |
Origjina |
- | - |
| Azoti | N itrogjenium | Nga greqishtja. "lindja e kripës" | "en" | |
| Alumini | Al uminium | Nga lat. "shpif" | "alumini" | |
| Argoni | Ar gon | Nga greqishtja. "joaktive" | "argon" | |
| Barium | Ba rium | Nga greqishtja. "e rende" | "barium" | |
| Bor | B orum | Nga arabishtja. "Mineral i bardhë" | "bor" | |
| Bromin | Br omum | Nga greqishtja. "e keqe" | "bromi" | |
| Hidrogjeni | H hidrogjen | Nga greqishtja. "lindja e ujit" | "hi" | |
| Heliumi | Ai lium | Nga greqishtja. "Dielli" | "helium" | |
| Hekuri | Fe rrum | Nga lat. "shpatë" | "ferrum" | |
| Ari | Au rum | Nga lat. "djegia" | "aurum" | |
| Jodi | I odum | Nga greqishtja. "vjollcë" | "jod" | |
| Kaliumi | K alium | Nga arabishtja. "lye" | "kalium" | |
| Kalciumi | Ca lcium | Nga lat. "gur gëlqeror" | "kalcium" | |
| Oksigjen | O ksigjenium | Nga greqishtja. "prodhues i acideve" | "rreth" | |
| Silikoni | Si licium | Nga lat. "stralli" | "silicium" | |
| Kripton | kr ypton | Nga greqishtja. "i fshehur" | "kripton" | |
| Magnezi | M a g nezium | Nga emri gadishujt e Magnezisë | "magnez" | |
| Mangani | M a n ganum | Nga greqishtja. "pastrimi" | "mangan" | |
| Bakri | Cu kumbulle | Nga greqishtja. emri rreth. Qipron | "cuprum" | |
| Natriumi | Na trium | Nga arabishtja, "detergjent" | "natrium" | |
| Neoni | Ne në | Nga greqishtja. " i ri" | "neoni" | |
| Nikel | Ni kolonë | Nga ai. "Bakri i Shën Nikollës" | "nikel" | |
| Mërkuri | H ydrar g yrum | lat. "argjendi i lëngshëm" | "hydrargyrum" | |
| Plumbi | P lum b um | Nga lat. emri i lidhjes së plumbit dhe kallajit. | "plumbum" | |
| Squfuri | S squfuri | Nga sanskritishtja "pluhur i ndezshëm" | "es" | |
| Argjendi | A r g entum | Nga greqishtja. "ngjyra te çelura" | "argentum" | |
| Karboni | C arboneum | Nga lat. "thëngjill" | "ce" | |
| Fosfori | P hosfor | Nga greqishtja. "dritë mbajtëse" | "pe" | |
| Fluori | F luorum | Nga lat. folja "të rrjedh" | "fluor" | |
| Klorin | Cl orum | Nga greqishtja. "e gjelber" | "klor" | |
| Krom | C h r omium | Nga greqishtja. "ngjyr" | "krom" | |
| Cezium | C ae s ium | Nga lat. "qiell blu" | "cesium" | |
| Zinku | Z i n sperma | Nga ai. "kallaj" | "zink" | |
2.3. Formulat kimike
Përdoret për t'iu referuar kimikateve formulat kimike.
Për substancat molekulare, formula kimike mund të tregojë gjithashtu një molekulë të kësaj substance.
Informacioni për një substancë mund të jetë i ndryshëm, kështu që ka të ndryshme llojet e formulave kimike.
Në varësi të plotësisë së informacionit, formulat kimike ndahen në katër lloje kryesore: protozoarët,
molekulare, strukturore dhe hapësinore.
Nënshkrimet në formulën më të thjeshtë nuk kanë një pjesëtues të përbashkët.
Indeksi "1" nuk futet në formula.
Shembuj të formulave më të thjeshta: ujë - H 2 O, oksigjen - O, squfur - S, oksid fosfori - P 2 O 5, butan - C 2 H 5, acid fosforik - H 3 PO 4, klorur natriumi (kripë e tryezës) - NaCl.
Formula më e thjeshtë e ujit (H 2 O) tregon se uji përmban elementin hidrogjeni(H) dhe elementi oksigjen(O), dhe në çdo pjesë (një pjesë është një pjesë e diçkaje që mund të ndahet pa humbur vetitë e tij.) të ujit, numri i atomeve të hidrogjenit është dy herë. më shumë numër atomet e oksigjenit.
Numri i grimcave, duke përfshirë numri i atomeve, e shënuar me shkronjën latine N. Duke treguar numrin e atomeve të hidrogjenit - N H , dhe numri i atomeve të oksigjenit është N O, ne mund ta shkruajmë atë
Ose N H: N O=2:1.
Formula më e thjeshtë e acidit fosforik (H 3 PO 4) tregon se acidi fosforik përmban atome hidrogjeni, atomet fosforit dhe atomet oksigjen, dhe raporti i numrit të atomeve të këtyre elementeve në çdo pjesë të acidit fosforik është 3:1:4, d.m.th.
NH: N P: N O=3:1:4.

Formula më e thjeshtë mund të hartohet për çdo individ kimike, dhe për një substancë molekulare, përveç kësaj, ajo mund të përbëhet formula molekulare.
Shembuj të formulave molekulare: ujë - H 2 O, oksigjen - O 2, squfur - S 8, oksid fosfori - P 4 O 10, butan - C 4 H 10, acid fosforik - H 3 PO 4.
Substancat jomolekulare nuk kanë formula molekulare.
Sekuenca e shkrimit të simboleve të elementeve në formulat më të thjeshta dhe molekulare përcaktohet nga rregullat e gjuhës kimike, të cilat do t'i mësoni ndërsa studioni kiminë. Sekuenca e karaktereve nuk ndikon në informacionin e përcjellë nga këto formula.
Nga shenjat që pasqyrojnë strukturën e substancave, ne do të përdorim vetëm deri tani goditje e valencës("dash"). Kjo shenjë tregon praninë ndërmjet atomeve të të ashtuquajturit lidhje kovalente(çfarë lidhjeje është kjo dhe cilat janë veçoritë e saj, do ta zbuloni së shpejti).
Në molekulën e ujit, atomi i oksigjenit është i lidhur me lidhje të thjeshta (të vetme) me dy atome hidrogjeni, dhe atomet e hidrogjenit nuk janë të lidhur me njëri-tjetrin. Kjo është ajo që tregon qartë formula strukturore ujë. ![]()
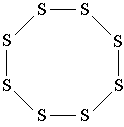
Një shembull tjetër: molekula e squfurit S 8 . Në këtë molekulë, 8 atome squfuri formojnë një cikël tetë anëtarësh në të cilin çdo atom squfuri është i lidhur me dy atome të tjera me lidhje të thjeshta. Krahasoni formulën strukturore të squfurit me modelin tredimensional të molekulës së tij të paraqitur në fig. 3. Ju lutemi vini re se formula strukturore e squfurit nuk përcjell formën e molekulës së tij, por tregon vetëm sekuencën e lidhjes së atomeve me lidhje kovalente.
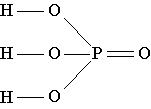
Formula strukturore e acidit fosforik tregon se në molekulën e kësaj substance një nga katër atomet e oksigjenit është i lidhur vetëm me atomin e fosforit me një lidhje të dyfishtë, dhe atomi i fosforit, nga ana tjetër, është i lidhur me tre atome të tjera të oksigjenit me lidhje të thjeshta. . Secili prej këtyre tre atomeve të oksigjenit, përveç kësaj, është i lidhur me një lidhje të thjeshtë me një nga tre atomet e hidrogjenit të pranishëm në molekulë./p>
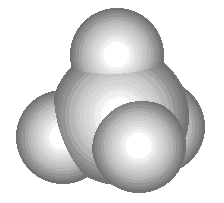
Krahasoni modelin tredimensional të mëposhtëm të molekulës së metanit me formulën e saj hapësinore, strukturore dhe molekulare:
|
|
|
Në formulën hapësinore të metanit, goditjet e valencës në formë pyke, sikur në perspektivë, tregojnë se cili nga atomet e hidrogjenit është "më afër nesh" dhe cili është "më larg nesh".
Ndonjëherë formula hapësinore tregon gjatësinë e lidhjes dhe vlerat e këndeve midis lidhjeve në molekulë, siç tregohet në shembullin e molekulës së ujit.

Substancat jomolekulare nuk përmbajnë molekula. Për lehtësinë e llogaritjet kimike në një substancë jo molekulare, të ashtuquajturat njësi formule.
Shembuj të përbërjes së njësive të formulës së disa substancave: 1) dioksidi i silikonit (rërë kuarci, kuarci) SiO 2 - njësi formule përbëhet nga një atom silikoni dhe dy atome oksigjeni; 2) klorur natriumi (kripë e zakonshme) NaCl - njësia e formulës përbëhet nga një atom natriumi dhe një atom klori; 3) hekuri Fe - një njësi formule përbëhet nga një atom hekuri Ashtu si një molekulë, një njësi formule është pjesa më e vogël e një substance që ruan vetitë e saj kimike.
Tabela 4
Informacioni i përcjellë nga lloje të ndryshme formulash
Lloji i formulës |
Informacioni kalohet nga formula. |
|
| Protozoar molekulare Strukturore Hapësinor |
|
|
Le të shqyrtojmë tani, me shembuj, se çfarë na japin formulat e informacionit të llojeve të ndryshme.
1. Substanca: acid acetik. Formula më e thjeshtë është CH 2 O, formula molekulare është C 2 H 4 O 2, formula strukturore
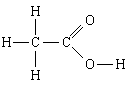
Formula më e thjeshtë na tregon se
1) acidi acetik përmban karbon, hidrogjen dhe oksigjen;
2) në këtë substancë, numri i atomeve të karbonit lidhet me numrin e atomeve të hidrogjenit dhe me numrin e atomeve të oksigjenit, si 1:2:1, d.m.th. N H: N C: N O = 1:2:1.
Formula molekulare shton se
3) në molekulën e acidit acetik - 2 atome karboni, 4 atome hidrogjeni dhe 2 atome oksigjen.
Formula strukturore shton se
4, 5) në molekulë, dy atome karboni janë të lidhur me një lidhje të vetme; njëri prej tyre, përveç kësaj, lidhet me tre atome hidrogjeni, secili me një lidhje të vetme, dhe tjetri me dy atome oksigjeni, me njëri një lidhje dyfishe dhe tjetra një lidhje e vetme; atomi i fundit i oksigjenit është gjithashtu i lidhur me një lidhje të thjeshtë me atomin e katërt të hidrogjenit.
2. Substanca: klorid sodium.
Formula më e thjeshtë është NaCl.
1) Kloruri i natriumit përmban natrium dhe klor.
2) Në këtë substancë, numri i atomeve të natriumit është i barabartë me numrin e atomeve të klorit.
3. Substanca: hekuri.
Formula më e thjeshtë është Fe.
1) Përbërja e kësaj substance përfshin vetëm hekurin, domethënë është një substancë e thjeshtë.
4. Substanca: acidi trimetafosforik . Formula më e thjeshtë është HPO 3, formula molekulare është H 3 P 3 O 9, formula strukturore
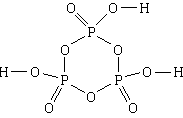
1) Përbërja e acidit trimetafosforik përfshin hidrogjen, fosfor dhe oksigjen.
2) N H: N P: N O = 1:1:3.
3) Një molekulë përbëhet nga tre atome hidrogjeni, tre atome fosfori dhe nëntë atome oksigjeni.
4, 5) Tre atome fosfori dhe tre atome oksigjeni, të alternuara, formojnë një cikël me gjashtë anëtarë. Të gjitha lidhjet në ciklin janë të thjeshta. Çdo atom fosfori, përveç kësaj, shoqërohet me dy atome të tjera oksigjeni, me një - një lidhje të dyfishtë, dhe tjetrën - një të thjeshtë. Secili nga tre atomet e oksigjenit të lidhur me lidhje të thjeshta me atomet e fosforit është gjithashtu i lidhur me një lidhje të thjeshtë me një atom hidrogjeni.
| Acidi fosforik - H 3 PO 4(një emër tjetër është acidi fosforik) - transparent pa ngjyrë substancë kristalore struktura molekulare, që shkrihet në 42 o C. Kjo substancë është shumë e tretshme në ujë dhe madje thith avujt e ujit nga ajri (në mënyrë higroskopike). Acidi fosforik prodhohet në sasi të mëdha dhe përdoret kryesisht në prodhimin e plehrave fosfatike, si dhe në industrinë kimike, në prodhimin e shkrepseve, madje edhe në ndërtim. Përveç kësaj, acidi fosforik përdoret në prodhimin e çimentos në teknologjinë dentare, është pjesë e shumë ilaçeve. Ky acid është mjaft i lirë sa që në disa vende, si në Shtetet e Bashkuara, acid fosforik shumë i pastër, shumë i holluar me ujë, u shtohet pijeve freskuese për të zëvendësuar acidin e shtrenjtë citrik. |
| Metan - CH 4. Nëse keni një sobë me gaz në shtëpi, atëherë çdo ditë hasni në këtë substancë: gazi natyror që digjet në ndezësit e sobës tuaj është 95% metan. Metani është një gaz pa ngjyrë dhe pa erë me një pikë vlimi prej -161 o C. Kur përzihet me ajrin, ai është shpërthyes, gjë që shpjegon shpërthimet dhe zjarret që ndodhin ndonjëherë në minierat e qymyrit (një emër tjetër i metanit është lagështia e zjarrit). Emri i tretë i metanit - gazi i kënetës - është për faktin se flluskat e këtij gazi të veçantë ngrihen nga fundi i kënetave, ku ai formohet si rezultat i aktivitetit të baktereve të caktuara. Në industri, metani përdoret si lëndë djegëse dhe lëndë e parë për prodhimin e substancave të tjera.Metani është më i thjeshti hidrokarbure. Kjo klasë substancash përfshin gjithashtu etanin (C 2 H 6), propan (C 3 H 8), etilen (C 2 H 4), acetilen (C 2 H 2) dhe shumë substanca të tjera. |
Tabela 5.Shembuj formulash të llojeve të ndryshme për disa substanca-