Energjia e një elektroni është maksimale në nivelin e energjisë. Llogaritja e numrit të orbitaleve atomike në nënnivele
1. Sistemi periodik i elementeve si formë e pasqyrimit të ligjit periodik . Formulimet e ligjit periodik. Rregullsitë kryesore të mbushjes së orbitaleve atomike me elektrone dhe formimi i periodave. s -, fq -, d - dhef -elementet dhe vendndodhja e tyre në sistemin periodik. Struktura e sistemit periodik: periudha të vogla dhe të mëdha, nëngrupe kryesore dhe dytësore. Pozicioni i lantanideve dhe aktinideve. Format moderne të tabelës periodike. Ligji periodik si bazë për zhvillimin e kimisë inorganike. Rëndësia e përgjithshme shkencore e ligjit periodik.
1 Me. 41–46; 2 Me. 46–55; 4 Me. 30–40; 5 . Me. 6–8, 21–32; 8 Me. 105–106; 11 Me. 75–203.
Ligji periodik në terma moderne: "Vetitë e atomeve të elementeve kimike, si dhe përbërja dhe vetitë e substancave që ato formojnë, janë në një varësi periodike nga ngarkesat. bërthamat atomike».
Shprehja grafike e ligjit periodik është tabela e sistemit periodik të elementeve. Ekziston vetëm një ligj periodik dhe njihen më shumë se 500 forma të sistemit periodik të elementeve. Prej tyre, më të zakonshmet periudhë e shkurtër(8 qeliza) , periudhë gjysmë e gjatë(18 qeliza) dhe periudhë e gjatë(32 qeliza).
Elementet kimike janë renditur në tabelën periodike sipas renditjes së ngarkesës në rritje të bërthamave të atomeve të tyre. Sistemi periodik përbëhet nga periudhave dhe grupe.
Periudha- një numër elementësh të renditur në rendin e rritjes së ngarkesës së bërthamave të atomeve të tyre, konfigurimi elektronik i nivelit të energjisë së jashtme të të cilave ndryshon nga ns 1 (metal alkali) në ns 2 np 6 (gaz fisnik). Për periudhën e parë - nga 1 s 1 (hidrogjen) në 1 s 2 (helium). Quhen periudha e parë, e dytë dhe e tretë i vogël(ose shkurt), pjesa tjetër - i madh(ose gjatë). Janë gjithsej 7 periudha.
Kuptimi fizik i numrit të periudhës – është e barabartë numri i niveleve të energjisë në atomet e elementeve kimike në një periudhë të caktuar. Për shembull, në atomet e elementeve të periudhës së 4-të, të cilat janë në gjendje të pangacmuar, elektronet shpërndahen në 4 nivele energjetike (4 predha elektronike).
Grupi – rresht vertikal elemente që kanë të ngjashme strukturë elektronike atomeve dhe duke shfaqur për rrjedhojë veti të ngjashme. Si rregull, numri i grupit tregon numri i elektroneve në një atom të një elementi që mund të marrë pjesë në formimin e një lidhjeje kimike.
2. Periodiciteti i vetive të atomeve të elementeve kimike. Faktorët që përcaktojnë natyrën e ndryshimit vetitë kimike elementet. "Konfigurimi" dhe "struktura" e predhave elektronike të atomit, ndryshimi i tyre në periudha dhe grupe. Rrezet e atomeve dhe joneve, raporti i vlerave të tyre. Rrezet efektive (kovalente, jonike, metalike) dhe orbitale. Ndryshimi i rrezeve të atomeve dhe joneve sipas periudhave dhe grupeve.
Energjia e jonizimit (potenciali i jonizimit) dhe afiniteti i elektroneve. Faktorët që përcaktojnë vlerat e tyre: rrezja e atomit, konfigurimi i shtresës së jashtme elektronike, ngarkesa efektive e bërthamës atomike. Modelet e ndryshimit të energjisë së jonizimit dhe afinitetit të elektroneve në periudha dhe grupe.
Koncepti i elektronegativitetit. Ndryshimi i elektronegativitetit të atomeve në periudha dhe grupe. Ndikimi i ndryshimit në elektronegativitetin e atomeve në natyrën e lidhjes kimike midis tyre. Ndryshimet në vetitë kimike të elementeve në grupe dhe periudha në varësi të strukturës predha elektronike, si dhe rrezet atomike.
1 Me. 46–51; 2 Me. 51–52, 94–98, 423; 99–103; 4 Me. 40–46; 5 Me. 6–9, 49–53; 7 Me. 81–90; 8 Me. 106–112; 11 Me. 63–67.
Faktorët më të rëndësishëm që përcaktojnë vetitë kimike të atomeve të elementeve kimike janë konfigurimi dhe struktura e predhave të tyre elektronike. Një rritje e njëpasnjëshme e ngarkesës së bërthamave atomike çon në një ndryshim periodik në konfigurimin elektronik të predhave të tyre të jashtme elektronike nga ns 1 deri në ns 2 np 6. Pasoja e kësaj është një ndryshim periodik i karakteristikave të atomeve si rrezja kovalente, jonike dhe metalike, energjia e jonizimit, afiniteti i elektroneve, gjendja e oksidimit, vëllimi atomik, etj.
Në mënyrë të rreptë, madhësia e çdo atomi është e pafundme, pasi ekziston një probabilitet jo zero për të gjetur elektronet e tij në një distancë arbitrare të madhe nga bërthama. Megjithatë, ekziston një maksimum kryesor në kurbën e shpërndarjes radiale të densitetit të elektroneve për çdo orbital. Bazuar në këtë, koncepti rrezja orbitale atom. Ai është i barabartë e llogaritur teorikisht distanca nga bërthama në maksimumin kryesor në kurbën e shpërndarjes radiale për orbitalin e jashtëm.
Duke folur për madhësinë e një atomi, më shpesh ata e nënkuptojnë atë efektiverreze. Vlerat e tij përcaktohen eksperimentalisht metodat e elektronografisë ose të difraksionit me rreze X, të cilat bëjnë të mundur gjetjen e distancave ndërbërthamore në molekula, kristalet jonike dhe metalike. Bazuar në vlerat e tyre, ata llogarisin në përputhje me rrethanat kovalente, jonike dhe metalike rreze atomike.
Vlera e rrezes efektive të një atomi varet nga shumë faktorë: struktura e substancës, natyra e lidhjes kimike, shkalla e oksidimit të elementit, etj. Koncepti i "rrezes atomike" është më në përputhje me kovalentin. dhe rrezet metalike të atomeve, ndërsa vlera e rrezes jonike varet fuqishëm nga mënyra e llogaritjes së saj nga të dhënat eksperimentale dhe për këtë arsye autorë të ndryshëm mund të ndryshojnë shumë.
Modeli i ndryshimit të vlerave të rrezeve atomike të elementeve kimike ka një karakter periodik.
Në periudha ndërsa ngarkesa e bërthamave atomike rritet (një rritje në numrin atomik) rrezja e atomeve zvogëlohet. Për shembull, tetë elementë të periudhës së 3-të (vetëm s- dhe R-elemente), rrezja zvogëlohet nga ora 190 pasdite (për natriumin) në 99 pasdite (për klorin), d.m.th., pothuajse 2 herë, dhe për dhjetë d-elementet e periudhës së 4-të, rrezja zvogëlohet nga ora 164 pasdite (për skandiumin) në 153 pasdite (për zinkun), d.m.th., vetëm me 7%.
Në grupe ndërsa ngarkesa e bërthamave rritet, rrezja e atomeve rritet, ndërsa në grupet A ( s- dhe fq-elemente), një rritje e tillë ndodh në një masë më të madhe sesa në grupet B ( d- dhe f-elementet).
d-Elementet e periodave të 5-të dhe të 6-të, të vendosur në të njëjtin grup, kanë pothuajse të njëjtat rreze atomike. Për shembull, rrezet atomike të zirkonit dhe hafniumit janë përkatësisht 160 pm dhe 150 pm, ndërsa ato të molibdenit dhe tungstenit janë përkatësisht 139 pm dhe 141 pm. Arsyeja për një afërsi të tillë të rrezeve është se në periudhën e 6-të 14 f-elemente, në atomet e të cilëve është e mbushur e treta e jashtme 4 f-Nënniveli i energjisë, i cili "mbron" fuqishëm elektronet e jashtme nga bërthama. Si rezultat, një rritje në ngarkesën e bërthamave atomike ka pak efekt në madhësinë e rrezeve atomike. Ky efekt quhet ngjeshja e lantanidit.
Energjia e jonizimit (E dhe ai. ) – energjia minimale e nevojshme për të hequr 1 elektron nga një atom i izoluar POR , e cila është në gjendjen e energjisë tokësore:
A 0 → A + + e – – E dhe ai.
Dalloni të parën ( E 1), e dyta ( E 2) dhe energjitë e mëvonshme të jonizimit që korrespondojnë me shkëputjen e elektroneve të parë, të dytë dhe të mëvonshëm. Njësia e energjisë së jonizimit është kJ/mol.
Potenciali i jonizimit (I ) –tensioni (diferenca potenciale) më e vogël e fushës elektrike në të cilën një elektron shkëputet nga një atom i izoluar.
Dalloni të parën ( I 1), e dyta ( I 2) dhe potencialet e mëvonshme të jonizimit që korrespondojnë me shkëputjen e elektroneve të parë, të dytë dhe të mëvonshëm. Njësia e potencialit të jonizimit është elektron volt, eV. Një eV korrespondon me 96.486 kJ/mol.
Vlera e energjisë së jonizimit të një atomi (dhe potenciali i tij jonizues) varet nga shumë faktorë: ngarkesa e bërthamës, rrezja e atomit, konfigurimi i shtresës elektronike të atomit.
Afiniteti i elektroneve (E kf. ) – energjia që lirohet ose absorbohet si rezultat i lidhjes së një elektroni me një atom të izoluar neutral A 0:
A 0 + e – → A – ± E kf.
Shtimi i një elektroni në një atom shoqërohet me çlirimi i energjisë(+e cf.), nëse kjo rezulton në grimcë atomike me një shtresë elektronike të qëndrueshme. Kjo është tipike, për shembull, për atomet halogjene. Nëse, si rezultat i lidhjes së një elektroni me një atom, formohet një grimcë atomike me një shtresë elektronike të paqëndrueshme, atëherë afiniteti elektronik i një atomi të tillë është negativ, d.m.th. energjia absorbohet(– e kf.). Kjo është e natyrshme, për shembull, në atomet metalike.
Elektronegativiteti (χ) – Vlera e kushtëzuar që karakterizon aftësinë e një atomi për të përbërje kimike tërheqin elektronet e valencës(çiftet e zakonshme të elektroneve).
Vlera e elektronegativitetit të një atomi në rastin më të thjeshtë përcaktohet në bazë të potencialit të tij jonizues dhe afinitetit të elektroneve.
Ekzistojnë shkallë të ndryshme në të cilat vlerat e χ të elementeve mund të ndryshojnë disi (elektronegativiteti sipas Pauling, sipas Mulliken, sipas Allred-Rochov, etj.). Në shumicën e shkallëve, fluori është elementi më elektronegativ dhe franciumi është më pak elektronegativ.
Me rritjen e numrit atomik Në një periudhë elektronegativiteti rritet, ndërsa në grup, si rregull, zvogëlohet. Për shembull, elektronegativiteti i oksigjenit është më i lartë se ai i karbonit, sepse ato ndodhen në të njëjtën periudhë, por oksigjeni ndodhet në të djathtë të karbonit. Elektronegativiteti i bariumit është më i ulët se ai i magnezit, pasi vlerat e tij ulen nga lart poshtë në një grup.
Nëse dy atome kanë të njëjtat vlera χ, atëherë midis tyre formohet një lidhje kimike jopolare kovalente. Nëse elektronegativiteti i atomeve nuk ndryshon shumë (ndryshimi në vlerat e elektronegativitetit Δχ nuk kalon 1.5), atëherë midis atomeve lind një lidhje polare kovalente. Çiftet e zakonshme të elektroneve që e formojnë atë gjithmonë zhvendosen në një atom me χ më të lartë, si rezultat i të cilit ai fiton një ngarkesë të pjesshme negative (δ–). Prandaj, atomi i dytë fiton një ngarkesë të pjesshme pozitive (δ+).
Pasoja e zgjidhjes së ekuacionit të Shrodingerit për atomin e hidrogjenit janë tre numra kuantikë që karakterizojnë sjelljen e një elektroni në një atom. Të njëjtat numrat kuantikë karakterizojnë në mënyrë unike gjendjen e elektroneve të çdo atomi të sistemit periodik të elementeve.
Numri kuantik kryesor n përcakton energjinë e elektronit dhe madhësinë e reve elektronike. Energjia e një elektroni varet kryesisht nga distanca e elektronit nga bërthama: sa më afër të jetë elektroni me bërthamën, aq më e ulët është energjia e tij. Prandaj, mund të themi se numri kuantik kryesor përcakton vendndodhjen e elektronit në një ose një tjetër niveli i energjisë(shtresa kuantike). Numri kuantik kryesor ka vlerat e një serie numrash të plotë nga 1 në Kur vlera e numrit kuantik kryesor është e barabartë me një, elektroni është në nivelin e parë të energjisë i vendosur në distancën minimale të mundshme nga bërthama. energji totale i një elektroni të tillë është më i vogli.
Elektroni në nivelin e energjisë më të largët nga bërthama ka energji maksimale. Prandaj, gjatë kalimit të një elektroni nga një nivel energjie më i largët në një nivel më të afërt, lëshohen pjesë (kuanta) të energjisë. Nivelet e energjisë tregohen me shkronja të mëdha sipas skemës:
Numri kuantik orbital Sipas llogaritjeve mekanike kuantike, retë elektronike ndryshojnë jo vetëm në madhësi, por edhe në formë. Forma e resë elektronike karakterizohet nga numri kuantik orbital ose azimutal. Forma e ndryshme e reve elektronike shkakton një ndryshim në energjinë e elektroneve brenda një niveli energjetik, d.m.th., ndarjen e tij në nënnivele të energjisë. Çdo formë e resë elektronike korrespondon me një vlerë të caktuar të momentit mekanik të elektronit, të përcaktuar nga numri kuantik orbital:
![]()
Numri kuantik orbital l. mund të ketë vlera nga 0 në të gjitha vlerat. Nënnivelet e energjisë shënohen me shkronja:
Me vlerën e numrit kuantik kryesor të barabartë me një, numri kuantik orbital ka vetëm një vlerë, të barabartë me zero. Kjo vlerë karakterizon retë elektronike që kanë simetri sferike (shih Fig. 1.3). Elektronet, numri kuantik orbital i të cilave është zero quhen -elektrone.
Vetëm -elektronet mund të jenë në nivelin e parë të energjisë, shënimi i tij i kushtëzuar Kur vlera e numrit kuantik kryesor është e barabartë me dy, numri kuantik orbital ka dy kuptime: numër orbital,
e barabartë me një korrespondon me formën në formë trap të një reje elektronike (forma e vëllimit tetë) (Fig. 1.4. Elektronet, numri kuantik orbital i të cilave është i barabartë me një quhen -elektrone.
Niveli i dytë i energjisë mund të përmbajë elektrone S dhe -, të cilat formojnë dy nënnivele: Kur vlera e numrit kuantik kryesor është tre, numri kuantik orbital ka tre vlera: Një numër kuantik orbital i barabartë me dy korrespondon me më shumë formë komplekse retë elektronike (Fig. 1.5). Elektronet me numër kuantik orbital prej dy quhen d-elektrone.
Niveli i tretë i energjisë mund të përmbajë -elektrone, të cilat formojnë tre nënnivele: Kur vlera e numrit kuantik kryesor është katër, numri kuantik orbital ka katër vlera: Një numër orbital i barabartë me tre korrespondon me një formë edhe më komplekse të reve. elektronet,
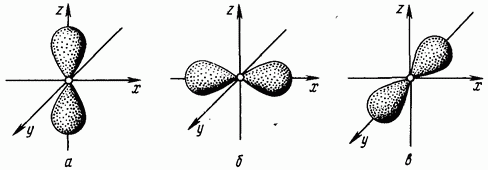
Oriz. 1.4. Elektronike -retë -orbitale; -orbitale; në - -orbitale

Oriz. 1.5. Elektroni d-retë - orbitale; -orbitale; c - orbitale; - -orbitale; - -orbitale
numri kuantik orbital i të cilave është tre, quhen -elektrone.
Niveli i katërt i energjisë mund të përmbajë dhe -elektrone, të cilat formojnë katër nënnivele;
Numri kuantik magnetik Nga zgjidhja e ekuacionit të Shrodingerit rezulton se retë elektronike janë të orientuara në hapësirë. Orientimi hapësinor i reve elektronike karakterizohet nga një numër kuantik magnetik.
Një fushë e jashtme magnetike ose elektrike ndryshon orientimin hapësinor të reve elektronike, prandaj, kur ekspozohen ndaj një fushe magnetike ose elektrike, nënnivelet e energjisë së elektroneve ndahen. në magnetike dhe fushat elektrike vërehet çarje e vijave spektrale atomike.
Numri kuantik magnetik merr çdo vlerë numerike të plotë nga deri në 0. Kështu, numri i vlerave të mundshme të numrit kuantik magnetik është nëse vlera e numrit kuantik orbital është zero, numri kuantik magnetik ka vetëm një vlera, e cila është zero (shih Fig. 1.3). Me një numër kuantik orbital të barabartë me një, numri kuantik magnetik ka tre vlera: Tre vlera të numrit magnetik karakterizojnë tre gjendje të -elektroneve, që korrespondon me orientimin e -reve në hapësirë në tre plane reciprokisht pingul përgjatë koordinatës. sëpata (shih Fig. 1.4).
Me një numër kuantik orbital të barabartë me dy, numri kuantik magnetik ka pesë vlera: . Pesë vlerat e numrit kuantik magnetik korrespondojnë me pesë pozicionet hapësinore të reve d-elektroni (Fig. 1.5). Numri kuantik orbital i barabartë me tre korrespondon me shtatë vlera të numrit magnetik dhe shtatë pozicione hapësinore të reve.
Orbitalet atomike (AO). Bazuar në konceptet e numrave kuantikë, është e mundur të përmirësohet përkufizimi i një orbitale elektronike në një atom. Grupi i pozicioneve të një elektroni në një atom, i karakterizuar nga vlera të caktuara të numrave kuantikë, quhet një orbitale atomike.
2. STRUKTURA ELEKTRONIKE E ATOMEVE. LIDHJA KIMIKE
Çdo gjendje e qëndrueshme e një elektroni në një atom karakterizohet nga vlera të caktuara të numrave kuantikë: n, l, ml, ms, të quajtura përkatësisht: kryesor, orbital, magnetik dhe spin.
Gjendja e një elektroni në një atom, që korrespondon me vlera të caktuara të numrave kuantikë n, ℓ, ml, quhet një orbitale atomike (a.o.). Përndryshe, orbitalja atomike është hapësira ku ka më shumë gjasa të qëndrojë elektroni.
Në varësi të vlerës së numrit kuantik orbital, përcaktimi i mëposhtëm i nënniveleve të energjisë pranohet:
– nënniveli (n/a) |
||
ℓ= 2 – d -*- ℓ= 3 – f -*-
Çdo lloj orbitale atomike ka formën e vet të resë elektronike. S është një orbitale sferike, p është një orbitale në formë shtangë dore, d është një orbitale në formë rozete dhe f është një orbitale me formë edhe më komplekse.
Numri i orbitaleve të çdo lloji përcaktohet nga numri i mënyrave për t'i orientuar ato në hapësirë, d.m.th. numri i vlerave të numrit kuantik magnetik - ml. Numri kuantik magnetik ka vlera (2ℓ + 1).
(Tabela 2.1).
Llogaritja e numrit të orbitaleve atomike në nënnivele | Tabela 2.1 |
||||
Emërtimi | Numri i vlerave | ||||
nënniveli | |||||
2;-1;0; + 1; + 2 | |||||
3;-2;-1;0; + 1;+2;+3 | |||||
Grafikisht, një orbitale atomike përshkruhet ose -. Numri (z) i orbitaleve atomike në një nivel energjie jepet nga za.o. = n2, ku n është numri kuantik kryesor.
Sipas parimit Pauli, një atom nuk mund të ketë dy elektrone të karakterizuar nga i njëjti grup numrash kuantikë. Nga kjo rrjedh se çdo orbitale atomike mund të pushtohet nga jo më shumë se dy elektrone, dhe numrat kuantikë të spinit të tyre duhet të jenë të ndryshëm, gjë që shënohet me ↓.
Kështu, numri i përgjithshëm i elektroneve në nivelin e energjisë përcaktohet me formulën ze = 2n2. Numri i elektroneve në një nënnivel përcaktohet nga formula 2(2ℓ + 1). Llogaritja e numrit të elektroneve dhe struktura e nivelit mund të paraqitet në formën e tabelës. 2.2.
Duke ditur strukturën e çdo nënniveli dhe niveli, është e mundur të hartohen formula elektronike të elementeve.
Gjendja e qëndrueshme (e pangacmuar) e një atomi multielektroni korrespondon me një shpërndarje të tillë të elektroneve mbi orbitalet atomike, në të cilën energjia e atomit është minimale. Prandaj, orbitalet atomike mbushen sipas rendit të rritjes së njëpasnjëshme të energjive të tyre. Rendi në të cilin orbitalet atomike mbushen me elektrone përcaktohet nga rregullat e Klechkovsky, të cilat marrin parasysh varësinë e energjisë së një orbitale nga vlerat e numrave kuantikë kryesorë (n) dhe orbitalë (ℓ). Sipas këtyre rregullave, orbitalet atomike mbushen me elektrone në rendin e rritjes sekuenciale të shumës (n + 1) (rregulli i parë i Klechkovsky), dhe për të njëjtat vlera të kësaj shume, në rendin e rritje e njëpasnjëshme në numrin kryesor n (rregulli i dytë i Klechkovsky).
Shpërndarja e elektroneve në orbitalet atomike brenda një nënniveli të energjisë përcaktohet nga rregulli i Hundit, sipas të cilit energjia minimale e një atomi korrespondon me një shpërndarje të tillë të elektroneve në orbitalet atomike të një nënniveli të caktuar, në të cilin vlera absolute e rrotullimit total i atomit është maksimal; me çdo rregullim tjetër të elektroneve, atomi do të jetë në gjendje të ngacmuar, d.m.th. do të ketë energji më të lartë.
Detyrat dhe ushtrimet
2.1. Si caktohet gjendja e një elektroni: a) me n=4, ℓ=2; b) me n=5, ℓ=3.
Zgjidhja: Gjatë regjistrimit të gjendjes energjetike, numri tregon numrin e nënnivelit (n), dhe shkronja tregon natyrën e nënnivelit (s, p, d, f). Për n=4 dhe ℓ=2 shkruajmë 4d; për n=5 dhe ℓ=3 shkruajmë 5f.
Tabela 2.2
Llogaritja e numrit të elektroneve
Emërtimi | Ze = 2 (2 ℓ + 1) | Ze = 2n2 | Struktura |
|||||
nënniveli | ||||||||
2 12 | ||||||||
2 22 | s2 p6 |
|||||||
Fundi i tryezës. 2.2
Emërtimi | Ze = 2 (2 ℓ + 1) | Ze = 2n2 | Struktura |
|||||||||
nënniveli | ||||||||||||
2 (2 2 + 1) = 10 | ||||||||||||
2 42 = 32 | s 2p 6d 10f 14 |
|||||||||||
2.2. Sa orbitale korrespondojnë me nivelin e tretë të energjisë? Sa elektrone ka në këtë nivel? Në sa nënnivele ndahet ky nivel?
Zgjidhje: Për nivelin e tretë energjetik n = 3, numri i orbitaleve atomike është 9 (32); ky numër orbitalësh është shuma e 1(s) + 3(p) + 5(d) = 9. Sipas parimit Pauli, numri i elektroneve në këtë nivel është 18. Niveli i tretë i energjisë është i ndarë në tre nënnivele : s, p, d (numri i nënniveleve është i njëjtë me numrin e vlerave të numrit kuantik kryesor).
Të gjitha elementet kimike mund të klasifikohet në varësi të natyrës së nënniveleve që do të plotësohen në 4 lloje:
s-elementet - mbush me elektrone ns - nënniveli; p-elementet - mbushja me elektrone np - nënniveli; d- elementet - mbushja me elektrone (n-1) d - nënniveli; f-elementet - mbush me elektrone (n-2) f - nënniveli.
Për të shkruar formulën elektronike të një elementi, duhet: të tregoni numrin e nivelit të energjisë me një numër arab, të shkruani vlerën e mirëfilltë të nënnivelit, të shkruani numrin e elektroneve si eksponent.
Për shembull: 26 FeIV 1s2 2s2 2p6 3s2 3p6 4s2 3d6 .
Formula elektronike është përpiluar duke marrë parasysh konkurrencën e nënniveleve, d.m.th. rregullat minimale të energjisë. Duke përjashtuar elektronikën e fundit
formula do të shkruhet: 26 Fe1V 1s2 2s2 2p6 3s2 3p6 3d6 4s2 . Valenca maksimale e një elementi përcaktohet nga numri i orbitaleve të valencës dhe varet nga lloji elektronik i elementit dhe numri i periudhës.
Struktura elektronike e elementeve sipas periodave dhe valenca maksimale janë paraqitur në tabelë. 2.3.
Tabela 2.3 Struktura elektronike dhe valenca maksimale e elementeve
Valence | ||||||||||||||||
Struktura | ||||||||||||||||
orbitalet | ||||||||||||||||
1s 1-2 | ||||||||||||||||
1s 22s 1-22p 1-6 | ||||||||||||||||
1s2 2s2 2p6 3s1-2 | 3d) | |||||||||||||||
3p 1-6 | ||||||||||||||||
4d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s 1-23d 1-104p 1-6 | ||||||||||||||||
5d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s2 3d10 4p6 5s1-2 | ||||||||||||||||
4d 1-105p 1-6 | ||||||||||||||||
6f) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | 6d) | |||||||||||||||
4s2 3d10 4p6 5s2 | ||||||||||||||||
4d 105p 66s 1-10 | ||||||||||||||||
5d 14f 1-145d 2-10 | ||||||||||||||||
6p 1-6 | ||||||||||||||||
2.3. Cili nënnivel mbushet në atom me elektrone pas mbushjes së nënnivelit: a) 4p; b) 4s?
R Zgjidhje: a) Nënniveli 4p korrespondon me shumën (n + l) të barabartë me 4+1 = 5. E njëjta shumë n+l karakterizon nënnivelet 3d (3+2 = 5)
dhe 5s (5+0 = 5). Megjithatë, gjendja 3d korrespondon me një vlerë më të vogël prej n (n = 3) sesa gjendja 4p, kështu që nënniveli 3d do të mbushet më herët se nënniveli 4p. Prandaj, pas plotësimit të nënnivelit 4p, do të plotësohet nënniveli 5s, që i përgjigjet një vlere më të madhe prej n (n=5).
b) nënniveli 4s korrespondon me shumën n+l = 4+0 = 4. E njëjta shumë n+l karakterizon nënnivelin 3р, por mbushja e këtij nënniveli i paraprin mbushjes së nënnivelit 4s, sepse kjo e fundit korrespondon me një vlerë më të madhe të numrit kuantik kryesor. Prandaj, pas nënnivelit 4s, nënniveli me shumën (n+l) = 5 do të plotësohet, për më tepër, nga të gjitha kombinimet e mundshme n+ℓ që i korrespondojnë kësaj shume (n=3, ℓ=2; n=4, ℓ =1; n= 5, ℓ=0), së pari do të zbatohet kombinimi me vlerën më të ulët të numrit kuantik kryesor, d.m.th. nënniveli 4s do të pasohet nga nënniveli 3d.
Përfundim: Kështu, mbushja e nënnivelit d mbetet me një niveli kuantik, mbushja e nënnivelit f mbetet pas me dy nivele kuantike.
2.4. Struktura elektronike e një atomi përshkruhet me formulën 1s 2 2s2 2p6 3s2 3d7 4s2 . Cili është ky element?
R Zgjidhja: Ky element i përket llojit elektronik
d-elementet 1U perioda, sepse nënniveli 3d ndërtohet nga elektronet; numri i elektroneve 3d7 tregon se ky është elementi i shtatë në rend. Numri i përgjithshëm i elektroneve është 27, që do të thotë se numri i serisë është 27. Ky element është kobalt.
2.5. Pse fosfori dhe vanadiumi vendosen në të njëjtin grup të tabelës periodike? Pse vendosen në nëngrupe të ndryshme?
R Zgjidhje: Konfigurimet elektronike të atomeve P 1s 2 2s2 2p3 3s 2 3p 3 ; V 1s2 2s2 2p6 3s2 3p6 4s 2 3d 3 . Elektronet e valencës janë të nënvizuara.
Këta elementë kanë të njëjtin numër elektronesh valente - 5. Prandaj, P dhe V ndodhen në të njëjtin grup të 5-të. Në të njëjtën kohë, këto elemente nuk janë homologe elektronike, sepse. ndërtoni nënnivele të ndryshme, kështu që ato nuk duhet të vendosen në të njëjtin nëngrup.
lidhje kimike është rezultat i bashkëveprimit mekanik kuantik të elektroneve.
Sipas natyrës së shpërndarjes së densitetit të elektroneve ndërmjet atomeve, lidhjet kimike ndahen në kovalente jopolare, polare dhe jonike (këtu nuk merret parasysh lidhja metalike e realizuar në metale). Nëse nuk ka zhvendosje të një çifti elektronesh, atëherë lidhja i afrohet një jopolare kovalente. Një lidhje polare kovalente kryhet nga një palë e zakonshme elektronesh të zhvendosur (polarizuar) në bërthamën e një prej atomeve partnere. Lidhja jonike konsiderohet jashtëzakonisht e polarizuar lidhje kovalente. Për të vlerësuar aftësinë e një atomi të një elementi të caktuar për të tërhequr një çift elektronik të përbashkët në vetvete, përdoret vlera e elektronegativitetit relativ (χ) (Tabela 5). Sa më i madh të jetë ndryshimi në elektronegativitet (Δχ), aq më i madh është polarizimi i lidhjes (aq më i lartë është jonikiteti i lidhjes). Besohet se nëse Δχ > 1.9, atëherë lidhja është jonike.
2.6. Llogaritni ndryshimin në elektronegativitetin relativ të atomeve për lidhjet H-O dhe E-O në përbërjet E(OH)2, ku E janë elementet Ca, Sr, Ba dhe përcaktoni:
nje Cfare N-O lidhje ose E-O karakterizohet në secilën molekulë nga një shkallë më e madhe jonikiteti; b) cila është natyra e jonizimit të këtyre molekulave në një tretësirë ujore?
Vendimi: a) Llogaritni Δχ për marrëdhënien midis E-O dhe H-O:
Δχ Ca-O = 3,5 - 1,04 = 2,46 ΔχSr-O = 3,5 - 0,99 = 2,51 Δχ Ba-O = 3,5 - 0,90 = 2,60 Δχ H-O = 3,5 - 2,1 = 1,4
Nga krahasimi i Δχ shohim se Komunikimi E-O mund të konsiderohet jonike, lidhja H-O është polare.
b) jonizimi në tretësirat ujore do të kryhet përgjatë lidhjes më jonike, d.m.th. sipas skemës: E (OH) 2 ↔ E2 + + 2OH- (sipas llojit
baza).
Forca e një lidhjeje kimike karakterizohet nga energjia (kJ/mol) dhe
gjatësia (nm ose A) e lidhjes. Sa më e lartë të jetë energjia e lidhjes dhe sa më e shkurtër të jetë gjatësia e saj, aq më e fortë është lidhja.
Lidhja kimike, d.m.th. një çift elektronik i përbashkët mund të formohet në dy mënyra: nga mekanizmi i shkëmbimit dhe dhurues-pranues. Një lidhje kimike karakterizohet nga tre veti kryesore:
1) ka një drejtim të caktuar në hapësirë. Nga ky këndvështrim, σ dhe lidhjet π. Këndi i formuar nga drejtimet e dy lidhjeve σ quhet kënd i valencës. Nëse një lidhje π kombinon disa atome, ajo quhet jo e lokalizuar;
2) priret në ngopje, si rezultat i së cilës grimcat kanë një përbërje dhe strukturë të caktuar. E mundur: koordinim

gjendjet e atomeve të pangopura, të ngopura në mënyrë koordinative, të ngopura me valencë dhe të pangopura me valencë;
3) mund të polarizohet nën ndikimin e faktorëve të ndryshëm (në varësi të elektronegativitetit të atomeve, si dhe nën ndikimin e një fushe të jashtme elektrike ose magnetike, nën veprimin e molekulave të tjera polare).
Për të shpjeguar strukturën gjeometrike të molekulave, përdoret koncepti i hibridizimit të orbitaleve atomike të atomit qendror. Sipas këtij koncepti, formimit të lidhjeve σ i paraprin një ndryshim në formën dhe energjinë e orbitaleve atomike. Orbitalet hibride janë formuar, të afta për mbivendosje më të thellë dhe rrjedhimisht lidhje më të forta. Për elementët e tipit elektronik s dhe p, orbitalet, duke përfshirë çiftet e elektroneve të pandarë, mund të marrin pjesë në hibridizim.
2.7. Tregoni formimin e një lidhjeje në një molekulë BF3 dhe një jon BF4. Shpjegoni strukturën e këtyre grimcave.
Zgjidhje: 1. Hartoni formulat elektronike të atomeve dhe io-
e re: B 1s2 2s2 2p1 ; F 1s2 2s2 2p5; F- 1s2 2s2 2p6 .
2. Le të tregojmë shpërndarjen e elektroneve mbi orbitalet e valencës. Në këtë rast, marrim parasysh shkallën e oksidimit të atomit të borit në përbërje (mund të supozojmë me kusht që numri i elektroneve të paçiftuara në atom korrespondon me shkallën e oksidimit).
3. Ne do të tregojmë formimin e të gjitha lidhjeve të mundshme, do të tregojmë mekanizmin e formimit të tyre:
3-lidhjet u formuan nga mekanizmi i shkëmbimit Bazuar në mundësitë valore të atomit
bori dhe tendenca e tij për ngopje, do të tregojmë formimin e lidhjes π nga mekanizmi dhurues-pranues. Por sepse kjo lidhje bashkon më shumë se dy atome
mov, do të jetë i pa lokalizuar.
Në jonin BF4 - formohen 4-lidhje σ, tre prej tyre nga shkëmbimi dhe një nga mekanizmi dhurues-pranues.

4. Llogaritni shumësinë e lidhjes si raport numri total lidhjet meσ-lidhjet. Në molekulën BF3, shumëfishimi i lidhjes është 1⅓; në jonin BF4, shumëfishimi i lidhjes është 1.
5. Le të përcaktojmë gjendjen e atomit qendror në termat e ngopjes
urat. Në molekulën BF3, valenca maksimale manifestohet për shkak të lidhjeve σ dhe π, prandaj, gjendja e atomit të borit është e ngopur me valencë.
Në jonin BF 4 - valenca maksimale manifestohet për shkak të lidhjeve σ, prandaj, gjendja e atomit të borit është e ngopur në mënyrë koordinative.
6. Le të përcaktojmë natyrën e lidhjes B-F për sa i përket polaritetit. Sepse diferenca në vlerën e elektronegativitetit (Δχ) është 4,0-2,0 = 2,0, d.m.th. më shumë se 1.9, lidhja mund të konsiderohet jonike.
7. Le të përcaktojmë llojin e hibridizimit të orbitaleve atomike të atomit qendror dhe formën gjeometrike të grimcave.
Në molekulën BF 3, orbitalet s dhe 2p përfshihen në formimin e lidhjeve σ, pra lloji i hibridizimit sp2. Molekula është trekëndore
strukturën. Në jonin BF4 - një s dhe tre orbitale p janë të përfshira në formimin e lidhjeve σ, pra lloji i hibridizimit sp3. Joni ka një formë katërkëndore.
8. Le të përshkruajmë grafikisht strukturën e grimcave
2.8. Tregoni formimin e lidhjeve në molekulën e SO3, shpjegoni strukturën e molekulës.
Zgjidhje: Formulat elektronike të elementeve
S 1s2 2s2 2p6 3s2 3p4 O 1s2 2s2 2p4 .
Sepse gjendja e oksidimit të atomit të squfurit është +6, do të tregojmë shpërndarjen e elektroneve mbi orbitalet valore të atomit të squfurit të ngacmuar.
Atomi i squfurit formon 3-lidhje σ (për shkak të orbitaleve një s dhe dy p-atomike) dhe 3-lidhje π (për shkak të një orbitalesh atomike p dhe dy d) nga mekanizmi i shkëmbimit.
Rrjedhimisht, atomi është i ngopur me valencë, i pangopur në mënyrë koordinative; Shumësia e lidhjes 6/3 = 2. Lidhja S-O polare, çiftet e zakonshme të elektroneve zhvendosen në oksigjen (Δχ = 0,5). Lloji i hibridizimit Sp2. Molekula ka strukturën e një trekëndëshi.

3. PËRBËRJE KOMPLEKSE
Komponimet komplekse luajnë një rol të rëndësishëm në jetën e organizmave të gjallë. Jonet e Na, K, Ca, Mg, të cilat kryejnë funksione të rëndësishme fiziologjike në trup, gjenden në gjak, limfë dhe lëngje indore në formën e përbërjeve komplekse. Jonet e Fe, Zn, Mn, Cu formojnë komponime komplekse me proteinat dhe janë pjesë e enzimave dhe vitaminave. Hekuri është pjesë e hemoglobinës. Hemoglobina është lidhja midis proteinës së globinës dhe kompleksit të hemit. Në hem, joni qendror është Fe2+.
Komponimet komplekse quhen komponime molekulare, kombinimi i përbërësve të të cilave çon në formimin e joneve komplekse të aftë për ekzistencë të lirë si në një kristal ashtu edhe në tretësirë. Në molekulat e përbërjeve komplekse, dallohen sferat e brendshme dhe të jashtme. Sfera e brendshme është e mbyllur në kllapa katrore dhe përbëhet nga një atom ose jon qendror, i quajtur agjent kompleks, dhe atome, jone ose molekula të koordinuara rreth saj, të quajtur ligandë.
Numri i ligandëve të koordinuar rreth agjentit kompleks përcakton numrin e tij të koordinimit (c.h.). Kjo e fundit tregon numrin e lidhjeve σ që lindin ndërmjet f.p. dhe ligandët.
Lidhja ndërmjet k.ch. | k.o. dhe gjendjen e tij të oksidimit |
||
Gjendja e oksidimit | |||
Molekula c.s. neutrale elektrike. Ngarkesa e sferës së brendshme e barabartë me ngarkesën e jashtme me shenjën e kundërt. Ngarkesa e një joni kompleks është e barabartë me shumën algjebrike të ngarkesave k.o. dhe ligandët.
Klasifikimi i komponimeve komplekse
1. Nga natyra e ngarkesës së jonit kompleks
- kationike: e formuar për shkak të koordinimit rreth një c.o të ngarkuar pozitivisht. molekulat e ligandit neutral
Cl2; Cl3;
- anionik: agjent kompleks - jone pozitive, nëse -
bandat janë anionet K2; Na2;
- neutral: i formuar me koordinim rreth një f.r neutrale. ligande neutrale o ose me koordinim të njëkohshëm rreth një c.o të ngarkuar pozitivisht.
ligandë të ngarkuar negativisht dhe neutralë
2. Nga natyra e ligandëve
Hidrate ose akuakomplekse Cl3;
Amoniak SO4;
- Komplekset e acidit K 2 ;
- Na hidroksokomplekse.
3. Nga numri i k.o.
Cl2 mononukleare;
Polinuklear [(NH 3 )4 Co\ / OH OH / \ Co(NH3 )4 ]Cl4.
Rregulla për emërtimin e përbërjeve komplekse
1) emri i c.s. filloni me një kation;
2) në emër të një joni kompleks, së pari tregohen ligandët, pastaj atomi qendror. Përfundimi "o" u shtohet emrave të ligandëve anionikë, ligandët molekularë quhen si
molekulat e lira përkatëse. Përjashtim: NH3 - amine; H2O - aqua; CO - karbonil;
3) agjent kompleksues në c.s kationik dhe neutral. quhet emri rus i elementit, në anionik - emri latin me shtimin e mbarimit "at";
4) gjendja e oksidimit k.o. shënohet me një numër arab dhe vendoset
kllapa pas emrit të saj. K3 – heksanitritokobaltat i kaliumit (+3); Cl3 - klorur hekzaakkromi (+3); o është pentakarbonil hekuri (0).
Sjellja e komponimeve komplekse në tretësirë
Në tretësirat e c.s. sillet si një elektrolit i fortë dhe shpërndahet tërësisht në një jon kompleks dhe jone të sferës së jashtme:
Cl → + + Cl-
Jonet komplekse jonizohen në mënyrë të kthyeshme dhe hap pas hapi: + ↔ + + NH3
+ ↔ Ag+ + NH3 ose në total: + ↔ Ag+ + 2NH3
Konstanta e ekuilibrit të jonizimit të një joni kompleks quhet konstanta e paqëndrueshmërisë
Të folesë = | |
Varet vetëm nga natyra e përbërjes dhe temperatura; është dhënë në librat e referencës (shih Tabelën 6).
4. EKUILIBRI KIMIK
Ekuilibri kimik është një gjendje që korrespondon me barazinë e shpejtësisë së reaksioneve të përparme dhe të kundërta:
Në këtë rast, ndryshimi në energjinë Gibbs është zero
Shko=O; ΔΗο = T Pra
Gjendja e ekuilibrit kimik mbetet e pandryshuar në një konstante kushtet e jashtme. Kur këto kushte (temperatura, presioni, përqendrimet) ndryshojnë, ekuilibri prishet për t'u rikthyer përsëri, por në kushte të reja.
Zhvendosja e ekuilibrit i bindet parimit Le Chatelier: nëse një nga kushtet që përcaktojnë pozicionin e ekuilibrit ndryshon në një sistem ekuilibri, atëherë ekuilibri zhvendoset në drejtimin e procesit që dobëson efektin e ndikimit. Pra, me rritjen e përqendrimit të reagentëve, ekuilibri zhvendoset drejt procesit që do të shkaktojë konsumimin e këtyre reagentëve. Arsyeja për këtë sjellje të sistemit të ekuilibrit është një rritje në numrin e përplasjeve të grimcave të reagentëve të treguar, gjë që shkakton një përshpejtim të reagimit përpara ose të kundërt.
Në sistemet e gazit, një rritje në përqendrimet e reagentëve ndodh me një rritje të presionit ose një ulje të vëllimit të sistemit. Prandaj, me një rritje të presionit total në sistem, një nga dy reaksionet e kthyeshme që ndodh me pjesëmarrjen e një numri më të madh molesh gazi, d.m.th. ekuilibri zhvendoset drejt formimit të një numri më të vogël nishanësh.
Me një rritje të temperaturës, shpejtësia e reaksioneve të përparme dhe të kundërta rritet, por shkalla e endotermisë rritet në një masë më të madhe.
reagimet, sepse ka një koeficient më të lartë të temperaturës.
Detyrat dhe ushtrimet
4.1. Tregoni drejtimin e zhvendosjes së ekuilibrit me uljen e përqendrimit të H2 në sistemin e ekuilibrit:
CO + H2 O↔ CO2 + H2 Zgjidhje: Me një ulje të CH 2, sipas parimit të Le-
Chatelier, reagimi i drejtpërdrejtë duhet të mbizotërojë, sepse në këtë rast, sasia e H2 do të rritet dhe ekuilibri do të rivendoset përsëri.
4.2. Në cilin drejtim do të zhvendoset ekuilibri PC15 ↔ PC13 + C12 - 31 kJ mol-1 me rritjen e temperaturës dhe presionit?
Zgjidhja: Me rritjen e temperaturës, ekuilibri do të zhvendoset djathtas, sepse reaksioni i drejtpërdrejtë vazhdon me thithjen e nxehtësisë, d.m.th. është
endotermike. Me rritjen e presionit, numri i përplasjeve të molekulave PC13 dhe C12 do të jetë më i madh se PC15, kështu që ekuilibri do të zhvendoset në të majtë.
4.3. Në çfarë kushtesh në një sistem ekuilibri
N2 g + 3H2 g ↔ 2NH3 g + 22 kJ mol-1 a është e mundur të maksimizohet rendimenti i NH3?
Zgjidhja: Për të rritur prodhimin e NH3, d.m.th. për të zhvendosur ekuilibrin në të djathtë, është e nevojshme:
1) rrisin presionin e përzierjes së gazit, sepse në këtë rast, shpejtësia e reaksionit të drejtpërdrejtë rritet, sepse më shumë nishane;
2) rritja e përqendrimit të N 2 dhe H2 dhe zvogëlojnë përqendrimin e NH3, duke e hequr atë nga sfera e reaksionit;
3) ulni temperaturën e përzierjes së reaksionit, sepse reagimi rreth-
Formimi i NH3 është ekzotermik.
Karakteristika sasiore e gjendjes së ekuilibrit kimik është konstanta e ekuilibrit, e cila pasqyron ligjin e veprimit të masës.
Konstanta e ekuilibrit është e lidhur me energjinë Gibbs nga relacioni RTlnK
= -∆G rreth . Për procesin aA + bB ↔ cC + dD konstante përqendrimi
ekuilibri ka formën: Кс = [C] c [D] d , ku [A], [B], [C], [D] – ekuilibri [A]a [B]b
përqendrimet nye në mol/l; a, b, c, d koeficientët stekiometrikë.
Për sistemet e gazit shkruani konstanten K | |||||||
presionet e pjesshme të gazeve dhe përzierjeve.
Konstantat Kc dhe Kp karakterizojnë proceset e ekuilibrit në tretësirat e holluara të elektroliteve dhe joelektroliteve dhe në sistemet e gazit në presione afër 101,3 kPa (gazrat ideale).
Për tretësirat e koncentruara dhe gazrat jo ideale, duhet të përdoren vlerat e aktivitetit:
K a = a C ca D da A a a B b
Konstanta e ekuilibrit varet nga natyra e reagentëve dhe temperatura, por nuk varet nga përqendrimet e përbërësve të sistemit të ekuilibrit.
Në sistemet heterogjene, përqendrimi i fazës së ngurtë përfshihet në vlerën e konstantës së ekuilibrit, pasi është një vlerë konstante.
Nëse reaksionet zhvillohen në tretësira ujore me pjesëmarrjen e ujit, atëherë përqendrimi i ujit është i madh dhe konstant dhe praktikisht nuk do të ndikojë në gjendjen e ekuilibrit.
Shkruajmë konstantet e ekuilibrit të proceseve: 4HC1g + O2 g ↔ 2H2 Og + 2C12 g
PH 2 | P С2 1 |
||||||||||||||
4 2 2 | |||||||||||||||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||||||||||||
Gjatë zgjidhjes së problemeve, është e nevojshme të përcaktohet qartë gjendja e grumbullimit substancave reaguese, si dhe për të dalluar përqendrimet fillestare të substancave nga ekuilibri.
C ekuilibri \u003d C fillestar - C i shpenzuar
4.4. 1 mol H2 dhe 1 mol I2 janë përzier në një enë me kapacitet 1 l në 410°C. Llogaritni në çfarë përqendrimi vendoset ekuilibri kimik nëse konstanta e ekuilibrit është 48?
Zgjidhje: H 2 + I 2 ↔ 2HI
Le të supozojmë se X mol të H2 dhe I2 janë konsumuar në reaksion. Pastaj u formuan 2X nishane HI, d.m.th. HI = 2 mol/l. Në këtë rast ==
1 - X. Le të shkruajmë: Кс = | (2x)2 | ||||
(1−x)2 |
|||||
Marrim ekuacionin: 44X2 - 96X + 48 = 0 Duke e zgjidhur atë, marrim X = 0,776. Llogaritni përqendrimet e ekuilibrit: HI = 2X = 2 0,776 = 1,552 mol/l
1 - X \u003d 0,222 mol / l.
4.5. Në reaksionin e kthyeshëm CO + C12 ↔ COC12, u vendosën përqendrimet e mëposhtme të ekuilibrit (mol/l): = 0,1; = 0,4; = 4. Llogaritni Crav. dhe përqendrimet fillestare të C12 dhe CO.
Zgjidhje: K = | |||||

Përqendrimet fillestare i gjejmë: Cish. = Komp. + Sizexp. . Për formimin e 4 mol COC12, sipas ekuacionit të reaksionit, 4
mol CO dhe C12. Prandaj, përqendrimet fillestare janë: CCO = 0,1 + 4 = = 4,1 mol/l; CC1 2 \u003d 0,4 + 4 \u003d 4,4 mol / l.
4.6. Përcaktoni përbërjen vëllimore të përzierjes në momentin e ekuilibrit për reaksionin Cgrafit + O2 g ↔ CO2 g, nëse në 1300 ° C Equn. = 0,289.
Zgjidhja: K p \u003d P R CO 2
Le të tregojmë X përmbajtjen e CO2 në fraksione vëllimore (përqindje). Atëherë përmbajtja e O2 do të jetë (100-X). Zëvendësoni në ekuacion:
K \u003d 0,289 \u003d (100 X - X); X = 22,42 vol.%. Përmbajtja e O2 do të jetë
5. KINETIKA KIMIKE
Kinetika kimike studion shpejtësinë dhe mekanizmin e reaksioneve kimike, si dhe ndikimin e faktorëve të ndryshëm në shpejtësinë. Shpejtësia mesatare reaksion kimik matet nga ndryshimi në përqendrimin e reaktantëve për njësi të kohës:
V = ±C 2 - C 1,
τ2−τ1
ku C2 dhe C1 janë përqendrimet e substancave (mol/l) që i përgjigjen kohës τ2 dhe τ1 (në s ose min). Për sistemet heterogjene, matet shpejtësia
ndryshimi i përqendrimit për njësi sipërfaqe të fazës së ngurtë (1 cm2 ose 1 m2).
Shpejtësia e një reaksioni kimik varet nga faktorët kryesorë të mëposhtëm:
- natyra dhe gjendja e substancave reaguese;
- natyra e mjedisit në të cilin zhvillohet reagimi;
Katalizator;
- përqendrimi i substancave reaguese, dhe për gazrat dhe presionin;
Temperaturat.
Aktiviteti kimik i substancave varet nga struktura e atomeve ose molekulave, natyra e lidhjeve intramolekulare dhe ndërmolekulare. Radikalët kanë aktivitetin më të lartë, është disi më i ulët për jonet dhe molekulat. Nuk ka rëndësi të vogël edhe gjendja e grumbullimit të reagentëve dhe shkalla e dispersitetit.
Pothuajse gjithmonë, substancat reagojnë me mediumin (tretësin), duke formuar solvate (hidrate). Përveç kësaj, tretësi mund të ketë një efekt katalitik.
Katalizatorët në përgjithësi përshpejtojnë reaksionet kimike duke ndryshuar rrugën e tyre. Në këtë rast, një rrugë e re reagimi korrespondon me një energji më të ulët aktivizimi. Energjia e aktivizimit (Ea) është energjia minimale që duhet të kenë grimcat e substancave reaguese për të kryer bashkëveprimin. Vlera e Ea përcaktohet nga natyra kimike e substancave.
Efekti i përqendrimit, presionit dhe temperaturës në shpejtësinë e një reaksioni kimik është i matshëm.
Ligji i masave që veprojnë shpreh varësinë e shpejtësisë së një reaksioni kimik nga përqendrimi i reaktantëve: shpejtësia e reaksionit është drejtpërdrejt proporcionale me përqendrimet e reaktantëve të ngritur me fuqinë e koeficientëve të tyre stoikiometrikë. Për reagim
аА + вВ → С V = KCA a CB b,

ku CA dhe CB janë përqendrimet molare të reagentëve A dhe B;
a dhe b janë koeficientë stekiometrikë për A dhe B;
te - konstanta e shpejtësisë së këtij reaksioni, duke reflektuar ndikimin e natyrës së substancave. Varet nga temperatura, por nuk varet nga përqendrimi i substancave.
Për sistemet e gazit, në vend të përqendrimeve, mund të përdorni vlerën
ne presionet e pjesshme: V = KPA a BP b.
Në sistemet heterogjene, përqendrimet e substancave kristalore janë vlera konstante dhe përfshihen në konstante të shpejtësisë. Arsyeja e rritjes së shpejtësisë së reagimit me rritjen e përqendrimeve të reaktantëve mund të shpjegohet me një rritje të numrit të përgjithshëm të përplasjeve të grimcave, dhe rrjedhimisht një rritje në numrin e përplasjeve aktive. Le të shkruajmë shprehje për shpejtësinë e reaksioneve të mëposhtme:
a) 2H2 g + O2 g \u003d 2H2 Og
V=KC | V=KP | |||||
b) CaOcr + CO2 g \u003d CaCO3 kr | ||||||
V=KCCO2 | V = KPCO 2 | |||||
c) Tretësirë FeCl3 + 3KSCN p-p = Fe(SCN)3 p-p | V = KC FeCl3 C 3 KSCN |
|||||
d) 2AgCO3 kr | V=K |
|||||
→ 2Agcr + 2CO2 g + O2 g |
||||||
Ligji i veprimit në masë është i vlefshëm vetëm për reaksione të thjeshta me një renditje dhe molekularitet të vogël.
Rendi i reagimit kuptohet si shuma e eksponentëve në përqendrime në shprehjen e ligjit të veprimit të masës. Molekulariteti i reaksionit përcaktohet nga numri minimal i molekulave të përfshira në aktin e bashkëveprimit. Në bazë të molekularitetit, reaksionet ndahen në një-molekulare (monomolekulare), dy-molekulare (bimolekulare) dhe tre-molekulare (trimolekulare). Reaksionet më të larta molekulare janë të rralla, sepse reagime të tilla zhvillohen në disa faza.
Reaksionet njëmolekulare përfshijnë reaksionet e zbërthimit dhe rirregullimet intramolekulare, për to V = K·C. Reaksionet dy molekulare përfshijnë reaksione në të cilat ndërveprimi ndodh kur dy molekula përplasen, për to V \u003d K C1 C2; për reaksionet tre molekulare V = K·C1 ·C2 ·C3 . Në bazë të renditjes së reaksionit dallohen rendet e para, të dyta dhe të treta, si dhe zero dhe thyesore.
renditja e tretë V = K·C3, V = K·C1 2 ·C2, V = K·C1 ·C2 2.
Reaksionet janë të rendit zero nëse përqendrimi i substancës nuk ndryshon gjatë gjithë procesit dhe shpejtësia është një vlerë konstante. Kjo është e mundur në sistemet heterogjene ku substancë kristalore ndërvepron me sipërfaqen dhe përqendrimi mbetet vlerë konstante. Për një reaksion të rendit zero, V = K·Co. Reaksioni ka një rend të pjesshëm nëse procesi ndodh në disa faza, secila prej të cilave ka një shpejtësi të papërfillshme.
Detyrat dhe ushtrimet
5.1. Përcaktoni molekularitetin dhe rendin e reaksionit:
С12 g + 2NOg = 2NOClg
Zgjidhje: 1 mol C12 dhe 2 mol NO hyjnë në reaksion, prandaj, reaksioni i treguar është trimolekular. Procedura për përcaktimin
përdorim barazimin: V = KCCl 2 C2 NO . Përgjigja është e rendit të tretë.
5.2. Njehsoni shpejtësinë e tretjes së hidroksidit të hekurit (II) në 0,02 M H2SO4 në K = 40. Përcaktoni molekularitetin dhe rendin e reaksionit.
Zgjidhja: Reaksioni do të shkojë sipas ekuacionit:
Fe(OH) 2 cr + H2 SO4 p-p = FeSO4 p-p + 2H2 Ozh
V \u003d KCH 2 SO 4, sepse Fe(OH)2 është në fazën kristalore. Molekulariteti i reaksionit është 2, rendi është 1. Llogaritni shpejtësinë e reaksionit:
V \u003d 40 0,02 \u003d 0,8 mol / min l.
5.3. Në një tretësirë që përmban 1 mol SnCl 2 dhe 2 mol FeCl3, reaksioni vazhdon sipas ekuacionit:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
Sa herë do të ulet shpejtësia e reaksionit pas reaksionit
ruet 0,65 mol SnCl2?
Zgjidhje: Llogaritni shpejtësinë e reaksionit në fillim
Pasi të ketë reaguar 0,65 mol SnCl2, përqendrimet do të jenë
kanë këto vlera: СSnCl2 = 1 - 0,65 = 0,35 mol/l; СFeCl3 = = 2 - 1,3 = 0,7 mol/l. Në këtë rast, shpejtësia e reagimit do të jetë e barabartë me:
V1 = K 0,35 0,72 = 0,17 K.
Raporti i shpejtësisë | |||||
5.4. Si do të ndryshojë shpejtësia e reaksionit CO2 + C12 g = COC12 g nëse vëllimi i përzierjes së gazit përgjysmohet?
Zgjidhja: Shpejtësia fillestare e reagimit do të jetë:
Vo = K CCO CC1 2 . Me një përgjysmim të vëllimit, përqendrimet e të gjithëve
komponentët do të dyfishohen dhe shpejtësia mund të llogaritet si më poshtë: V 1= K 2C CO2C Cl2 = 4KC COC Cl2
Është mjaft e qartë se me një ulje të vëllimit me 2 herë, shpejtësia e reagimit rritet me 4 herë.
Efekti i temperaturës në shpejtësinë e një reaksioni kimik vlerësohet gjithashtu. Me rritjen e temperaturës, shpejtësia e çdo reaksioni rritet, gjë që shpjegohet me një rritje të numrit të grimcave aktive, energjia e të cilave arrin ose tejkalon energjinë e aktivizimit Ea. Varësia nga temperatura e konstantës së shpejtësisë së reaksionit shprehet si
Ekuacioni Arrhenius: 2.303 lg | |||||||||
Këtu K1 dhe K2 | janë konstantet e shpejtësisë së këtij reaksioni për absolute |
||||||||
temperaturat T1 dhe T2; | |||||||||
Ea | është energjia e aktivizimit; | ||||||||
është konstanta e gazit. | |||||||||
Në praktikë, për llogaritjet, përdoret rregulli van't Hoff, sipas të cilit, me një rritje të temperaturës me 10 °, shpejtësia ose konstanta e shpejtësisë së reagimit rritet me 2-4 herë.
Vt 2 | Kt 2 | t2 − t1 | ||||||
= γ 10, |
||||||||
ku Vt1 dhe Vt2 | janë shpejtësitë e reaksionit në temperaturat t1 dhe t2; |
|||||||
Kt1, Kt2 | janë konstantet e normës; | |||||||
γ është koeficienti i temperaturës.
Rregulli i Van't Hoff jep rezultate më pak të sakta se ekuacioni Arrhenius, sepse γ mund të konsiderohet konstante vetëm në një interval të vogël temperaturash. Për reaksionet inorganike γ = 2-4, për reaksionet enzimatike γ = 7-8.
5.5. Koeficienti i temperaturës së shpejtësisë së zbërthimit të HI në diapazonin e temperaturës 356-376o C është 2. Njehsoni konstantën e shpejtësisë së këtij reaksioni në 376o C, nëse në 356o C është 8,09·10-5.
Zgjidhja: | Le të shkruajmë shprehjen matematikore të rregullit |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van't Hoff: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V 376 | K 376 | 376− 356 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
= γ 10 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.7. Pesticidi dekompozohet në ujë në 25°C për 10 ditë. Në çfarë temperature duhet mbajtur uji i helmuar që të bëhet i padëmshëm pas 1 ore nëse koeficienti i temperaturës së reaksionit të dekompozimit kimik është 3?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tërësia e gjendjeve të një elektroni në një atom me të njëjtën vlerë n thirrur niveli i energjisë. Numri i niveleve në të cilat elektronet janë në gjendjen bazë të atomit përkon me numrin e periudhës në të cilën ndodhet elementi. Numrat e këtyre niveleve tregohen me numra: 1, 2, 3, ... (më rrallë - me shkronja K, L, M, ...).
Nënniveli i energjisë- një grup gjendjesh energjetike të një elektroni në një atom, të karakterizuar nga të njëjtat vlera të numrave kuantikë n dhe l. Nënnivelet shënohen me shkronja: s, fq, d, f... Niveli i parë energjetik ka një nënnivel, i dyti - dy nënnivele, i treti - tre nënnivele e kështu me radhë.
Nëse orbitalet janë caktuar në diagram si qeliza (korniza katrore), dhe elektronet si shigjeta (ose ↓), atëherë mund të shihni se numri kuantik kryesor karakterizon nivelin e energjisë (EU), kombinimin e kuantit kryesor dhe orbital. numrat - nënniveli i energjisë (EPL), një grup numrash kuantikë kryesorë, orbitalë dhe magnetikë - orbitale atomike, dhe të katër numrat kuantikë janë një elektron.
Çdo orbitale korrespondon me një energji të caktuar. Emërtimi i orbitalit përfshin numrin e nivelit të energjisë dhe shkronjën që korrespondon me nënnivelin përkatës: 1 s, 3fq, 4d etj. Për çdo nivel energjetik, duke filluar nga i dyti, ekzistenca e tre të barabartë në energji fq orbitalet e vendosura në tre drejtime pingul reciprokisht. Në çdo nivel energjie, duke filluar nga i treti, ka pesë d-orbitale me formë më komplekse katër fletëshe. Duke u nisur nga niveli i katërt i energjisë, shfaqen forma edhe më komplekse. f-orbitalet; Ka shtatë në çdo nivel. Një orbitale atomike me një ngarkesë elektronike të shpërndarë mbi të quhet shpesh një re elektronike.
Pyetja 12.
Periodiciteti horizontal
Të tillë vetitë fizike, si energjia e jonizimit dhe afiniteti i elektroneve, manifestohet gjithashtu një periodicitet horizontal, i shoqëruar me një ndryshim periodik në numrin e elektroneve në nënnivelet e fundit të energjisë:
Pyetja 13.
Pyetja 14.
Karakteristikat magnetike të një atomi
Elektroni ka momentin e tij magnetik, i cili kuantizohet në drejtimin paralel ose të kundërt me fushën magnetike të aplikuar. Nëse dy elektrone që zënë të njëjtën orbitale kanë rrotullime me drejtim të kundërt (sipas parimit Pauli), atëherë ato anulojnë njëri-tjetrin. Në këtë rast, elektronet thuhet se janë çiftuar. Atomet me vetëm elektrone të çiftëzuara shtyhen nga fusha magnetike. Atome të tilla quhen diamagnetike. Atomet që kanë një ose më shumë elektrone të paçiftuar tërhiqen në një fushë magnetike. Ato quhen diamagnetike.
Momenti magnetik i një atomi, i cili karakterizon intensitetin e ndërveprimit të një atomi me fushë magnetike, është praktikisht proporcional me numrin e elektroneve të paçiftëzuara.
Veçoritë strukturë elektronike atomet elemente të ndryshme reflektohen në karakteristika të tilla energjetike si energjia e jonizimit dhe afiniteti i elektroneve.
Energjia e jonizimit
Energjia (potenciali) i jonizimit të një atomi E iështë energjia minimale e nevojshme për të hequr një elektron nga një atom në pafundësi sipas ekuacionit
X = X + + e− . Vlerat e tij janë të njohura për atomet e të gjithë elementëve të sistemit periodik. Për shembull, energjia e jonizimit të një atomi hidrogjeni korrespondon me kalimin e një elektroni nga 1 s- nënniveli i energjisë (−1312,1 kJ/mol) në nënnivelin me energji zero dhe është i barabartë me +1312,1 kJ/mol.
Në ndryshimin e potencialeve të para të jonizimit, që korrespondojnë me heqjen e një elektroni, të atomeve, periodiciteti shprehet qartë me një rritje të numrit rendor të atomit:
Kur lëvizni nga e majta në të djathtë përgjatë periudhës, energjia e jonizimit, në përgjithësi, rritet gradualisht, ndërsa duke rritur numrin serial brenda grupit, zvogëlohet. Potencialet minimale të jonizimit të parë kanë metale alkali, maksimumi - gaze fisnike.
Për të njëjtin atom, energjitë e jonizimit të dytë, të tretë dhe të mëpasshëm rriten gjithmonë, pasi elektroni duhet të shkëputet nga një jon i ngarkuar pozitivisht. Për shembull, për një atom litiumi, energjia e parë, e dytë dhe e tretë e jonizimit janë përkatësisht 520.3, 7298.1 dhe 11814.9 kJ/mol.
Sekuenca e shkëputjes së elektroneve është zakonisht e kundërta e sekuencës së popullimit të orbitaleve nga elektronet në përputhje me parimin e energjisë minimale. Megjithatë, elementet që janë të populluara d-Orbitalet janë përjashtime - para së gjithash ato nuk humbasin d-, a s-elektrone.
afiniteti i elektroneve
Afiniteti i një atomi për një elektron A e - aftësia e atomeve për të lidhur një elektron shtesë dhe për t'u kthyer në një jon negativ. Masa e afinitetit të elektroneve është energjia e çliruar ose e absorbuar në proces. Afiniteti i elektroneve është i barabartë me energjinë e jonizimit të jonit negativ X − : X − = X + e −
Atomet halogjene kanë afinitetin më të lartë të elektroneve. Për shembull, për një atom fluor, shtimi i një elektroni shoqërohet me çlirimin e 327,9 kJ/mol energjie. Për një numër elementësh, afiniteti i elektroneve është afër zeros ose negativ, që do të thotë se nuk ka anion të qëndrueshëm për këtë element.
Zakonisht, afiniteti i elektroneve për atomet e elementeve të ndryshëm zvogëlohet paralelisht me një rritje të energjisë së jonizimit të tyre. Megjithatë, ka përjashtime për disa palë elementësh:
Një shpjegim për këtë mund të jepet duke u bazuar në madhësitë më të vogla të atomeve të para dhe zmbrapsjen më të madhe elektron-elektroni në to.
Pyetja 15.
Pyetja 16.
Periodiciteti horizontal
Periodiciteti horizontal konsiston në shfaqjen e vlerave maksimale dhe minimale të vetive substanca të thjeshta dhe lidhjet brenda çdo periudhe. Është veçanërisht e dukshme për elementët e grupit VIIB dhe lantanidet (për shembull, lantanidet me numra serialë çift janë më të zakonshëm se ato me tek).
Në vetitë fizike të tilla si energjia e jonizimit dhe afiniteti i elektroneve, shfaqet edhe periodiciteti horizontal, i shoqëruar me një ndryshim periodik të numrit të elektroneve në nënnivelet e fundit të energjisë.






