Molekula tuzilishi Molekula tuzilishi
MOLEKULA TUZILISHI
MOLEKULA TUZILISHI- (molekulyar tuzilish), molekulalarda atomlarning o'zaro joylashishi. Davomida kimyoviy reaksiyalar reagentlar molekulalarida atomlarning qayta joylashishi sodir bo'ladi va yangi birikmalar hosil bo'ladi. SHuning uchun ham asosiy kimyoviy masalalardan biri bu boshlang’ich birikmalardagi atomlarning joylashishini va ulardan boshqa birikmalar hosil bo’lishidagi o’zgarishlar tabiatini yoritishdir. Molekulalarning tuzilishi haqidagi dastlabki g'oyalar moddaning kimyoviy harakatini tahlil qilishga asoslangan. Bu g'oyalar moddalarning kimyoviy xossalari to'g'risidagi bilimlar to'planganligi sababli yanada murakkablashdi. Kimyoning asosiy qonunlarini qo'llash ma'lum birikma molekulasini tashkil etuvchi atomlarning soni va turini aniqlash imkonini berdi; bu ma'lumot kimyoviy formulada mavjud. Vaqt o'tishi bilan kimyogarlar molekulani to'g'ri tavsiflash uchun bitta kimyoviy formula etarli emasligini tushunishdi, chunki bir xil kimyoviy formulalarga ega, ammo har xil xususiyatlarga ega izomer molekulalari mavjud. Bu fakt olimlarni molekuladagi atomlar ular orasidagi bog'lar bilan barqarorlashgan ma'lum bir topologiyaga ega bo'lishi kerak degan fikrga olib keldi. Bu fikrni birinchi marta 1858 yilda nemis kimyogari F. Kekule bildirgan. Uning g'oyalariga ko'ra, molekulani strukturaviy formuladan foydalanib tasvirlash mumkin, bu nafaqat atomlarning o'zini, balki ular orasidagi aloqalarni ham ko'rsatadi. Atomlararo aloqalar atomlarning fazoviy joylashuviga ham mos kelishi kerak. Metan molekulasining tuzilishi haqidagi g'oyalarning rivojlanish bosqichlari 2-rasmda ko'rsatilgan. 1. Tuzilishi r zamonaviy ma'lumotlarga mos keladi: molekula muntazam tetraedr shakliga ega, uning markazida uglerod atomi va uchlarida - vodorod atomlari joylashgan.
Guruch. 1. METAN MOLEKULASINI TASVIR OLISHNING TO'RT USULI. a - kimyoviy formula. Faqat atomlarning soni va turi ko'rsatilgan; b - strukturaviy formula; c - molekulaning haqiqiy sxemasi; d - molekuladagi atomlarning fazoviy joylashishi.
Biroq, bunday tadqiqotlar molekulalarning kattaligi haqida hech narsa aytmadi. Ushbu ma'lumot faqat tegishli jismoniy usullarni ishlab chiqish bilan mavjud bo'ldi. Ulardan eng muhimi rentgen nurlarining diffraksiyasi edi. Tarqalgan rasmlardan rentgen nurlari kristallarda atomlarning kristaldagi aniq o'rnini aniqlash, molekulyar kristallar uchun esa bitta molekulada atomlarni lokalizatsiya qilish mumkin bo'ldi. Boshqa usullar gazlar yoki bug'lar orqali o'tayotganda elektronlarning diffraktsiyasini va molekulalarning aylanish spektrlarini tahlil qilishni o'z ichiga oladi. Bu ma'lumotlarning barchasi faqat umumiy fikr molekulaning tuzilishi haqida. tabiat kimyoviy bog'lanishlar zamonaviy tadqiq qilish imkonini beradi kvant nazariyasi. Va molekulyar strukturani hali etarlicha yuqori aniqlik bilan hisoblash mumkin bo'lmasa-da, kimyoviy bog'lanishlar haqidagi barcha ma'lum ma'lumotlarni tushuntirish mumkin. Yangi turdagi kimyoviy bog'lanishlar mavjudligi hatto bashorat qilingan.
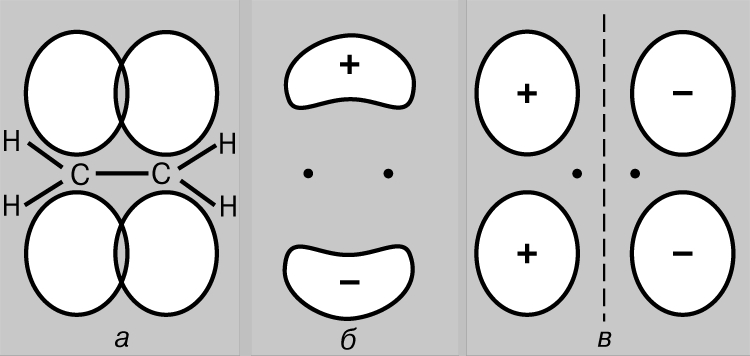
Oddiy kovalent bog'lanish. Vodorod molekulasi H 2 ikkita bir xil atomdan iborat. Ga ko'ra jismoniy o'lchovlar bog'lanish uzunligi - vodorod atomlari (protonlar) yadrolari orasidagi masofa - 0,70 (1 = 10-8 sm), bu asosiy holatdagi vodorod atomining radiusiga to'g'ri keladi, ya'ni. eng past energiya holatida. Atomlar orasidagi bog'lanishni faqat ularning elektronlari asosan yadrolar o'rtasida lokalize bo'lib, manfiy zaryadlangan bog'lovchi zarrachalar bulutini hosil qilib, musbat zaryadlangan protonlarni birga ushlab turadi, deb taxmin qilish bilan izohlash mumkin. Asosiy holatda ikkita vodorod atomini ko'rib chiqing, ya'ni. ularning elektronlari 1s orbitalda joylashgan holat. Ushbu elektronlarning har birini to'lqin, orbitalni esa doimiy to'lqin deb hisoblash mumkin. Atomlar bir-biriga yaqinlashganda, orbitallar bir-birining ustiga chiqa boshlaydi (2-rasm) va oddiy to'lqinlarda bo'lgani kabi, interferensiya sodir bo'ladi - to'lqinlarning bir-birining ustiga chiqishi (to'lqin funktsiyalari) bir-birining ustiga chiqish hududida. Agar to'lqin funktsiyalarining belgilari qarama-qarshi bo'lsa, u holda to'lqinlar interferensiya paytida (buzg'unchi interferentsiya) bir-birini yo'q qiladi va agar ular bir xil bo'lsa, ular qo'shiladi (konstruktiv interferensiya). Vodorod atomlari bir-biriga yaqinlashganda, to'lqin funktsiyalari fazada (2a-rasm) yoki antifazada (2b-rasm) bo'lishiga qarab ikkita natija mumkin. Birinchi holda, konstruktiv shovqin paydo bo'ladi, ikkinchisida - halokatli va ikkita molekulyar orbital paydo bo'ladi; ulardan biri yadrolar orasidagi mintaqada yuqori zichlik bilan tavsiflanadi (2c-rasm), ikkinchisi past zichlik bilan tavsiflanadi (2d-rasm) - aslida yadrolarni ajratib turadigan nol amplitudali tugun.
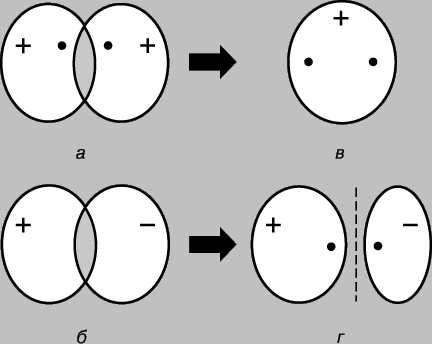
Guruch. 2. Vodorod atomlarining 1S ORBITALLARINING QO'PLASHTIRISH NATIJALARI. a - to'lqin funktsiyalarining fazalari mos keladi; konstruktiv interferensiya kuzatiladi va natijada yadrolar orasidagi mintaqada yuqori zichlikdagi molekulyar orbital hosil bo'ladi (c); b - to'lqin funktsiyalarining fazalari bir-biriga to'g'ri kelmaydi; halokatli interferensiya sodir bo'ladi, natijada atomlar (r) o'rtasida past zichlikka ega bo'lgan molekulyar orbital hosil bo'ladi.
Shunday qilib, vodorod atomlari yaqinlashganda va o'zaro ta'sirlashganda, 1s orbitallari ikkita molekulyar orbital hosil qiladi va ikkita elektron ulardan birini to'ldirishi kerak. Atomlardagi elektronlar har doim eng barqaror pozitsiyani - ularning energiyasi minimal bo'lgan joyni egallashga intiladi. Shaklda ko'rsatilgan orbital uchun. 2c, yadrolar orasidagi mintaqada yuqori zichlik xarakterlidir va bu orbitalni egallagan har bir elektron ko'pincha musbat zaryadlangan yadrolar yaqinida bo'ladi, ya'ni. uning potentsial energiya kichik bo'ladi. Aksincha, rasmda ko'rsatilgan orbital. 2d, maksimal zichlik yadrolarning chap va o'ng tomonida joylashgan hududlarda sodir bo'ladi va bu orbitaldagi elektronlarning energiyasi yuqori bo'ladi. Shunday qilib, elektronlar orbitalni egallaganida kamroq energiyaga ega bo'ladi va bu energiya atomlar bir-biridan cheksiz uzoqlashganda bo'ladigan energiyadan ham kamroq. Bu holda faqat ikkita elektron mavjud bo'lganligi sababli, ularning spinlari antiparallel bo'lsa, ularning ikkalasi ham energiya jihatidan foydaliroq orbitani egallashi mumkin (Pauli printsipi). Shuning uchun ikkita vodorod atomidan iborat tizimning energiyasi atomlar bir-biriga yaqinlashganda kamayadi va atomlarni bir-biridan olib tashlash uchun energiya kerak bo'ladi. energiyaga teng barqaror vodorod molekulasi H2 hosil bo'lishi. E'tibor bering, vodorod molekulasi mavjudligining zaruriy sharti yuqorida aytib o'tganimizdek, yadrolar orasidagi elektronlarning imtiyozli joylashishi hisoblanadi. Molekulyar orbital c bog'lovchi orbital, r orbital esa bo'shashuvchi orbital deb ataladi. Endi ikkita geliy atomining (atom raqami 2) yaqinlashishini ko'rib chiqing. Bu yerda ham 1s orbitallarning bir-birining ustiga chiqishi natijasida ikkita molekulyar orbital hosil bo'ladi, ulardan biri pastroq, ikkinchisi esa yuqori energiyaga to'g'ri keladi. Biroq, bu safar orbitallarga 4 ta elektron, har bir geliy atomidan 2 ta elektron joylashtirilishi kerak. Ulardan faqat ikkitasi kam energiyali bog'lovchi orbitalni to'ldirishi mumkin, qolgan ikkitasi yuqori energiyali orbitalni egallashi kerak r.Birinchi juftlikning qulay lokalizatsiyasi tufayli energiyaning kamayishi, noqulaylik tufayli energiyaning ko'payishiga taxminan tengdir. ikkinchi juftlikning pozitsiyasi. Endi atomlarning yondashishi energiyada daromad keltirmaydi va molekulyar geliy He2 hosil bo'lmaydi. Buni diagramma bilan qulay tarzda tasvirlash mumkin (3-rasm); undagi turli orbitallar shaklida ifodalanadi energiya darajalari elektronlarni qaerdan topish mumkin. Ikkinchisi aylanishlarning yo'nalishlarini farqlash uchun yuqoriga va pastga yo'naltirilgan o'qlar bilan ko'rsatilgan. Ikki elektron bir xil orbitalni egallashi mumkin, agar ularning spinlari antiparallel bo'lsa.
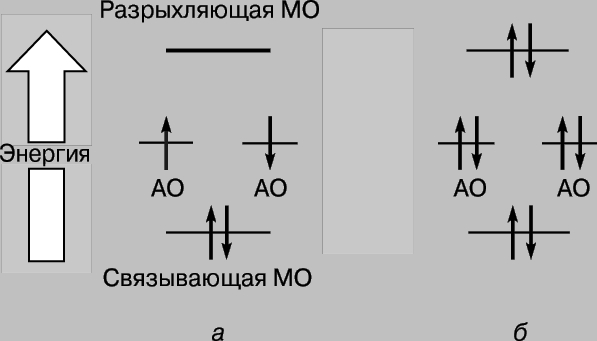
Guruch. 3. (a) vodorod va (b) geliy molekulalarining hosil bo'lishida ELEKTRON ENERGIYASINING O'ZGARISHI. Elektronlar spinlarini farqlash uchun yuqoriga va pastga qaragan strelkalar bilan ko'rsatilgan. Past energiyali molekulyar orbitallar bog'lanish, yuqori energiyali molekulyar orbitallar esa antibog'lanishdir.
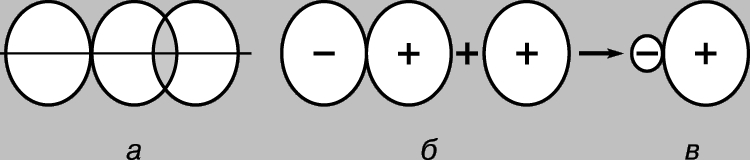
Bu umumiy tamoyillar atomlardan molekulalarni hosil qilishda bajariladi. Ikki atom yaqinlashishi bilan ularning atom orbitallari (AO) bir-birining ustiga chiqa boshlagach, ikkita molekulyar orbital (MO) paydo bo'ladi: biri bog'lanadi, ikkinchisi bo'shashadi. Agar AO larning har biri faqat bitta elektronga ega bo'lsa, ularning ikkalasi ham AO dan kamroq energiyaga ega bo'lgan bog'lanish MO ni egallashi va kimyoviy bog' hosil qilishi mumkin. Hozirgi vaqtda kovalent deb ataladigan bu turdagi bog'lanishlar kimyogarlarga uzoq vaqtdan beri ma'lum (kovalent bog'lanish g'oyasi 1916 yilda amerikalik fizik kimyogari G. Lyuis tomonidan tuzilgan oktet bog'lanish nazariyasiga asos bo'lgan). Ularning shakllanishi o'zaro ta'sir qiluvchi atomlar tomonidan bir juft elektronning ijtimoiylashuvi bilan izohlangan. Zamonaviy tushunchalarga ko'ra, bog'lanish kuchi mos keladigan orbitallarning bir-biriga yopishish darajasiga bog'liq. Yuqorida aytilganlarning barchasi atomlar orasidagi bog'lanishlar nafaqat ikkita, balki bir yoki uchta elektronning sotsializatsiyasi paytida ham paydo bo'lishi mumkinligini ko'rsatadi. Biroq, ular odatdagidan zaifroq bo'ladi valent bog'lanishlar quyidagi sabablar. Bir elektronli bog'lanish hosil bo'lganda, faqat bitta elektronning energiyasi kamayadi va uchta elektronning sotsializatsiyasi natijasida bog'lanish hosil bo'lganda, ulardan ikkitasining energiyasi kamayadi, uchinchisi esa, aksincha. ortadi, bu birinchi ikkita elektrondan birining energiyasining pasayishini qoplaydi. Natijada, hosil bo'lgan uch elektronli bog'lanish odatdagi kovalent bog'lanishdan ikki baravar kuchsiz bo'ladi. Bir va uchta elektronning sotsializatsiyasi shakllanish jarayonida sodir bo'ladi molekulyar ion mos ravishda vodorod H 2+ va HHe molekulalari. Umuman olganda, bunday turdagi bog'lanishlar kam uchraydi va mos keladigan molekulalar yuqori reaktivdir.
Valentlik. Donor-akseptor aloqalari. Yuqorida aytilganlarning barchasi atomlar bir elektron egallagan orbitallar soniga ko'ra kovalent bog'lanish hosil qilishi mumkinligini taxmin qiladi, ammo bu har doim ham shunday emas. (Qabul qilingan AO to'ldirish sxemasida avval qobiq sonini, so'ngra orbital turini, so'ngra orbitalda bir nechta elektron bo'lsa, ularning soni (yuqori yozuv). Demak, belgi (2s) 2 ni ko'rsating. ikkinchi qobiqning s-orbitalida ikkita elektron borligini bildiradi.) Asosiy holatdagi uglerod atomi (3P) elektron konfiguratsiyaga ega (1s) 2 (2s) 2 (2px)(2py), ikkita orbital toʻldirilmagan. , ya'ni. bitta elektronni o'z ichiga oladi. Biroq, ikki valentli uglerod birikmalari juda kam uchraydi va yuqori kimyoviy faollikka ega. Odatda, uglerod tetravalentdir va bu to'rtta bo'sh orbital bilan qo'zg'atilgan 5S (1s) 2 (2s) (2px) (2py) (2pz) holatiga o'tish uchun juda kam energiya talab qilinishi bilan bog'liq. 2s elektronning erkin 2p orbitalga o'tishi bilan bog'liq energiya xarajatlari ikkita qo'shimcha bog'lanish hosil bo'lganda chiqarilgan energiya bilan qoplanadi. To'ldirilmagan AO shakllanishi uchun bu jarayon energetik jihatdan qulay bo'lishi kerak. (1s) 2 (2s)2(2px)(2py)(2pz) elektron konfiguratsiyaga ega azot atomi besh valentli birikmalar hosil qilmaydi, chunki 2s elektronni besh valentli konfiguratsiya hosil boʻlishi bilan 3d orbitalga oʻtkazish uchun energiya talab qilinadi. (1s) 2 (2s )(2px)(2py)(2pz)(3d) juda katta. Xuddi shunday, odatdagi (1s) 2 (2s)2(2p) konfiguratsiyaga ega boʻlgan bor atomlari (1s) 2 (2s)(2px)(2py) qoʻzgʻaluvchan holatda uch valentli birikmalar hosil qilishi mumkin, bu 2s elektron 2p ga oʻtganda sodir boʻladi. -AO, lekin besh valentli birikmalar hosil qilmaydi, chunki 1s-elektronlardan birining ko'proqqa o'tishi tufayli qo'zg'aluvchan holatga (1s)(2s)(2px)(2py)(2pz) o'tadi. yuqori daraja, juda ko'p energiya talab qiladi. Atomlarning ular orasidagi bog'lanish hosil bo'lishi bilan o'zaro ta'siri faqat yaqin energiyaga ega bo'lgan orbitallar mavjudligida sodir bo'ladi, ya'ni. bosh kvant soni bir xil bo'lgan orbitallar. Davriy jadvalning dastlabki 10 elementi uchun tegishli ma'lumotlar quyida umumlashtiriladi. Atomning valentlik holati - bu kimyoviy bog'lanishlar hosil qiladigan holat, masalan, tetravalent uglerod uchun 5S holati.
Ushbu naqshlar quyidagi misollarda ko'rsatilgan:
Yuqorida aytilganlarning barchasi faqat neytral atomlarga tegishli. Ionlar va tegishli atomlar turli xil elektronlar soniga ega; ionlar bir xil miqdordagi elektronga ega bo'lgan boshqa atomlar kabi bir xil valentlikka ega bo'lishi mumkin. Demak, N+ va B ionlari neytral uglerod atomi bilan bir xil miqdordagi (olti) elektronga ega va shunga mos ravishda ular tetravalentdir. Ammoniy ionlari NH 4 + va bor gidrid BH 4 - murakkab tuzlar hosil qiladi va ularda elektron konfiguratsiya metan CH 4 ga o'xshash. Endi ammiak NH 3 va bor triflorid BF 3 molekulalari bir-biriga yaqinlashadi deb faraz qilaylik. Elektron azot atomidan bor atomiga o'tganda biz har birida bo'sh orbitalga ega bo'lgan NH 3 + va BF 3 - ikkita ionni olamiz, bu kovalent bog'lanish hosil bo'lishiga olib kelishi mumkin. H 3 N-BF 3 molekulasi 1,1,1-trifloroetan H 3 C-CF 3 ning elektron analogidir. Atomlararo elektronlar ko`chishi natijasida hosil bo`ladigan bog`lar, so`ngra kovalent bog`lanish hosil bo`lishi donor-akseptor bog`lar deyiladi.
Molekulalar geometriyasi. Gibridlanish. Barcha atom orbitallari, s dan tashqari, sferik assimetrik bo'lib, ularning boshqa atomlarning AO bilan qoplanish darajasi orbitallarning o'zaro yo'nalishiga bog'liq. Shunday qilib, p-AO boshqa atomning AO bilan ustma-ust tushadi eng, agar ikkinchisi o'z o'qi bo'ylab joylashgan bo'lsa (4a-rasm). Bu shuni anglatadiki, AO qoplamasi natijasida hosil bo'lgan bog'lanishlar o'ziga xos geometriyaga ega bo'lishi kerak. 5S holatidagi uglerod atomini ko'rib chiqing. U uchta p-orbitalda va to'rtinchi, sferik simmetrik s-orbitalda bittadan elektronga ega. Ko'rinib turibdiki, u hosil qiladigan uchta bog'lanish to'rtinchisidan farq qiladi, p-bog'lar esa p-AO o'qlari bo'ylab o'zaro perpendikulyar yo'nalishda joylashgan bo'ladi. Aslida, boshqa, butunlay nosimmetrik rasm mavjud. Buni tushuntirishning eng oson yo'li quyidagicha. Orbitallar to'plami (2s)+(2px)+(2py)+(2pz) to'rt juft elektronni ushlab turishga qodir bo'lgan ma'lum miqdordagi "orbital bo'shliq" dir. Biz barcha orbitallarni aralashtirish va ularning yig'indisini to'rtta teng qismga bo'lish orqali bu holatning ekvivalent tavsifini olishimiz mumkin, shunda hosil bo'lgan aralash yoki gibrid orbitallarning har birida bir juft elektron bo'ladi. Demak, uglerodning 5S holatini (1s)2(t 1)(t 2)(t 3)(t 4) shaklida ifodalash mumkin, bunda t i gibrid orbitallardir, bu simmetrik tetravalent uglerod molekulasining hosil bo lishini muvaffaqiyatli tushuntiradi. Keling, p-AO s-AO bilan aralashtirilganda nima sodir bo'lishini ko'rib chiqaylik. Interferentsiya vaqtida p-gantelning yarmining kuchayishi har doim uning ikkinchi yarmining zaiflashishi bilan birga bo'ladi (4b-rasm), natijada assimetrik gibrid orbital hosil bo'ladi (4c-rasm). U bir xil yo'nalishda yo'naltirilgan boshqa orbitallar bilan samarali tarzda qoplanadi va etarlicha kuchli bog'lanishlar hosil bo'ladi. Bu uglerod atomi AO gibridizatsiyasi orqali bog'lanishni afzal ko'rishining sabablaridan biridir. Ammo boshqa sabab ham bor. Metan CH 4 kabi odatiy tetravalent uglerod birikmasini ko'rib chiqing. Unda har bir vodorod atomi bir juft elektronlar tomonidan uglerod atomiga yaqin tutiladi. Bu juftliklar bir-birini itaradi va molekulaning optimal konfiguratsiyasi shundayki, ular bir-biridan mumkin bo'lgan maksimal masofada joylashgan. Bunday holda, vodorod atomlari muntazam tetraedrning uchlarida, uglerod atomi esa uning markazida joylashgan bo'ladi. Bunday geometriya deb atalmish yordamida amalga oshirilishi mumkin. sp 3 gibrid orbitallar, ularning har biri 2s-AO ning 1/4 qismi va 2p-AO ning biri tomonidan hosil bo'ladi. Bu orbitallarning barchasi bir xil shaklga ega, osongina bog'lanish hosil qiladi va muntazam tetraedr markazidagi uglerod atomidan uning to'rtta uchiga yo'naltiriladi (1d-rasm).
Guruch. 4. P-ORBITALNING BOSHQA ATOM ORBITALI BILAN UST-QAMASASI, agar ikkinchisi bir xil o'q (a) bo'ylab yo'naltirilgan bo'lsa, eng samarali hisoblanadi. Atom p-orbitalining s-orbital (b) bilan ustma-ust tushishi assimetrik "gantel" (c) hosil bo'lishiga olib keladi.
Azot atomi faqat 2p-AO yordamida bog'lar hosil qilishi mumkin edi, ularning orasidagi burchaklar 90 ° bo'ladi, lekin "tetraedral" bo'lsa, bog'lovchi elektronlar juftlari va 2-chi qavatning bog'lanmagan elektronlari juftlarining o'zaro itarilishi minimallashtiriladi. sp3 orbitallari bog'lanish hosil bo'lishida ishtirok etadi. Biroq, bu erda yana bir xususiyat paydo bo'ladi. N+ ioni uchun konfiguratsiyalar (1s)2(2s)(2p)3 va (1s)2(t) 4 , bunda t sp 3 gibrid AO lar haqiqatda ekvivalentdir. Yana bir narsa - neytral azot atomi, uning 7-elektroni yo 2s-AO ni egallashi mumkin, so'ngra konfiguratsiya (1s)2(2s)(2p) 4 olinadi yoki konfiguratsiyadagi t-AO (1s). )2(t) 5 . 2s-AO 2p-AO ostida va shuning uchun har qanday sp-gibrid orbital ostida joylashganligi sababli, birinchi konfiguratsiya energetik jihatdan qulayroq va boshqa barcha narsalar teng bo'lganda, uch valentli azot "gibridlanmagan" konfiguratsiyani afzal ko'rishini kutish mumkin. Biroq, elektron juftlarning o'zaro itarilishi gibridlanishning sodir bo'lishi uchun etarli bo'ladi, bunda ammiak NH3 kabi azotli birikmadagi bog'lanish burchaklari muntazam tetraedrdagi mos burchaklarga yaqin, ya'ni. 109° gacha. Xuddi shu narsa H 2 O suv molekulasi tarkibidagi ikki valentli kislorod uchun ham amal qiladi. Bu barcha holatlarda bog'langan atomlar tetraedrning uchta (yoki ikkita) uchini egallaydi va 2-chi qobiqning yolg'iz elektronlari juftlari qolgan uchlarini egallaydi. Xuddi shunday mulohaza davriy sistemaning IV, V va VI guruhlarining boshqa tipik elementlariga ham tegishli. IV guruhning tetravalent elementlari (Si, Ge, Sn va Pb) har doim tetraedr tuzilmalarni hosil qiladi, ammo V va VI guruhning boshqa elementlari (P, S, As, Se, Sb, Te) azot va kisloroddan farq qiladi va birikmalar hosil qiladi. bog'lanish burchaklari bilan, 90 ° ga yaqin. Ko'rinishidan, tufayli kattaroq o'lcham bu o'zaro itarish atomlari valent elektronlar N va O uchun kuzatilgan duragaylanishni amalga oshirish uchun etarli emas.
d-orbitallarni o'z ichiga olgan bog'lanishlar. Azotdan farqli o'laroq, fosfor atomi beshta kovalent aloqa hosil qilishi mumkin. Asosiy holatda fosfor (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)(3p z) konfiguratsiyaga ega va uch valentli bo'lib, azot kabi PF birikmalarini hosil qiladi. 3 turi. Biroq, bu holda, 3s elektronlarning bog'lanish hosil bo'lishida ishtirok etishi mumkin, chunki d-AO (3d) bir xil printsipga ega. kvant soni. Darhaqiqat, PF 5 tipidagi besh valentli fosfor birikmalari ham ma'lum, bu erda fosfor elektron konfiguratsiyaga (1s) 2 (2s) 2 (2p) 6 (3s) (3p x)( ga mos keladigan +5 valentlik holatidadir. 3p y)(3p z )(3d); bu holda bog'lar sp 3 d-gibridlanish natijasida hosil bo'ladi (ya'ni, bitta s-, uchta p- va bitta d-AO aralashtirish natijasida). Uchburchak bipiramida valentlik elektronlar juftlarining o'zaro itarilishini kamaytirish nuqtai nazaridan optimal tuzilma hisoblanadi (5a-rasm). Oltingugurt nafaqat ikki valentli, balki (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)( holatlarida bo'lgan tetra- (SF4) va olti valentli (SF 6) ham bo'lishi mumkin. 3p z)(3d) va (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)(3p y)(3p z)(3d 1)(3d 2). Tetravalent oltingugurt birikmalarida 3-chi qavat elektronlarining o'zaro itarilishi uning barcha elektronlari orbitallarini gibridlash orqali optimallashtiriladi. Ushbu turdagi birikmalarning tuzilishi PF 5 ga o'xshaydi, lekin uchburchak bipiramidaning cho'qqilaridan biri 3-chi qavatning bir juft yolg'iz elektronlari bilan band (5b-rasm). Olti valentli oltingugurt birikmalarida sp 3 d 2 gibridlanish jarayonida elektronlarning o‘zaro itarilishi minimallashtiriladi, bunda barcha orbitallar ekvivalent bo‘lib, muntazam oktaedrning uchlari tomon yo‘nalgan (5c-rasm).
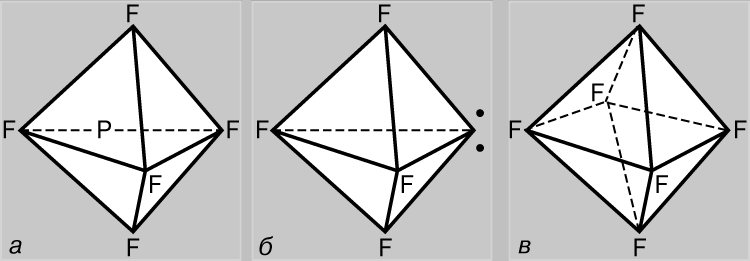
Guruch. 5. FOSFOR PENTAFLORIDI (a) 3s elektron ishtirokida hosil bo'ladi. Oltingugurt tetraflorid molekulasi (b) shunga o'xshash shaklga ega, ammo uchburchak bipiramidaning cho'qqilaridan biri 3-chi qavatning (nuqta) bo'linmagan elektronlari juftligi bilan band. Oltingugurt geksafloridida (c) barcha orbitallar ekvivalent va muntazam oktaedrning uchlariga yo'naltirilgan.
Shu paytgacha biz davriy jadvalning faqat d-orbitali qobiqlari to'liq to'ldirilgan yoki butunlay bo'sh bo'lgan elementlarini ko'rib chiqdik. Keling, bu qobiqlar to'liq to'ldirilmagan o'tish elementlariga to'xtalib o'tamiz. 3-chi qavatning turli orbitallarida elektronlar energiyasi quyidagi tartibda ortadi: 3s
Bir nechta ulanishlar. Uglerodning ma'lum birikmalaridan biri etilen C2H4 bo'lib, unda har bir uglerod atomi faqat uchta boshqa atom bilan bog'langan. Bor bilan taqqoslaganda, sp 2 gibrid orbitallari bir tekislikda joylashgan bunday geometriya optimal bo'ladi deb taxmin qilish mumkin. Bunda har bir uglerod atomida bitta foydalanilmagan (sp 2 gibridlanishda) p-orbital bo'ladi, u to'rtta valentlik elektrondan birini o'z ichiga oladi. Agar barcha olti etilen atomi bir tekislikda yotsa, u holda ikkita ishlatilmagan p-AO 2-rasmda ko'rsatilganidek, bir-birining ustiga tushadi. 6, a. Bu oʻzaro bogʻlanish juft MO hosil boʻlishiga olib keladi: bitta bogʻlovchi (6b-rasm) va bitta boʻshashtiruvchi MO (6c-rasm). Ularning har biri faqat bitta elektronni o'z ichiga olganligi sababli, ular kam energiyali bog'lanish MO hosil qilishi mumkin. Shunday qilib, uglerod atomlari o'rtasida qo'shimcha bog'lanish paydo bo'ladi va etilenning strukturaviy formulasi shaklga ega.
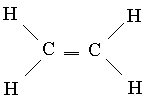
Ushbu yangi turdagi bog'lanish atomlarning ulanish chizig'i bo'ylab orbitallarning bir-birining ustiga chiqishi natijasida hosil bo'lganlardan ikki jihati bilan farq qiladi. Oxirgi turdagi havolalar, bitta C-C ulanishlari, eksenel nosimmetrikdir va shuning uchun ular bog'laydigan guruhlarning aylanishiga ta'sir qilmaydi. Bundan farqli o'laroq, p-orbitallarning bir-birining ustiga chiqishi etilen molekulasidagi barcha olti atomning bir xil tekislikda yotishiga bog'liq, chunki p-AOlar optimal o'xshashlik uchun parallel bo'lishi kerak. Shunday qilib, agar bitta C-C bog'i atrofida aylanish nisbatan erkin sodir bo'lishi mumkin bo'lsa, C=C qo'sh bog'lanish atrofida bu juda qiyin. Haqiqatan ham, etilen molekulasi qattiq tekis strukturadir. Ikkinchi farq orbital qoplama darajasiga tegishli. p-AO ning o'zaro bog'lanishi nisbatan samarasiz va shuning uchun bu turdagi bog'lanish zaifdir. Shuning uchun etilen kimyoviy jihatdan faqat bitta bog'langan to'yingan birikmalarga qaraganda ko'proq reaktivdir.
Guruch. 6. AGAR HAMMA OLTI ETILEN ATOMLARI bir tekislikda yotsa, u holda foydalanilmagan ikkita atom p-orbitali ko'ndalang qoplanishda ishtirok etadi (a). Bu juft molekulyar orbitallarning hosil bo'lishiga olib keladi - bog'lanish (b) va bo'shashish (c).
Orbitallar atomlarning tutashuv chizigʻi boʻylab (boʻylama ustma-ust tushsa) hosil boʻladigan bogʻlar s-bogʻlar, koʻndalang qoʻshilganda esa p-bogʻlar deyiladi. Ba'zi birikmalarning molekulalari, masalan, C 2 H 2 asetilen, uchta bog'lanishni o'z ichiga oladi. Ularda har bir uglerod atomi qo'shnisi bilan sp-gibrid orbitallar hosil qilgan s-bog'lar orqali bog'langan. Ular kollineardir, shuning uchun atsetilen molekulasidagi to'rtta atom bir xil to'g'ri chiziqda yotadi. Uglerod atomlarining qolgan p-AO lari bir-biriga yopishganda ikkita p-bog' hosil qiladi.
aromatik birikmalar. C6H6 benzol molekulasi olti a'zoli uglerod atomlari halqasi sifatida ifodalanadi, ularning har birida vodorod atomi ham biriktirilgan (7a-rasm). Har bir uglerod atomining uchta qo'shnisi bo'lganligi sababli, tegishli bog'lanishlar sp 2 gibridlanish natijasida hosil bo'ladi va bir xil tekislikda bir-biriga 120 ° burchak ostida yotadi deb taxmin qilish mumkin. Darhaqiqat, benzol molekulasi tekis strukturadir. Uglerod atomlarining foydalanilmagan p-AO lari p-bog'larni hosil qilishi mumkin (7b-rasm), lekin benzol uchun AO juftlarining bir-birining ustiga chiqishi natijasida bog'lar hosil bo'lgan yuqorida ko'rib chiqilgan holatlarga qaraganda, vaziyat murakkabroq. Benzolda har bir uglerod atomining 2p-AO si barcha qo'shni atomlarning 2p-AO si bilan teng ravishda bir-biriga mos kelishi kerak. (Bu yerda benzol molekulasidagi orbitallarning ustma-ust tushishini ikki tirqish yoki difraksion panjara ustidagi diffraksiyalangan to‘lqinlarning ustma-ust tushishi bilan solishtirib ko‘p to‘lqin interferensiyasiga o‘xshatishimiz mumkin.) Natijada benzol uchun halqa molekulyar to‘plamini olamiz. Barcha oltita uglerod atomini qamrab olgan orbitallar (7-rasm, in). Bunday elektron konfiguratsiyaga ega bo'lgan tizimning umumiy energiyasi, agar p-AOlar juft bo'lib oddiy p-bog'larni hosil qilsa, kamroq bo'ladi. Darhaqiqat, benzol o'zining "klassik" tuzilishiga ko'ra kutilganidan ko'ra barqarorroq va kamroq faoldir (7d-rasm). Uning molekulasidagi barcha bog'lar simmetrik bo'lib, ularning uzunligi bir xil bo'lib, mustahkamligi bo'yicha ular bir va qo'sh bog'lar orasida oraliq joyni egallaydi. Boshqa birikmalar ham ma'lumki, ularda p-elektronlar "ko'p markazli" MO'larning shakllanishida ishtirok etadilar va ular uchun o'xshash xususiyatlar bog'lanish uzunligi va kimyoviy faollik.
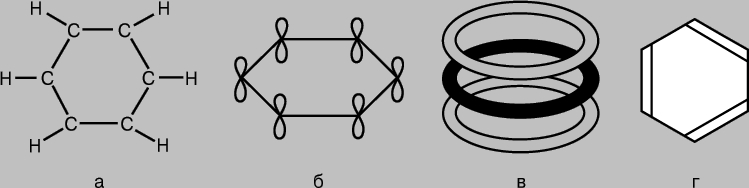
Guruch. 7. BENZOL MOLEKULASI C 6 H 6 uglerod atomlarining olti a'zoli halqasi bo'lib, ularning har biri vodorod atomi (a) bilan ham bog'langan. Uglerod atomlarining "qo'shimcha" p-orbitallari p-bog'larning (b) hosil bo'lishi bilan bir-biriga yopishadi, natijada barcha olti atomni (c) qoplaydigan halqali molekulyar orbitallar to'plami paydo bo'ladi. Natijada, benzol o'zining "klassik" tuzilishidan (d) kutilganidan ko'ra barqarorroq va kamroq faol birikma hisoblanadi.
Ko'p markazli aloqalarni o'z ichiga olgan birikmalar. Hatto CH4 kabi oddiy molekulalarda ham alohida molekulyar orbitallar bir-biri bilan o'zaro ta'sir qiladi. Shuning uchun mahalliylashtirilgan ikki markazli kovalent bog'lanish g'oyasini faqat taxminiy deb hisoblash mumkin. Biroq, qoida tariqasida, bu o'zaro ta'sirlar zaifdir, chunki orbital qoplama darajasi kichik (aromatik va shunga o'xshash birikmalarda p-MO bundan mustasno). Shunga qaramay, uch yoki undan ortiq atomlar tomonidan elektronlarni bo'lishish orqali bog'lanishlar hosil bo'lishi uchun mas'ul bo'lgan ko'paytiriladigan AO'larga ega molekulalarning mavjudligini inkor etib bo'lmaydi. Misol tariqasida olti juft valentlik elektronga ega diboran B 2 H 6; bu klassik H3B-BH3 tuzilishini yaratish uchun zarur bo'lgan etti bog'lanishni shakllantirish uchun etarli emas. H. Longe-Higgins diboranning tuzilishini taklif qildi, rasmda ko'rsatilgan. 8, a. Bu tuzilishda markaziy vodorod atomlari ikki bor atomining sp3 gibrid orbitallarining vodorod atomining 1s-AO bilan ustma-ust tushishi natijasida hosil bo'lgan uch markazli bog'lar orqali bog'langan (8b-rasm). Olti juft valentlik elektrondan to'rttasi "terminal" vodorod atomlari bilan oddiy s-bog'larni va ikkita juft - uch markazli aloqalarni hosil qilishda ishtirok etadi. Ko'p markazli bog'lanishning yanada murakkab misoli dibenzenekrom molekulasi tomonidan taqdim etilgan (8c-rasm). Bu molekuladagi benzol halqalari metall atomi bilan benzolning p-MO ning markaziy atomning 3d-, 4s- va 4p-AO larining qoplanishi natijasida hosil boʻlgan murakkab koʻp markazli orbitallar orqali bogʻlangan. Boshqa shunga o'xshash birikmalar ham sendvich tuzilishiga ega.
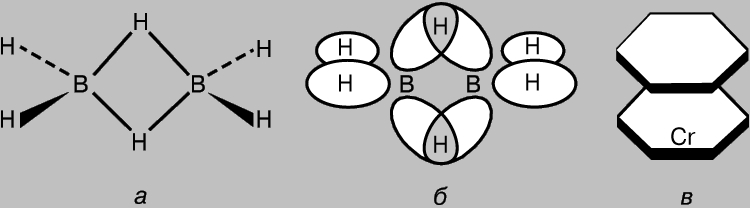
Guruch. 8. DIBORANE (a) da vodorod atomlari ikki bor atomining sp3 gibrid orbitallarining vodorodning 1s atom orbitali (b) bilan ustma-ust tushishi natijasida hosil boʻlgan uch markazli bogʻlar orqali bogʻlangan. Ushbu turdagi bog'lanishlar hosil bo'lishining yanada murakkab misoli dibenzenxrom molekulasi (c).
istiqbollari. Bugungi kunga kelib, molekulalar tuzilishining umumiy tamoyillarini o'rnatilgan deb hisoblash mumkin. Murakkab molekulalarning, shu jumladan biologik molekulalarning tuzilishini aniqlash uchun fizik-kimyoviy usullar ishlab chiqilgan. Yaqin kelajakda bir-biriga bog'liq ikkita yo'nalishda taraqqiyot mumkin. Birinchidan, kvant mexanik hisob-kitoblarning aniqligini oshirishni, ikkinchidan, yaxshilanishni kutish kerak. eksperimental usullar mos keladigan molekulyar parametrlarni o'lchash.
ADABIYOT
Kondratiyev V.N. Atomlar va molekulalarning tuzilishi. M., 1959 Coulson C. Valence. M., 1965 Slater J. Elektron tuzilma molekulalar. M., 1965 Cartmell E., Fouls G. Valentlik va molekulalarning tuzilishi. M., 1979 yil
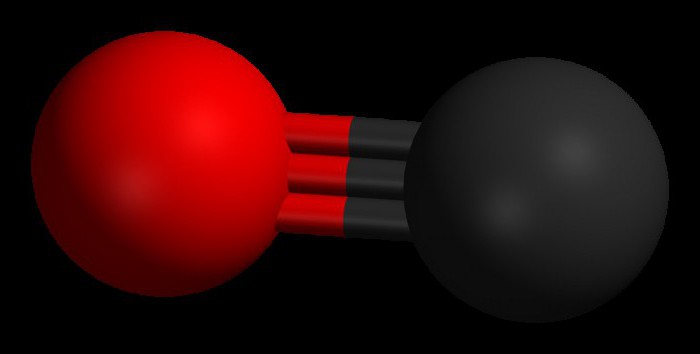
Uglerod oksidi, shuningdek, uglerod oksidi sifatida ham tanilgan, juda kuchli molekulyar tarkibga ega, inertdir. kimyoviy xossalari va suvda yomon eriydi. Ushbu birikma ham nihoyatda zaharli bo'lib, nafas olish tizimiga tushganda qon gemoglobin bilan birlashadi va kislorodni to'qimalar va organlarga tashishni to'xtatadi.
Kimyoviy nomlar va formulalar
Uglerod oksidi boshqa nomlar bilan ham tanilgan, jumladan uglerod oksidi II. Kundalik hayotda u odatda uglerod oksidi deb ataladi. Bu uglerod oksidi zaharli, rangsiz, mazasiz va hidsiz gazdir. Uning kimyoviy formulasi CO va bitta molekulaning massasi 28,01 g / mol.

Tanaga ta'siri
Uglerod oksidi gemoglobin bilan qo‘shilib, kislorodni o‘tkazish qobiliyatiga ega bo‘lmagan karboksigemoglobinni hosil qiladi. Uning bug'larini nafas olish markaziy asab tizimiga zarar etkazadi (markaziy asab tizimi) va bo'g'ilish. Natijada kislorod etishmasligi bosh og'rig'i, bosh aylanishi, yurak tezligi va nafas olish tezligining pasayishiga olib keladi, bu esa hushidan ketishga va tananing keyingi o'limiga olib keladi.

Zaharli gaz
Uglerod oksidi, masalan, dvigatellarda uglerod o'z ichiga olgan moddalarning qisman yonishi natijasida hosil bo'ladi ichki yonish. Murakkab tarkibida 1 kislorod atomiga kovalent bog'langan 1 ta uglerod atomi mavjud. Uglerod oksidi juda zaharli va butun dunyo bo'ylab o'limga olib keladigan zaharlanishning eng keng tarqalgan sabablaridan biridir. Ta'sir qilish yurak va boshqa organlarga zarar etkazishi mumkin.
Uglerod oksidining qanday afzalliklari bor?
Jiddiy zaharliligiga qaramay, uglerod oksidi juda foydali - zamonaviy texnologiyalar tufayli undan bir qator hayotiy mahsulotlar yaratiladi. Uglerod oksidi, garchi bugungi kunda ifloslantiruvchi deb hisoblansa ham, tabiatda doimo mavjud bo'lgan, ammo, masalan, karbonat angidrid kabi miqdorda emas.
Murakkab uglerod oksidi tabiatda mavjud emas deb hisoblaganlar xato qiladilar. CO er mantiyasida yuqori bosim ostida erigan vulqon jinsida eriydi. Vulkanik gazlardagi uglerod oksidlarining miqdori vulqonga qarab 0,01% dan 2% gacha o'zgarib turadi. Ushbu birikmaning tabiiyligi doimiy qiymat emasligi sababli, tabiiy gaz chiqindilarini aniq o'lchash mumkin emas.

Kimyoviy xossalari
Uglerod oksidi (formula CO) tuz hosil qilmaydigan yoki befarq oksidlarga ishora qiladi. Biroq, +200 o haroratda U bilan natriy gidroksid bilan reaksiyaga kirishadi. Bunda natriy formati hosil bo'ladi:
NaOH + CO = HCOONa (chumoli kislota tuzi).
Uglerod oksidining xossalari uning kamaytirish qobiliyatiga asoslanadi. Uglerod oksidi:
Molekula tuzilishi
Uglerod oksidi (CO) molekulasini tashkil etuvchi ikkita atom uchlik bog' bilan bog'langan. Ulardan ikkitasi uglerod atomlarining p-elektronlarining kislorod bilan qoʻshilishidan hosil boʻlsa, uchinchisi esa uglerodning erkin 2p orbitali va kislorodning 2p elektron juftligi hisobiga maxsus mexanizm hisobiga hosil boʻladi. Ushbu struktura molekulani yuqori quvvat bilan ta'minlaydi.
Biroz tarix
Ko'proq Aristoteldan qadimgi Gretsiya ko'mirni yoqish natijasida hosil bo'ladigan zaharli bug'larni tasvirlab berdi. O'lim mexanizmining o'zi noma'lum edi. Biroq, qatl qilishning qadimiy usullaridan biri jinoyatchini ko'mir yonayotgan bug 'xonasida qulflash edi. Yunon shifokori Galen nafas olayotganda zarar etkazadigan havo tarkibida ma'lum o'zgarishlar sodir bo'lishini taklif qildi.
Ikkinchi jahon urushi davrida uglerod oksidi bilan toʻldirilgan gaz benzin va dizel yoqilgʻisi kam boʻlgan dunyoning ayrim qismlarida avtomobillar uchun yoqilgʻi sifatida ishlatilgan. Tashqi (bir nechta istisnolardan tashqari) ko'mir yoki yog'och gaz generatorlari o'rnatildi va atmosfera azoti, uglerod oksidi va oz miqdordagi boshqa gazlar aralashmasi gaz aralashtirgichga yuborildi. Bu yog'och gaz deb ataladigan narsa edi.
Uglerod oksidining oksidlanishi
Uglerod oksidi uglerod o'z ichiga olgan birikmalarning qisman oksidlanishida hosil bo'ladi. CO karbonat angidrid (CO 2) hosil qilish uchun etarli kislorod bo'lmaganda hosil bo'ladi, masalan, o'choq yoki ichki yonish dvigateli yopiq xonada ishlaganda. Agar kislorod va boshqa atmosfera kontsentratsiyasi mavjud bo'lsa, uglerod oksidi yonib, ko'k chiroq chiqaradi va karbonat angidrid deb ataladigan karbonat angidridni hosil qiladi.
1960-yillarga qadar ichki yoritish, pishirish va isitish uchun keng qo'llanilgan ko'mir gazida asosiy yoqilg'i komponenti sifatida CO bor edi. Ba'zi jarayonlar ichida zamonaviy texnologiyalar, masalan, temir eritish, hali ham yon mahsulot sifatida uglerod oksidini ishlab chiqaradi. CO birikmasining o'zi xona haroratida CO 2 ga oksidlanadi.
CO tabiatda mavjudmi?
Tabiatda uglerod oksidi bormi? Uning tabiiy manbalaridan biri fotokimyoviy reaktsiyalar troposferada sodir bo'ladi. Bu jarayonlar har yili taxminan 5×10 12 kg e modda hosil qilishi kutilmoqda. Boshqa manbalar orasida, yuqorida aytib o'tilganidek, vulqonlar, o'rmon yong'inlari va boshqa yonish turlari mavjud.
Molekulyar xossalari
Uglerod oksidi bor molyar massa 28.0, bu havodan biroz kamroq zichroq qiladi. Ikki atom orasidagi bog'lanish uzunligi 112,8 mikrometrga teng. Bu eng kuchli kimyoviy bog'lanishlardan birini ta'minlash uchun etarlicha yaqin. CO birikmasidagi ikkala element birgalikda bitta valentlik qobig'ida 10 ga yaqin elektronga ega.
Qoida tariqasida, organik karbonil birikmalarida qo'sh bog'lanish paydo bo'ladi. xarakterli xususiyat CO molekulasi shundan iboratki, 3 ta molekulyar orbitalda 6 ta umumiy elektronga ega bo'lgan atomlar o'rtasida kuchli uchlik bog'lanish paydo bo'ladi. Umumiy elektronlarning 4 tasi kislorod atomidan va faqat 2 tasi ugleroddan kelganligi sababli, bitta bog'langan orbitalni O 2 dan ikkita elektron egallab, dativ yoki dipol bog'lanish hosil qiladi. Bu uglerodda kichik "-" zaryad va kislorodda kichik "+" zaryad bilan molekulaning C ← O polarizatsiyasiga olib keladi.
Qolgan ikkita bog'langan orbital ugleroddan va kisloroddan bitta zaryadlangan zarrachani egallaydi. Molekula assimetrikdir: kislorod uglerodga qaraganda yuqori elektron zichlikka ega va manfiy uglerodga nisbatan ham bir oz musbat zaryadlangan.
Kvitansiya
Sanoatda karbon monoksit CO karbonat angidrid yoki suv bug'ini havoga kirmasdan ko'mir bilan isitish orqali olinadi:
CO 2 + C \u003d 2CO;
H 2 O + C \u003d CO + H 2.
Oxirgi hosil bo'lgan aralashma suv yoki sintez gazi deb ham ataladi. Laboratoriya sharoitida uglerod oksidi II organik kislotalarni suvsizlantiruvchi vosita sifatida ishlaydigan konsentrlangan sulfat kislotaga ta'sir qilish orqali:
HCOOH \u003d CO + H 2 O;
H 2 C 2 O 4 \u003d CO 2 + H 2 O.
CO zaharlanishining asosiy belgilari va yordami
Uglerod oksidi zaharlanishga olib keladimi? Ha, va juda kuchli. Uglerod oksidi bilan zaharlanish butun dunyoda eng keng tarqalgan hodisadir. Eng ko'p uchraydigan alomatlar:
- zaiflik hissi;
- ko'ngil aynishi;
- bosh aylanishi;
- charchoq;
- asabiylashish;
- yomon ishtaha;
- Bosh og'rig'i;
- disorientatsiya;
- ko'rishning buzilishi;
- qusish;
- hushidan ketish;
- konvulsiyalar.
Ushbu zaharli gazga ta'sir qilish jiddiy zarar etkazishi mumkin, bu ko'pincha uzoq muddatli surunkali kasalliklarga olib kelishi mumkin. Uglerod oksidi homilador ayolning homilasiga jiddiy zarar etkazishi mumkin. Jabrlanganlarga, masalan, yong'indan keyin darhol yordam ko'rsatish kerak. tez yordam chaqirish, toza havoga chiqish, nafas olishni cheklaydigan kiyimlarni olib tashlash, tinchlantirish, iliqlik qilish kerak. Og'ir zaharlanish, qoida tariqasida, faqat shifokorlar nazorati ostida, shifoxonada davolanadi.
Ilova
Uglerod oksidi, yuqorida aytib o'tilganidek, zaharli va xavflidir, ammo u zamonaviy sanoatda organik sintez uchun ishlatiladigan asosiy birikmalardan biridir. CO sof metallar, karbonillar, fosgen, uglerod sulfidi, metil spirti, formamid, aromatik kislotalar. Ushbu modda yoqilg'i sifatida ham ishlatiladi. Uning zaharliligi va zaharliligiga qaramay, u ko'pincha ishlab chiqarish uchun xom ashyo sifatida ishlatiladi turli moddalar kimyo sanoatida.
Uglerod oksidi va karbonat angidrid: farqi nimada?
Uglerod oksidi va karbonat angidrid (CO va CO 2) ko'pincha bir-birlari bilan yanglishadilar. Ikkala gaz ham hidsiz va rangsizdir va ikkalasi ham yurak-qon tomir tizimiga salbiy ta'sir qiladi. Ikkala gaz ham tanaga nafas olish, teri va ko'z orqali kirishi mumkin. Ushbu birikmalar, tirik organizmga ta'sir qilganda, bir qator umumiy belgilarga ega - bosh og'rig'i, bosh aylanishi, konvulsiyalar va gallyutsinatsiyalar. Aksariyat odamlar farqni aytishga qiynaladi va avtomobil chiqindi gazlari CO va CO 2 ni chiqarishini tushunmaydi. Bino ichida bu gazlar kontsentratsiyasining ortishi ularga ta'sir qiladigan odamning salomatligi va xavfsizligi uchun xavfli bo'lishi mumkin. Farqi nimada?
Yuqori konsentratsiyalarda ikkalasi ham o'limga olib kelishi mumkin. Farqi shundaki, CO 2 barcha o'simlik va hayvonlar hayoti uchun zarur bo'lgan umumiy tabiiy gazdir. CO keng tarqalgan emas. Bu kislorodsiz yoqilg'ining yonishi natijasida hosil bo'lgan yon mahsulotdir. Kritik kimyoviy farq shundaki, CO 2 bitta uglerod atomi va ikkita kislorod atomini o'z ichiga oladi, CO esa faqat bitta. Karbonat angidrid yonmaydi, monooksid esa yonib ketadi.
Karbonat angidrid tabiiy ravishda atmosferada paydo bo'ladi: odamlar va hayvonlar kislorod bilan nafas oladilar va karbonat angidridni chiqaradilar, ya'ni tirik mavjudotlar uning oz miqdoriga bardosh bera oladi. Bu gaz o'simliklar tomonidan fotosintezni amalga oshirish uchun ham zarur. Biroq, uglerod oksidi atmosferada tabiiy ravishda paydo bo'lmaydi va hatto past konsentratsiyalarda ham sog'liq muammolariga olib kelishi mumkin. Ikkala gazning zichligi ham har xil. Karbonat angidrid havodan og'irroq va zichroq, uglerod oksidi esa biroz engilroq. Uylarda tegishli sensorlarni o'rnatishda ularning bu xususiyati hisobga olinishi kerak.
Kimyoviy bog'lanish deganda tushuniladi har xil turlari Ikki va ko'p atomli birikmalarning barqaror mavjudligiga olib keladigan o'zaro ta'sirlar: molekulalar, ionlar, kristalli moddalar. O'z tabiatiga ko'ra, kimyoviy bog'lanish musbat zaryadlangan yadrolar va manfiy zaryadlangan elektronlar, shuningdek elektronlarning bir-biri bilan o'zaro ta'siridir. Kimyoviy bog'lanishning asosiy turlari: kovalent, ion, metall. Kovalent bog'lanishni tavsiflash uchun ikkita usul qo'llaniladi - valent bog'lanish usuli (MVS) va molekulyar orbital usul (MMO).
VS usuli quyidagi qoidalarga asoslanadi:
1. Kovalent bog'lanish (bog'lanishning almashinish mexanizmi) yoki bitta atomning elektron jufti hosil bo'lishida faqat spinlari qarama-qarshi yo'naltirilgan ikkita atomning juftlanmagan elektronlari ishtirok etadi.
Donor va boshqa atomning erkin orbitali - qabul qiluvchi (donor-akseptor mexanizmi).
2. Ikki atom o'rtasidagi kovalent kimyoviy bog'lanish bir-birining ustiga chiqishi natijasida yuzaga keladi atom orbitallari elektron juftlarning shakllanishi bilan (ikki elektronning ijtimoiylashuvi).
Valentlik bog'lanishlar nazariyasiga ko'ra, kovalent bog'lanish o'zaro ta'sir qiluvchi atomlarning atom orbitallarining maksimal qoplanishiga yo'naltirilgan.
Ikki dan ortiq atomdan tashkil topgan molekulaning geometrik (fazoviy) tuzilishi tufayli o'zaro tartibga solish kimyoviy bog'larning hosil bo'lishida ishtirok etadigan atom orbitallari. AB 2 molekulasi chiziqli bo'lishi mumkin ![]() , yoki burchakli struktura (a). AB 3 molekulasi muntazam uchburchak (b), trigonal piramida (c) shakliga ega bo'lishi mumkin. AB 4 molekulasi tetraedr shaklidir (d).
, yoki burchakli struktura (a). AB 3 molekulasi muntazam uchburchak (b), trigonal piramida (c) shakliga ega bo'lishi mumkin. AB 4 molekulasi tetraedr shaklidir (d).
a) 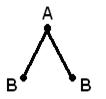 b)
b) 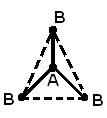 ichida)
ichida) 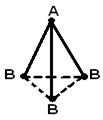 G)
G) 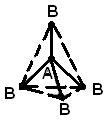
Molekulaning fazoviy tuzilishi markaziy atomning valentlik orbitallarining gibridlanish turiga va valentlik elektron qatlamidagi umumiy boʻlmagan elektron juftlarining soniga qarab belgilanadi.
1-misol Valentlik bog lanish usuli nuqtai nazaridan molekulalarning tuzilishini tavsiflang: a) RN 3 , b) BBr 3 . Kimyoviy bog'lanish hosil bo'lishida qanday atom orbitallari ishtirok etadi? Gibridlanish turini ko'rsating (agar duragaylash sodir bo'lsa). Bu molekulalarning fazoviy tuzilishi qanday?
Yechim. a) PH 3 molekulasining hosil bo'lishi.
PH 3 molekulasini asosiy (normal) holatda hosil qiluvchi atomlarning elektron formulalarini yozamiz: 15 R 1s 2 2s 2 2p 6 3s 2 3p 3 ; 1 H 1s 1
Ushbu atomlarning tashqi sathining elektron-grafik formulalari:
Ushbu molekulada markaziy atom fosfor atomi bo'lib, unda faqat p orbitallar uchta kimyoviy bog'lanish hosil bo'lishida ishtirok etadi, bir xil pastki sathda joylashgan va bir xil shaklga va bir xil energiyaga ega. Shunday qilib, PH 3 molekulasida gibridlanish yo'q.
Valentlik sxemalarini vizual tasvirlash uchun quyidagi usuldan foydalanish mumkin. Tashqi elektron qatlamda joylashgan elektronlar atomning kimyoviy belgisi atrofida joylashgan nuqtalar bilan belgilanadi. Ikki atom uchun umumiy elektronlar kimyoviy belgilar orasiga qo'yilgan nuqtalar bilan ko'rsatilgan; qo'sh yoki uch bog'lanish mos ravishda ikki yoki uch juft umumiy nuqta bilan belgilanadi. Ushbu belgilar yordamida PH 3 molekulasining shakllanishi quyidagicha ifodalanishi mumkin:
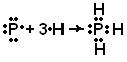 H
H
ê
Ushbu sxema boshqacha yozilishi mumkin: H - P - H, bu erda ikkita atomni bog'laydigan elektronlarning har bir jufti tizimli formulalarda kovalent bog'lanishni tasvirlaydigan bitta chiziqqa to'g'ri keladi.
p - fosfor atomining elektron bulutlari o'zaro perpendikulyar yo'nalishlarda (koordinata o'qlari bo'ylab) -p x, p y, p z yo'naltirilgan va gantel shakliga ega. Kimyoviy hosil bo'lishida vodorod atomida R-N aloqa s-elektron ishtirok etadi, u sferik bulut shakliga ega. PH 3 molekulasi hosil bo'lganda, fosfor atomining p-elektron bulutlari uchta vodorod atomining s-elektron bulutlari bilan ustma-ust tushadi:
Valentlik bog'lanish usulining talablariga muvofiq, uchta bog'lanish
P - H 90 ° S ga yaqin burchak ostida joylashgan bo'lishi kerak. Shuning uchun yagona bog'lanishlarning fazoviy joylashuvi molekulaning geometrik tuzilishini belgilaydi. PH 3 molekulasi trigonal piramida shakliga ega bo'lishi kerak:
Piramidaning tepasida fosfor atomi, poydevorining tepasida esa vodorod atomlari joylashgan.
b) BBr 3 molekulasining hosil bo'lishi. VVr 3 molekulasida markaziy atom bor atomidir.
Atomlarning elektron formulalari:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Tashqi darajadagi elektron grafik formulalar quyidagi shaklga ega:
Murakkab tarkibidagi bor uch valentli bo'lgani uchun biz qo'zg'aluvchan holatda bor atomining elektron-grafik formulasini yozamiz:
BBr 3 molekulasida uchta kimyoviy bog'lanish hosil bo'lishida bir s- va ikkita p-orbital ishtirok etadi, ular turli quyi darajalarda joylashgan va turli shakl va har xil energiya
Bunda qo`zg`algan bor atomining dastlabki bitta s- va ikkita p-orbitallari o`rniga uchta ekvivalent gibrid orbitallar hosil bo`ladi (sp 2 - gibridlanish). Sp 2 gibridizatsiyasi bilan gibrid elektron bulutlari bir xil tekislikda yotadigan va bir-biriga 120 ° burchak ostida yo'naltirilgan yo'nalishlarda joylashgan:
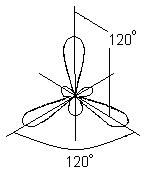
Gibridlanishning bu turi tekis uchburchak molekula hosil bo'lishiga mos keladi. BBr 3 molekulasi hosil bo'lganda, bor atomining uchta gibrid orbitali uchta brom atomining p-elektron orbitallari bilan ustma-ust tushadi:
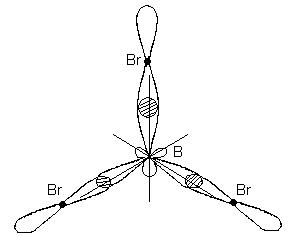
BBr 3 molekulasi markazda bor atomi va uchlarida brom atomlari joylashgan tekis muntazam uchburchak shakliga ega. BBr 3 molekulasidagi barcha uchta B-Br bog'lari ekvivalentdir.
2-misol Molekulyar orbital usul yordamida F 2 molekulasi va F 2 + molekulyar ionini hosil qilishning energiya sxemalarini tuzing. Bog'lanish va antibog'lanish orbitallarida nechta elektron bor? Ushbu zarrachalardagi bog'lanish tartibi qanday? Ularning magnit xususiyatini belgilang (paramagnetizm yoki diamagnetizm).
Yechim. Molekulyar orbitallar (MMO) nazariyasiga ko'ra, molekula musbat zaryadlangan yadrolar va manfiy zaryadlangan elektronlar yig'indisi sifatida qaraladi, bu erda har bir elektron boshqa elektronlar va barcha yadrolar maydonida harakat qiladi.
Molekulani MMO nazariyasiga ko'ra tasvirlash uning orbitallarining turini, ularning energiyalarini va orbitallar bo'ylab elektronlarning taqsimlanish xarakterini aniqlashni anglatadi.
Molekula hosil bo'lganda, molekulyar orbitallarning ikki turi paydo bo'ladi - bog'lanish va bo'shashish. Agar atomlardan molekula hosil bo'lishi jarayonida elektronning molekulyar orbitalga o'tishi energiyaning pasayishi bilan birga bo'lsa, unda bunday molekulyar orbital bo'ladi. bog'lash. Agar elektronning molekulyar orbitalga o'tishi energiyaning ortishi bilan birga bo'lsa, unda bunday molekulyar orbital bo'ladi. bo'shashish.
Molekulalardagi elektronlar s- va p-molekulyar orbitallarda joylashgan. s-orbitallar s - atom orbitallari va 2p x - atom orbitallarining bir-birining ustiga chiqishi orqali hosil bo'lishi mumkin. Bunda molekulyar orbitallar hosil bo'ladi: s-bog'lanish (s st) va s-bo'shashtirish (s raz). 2p y va 2p z atom orbitallari ustma-ust tushganda molekulyar orbitallar hosil bo'ladi: p sv2Py, p sv2P z va p marta2Py, p marta2P z. Elektronlarning molekulyar orbitallarda joylashish tartibi atom orbitallaridagi kabi, ya’ni eng kam energiya prinsipiga Pauli prinsipiga, Xund qoidasiga mos keladi.








