Elektronlarning energiya darajalari bo'yicha joylashishi jadvaldir. Elektronlarning energiya darajalarida joylashishi
|
l= 0, 1, ... dan n-1 gacha |
m = - l; 0;+ l | |||
|
l= 0(lar) | ||||
|
l= 0(lar), l= 1(p) |
m = -1, 0, +1 |
| ||
|
l= 0(lar), l= 1(p) l= 1(d) |
m = -1, 0, +1 m = -2, -1, 0, +1,+2 |
|
Eslatma: Jadvalda energiya darajasidagi elektronlarning maksimal mumkin bo'lgan soni ko'rsatilgan.
Elektron formula
Elektronlar atom orbitallarini energiyani oshirish tartibida to'ldiradi. Orbital yadroga qanchalik yaqin bo'lsa (kamroq raqam bilan energiya darajasi), elektron yadroga qanchalik kuchli jalb qilinsa, u uchun bunday tartibga solish shunchalik qulay bo'ladi.
Masalan, uglerod atomining atom raqami oltita, ya'ni yadro zaryadi +6, elektronlar soni ham oltita. Bu elektronlar ikki energiya sathida (davr raqami) joylashgan. Uglerod atomining birinchi energiya darajasi to'liq to'ldirilgan: bitta orbitalda qarama-qarshi spinli (1s 2) ikkita elektron mavjud (7-jadvalga qarang). Qolgan to'rtta elektron ikkinchi energiya darajasini egallaydi, ikkitasi o'zlarining afzal ko'rgan s orbitallarida va ikkitasi p orbitallarida (2s 2 2p 2).
Elektronlarning taqsimlanishi energiya darajalari va pastki darajalar quyidagilarga bo'ysunadi:
1. Pauli printsipi
2. Klechkovskiy qoidasi
3. Hund qoidasi.
Pauli printsipi. 1925 yilda P. Pauli atomda aynan bir xil to'plamga ega bo'lgan ikkita elektron bo'lishi mumkin emas degan tamoyilni ilgari surdi. kvant raqamlari: n l, Xonim. Bundan kelib chiqadiki, har bir orbitalda ikkitadan ortiq elektron bo'lishi mumkin emas va ular qarama-qarshi spinlarga ega bo'lishi kerak, ya'ni. to'ldirishga ruxsat beriladi va va to'ldirishga ruxsat berilmaydi.
V. Klechkovskiy hukmronligi. Energiyaning ko'payishi va shunga mos ravishda orbitalning to'ldirilishi n + kvant sonlari yig'indisini oshirish tartibida sodir bo'ladi. l, va qachon summasiga teng n+ l n ning ortib borish tartibida.
Masalan, Ca +20)))) 1s 2s 2p 3s 3p 3d 4s 4p 4d
energiya pastki darajalari ketma-ketligi
agar s = 0, p = 1, d = 2 bo'lsa
Demak, sathlar va pastki sathlarning elektronlar bilan to'ldirilishi n va ning yig'indisining ortish tartibida sodir bo'ladi. l: 1s 2 2s 2 2p 6 3s 2 3p 6 3 d 0 4s 2
Ba'zi d va f elementlar bundan mustasno bo'lib, ular dip deb ataladigan (elektronning s pastki sathidan oldingi tashqi d yoki f darajasiga tushishi) ega. Masalan, Cu, Ag, Cr, Pd, Pt.
Hund qoidasi.Atomning normal holatidagi orbital p, d, f pastki sathlarini to'ldirish bir xil spinli yagona elektronlardan boshlanadi. Yagona elektronlar barcha pastki darajadagi orbitallarni egallagandan so'ng, orbitallar qarama-qarshi spinli ikkinchi elektronlar bilan to'ldiriladi. Masalan, elektron tuzilma azot atomi quyidagi tuzilishga ega 1s2s2p
Elementlarning xossalari valentlik elektronlarining elektron konfiguratsiyasiga bog'liq. Valentlik elektronlari, qoida tariqasida, tashqi energiya darajasida (davr raqami), valent elektronlar soni guruh raqami bilan aniqlanishi mumkin (VIII guruhning d elementlari bundan mustasno). Misol uchun, azot atomida beshta valentlik elektron (V guruh) mavjud bo'lib, ular ikkinchi energiya darajasida joylashgan (element ikkinchi davrda).
Valentlik elektronlarining tuzilishiga ko'ra PSE ning barcha elementlarini s-, p-, d-, f- elementlarga bo'lish mumkin, aks holda ular oilalar deb ataladi:
s-elementlar I, II guruhlarda (asosiy kichik guruhlar)
p-elementlar III-VIII guruhlarda (asosiy kichik guruhlar)
d-elementlar I-VIII guruhlarda (yon kichik guruhlar)
f-elementlar lantanidlar va aktinidlar deb tasniflanadi.
Oilaning barcha elementlari o'xshash tuzilishga ega:
qo'zg'atmagan holatdagi s-elementlar faqat s-kichik darajadagi valentlik elektronlariga ega.
qo'zg'atmagan holatdagi p-elementlarning tashqi s va p-kichik darajalarida valentlik elektronlari mavjud.
qo'zg'atmagan holatdagi d-elementlarning tashqi s va oldingi tashqi d-kichik darajalarida valentlik elektronlari mavjud.
Oila elementlarining o'xshash elektron konfiguratsiyasi ushbu oila elementlarining kimyoviy xossalarining o'xshashligini ta'minlaydi.
TA'RIF
Skandiy davriy sistemaning ikkilamchi (B) kichik guruhi III guruhining toʻrtinchi davrida joylashgan.
d-oilasining elementlariga ishora qiladi. Metall. Belgilanishi - Sc. Tartib son - 21. Nisbatan atom massasi- 44,956 amu
Skandiy atomining elektron tuzilishi
Skandiy atomi musbat zaryadlangan yadrodan (+21) iborat boʻlib, uning ichida 21 ta proton va 24 neytron boʻlib, 21 ta elektron toʻrtta orbita boʻylab harakatlanadi.
1-rasm. Skandiy atomining sxematik tuzilishi.
Elektronlarning orbitallarda taqsimlanishi quyidagicha:
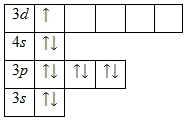
1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 .
Skandiy atomining tashqi energiya darajasida valentlik bo'lgan 3 ta elektron mavjud. Skandiyning oksidlanish darajasi +3 ga teng. Asosiy holatning energiya diagrammasi quyidagi shaklni oladi:
Muammoni hal qilishga misollar
MISOL 1
2-MISA
| Mashq qilish | Galliy elementi ikkita tabiiy izotopga ega 69 Ga va 71 Ga. Agar elementning nisbiy atom massasi 69,72 ga teng bo‘lsa, tabiiy galliydagi ushbu izotoplarning massa ulushlarini hisoblang. |
| Yechim | Izotoplar bir xil kimyoviy elementning atomlari bo'lib, ular bir-biridan farq qiladi massa raqamlari(protonlar soni bir xil, lekin har xil - neytronlar). Tabiiy xlorning har yuzta atomidagi 69 Ga galliy izotopining atomlari sonini x deb olaylik, u holda 71 Ga izotopining atomlari soni (100-x) ga teng bo'ladi. 69 Ga izotopi atomlarining massasi 69x va 71 Ga - 71 × (100-x) ga teng bo'ladi. Keling, tenglama tuzamiz: 69x + 74x(100x) = 69,72x100%. Keling, x ni topamiz: 69x + 7400 - 74x = 6972; |
| Javob | Tabiiy xlorda 69 Ga izotopining miqdori 85,6%, 71 Ga izotopiniki esa 14,4% ni tashkil qiladi. |
I. Atomlarning elektron formulalari kimyoviy elementlar quyidagi tartibda tuziladi:
· Birinchidan, D. I. Mendeleyev jadvalidagi element soni bo‘yicha atomdagi elektronlarning umumiy soni aniqlanadi;
· Keyin, element joylashgan davrning soniga ko'ra, energiya darajalari soni aniqlanadi;
· Darajalar pastki sathlarga va orbitallarga bo'linadi va ga muvofiq elektronlar bilan to'ldiriladi Eng kam energiya printsipi
· Qulaylik uchun elektronlarni formuladan foydalanib energiya darajalariga bo'lish mumkin N=2n2 va shuni hisobga olib:
1. elementlarda asosiy kichik guruhlar ( s-; p -elementlar), tashqi darajadagi elektronlar soni guruh soniga teng.
2. elementlarda yon kichik guruhlar odatda tashqarida ikki elektron (atomlar bundan mustasnoCu, Ag, au, Cr, Nb, Mo, Ru, Rh, kimning tashqi darajasi bitta elektron, atPdtashqi darajada nol elektronlar);
3. oxirgi darajadagi elektronlar soni umumiy soni atomdagi elektronlar minus boshqa barcha darajadagi elektronlar soni.
II. Elektron to'ldirish tartibi atom orbitallari belgilangan :
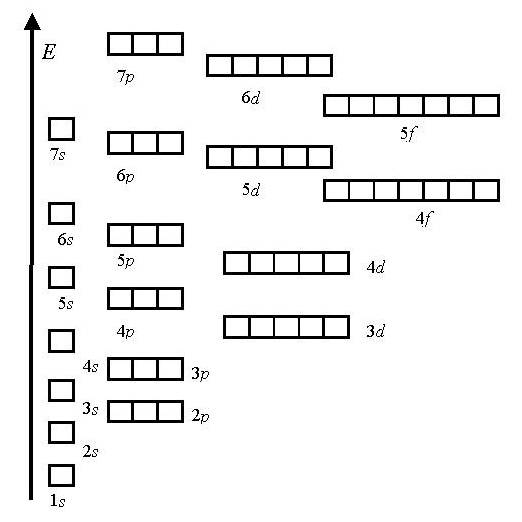
1.Eng kam energiya printsipi
Energiya shkalasi:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. To'liq yoki yarim to'ldirilgan pastki sathga ega bo'lgan atomning holati (ya'ni, har bir orbitalda bitta juftlashtirilmagan elektron mavjud bo'lganda) barqarorroq.
Bu elektronning "qobiliyatsizligi" ni tushuntiradi. Shunday qilib, elektronlarning quyidagi taqsimoti xrom atomining barqaror holatiga mos keladi:
Cr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 , lekin emas 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4,
ya'ni 4 dan elektronning "qobiliyati" mavjud s-pastki sathdan 3 d-pastki darajagacha.
O'ZINGIZNI TEKSHIRING: Elementlarning elektron formulalari.
Modulni yuklab oling: o'quv apparati"Elementlar atomlarining elektron qobiqlarini to'ldirish" kimyoviy elementlarning davriy jadvali va atomda elektronlarning taqsimlanishini tasvirlaydigan diagrammani o'z ichiga oladi.
Sizni atomning elektron tuzilishi bo'yicha kimyoviy elementni aniqlash taklif etiladi.
1. Jadvalning birinchi ustunida atomlarning elektron sxemalari ko'rsatilgan kimyoviy elementlar davriy tizimning qaysi guruhlari asosiy kichik guruhlarida mavjudligini aniqlang.
Elektron sxemalar Guruhlar 1 2 3 4 5 6 7 2-4-chi SCH VA E X LEKIN B Da 2-8-2-chi DA Va Kimga M H O P 2-1-chi M FROM S F YU LEKIN I 2-8-5 R B T DA Va E G 2-8-1-chi H D VA Va Kimga Z M 2-8-7 L O DA H Da P E 2-8-3-chi R T FROM X C H F 2-3-chi SCH S Kimga E M H Kimga 2-8-6 O I LEKIN DA FROM Va O 2-5-chi YU P R M Y DA X 2. Davriy tizimning qaysi guruhlari asosiy kichik guruhlarida kimyoviy elementlar borligini aniqlang, ularning proton va neytronlari soni jadvalning birinchi ustunida keltirilgan.
Proton va neytronlar soni Guruhlar 1 2 3 4 5 6 7 13r 14n LEKIN G E G O FROM B 12p 12n DA L SCH Kimga Va P H 15r 16n B O P E E Kimga Da 19r 20n M C Da LEKIN D S E 17p18n Y Z F L Z L E 6p 6n Kimga M I H YU YU I 8p 8n P FROM T D H T DA
Modulni yuklab oling va t ni ishga tushiring“Kimyoviy elementlarning davriy qonuni va davriy tizimi” mavzusida ovqatlanadi
D. I. Mendeleyev va atomning tuzilishi”
Modulni yuklab oling va t ni ishga tushiring “Atomlar tuzilishi haqida asosiy ma’lumotlar” mavzusida ovqatlanadi. Modulda mavzu bo‘yicha 10 ta test savollari mavjud. Xususan, sizga raqamli va alifbo belgilarini tegishli zonaga o'tkazish orqali oltingugurt atomining elektron formulasini qurish taklif etiladi.
Tuzatish uchun vazifalar
3. Atom yadrosi qanday tarkibdan iborat?
5. Izotoplarni solishtiring.
6. Na+1 ionini hosil qilish sxemasini yozing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. O -2 ionining hosil bo`lish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring.
6. S-2 ionining hosil bo`lish sxemasini yozing
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. Mg+2 ionini hosil qilish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. Si+4 ionining hosil bo’lish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. Al+3 ionining hosil bo`lish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. Cl -1 ionining hosil bo`lish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
1. D.I.Mendeleyev kimyoviy elementining davriy sistemasidagi elementning o‘rnini yozing.
2. Yadro zaryadini, elektronlarning umumiy sonini aniqlang.
3. Atom yadrosi qanday tarkibdan iborat?
4. Elektronlarning qatlamlarda (darajalarda) taqsimlanish diagrammasini chizing.
5. Izotoplarni solishtiring ![]() .
.
6. K+1 ionini hosil qilish sxemasini yozing.
7. Elektronlarning iondagi qatlamlar (darajalar) bo‘yicha taqsimlanishi diagrammasini tuzing.
Kimyoviy elementlarning davriy tizimi - kimyoviy elementlarning qat'iy tartiblangan to'plami, ularning tabiiy tasnifi davriy qonunning jadval yoki boshqa grafik ifodasidir.
Davriy tizim jadvallarining juda ko'p turli xil versiyalari ma'lum. Biroq, ulardan faqat D.I. tomonidan tuzilgan jadvalga yaqin bo'lganlar. Mendeleev. Hozirgi vaqtda davriy tizimning ikki shakli asosan qo'llaniladi: uzoq va qisqa davr.
Davriy tizimning vertikal grafiklari deyiladi guruhlar, va gorizontallar davrlar. Qisqa davr shakli sakkiz guruh va etti davrdan iborat. Lantanidlar va aktinidlar oilalari jadval ostida joylashgan.
Davr - atomlarida bir xil miqdordagi energiya darajalari elektronlar bilan to'ldirilgan elementlarning ketma-ket seriyasi (darajalar soni davr soniga teng). Davrlar o'z ichiga oladi 2, 8, 8, 18, 32 va 32 elementlar. Oxirgi davr tugallanmagan. Davrlardagi elementlarning har xil soni energiya pastki sathlarini to'ldirishning turli ketma-ketligi bilan izohlanadi. Elektronlar bilan to'ldirilgan elementlar s- pastki daraja deyiladi s- u to'ldirilgan elementlar R- pastki daraja - R- u to'ldirilgan elementlar d- va f- pastki darajalar - mos ravishda d- va f- elementlar. Davrlar gidroksidi metallar bilan boshlanadi, ularning atomlarida yangi elektron darajada, s- elektron. Davrlar atomlari to'liq to'ldirilgan elementlar bilan tugaydi p- olti elektronli tashqi sathning pastki darajasi (inert gazlar), geliy bilan tugaydigan birinchi davr bundan mustasno, bunda daraja 2 ga oshadi. s- elektronlar. 4 va 5-chi davrlarda s- va p- joylashtirilgan elementlar 10 d- elementlar, 6 va 7-davrlarda esa - 10 d- elementlar va 14 f- elementlar.
Davriy tizim 8 guruhdan (yoki tizimning uzoq muddatli versiyasida 32 guruhdan) iborat. Guruhlar rim raqamlari bilan belgilanadi I - VIII va ikkita kichik guruhdan iborat: LEKIN va B.
Har bir guruh atomlari elektron qobiqlarning o'xshash tuzilishiga ega bo'lgan elementlardan iborat. Masalan, kaliy 4 s 1 (IA), va mis - 3d 10 4 s 1 (I B). Ushbu elementlar tashqi tomondan 4 s- Har bir kichik daraja bitta elektronga ega. Xuddi shu guruhga kiruvchi elementlar deyiladi elektron analoglar.
Bir kichik guruhning bir qismi bo'lgan elementlar to'liq elektron hamkasblari, chunki ular elektron darajalarning bir xil tuzilishiga ega. Masalan, elementlar I A guruhlar umumiy formulaga ega ns 1 , va elementlar I B -(n-1)d 10 ns 1 .
Elementlarning davriy tizimi nashr etilgandan beri unda 40 dan ortiq yangi elementlar paydo bo'ldi. Davriy qonunga asoslanib, atom raqamlari 93 dan 105 gacha (jami 15 ta) bo'lgan transuran elementlari sun'iy ravishda olingan. Ularning ishlab chiqarilishi Yerda mavjud bo'lgan eng og'ir element - uran-238 dan foydalanishga asoslangan bo'lib, uning yadrolari neytronlar bilan bombardimon qilish orqali "qurilgan". Fermiygacha bo'lgan elementlar shu tarzda olinadi 100 Fm 257 yadroviy reaktorlarda. Transuranidlar termoyadro portlashlarida ham hosil bo'ladi.
Atom raqamlari 100 dan ortiq bo'lgan barcha elementlar tezlatgichlarda ishlab chiqariladi. Og'ir atom yadrolari (maqsadlar) og'ir ionlar bilan bombardimon qilinadi. Neytronlar chiqarilgandan so'ng, ularning ikkalasi ham birlashib, tarkibiy qismlarning atom raqamlari yig'indisi bilan yangi elementlarni hosil qiladi. Davriy tizim rivojlanadi, yangi elementlar ochiladi. Zamonaviy kompyuter texnologiyalari yordamida hisoblangan ehtimollik nazariyasiga ko'ra, 8-davr 50 ta elementni o'z ichiga olishi kerak, ular orasida 18 ta elementdan iborat kimyoviy jihatdan o'xshash elementlarning yangi guruhi paydo bo'ladi, ular hozirgacha oktadekanoidlar deb ataladi. (Z=121-138). Mumkin bo'lgan barqarorlikning yuqori chegarasi, chunki uni hozirgi bilim darajasi bilan aniqlash mumkin, atom raqami 174 ga yaqin. Biroq, bu chegara emas, chunki, masalan, Seaborg kimyoviy elementlarning barqarorlik diagrammasidan, mavjudligi atom raqamlari 500 gacha bo'lgan elementlardan iborat bo'lishi mumkin.







