H kimyoviy bog'lanish. Kimyoviy bog'lanishning xususiyatlari
Har bir atom ma'lum miqdordagi elektronga ega.
Kirish kimyoviy reaksiyalar, atomlar elektronlarni beradi, oladi yoki ijtimoiylashtiradi, eng barqaror elektron konfiguratsiyaga erishadi. Eng past energiyaga ega konfiguratsiya eng barqaror hisoblanadi (asli gaz atomlarida bo'lgani kabi). Bu naqsh "okteta qoidasi" deb ataladi (1-rasm).
Guruch. bitta.
Bu qoida hamma uchun amal qiladi ulanish turlari. Atomlar orasidagi elektron aloqalar ularga eng oddiy kristallardan tortib, oxir-oqibat tirik tizimlarni tashkil etuvchi murakkab biomolekulalargacha barqaror tuzilmalarni shakllantirishga imkon beradi. Ular kristallardan uzluksiz metabolizmda farqlanadi. Biroq, ko'plab kimyoviy reaktsiyalar mexanizmlarga muvofiq davom etadi elektron transfer, bu organizmdagi energiya jarayonlarida muhim rol o'ynaydi.
Kimyoviy bog'lanish ikki yoki undan ortiq atomlar, ionlar, molekulalar yoki ularning har qanday birikmasini ushlab turadigan kuchdir..
Tabiat kimyoviy bog'lanish universal: bu atomlarning tashqi qobig'idagi elektronlarning konfiguratsiyasi bilan belgilanadigan manfiy zaryadlangan elektronlar va musbat zaryadlangan yadrolar o'rtasidagi elektrostatik tortishish kuchi. Atomning kimyoviy aloqalar hosil qilish qobiliyati deyiladi valentlik, yoki oksidlanish darajasi. tushunchasi valent elektronlar - kimyoviy bog'larni hosil qiluvchi elektronlar, ya'ni eng yuqori energiyali orbitallarda joylashganlar. Shunga ko'ra, ushbu orbitallarni o'z ichiga olgan atomning tashqi qobig'i deyiladi valentlik qobig'i. Hozirgi vaqtda kimyoviy bog'lanish mavjudligini ko'rsatishning o'zi etarli emas, lekin uning turini aniqlashtirish kerak: ion, kovalent, dipol-dipol, metall.
Ulanishning birinchi turiionli ulanish
Lyuis va Kosselning elektron valentlik nazariyasiga ko'ra, atomlar barqaror elektron konfiguratsiyaga ikki yo'l bilan erishishi mumkin: birinchidan, elektronlarni yo'qotish orqali kationlar, ikkinchidan, ularni egallash, aylantirish anionlar. Elektron uzatish natijasida qarama-qarshi ishorali zaryadli ionlar orasidagi elektrostatik tortishish kuchi tufayli Kossel deb nomlangan kimyoviy bog'lanish hosil bo'ladi. elektrovalent(hozir chaqiriladi ionli).
Bunday holda, anionlar va kationlar tashqi to'ldirilgan barqaror elektron konfiguratsiyani hosil qiladi elektron qobiq. Odatda ionli bog'lanishlar davriy tizimning T va II guruhlari kationlaridan va VI va VII guruhlardagi metall bo'lmagan elementlarning anionlaridan (mos ravishda 16 va 17 kichik guruhlar) hosil bo'ladi. xalkogenlar va halogenlar). Ion birikmalaridagi bog'lanishlar to'yinmagan va yo'nalishsizdir, shuning uchun ular boshqa ionlar bilan elektrostatik o'zaro ta'sir qilish imkoniyatini saqlab qoladilar. Shaklda. 2 va 3 da Kossel elektron uzatish modeliga mos keladigan ionli bog'lanishlar misollari ko'rsatilgan.
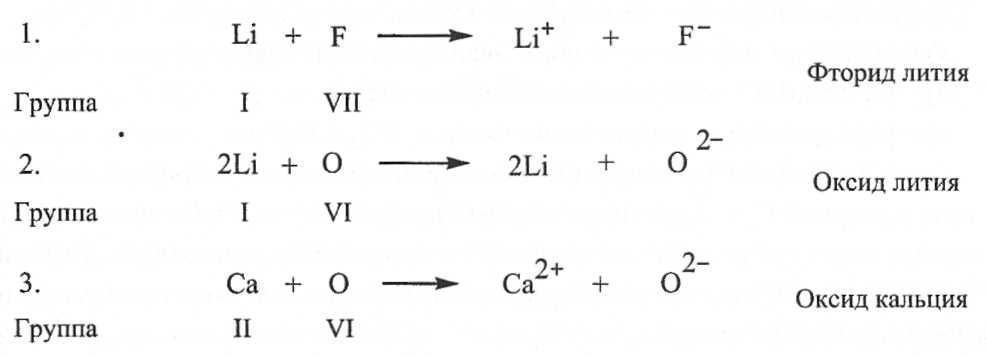
Guruch. 2.
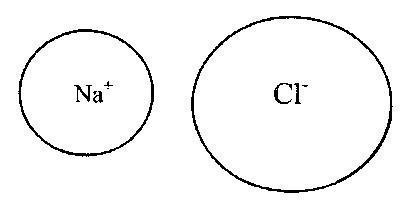
Guruch. 3. Natriy xlorid (NaCl) molekulasidagi ion aloqasi
Bu erda moddalarning tabiatdagi xatti-harakatlarini tushuntiruvchi ba'zi xususiyatlarni esga olish, xususan, kontseptsiyani ko'rib chiqish o'rinlidir. kislotalar va asoslar.
Bu moddalarning barchasining suvli eritmalari elektrolitlardir. Ular rangni turli yo'llar bilan o'zgartiradilar. ko'rsatkichlar. Ko'rsatkichlarning ta'sir qilish mexanizmini F.V. Ostvald. U indikatorlar zaif kislotalar yoki asoslar ekanligini ko'rsatdi, ularning dissotsilanmagan va dissotsilangan holatlarida rangi har xil.
Asoslar kislotalarni neytrallashi mumkin. Barcha asoslar suvda erimaydi (masalan, tarkibida -OH guruhlari bo'lmagan ba'zi organik birikmalar erimaydi, xususan, trietilamin N (C 2 H 5) 3); eruvchan asoslar deyiladi ishqorlar.
Kislotalarning suvli eritmalari xarakterli reaksiyalarga kiradi:
a) metall oksidlari bilan - tuz va suv hosil bo'lishi bilan;
b) metallar bilan - tuz va vodorod hosil bo'lishi bilan;
c) karbonatlar bilan - tuz hosil bo'lishi bilan, CO 2 va H 2 O.
Kislota va asoslarning xossalari bir qancha nazariyalar bilan tavsiflanadi. S.A. nazariyasiga muvofiq. Arrhenius, kislota - bu ionlarni hosil qilish uchun ajraladigan modda H+ , asos esa ionlarni hosil qiladi U- . Bu nazariya gidroksil guruhlarga ega bo'lmagan organik asoslarning mavjudligini hisobga olmaydi.
ga muvofiq proton Bronsted va Louri nazariyasiga ko'ra, kislota proton beruvchi molekulalar yoki ionlarni o'z ichiga olgan moddadir ( donorlar protonlar), asos esa protonlarni qabul qiluvchi molekulalar yoki ionlardan tashkil topgan moddadir ( qabul qiluvchilar protonlar). E'tibor bering, suvli eritmalarda vodorod ionlari gidratlangan shaklda, ya'ni gidroniy ionlari shaklida mavjud. H3O+ . Bu nazariya nafaqat suv va gidroksid ionlari bilan, balki erituvchisiz yoki suvsiz erituvchi bilan ham amalga oshiriladigan reaktsiyalarni tavsiflaydi.
Masalan, ammiak orasidagi reaksiyada NH 3 (zaif asos) va vodorod xlorid gaz fazasida qattiq ammoniy xlorid hosil bo'ladi va ikkita moddaning muvozanat aralashmasida doimo 4 ta zarracha mavjud bo'lib, ulardan ikkitasi kislotalar, qolgan ikkitasi esa asosdir:
Ushbu muvozanat aralashmasi ikkita konjuge juft kislota va asoslardan iborat:
1)NH 4+ va NH 3
2) HCl va Cl ‑
Bu erda har bir konjugatsiyalangan juftlikda kislota va asos bir proton bilan farq qiladi. Har bir kislota konjugat asosga ega. Kuchli kislota zaif konjugat asosga ega, kuchsiz kislota esa kuchli konjugat asosga ega.
Bronsted-Louri nazariyasi suvning biosfera hayotidagi beqiyos rolini tushuntirishga imkon beradi. Suv, u bilan o'zaro ta'sir qiluvchi moddaga qarab, kislota yoki asos xususiyatlarini ko'rsatishi mumkin. Masalan, sirka kislotaning suvli eritmalari bilan reaksiyalarda suv asos, ammiakning suvdagi eritmalari bilan esa kislota hisoblanadi.
1) CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 SOO- . Bu yerda sirka kislota molekulasi suv molekulasiga proton beradi;
2) NH3 + H 2 O ↔ NH4 + + U- . Bu erda ammiak molekulasi suv molekulasidan protonni qabul qiladi.
Shunday qilib, suv ikkita konjuge juft hosil qilishi mumkin:
1) H 2 O(kislota) va U- (konjugat asos)
2) H 3 O+ (kislota) va H 2 O(konjugat asos).
Birinchi holda, suv proton beradi, ikkinchisida esa uni qabul qiladi.
Bunday mulk deyiladi amfiprotonlik. Ham kislota, ham asos sifatida reaksiyaga kirisha oladigan moddalar deyiladi amfoter. Bunday moddalar ko'pincha tabiatda uchraydi. Masalan, aminokislotalar ham kislotalar, ham asoslar bilan tuzlar hosil qilishi mumkin. Shuning uchun peptidlar mavjud bo'lgan metall ionlari bilan osongina koordinatsion birikmalar hosil qiladi.
Shunday qilib, ionli bog'lanishning xarakterli xususiyati - bog'lovchi elektronlar to'plamining yadrolardan biriga to'liq siljishi. Bu ionlar orasida elektron zichligi deyarli nolga teng bo'lgan hudud mavjudligini anglatadi.
Ulanishning ikkinchi turikovalent ulanish
Atomlar barqaror hosil bo'lishi mumkin elektron konfiguratsiyalar elektronlarni almashish orqali.
Bunday bog'lanish bir juft elektron bir vaqtning o'zida taqsimlanganda hosil bo'ladi. har biridan atom. Bunday holda, ijtimoiylashtirilgan bog'lanish elektronlari atomlar orasida teng taqsimlanadi. Kovalent bog'lanishga misol gomonuklear diatomik H molekulalari 2 , N 2 , F 2. Allotroplar bir xil turdagi bog'lanishga ega. O 2 va ozon O 3 va ko'p atomli molekula uchun S 8 va shuningdek heteronuklear molekulalar vodorod xlorid HCl, karbonat angidrid CO 2, metan CH 4, etanol FROM 2 H 5 U, oltingugurt geksaflorid SF 6, asetilen FROM 2 H 2. Bu molekulalarning barchasi bir xil umumiy elektronlarga ega bo'lib, ularning bog'lari bir xil tarzda to'yingan va yo'naltirilgan (4-rasm).
Biologlar uchun er-xotin va uch bog'lanishdagi atomlarning kovalent radiuslari bitta bog'lanishga nisbatan kamayishi muhimdir.
![]()
Guruch. to'rtta. Cl 2 molekulasidagi kovalent bog'lanish.
Ion va kovalent bog'lanish turlari to'plamning ikkita cheklovchi holatidir mavjud turlari kimyoviy bog'lar, amalda esa ko'pchilik bog'lar oraliqdir.
Mendeleyev tizimining bir xil yoki turli davrlarining qarama-qarshi uchlarida joylashgan ikkita elementning birikmalari asosan ionli bog'lanishlarni hosil qiladi. Elementlar bir davr ichida bir-biriga yaqinlashganda, ularning birikmalarining ion tabiati pasayadi, kovalent xarakteri esa ortadi. Masalan, davriy jadvalning chap tomonidagi elementlarning galogenidlari va oksidlari asosan ionli bog'lanishlarni hosil qiladi ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH) va jadvalning o'ng tomonidagi elementlarning bir xil birikmalari kovalent ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glyukoza C 6 H 12 O 6, etanol C 2 H 5 OH).
Kovalent bog'lanish, o'z navbatida, boshqa modifikatsiyaga ega.
Ko'p atomli ionlarda va murakkab biologik molekulalarda ikkala elektron ham faqatgina kelib chiqishi mumkin bitta atom. U deyiladi donor elektron juft. Ushbu juft elektronni donor bilan ijtimoiylashtiradigan atom deyiladi qabul qiluvchi elektron juft. Ushbu turdagi kovalent bog'lanish deyiladi muvofiqlashtirish (donor-akseptor, yokidating) aloqa(5-rasm). Ushbu turdagi bog'lanish biologiya va tibbiyot uchun juda muhimdir, chunki metabolizm uchun eng muhim d-elementlarning kimyosi asosan koordinatsion aloqalar bilan tavsiflanadi.
![]()
Rasm. 5.
Qoida tariqasida, murakkab birikmada metall atomi elektron juft qabul qiluvchi rolini bajaradi; aksincha, ion va kovalent bog'lanishlarda metall atomi elektron donor hisoblanadi.
Kovalent bog'lanishning mohiyatini va uning xilma-xilligini - koordinatsion bog'lanishni GN tomonidan taklif qilingan boshqa kislotalar va asoslar nazariyasi yordamida oydinlashtirish mumkin. Lyuis. U Bronsted-Lowri nazariyasiga ko'ra "kislota" va "asos" atamalarining semantik tushunchasini biroz kengaytirdi. Lyuis nazariyasi kompleks ionlarning hosil boʻlish tabiatini va moddalarning nukleofil oʻrinbosar reaksiyalarida, yaʼni CS hosil boʻlishida ishtirokini tushuntiradi.
Lyuisning fikricha, kislota asosdan elektron juftini qabul qilib, kovalent bog'lanish hosil qila oladigan moddadir. Lyuis asosi - bu elektronlar berish orqali Lyuis kislotasi bilan kovalent bog'lanish hosil qiladigan yagona juft elektronga ega bo'lgan modda.
Ya'ni, Lyuis nazariyasi kislota-asos reaktsiyalari doirasini protonlar umuman ishtirok etmaydigan reaktsiyalarga ham kengaytiradi. Bundan tashqari, ushbu nazariyaga ko'ra, protonning o'zi ham kislotadir, chunki u elektron juftini qabul qilishga qodir.
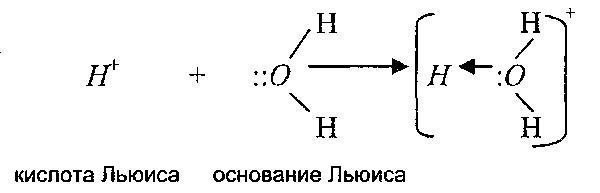
Shuning uchun bu nazariyaga ko'ra, kationlar Lyuis kislotalari, anionlar esa Lyuis asoslaridir. Bunga quyidagi reaktsiyalar misol bo'la oladi:
Yuqorida ta'kidlanganidek, moddalarning ionli va kovalentlarga bo'linishi nisbiydir, chunki kovalent molekulalarda elektronning metall atomlaridan akseptor atomlariga to'liq o'tishi yo'q. Ion bog`li birikmalarda har bir ion qarama-qarshi belgili ionlarning elektr maydonida bo`ladi, shuning uchun ular o`zaro qutblanadi, qobiqlari deformatsiyalanadi.
Polarizatsiya qobiliyati belgilangan elektron tuzilma, ionning zaryadi va hajmi; u anionlar uchun kationlarga qaraganda yuqori. Kationlar orasida eng yuqori qutblanish qobiliyati kattaroq va kichikroq o'lchamdagi kationlar uchun, masalan, Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Kuchli polarizatsiya ta'siriga ega H+ . Ion polarizatsiyasining ta'siri ikki tomonlama bo'lgani uchun ular hosil bo'lgan birikmalarning xususiyatlarini sezilarli darajada o'zgartiradi.
Uchinchi turdagi ulanish -dipol-dipol ulanish
Ro'yxatda keltirilgan aloqa turlaridan tashqari, dipol-dipol ham mavjud molekulalararo o'zaro ta'sirlar, deb ham ataladi van der Vaals .
Ushbu o'zaro ta'sirlarning kuchi molekulalarning tabiatiga bog'liq.
O'zaro ta'sirning uch turi mavjud: doimiy dipol - doimiy dipol ( dipol-dipol diqqatga sazovor joylar); doimiy dipol - induktsiyalangan dipol ( induksiya diqqatga sazovor joylar); oniy dipol - induktsiyalangan dipol ( dispersiya attraktsion yoki London kuchlari; guruch. 6).

Guruch. 6.
Faqat qutbli qutbli molekulalar dipol-dipol momentiga ega. kovalent aloqalar (HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl) va bog'lanish kuchi 1-2 ga teng debye(1D \u003d 3,338 × 10 -30 kulon metr - C × m).
Biokimyoda bog'lanishning yana bir turi ajralib turadi - vodorod cheklovchi holat bo'lgan ulanish dipol-dipol diqqatga sazovor joy. Bu bog'lanish vodorod atomi va kichik elektronegativ atom, ko'pincha kislorod, ftor va azot o'rtasidagi tortishish natijasida hosil bo'ladi. Xuddi shunday elektronegativlikka ega bo'lgan yirik atomlar bilan (masalan, xlor va oltingugurt bilan) vodorod aloqasi ancha zaifdir. Vodorod atomi bitta muhim xususiyat bilan ajralib turadi: bog'lovchi elektronlar tortib olinganda, uning yadrosi - proton ochiladi va elektronlar tomonidan ekranga tushishni to'xtatadi.
Shuning uchun atom katta dipolga aylanadi.
Vodorod aloqasi, van der Vaals bog'idan farqli o'laroq, nafaqat molekulalararo o'zaro ta'sirlar paytida, balki bir molekula ichida ham hosil bo'ladi - intramolekulyar vodorod aloqasi. Vodorod aloqalari biokimyoda muhim rol o'ynaydi, masalan, a-spiral shaklidagi oqsillarning tuzilishini barqarorlashtirish yoki DNK qo'sh spiralini hosil qilish uchun (7-rasm).
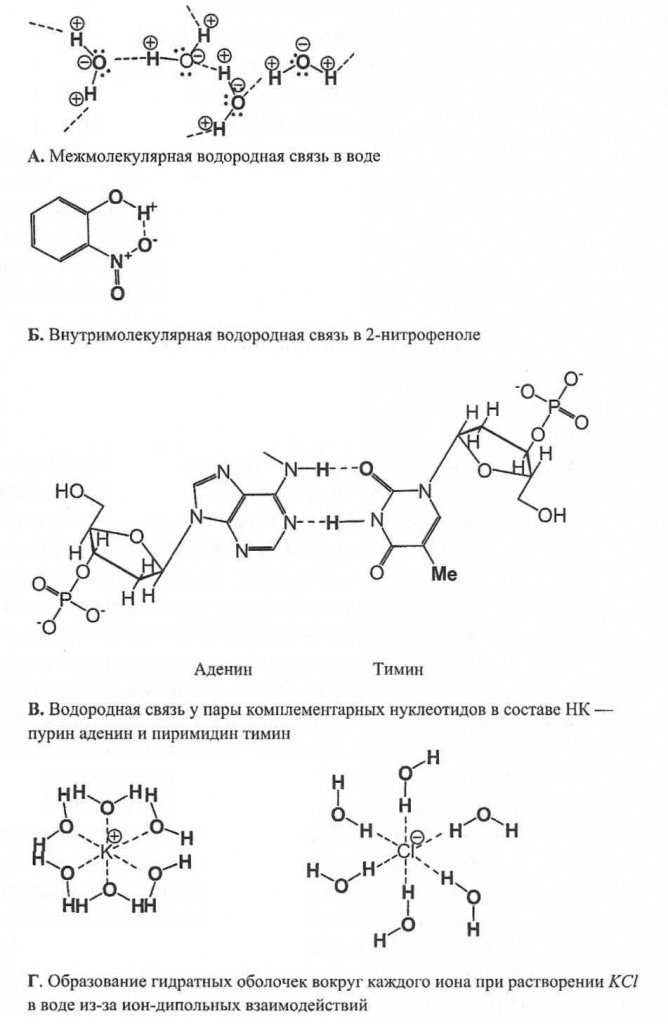
7-rasm.
Vodorod va van der Vaals bog'lari ion, kovalent va koordinatsion bog'larga qaraganda ancha zaifdir. Molekulyar aloqalarning energiyasi Jadvalda ko'rsatilgan. bitta.
1-jadval. Molekulalararo kuchlar energiyasi
Eslatma: Molekulalararo o'zaro ta'sir darajasi erish va bug'lanish (qaynatish) entalpiyasini aks ettiradi. Ion birikmalari ionlarni ajratish uchun molekulalarni ajratishdan ko'ra ko'proq energiya talab qiladi. Ion birikmalarining erish entalpiyalari molekulyar birikmalarga qaraganda ancha yuqori.
To'rtinchi ulanish turi -metall bog'lanish
Va nihoyat, molekulalararo aloqalarning yana bir turi mavjud - metall: ulanish ijobiy ionlar erkin elektronli metallarning panjaralari. Bunday aloqa turi biologik ob'ektlarda uchramaydi.
Kimdan umumiy koʻrinish bog'lanish turlari, bir tafsilot aniqlangan: metall atomi yoki ionining muhim parametri - elektron donor, shuningdek atom - elektron qabul qiluvchi. hajmi.
Tafsilotlarga kirmasdan shuni ta'kidlaymizki, atomlarning kovalent radiuslari, metallarning ion radiuslari va o'zaro ta'sir qiluvchi molekulalarning van-der-Vaals radiuslari davriy tizim guruhlarida ularning atom soni ortishi bilan ortadi. Bunday holda, ion radiuslarining qiymatlari eng kichik, van der Waals radiuslari esa eng katta. Qoidaga ko'ra, guruh bo'ylab pastga siljishda barcha elementlarning radiusi kovalent va van-der-vaals bo'yicha ortadi.
Biologlar va shifokorlar uchun eng muhimi muvofiqlashtirish(donor-akseptor) koordinatsion kimyo tomonidan ko'rib chiqiladigan bog'lanishlar.
Tibbiy bioanorganiklar. G.K. Barashkov
Ikki yoki undan ortiq atomlardan hosil bo'lgan kimyoviy zarralar deyiladi molekulalar(haqiqiy yoki shartli formula birliklari ko'p atomli moddalar). Molekulalardagi atomlar kimyoviy bog'langan.
Kimyoviy bog'lanish deganda tushuniladi elektr kuchlari zarrachalarni birga ushlab turuvchi tortishish. Har bir kimyoviy bog'lanish strukturaviy formulalar ko'rinadi valentlik chizig'i, masalan:
H - H (ikki vodorod atomi orasidagi bog'lanish);
H 3 N - H + (ammiak molekulasining azot atomi va vodorod kationi orasidagi bog'lanish);
(K +) - (I -) (kaliy kationi va yodid ioni orasidagi bog'lanish).
Kimyoviy bog'lanish bir juft elektron ( ) tomonidan hosil bo'ladi, ular murakkab zarrachalarning elektron formulalarida (molekulalar, murakkab ionlar) odatda o'zlarining bo'linmagan elektron juft atomlaridan farqli ravishda valentlik chizig'i bilan almashtiriladi, masalan:
Kimyoviy bog'lanish deyiladi kovalent, agar u ikkala atom tomonidan bir juft elektronning ijtimoiylashuvi natijasida hosil bo'lsa.
F 2 molekulasida ikkala ftor atomi ham bir xil elektronegativlikka ega, shuning uchun elektron juftga ega bo'lish ular uchun bir xil. Bunday kimyoviy bog'lanish qutbsiz deb ataladi, chunki har bir ftor atomiga ega elektron zichligi ichida xuddi shunday elektron formula molekulalarni shartli ravishda ular orasida teng taqsimlash mumkin:
HCl molekulasida kimyoviy bog'lanish allaqachon mavjud qutbli, chunki xlor atomidagi elektron zichligi (katta elektr manfiyli element) vodorod atomiga qaraganda ancha yuqori:
Kovalent bog'lanish, masalan, H - H, ikkita neytral atomning elektronlarini almashish orqali hosil bo'lishi mumkin:
H + H > H - H
Ushbu bog'lanish mexanizmi deyiladi almashish yoki ekvivalent.
Boshqa mexanizmga ko'ra, H - H gidrid ionining elektron jufti vodorod kationi H + tomonidan sotsializatsiyalanganda bir xil kovalent bog'lanish paydo bo'ladi:
H + + (:H) - > H - H
Bu holda H + kation deyiladi qabul qiluvchi va anion H - donor elektron juft. Bu holda kovalent bog'lanishning hosil bo'lish mexanizmi bo'ladi donor-akseptor, yoki muvofiqlashtirish.
Yagona bog'lanishlar (H - H, F - F, H - CI, H - N) deyiladi a-havolalar, ular molekulalarning geometrik shaklini aniqlaydi.
Ikki va uch bog'lanish () bir?-komponent va bir yoki ikki?-komponentni o'z ichiga oladi; Bosh va shartli shakllangan birinchi bo'lgan ?-komponent har doim?-komponentlardan kuchliroqdir.
Kimyoviy bog'lanishning fizik (aslida o'lchanadigan) xususiyatlari uning energiyasi, uzunligi va qutbliligidir.
Kimyoviy bog'lanish energiyasi (E cv) - bu bog'lanish hosil bo'lganda ajralib chiqadigan va uni buzishga sarflanadigan issiqlik. Xuddi shu atomlar uchun har doim bitta bog'lanish mavjud kuchsizroq ko'pdan (ikki, uch barobar).
Kimyoviy bog'lanish uzunligi (l s) - yadrolararo masofa. Xuddi shu atomlar uchun har doim bitta bog'lanish mavjud uzoqroq ko'pdan ko'ra.
Polarlik aloqa o'lchanadi elektr dipol momenti p- haqiqiy elektr zaryadining (ma'lum bir bog'lanish atomlari bo'yicha) dipol uzunligiga (ya'ni, bog'lanish uzunligi) ko'paytmasi. Dipol momenti qanchalik katta bo'lsa, bog'lanishning qutbliligi shunchalik yuqori bo'ladi. Haqiqiy elektr zaryadlari kovalent bog'lanishdagi atomlar bo'yicha har doim elementlarning oksidlanish darajalariga qaraganda kamroq qiymatga ega, lekin belgisi bo'yicha mos keladi; masalan, H + I -Cl -I aloqasi uchun haqiqiy zaryadlar H +0 "17 -Cl -0" 17 (bipolyar zarracha yoki dipol).
Molekulalarning qutblanishi ularning tarkibi va geometrik shakli bilan belgilanadi.
Qutbsiz (p = O) bo'ladi:
a) molekulalar oddiy moddalar, chunki ular faqat qutbsiz kovalent aloqalarni o'z ichiga oladi;
b) ko'p atomli molekulalar qiyin moddalar, agar ularning geometrik shakli bo'lsa simmetrik.
Masalan, CO 2, BF 3 va CH 4 molekulalari teng (uzunlik bo'ylab) bog'lanish vektorlarining quyidagi yo'nalishlariga ega:
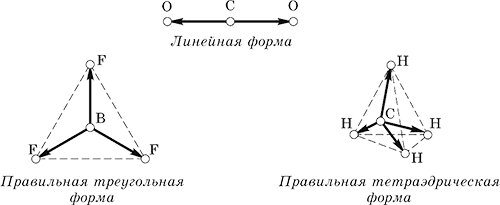
Bog'lanish vektorlari qo'shilganda, ularning yig'indisi doimo yo'qoladi va molekulalar umuman qutbsiz bo'ladi, garchi ular qutbli aloqalarni o'z ichiga oladi.
Polar (s> O) bo'ladi:
a) diatomik molekulalar qiyin moddalar, chunki ular faqat qutbli aloqalarni o'z ichiga oladi;
b) ko'p atomli molekulalar qiyin moddalar, agar ularning tuzilishi assimetrik tarzda, ya'ni ularning geometrik shakli to'liq bo'lmagan yoki buzilgan bo'lib, bu umumiy elektr dipolning paydo bo'lishiga olib keladi, masalan, NH 3, H 2 O, HNO 3 va HCN molekulalari uchun.
NH 4 +, SO 4 2- va NO 3 - kabi murakkab ionlar printsipial jihatdan dipol bo'la olmaydi, ular faqat bitta (musbat yoki manfiy) zaryadga ega.
Ion aloqasi kationlar va anionlarning elektrostatik tortishish paytida, masalan, K + va I - o'rtasida bir juft elektronning deyarli sotsializatsiyasisiz paydo bo'ladi. Kaliy atomida elektron zichligi yo'q, yod atomida ortiqcha. Ushbu ulanish ko'rib chiqiladi cheklovchi kovalent bog'lanish holati, chunki bir juft elektron amalda anionga ega. Bunday bog'lanish tipik metallar va metall bo'lmaganlar (CsF, NaBr, CaO, K 2 S, Li 3 N) va tuz sinfidagi moddalar (NaNO 3, K 2 SO 4, CaCO 3) birikmalari uchun eng xosdir. Xona sharoitida bu birikmalarning barchasi kristalli moddalar birlashtiradi umumiy ismion kristallari(kationlar va anionlardan tuzilgan kristallar).
Ulanishning yana bir turi mavjud metall aloqa, bunda valentlik elektronlar metall atomlari tomonidan shunchalik erkin tutiladiki, ular aslida ma'lum atomlarga tegishli emas.
Tashqi elektronlarsiz qolgan metallarning atomlari go'yo musbat ionlarga aylanadi. Ular shakllanadi metall kristall panjara. Ijtimoiylashtirilgan valent elektronlar to'plami ( elektron gaz) musbat metall ionlarini birga va muayyan panjara joylarida ushlab turadi.
Ion va metall kristallardan tashqari, ular ham bor atom va molekulyar kristall moddalar, ularning panjara joylarida mos ravishda atomlar yoki molekulalar mavjud. Misollar: olmos va grafit - atom panjarali kristallar, yod I 2 va karbonat angidrid CO 2 (quruq muz) - molekulyar panjarali kristallar.
Kimyoviy bog'lanishlar nafaqat moddalar molekulalari ichida, balki molekulalar o'rtasida ham paydo bo'lishi mumkin, masalan, suyuq HF, suv H 2 O va H 2 O + NH 3 aralashmasi:
vodorod aloqasi eng elektromanfiy elementlarning atomlarini o'z ichiga olgan qutbli molekulalarning elektrostatik tortishish kuchlari tufayli hosil bo'ladi - F, O, N. Masalan, vodorod aloqalari HF, H 2 O va NH 3 da mavjud, ammo ular HCl, H da emas. 2 S va PH 3.
Vodorod aloqalari beqaror va juda oson buziladi, masalan, muz erishi va suv qaynayotganda. Biroq, bu bog'larni uzish uchun ma'lum bir qo'shimcha energiya sarflanadi va shuning uchun vodorod bog'lari bo'lgan moddalarning erish nuqtalari (5-jadval) va qaynash nuqtalari.

(masalan, HF va H 2 O) shunga o'xshash moddalarga qaraganda sezilarli darajada yuqori, ammo vodorod aloqalarisiz (masalan, mos ravishda HCl va H 2 S).
Ko'pgina organik birikmalar vodorod bog'larini ham hosil qiladi; Vodorod aloqasi biologik jarayonlarda muhim rol o'ynaydi.
A qismi topshiriqlariga misollar1. Faqat kovalent bog'lanishga ega bo'lgan moddalar
1) SiH 4, Cl 2 O, CaBr 2
2) NF 3, NH 4 Cl, P 2 O 5
3) CH 4 , HNO 3 , Na (CH 3 O)
4) CCl 2 O, I 2, N 2 O
2–4. kovalent bog'lanish
2. yagona
3. ikki barobar
4. uchlik
materiyada mavjud
5. Molekulalarda bir nechta bog'lar mavjud
6. Radikallar deb ataladigan zarralar
7. Bog'lardan biri ionlar to'plamida donor-akseptor mexanizmi orqali hosil bo'ladi
1) SO 4 2-, NH 4 +
2) H 3 O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 + , SO 3 2-
8. Eng bardoshli va qisqa bog'lanish - molekulada
9. Faqat ionli bog'langan moddalar - to'plamda
2) NH 4 Cl, SiCl 4
10–13. Moddaning kristall panjarasi
13. Va (OH) 2
1) metall
3) yadroviy
Bog'lanishning eng muhim belgilariga quyidagilar kiradi: uzunlik, qutblilik, dipol moment, to'yinganlik, yo'nalish, kuch va bog'larning ko'pligi.
Aloqa davomiyligi molekuladagi atomlar yadrolari orasidagi masofa. Bog'lanish uzunligi yadrolarning kattaligi va elektron bulutlarning bir-biriga yopishish darajasi bilan belgilanadi.
HFda bog’ uzunligi 0,92∙10 -10, HCl da 1,28∙10 -10 m.Kimyoviy bog’lanish qanchalik kuchli bo’lsa, uning uzunligi shunchalik qisqa bo’ladi.
Bog'lanish burchagi (valentlik burchagi) kimyoviy bog'langan atomlar yadrolari orqali o'tadigan xayoliy chiziqlar orasidagi burchak deb ataladi. ∟HOH=104 0,5; ∟H 2 S \u003d 92,2 0; ∟H 2 S e \u003d 91 0,0.
Kimyoviy bog'lanishning eng muhim xususiyati hisoblanadi energiya, uni aniqlash kuch.
Miqdoriy jihatdan bog'ning mustahkamligi uni uzish uchun sarflangan energiya bilan tavsiflanadi va moddaning 1 moliga kJ bilan o'lchanadi.
Shuning uchun bog'lanish kuchi sublimatsiya energiyasini miqdoriy jihatdan tavsiflaydi E subl. moddalar va molekulaning atomlarga dissotsilanish energiyasi E diss. . Sublimatsiya energiyasi deganda moddaning o'tishi uchun sarflangan energiya tushuniladi qattiq holat gazga aylanadi. Ikki atomli molekulalar uchun bog'lanish energiyasi molekulaning ikki atomga ajralish energiyasiga teng.
Masalan, E diss. (va shuning uchun E St.) H 2 molekulasida 435 kJ / mol. F 2 molekulasida \u003d 159 kJ / mol, N 2 molekulasida \u003d 940 kJ / mol.
Ikki atomli emas, balki AB tipidagi ko'p atomli molekulalar uchun n - o'rtacha bog'lanish energiyasi
AB n \u003d A + nB tufayli.
Masalan, jarayonda so'rilgan energiya
924 kJ/mol ga teng.
Bog'lanish energiyasi
E OH = = = = 462 kJ/mol.
Molekulalarning tuzilishi va moddaning tuzilishi haqida xulosa turli usullar bilan olingan natijalarga ko'ra amalga oshiriladi. Bunday holda, olingan ma'lumotlar nafaqat bog'larning uzunligi va energiyalari, bog'lanish burchaklari, balki moddaning boshqa xususiyatlari, masalan, magnit, optik, elektr, issiqlik va boshqalar haqida ham qo'llaniladi.
Moddaning tuzilishiga oid eksperimental ravishda olingan ma'lumotlar to'plami kimyoviy bog'lanishning kvant-mexanik nazariyasi kontseptsiyasidan foydalanadigan kvant-kimyoviy hisoblash usullari natijalarini to'ldiradi va umumlashtiradi. Kimyoviy bog'lanish asosan valent elektronlar tomonidan amalga oshiriladi, deb ishoniladi. s- va p-elementlar uchun valentlik elektronlari tashqi qatlamning orbitallari, d-elementlar uchun esa tashqi qatlamning s-orbitali va oldingi tashqi qavatning d-orbitali elektronlari hisoblanadi.
Kimyoviy bog'lanishning tabiati.
Kimyoviy bog'lanish faqat atomlar bir-biriga yaqinlashganda hosil bo'ladi umumiy energiya tizimi (E kin. + E pot.) kamayadi.
Molekulyar vodorod ioni H 2 + misolidan foydalanib, kimyoviy bog'lanishning tabiatini ko'rib chiqing. (U H 2 vodorod molekulalarini elektronlar bilan nurlantirish orqali olinadi; gaz razryadda). Bunday oddiy molekulyar tizim uchun Shredinger tenglamasi eng aniq echiladi.
Vodorod ionida H 2 + bitta elektron ikkita yadro - proton maydonida harakat qiladi. Yadrolar orasidagi masofa 0,106 nm, bog'lanish energiyasi (H atomlari va H + ionlariga ajralish) 255,7 kJ/mol. Ya'ni, zarracha kuchli.
DA molekulyar ion H 2 + ikki turdagi elektrostatik kuchlar ta'sir qiladi - elektronni ikkala yadroga tortish kuchlari va yadrolar orasidagi itarilish kuchlari. Itirish kuchi musbat zaryadlangan H A + va H A + yadrolari o'rtasida namoyon bo'ladi, uni quyidagi rasmda ko'rsatish mumkin. 3. Qaytaruvchi kuch yadrolarni bir-biridan ajratishga intiladi.

Guruch. 3. Ikki yadro orasidagi (a) va tortishish (b) kuchi, ular bir-biriga atomlar kattaligi tartibidagi masofalarda yaqinlashganda paydo bo'ladi.
Jozibador kuchlar manfiy zaryadlangan elektron e - va musbat zaryadlangan H + va H + yadrolari o'rtasida harakat qiladi. Agar tortishish va qaytarilish kuchlarining natijasi nolga teng bo'lsa, molekula hosil bo'ladi, ya'ni yadrolarning o'zaro itarilishi elektronning yadrolarga tortilishi bilan qoplanishi kerak. Bunday kompensatsiya elektronning joylashishiga bog'liq e - yadrolarga nisbatan (3-rasm b va c). Bu erda biz elektronning fazodagi o'rnini emas (aniqlab bo'lmaydi), balki fazoda elektronni topish ehtimolini nazarda tutamiz. Kosmosdagi elektron zichligining joylashuvi, rasmga mos keladi. 3.b) yadrolarning yaqinlashishiga hissa qo'shadi va tegishli shakl. 3.c) - yadrolarning itarilishi, chunki bu holda tortishish kuchlari bir yo'nalishga yo'naltiriladi va yadrolarning itarilishi kompensatsiya qilinmaydi. Shunday qilib, elektron zichligi yadrolar o'rtasida taqsimlanganda va elektron zichligi yadrolar orqasida taqsimlanganda bo'shashmaslik yoki bog'lanishga qarshi hudud mavjud bo'lganda bog'lanish hududi mavjud.
Agar elektron bog'lanish hududiga kirsa, u holda kimyoviy bog'lanish hosil bo'ladi. Agar elektron bo'shashadigan hududga kirsa, u holda kimyoviy bog'lanish hosil bo'lmaydi.
Bog'lanish hududida elektron zichligi taqsimotining tabiatiga qarab, kimyoviy bog'lanishning uchta asosiy turi mavjud: kovalent, ion va metall. Bu bog'lanishlar sof shaklda bo'lmaydi va odatda bu turdagi bog'lanishlarning kombinatsiyasi birikmalarda mavjud.
Bog'lanish turlari.
Kimyoda bog'lanishning quyidagi turlari ajratiladi: kovalent, ion, metall, vodorod bog'lari, van-der-vaals bog'lari, donor-akseptor bog'lari va dativ bog'lar.
kovalent bog'lanish
Kovalent bog'lanish hosil bo'lganda, atomlar bir-biri bilan elektronlarni almashadilar. Kovalent bog'lanishga misol Cl 2 molekulasidagi kimyoviy bog'lanishdir. Lyuis (1916) birinchi marta bunday bog'lanishda ikkita xlor atomining har biri o'zining tashqi elektronlaridan birini boshqa xlor atomi bilan bo'lishishini taklif qildi. Bir-biriga yopishish uchun atom orbitallari ikki atom imkon qadar bir-biriga yaqin kelishi kerak. Umumiy juft elektron kovalent bog'lanish hosil qiladi. Bu elektronlar bir xil orbitalni egallaydi va ularning spinlari qarama-qarshi yo'nalishda yo'naltiriladi.
Shunday qilib, kovalent bog'lanish qarama-qarshi spinli elektronlarning juftlashishi natijasida turli atomlardan elektronlarning ijtimoiylashuvi orqali amalga oshiriladi.
Kovalent bog'lanish keng qo'llaniladigan bog'lanish turidir. Kovalent bog'lanish nafaqat molekulalarda, balki kristallarda ham paydo bo'lishi mumkin. U bir xil atomlar (H 2, Cl 2, olmos molekulalarida) va turli atomlar o'rtasida (H 2 O, NH 3 ... da) sodir bo'ladi.
Kovalent bog'lanishning paydo bo'lish mexanizmi
Keling, H 2 molekulasining hosil bo'lishi misolida mexanizmni ko'rib chiqaylik.
H + H \u003d H 2, ∆H \u003d -436 kJ / mol
Erkin vodorod atomining yadrosi 1s elektrondan hosil bo'lgan sferik simmetrik elektron buluti bilan o'ralgan. Atomlar bir-biriga ma'lum masofagacha yaqinlashganda, ularning elektron bulutlari (orbitallari) qisman bir-biriga yopishadi (4-rasm).
Guruch. 4. Vodorod molekulasida bog`lanishning hosil bo`lish mexanizmi.
Agar teginishdan oldin yaqinlashayotgan vodorod atomlarining yadrolari orasidagi masofa 0,106 nm bo'lsa, elektron bulutlar bir-birining ustiga chiqqandan keyin bu masofa 0,074 nm ni tashkil qiladi.
Natijada, yadrolar markazlari o'rtasida molekulyar ikki elektronli bulut paydo bo'lib, yadrolar orasidagi bo'shliqda maksimal elektron zichlikka ega. Zichlikning oshishi manfiy zaryad yadrolar orasidagi tortishish kuchlarining kuchli o'sishini ma'qullaydi, bu esa energiyaning chiqishiga olib keladi. Kimyoviy bog'lanish qanchalik kuchli bo'lsa, elektron orbitallarning bir-birining ustiga chiqishi shunchalik katta bo'ladi. Ikki vodorod atomi o'rtasida kimyoviy bog'lanishning paydo bo'lishi natijasida ularning har biri asil gaz atomining elektron konfiguratsiyasiga - geliyga etadi.
Kvant-mexanik nuqtai nazardan mos ravishda elektron bulutlarning bir-biriga yopishgan hududining hosil bo'lishini va kovalent bog'lanishning hosil bo'lishini tushuntiruvchi ikkita usul mavjud. Ulardan biri BC (valent bog'lanishlar) usuli, ikkinchisi MO (molekulyar orbitallar) deb ataladi.
Valentlik bog'lanish usulida tanlangan juft atomlarning atom orbitallarining ustma-ust tushishi ko'rib chiqiladi. MO usulida molekula bir butun sifatida qaraladi va elektron zichligi taqsimoti (bir elektrondan) butun molekulaga tarqaladi. H 2 dagi MO 2H holatidan yadrolarning ushbu yadrolar orasida joylashgan elektron bulutiga tortilishi tufayli bog'lanadi.
Kovalent bog'lanishning tasviri
Havolalar turli yo'llar bilan tasvirlangan:
biri). Elektronlarni nuqta sifatida ishlatish
Bunday holda, vodorod molekulasining hosil bo'lishi diagrammada ko'rsatilgan
H∙ + H∙ → H: H
2). Kvadrat hujayralar (orbitallar) yordamida, bir molekulada qarama-qarshi spinli ikkita elektronni joylashtirish kabi kvant hujayrasi

Ushbu sxema molekulyar energiya darajasining dastlabki atom darajalaridan past ekanligini ko'rsatadi, ya'ni moddaning molekulyar holati atom holatiga qaraganda barqarorroqdir.
3). Kovalent bog'lanish chiziq bilan ifodalanadi
Masalan, N - N. bu xususiyat elektron juftligini ramziy qiladi.
Agar atomlar (bitta umumiy elektron jufti) o'rtasida bitta kovalent bog'lanish paydo bo'lsa, u deyiladi yagona, agar ko'p bo'lsa, u holda ko'p ikki barobar(ikki umumiy elektron juft), uchlik(uchta umumiy elektron juftlik). Bitta bog'lanish bir chiziq bilan, qo'sh bog'lanish ikki bilan va uchlik bog'lanish uchta bilan ifodalanadi.
Atomlar orasidagi chiziq ularning umumiy elektron juftligiga ega ekanligini ko'rsatadi.
Kovalent bog'lanishlarning tasnifi
Elektron bulutlarning ustma-ust tushish yo‘nalishiga qarab s-, p-, d-bog‘lar farqlanadi. s-bog' elektron bulutlari o'zaro ta'sir qiluvchi atomlarning yadrolarini bog'laydigan o'q bo'ylab bir-birining ustiga tushganda paydo bo'ladi.
s-bog'larga misollar:

Guruch. 5. s-, p-, d- elektronlar o'rtasida s-bog' hosil bo'lishi.
Vodorod molekulasida s-s bulutlari bir-birining ustiga tushganda s-bog'ning hosil bo'lishiga misol.
p-bog'lanish o'qning har ikki tomonida bir-birining ustiga chiqadigan elektron bulutlarni atomlarning yadrolarini bog'lash orqali amalga oshiriladi.

Guruch. 6. p-, d- elektronlar o'rtasida p-bog' hosil bo'lishi.
d-bog'lanish parallel tekisliklarda joylashgan ikkita d-elektron bulutlari bir-birining ustiga chiqqanda yuzaga keladi. d bog'lanish p bog'dan, p bog' esa s bog'dan kuchliroqdir.
Kovalent bog'lanishning xossalari
a). Polarlik.
Kovalent bog'lanishning ikki turi mavjud: qutbsiz va qutbli.
Qutbsiz kovalent bog lanishda umumiy juft elektronlar hosil qilgan elektron buluti fazoda atomlar yadrolariga nisbatan simmetrik tarzda taqsimlanadi. Misol tariqasida bitta elementning atomlaridan tashkil topgan diatomik molekulalarni keltirish mumkin: H 2 , Cl 2 , O 2 , N 2 , F 2 . Ularning elektron juftligi har ikkala atomga teng darajada tegishli.
Qutbli bog lanish holatida bog ni tashkil etuvchi elektron bulut nisbiy elektronegativligi yuqori bo lgan atom tomon siljiydi.
Misollar molekulalar: HCl, H 2 O, H 2 S, N 2 S, NH 3 va boshqalar HCl molekulasining hosil bo'lishini ko'rib chiqing, uni quyidagi sxema bilan ifodalash mumkin.
![]()
Elektron jufti xlor atomiga siljiydi, chunki xlor atomining nisbiy elektr manfiyligi (2.83) vodorod atominikidan (2.1) katta.
b). To'yinganlik.
Atomlarning cheklangan miqdordagi kovalent bog'lanish hosil bo'lishida ishtirok etish qobiliyati kovalent bog'lanishning to'yinganligi deyiladi. Kovalent bog'larning to'yinganligi kimyoviy o'zaro ta'sirda faqat tashqi elektronlar ishtirok etishi bilan bog'liq. energiya darajalari, ya'ni cheklangan miqdordagi elektronlar.
ichida) . Orientatsiya va kovalent bog'lanishning gibridlanishi.
Kovalent bog'lanish kosmosda orientatsiya bilan tavsiflanadi. Bu elektron bulutlarning ma'lum bir shaklga ega bo'lishi va ularning maksimal bir-biriga mos kelishi ma'lum bir fazoviy yo'nalish bilan mumkinligi bilan izohlanadi.
Kovalent bog'lanish yo'nalishi molekulalarning geometrik tuzilishini belgilaydi.
Masalan, suv uchun u uchburchak shaklga ega.
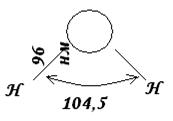
Guruch. 7. Suv molekulasining fazoviy tuzilishi.
H 2 O suv molekulasida vodorod va kislorod yadrolari orasidagi masofa 0,096 nm (96 pm) ekanligi eksperimental ravishda aniqlangan. Yadrolardan o'tuvchi chiziqlar orasidagi burchak 104,5 0 ga teng. Shunday qilib, suv molekulasi burchak shakliga ega va uning tuzilishi taqdim etilgan rasm shaklida ifodalanishi mumkin.
Gibridlanish
Eksperimental sifatida va nazariy tadqiqotlar(Slater, Pauling) BeCl 2 , BeF 2 , BeBr 2 kabi baʼzi birikmalar hosil boʻlishida molekuladagi atomning valentlik elektronlarining holati sof s-, p-, d- toʻlqin funksiyalari bilan tavsiflanmaydi. , lekin ularning chiziqli birikmalari bilan. Bunday aralash tuzilmalar gibrid orbitallar, aralashtirish jarayoni esa gibridlanish deb ataladi.
Kvant-kimyoviy hisob-kitoblar shuni ko'rsatadiki, atomning s- va p-orbitallarini aralashtirish molekula hosil bo'lishi uchun qulay jarayondir. Bunda sof s- va p-orbitallarni oʻz ichiga olgan bogʻlanish hosil boʻlishiga qaraganda koʻproq energiya ajralib chiqadi. Shuning uchun atomning elektron orbitallarining gibridlanishi tizim energiyasining katta pasayishiga va shunga mos ravishda molekula barqarorligining oshishiga olib keladi. Gibridlangan orbital yadroning bir tomonida boshqa tomoniga qaraganda ko'proq cho'zilgan. Demak, gibrid bulutning bir-birining ustiga chiquvchi mintaqasidagi elektron zichligi s- va p-orbitallarning alohida-alohida bir-birining ustiga chiquvchi mintaqasidagi elektron zichligidan kattaroq bo‘ladi, buning natijasida gibrid orbital elektronlari hosil qilgan bog‘lanish hosil bo‘ladi. kuchliroqligi bilan ajralib turadi.
Gibrid davlatlarning bir necha turlari mavjud. S- va p-orbitallar gibridlashganda (sp gibridlanish deb ataladi) bir-biriga nisbatan 180 0 burchak ostida joylashgan ikkita gibrid orbital paydo bo'ladi. Bunday holda chiziqli struktura hosil bo'ladi. Ushbu konfiguratsiya (tuzilish) ko'pchilik gidroksidi tuproqli metall galogenidlar uchun ma'lum (masalan, BeX 2 bu erda X=Cl, F, Br), ya'ni. ulanish burchagi 180 0 S.

Guruch. 8. sp gibridlanishi
Gibridlanishning yana bir turi sp 2 gibridlanish (bir s va ikkita p orbitaldan hosil bo'ladi) bir-biriga 120 0 burchak ostida joylashgan uchta gibrid orbital hosil bo'lishiga olib keladi. Bunda fazoda molekulaning (yoki muntazam uchburchakning) trigonal tuzilishi hosil bo'ladi. Bunday tuzilmalar BX 3 (X=Cl, F, Br) birikmalari uchun ma'lum.



Guruch. 9. sp 2 gibridlanishi.
Bir s va uchta p orbitaldan hosil bo'lgan sp 3 gibridizatsiyasi kamroq tarqalgan. Bunda fazoda tetraedrning toʻrtta choʻqqisiga simmetrik yoʻnaltirilgan toʻrtta gibrid orbital hosil boʻladi, yaʼni ular 109 0 28” burchak ostida joylashadi. Bunday fazoviy holat tetraedr deyiladi. Bunday tuzilish maʼlum NH 3, H 2 O molekulalari va umuman II davr elementlari uchun uning fazodagi ko'rinishini sxematik tarzda quyidagi rasmda ko'rsatish mumkin.

Guruch. 10. Ammiak molekulasidagi bog’larning fazoda joylashishi,
samolyotga proyeksiyalangan.
sp 3 gibridlanishi natijasida tetraedral bog'larning hosil bo'lishini quyidagicha ifodalash mumkin (11-rasm):
Guruch. 11. sp 3 gibridlanish jarayonida tetraedral bog'larning hosil bo'lishi.
sp 3 gibridizatsiyasi paytida tetraedral bog'lanishlarning hosil bo'lishi shaklda ko'rsatilgan. 12.

12-rasm. sp 3 - CCl 4 molekulalariga gibridlanish jarayonida tetraedral bog'larning hosil bo'lishi.
Gibridlanish nafaqat s- va p-orbitallarga tegishli. III va keyingi davrlarning stereokimyoviy elementlarini tushuntirish uchun bir vaqtning o'zida gibrid orbitallarni, shu jumladan s-, p-, d-orbitallarni qurish kerak bo'ladi.
Kovalent bog'lanishga ega bo'lgan moddalarga quyidagilar kiradi:
1. organik birikmalar;
2. qattiq va suyuq moddalar, bunda galogen atomlari juftlari o'rtasida, shuningdek, vodorod, azot va kislorod atomlari juftlari o'rtasida, masalan, H 2 hosil bo'ladi;
3. VI guruh elementlari (masalan, tellurning spiral zanjirlari), V guruh elementlari (masalan, mishyak), IV guruh elementlari (olmos, kremniy, germaniy);
4. 8-N qoidasiga bo‘ysunuvchi birikmalar (InSb, CdS, GaAs, CdTe kabi), ularni hosil qiluvchi elementlar Mendeleyev davriy sistemasida II-VI, III-V guruhlarda joylashganda.
DA qattiq moddalar kovalent bog'lanish bilan bir xil modda uchun turli xil kristall tuzilmalar hosil bo'lishi mumkin, ularning bog'lanish energiyasi deyarli bir xil. Masalan, ZnS tuzilishi kubik (rux aralashmasi) yoki olti burchakli (vurtsit) bo'lishi mumkin. Rux aralashmasi va vurtsitdagi eng yaqin qo'shnilarning joylashishi bir xil va bu ikki tuzilmaning energiyalaridagi yagona va ozgina farq atomlarning eng yaqinlaridan keyin joylashishi bilan belgilanadi. Ayrim moddalarning bunday qobiliyati allotropiya yoki polimorfizm deb ataladi. Allotropiyaning yana bir misoli silikon karbid bo'lib, unda sof kubdan olti burchakligacha turli xil tuzilmalarning bir qator polititlari mavjud. ZnS, SiC ning ko'plab kristalli modifikatsiyalari xona haroratida mavjud.
Ion aloqasi
Ion bog'lanish - qarama-qarshi zaryadli (ya'ni + va -) ionlar orasidagi elektrostatik tortishish kuchi.
Ion bog'lanish g'oyasi V. Kossel g'oyalari asosida shakllangan. U (1916) ikkita atom o'zaro ta'sirlashganda ulardan biri voz kechib, ikkinchisi elektronlarni qabul qilishni taklif qildi. Shunday qilib, bir yoki bir nechta elektronning bir atomdan ikkinchisiga o'tishi natijasida ion bog'lanish hosil bo'ladi. Masalan, natriy xloridda elektronning natriy atomidan xlor atomiga o'tishi natijasida ion bog'lanish hosil bo'ladi. Ushbu ko'chirish natijasida zaryadi +1 bo'lgan natriy ioni va zaryadi -1 bo'lgan xlor ioni hosil bo'ladi. Ular elektrostatik kuchlar bilan bir-biriga tortilib, barqaror molekula hosil qiladi. Kossel tomonidan taklif qilingan elektron uzatish modeli litiy ftorid, kaltsiy oksidi va litiy oksidi kabi birikmalarning hosil bo'lishini tushuntirishga imkon beradi.
Eng tipik ionli birikmalar davriy sistemaning I va II guruhlariga mansub metall kationlari va VI va VII guruhlarga kiruvchi nometall elementlarning anionlaridan iborat.
Ion birikmalarining hosil bo`lish qulayligi uning tarkibidagi kationlar va anionlarning hosil bo`lish qulayligiga bog`liq. Shakllanish qulayligi qanchalik yuqori bo'lsa, ionlanish energiyasi shunchalik kam bo'lsa, elektronlarni beruvchi atom (elektron donor) va elektronlarni qabul qiluvchi atom (elektron qabul qiluvchi) elektronga ko'proq yaqinlikka ega. elektronga yaqinlik atomning elektronni qabul qilish qobiliyatining o'lchovidir. Miqdoriy jihatdan bir mol atomlardan bir mol yakka zaryadlangan anionlar hosil bo'lganda sodir bo'ladigan energiyaning o'zgarishi sifatida aniqlanadi. Bu "birinchi elektron yaqinlik" tushunchasi. Ikkinchi elektron yaqinlik - bu bir mol bir zaryadlangan anionlardan bir mol ikki marta zaryadlangan anion hosil bo'lganda sodir bo'ladigan energiyaning o'zgarishi. Bu tushunchalar, ya'ni ionlanish energiyasi va elektronga yaqinlik gazsimon moddalarga tegishli bo'lib, ulardagi atom va ionlarning xarakteristikasi hisoblanadi. gazsimon holat. Ammo shuni yodda tutish kerakki, aksariyat ionli birikmalar qattiq holatda eng barqarordir. Bu holat ularning qattiq holatida kristall panjara mavjudligi bilan izohlanadi. degan savol tug'iladi. Nima uchun ionli birikmalar gazsimon holatda emas, balki kristall panjaralar shaklida barqarorroq? Bu savolga javob elektrostatik modelga asoslangan kristall panjaraning energiyasini hisoblashdir. Bunga qo'shimcha ravishda, bu hisob ion bog'lanish nazariyasining sinovidir.
Kristal panjaraning energiyasini hisoblash uchun gazsimon ionlarning hosil bo'lishi bilan kristall panjarani yo'q qilish uchun sarflanishi kerak bo'lgan ishni aniqlash kerak. Hisoblash uchun tortishish va itarish kuchlari tushunchasidan foydalaniladi. Yakka zaryadlangan ionlarning o'zaro ta'sir qilish potentsial energiyasining ifodasi tortishish energiyasi va itarilish energiyasini yig'ish orqali olinadi.
E \u003d E inc + E chiqish (1).
E prit sifatida qarama-qarshi belgilardagi ionlarning kulon tortishish energiyasi olinadi, masalan, NaCl birikmasi uchun Na + va Cl -
E int \u003d -e 2 / 4πe 0 r (2),
chunki to'ldirilgan elektron qobiqdagi elektron zaryadning taqsimlanishi sferik simmetrikdir. Anion va kationning to'ldirilgan qobiqlari bir-biriga yopishganda Pauli printsipi tufayli yuzaga keladigan itarilish tufayli ionlar yaqinlasha oladigan masofa cheklangan. Itirish energiyasi yadrolararo masofa bilan tez o'zgaradi va quyidagi ikkita taxminiy ifoda sifatida yozilishi mumkin:
E otm \u003d A / r n (n≈12) (3)
E otm \u003d B ∙ exp (-r / r) (4),
bu yerda A va B konstantalar, r ionlar orasidagi masofa, r parametr (xarakterli uzunlik).
Shuni ta'kidlash kerakki, bu ifodalarning hech biri itarishga olib keladigan murakkab kvant mexanik jarayonga mos kelmaydi.
Ushbu formulalarning yaqinlashishiga qaramay, ular NaCl, KCl, CaO kabi ionli birikmalarning molekulalarida kimyoviy bog'lanishni aniq hisoblash va shunga mos ravishda tavsiflash imkonini beradi.
Ionning elektr maydoni sferik simmetriyaga ega bo'lganligi sababli (13-rasm), ion bog'lanish kovalent bog'lanishdan farqli o'laroq, yo'nalishga ega emas. Ikki qarama-qarshi zaryadlangan ionlarning o'zaro ta'siri faqat ionlar yadrolarining markazlarini bog'laydigan yo'nalishdagi itaruvchi kuchlar bilan qoplanadi, boshqa yo'nalishlarda esa ionlarning elektr maydonlari kompensatsiyalanmaydi. Shuning uchun ular boshqa ionlar bilan ta'sir o'tkazishga qodir. Shunday qilib, ionli bog'lanish to'yinganlikka ega emas.
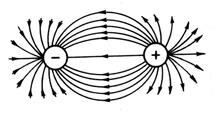
Guruch. 13. Sferik simmetriya elektrostatik maydon
qarama-qarshi zaryadlangan to'lovlar.
Ion bog'lanishning yo'nalishi bo'lmaganligi va to'yinmaganligi tufayli har bir ion bilan o'ralgan bo'lsa, u energiya jihatidan eng qulaydir. maksimal raqam qarama-qarshi belgili ionlar. Shu sababli, ionli birikma mavjudligining eng maqbul shakli kristalldir. Misol uchun, NaCl kristalida har bir kation eng yaqin qo'shni sifatida oltita anionga ega.
Faqat qachon yuqori haroratlar gazsimon holatda ionli birikmalar bog'lanmagan molekulalar shaklida mavjud.
Ion birikmalarida koordinatsion raqam kovalent birikmalardagi kabi atomlarning elektron tuzilishining o'ziga xos xususiyatlariga bog'liq emas, balki ionlarning o'lchamlari nisbati bilan belgilanadi. Ion radiuslarining nisbati 0,41 - 0,73 oralig'ida ionlarning oktaedral koordinatsiyasi kuzatiladi, 0,73-1,37 nisbatda - kubik koordinatsiyasi va boshqalar.
Shunday qilib, normal sharoitda ionli birikmalar kristalli moddalardir. Ikki ionli molekulalar, masalan, NaCL, CsCl tushunchasi ularga taalluqli emas. Har bir kristall ko'p sonli ionlardan tashkil topgan.
Ion bog'lanishni cheklovchi qutbli bog'lanish sifatida ko'rsatish mumkin, buning uchun atomning samarali zaryadi birlikka yaqin. Sof kovalent qutbsiz aloqa uchun atomlarning samarali zaryadi nolga teng. Haqiqiy moddalarda sof ionli va sof kovalent aloqalar kam uchraydi. Ko'pgina birikmalar qutbsiz kovalent va qutbli ion o'rtasidagi bog'lanishning oraliq xususiyatiga ega. Ya'ni, bu birikmalarda kovalent bog'lanish qisman ionli xususiyatga ega. Haqiqiy moddalardagi ion va kovalent bog'lanishlarning tabiati 14-rasmda ko'rsatilgan.

Guruch. 14. Bog'lanishning ion va kovalent tabiati.
Bog'lanishning ionlik tabiatining nisbati ionlik darajasi deb ataladi. U molekuladagi atomlarning samarali zaryadlari bilan tavsiflanadi. Ionlik darajasi uning tarkibidagi atomlarning elektr manfiyligidagi farqning oshishi bilan ortadi.
metall aloqa
Metall atomlarida tashqi valentlik elektronlari metall bo'lmagan atomlarga qaraganda ancha zaifroq bo'ladi. Bu etarlicha uzoq vaqt davomida elektronlarning alohida atomlar bilan aloqasini yo'qotadi va ularning ijtimoiylashuviga olib keladi. Tashqi elektronlarning ijtimoiylashgan ansambli shakllanadi. Bunday elektron tizimning mavjudligi, xuddi shunday zaryadga qaramay, ijobiy metall ionlarini yaqin holatda ushlab turadigan kuchlarning paydo bo'lishiga olib keladi. Bunday bog'lanish metall bog'lanish deb ataladi. Bunday bog'lanish faqat metallga xos bo'lib, qattiq va holda mavjud suyuqlik holati moddalar. Metall aloqa kimyoviy bog'lanishning bir turidir. U tashqi elektronlarning sotsializatsiyasiga asoslanadi, ular atom bilan aloqasini yo'qotadi va shuning uchun erkin elektronlar deb ataladi (15-rasm).
Guruch. 15. Metall aloqa.
Quyidagi faktlar metall aloqaning mavjudligini tasdiqlaydi. Barcha metallar yuqori issiqlik o'tkazuvchanligiga va yuqori elektr o'tkazuvchanligiga ega, bu erkin elektronlar mavjudligi bilan ta'minlanadi. Bundan tashqari, xuddi shu holat metallarning yorug'lik nurlanishini yaxshi aks ettirish qobiliyatini, ularning yorqinligi va shaffofligini, yuqori plastikligini va elektr qarshiligining ijobiy harorat koeffitsientini belgilaydi.
Metalllarning kristall panjarasining barqarorligini ion va kovalent kabi bog'lanish turlari bilan izohlab bo'lmaydi. Kristal panjaraning tugunlarida joylashgan metall atomlari orasidagi ionli bog'lanish mumkin emas, chunki ular bir xil zaryadga ega. Metall atomlari orasidagi kovalent bog'lanish ham dargumon, chunki har bir atomning 8 dan 12 tagacha eng yaqin qo'shnilari bor va shunchalik ko'p umumiy elektron juftlari bilan kovalent bog'lanishlar hosil bo'lishi noma'lum.
Metall konstruktsiyalar atomlarning juda kam joylashishi (yadrolararo masofalar katta) va katta raqam kristall panjaradagi har bir atomning eng yaqin qo'shnilari. 1-jadvalda uchta tipik metall konstruktsiyalar keltirilgan.
1-jadval
Eng keng tarqalgan uchta metallning strukturalarining xususiyatlari
Ko'ramizki, har bir atom ko'p sonli bog'lar hosil bo'lishida ishtirok etadi (masalan, 8 ta atom bilan). Bunday ko'p miqdordagi bog'lanishlarni (8 yoki 12 atomli) bir vaqtning o'zida kosmosda lokalizatsiya qilish mumkin emas. Aloqa rezonans tufayli amalga oshirilishi kerak tebranish harakati har bir atomning tashqi elektronlari, bu elektron gaz hosil bo'lishi bilan kristalning barcha tashqi elektronlarini kollektivlashtirishga olib keladi. Ko'pgina metallarda metall aloqa hosil qilish uchun har bir atomdan bitta elektron olish kifoya qiladi. Aynan shu narsa tashqi qobiqda faqat bitta elektronga ega bo'lgan lityum uchun kuzatiladi. Litiy kristalli - elektron gaz bilan o'ralgan Li + ionlarining panjarasi (radiusi 0,068 nm bo'lgan sharlar).

Guruch. 16. Har xil turdagi kristalli qadoqlash: a-olti burchakli yaqin qadoqlash; b - yuzga markazlashtirilgan kubik qadoqlash; B-kubik qadoqlash.
Metall va kovalent aloqalar o'rtasida o'xshashliklar mavjud. Bu ikkala turdagi bog'lanishlar valent elektronlarning sotsializatsiyasiga asoslanganligidadir. Biroq, kovalent bog'lanish faqat ikkita qo'shni atomni bog'laydi va umumiy elektronlar bog'langan atomlarga yaqin joylashgan. Metall bog'lanishda bir nechta atomlar valentlik elektronlarini sotsializatsiya qilishda ishtirok etadi.
Shunday qilib, metall bog'lanish tushunchasi elektron gaz bilan to'ldirilgan ionlar orasidagi katta bo'shliqlarga ega bo'lgan musbat zaryadlangan ion yadrolari to'plami sifatida metallar g'oyasi bilan uzviy bog'liq bo'lib, makroskopik darajada tizim elektr neytralligicha qoladi.
Yuqorida ko'rib chiqilgan kimyoviy bog'lanish turlaridan tashqari, molekulalararo bog'lanishning boshqa turlari mavjud: vodorod aloqasi, van der Vaals o'zaro ta'siri, donor-akseptor o'zaro ta'siri.
Molekulalarning donor-akseptor o'zaro ta'siri
Bir atomning ikki elektronli buluti va boshqa atomning erkin orbitali tufayli kovalent bog'lanishning hosil bo'lish mexanizmi donor-akseptor deb ataladi. Aloqa uchun ikki elektronli bulutni ta'minlovchi atom yoki zarracha donor deb ataladi. Bu elektron juftini qabul qiladigan erkin orbitalga ega bo'lgan atom yoki zarrachalar qabul qiluvchi deyiladi.
Molekulyar o'zaro ta'sirning asosiy turlari. vodorod aloqasi
Molekulalar o'rtasida valentlik bilan to'yingan, zarrachalar hajmidan oshib ketadigan masofalarda molekulalararo tortishishning elektrostatik kuchlari paydo bo'lishi mumkin. Ular van der Vaals kuchlari deb ataladi. Van der Waals o'zaro ta'siri har doim bir-biriga yaqin joylashgan atomlar o'rtasida mavjud, ammo kuchliroq bog'lanish mexanizmlari yo'qligida muhim rol o'ynaydi. 0,2 eV/atom xarakterli energiyaga ega bo'lgan bu zaif o'zaro ta'sir neytral atomlar va molekulalar o'rtasida sodir bo'ladi. O'zaro ta'sirning nomi van der Vaals nomi bilan bog'liq, chunki u birinchi bo'lib gaz molekulalari orasidagi zaif o'zaro ta'sirni hisobga olgan holda holat tenglamasi haqiqiy gazlarning xossalarini tenglamadan ko'ra yaxshiroq tavsiflaydi, deb taklif qilgan. davlat ideal gaz. Biroq, bu jozibador kuchning tabiati faqat 1930 yilda London tomonidan tushuntirilgan. Hozirgi vaqtda Van der Vaals attraktsioniga quyidagi uch turdagi o'zaro ta'sirlar kiradi: orientatsion, induksiya, dispersiya (London effekti). Van der Vaalsning tortishish energiyasi orientatsiya, induksiya va dispersiya o'zaro ta'sirlari yig'indisi bilan aniqlanadi.
E int = E op + E ind + E disp (5).
Yo'naltirilgan o'zaro ta'sir (yoki dipol-dipol o'zaro ta'siri) qutbli molekulalar o'rtasida namoyon bo'ladi, ular yaqinlashganda, qarama-qarshi qutblar bilan bir-biriga buriladi (yo'naltiriladi). potentsial energiya molekulalar tizimi minimal bo'ldi. Orientatsion o'zaro ta'sirning energiyasi qanchalik muhim bo'lsa, molekulalarning dipol momenti m qanchalik katta bo'lsa va ular orasidagi masofa l shunchalik kichik bo'ladi:
E op \u003d - (m 1 m 2) 2 / (8p 2 ∙e 0 ∙l 6) (6),
bu yerda e 0 - elektr doimiysi.
Induktiv o'zaro ta'sir molekulalarning atrofdagi dipollar tomonidan qutblanish jarayonlari bilan bog'liq. Bu qanchalik muhim bo'lsa, qutbsiz molekulaning a qutblanish qobiliyati shunchalik yuqori va qutbli molekulaning m dipol momenti shunchalik katta bo'ladi.
E ind \u003d - (am 2) / (8p 2 ∙e 0 ∙l 6) (7).
Qutbsiz molekulaning a qutblanishi deformatsiya qutblanishi deyiladi, chunki u zarrachaning deformatsiyasi bilan bog'liq bo'lsa, m elektron buluti va yadrolarning oldingi holatiga nisbatan siljishini tavsiflaydi.
Dispersion o'zaro ta'sir (London effekti) tuzilishi va qutbliligidan qat'i nazar, har qanday molekulalarda sodir bo'ladi. Elektron buluti va yadrolari zaryadlarining og'irlik markazlarining bir lahzada mos kelmasligi tufayli, boshqa zarrachalarda lahzali dipollarni keltirib chiqaradigan lahzali dipol hosil bo'ladi. Bir lahzali dipollarning harakati muvofiqlashtirilgan bo'ladi. Natijada qo'shni zarralar o'zaro tortishishni boshdan kechiradilar. Dispersiyaning o'zaro ta'sir energiyasi ionlanish energiyasiga E I va molekulalarning a qutblanishiga bog'liq.
E disp \u003d - (E I 1 ∙ E I 2) ∙ a 1 a 2 / (E I 1 + E I 2) l 6 (8).
Vodorod bog'i valentlik va molekulalararo o'zaro ta'sirlar o'rtasida oraliq xususiyatga ega. Vodorod bog'lanish energiyasi past, 8-80 kJ/mol, lekin u van der Vaalsning o'zaro ta'sir qilish energiyasidan yuqori. Vodorod bilan bog'lanish suv, spirt, kislotalar kabi suyuqliklarga xos bo'lib, musbat qutblangan vodorod atomiga bog'liq. Kichik o'lcham va ichki elektronlarning yo'qligi har qanday birikmadagi suyuqlikda mavjud bo'lgan vodorod atomiga kovalent bog'liq bo'lmagan boshqa yoki bir xil molekulaning manfiy qutblangan atomi bilan qo'shimcha ta'sir o'tkazishga imkon beradi.
A d- - H d+ .... A d- - H d+.
Ya'ni molekulalarning assotsiatsiyasi mavjud. Molekulalarning birlashishi uchuvchanlikning pasayishiga, qaynash nuqtasi va bug'lanish issiqligining oshishiga, yopishqoqlikning oshishiga va o'tkazuvchanlik suyuqliklar.
Suv vodorod bog'larini hosil qilish uchun ayniqsa mos moddadir, chunki uning molekulasida ikkita vodorod atomi va kislorod atomida ikkita yolg'iz juft mavjud. Bu molekulaning yuqori dipol momentini (m D = 1,86 D) va to'rtta vodorod aloqasini hosil qilish qobiliyatini keltirib chiqaradi: ikkitasi proton donori va ikkitasi proton qabul qiluvchisi sifatida.
(H 2 O .... N - O ... H 2 O) 2 marta.
Tajribalardan ma'lumki, seriyadagi molekulyar og'irlikning o'zgarishi bilan vodorod birikmalari uchinchi va keyingi davrlarning elementlari, qaynoq nuqtasi ko'tariladi. Agar bu naqsh suvga qo'llanilsa, unda uning qaynash nuqtasi 100 0 C emas, balki 280 0 S bo'lishi kerak. Bu qarama-qarshilik suvda vodorod bog'ining mavjudligini tasdiqlaydi.
Tajribalar shuni ko'rsatdiki, molekulyar assotsiatsiyalar suyuqlikda va ayniqsa qattiq suvda hosil bo'ladi. Muz tetraedral kristall panjaraga ega. Tetraedrning markazida bitta suv molekulasining kislorod atomi, to'rtta uchida qo'shni molekulalarning kislorod atomlari joylashgan bo'lib, ular eng yaqin qo'shnilari bilan vodorod aloqalari bilan bog'langan. Suyuq suvda vodorod aloqalari qisman buziladi, uning tuzilishida molekulalar va erkin molekulalar o'rtasida dinamik muvozanat kuzatiladi.
Valentlik bog'lanish usuli
Valentlik bog'lanishlari yoki mahalliylashtirilgan elektron juftlik nazariyasi molekuladagi har bir atom juftligini bir yoki bir nechta umumiy elektron juftlari bilan birga ushlab turishini taxmin qiladi. Valentlik bog'lanishlar nazariyasining ifodalanishida kimyoviy bog'lanish ikki atom o'rtasida lokalizatsiya qilinadi, ya'ni u ikki markazli va ikki elektronli.
Valentlik bog'lanish usuli quyidagi asosiy qoidalarga asoslanadi:
Molekuladagi atomlarning har bir jufti bir yoki bir nechta umumiy elektron juftlari tomonidan birga tutiladi;
Yagona kovalent bogʻlanish bogʻlovchi atomlarning valentlik orbitallarida joylashgan antiparallel spinli ikkita elektrondan hosil boʻladi;
Bog'lanish hosil bo'lganda, elektronlarning to'lqin funktsiyalari bir-biriga mos keladi, bu atomlar orasidagi elektron zichligining oshishiga va kamayishiga olib keladi. umumiy energiya tizimlar;
Har bir atom ma'lum miqdordagi elektronga ega.
Kimyoviy reaktsiyalarga kirishgan atomlar elektronlarni beradi, oladi yoki ijtimoiylashtiradi va eng barqaror elektron konfiguratsiyaga erishadi. Eng past energiyaga ega konfiguratsiya eng barqaror hisoblanadi (asli gaz atomlarida bo'lgani kabi). Bu naqsh "okteta qoidasi" deb ataladi (1-rasm).
Guruch. bitta.
Bu qoida hamma uchun amal qiladi ulanish turlari. Atomlar orasidagi elektron aloqalar ularga eng oddiy kristallardan tortib, oxir-oqibat tirik tizimlarni tashkil etuvchi murakkab biomolekulalargacha barqaror tuzilmalarni shakllantirishga imkon beradi. Ular kristallardan uzluksiz metabolizmda farqlanadi. Biroq, ko'plab kimyoviy reaktsiyalar mexanizmlarga muvofiq davom etadi elektron transfer, bu organizmdagi energiya jarayonlarida muhim rol o'ynaydi.
Kimyoviy bog'lanish ikki yoki undan ortiq atomlar, ionlar, molekulalar yoki ularning har qanday birikmasini ushlab turadigan kuchdir..
Kimyoviy bog'lanishning tabiati universaldir: bu atomlarning tashqi qobig'idagi elektronlarning konfiguratsiyasi bilan belgilanadigan manfiy zaryadlangan elektronlar va musbat zaryadlangan yadrolar o'rtasidagi elektrostatik tortishish kuchi. Atomning kimyoviy aloqalar hosil qilish qobiliyati deyiladi valentlik, yoki oksidlanish darajasi. tushunchasi valent elektronlar- kimyoviy bog'larni hosil qiluvchi elektronlar, ya'ni eng yuqori energiyali orbitallarda joylashganlar. Shunga ko'ra, ushbu orbitallarni o'z ichiga olgan atomning tashqi qobig'i deyiladi valentlik qobig'i. Hozirgi vaqtda kimyoviy bog'lanish mavjudligini ko'rsatishning o'zi etarli emas, lekin uning turini aniqlashtirish kerak: ion, kovalent, dipol-dipol, metall.
Ulanishning birinchi turiionli ulanish
Lyuis va Kosselning elektron valentlik nazariyasiga ko'ra, atomlar barqaror elektron konfiguratsiyaga ikki yo'l bilan erishishi mumkin: birinchidan, elektronlarni yo'qotish orqali kationlar, ikkinchidan, ularni egallash, aylantirish anionlar. Elektron uzatish natijasida qarama-qarshi ishorali zaryadli ionlar orasidagi elektrostatik tortishish kuchi tufayli Kossel deb nomlangan kimyoviy bog'lanish hosil bo'ladi. elektrovalent(hozir chaqiriladi ionli).
Bunday holda, anionlar va kationlar to'ldirilgan tashqi elektron qobig'i bilan barqaror elektron konfiguratsiyani hosil qiladi. Odatda ionli bog'lanishlar davriy tizimning T va II guruhlari kationlaridan va VI va VII guruhlardagi metall bo'lmagan elementlarning anionlaridan (mos ravishda 16 va 17 kichik guruhlar) hosil bo'ladi. xalkogenlar va halogenlar). Ion birikmalaridagi bog'lanishlar to'yinmagan va yo'nalishsizdir, shuning uchun ular boshqa ionlar bilan elektrostatik o'zaro ta'sir qilish imkoniyatini saqlab qoladilar. Shaklda. 2 va 3 da Kossel elektron uzatish modeliga mos keladigan ionli bog'lanishlar misollari ko'rsatilgan.

Guruch. 2.

Guruch. 3. Natriy xlorid (NaCl) molekulasidagi ion aloqasi
Bu erda moddalarning tabiatdagi xatti-harakatlarini tushuntiruvchi ba'zi xususiyatlarni esga olish, xususan, kontseptsiyani ko'rib chiqish o'rinlidir. kislotalar va asoslar.
Bu moddalarning barchasining suvli eritmalari elektrolitlardir. Ular rangni turli yo'llar bilan o'zgartiradilar. ko'rsatkichlar. Ko'rsatkichlarning ta'sir qilish mexanizmini F.V. Ostvald. U indikatorlar zaif kislotalar yoki asoslar ekanligini ko'rsatdi, ularning dissotsilanmagan va dissotsilangan holatlarida rangi har xil.
Asoslar kislotalarni neytrallashi mumkin. Barcha asoslar suvda erimaydi (masalan, tarkibida -OH guruhlari bo'lmagan ba'zi organik birikmalar erimaydi, xususan, trietilamin N (C 2 H 5) 3); eruvchan asoslar deyiladi ishqorlar.
Kislotalarning suvli eritmalari xarakterli reaksiyalarga kiradi:
a) metall oksidlari bilan - tuz va suv hosil bo'lishi bilan;
b) metallar bilan - tuz va vodorod hosil bo'lishi bilan;
c) karbonatlar bilan - tuz hosil bo'lishi bilan, CO 2 va H 2 O.
Kislota va asoslarning xossalari bir qancha nazariyalar bilan tavsiflanadi. S.A. nazariyasiga muvofiq. Arrhenius, kislota - bu ionlarni hosil qilish uchun ajraladigan modda H+ , asos esa ionlarni hosil qiladi U- . Bu nazariya gidroksil guruhlarga ega bo'lmagan organik asoslarning mavjudligini hisobga olmaydi.
ga muvofiq proton Bronsted va Louri nazariyasiga ko'ra, kislota proton beruvchi molekulalar yoki ionlarni o'z ichiga olgan moddadir ( donorlar protonlar), asos esa protonlarni qabul qiluvchi molekulalar yoki ionlardan tashkil topgan moddadir ( qabul qiluvchilar protonlar). E'tibor bering, suvli eritmalarda vodorod ionlari gidratlangan shaklda, ya'ni gidroniy ionlari shaklida mavjud. H3O+ . Bu nazariya nafaqat suv va gidroksid ionlari bilan, balki erituvchisiz yoki suvsiz erituvchi bilan ham amalga oshiriladigan reaktsiyalarni tavsiflaydi.
Masalan, ammiak orasidagi reaksiyada NH 3 (zaif asos) va vodorod xlorid gaz fazasida qattiq ammoniy xlorid hosil bo'ladi va ikkita moddaning muvozanat aralashmasida doimo 4 ta zarracha mavjud bo'lib, ulardan ikkitasi kislotalar, qolgan ikkitasi esa asosdir:
Ushbu muvozanat aralashmasi ikkita konjuge juft kislota va asoslardan iborat:
1)NH 4+ va NH 3
2) HCl va Cl ‑
Bu erda har bir konjugatsiyalangan juftlikda kislota va asos bir proton bilan farq qiladi. Har bir kislota konjugat asosga ega. Kuchli kislota zaif konjugat asosga ega, kuchsiz kislota esa kuchli konjugat asosga ega.
Bronsted-Louri nazariyasi suvning biosfera hayotidagi beqiyos rolini tushuntirishga imkon beradi. Suv, u bilan o'zaro ta'sir qiluvchi moddaga qarab, kislota yoki asos xususiyatlarini ko'rsatishi mumkin. Masalan, sirka kislotaning suvli eritmalari bilan reaksiyalarda suv asos, ammiakning suvdagi eritmalari bilan esa kislota hisoblanadi.
1) CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 SOO- . Bu yerda sirka kislota molekulasi suv molekulasiga proton beradi;
2) NH3 + H 2 O ↔ NH4 + + U- . Bu erda ammiak molekulasi suv molekulasidan protonni qabul qiladi.
Shunday qilib, suv ikkita konjuge juft hosil qilishi mumkin:
1) H 2 O(kislota) va U- (konjugat asos)
2) H 3 O+ (kislota) va H 2 O(konjugat asos).
Birinchi holda, suv proton beradi, ikkinchisida esa uni qabul qiladi.
Bunday mulk deyiladi amfiprotonlik. Ham kislota, ham asos sifatida reaksiyaga kirisha oladigan moddalar deyiladi amfoter. Bunday moddalar ko'pincha tabiatda uchraydi. Masalan, aminokislotalar ham kislotalar, ham asoslar bilan tuzlar hosil qilishi mumkin. Shuning uchun peptidlar mavjud bo'lgan metall ionlari bilan osongina koordinatsion birikmalar hosil qiladi.
Shunday qilib, ionli bog'lanishning xarakterli xususiyati - bog'lovchi elektronlar to'plamining yadrolardan biriga to'liq siljishi. Bu ionlar orasida elektron zichligi deyarli nolga teng bo'lgan hudud mavjudligini anglatadi.
Ulanishning ikkinchi turikovalent ulanish
Atomlar elektronlarni almashish orqali barqaror elektron konfiguratsiyalarni hosil qilishi mumkin.
Bunday bog'lanish bir juft elektron bir vaqtning o'zida taqsimlanganda hosil bo'ladi. har biridan atom. Bunday holda, ijtimoiylashtirilgan bog'lanish elektronlari atomlar orasida teng taqsimlanadi. Kovalent bog'lanishga misol gomonuklear diatomik H molekulalari 2 , N 2 , F 2. Allotroplar bir xil turdagi bog'lanishga ega. O 2 va ozon O 3 va ko'p atomli molekula uchun S 8 va shuningdek heteronuklear molekulalar vodorod xlorid HCl, karbonat angidrid CO 2, metan CH 4, etanol FROM 2 H 5 U, oltingugurt geksaflorid SF 6, asetilen FROM 2 H 2. Bu molekulalarning barchasi bir xil umumiy elektronlarga ega bo'lib, ularning bog'lari bir xil tarzda to'yingan va yo'naltirilgan (4-rasm).
Biologlar uchun er-xotin va uch bog'lanishdagi atomlarning kovalent radiuslari bitta bog'lanishga nisbatan kamayishi muhimdir.
![]()
Guruch. to'rtta. Cl 2 molekulasidagi kovalent bog'lanish.
Ion va kovalent bog'lanish turlari mavjud bo'lgan ko'plab kimyoviy bog'lanishlarning ikkita cheklovchi holati bo'lib, amalda ko'pchilik bog'lanishlar oraliqdir.
Mendeleyev tizimining bir xil yoki turli davrlarining qarama-qarshi uchlarida joylashgan ikkita elementning birikmalari asosan ionli bog'lanishlarni hosil qiladi. Elementlar bir davr ichida bir-biriga yaqinlashganda, ularning birikmalarining ion tabiati pasayadi, kovalent xarakteri esa ortadi. Masalan, davriy jadvalning chap tomonidagi elementlarning galogenidlari va oksidlari asosan ionli bog'lanishlarni hosil qiladi ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH) va jadvalning o'ng tomonidagi elementlarning bir xil birikmalari kovalent ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glyukoza C 6 H 12 O 6, etanol C 2 H 5 OH).
Kovalent bog'lanish, o'z navbatida, boshqa modifikatsiyaga ega.
Ko'p atomli ionlarda va murakkab biologik molekulalarda ikkala elektron ham faqatgina kelib chiqishi mumkin bitta atom. U deyiladi donor elektron juft. Ushbu juft elektronni donor bilan ijtimoiylashtiradigan atom deyiladi qabul qiluvchi elektron juft. Ushbu turdagi kovalent bog'lanish deyiladi muvofiqlashtirish (donor-akseptor, yokidating) aloqa(5-rasm). Ushbu turdagi bog'lanish biologiya va tibbiyot uchun juda muhimdir, chunki metabolizm uchun eng muhim d-elementlarning kimyosi asosan koordinatsion aloqalar bilan tavsiflanadi.
![]()
Rasm. 5.
Qoida tariqasida, murakkab birikmada metall atomi elektron juft qabul qiluvchi rolini bajaradi; aksincha, ion va kovalent bog'lanishlarda metall atomi elektron donor hisoblanadi.
Kovalent bog'lanishning mohiyatini va uning xilma-xilligini - koordinatsion bog'lanishni GN tomonidan taklif qilingan boshqa kislotalar va asoslar nazariyasi yordamida oydinlashtirish mumkin. Lyuis. U Bronsted-Lowri nazariyasiga ko'ra "kislota" va "asos" atamalarining semantik tushunchasini biroz kengaytirdi. Lyuis nazariyasi kompleks ionlarning hosil boʻlish tabiatini va moddalarning nukleofil oʻrinbosar reaksiyalarida, yaʼni CS hosil boʻlishida ishtirokini tushuntiradi.
Lyuisning fikricha, kislota asosdan elektron juftini qabul qilib, kovalent bog'lanish hosil qila oladigan moddadir. Lyuis asosi - bu elektronlar berish orqali Lyuis kislotasi bilan kovalent bog'lanish hosil qiladigan yagona juft elektronga ega bo'lgan modda.
Ya'ni, Lyuis nazariyasi kislota-asos reaktsiyalari doirasini protonlar umuman ishtirok etmaydigan reaktsiyalarga ham kengaytiradi. Bundan tashqari, ushbu nazariyaga ko'ra, protonning o'zi ham kislotadir, chunki u elektron juftini qabul qilishga qodir.

Shuning uchun bu nazariyaga ko'ra, kationlar Lyuis kislotalari, anionlar esa Lyuis asoslaridir. Bunga quyidagi reaktsiyalar misol bo'la oladi:
Yuqorida ta'kidlanganidek, moddalarning ionli va kovalentlarga bo'linishi nisbiydir, chunki kovalent molekulalarda elektronning metall atomlaridan akseptor atomlariga to'liq o'tishi yo'q. Ion bog`li birikmalarda har bir ion qarama-qarshi belgili ionlarning elektr maydonida bo`ladi, shuning uchun ular o`zaro qutblanadi, qobiqlari deformatsiyalanadi.
Polarizatsiya qobiliyati ionning elektron tuzilishi, zaryadi va hajmi bilan aniqlanadi; u anionlar uchun kationlarga qaraganda yuqori. Kationlar orasida eng yuqori qutblanish qobiliyati kattaroq va kichikroq o'lchamdagi kationlar uchun, masalan, Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Kuchli polarizatsiya ta'siriga ega H+ . Ion polarizatsiyasining ta'siri ikki tomonlama bo'lgani uchun ular hosil bo'lgan birikmalarning xususiyatlarini sezilarli darajada o'zgartiradi.
Uchinchi turdagi ulanish -dipol-dipol ulanish
Ro'yxatda keltirilgan aloqa turlaridan tashqari, dipol-dipol ham mavjud molekulalararo o'zaro ta'sirlar, deb ham ataladi van der Vaals .
Ushbu o'zaro ta'sirlarning kuchi molekulalarning tabiatiga bog'liq.
O'zaro ta'sirning uch turi mavjud: doimiy dipol - doimiy dipol ( dipol-dipol diqqatga sazovor joylar); doimiy dipol - induktsiyalangan dipol ( induksiya diqqatga sazovor joylar); oniy dipol - induktsiyalangan dipol ( dispersiya attraktsion yoki London kuchlari; guruch. 6).

Guruch. 6.
Faqat qutbli kovalent bog'langan molekulalar dipol-dipol momentga ega ( HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl) va bog'lanish kuchi 1-2 ga teng debye(1D \u003d 3,338 × 10 -30 kulon metr - C × m).
Biokimyoda bog'lanishning yana bir turi ajralib turadi - vodorod cheklovchi holat bo'lgan ulanish dipol-dipol diqqatga sazovor joy. Bu bog'lanish vodorod atomi va kichik elektronegativ atom, ko'pincha kislorod, ftor va azot o'rtasidagi tortishish natijasida hosil bo'ladi. Xuddi shunday elektronegativlikka ega bo'lgan yirik atomlar bilan (masalan, xlor va oltingugurt bilan) vodorod aloqasi ancha zaifdir. Vodorod atomi bitta muhim xususiyat bilan ajralib turadi: bog'lovchi elektronlar tortib olinganda, uning yadrosi - proton ochiladi va elektronlar tomonidan ekranga tushishni to'xtatadi.
Shuning uchun atom katta dipolga aylanadi.
Vodorod aloqasi, van der Vaals bog'idan farqli o'laroq, nafaqat molekulalararo o'zaro ta'sirlar paytida, balki bir molekula ichida ham hosil bo'ladi - intramolekulyar vodorod aloqasi. Vodorod aloqalari biokimyoda muhim rol o'ynaydi, masalan, a-spiral shaklidagi oqsillarning tuzilishini barqarorlashtirish yoki DNK qo'sh spiralini hosil qilish uchun (7-rasm).

7-rasm.
Vodorod va van der Vaals bog'lari ion, kovalent va koordinatsion bog'larga qaraganda ancha zaifdir. Molekulyar aloqalarning energiyasi Jadvalda ko'rsatilgan. bitta.
1-jadval. Molekulalararo kuchlar energiyasi
Eslatma: Molekulalararo o'zaro ta'sir darajasi erish va bug'lanish (qaynatish) entalpiyasini aks ettiradi. Ion birikmalari ionlarni ajratish uchun molekulalarni ajratishdan ko'ra ko'proq energiya talab qiladi. Ion birikmalarining erish entalpiyalari molekulyar birikmalarga qaraganda ancha yuqori.
To'rtinchi ulanish turi -metall bog'lanish
Va nihoyat, molekulalararo aloqalarning yana bir turi mavjud - metall: metallar panjarasining musbat ionlarining erkin elektronlar bilan bog'lanishi. Bunday aloqa turi biologik ob'ektlarda uchramaydi.
Bog'lanish turlarini qisqacha ko'rib chiqish natijasida bitta tafsilot paydo bo'ladi: metallning atomi yoki ionining muhim parametri - elektron donor, shuningdek atom - elektron qabul qiluvchisi. hajmi.
Tafsilotlarga kirmasdan shuni ta'kidlaymizki, atomlarning kovalent radiuslari, metallarning ion radiuslari va o'zaro ta'sir qiluvchi molekulalarning van-der-Vaals radiuslari davriy tizim guruhlarida ularning atom soni ortishi bilan ortadi. Bunday holda, ion radiuslarining qiymatlari eng kichik, van der Waals radiuslari esa eng katta. Qoidaga ko'ra, guruh bo'ylab pastga siljishda barcha elementlarning radiusi kovalent va van-der-vaals bo'yicha ortadi.
Biologlar va shifokorlar uchun eng muhimi muvofiqlashtirish(donor-akseptor) koordinatsion kimyo tomonidan ko'rib chiqiladigan bog'lanishlar.
Tibbiy bioanorganiklar. G.K. Barashkov






