Elektronning energiyasi energiya darajasida maksimaldir. Pastki sathlardagi atom orbitallari sonini hisoblash
1. Elementlarning davriy tizimi davriy qonunni aks ettirish shakli sifatida . Davriy qonunning formulalari. Atom orbitallarini elektronlar bilan to'ldirish va davrlar hosil bo'lishining asosiy qonuniyatlari. s -, p -, d - vaf -elementlar va ularning davriy sistemada joylashishi. Davriy tizimning tuzilishi: kichik va katta davrlar, asosiy va ikkilamchi kichik guruhlar. Lantanidlar va aktinidlarning joylashishi. Davriy jadvalning zamonaviy shakllari. Davriy qonun noorganik kimyo rivojlanishining asosi sifatida. Davriy qonunning umumiy ilmiy ahamiyati.
1 Bilan. 41–46; 2 Bilan. 46–55; 4 Bilan. 30–40; 5 . Bilan. 6–8, 21–32; 8 Bilan. 105–106; 11 Bilan. 75–203.
Davriy qonun zamonaviy tilda: "Kimyoviy elementlar atomlarining xususiyatlari, shuningdek ular hosil qiladigan moddalarning tarkibi va xususiyatlari davriy ravishda zaryadlarga bog'liq. atom yadrolari».
Davriy qonunning grafik ifodasi elementlar davriy tizimining jadvalidir. Faqat bitta davriy qonun mavjud bo'lib, elementlar davriy tizimining 500 dan ortiq shakllari ma'lum.Ulardan eng keng tarqalgani. qisqa muddat(8 hujayra) , yarim uzoq davr(18 hujayra) va uzoq muddat(32 hujayra).
Kimyoviy elementlar davriy sistemada atom yadrolarining zaryadini oshirish tartibida joylashtirilgan. Davriy tizim quyidagilardan iborat davrlar va guruhlar.
Davr- tashqi energiya darajasining elektron konfiguratsiyasi o'z atomlari yadrolarining zaryadini oshirish tartibida joylashgan bir qator elementlar. ns 1 (ishqoriy metall) gacha ns 2 np 6 (nobil gaz). Birinchi davr uchun - 1 dan s 1 (vodorod) dan 1 gacha s 2 (geliy). Birinchi, ikkinchi va uchinchi davrlar deyiladi kichik(yoki qisqa), qolganlari - katta(yoki uzoq). Hammasi bo'lib 7 ta davr mavjud.
Davr raqamining jismoniy ma'nosi – tengdir ma'lum bir davrda kimyoviy elementlar atomlaridagi energiya darajalari soni. Masalan, qo'zg'atmagan holatda bo'lgan 4-davr elementlari atomlarida elektronlar 4 ta energiya darajasida (4 elektron qobiq) taqsimlanadi.
Guruh – vertikal qator o'xshash elementlar elektron tuzilma atomlar va shuning uchun o'xshash xususiyatlarni namoyon qiladi. Qoida tariqasida, guruh raqami ko'rsatadi kimyoviy bog'lanish hosil bo'lishida ishtirok eta oladigan element atomidagi elektronlar soni.
2. Kimyoviy elementlar atomlari xossalarining davriyligi. O'zgarishlarning xarakterini belgilovchi omillar kimyoviy xossalari elementlar. Atom elektron qobiqlarining "konfiguratsiyasi" va "tuzilishi", ularning davrlar va guruhlardagi o'zgarishi. Atom va ionlarning radiuslari, ularning qiymatlarining nisbati. Effektiv (kovalent, ion, metall) va orbital radiuslar. Atomlar va ionlarning radiuslarini davrlar va guruhlar bo'yicha o'zgartirish.
Ionlanish energiyasi (ionlanish potentsiali) va elektronga yaqinlik. Ularning qiymatlarini belgilovchi omillar: atomning radiusi, tashqi elektron qobig'ining konfiguratsiyasi, atom yadrosining samarali zaryadi. Davrlar va guruhlarda ionlanish energiyasi va elektron yaqinligining o'zgarish qonuniyatlari.
Elektromanfiylik tushunchasi. Davr va guruhlarda atomlarning elektron manfiyligining o'zgarishi. Atomlarning elektromanfiyligidagi farqning ular orasidagi kimyoviy bog'lanish tabiatiga ta'siri. Elementlarning kimyoviy xossalarining tuzilishiga qarab guruhlar va davrlardagi o'zgarishi elektron qobiqlar, shuningdek, atom radiuslari.
1 Bilan. 46–51; 2 Bilan. 51–52, 94–98, 423; 99–103; 4 Bilan. 40–46; 5 Bilan. 6–9, 49–53; 7 Bilan. 81–90; 8 Bilan. 106–112; 11 Bilan. 63–67.
Kimyoviy elementlar atomlarining kimyoviy xossalarini belgilovchi eng muhim omillar ularning elektron qobiqlarining konfiguratsiyasi va tuzilishidir. Atom yadrolari zaryadining ketma-ket ortishi ularning tashqi elektron qobiqlarining elektron konfiguratsiyasining davriy o'zgarishiga olib keladi. ns 1 ga ns 2 np 6. Buning oqibati atomlarning kovalent, ion va metall radiusi, ionlanish energiyasi, elektron yaqinligi, oksidlanish darajasi, atom hajmi va boshqalar kabi xususiyatlarining davriy o'zgarishidir.
To'g'ri aytganda, har qanday atomning o'lchami cheksizdir, chunki yadrodan o'zboshimchalik bilan katta masofada uning elektronlarini topishning nolga teng bo'lmagan ehtimoli bor. Biroq, har qanday orbital uchun radial elektron zichligi taqsimotining egri chizig'ida asosiy maksimal mavjud. Bunga asoslanib, kontseptsiya orbital radiusi atom. U tengdir nazariy jihatdan hisoblangan tashqi orbital uchun radial taqsimot egri chizig'ida yadrodan asosiy maksimalgacha bo'lgan masofa.
Atomning o'lchami haqida gapirganda, ular ko'pincha buni anglatadi samaraliradius. Uning qiymatlari aniqlanadi eksperimental tarzda molekulalarda, ion va metall kristallarida yadrolararo masofalarni topishga imkon beradigan elektronografiya yoki rentgen nurlari diffraktsiyasi usullari. Ularning qiymatlariga asoslanib, ular mos ravishda hisoblab chiqadilar kovalent, ion va metall atom radiuslari.
Atomning samarali radiusining qiymati ko'plab omillarga bog'liq: moddaning tuzilishi, kimyoviy bog'lanishning tabiati, elementning oksidlanish darajasi va boshqalar ma'lumotlar va shuning uchun turli mualliflar juda farq qilishi mumkin.
Kimyoviy elementlarning atom radiuslari qiymatlarining o'zgarishi davriy xususiyatga ega.
Davrlarda atom yadrolarining zaryadi ortishi bilan (atom sonining ortishi) atomlarning radiusi kamayadi. Masalan, 3-davrning sakkiz elementi (faqat s- va R-elementlar), radius 190 pm (natriy uchun) 99 pm (xlor uchun), ya'ni deyarli 2 marta va o'nga kamayadi. d-4-davrning elementlari, radius 164 pm (skandiy uchun) 153 pm (rux uchun), ya'ni atigi 7% ga kamayadi.
Guruhlarda yadrolarning zaryadi ortishi bilan atomlarning radiusi oshadi ortadi, A guruhida ( s- va p-elementlar), bunday o'sish B guruhiga qaraganda ko'proq sodir bo'ladi ( d- va f-elementlar).
d-Bir guruhda joylashgan 5 va 6 davr elementlari deyarli bir xil atom radiuslariga ega. Masalan, sirkoniy va gafniyning atom radiusi mos ravishda 160 pm va 150 pm, molibden va volframniki esa mos ravishda 139 pm va 141 pm. Radiuslarning bunday yaqinligining sababi 6-davrda 14 f-atomlarida uchinchi tashqi qismi to'ldirilgan elementlar 4 f- tashqi elektronlarni yadrodan kuchli "qalqon" qiluvchi energiya pastki darajasi. Natijada, atom yadrolari zaryadining ortishi atom radiuslarining kattaligiga kam ta'sir qiladi. Bu effekt deyiladi lantanid siqish.
Ionizatsiya energiyasi (E va u. ) – Izolyatsiya qilingan atomdan 1 ta elektronni olib tashlash uchun zarur bo'lgan minimal energiya LEKIN , erning energiya holatida:
A 0 → A + + e – – E va u.
Birinchisini ajrating ( E 1), ikkinchi ( E 2) va birinchi, ikkinchi va keyingi elektronlarning ajralishiga mos keladigan keyingi ionlanish energiyalari. Ionlanish energiyasining birligi kJ/mol.
Ionlanish potentsiali (I ) –elektron ajratilgan atomdan ajralib chiqadigan elektr maydonining eng kichik kuchlanishi (potentsial farq).
Birinchisini ajrating ( I 1), ikkinchi ( I 2) va birinchi, ikkinchi va keyingi elektronlarning ajralishiga mos keladigan keyingi ionlanish potentsiallari. Ionlanish potentsialining birligi elektron volt, eV. Bir eV 96,486 kJ/mol ga to'g'ri keladi.
Atomning ionlanish energiyasining qiymati (va uning ionlanish potentsiali) ko'plab omillarga bog'liq: yadro zaryadi, atom radiusi, atomning elektron qobig'ining konfiguratsiyasi.
Elektron yaqinligi (E qarang. ) – Neytral izolyatsiyalangan atomga elektron biriktirilishi natijasida chiqarilgan yoki so'rilgan energiya A 0:
A 0 + e – → A – ± E qarang.
Atomga elektron qo'shilishi bilan birga keladi energiya chiqishi(+e qarang.), agar bu natijaga olib kelsa atom zarrasi barqaror elektron qobiq bilan. Bu, masalan, halogen atomlari uchun xosdir. Agar elektronning atomga biriktirilishi natijasida beqaror elektron qobiqli atom zarrasi hosil bo'lsa, unda bunday atomning elektronga yaqinligi manfiy, ya'ni. energiya so'riladi(– e qarang.). Bu, masalan, metall atomlariga xosdir.
Elektromanfiylik (ch) – atomning qobiliyatini tavsiflovchi shartli qiymat kimyoviy birikma jalb qilish valent elektronlar(umumiy elektron juftlari).
Atomning elektron manfiylik qiymati eng oddiy holatda uning ionlanish potentsiali va elektronga yaqinligi asosida aniqlanadi.
Elementlarning ch qiymatlari biroz farq qilishi mumkin bo'lgan turli xil shkalalar mavjud (Polingga ko'ra elektronegativlik, Mullikenga ko'ra, Allred-Rochovga ko'ra va boshqalar). Ko'pgina shkalalarda ftor eng elektronegativ element, fransiy esa eng kam elektronegativ hisoblanadi.
Atom sonining ortishi bilan Muayyan davrda elektromanfiylik kuchayadi, guruhda esa, qoida tariqasida, pasayadi. Masalan, kislorodning elektron manfiyligi uglerodnikidan yuqori, chunki ular bir davrda joylashgan, ammo kislorod uglerodning o'ng tomonida joylashgan. Bariyning elektromanfiyligi magniynikidan past, chunki uning qiymatlari guruhda yuqoridan pastgacha pasayadi.
Agar ikkita atomning ch qiymatlari bir xil bo'lsa, ular o'rtasida kovalent qutbsiz kimyoviy bog'lanish hosil bo'ladi. Agar atomlarning elektr manfiyligi unchalik farq qilmasa (elektronmanfiylik qiymatlaridagi farq Dc 1,5 dan oshmasa), atomlar o'rtasida kovalent qutbli bog'lanish paydo bo'ladi. Uni tashkil etuvchi umumiy elektron juftlari har doim ch yuqori bo'lgan atomga o'tadi, buning natijasida u qisman manfiy zaryadga ega bo'ladi (d-). Shunga ko'ra, ikkinchi atom qisman musbat zaryad oladi (d+).
Vodorod atomi uchun Shredinger tenglamasini yechish natijasi atomdagi elektronning harakatini tavsiflovchi uchta kvant sonidir. Bular bir xil kvant raqamlari elementlar davriy sistemasining har qanday atomining elektronlari holatini o'ziga xos tarzda tavsiflaydi.
Bosh kvant soni n elektronning energiyasini va elektron bulutlarning hajmini aniqlaydi. Elektronning energiyasi asosan elektronning yadrodan uzoqligiga bog'liq: elektron yadroga qanchalik yaqin bo'lsa, uning energiyasi shunchalik past bo'ladi. Demak, asosiy kvant soni elektronning u yoki bu yerda joylashishini aniqlaydi, deyishimiz mumkin energiya darajasi(kvant qatlami). Asosiy kvant soni 1 dan 1 gacha bo'lgan butun sonlar qatorining qiymatlariga ega. Asosiy kvant sonining qiymati birga teng bo'lganda, elektron yadrodan mumkin bo'lgan minimal masofada joylashgan birinchi energiya darajasida bo'ladi. umumiy energiya Bunday elektronning eng kichiki.
Yadrodan eng uzoq energiya darajasidagi elektron mavjud maksimal energiya. Shuning uchun elektronning uzoqroq energiya darajasidan yaqinroqqa o'tishi paytida energiyaning qismlari (kvantalari) ajralib chiqadi. Energiya darajalari sxema bo'yicha bosh harflar bilan ko'rsatilgan:
Orbital kvant soni Kvant mexanik hisob-kitoblariga ko'ra, elektron bulutlar nafaqat hajmi, balki shakli bilan ham farqlanadi. Elektron bulutning shakli orbital yoki azimutal kvant soni bilan tavsiflanadi. Elektron bulutlarning har xil shakli bir energiya darajasidagi elektronlar energiyasining o'zgarishiga, ya'ni uning energiya pastki darajalariga bo'linishiga olib keladi. Elektron bulutining har bir shakli orbital kvant soni bilan aniqlangan elektronning mexanik impulsining ma'lum bir qiymatiga to'g'ri keladi:
![]()
Orbital kvant soni l. 0 dan barcha qiymatlargacha bo'lgan qiymatlarga ega bo'lishi mumkin. Energiya pastki darajalari harflar bilan belgilanadi:
Bosh kvant sonining qiymati birga teng bo'lsa, orbital kvant soni faqat bitta qiymatga ega, nolga teng. Bu qiymat sferik simmetriyaga ega bo'lgan elektron bulutlarni tavsiflaydi (1.3-rasmga qarang). Orbital kvant soni nolga teng bo'lgan elektronlar -elektronlar deyiladi.
Birinchi energiya sathida faqat -elektronlar bo'lishi mumkin, uning shartli belgisi Asosiy kvant sonining qiymati ikkiga teng bo'lsa, orbital kvant soni ikkita ma'noga ega: Orbital son,
ga teng elektron bulutning gantel shaklidagi shakliga (sakkiz hajm shakli) mos keladi (1.4-rasm. Orbital kvant soni birga teng bo'lgan elektronlar -elektronlar deyiladi.
Ikkinchi energetik daraja S- va -elektronlarni o'z ichiga olishi mumkin, ular ikkita kichik darajani tashkil qiladi: Asosiy kvant sonining qiymati uchta bo'lsa, orbital kvant soni uchta qiymatga ega bo'ladi: Ikki ga teng orbital kvant soni ko'proqqa mos keladi. murakkab shakl elektron bulutlar (1.5-rasm). Orbital kvant soni ikkiga teng bo'lgan elektronlar d-elektronlar deyiladi.
Uchinchi energiya darajasida uchta kichik darajani tashkil etuvchi elektronlar bo'lishi mumkin: Asosiy kvant sonining qiymati to'rt bo'lsa, orbital kvant soni to'rtta qiymatga ega bo'ladi: Uch ga teng orbital raqam bulutlarning yanada murakkab shakliga mos keladi. elektronlar,
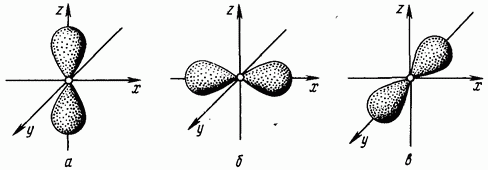
Guruch. 1.4. Elektron -bulutlar -orbital; -orbital; - -orbitalda

Guruch. 1.5. Elektron d-bulutlar - orbital; -orbital; c - orbital; - -orbital; - -orbital
orbital kvant soni uchta bo'lgan elektronlar deyiladi.
To'rtinchi energiya darajasi o'z ichiga olishi mumkin va -elektronlar, to'rt pastki darajani tashkil qiladi;
Magnit kvant soni Shredinger tenglamasining yechimidan kelib chiqadiki, elektron bulutlar fazoda yo'naltirilgan. Elektron bulutlarning fazoviy yo'nalishi magnit kvant soni bilan tavsiflanadi.
Tashqi magnit yoki elektr maydon elektron bulutlarning fazoviy yo'nalishini o'zgartiradi, shuning uchun magnit yoki elektr maydon ta'sirida elektronlarning energiya pastki darajalari bo'linadi. magnitda va elektr maydonlari atom spektral chiziqlarining bo'linishi kuzatiladi.
Magnit kvant soni 0 dan boshlab har qanday butun son qiymatini oladi. Shunday qilib, magnit kvant sonining mumkin bo'lgan qiymatlari soni. Agar orbital kvant sonining qiymati nolga teng bo'lsa, magnit kvant soni faqat bitta bo'ladi. qiymat, nolga teng (1.3-rasmga qarang). Orbital kvant soni birga teng bo'lsa, magnit kvant soni uchta qiymatga ega: Magnit sonning uchta qiymati koordinata bo'ylab uchta o'zaro perpendikulyar tekislikda kosmosdagi bulutlarning yo'nalishiga mos keladigan elektronlarning uchta holatini tavsiflaydi. oqlari (1.4-rasmga qarang).
Orbital kvant soni ikkiga teng bo'lsa, magnit kvant soni beshta qiymatga ega: . Magnit kvant sonining beshta qiymati d-elektron bulutlarining beshta fazoviy holatiga mos keladi (1.5-rasm). Uch ga teng orbital kvant soni magnit sonning etti qiymatiga va bulutlarning etti fazoviy pozitsiyasiga mos keladi.
Atom orbitallari (AO). Kvant raqamlari tushunchalariga asoslanib, atomdagi elektron orbitalning ta'rifini aniqlashtirish mumkin. Kvant sonlarining ma'lum qiymatlari bilan tavsiflangan atomdagi elektronning pozitsiyalari to'plamiga atom orbitali deyiladi.
2. ATOMLARNING ELEKTRON TUZILISHI. KIMYOVIY BOG'
Atomdagi elektronning har qanday barqaror holati kvant sonlarining ma'lum qiymatlari bilan tavsiflanadi: n, l, ml, ms, mos ravishda: asosiy, orbital, magnit va spin deb ataladi.
Atomdagi elektronning n, ℓ, ml kvant sonlarining ma'lum qiymatlariga mos keladigan holati atom orbitali (a.o.) deb ataladi. Aks holda, atom orbitali elektronning qolish ehtimoli yuqori bo'lgan bo'shliqdir.
Orbital kvant sonining qiymatiga qarab, energiya quyi darajalarining quyidagi belgilari qabul qilinadi:
– s pastki darajasi (n/a) |
||
ℓ= 2 – d -*- ℓ= 3 – f -*-
Har bir atom orbital turi elektron bulutning o'ziga xos shakliga ega. S - sharsimon orbital, p - gantel shaklidagi orbital, d - rozet shaklidagi orbital, f - undan ham murakkab shakldagi orbital.
Har bir turdagi orbitallar soni ularni kosmosda yo'naltirish usullari soni bilan belgilanadi, ya'ni. magnit kvant sonining qiymatlari soni - ml. Magnit kvant soni (2ℓ + 1) qiymatlarga ega
(2.1-jadval).
Pastki sathlardagi atom orbitallari sonini hisoblash | 2.1-jadval |
||||
Belgilanish | Qiymatlar soni | ||||
pastki daraja | |||||
2;-1;0; + 1; + 2 | |||||
3;-2;-1;0; + 1;+2;+3 | |||||
Grafik jihatdan atom orbitali tasvirlangan yoki -. Energiya darajasidagi atom orbitallarining soni (z) za.o. = n2, bu erda n - bosh kvant soni.
Pauli printsipiga ko'ra, atomda bir xil kvant sonlari bilan tavsiflangan ikkita elektron bo'lishi mumkin emas. Bundan kelib chiqadiki, har bir atom orbitalini ikkitadan ko'p bo'lmagan elektron egallashi mumkin va ularning spin kvant sonlari har xil bo'lishi kerak, bu ↓ bilan belgilanadi.
Shunday qilib, energiya darajasidagi elektronlarning umumiy soni ze = 2n2 formulasi bilan aniqlanadi. Pastki darajadagi elektronlar soni 2 (2ℓ + 1) formulasi bilan aniqlanadi. Elektronlar soni va daraja tuzilishini hisoblash jadval shaklida taqdim etilishi mumkin. 2.2.
Har bir kichik daraja va darajaning tuzilishini bilib, elementlarning elektron formulalarini tuzish mumkin.
Ko'p elektronli atomning barqaror (qo'zg'atmagan) holati elektronlarning atom energiyasi minimal bo'lgan atom orbitallari bo'yicha shunday taqsimlanishiga mos keladi. Shuning uchun atom orbitallari energiyalarining ketma-ket ortishi tartibida to'ldiriladi. Atom orbitallarini elektronlar bilan to'ldirish tartibi orbital energiyasining asosiy (n) va orbital (ℓ) kvant sonlarining qiymatlariga bog'liqligini hisobga oladigan Klechkovskiy qoidalari bilan belgilanadi. Ushbu qoidalarga ko'ra, atom orbitallari yig'indining ketma-ket o'sishi (n + 1) (Klechkovskiyning birinchi qoidasi) va bu yig'indining bir xil qiymatlari uchun elektronlar bilan to'ldiriladi. asosiy son n ning ketma-ket ortishi (Klechkovskiyning ikkinchi qoidasi).
Atom orbitallarida elektronlarning bitta energiya pastki sathida joylashishi Xund qoidasi bilan belgilanadi, unga ko'ra atomning minimal energiyasi ma'lum pastki darajadagi atom orbitallarida elektronlarning shunday taqsimlanishiga to'g'ri keladi, bunda umumiy spinning mutlaq qiymati aniqlanadi. atomning maksimal miqdori; elektronlarning har qanday boshqa joylashuvi bilan atom hayajonlangan holatda bo'ladi, ya'ni. yuqori energiyaga ega bo'ladi.
Vazifalar va mashqlar
2.1. Elektronning holati qanday belgilanadi: a) n=4, ℓ=2 bilan; b) n=5, ℓ=3 bilan.
Yechish: Energiya holatini qayd etishda raqam pastki daraja (n) raqamini, harf esa pastki darajaning (s, p, d, f) xususiyatini ko'rsatadi. n=4 va ℓ=2 uchun 4d yozamiz; n=5 va ℓ=3 uchun 5f ni yozamiz.
2.2-jadval
Elektronlar sonini hisoblash
Belgilanish | Ze = 2(2ℓ + 1) | Ze = 2n2 | Tuzilishi |
|||||
pastki daraja | ||||||||
2 12 | ||||||||
2 22 | s2 p6 |
|||||||
Jadvalning oxiri. 2.2
Belgilanish | Ze = 2(2ℓ + 1) | Ze = 2n2 | Tuzilishi |
|||||||||
pastki daraja | ||||||||||||
2(2 2 + 1) = 10 | ||||||||||||
2 42 = 32 | s 2p 6d 10f 14 |
|||||||||||
2.2. Uchinchi energiya darajasiga nechta orbital mos keladi? Bu darajada nechta elektron bor? Bu daraja nechta kichik darajaga bo'linadi?
Yechish: Uchinchi energiya darajasi n = 3 uchun atom orbitallari soni 9 (32); bu orbitallar soni 1(s) + 3(p) + 5(d) = 9 yig'indisidir. Pauli printsipiga ko'ra, bu darajadagi elektronlar soni 18. Uchinchi energiya darajasi uchta pastki darajaga bo'linadi. : s, p, d (pastki darajalar soni asosiy kvant sonining qiymatlari soni bilan bir xil).
Hammasi kimyoviy elementlar To'ldirilishi kerak bo'lgan pastki darajalarning tabiatiga qarab 4 turga bo'linishi mumkin:
s-elementlar - elektronlar bilan to'ldirish ns - pastki daraja; p-elementlar - elektronlar bilan to'ldirish np - pastki daraja; d- elementlar - elektronlar bilan to'ldirish (n-1) d - pastki daraja; f-elementlar - elektronlar bilan to'ldirish (n-2) f - pastki daraja.
Elementning elektron formulasini yozish uchun quyidagilar kerak: energiya darajasining sonini arab raqami bilan ko'rsatish, pastki sathning harfiy qiymatini yozish, ko'rsatkich sifatida elektronlar sonini yozish.
Masalan: 26 FeIV 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Elektron formula quyi darajalar raqobatini hisobga olgan holda tuzilgan, ya'ni. minimal energiya qoidalari. Oxirgi elektron bundan mustasno
formula yoziladi: 26 Fe1V 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Elementning maksimal valentligi valentlik orbitallari soni bilan belgilanadi va elementning elektron turiga va davr raqamiga bog'liq.
Davrlar bo'yicha elementlarning elektron tuzilishi va maksimal valentlik jadvalda keltirilgan. 2.3.
2.3-jadval Elektron tuzilishi va elementlarning maksimal valentligi
Valentlik | ||||||||||||||||
Tuzilishi | ||||||||||||||||
orbitallar | ||||||||||||||||
1s 1-2 | ||||||||||||||||
1s 22s 1-22p 1-6 | ||||||||||||||||
1s2 2s2 2p6 3s1-2 | 3d) | |||||||||||||||
3p 1-6 | ||||||||||||||||
4d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s 1-23d 1-104p 1-6 | ||||||||||||||||
5d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s2 3d10 4p6 5s1-2 | ||||||||||||||||
4d 1-105p 1-6 | ||||||||||||||||
6f) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | 6d) | |||||||||||||||
4s2 3d10 4p6 5s2 | ||||||||||||||||
4d 105p 66s 1-10 | ||||||||||||||||
5d 14f 1-145d 2-10 | ||||||||||||||||
6p 1-6 | ||||||||||||||||
2.3. Quyi sathni to'ldirgandan so'ng atom qaysi kichik sath elektronlar bilan to'ldiriladi: a) 4p; b) 4s?
R Yechish: a) 4p pastki daraja 4+1 = 5 ga teng yig‘indiga (n + l) mos keladi. Xuddi shu n+l yig‘indisi 3d (3+2 = 5) kichik darajalarni xarakterlaydi.
va 5s (5+0 = 5). Biroq, 3d holati 4p holatiga qaraganda n ning kichikroq qiymatiga (n = 3) mos keladi, shuning uchun 3d pastki darajasi 4p pastki darajasidan oldinroq to'ldiriladi. Shuning uchun, 4p pastki darajasini to'ldirgandan so'ng, 5s pastki daraja to'ldiriladi, bu n ning bir kattaroq qiymatiga mos keladi (n = 5).
b) pastki darajali 4s n+l = 4+0 = 4 yig'indisiga mos keladi. Xuddi shu n+l yig'indisi 3r ostki darajani xarakterlaydi, lekin bu pastki darajani to'ldirish 4-chi darajani to'ldirishdan oldin keladi, chunki ikkinchisi bosh kvant sonining kattaroq qiymatiga mos keladi. Shuning uchun, 4-chi darajalidan so'ng, yig'indisi (n+l) = 5 bo'lgan pastki daraja, bundan tashqari, ushbu yig'indiga mos keladigan barcha mumkin bo'lgan n+ℓ birikmalaridan (n=3, ℓ=2; n=4, ℓ) to'ldiriladi. =1; n= 5, ℓ=0), birinchi navbatda asosiy kvant sonining eng past qiymatiga ega kombinatsiya amalga oshiriladi, ya'ni. 4s pastki darajasidan keyin 3D pastki darajasi bo'ladi.
Xulosa: Shunday qilib, d pastki darajasini to'ldirish birdan orqada qoladi kvant darajasi, f pastki sathni to'ldirish ikki kvant sathidan orqada qoladi.
2.4. Atomning elektron tuzilishi 1s formula bilan tavsiflanadi 2 2s2 2p6 3s2 3d7 4s2. Bu element nima?
R Yechim: Bu element elektron turga tegishli
d-elementlar 1U davri, chunki 3d pastki darajasi elektronlar tomonidan qurilgan; elektronlar soni 3d7 bu tartibda ettinchi element ekanligini ko'rsatadi. Elektronlarning umumiy soni 27 ta, ya'ni seriya raqami 27. Bu element kobalt.
2.5. Nima uchun fosfor va vanadiy davriy sistemaning bir guruhiga joylashtirilgan? Nima uchun ular turli kichik guruhlarga joylashtirilgan?
R Yechish: P 1s atomlarining elektron konfiguratsiyasi 2 2s2 2p3 3s 2 3p 3; V 1s2 2s2 2p6 3s2 3p6 4s 2 3d 3. Valentlik elektronlarning tagiga chizilgan.
Bu elementlarning valentlik elektronlari soni bir xil - 5. Shuning uchun P va V bir xil 5-guruhda joylashgan. Shu bilan birga, bu elementlar elektron hamkasblar emas, chunki. turli pastki darajalarni qurish, shuning uchun ular bir kichik guruhga joylashtirilmasligi kerak.
kimyoviy bog'lanish elektronlarning kvant mexanik ta'sirining natijasidir.
Atomlar orasidagi elektron zichligi taqsimotining tabiatiga ko'ra, kimyoviy bog'lanishlar kovalent qutbsiz, qutbli va ionlarga bo'linadi (bu erda metallarda amalga oshiriladigan metall bog'lanish hisobga olinmaydi). Agar bir juft elektronning siljishi bo'lmasa, u holda bog'lanish kovalent qutbsizga yaqinlashadi. Kovalent qutbli bog'lanish sherik atomlardan birining yadrosiga ko'chirilgan (qutblangan) elektronlarning umumiy juftligi tomonidan amalga oshiriladi. Ion aloqasi juda qutblangan deb hisoblanadi kovalent bog'lanish. Berilgan element atomining umumiy elektron juftini o'ziga jalb qilish qobiliyatini baholash uchun nisbiy elektronegativlik qiymati (ch) qo'llaniladi (5-jadval). Elektromanfiylikdagi farq (Dc) qanchalik katta bo'lsa, bog'lanishning qutblanishi shunchalik katta bo'ladi (bog'ning ionligi shunchalik yuqori bo'ladi). Agar Dch > 1,9 bo'lsa, bog'lanish ionli bo'ladi, deb ishoniladi.
2.6. E(OH)2 birikmalaridagi H-O va E-O bog’lari bo’yicha atomlarning nisbiy elektron manfiyligi farqini hisoblang, bunda E Ca, Sr, Ba elementlardir va aniqlang:
a) nima N-O aloqasi yoki E-O har bir molekulada kattaroq ionlik darajasi bilan tavsiflanadi; b) suvli eritmada bu molekulalarning ionlanishi qanday xarakterga ega?
Qaror: a) E-O va H-O o'rtasidagi munosabat uchun Dch ni hisoblang:
Dc Ca-O = 3,5 - 1,04 = 2,46 Dc Sr-O = 3,5 - 0,99 = 2,51 Dc Ba-O = 3,5 - 0,90 = 2,60 Dc H-O = 3,5 - 2,1 = 1.
Dch ni taqqoslashdan buni ko'ramiz E-O aloqasi ionli deb hisoblash mumkin, H-O aloqasi qutblidir.
b) suvli eritmalarda ionlanish eng ionli bog'lanish bo'ylab amalga oshiriladi, ya'ni. sxema bo'yicha: E (OH) 2 ↔ E2 + + 2OH- (turi bo'yicha).
asoslar).
Kimyoviy bog'lanishning mustahkamligi energiya (kJ/mol) va bilan tavsiflanadi
bog'lanish uzunligi (nm yoki A). Bog'lanish energiyasi qanchalik baland bo'lsa va uzunligi qanchalik qisqa bo'lsa, bog'lanish shunchalik kuchli bo'ladi.
Kimyoviy bog'lanish, ya'ni. umumiy elektron jufti ikki yo'l bilan: almashinuv va donor-akseptor mexanizmi orqali hosil bo'lishi mumkin. Kimyoviy bog'lanish uchta asosiy xususiyat bilan tavsiflanadi:
1) kosmosda ma'lum bir yo'nalishga ega. Shu nuqtai nazardan, s va p obligatsiyalari. Ikki s-bog'ning yo'nalishidan hosil bo'lgan burchak valentlik burchagi deb ataladi. Agar p bog bir necha atomlarni birlashtirsa, u lokalizatsiyalanmagan deyiladi;
2) to'yinganlikka intiladi, buning natijasida zarralar ma'lum tarkibga va tuzilishga ega. Mumkin: muvofiqlashtirish

atomlarning toʻyinmagan, koordinativ toʻyingan, valentlikka toʻyingan va valentlik toʻyinmagan holatlari;
3) turli omillar ta'sirida (atomlarning elektromanfiyligiga qarab, shuningdek, tashqi elektr yoki magnit maydon ta'sirida, boshqa qutbli molekulalar ta'sirida) qutblanishi mumkin.
Molekulalarning geometrik tuzilishini tushuntirish uchun markaziy atom atom orbitallarining gibridlanishi tushunchasidan foydalaniladi. Bu kontseptsiyaga ko'ra, s-bog'larning hosil bo'lishidan oldin atom orbitallarining shakli va energiyasi o'zgaradi. Gibrid orbitallar hosil bo'ladi, ular chuqurroq qoplanishga qodir va shuning uchun kuchliroq bog'lanishlar. s va p elektron tipidagi elementlar uchun gibridlanishda orbitallar, shu jumladan taqsimlanmagan elektron juftlar ishtirok etishi mumkin.
2.7. BF3 molekulasi va BF4 - ionida bog` hosil bo`lishini ko`rsating. Ushbu zarrachalarning tuzilishini tushuntiring.
Yechish: 1. Atomlar va io-larning elektron formulalarini tuzing.
yangi: B 1s2 2s2 2p1; F 1s2 2s2 2p5; F- 1s2 2s2 2p6.
2. Elektronlarning valentlik orbitallari bo‘yicha taqsimlanishini ko‘rsatamiz. Bunda birikmadagi bor atomining oksidlanish darajasini hisobga olamiz (shartli ravishda atomdagi juftlanmagan elektronlar soni oksidlanish darajasiga mos keladi deb taxmin qilishimiz mumkin).
3. Barcha mumkin bo‘lgan bog‘lanishlarning hosil bo‘lishini ko‘rsatamiz, ularning hosil bo‘lish mexanizmini ko‘rsatamiz:
3 ta s-bog'lar almashinuv mexanizmi orqali hosil bo'lgan Atomning valentlik imkoniyatlaridan kelib chiqqan holda
bor va uning to'yinganlik tendentsiyasi, donor-akseptor mexanizmi orqali p-bog' hosil bo'lishini ko'rsatamiz. Lekin, chunki bu aloqa ikkidan ortiq atomlarni birlashtiradi
mov, u mahalliylashtirilmaydi.
BF4 - ionida 4 ta s-bog'lar hosil bo'ladi, ulardan uchtasi almashinuv va bittasi donor-akseptor mexanizmi.

4. Ulanishning ko'pligini nisbat sifatida hisoblang umumiy soni ga ulanishlar s-bog'lar. BF3 molekulasida bog'lanish ko'pligi 1⅓, BF4 ionida esa 1 ga teng.
5. Markaziy atomning holatini to'yinganlik nuqtai nazaridan aniqlaylik
ko'priklar. BF3 molekulasida maksimal valentlik s va p bog'lanishlar tufayli namoyon bo'ladi, shuning uchun bor atomining holati valentlik bilan to'yingan.
BF 4 - ionida maksimal valentlik s-bog'lar tufayli namoyon bo'ladi, shuning uchun bor atomining holati koordinatali ravishda to'yingan.
6. Keling, ulanishning tabiatini aniqlaylik B-F qutblilik nuqtai nazaridan. Chunki elektronegativlik qiymatidagi farq (Dc) 4,0-2,0 = 2,0, ya'ni. 1,9 dan ortiq bo'lsa, bog'lanishni ion deb hisoblash mumkin.
7. Markaziy atomning atom orbitallarining gibridlanish turini va zarrachalarning geometrik shaklini aniqlaymiz.
BF 3 molekulasida s va 2p orbitallar s-bog'larning hosil bo'lishida ishtirok etadi, shuning uchun sp2 gibridlanish turi. Molekula uchburchak shaklida
tuzilishi. BF4 - ionida bir s va uchta p orbital s-bog'larning hosil bo'lishida ishtirok etadi, shuning uchun sp3 gibridlanish turi. Ion tetraedral shaklga ega.
8. Zarrachalar tuzilishini grafik tarzda tasvirlaylik
2.8. SO3 molekulasida bog`larning hosil bo`lishini ko`rsating, molekulaning tuzilishini tushuntiring.
Yechish: Elementlarning elektron formulalari
S 1s2 2s2 2p6 3s2 3p4 O 1s2 2s2 2p4.
Chunki oltingugurt atomining oksidlanish darajasi +6, biz qo'zg'aluvchan oltingugurt atomining valentlik orbitallari bo'yicha elektronlarning taqsimlanishini ko'rsatamiz.
Oltingugurt atomi almashinuv mexanizmi orqali 3 ta s-bog' (bir s va ikkita p-atom orbital hisobiga) va 3 ta p-bog' (bir p- va ikkita d-atomik orbital hisobiga) hosil qiladi.
Binobarin, atom valentlikka to`yingan, koordinativ to`yinmagan; bog'lanish ko'pligi 6/3 = 2. S-O aloqasi qutbli, umumiy elektron juftlari kislorodga siljiydi (Dc = 0,5). Sp2 gibridizatsiya turi. Molekula uchburchak tuzilishiga ega.

3. MURAKBAK BIRIKMALAR
Murakkab birikmalar tirik organizmlar hayotida muhim rol o'ynaydi. Organizmda muhim fiziologik funktsiyalarni bajaradigan Na, K, Ca, Mg ionlari qon, limfa va to'qima suyuqliklarida murakkab birikmalar shaklida bo'ladi. Fe, Zn, Mn, Cu ionlari oqsillar bilan murakkab birikmalar hosil qiladi va fermentlar va vitaminlar tarkibiga kiradi. Temir gemoglobinning bir qismidir. Gemoglobin globin oqsili va gem kompleksi o'rtasidagi bog'liqlikdir. Gemda markaziy ion Fe2+ dir.
Kompleks birikmalar molekulyar birikmalar deb ataladi, ularning tarkibiy qismlarining kombinatsiyasi kristalda ham, eritmada ham erkin mavjud bo'lgan murakkab ionlarning hosil bo'lishiga olib keladi. Kompleks birikmalar molekulalarida ichki va tashqi sferalar ajralib turadi. Ichki sfera kvadrat qavs ichiga olingan va kompleks hosil qiluvchi vosita deb ataladigan markaziy atom yoki ion va uning atrofida muvofiqlashtirilgan atomlar, ionlar yoki ligandlar deb ataladigan molekulalardan iborat.
Kompleks hosil qiluvchi vosita atrofida muvofiqlashtirilgan ligandlar soni uning koordinatsion sonini (c.h.) aniqlaydi. Ikkinchisi f.p o'rtasida paydo bo'ladigan s-bog'larning sonini ko'rsatadi. va ligandlar.
K.ch oʻrtasidagi bogʻliqlik. | k.o. va uning oksidlanish darajasi |
||
Oksidlanish holati | |||
Molekula c.s. elektr neytral. Ichki sfera zaryadi zaryadga teng qarama-qarshi belgi bilan tashqi. Kompleks ionning zaryadi zaryadlarning algebraik yigʻindisiga teng k.o. va ligandlar.
Kompleks birikmalarning tasnifi
1. Kompleks ion zaryadining tabiati bo'yicha
- katyonik: musbat zaryadlangan k.o atrofida koordinatsiya tufayli hosil boʻladi. neytral ligand molekulalari
Cl2; Cl3;
- anion: murakkablashtiruvchi vosita - ijobiy ionlar, xoh-
to'dalar K2 anionlari; Na2;
- neytral: neytral f.r atrofida muvofiqlashtirish natijasida hosil boʻladi. neytral ligandlar o yoki musbat zaryadlangan c.o atrofida bir vaqtning oʻzida muvofiqlashtiruvchi.
manfiy zaryadli va neytral ligandlar
2. Ligandlarning tabiati bo'yicha
Gidratlar yoki akvakomplekslar Cl3;
Ammiak SO4;
- kislota komplekslari K 2 ;
- Na gidroksokomplekslar.
3. K.o. soni boʻyicha.
Bir yadroli Cl2;
Ko'p yadroli [(NH 3 )4 Co\ / OH OH / \ Co(NH3 )4 ]Cl4.
Kompleks birikmalarni nomlash qoidalari
1) c.lar nomi. kation bilan boshlang;
2) murakkab ion nomida birinchi navbatda ligandlar, so'ngra markaziy atom ko'rsatiladi. Anion ligandlar nomlariga “o” oxiri qo‘shiladi, molekulyar ligandlar shunday deyiladi.
mos keladigan erkin molekulalar. Istisno: NH3 - amin; H2O - suv; CO - karbonil;
3) katyonik va neytral k.larda kompleks hosil qiluvchi. elementning ruscha nomi, anionda - "at" oxiri qo'shilishi bilan lotincha nomi;
4) oksidlanish darajasi k.o. arab raqami bilan belgilanadi va kiritiladi
nomidan keyin qavslar. K3 – kaliy geksanitritokobaltat (+3); Cl3 - hexaaquachromium (+3) xlorid; o - temir pentakarbonil (0).
Kompleks birikmalarning eritmadagi harakati
C.larning eritmalarida. kuchli elektrolit kabi harakat qiladi va butunlay murakkab ion va tashqi sfera ionlariga ajraladi:
Cl → + + Cl-
Murakkab ionlar teskari va bosqichma-bosqich ionlanadi: + ↔ + + NH3
+ ↔ Ag+ + NH3 yoki jami: + ↔ Ag+ + 2NH3
Kompleks ionning ionlanish muvozanat konstantasi beqarorlik konstantasi deyiladi
Uya qilish. = | |
Bu faqat birikmaning tabiatiga va haroratga bog'liq; ma'lumotnomalarda keltirilgan (6-jadvalga qarang).
4. KIMYOVIY MUVOZANAT
Kimyoviy muvozanat - bu to'g'ridan-to'g'ri va teskari reaktsiyalar tezligining tengligiga mos keladigan holat:
Bu holda Gibbs energiyasining o'zgarishi nolga teng
Go=O; DO = T Shunday qilib
Kimyoviy muvozanat holati doimiy ravishda o'zgarishsiz qoladi tashqi sharoitlar. Bu sharoitlar (harorat, bosim, kontsentratsiyalar) o'zgarganda, muvozanat qayta tiklanishi uchun buziladi, lekin yangi sharoitlarda.
Muvozanatning siljishi Le Shatelye tamoyiliga bo‘ysunadi: agar muvozanat tizimida muvozanat holatini belgilovchi shartlardan biri o‘zgartirilsa, u holda muvozanat ta’sir ta’sirini zaiflashtiradigan jarayon yo‘nalishiga siljiydi. Shunday qilib, reagentlar konsentratsiyasining oshishi bilan muvozanat ushbu reagentlarning sarflanishiga olib keladigan jarayonga o'tadi. Muvozanat tizimining bunday xatti-harakatining sababi ko'rsatilgan reagentlarning zarrachalari to'qnashuvi sonining ko'payishi bo'lib, bu oldinga yoki teskari reaktsiyaning tezlashishiga olib keladi.
Gaz tizimlarida reagentlar kontsentratsiyasining oshishi bosimning oshishi yoki tizim hajmining pasayishi bilan sodir bo'ladi. Shuning uchun tizimdagi umumiy bosimning oshishi bilan ko'proq mol gazining ishtirokida sodir bo'ladigan ikkita qaytar reaktsiyadan biri, ya'ni. muvozanat kamroq miqdordagi mol hosil bo'lishiga qarab siljiydi.
Haroratning oshishi bilan to'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi oshadi, ammo endotermik tezligi ko'proq darajada oshadi.
reaktsiyalar, chunki u yuqori harorat koeffitsientiga ega.
Vazifalar va mashqlar
4.1. Muvozanat tizimidagi H2 kontsentratsiyasining pasayishi bilan muvozanatning siljish yo'nalishini ko'rsating:
CO + H2 O↔ CO2 + H2 Yechim: CH 2 ning kamayishi bilan, Le- printsipiga ko'ra.
Chatelier, to'g'ridan-to'g'ri reaktsiya ustunlik qilishi kerak, chunki bu holda H2 miqdori ortadi va muvozanat yana tiklanadi.
4.2. Harorat va bosim ortishi bilan PC15 ↔ PC13 + C12 - 31 kJ mol-1 muvozanati qaysi tomonga siljiydi?
Yechish: Harorat ko'tarilganda muvozanat o'ngga siljiydi, chunki to'g'ridan-to'g'ri reaktsiya issiqlikning yutilishi bilan davom etadi, ya'ni. hisoblanadi
endotermik. Bosim ortishi bilan PC13 va C12 molekulalarining to'qnashuvlari soni PC15 dan ko'proq bo'ladi, shuning uchun muvozanat chapga siljiydi.
4.3. Muvozanat tizimida qanday sharoitlarda
N2 g + 3H2 g ↔ 2NH3 g + 22 kJ mol-1 NH3 ning unumini maksimal darajada oshirish mumkinmi?
Yechim: NH3 chiqishini oshirish uchun, ya'ni. muvozanatni o'ngga siljitish uchun quyidagilar zarur:
1) gaz aralashmasining bosimini oshirish, chunki bu holda to'g'ridan-to'g'ri reaktsiya tezligi ortadi, chunki Ko'proq mollar;
2) N kontsentratsiyasini oshirish 2 va H2 va NH3 konsentratsiyasini kamaytirish, uni reaktsiya sohasidan olib tashlash;
3) reaksiya aralashmasining haroratini pasaytiring, chunki haqida reaktsiya -
NH3 hosil bo'lishi ekzotermikdir.
Kimyoviy muvozanat holatining miqdoriy xarakteristikasi muvozanat konstantasi bo'lib, u massalar ta'siri qonunini aks ettiradi.
Muvozanat konstantasi Gibbs energiyasiga RTlnK munosabati bilan bog'langan
= -∆G haqida. aA + bB ↔ cC + dD jarayoni uchun konsentratsiya konstantasi
muvozanat quyidagi ko'rinishga ega: Ks = [C] c [D] d , bu erda [A], [B], [C], [D] - muvozanat [A]a [B]b
nye konsentrasiyalari mol/l; a B C D stoxiometrik koeffitsientlar.
Gaz tizimlari uchun K doimiyligini yozing | |||||||
gazlar va aralashmalarning qisman bosimlari.
Kc va Kp konstantalari elektrolitlar va noelektrolitlarning suyultirilgan eritmalaridagi va 101,3 kPa (ideal gazlar) ga yaqin bosimdagi gaz tizimlaridagi muvozanat jarayonlarini tavsiflaydi.
Konsentrlangan eritmalar va ideal bo'lmagan gazlar uchun faollik qiymatlaridan foydalanish kerak:
K a = a C ca D da A a a B b
Muvozanat konstantasi reagentlarning tabiatiga va haroratga bog'liq, ammo muvozanat tizimining tarkibiy qismlarining konsentratsiyasiga bog'liq emas.
Geterogen sistemalarda qattiq faza konsentratsiyasi muvozanat konstantasi qiymatiga kiritiladi, chunki doimiy qiymatdir.
Agar reaktsiyalar suv ishtirokidagi suvli eritmalarda davom etsa, u holda suvning konsentratsiyasi katta va doimiy bo'lib, deyarli muvozanat holatiga ta'sir qilmaydi.
Jarayonlarning muvozanat konstantalarini yozamiz: 4HC1g + O2 g ↔ 2H2 Og + 2C12 g
PH 2 | P S2 1 |
||||||||||||||
4 2 2 | |||||||||||||||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||||||||||||
Muammolarni hal qilishda aniq belgilash kerak agregatsiya holati reaksiyaga kirishuvchi moddalar, shuningdek moddalarning dastlabki kontsentratsiyasini muvozanatdan farqlash.
C muvozanati \u003d C boshlang'ich - C sarflangan
4.4. 1 mol H2 va 1 mol I2 1 l hajmli idishda 410 ° C da aralashtiriladi. Muvozanat konstantasi 48 bo‘lsa, kimyoviy muvozanat qanday konsentratsiyalarda o‘rnatilishini hisoblang?
Yechish: H 2 + I 2 ↔ 2HI
Reaksiyada H2 va I2 ning X mollari sarflangan deb faraz qilaylik. Keyin HI ning 2X mollari hosil bo'ldi, ya'ni. HI = 2 mol/l. Bu holda ==
1 - X. Keling, yozamiz: Ks = | (2x)2 | ||||
(1−x)2 |
|||||
Biz tenglamani olamiz: 44X2 - 96X + 48 = 0 Uni yechish, X = 0,776 ni olamiz. Muvozanat konsentrasiyalarini hisoblang: HI = 2X = 2 0,776 = 1,552 mol/l
1 - X \u003d 0,222 mol / l.
4.5. Qaytariladigan CO + C12 ↔ COC12 reaktsiyasida quyidagi muvozanat konsentratsiyalari (mol / l) o'rnatildi: = 0,1; = 0,4; = 4. Cravni hisoblang. va C12 va CO ning dastlabki konsentratsiyasi.
Yechish: K = | |||||

Biz dastlabki konsentratsiyalarni topamiz: Cish. = Comp. + Sizeexp. . 4 mol COC12 hosil bo'lishi uchun reaksiya tenglamasiga ko'ra, 4
mol CO va C12. Demak, dastlabki konsentratsiyalar: CCO = 0,1 + 4 = = 4,1 mol/l; CC1 2 \u003d 0,4 + 4 \u003d 4,4 mol / l.
4.6. Cgraphite + O2 g ↔ CO2 g reaktsiyasi uchun muvozanat momentidagi aralashmaning hajmli tarkibini aniqlang, agar 1300 ° C da Equn. = 0,289.
Yechim: K p \u003d P R CO 2
X CO2 miqdorini hajmli fraktsiyalarda (foizda) bildirsin. Keyin O2 tarkibi (100-X) bo'ladi. Tenglamaga almashtiring:
K \u003d 0,289 \u003d (100 X - X); X = 22,42 vol.%. O2 ning tarkibi bo'ladi
5. KIMYOVIY KINETIKA
Kimyoviy kinetika kimyoviy reaktsiyalarning tezligi va mexanizmini, shuningdek, tezlikka turli omillarning ta'sirini o'rganadi. o'rtacha tezlik kimyoviy reaksiya vaqt birligida reaktivlar konsentratsiyasining o'zgarishi bilan o'lchanadi:
V = ±C 2 - C 1,
t2−t1
bu yerda C2 va C1 moddalarning konsentratsiyasi (mol/l) t2 va t1 vaqtiga (s yoki min da) mos keladi. Geterogen tizimlar uchun tezlik o'lchanadi
qattiq fazaning birlik yuzasiga konsentratsiyaning o'zgarishi (1 sm2 yoki 1 m2).
Kimyoviy reaktsiya tezligi quyidagi asosiy omillarga bog'liq:
- reaksiyaga kirishuvchi moddalarning tabiati va holati;
- reaksiya sodir bo'ladigan muhitning tabiati;
katalizator;
- reaksiyaga kirishuvchi moddalarning kontsentratsiyasi va gazlar va bosim uchun;
Haroratlar.
Moddalarning kimyoviy faolligi atomlar yoki molekulalarning tuzilishiga, molekula ichidagi va molekulalararo bog'lanishlarning tabiatiga bog'liq. Radikallar eng yuqori faollikka ega, u ionlar va molekulalar uchun biroz pastroq. Reagentlarning agregat holati va disperslik darajasi ham katta ahamiyatga ega emas.
Deyarli har doim moddalar muhit (erituvchi) bilan reaksiyaga kirishib, solvatlar (gidratlar) hosil qiladi. Bundan tashqari, hal qiluvchi katalitik ta'sirga ega bo'lishi mumkin.
Katalizatorlar, odatda, yo'llarini o'zgartirib, kimyoviy reaktsiyalarni tezlashtiradi. Bunday holda, yangi reaktsiya yo'li pastroq faollashuv energiyasiga to'g'ri keladi. Faollanish energiyasi (Ea) - reaksiyaga kirishuvchi moddalarning zarralari o'zaro ta'sirni amalga oshirish uchun bo'lishi kerak bo'lgan minimal energiya. Ea qiymati moddalarning kimyoviy tabiati bilan belgilanadi.
Kimyoviy reaksiya tezligiga kontsentratsiya, bosim va haroratning ta'sirini aniqlash mumkin.
Harakat qiluvchi massalar qonuni kimyoviy reaksiya tezligining reaksiyaga kirishuvchi moddalar kontsentratsiyasiga bog'liqligini ifodalaydi: reaksiya tezligi reaksiyaga kirishuvchi moddalar kontsentratsiyasiga ularning stexiometrik koeffitsientlari kuchiga ko'tarilgan to'g'ridan-to'g'ri proportsionaldir. Reaktsiya uchun
aA + vV → S V = KCA a CB b,

bu erda CA va CB - A va B reaktivlarining molyar konsentratsiyasi;
a va b - A va B uchun stexiometrik koeffitsientlar;
Kimga - moddalar tabiatining ta'sirini aks ettiruvchi ushbu reaksiyaning tezlik konstantasi. Bu haroratga bog'liq, lekin moddalarning konsentratsiyasiga bog'liq emas.
Gaz tizimlari uchun kontsentratsiyalar o'rniga siz qiymatdan foydalanishingiz mumkin
Biz qisman bosimlar: V = KPA a PB b.
Geterogen tizimlarda kristall moddalarning kontsentratsiyasi doimiy qiymatlar bo'lib, tezlik konstantasiga kiradi. Reaksiyaga kirishuvchi moddalar kontsentratsiyasi ortishi bilan reaksiya tezligining ortishi sababini zarrachalar to‘qnashuvlarining umumiy sonining ko‘payishi, demak, faol to‘qnashuvlar sonining ko‘payishi bilan izohlash mumkin. Quyidagi reaksiyalar tezligi uchun ifodalarni yozamiz:
a) 2H2 g + O2 g \u003d 2H2 Og
V=KC | V=KP | |||||
b) CaOcr + CO2 g \u003d CaCO3 kr | ||||||
V=KCCO2 | V = KPCO 2 | |||||
c) FeCl3 eritmasi + 3KSCN p-p = Fe(SCN)3 p-p | V = KC FeCl3 C 3 KSCN |
|||||
d) 2AgCO3 kr | V=K |
|||||
→ 2Agcr + 2CO2 g + O2 g |
||||||
Massalar ta'siri qonuni faqat kichik tartib va molekulyarlikka ega bo'lgan oddiy reaktsiyalar uchun amal qiladi.
Reaksiya tartibi deganda massalar ta'siri qonunini ifodalashda konsentratsiyalardagi ko'rsatkichlar yig'indisi tushuniladi. Reaktsiya molekulyarligi o'zaro ta'sir qilish aktida ishtirok etuvchi molekulalarning minimal soni bilan belgilanadi. Molekulyarligi asosida reaksiyalar bir molekulyar (monomolekulyar), ikki molekulyar (bimolekulyar) va uch molekulyar (trimolekulyar) ga bo'linadi. Yuqori molekulyar reaksiyalar kam uchraydi, chunki bunday reaksiyalar bir necha bosqichda boradi.
Bir molekulyar reaksiyalarga parchalanish va molekula ichidagi qayta joylashish reaksiyalari kiradi, ular uchun V = K·C. Ikki molekulyar reaktsiyalarga ikkita molekula to'qnashganda o'zaro ta'sir sodir bo'ladigan reaktsiyalar kiradi, ular uchun V \u003d K C1 C2; uch molekulyar reaksiyalar uchun V = K·C1 ·C2 ·C3 . Reaksiya tartibi asosida birinchi, ikkinchi va uchinchi tartiblar, shuningdek, nol va kasrlar mavjud.
uchinchi tartib V = K·C3 , V = K·C1 2 ·C2 , V = K·C1 ·C2 2 .
Agar moddaning konsentratsiyasi butun jarayon davomida o'zgarmasa va tezligi doimiy qiymat bo'lsa, reaktsiyalar nol tartibli bo'ladi. Bu heterojen tizimlarda mumkin kristalli modda sirt bilan o'zaro ta'sir qiladi va konsentratsiya saqlanib qoladi doimiy qiymat. Nol tartibli reaksiya uchun V = K·Co . Agar jarayon bir necha bosqichda sodir bo'lsa, ularning har biri ahamiyatsiz tezlikka ega bo'lsa, reaksiya kasr tartibiga ega.
Vazifalar va mashqlar
5.1. Reaksiyaning molekulyarligini va tartibini aniqlang:
S12 g + 2NOg = 2NOClg
Yechish: Reaksiyaga 1 mol C12 va 2 mol NO kiradi, shuning uchun ko'rsatilgan reaksiya trimolekulyardir. Aniqlash tartibi
tenglamadan foydalanamiz: V = KCCl 2 C2 NO. Javob uchinchi darajali.
5.2. Temir (II) gidroksidning 0,02 M H2SO4 da K = 40 da erish tezligini hisoblang.Reaksiyaning molekulyarligi va tartibini aniqlang.
Yechish: Reaksiya tenglama bo‘yicha boradi:
Fe(OH)2 cr + H2 SO4 p-p = FeSO4 p-p + 2H2 Ozh
V \u003d KCH 2 SO 4, chunki Fe (OH) 2 kristall fazada. Reaksiyaning molekulyarligi 2, tartibi 1. Reaksiya tezligini hisoblang:
V \u003d 40 0,02 \u003d 0,8 mol / min l.
5.3. 1 mol SnCl ni o'z ichiga olgan eritmada 2 va 2 mol FeCl3 bo'lsa, reaktsiya tenglama bo'yicha davom etadi:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
Reaksiyadan keyin reaksiya tezligi necha marta kamayadi
ruet 0,65 mol SnCl2?
Yechish: Dastlabki reaksiya tezligini hisoblang
0,65 mol SnCl2 reaksiyaga kirgach, konsentratsiyalar shunday bo'ladi
quyidagi qiymatlarga ega: SSnCl2 = 1 - 0,65 = 0,35 mol/l; SFeCl3 = = 2 - 1,3 = 0,7 mol/l. Bunday holda, reaktsiya tezligi quyidagicha bo'ladi:
V1 = K 0,35 0,72 = 0,17 K.
Tezlik nisbati | |||||
5.4. Agar gaz aralashmasining hajmi ikki baravar kamaytirilsa, CO2 + C12 g = COC12 g reaksiya tezligi qanday o'zgaradi?
Yechish: Dastlabki reaksiya tezligi:
Vo = K CCO CC1 2. Hajmining yarmi kamayishi bilan, barcha konsentratsiyalar
komponentlar ikki barobar ortadi va tezlikni quyidagicha hisoblash mumkin: V 1= K 2C CO2C Cl2 = 4KC COC Cl2
Hajmi 2 marta kamayishi bilan reaksiya tezligi 4 marta oshishi aniq.
Haroratning kimyoviy reaksiya tezligiga ta'siri ham miqdoriy jihatdan aniqlanadi. Haroratning oshishi bilan har qanday reaktsiyalar tezligi oshadi, bu energiya Ea faollashuv energiyasiga yetadigan yoki undan yuqori bo'lgan faol zarralar sonining ko'payishi bilan izohlanadi. Reaksiya tezligi konstantasining haroratga bog'liqligi quyidagicha ifodalanadi
Arrhenius tenglamasi: 2.303 lg | |||||||||
Bu erda K1 va K2 | mutlaq uchun bu reaksiyaning tezlik konstantalari |
||||||||
harorat T1 va T2; | |||||||||
Ea | - faollashtirish energiyasi; | ||||||||
gaz konstantasi hisoblanadi. | |||||||||
Amalda, hisob-kitoblar uchun Vant-Xoff qoidasi qo'llaniladi, unga ko'ra, harorat 10 ° ga ko'tarilganda, reaktsiya tezligi yoki tezlik konstantasi 2-4 marta ortadi.
Vt 2 | Kt 2 | t2 − t1 | ||||||
= g 10, |
||||||||
bu erda Vt1 va Vt2 | t1 va t2 haroratlarda reaksiya tezligi; |
|||||||
Kt1, Kt2 | tezlik konstantalari; | |||||||
γ harorat koeffitsienti hisoblanadi.
Vant-Xoff qoidasi Arrhenius tenglamasidan kamroq aniq natijalar beradi, chunki g ni faqat kichik harorat oralig'ida doimiy deb hisoblash mumkin. Noorganik reaksiyalar uchun g = 2-4, fermentativ reaksiyalar uchun g = 7-8.
5.5. HI ning 356-376o S harorat oralig'ida parchalanish tezligining harorat koeffitsienti 2. Bu reaksiyaning 376o S da tezlik konstantasini hisoblang, agar 356o S da 8,09·10-5 bo'lsa.
Yechim: | Qoidaning matematik ifodasini yozamiz |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van't Xoff: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V 376 | K 376 | 376− 356 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
= g 10 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.7. Pestitsid suvda 25°C da 10 kun davomida parchalanadi. Kimyoviy parchalanish reaksiyasining harorat koeffitsienti 3 ga teng bo'lsa, zaharlangan suv 1 soatdan keyin zararsiz bo'lib qolishi uchun uni qanday haroratda saqlash kerak?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bir xil qiymatga ega bo'lgan atomdagi elektronning holatlar to'plami n chaqirdi energiya darajasi. Elektronlar atomning asosiy holatida bo'lgan darajalar soni element joylashgan davrning soniga to'g'ri keladi. Ushbu darajalarning raqamlari raqamlar bilan ko'rsatilgan: 1, 2, 3, ... (kamroq - harflar bilan). K, L, M, ...).
Energiya pastki darajasi- atomdagi elektronning kvant sonlarining bir xil qiymatlari bilan tavsiflangan energiya holatlari to'plami n va l. Pastki darajalar harflar bilan belgilanadi: s, p, d, f...Birinchi energetik sathida bitta pastki daraja, ikkinchisi - ikkita pastki daraja, uchinchisi - uchta pastki daraja va boshqalar mavjud.
Agar diagrammada orbitallar hujayralar (kvadrat ramkalar) va elektronlar o'qlar (yoki ↓) sifatida belgilangan bo'lsa, unda siz asosiy kvant soni energiya darajasini (EI), asosiy va orbital kvantning kombinatsiyasini tavsiflashini ko'rishingiz mumkin. raqamlar - energiya pastki darajasi (EPL), asosiy, orbital va magnit kvant sonlari to'plami - atom orbitali, va barcha to'rt kvant soni elektrondir.
Har bir orbital ma'lum energiyaga mos keladi. Orbitalning belgilanishi energiya darajasining raqamini va tegishli pastki darajaga mos keladigan harfni o'z ichiga oladi: 1 s, 3p, 4d va h.k. Har bir energiya darajasi uchun, ikkinchidan boshlab, uchta teng energiya mavjudligi p orbitallar uchta o'zaro perpendikulyar yo'nalishda joylashgan. Har bir energiya darajasida, uchinchidan boshlab, beshtasi mavjud d-to'rt bargli shakldagi murakkabroq orbitallar. To'rtinchi energiya darajasidan boshlab, yanada murakkab shakllar paydo bo'ladi. f-orbitallar; Har bir darajada yettita bor. Ustida elektron zaryadi taqsimlangan atom orbital ko'pincha elektron bulut deb ataladi.
12-savol.
Gorizontal davriylik
Bunday jismoniy xususiyatlar, ionlanish energiyasi va elektronga yaqinlik sifatida, oxirgi energiya pastki sathlarida elektronlar sonining davriy o'zgarishi bilan bog'liq bo'lgan gorizontal davriylik ham namoyon bo'ladi:
13-savol.
14-savol.
Atomning magnit xususiyatlari
Elektron o'zining magnit momentiga ega bo'lib, u qo'llaniladigan magnit maydonga parallel yoki qarama-qarshi yo'nalishda kvantlangan. Agar bir xil orbitalni egallagan ikkita elektron qarama-qarshi yo'naltirilgan spinlarga ega bo'lsa (Pauli printsipiga ko'ra), ular bir-birini bekor qiladi. Bunda elektronlar juftlashgan deyiladi. Faqat juftlashgan elektronlari bo'lgan atomlar magnit maydondan tashqariga suriladi. Bunday atomlar diamagnit deyiladi. Bir yoki bir nechta juftlashtirilmagan elektronga ega bo'lgan atomlar magnit maydonga tortiladi. Ular diamagnetik deb ataladi.
Atomning o'zaro ta'sirining intensivligini tavsiflovchi atomning magnit momenti magnit maydon, juftlanmagan elektronlar soniga amalda proportsionaldir.
Xususiyatlari elektron tuzilma atomlar turli elementlar ionlanish energiyasi va elektronga yaqinlik kabi energetik xususiyatlarda aks etadi.
Ionizatsiya energiyasi
Atomning ionlanish energiyasi (potentsial). Ei tenglamaga ko'ra elektronni atomdan cheksizgacha olib tashlash uchun zarur bo'lgan minimal energiya
X = X + + e− . Uning qiymatlari davriy tizimning barcha elementlarining atomlari uchun ma'lum. Masalan, vodorod atomining ionlanish energiyasi elektronning 1 dan o'tishiga to'g'ri keladi s- energiya pastki darajasi (−1312,1 kJ/mol) nol energiya bilan pastki darajaga va +1312,1 kJ/mol ga teng.
Atomlarning bir elektronning olib tashlanishiga mos keladigan birinchi ionlanish potentsiallarining o'zgarishida davriylik atomning tartib raqamining ortishi bilan aniq ifodalanadi:
Davr bo'ylab chapdan o'ngga harakat qilganda, ionlanish energiyasi, umuman olganda, asta-sekin o'sib boradi, guruh ichidagi seriya raqamini ko'paytirish bilan birga, u kamayadi. Minimal birinchi ionlanish potentsiallari mavjud ishqoriy metallar, maksimal - asil gazlar.
Xuddi shu atom uchun ikkinchi, uchinchi va keyingi ionlanish energiyalari doimo ortadi, chunki elektronni musbat zaryadlangan iondan ajratish kerak. Masalan, litiy atomi uchun birinchi, ikkinchi va uchinchi ionlanish energiyalari mos ravishda 520,3, 7298,1 va 11814,9 kJ/mol.
Elektronlarning ajralish ketma-ketligi odatda minimal energiya printsipiga muvofiq orbitallarning elektronlar tomonidan populyatsiyasi ketma-ketligiga teskari bo'ladi. Biroq, to'ldirilgan elementlar d-orbitallar bundan mustasno - birinchi navbatda ular yo'qotmaydi d-, a s-elektronlar.
elektronga yaqinlik
Atomning elektronga yaqinligi A e - atomlarning qo'shimcha elektronni biriktirish va manfiy ionga aylanish qobiliyati. Elektron yaqinligining o'lchovi jarayonda chiqarilgan yoki so'rilgan energiyadir. Elektron yaqinligi manfiy ionning ionlanish energiyasiga teng X - : X - = X + e −
Galogen atomlari eng yuqori elektron yaqinligiga ega. Masalan, ftor atomi uchun elektron qo'shilishi 327,9 kJ/mol energiya ajralishi bilan birga keladi. Bir qator elementlar uchun elektronning yaqinligi nolga yaqin yoki manfiy, ya'ni bu element uchun barqaror anion yo'q.
Odatda, turli elementlarning atomlari uchun elektron yaqinligi ularning ionlanish energiyasining ortishi bilan parallel ravishda kamayadi. Biroq, ayrim juft elementlar uchun istisnolar mavjud:
Buni birinchi atomlarning kichikroq o'lchamlari va ulardagi elektron-elektron repulsiyasining kattaligi asosida tushuntirish mumkin.
15-savol.
16-savol.
Gorizontal davriylik
Gorizontal davriylik xususiyatlarning maksimal va minimal qiymatlarining paydo bo'lishidan iborat oddiy moddalar va har bir davr ichidagi aloqalar. Bu, ayniqsa, VIIIB guruh elementlari va lantanidlar uchun seziladi (masalan, toq raqamlarga qaraganda juft seriyali lantanidlar ko'proq uchraydi).
Ionlanish energiyasi va elektronga yaqinlik kabi jismoniy xususiyatlarda gorizontal davriylik ham namoyon bo'ladi, bu oxirgi energiya pastki darajalarida elektronlar sonining davriy o'zgarishi bilan bog'liq.






