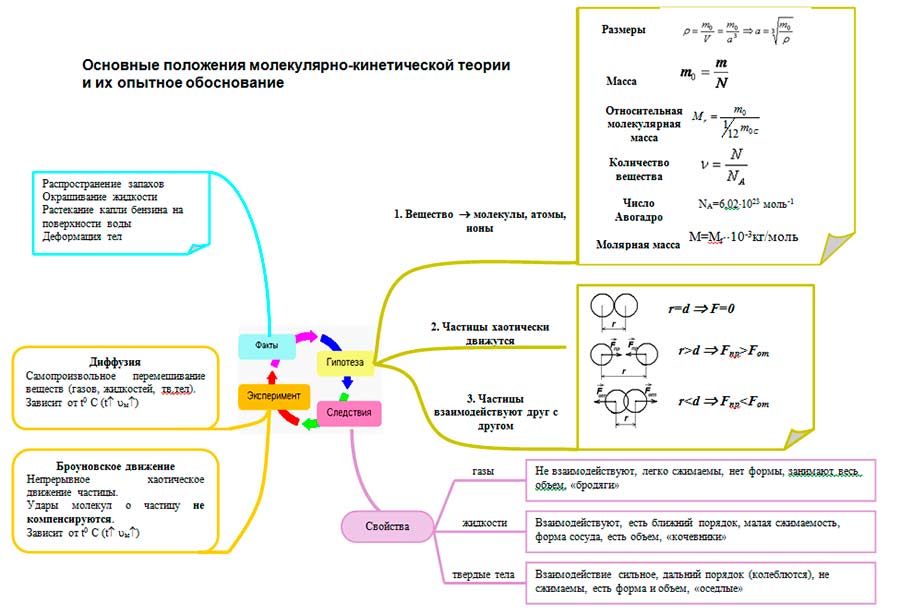
Molekulyar kinetikaning asosiy qoidalarini tuzing. Barcha jismlar zarrachalardan - atomlardan, molekulalardan, ionlardan iborat. Molekulyar kinetik nazariyaning asosiy qoidalari
Molekulyar kinetik nazariyaning asosiy qoidalari
Molekulyar fizikaning asosiy vazifasi nimadan iborat? Molekulyar kinetik nazariya nima? Molekulyar-kinetik nazariyaning asosiy qoidalarini tuzing. Qanday kuzatishlar va tajribalar molekulyar kinetik nazariyaning asosiy qoidalarini tasdiqlaydi? Molekula nima? atom?
Molekulyar fizikaning asosiy vazifasi nimadan iborat? Barcha jismlar alohida, tasodifiy harakatlanuvchi zarrachalardan iborat degan fikrga asoslanib, makroskopik jismlarning xossalarini va ularda sodir bo‘ladigan issiqlik jarayonlarini tushuntiring.
Molekulyar kinetik nazariya nima? Molekulyar-kinetik nazariya (MKT) - moddaning tuzilishini uchta asosiy taxminan to'g'ri qoidalar nuqtai nazaridan ko'rib chiqadigan nazariya.
Molekulyar-kinetik nazariyaning asosiy qoidalarini tuzing. barcha jismlar zarrachalardan iborat bo'lib, ular orasida bo'shliqlar mavjud zarralar doimiy tartibsiz harakatda zarralar bir-biri bilan o'zaro ta'sir qiladi.
Qanday kuzatishlar va tajribalar molekulyar kinetik nazariyaning asosiy qoidalarini tasdiqlaydi? Diffuziya Braun harakati Dunoyer va Stern tajribalari
Molekula nima? atom? Molekula - mustaqil zarracha, barcha kimyoviy moddalarga ega bo'lgan har qanday moddaning majburiy komponenti jismoniy xususiyatlar bu modda. Har qanday molekula eng oddiy mustaqil zarrachalar - atomlardan iborat. Atom - eng oddiy zarralarning eng kichik zarrasi kimyoviy moddalar elementlar deb ataladi.
Molekulyar kinetik nazariyaning asosiy qoidalari har tomonlama eksperimental tekshiruvdan o'tkazildi. Moddaning molekulyar tuzilishini ko'rsatuvchi va molekulyar kinetik nazariyani tasdiqlovchi eng mashhur tajribalar 1911 va 1920 yillarda o'tkazilgan Dunoyer tajribasi va Otto Shtern tajribasi (1888 - 1969) hisoblanadi. Ushbu tajribalarda turli metallarning bug'lanishi natijasida molekulyar nurlar yaratilgan va shuning uchun o'rganilayotgan gazlarning molekulalari bu metallarning atomlari edi. Bunday tajribalar molekulyar-kinetik nazariyaning bashoratlarini tekshirishga imkon berdi, u molekulalarini gazlar holati uchun beradi. moddiy nuqtalar, ya'ni bir atomli gazlar uchun.
Dunoyer tajribasi Molekulyar nurlar bilan Dunoyer tajribasining sxemasi rasmda ko'rsatilgan. 1. Materiali yuqori vakuumni ta'minlaydigan tarzda tanlangan shisha idish diafragma 4 bo'lgan ikkita bo'linma bilan uchta bo'linma 1, 2 va 3 ga bo'lingan. 1-bo'limda gaz bor edi. bu tajriba uni isitish natijasida olingan natriy bug'idan foydalanilgan. Bu gazning molekulalari diafragma teshiklari orqali erkin uchib, molekulyar nurni 5 kollimatsiya qilish, ya'ni uni faqat kichik qattiq burchak ostida o'tkazish imkonini beradi. 2 va 3-bo'limlarda natriy atomlari havo molekulalari bilan to'qnashmasdan uchib o'tishi uchun juda yuqori vakuum yaratilgan. Tarqalmagan molekulyar nur tomirning so'nggi devorida 6 iz qoldirdi.Lekin o'ta yuqori vakuum holatida ham molekulyar nur diafragma 4 chetlarida tarqalib ketgan.Shuning uchun oxirida "penumbra" mintaqasi 7 mavjud edi. tomir devori, unda tarqalib ketgan zarralar iz qoldirgan. 3-bo'limdagi vakuum yomonlashgani sababli, 7-hudud oshdi. Tarqalgan natriy atomlari izining bulg'anishining kattaligidan ularning erkin yo'lining uzunligini taxmin qilish mumkin edi. Bunday hisob-kitoblarni Maks Born (1882 - 1970) Dunoyernikiga o'xshash tajribalar natijalariga ko'ra qilgan.
Otto Shternning tajribasi Molekulyar nurlar bilan o'tkazilgan eng mashhur tajribalardan biri bu Stern tajribalari bo'lib, unda birinchi marta molekulyar tezliklarni to'g'ridan-to'g'ri o'lchashni amalga oshirish mumkin edi. Stern tajribasining eng mashhur sxemasi rasmda ko'rsatilgan. 2. Bir tomchi kumush qo'yilgan platina ipi 1 ikkita koaksiyal tsilindr 2 va 3 o'qida joylashgan va 2 silindrda uning o'qiga parallel bo'lgan tirqish bor edi. Tsilindrlar o'z o'qi atrofida aylanishi mumkin edi. Shtern tajribalarida ularning aylanish burchak tezligi daqiqada 2...3 ming aylanishni tashkil etdi. Platinali ipdan o'tkazilganda elektr toki u qizib ketdi maksimal harorat taxminan 1200 oS. Natijada kumush bug'lana boshladi, uning atomlari 2-silindrning 4-teshigidan uchib o'tib, 3-silindr yuzasiga joylashdi va unda ularning to'g'ri chiziqli taqsimlanishiga mos keladigan 5-sonli iz qoldirdi. Tsilindrlarning aylanishi silindrlar bilan bog'langan mos yozuvlar ramkasida molekulalar traektoriyasining egriligiga va natijada tashqi silindrga joylashadigan kumush atomlari holatining o'zgarishiga olib keldi. O'rnashgan molekulalarning zichligini tahlil qilib, molekulalarning tezlik bo'yicha taqsimlanish xususiyatlarini, xususan, yo'lning chekkalariga mos keladigan maksimal va minimal tezliklarni, shuningdek, maksimalga mos keladigan eng katta tezlikni topish mumkin edi. cho'kma molekulalarning zichligi.
Guruch. 1 - Dunoyer tajribasi sxemasi 1 - gaz bilan to'ldirilgan bo'lim 2 va 3 - o'ta yuqori vakuumli bo'limlar 4 - diafragmali bo'limlar 5 - molekulyar nur 6 - tarqalmagan nurning izi 7 - tarqoq molekulalar izi
2-rasm - Stern tajribasining sxemasi 1 - molekulalar manbai 2 va 3 - aylanadigan silindrlar 4 - molekulyar nurni cheklovchi tirqish 5 - molekulyar nurning izi
Diffuziya Diffuziya - bir modda molekulasining boshqa modda molekulalari orasiga o'zaro kirib borishi hodisasi. Diffuziya gazlarda (juda tez), suyuqliklarda (tez), metallarda (juda sekin) sodir bo'lishi mumkin.
Broun harakati Broun harakati suyuqlik yoki gazda muallaq turgan zarrachalarning issiqlik harakatidir. Broun harakatining sabablari quyidagilardir: 1. Molekulalarning tasodifiy harakati 2. Ular tomonidan ishlab chiqarilgan bosimning o'rtacha qiymatidan chetga chiqish. Quyidagilar aniqlangan: 1. Braun harakati har qanday t da amalga oshiriladi va cheksiz davom etadi. 2. Braun zarralari tasodifiy traektoriyalar qiladi. 3. Broun zarrasi harakatining tabiati uning tabiatiga bog'liq emas Broun harakati molekulalarning tasodifiy harakatining bevosita dalilidir.
Bizni turli xil narsalar o'rab oladi. Biz ular qattiq yoki suyuqlik yoki gaz ekanligini ko'rishimiz mumkin. Bizni o'rab turgan hamma narsa haqida juda ko'p savollar bor. Ko'p savollarga javob beradi molekulyar kinetik nazariya.
Molekulyar-kinetik nazariya - ma'lum bir moddaning atomlari va molekulalarining xususiyatlarini, ularning o'zaro ta'siri va harakatini o'rganishga asoslangan moddaning kuzatilgan va o'lchanadigan xususiyatlarini tavsiflash uchun ishlatiladigan qarashlar yig'indisidir.
Molekulyar kinetik nazariyaning asosiy qoidalari
Barcha jismlar zarrachalardan - atomlardan, molekulalardan, ionlardan iborat.
Barcha zarralar uzluksiz xaotik termal harakatda.
Har qanday jismning zarralari o'rtasida o'zaro ta'sir kuchlari - tortishish va itarish kuchlari mavjud.
Shunday qilib, molekulyar-kinetik nazariyada o'rganish ob'ekti ko'p sonli zarralardan tashkil topgan tizim - makrotizim. Bunday tizimning harakatini tushuntirish uchun mexanika qonunlari qo'llanilmaydi. Shuning uchun asosiy tadqiqot usuli hisoblanadi statistik usul materiyaning xususiyatlarini o'rganish.
Hodisalarni tushuntirish va bashorat qilish uchun bilish muhimdir molekulalarning asosiy xususiyatlari:
- O'lchamlari

Molekulaning o'lchamini taxmin qilish, qattiq yoki qattiq moddalarning zichligiga qarab, bitta molekulani o'z ichiga olgan kubning o'lchami sifatida amalga oshirilishi mumkin. suyuq moddalar va bitta molekulaning massasi:

- Molekulalar massasi
Bir moddaning massasining nisbati m molekulalar soniga N ushbu moddada:
- Nisbiy molekulyar og'irlik
Berilgan moddaning molekulasi (yoki atomi) massasining uglerod atomi massasining 1/12 qismiga nisbati:
- Moddaning miqdori
Moddaning miqdori zarrachalar sonining nisbatiga teng N tanadagi (atomlar - atom moddada, molekulalar - molekulada) moddaning bir molidagi molekulalar soniga NLEKIN:

- Avogadro doimiy
1 mol modda tarkibidagi molekulalar soni.
- Molyar massa
Moddaning molyar massasi - 1 mol miqdorida olingan moddaning massasi.
DA xalqaro tizim Bir moddaning molyar massasi bilan ifodalanadi kg/mol.
- O'zaro ta'sir (tajribaga asoslangan miqdoriy)

Molekulalarning o'zaro ta'siri bir vaqtning o'zida ham tortishish, ham itarilish bilan tavsiflanadi: masofalarda r
Molekulyar kinetik nazariya moddaning nima uchun gazsimon, suyuq va qattiq holatda bo'lishi mumkinligini tushunishga imkon beradi. MKT nuqtai nazaridan agregatsiya holatlari jihatidan farqlanadi molekulalar orasidagi o'rtacha masofaning qiymati va molekulalarning bir-biriga nisbatan harakatining tabiati.
Molekulyar kinetik nazariyaning asosiy qoidalari turli fizik tajribalar bilan bir necha bor tasdiqlangan. Masalan, tadqiqot:
A) diffuziya
B) Braun harakati
Qisqacha xulosa
Molekulyar-kinetik nazariya jismlarning tuzilishi va xossalarini atomlar, molekulalar va ionlarning harakati va oʻzaro taʼsiri asosida tushuntiradi. MKT ga asoslanadi uchta pozitsiya, ular eksperimental va nazariy jihatdan to'liq tasdiqlangan:
1) barcha jismlar zarrachalardan - molekulalardan, atomlardan, ionlardan iborat;
2) zarralar uzluksiz xaotik issiqlik harakatida bo'ladi;
3) har qanday jismning zarralari orasida o'zaro ta'sir kuchlari - tortishish va itarish kuchlari mavjud.
Moddaning molekulyar tuzilishi elektron mikroskopda molekulalarning bevosita kuzatilishi, shuningdek, qattiq moddalarning suyuqliklarda erishi, moddaning siqilishi va o‘tkazuvchanligi bilan tasdiqlanadi. Issiqlik harakati - Broun harakati va diffuziya. Molekulyar o'zaro ta'sir kuchi va elastikligi mavjudligi qattiq moddalar, sirt tarangligi suyuqliklar.
Dars uchun ma'lumotnoma rejasi:
"Molekulyar kinetik nazariyaning asosiy qoidalari va ularning eksperimental asoslanishi" blokida o'z-o'zini nazorat qilish uchun savollar.
- Molekulyar-kinetik nazariyaning asosiy qoidalarini tuzing.
- Qanday kuzatishlar va tajribalar molekulyar kinetik nazariyaning asosiy qoidalarini tasdiqlaydi?
- Molekula nima? atom?
- Nisbiy molekulyar og'irlik deb nimaga aytiladi? Ushbu tushuncha qaysi formulada ifodalanadi?
- Moddaning miqdori qancha? Ushbu tushuncha qaysi formulada ifodalanadi? Moddaning miqdor birligi nima?
- Avogadro doimiysi nima deb ataladi?
- Moddaning molyar massasi nimaga teng? Ushbu tushunchaning ma'nosi qaysi formulada ifodalanadi? Birlik nima molyar massa?
- Molekulalararo kuchlarning tabiati qanday?
- Molekulyar kuchlarning xossalari qanday?
- O'zaro ta'sir kuchlari ular orasidagi masofaga qanday bog'liq?
- Gazlar, suyuqliklar va qattiq jismlardagi molekulalarning harakati xarakterini aytib bering.
- Gazlar, suyuqliklar va qattiq jismlarda zarrachalarning qadoqlanishi qanday xususiyatga ega?
- Gazlar, suyuqliklar va qattiq jismlardagi molekulalar orasidagi o'rtacha masofa qancha?
- Gazlar, suyuqliklar, qattiq jismlarning asosiy xossalarini sanab bering.
- Braun harakati nima deb ataladi?
- Braun harakati nimani ko'rsatadi?
- Diffuziya deb nimaga aytiladi? Gazlar, suyuqliklar va qattiq moddalardagi diffuziyaga misollar keltiring.
- 18. Diffuziya tezligi jismlarning haroratiga qanday bog'liq?
TA'RIF
Atom - berilganning eng kichik zarrasi kimyoviy element. Tabiatda mavjud bo'lgan barcha atomlar Mendeleyevning davriy elementlar tizimida ifodalangan.
Atomlar molekulaga birlashadi kimyoviy bog'lanishlar shunga asosan elektr o'zaro ta'siri. Molekuladagi atomlar soni har xil bo'lishi mumkin. Molekula bir, ikki, uch va hatto bir necha yuz atomdan iborat bo'lishi mumkin.
TA'RIF
Molekula- ma'lum bir moddaning kimyoviy xossalariga ega bo'lgan eng kichik zarrasi.
Molekulyar kinetik nazariya- atom va molekulalarning mavjudligi haqidagi kontseptsiyaga asoslangan moddaning tuzilishi va xossalari haqidagi ta'limot.
Molekulyar kinetik nazariyaning asoschisi M.V. Lomonosov (1711-1765), uning asosiy qoidalarini shakllantirgan va ularni turli xil issiqlik hodisalarini tushuntirish uchun qo'llagan.
Molekulyar kinetik nazariyaning asosiy qoidalari
AKTning asosiy qoidalari:
- tabiatdagi barcha jismlar eng kichik zarrachalardan (atom va molekulalardan) iborat;
- zarralar doimiy xaotik harakatda bo'lib, bu termal deyiladi;
- zarralar bir-biri bilan o'zaro ta'sir qiladi: zarralar orasidagi masofaga bog'liq bo'lgan zarralar o'rtasida tortishish va qaytarish kuchlari ta'sir qiladi.
Molekulyar kinetik nazariya ko'plab hodisalar bilan tasdiqlangan.
Har xil suyuqliklarning aralashishi, qattiq moddalarning suyuqliklarda erishi har xil turdagi molekulalarning aralashishi bilan izohlanadi. Bunday holda, aralashmaning hajmi uning tarkibiy qismlarining umumiy hajmidan farq qilishi mumkin. bu molekulyar birikmalarning turli o'lchamlarini ko'rsatadi.
TA'RIF
Diffuziya- ikki yoki undan ortiq qo'shni moddalarning bir-biriga kirib borishi hodisasi.
Diffuziya eng intensiv gazlarda boradi. Hidlarning tarqalishi diffuziyaga bog'liq. Diffuziya molekulalarning doimiy xaotik harakatda ekanligini ko'rsatadi. Shuningdek, diffuziya hodisasi molekulalar orasidagi bo'shliqlar mavjudligini ko'rsatadi, ya'ni. materiya diskretdir.
TA'RIF
Braun harakati- suyuqlik yoki gazda to'xtatilgan eng kichik mikroskopik zarrachalarning issiqlik harakati.
Bu hodisani birinchi marta ingliz botaniki R.Braun 1827-yilda kuzatgan.Suvda muallaq turgan gul changlarini mikroskop orqali kuzatar ekan, har bir gulchang zarrasi maʼlum masofada tez tasodifiy harakatlar qilishini koʻrdi. Shaxsiy harakatlar natijasida har bir gulchang zarrasi zigzag traektoriyasi bo'ylab harakat qildi (1a-rasm).
1-rasm. Broun harakati: a) suyuqlikda muallaq turgan alohida zarrachalarning harakat traektoriyalari; b) suyuqlik molekulalari tomonidan impulsning to'xtatilgan zarrachaga o'tishi.
Turli suyuqliklarda va turli qattiq zarralar bilan Broun harakatining keyingi tadqiqotlari shuni ko'rsatdiki, bu harakat kuchayib boradi, zarrachalar hajmi qanchalik kichik bo'lsa va tajriba harorati shunchalik yuqori bo'ladi. Bu harakat hech qachon to'xtamaydi va hech qanday tashqi sabablarga bog'liq emas.
R.Braun kuzatilgan hodisani tushuntirib bera olmadi. Broun harakati nazariyasi 1905 yilda A. Eynshteyn tomonidan qurilgan va fransuz fizigi J. Perren (1900-1911) tajribalarida eksperimental tasdiqni olgan.
Doimiy xaotik harakatda bo'lgan suyuqlik molekulalari muallaq zarracha bilan to'qnashganda unga qandaydir impuls o'tkazadi (1-rasm, b). Zarracha holatida katta o'lchamlar unga har tomondan hujum qiladigan molekulalar soni ko'p, ularning ta'siri har bir vaqtning har bir daqiqasida qoplanadi va zarracha amalda harakatsiz qoladi. Agar zarrachalar hajmi juda kichik bo'lsa, molekulalarning ta'siri qoplanmaydi - bir tomondan u urishi mumkin. Ko'proq molekulalar boshqasiga qaraganda, buning natijasida zarracha harakatlana boshlaydi. Broun zarralari molekulalarning tasodifiy ta'siri ostida aynan shunday harakatni amalga oshiradi. Broun zarralari alohida molekulalarning massasidan milliardlab marta katta bo'lishiga va juda past tezlikda (molekulalarning tezligiga nisbatan) harakatlanishiga qaramasdan, ularning harakatini hali ham mikroskop ostida kuzatish mumkin.
Muammoni hal qilishga misollar
MISOL 1
2-MISA
Molekulyar kinetik nazariya kimyoviy moddalarning eng kichik zarralari sifatida atomlar va molekulalarning mavjudligi haqidagi g'oyaga asoslangan materiyaning tuzilishi va xususiyatlari haqidagi ta'limot deb ataladi.
Molekulyar kinetik nazariyaga asoslanadi uchta asosiy nuqta:
1.
Barcha moddalar - suyuq, qattiq va gazsimon - o'zlari atomlardan tashkil topgan eng kichik zarralar - molekulalardan hosil bo'ladi.
Molekulalar va atomlar elektr neytral zarralardir. Muayyan sharoitlarda molekulalar va atomlar qo'shimcha olishlari mumkin elektr zaryadi va musbat yoki manfiy ionlarga aylanadi.
2. Atomlar va molekulalar doimiy xaotik harakatda.
3. Zarralar bir-biri bilan tabiatan elektr kuchlari bilan o'zaro ta'sir qiladi. Zarrachalar orasidagi tortishish o'zaro ta'siri
ahamiyatsiz.
Atomlar va molekulalarning tasodifiy harakati haqidagi molekulyar kinetik nazariya g'oyalarining eng yorqin eksperimental tasdig'idir. Braun harakati.
Braun harakati - e Bu suyuqlik yoki gazda to'xtatilgan eng kichik mikroskopik zarralarning termal harakatidir. Uni ingliz botanigi R.Braun kashf etgan.
Broun zarralari molekulalarning tasodifiy to'qnashuvi ta'sirida harakat qiladi. Molekulalarning xaotik issiqlik harakati tufayli bu ta'sirlar hech qachon bir-birini muvozanatlashtirmaydi. Natijada, Broun zarrasining tezligi tasodifiy ravishda kattaligi va yo'nalishi bo'yicha o'zgaradi va uning traektoriyasi murakkab zigzag egri chiziqdir.
Modda molekulalarining doimiy xaotik harakati boshqa oson kuzatiladigan hodisada ham namoyon bo'ladi - diffuziya.
diffuziya orqali Ikki yoki undan ortiq qo'shni moddalarning bir-biriga kirib borishi hodisasi deyiladi.
Agar gaz tarkibida heterojen bo'lsa, jarayon eng tez sodir bo'ladi. Diffuziya, tarkibiy qismlarning zichligidan qat'i nazar, bir hil aralashmaning hosil bo'lishiga olib keladi. Shunday qilib, agar idishning ikkita qismida bo'linma bilan ajratilgan bo'lsa, kislorod O 2 va vodorod H 2 bo'lsa, bo'linma olib tashlangandan so'ng, gazlarning bir-biriga kirishi jarayoni boshlanadi va bu hosil bo'lishiga olib keladi. portlovchi aralashma - portlovchi gaz.
Diffuziya va Broun harakati o'zaro bog'liq hodisalardir. Aloqa qiluvchi moddalarning bir-biriga kirib borishi va suyuqlik yoki gazda to'xtatilgan eng kichik zarrachalarning tasodifiy harakati molekulalarning xaotik issiqlik harakati tufayli sodir bo'ladi.
"Issiqlik sig'imi" atamasini aniqlang. Issiqlik muhandislik hisoblarida qanday turdagi issiqlik quvvatlari qo'llaniladi. Gazlarning issiqlik sig'imi nima bilan bog'liqligini tushuntiring? Mayer tenglamasini yozing.
Issiqlik quvvati- tanaga berilgan yoki undan chiqarilgan issiqlikning uning haroratining mos keladigan o'zgarishiga nisbatiga teng qiymat: C= , [J/K]
bu erda C - issiqlik sig'imi; Q - berilgan (yoki olib tashlangan) issiqlik; ∆T - tana haroratining o'zgarishi.
Termal hisob-kitoblarda murojaat qiling har xil turlari kamaytirilgan issiqlik sig'imlari (massa, miqdor va hajm birligiga ishora qilinadi)
Massa (yoki o'ziga xos) issiqlik sig'imi tananing issiqlik sig'imi uning massasiga nisbati: c \u003d,
bu erda c - massa issiqlik sig'imi; m - tana vazni.
molar issiqlik sig'imi- issiqlik sig'imining modda miqdoriga nisbati: µ c =,
bu erda m c - molyar issiqlik sig'imi; n - moddaning miqdori.
Volumetrik issiqlik sig'imi normal sharoitda issiqlik sig'imining 1 m 3 gazga nisbati: c`=,
bu erda c` - hajmli issiqlik sig'imi; v 0 - normal sharoitdagi gaz hajmi.
SIda massa issiqlik sig'imi c J / kg * K, molyar issiqlik sig'imi µ s - J / mol * K, hajmli issiqlik sig'imi c "- J / m 3 * K bilan o'lchanadi.
Gazlar va bug'larning issiqlik sig'imlari o'zgaruvchan; uchun ideal gazlar ular haroratga, haqiqiy gazlar va bug'lar uchun esa ularning bosimiga bog'liq.
Gazlarning issiqlik sig'imi ko'p jihatdan ularni isitish yoki sovutish sharoitlariga bog'liq. Texnologiyadagi bu jarayonlar orasida eng muhimi bu jarayonda sodir bo'ladigan jarayonlardir doimiy hajm gaz (izokorik jarayon) va at doimiy bosim gaz (izobarik jarayon).
Shu munosabat bilan ajrating doimiy hajmdagi issiqlik sig'imi(v bilan) va doimiy bosimdagi issiqlik sig'imi(p bilan).
c p va c v o'rtasidagi miqdoriy munosabat yordamida o'rnatiladi Mayer tenglamalari: p - bilan v = R bilan, bu erda R universal gaz doimiysi.
Shunday qilib, barcha gazlar uchun izobar va izoxorik issiqlik sig'imlari orasidagi farq doimiy qiymat bo'lib, universal gaz konstantasiga teng.
Atamani aniqlang " dispers tizimlar". Dispers tizimlarning ikkita asosiy xususiyatini ayting. Dispers tizimlar qanday tasniflanadi? Har bir xususiyatdan foydalanib, dispers tizimlarni tavsiflang.
tarqalgan suyuq, qattiq yoki gazsimon muhitda tarqalgan ko'plab mayda zarralardan tashkil topgan tizimlar deb ataladi.
Barcha dispers tizimlar bilan xarakterlanadi ikkita asosiy xususiyat: yuqori parchalanish (dispersiya) va heterojenlik.
Heterojenlik dispers tizimlar bu tizimlarning ikki (yoki undan ortiq) fazadan iboratligida namoyon bo'ladi. Barcha dispers tizimlar uzluksiz fazadan iborat - dispersiya muhiti va uzluksiz faza (zarralar) - dispers faza.
Yuqori dispersiya moddalarga yangi sifat xususiyatlarini beradi: reaktivlik va eruvchanlikni oshiradi, rang intensivligi, yorug'likning tarqalishi va boshqalar.
Dispers tizimlarning tasnifi turli xususiyatlar asosida amalga oshiriladi, xususan: 1) zarrachalar hajmi bo'yicha, 2) dispers faza va dispersiya muhitining agregatsiya holatiga ko'ra, 3) dispers faza zarralarining har biri bilan o'zaro ta'siri tabiati bo'yicha. boshqa va vosita bilan.
Zarrachalar hajmiga qarab Dispers tizimlar guruhlarga bo'linadi:
1) qo'pol tizimlar - zarralari 1000 nm yoki undan ortiq o'lchamga ega bo'lgan tizimlar;
2) kolloid sistemalar - zarrachalar 1 dan 500 nm gacha o'lchamga ega.
3) haqiqiy eritmalar - zarrachalar 1 nm gacha bo'lgan o'lchamga ega.
Dispers faza va dispersiya muhitining agregatsiya holatiga ko'ra tizimlar quyidagicha tasniflanadi:
Kolloid zarrachalarning dispersion muhitga nisbatiga nisbatan liyofil va liofob tizimlarni ajrata oladi ( yunon tilidan "philia" - sevgi, "fobiya" - nafrat).
Liyofil tizimlar- kolloid zarralar dispersion muhit molekulalari bilan bog'langan va ularning qobig'iga ega bo'lganlar (agar dispersiya muhiti suv bo'lsa, tizimlar gidrofil deb ataladi). Masalan, liofil kolloid tizimlar tarkibiga tabiiy yoki sintetik IUDlarni eritish natijasida hosil bo'lgan eritmalar kiradi. Bular oqsillar, kraxmal, tsellyuloza efirlari va turli xil qatronlar, ham tabiiy, ham sintetik eritmalardir.
Liyofobik tizimlar(gidrofobik) - kolloid zarrachalar dispersion muhit yoki erituvchi molekulalari bilan kuchsiz bog'langanlar. Masalan, liofob tizimlarga qimmatbaho metallar eritmalari, oltingugurt eritmalari, temir va alyuminiy gidroksidlari eritmalari va boshqalar kiradi. Ushbu tizimlar agregativ beqarorlik bilan tavsiflanadi va barqarorlikni talab qiladi.
7. “Kimyoviy muvozanat” tushunchasiga ta’rif bering. Le Shatelye printsipini tuzing. Bosimning o'zgarishi reaksiyaning muvozanat holatiga qanday ta'sir qilishini asoslang: N 2 +3H 2 ⇄2NH 3 . Bu jarayon uchun muvozanat konstantasining ifodasini yozing va agar reaksiyaga kirishuvchi moddalar azot, vodorod va ammiakning muvozanat konsentrasiyalari mos ravishda 3 mol/l, 9 mol/l, 4 mol/l bo‘lsa, uning qiymatini taxmin qiling.
Kimyoviy muvozanat
Kimyoviy muvozanatdagi tizim uchun reagentlar konsentratsiyasi, harorat va tizimning boshqa parametrlari vaqt o'tishi bilan o'zgarmaydi.
Le Chatelier printsipi: agar muvozanat holatidagi tizimga tashqaridan ta’sir etsa, muvozanat sharoitlaridan birortasini (harorat, bosim, konsentratsiya) o‘zgartirsa, u holda tizimdagi jarayonlar kuchayib, tashqi ta’sirni qoplashga (yoki zaiflashtirishga) yo‘naltirilgan bo‘ladi.
Reaksiya N 2 + 3H 2 ⇄ 2NH 3 gazsimon moddalar ishtirokida davom etadi va qaytariladi. Bosim bunday reaktsiyalarda muvozanat holatiga sezilarli darajada ta'sir qiladi, chunki ular boshlang'ich moddalardan reaktsiya mahsulotlariga o'tishda modda miqdorining o'zgarishi tufayli hajmning o'zgarishi bilan birga keladi: bosimning oshishi bilan muvozanat mollarning umumiy soni bo'lgan tomonga siljiydi. gazlar miqdori kamayadi va aksincha.
N 2 + 3H 2 ⇄ 2NH 3 reaktsiya tenglamasiga ko'ra, dastlabki gazsimon moddalarning miqdori 4 mol (1 mol azot va 3 mol vodorod), gazsimon mahsulotlar miqdori esa 2 mol ( 2 mol ammiak). Binobarin, bosimning oshishi bilan kimyoviy muvozanat o'ngga, ozroq miqdorda gazsimon moddalarga va bosimning pasayishi bilan chapga, boshlang'ich moddalarga siljiydi.
Muvozanat konstantasi- ma'lum bir kimyoviy reaktsiya uchun termodinamik harakatlar o'rtasidagi nisbatni aniqlaydigan qiymat (yoki reaktsiya shartlariga qarab, qisman bosimlar, konsentratsiyalari) kimyoviy muvozanat holatidagi boshlang'ich moddalar va mahsulotlar (massa ta'siri qonuniga muvofiq). Reaksiyaning muvozanat konstantasini bilib, reaksiyaga kirishuvchi aralashmaning muvozanat tarkibini, mahsulotlarning cheklovchi unumini hisoblash va reaksiya yo‘nalishini aniqlash mumkin.
Berilgan:\u003d 3 mol / l, \u003d 9 mol / l, \u003d 4 mol / l
Toping: K bilan -?
Yechim: 1) N 2 +3H 2 ⇄2NH 3 reaksiya tenglamasini yozamiz.
2) Ushbu reaktsiya uchun muvozanat konstantasi quyidagi ifodaga ega: K c \u003d 2 / * 3; 3) muvozanat konstantasini hisoblang K c \u003d 4 2/3 * 9 3 \u003d 0,0073
Javob: K c \u003d 0,0073
8. “Dispers sistema” atamasiga ta’rif bering. Dispers faza va dispers muhitning agregatsiya holatiga ko’ra dispers sistemalarning tasnifini keltiring. Ushbu bilimlarni tizimlashtirish va tavsiya etilgan tizimlar uchun dispers faza va dispersiya muhitining agregatsiya holatini aniqlang: neft; changli havo. Bu kolloid sistemalarning barqarorligini bashorat qiling va tushuntiring.
Dispers tizimi- bular umuman yoki amalda aralashmaydigan va bir-biri bilan kimyoviy reaksiyaga kirishmaydigan ikki yoki undan ortiq faza (jismlar) hosilalari.
Ko'pchilik dispers tizimlarning umumiy tasnifi dispersion muhit va dispers fazaning agregatsiya holatidagi farqga asoslanadi. Uch turdagi kombinatsiyalar agregatsiya holati dispers tizimlarning to'qqiz turini ajratish imkonini beradi. Qisqartirish uchun ular odatda kasr bilan belgilanadi, ularning numeratori dispers fazani ko'rsatadi va maxraj dispersiya muhitini ko'rsatadi, masalan, "suyuqlikdagi gaz" tizimi uchun G / L belgisi qabul qilinadi.
| Belgilanish | Dispers faza | Dispersiya muhiti | Ism va misol |
| Y/Y | gazsimon | gazsimon | Dispersiya tizimi shakllanmagan |
| F/G | Suyuqlik | gazsimon | Aerozollar: tumanlar, bulutlar |
| T/Y | qattiq | gazsimon | Aerozollar (chang, tutun), kukunlar |
| G/F | gazsimon | Suyuqlik | Gaz emulsiyalari va ko'piklari |
| F/F | Suyuqlik | Suyuqlik | Emulsiyalar: yog ', qaymoq, sut |
| T/F | qattiq | Suyuqlik | Suspenziyalar va eritmalar: pulpa, loy, suspenziya, pasta |
| G/T | gazsimon | qattiq | gözenekli jismlar |
| F/T | Suyuqlik | qattiq | Kapillyar tizimlar: gözenekli jismlardagi suyuqlik, tuproq, tuproq |
| T/T | qattiq | qattiq | Qattiq heterojen tizimlar: qotishmalar, beton, kompozit materiallar |
O'z navbatida, bu tizimlar tarqalish darajasiga ko'ra tasniflanadi.
Bir xil o'lchamdagi dispers faza zarralari bo'lgan tizimlar monodispers, zarralari har xil bo'lgan tizimlar esa polidispers deb ataladi. Qoida tariqasida, bizni o'rab turgan haqiqiy tizimlar polidispersdir.
Dispers tizimlarning barqarorligi ularning noaniq uzoq vaqt davomida dastlabki holatda bo'lish imkoniyatidir.
Dispers tizimlarning barqarorligi quyidagilar bo'lishi mumkin:
1. Yog'ingarchilikka
dispers faza - dispers tizimning dispersiya muhiti hajmi bo'yicha fazaning muvozanat taqsimlanishini yoki uning fazalarni ajratishga chidamliligini ta'minlash qobiliyatini tavsiflaydi. Bu xususiyat deyiladi sedimentatsiya (kinetik) barqarorlik .
2. Birlashtirish tomon
uning zarralari. Aggregativ barqarorlik
dispers tizimning vaqt o'tishi bilan dispersiya darajasini o'zgarmagan holda ushlab turish qobiliyatidir, ya'ni. zarrachalar kattaligi va ularning individualligi.
Bu dispers tizimlarning agregatlar hosil qilish qobiliyatiga bog'liq (ya'ni, kattalashib boradi). Agregatsiyaga kelsak, dispers tizimlar barqaror bo'lishi mumkin kinetik
va termodinamik jihatdan
. Termodinamik barqaror tizimlar fazalardan birining o'z-o'zidan tarqalishi natijasida hosil bo'ladi, ya'ni. heterojen tizimning o'z-o'zidan shakllanishi.
Dispersiya tizimi: changli havo gazsimon dispersiya muhiti va qattiq dispersiya fazasidan iborat. Bu tizim kinetik va agregativ jihatdan beqaror.
Dispersiya tizimi: moy suyuq dispersiya muhiti va suyuq dispersiya fazasidan iborat. Va tizim kinetik va agregativ jihatdan barqaror.
9. “Kimyoviy muvozanatning siljishi” tushunchasiga ta’rif bering. Kimyoviy muvozanat holatiga qanday omillar ta'sir qiladi va nima ta'sir qilmaydi, degan fikrni ayting? Le Shatelye printsipini tuzing. Reaksiya uchun bosim, harorat, dastlabki moddalar kontsentratsiyasi ortishi bilan muvozanatning qaysi tomonga siljishini taxmin qiling:
+CaCO3 + O(bugʻ)⇄Ca(HCO3 +Q
Kimyoviy muvozanat- kimyoviy tizimning dinamik holati, bunda kimyoviy reaksiya teskari yo'l bilan boradi va to'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi bir-biriga tengdir.
Kimyoviy muvozanatning holati quyidagi reaktsiya parametrlariga bog'liq: harorat, bosim va kontsentratsiya. Ushbu parametrlarning o'zgarishi oqim tezligining o'zgarishiga olib keladi kimyoviy reaksiyalar va kimyoviy muvozanatni o'zgartiradi.
Kimyoviy muvozanatga ta'sir etuvchi omillar: harorat, bosim, konsentratsiya.
1) harorat: harorat ko'tarilganda kimyoviy muvozanat endotermik (absorbtsiya) reaktsiyaga, pasayganda esa ekzotermik (izolyatsiya) reaktsiyaga o'tadi.
2) bosim: bosim ortganda kimyoviy muvozanat moddalarning kichikroq hajmiga, pasayganda esa kattaroq hajmga siljiydi. Bu tamoyil faqat gazlar uchun amal qiladi, ya'ni. agar ular reaksiyada ishtirok etsa qattiq moddalar, ular hisobga olinmaydi.
3) boshlang'ich moddalar va reaktsiya mahsulotlarining konsentratsiyasi
Boshlang'ich moddalardan birining konsentratsiyasining oshishi bilan kimyoviy muvozanat reaktsiya mahsulotlariga, reaktsiya mahsulotlarining konsentratsiyasining oshishi bilan esa boshlang'ich moddalarga o'tadi.






