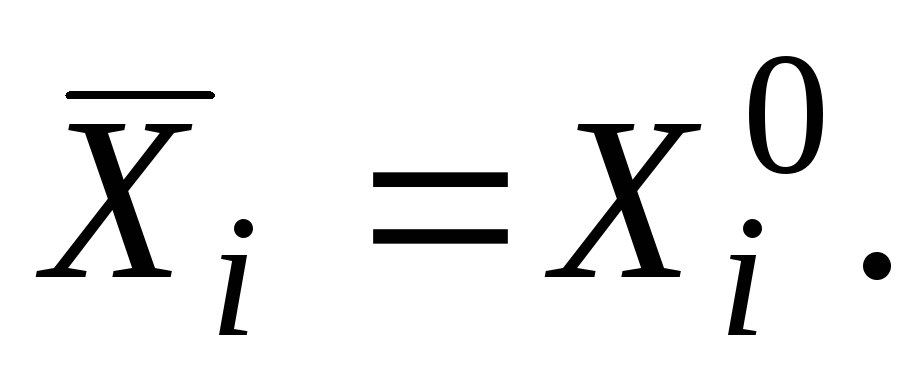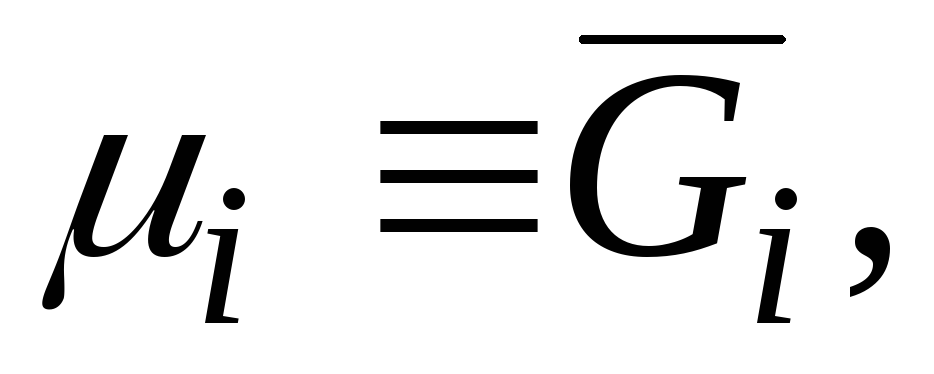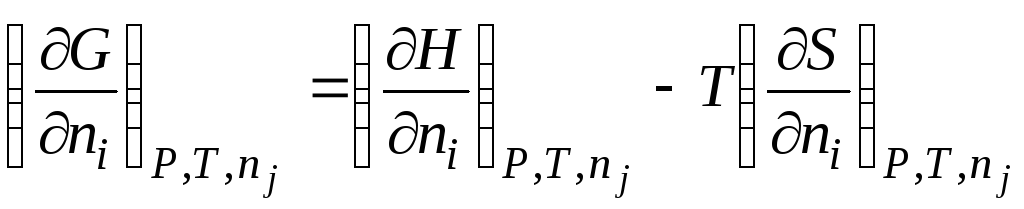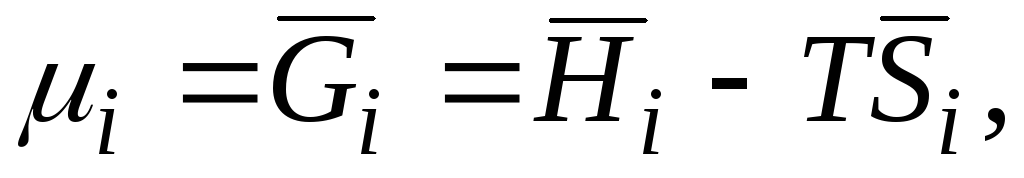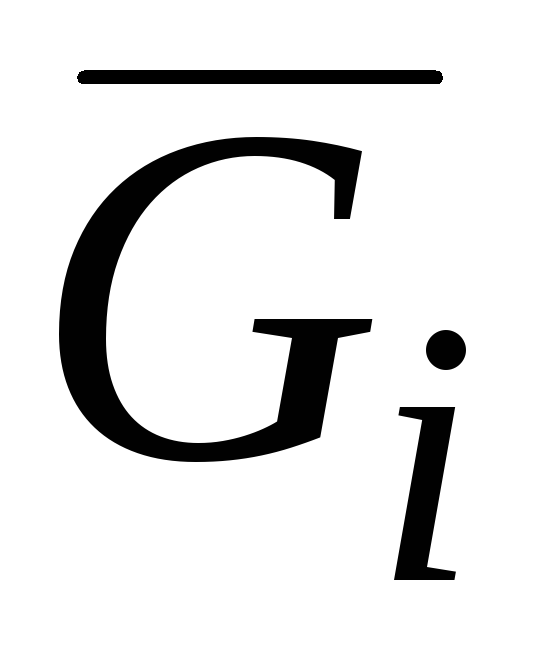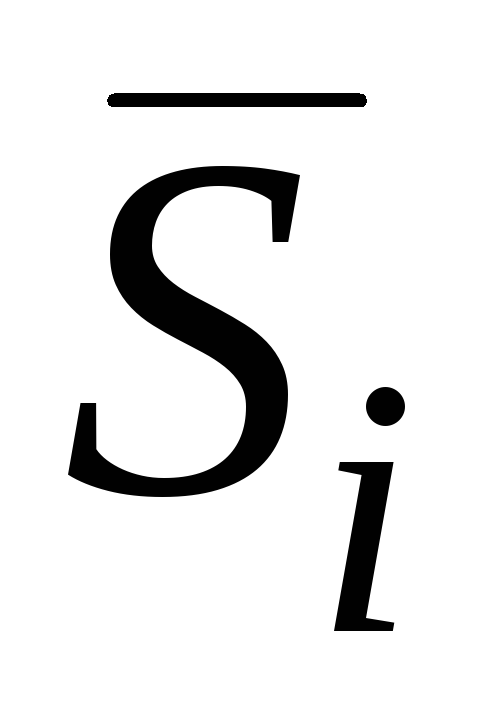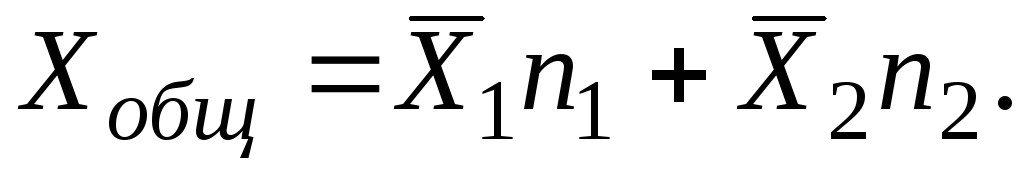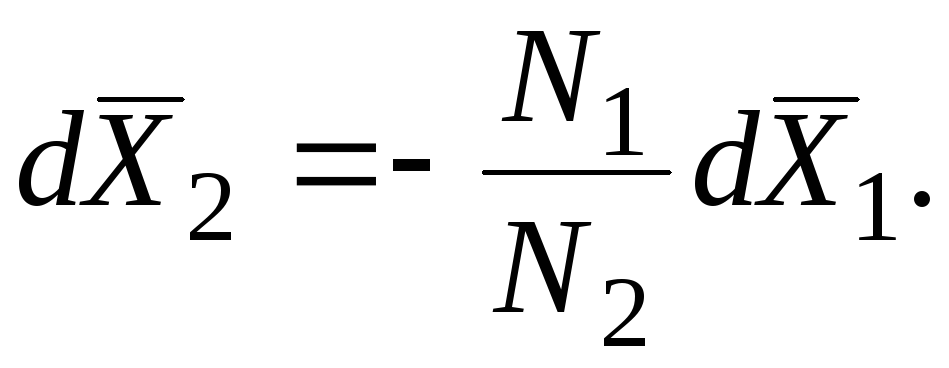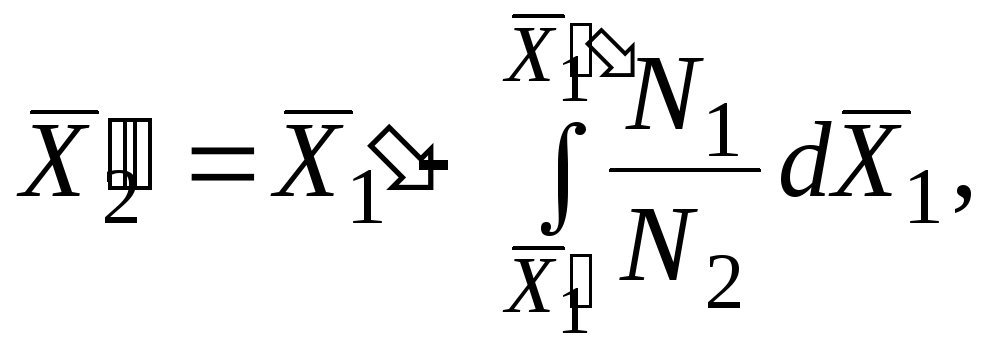Görev örnekleri. Fiziksel kimya
Kapsamlı özellikleri madde miktarı ile orantılıdır. Bunlar, örneğin hacim, kütle, içsel enerji, entropi. Yani iki özdeş metal parçasının iç enerjisi, bir parçanın enerjisinin iki katıdır. Bir sistemin kapsamlı özellikleri, onu oluşturan parçaların kapsamlı özelliklerinden ek olarak oluşur. Madde miktarına bağlı olmayan sıcaklık, basınç gibi özelliklere denir. yoğun. Çözeltiler için yoğun özellikler bileşim ile belirlenir. Örneğin, bir çözeltinin üzerindeki herhangi bir bileşenin buhar basıncı, konsantrasyonuna bağlıdır. Sistemin farklı bölümlerindeki yoğun özelliklerin değerleri eşitlenme eğilimindedir. Yoğun bir niceliğin ölçümü, değişimine her zaman bazı kapsamlı nicelikte bir değişikliğin eşlik ettiği gerçeğine dayanır. Bu nedenle, sıcaklığı ölçmek için, örneğin cıva gibi bir maddenin hacmindeki bir değişiklik kullanılır, yani. geniş mülk.
G. Lewis, bileşenin kısmi molar değerini çağırdı gi bazı kapsamlı miktarın kısmi türevi gi mol sayısına göre benÇözeltinin bu bileşeni, sabit basınçta, sıcaklıkta ve kalan bileşenlerin mol sayılarında:
gi = (∂g/∂ben) p.T.nj(j ≠ i) . (V.1)Bu tanımın gerektirdiği koşullara uygunluk, örneğin, sabit bir konsantrasyonda çok büyük bir hacimde bir çözeltinin olduğunu hayal edersek sağlanabilir. R ve T 1 mol herhangi bir bileşen eklenir. Bu durumda, çözeltinin konsantrasyonu pratik olarak değişmeyecektir ve çözeltinin özelliklerinde karşılık gelen değişiklik, eklenen bileşenin kısmi molar değeri olacaktır.
Örneğin, kısmi molar hacim vi, denklem ile belirlenir:
vi = (∂V/∂ben) p.T.nj(j ≠ i) . (V.2)Çözüm, hacimde bir değişiklik olmaksızın bileşenlerden oluşuyorsa, bileşenin kısmi molar hacminin, molar hacmine eşit olduğu açıktır, yani. vi = V
| 0 |
| i |
bileşenlerin çözümü, hacmin eklenmesi gözlenir, yani. örneğin aşağıdakilerden oluşan ikili bir çözüm için değişmez P 1 mol birinci bileşen ve P 2 mol saniye: V = n 1 V
| 0 |
| 1 |
| 0 |
| 2 |
| 0 |
| 1 |
| 0 |
| 2 |
Örneğin, bir çözeltinin oluşumunda entalpi katkı maddesi ise, o zaman Δ H= 0 ve bu nedenle çözüm, termal etki olmadan oluşturulur. Başlangıç maddelerinin entalpisi ise daha fazla entalpiÇözelti oluştuğunda ısı açığa çıkar. Aksi takdirde, ısı emilecektir.
Kısmi molar miktarlar arasında, kısmi molar Gibbs enerjisi özellikle önemlidir:
ben = (∂G/∂ben) p.T.nj(j ≠ i) (V.3)hangi, Bölüm'de belirtildiği gibi. II, denilen kimyasal potansiyel ve μ ile gösterilir.
Kimyasal potansiyel, sıcaklık ve basınçla birlikte yoğun bir miktardır. Böylece sistemin farklı bölümlerindeki tüm bileşenlerin sıcaklık, basınç ve kimyasal potansiyellerinin eşitliği, termal, mekanik ve kimyasal denge koşullarını ifade eder. Değer ben = μ i bir maddenin belirli bir fazdan ayrılma eğilimini yansıtır ve dağılımının bir ölçüsüdür.
İki bitişik fazı ele alalım - bir çözelti ve onun üzerinde bir buhar. Bu aşamaların her birinde belirli bir bileşen vardır. i. dengede bençözüm = ben buhar.
Örneğin, kimyasal potansiyelçözeltide gaz fazından daha fazla madde varsa, bu maddenin buharlaşması meydana gelir ve bu bençözüm azalır, ben denge kuruluncaya kadar par artar. Aksi takdirde, bileşenin bir geçişi olurdu i buhardan çözeltiye.
Buhar fazının aşağıdaki özelliklere sahip olduğunu varsayalım. ideal gazlar. Bu durumda moleküller arasında etkileşim olmadığından, gaz bileşeninin kısmi molar Gibbs enerjisi veya kimyasal potansiyeli, saf bileşenin molar Gibbs enerjisine eşittir. ben karışımdaki kısmi basıncına eşit bir basınçta, yani. μ i gaz = G i gaz = G i gaz. Böylece, (II.28) denklemine göre:
bençözüm = μ içözüm = ben = G
genellikle μ + ile gösterilir RT içinde pi(V.4)Kısmi molar değerler, çözeltilerin özelliklerini karakterize eder. Çözümlerdeki dengelerin termodinamik hesaplamalarında karşılık gelen fonksiyonlarla aynı rolü oynarlar. U, H, F, G, S vb. saf maddeler arasındaki reaksiyonlarla ilgili hesaplamalarda. Bu bağlamda, kısmi molar değerler tablolarının derlenmesi tavsiye edilir.
giriiş
Konu 6. Çözümler
Çözeltilerin incelenmesi, hem doğada hem de teknolojide sürekli olarak saf maddelerle değil, çözümlerle uğraşmak zorunda olduğumuz için fiziksel kimyanın önemli bir alanıdır. Örneğin, modern teknolojide vakum ve bölge eritme yöntemleriyle elde edilen en saf metaller, hala ihmal edilebilir miktarlarda (%10-6), özellikle metaloidler olmak üzere safsızlıklar içerir ve esasen çözeltidir.
Doğada meydana gelen süreçlerin çoğu ve çeşitli teknolojik süreçlerin altında yatan sıvı fazda meydana gelir. Yani kimyasal reaksiyonlar demir ve çeliğin eritilmesinde esas olarak çözeltilerde bulunurlar. Sıvı demir ve çelik çözümlerdir çeşitli unsurlar demir içinde. Yüksek ve çelik eritme fırınlarında, bir oksit çözeltisi olan sıvı cüruf ile etkileşime girerler.
Cevherlerden demir dışı metallerin çıkarılması için hidrometalurjide tuzların, asitlerin ve bazların sulu çözeltileri yaygın olarak kullanılmaktadır.
Bir çözelti, iki veya daha fazla bileşenden oluşan homojen, homojen bir değişken bileşim sistemidir. Çözümler, herhangi bir kümelenme durumunda bulunabilir - katı, sıvı veya gaz. Ortak özellikleri tek fazlıdır.
Çözümler doğada ve bileşenlerinin parçacıkları arasındaki etkileşimin doğasında çok çeşitlidir. Bu nedenle, örneğin, büyük miktarda ısının salınmasıyla oluşan sudaki bir sülfürik asit çözeltisi, açıkça belirgin bir kimyasal etkileşim ile ve sıvılaştırılmış soy gazların bir çözeltisinde - argon ve neon - karakterize edilir. fiziksel kuvvetler. Birçok gerçek çözümde, parçacıklar arasındaki etkileşimin doğası o kadar karmaşıktır ki kimyasal ve fiziksel yönlerini ayırmak imkansızdır.
Bir çözeltinin bileşenleri, bir çözücü (ortam) ve çözücü içinde moleküller, atomlar veya iyonlar şeklinde eşit olarak dağılmış bir çözünen (veya birkaç maddedir). Bir çözücü genellikle, bir bütün olarak çözelti ile aynı kümelenme durumunda olan bir madde olarak anlaşılır. Çözeltiyi oluşturan maddelerin toplam halleri aynı ise, bu sistemde çözücü hakimdir. Örneğin, sudaki %5'lik bir şeker çözeltisinde, ikincisi çözücüdür ve şeker çözünendir. Genel olarak, "çözücü" ve "çözünen" kavramları bir dereceye kadar koşulludur. Örneğin, konsantre çözeltilerde, çözünen ve çözücü arasındaki ayrım daha az belirgindir. %50'lik bir etil alkol ve su çözeltisi için kavramlar eşittir ve %95 alkol ve %5 su içeren bir çözelti için, ikincisi bir çözünendir. Bu nedenle, seyreltik (konsantre olmayan) çözeltilere uygulandığında "çözücü" ve "çözünen" kavramları kullanılmalıdır. Elektrolit çözeltileri için su, çok küçük olsa bile her zaman çözücüdür.
Bir çözeltinin bileşimi veya konsantrasyonu çeşitli şekillerde ifade edilir. Mol fraksiyonlarında bir çözeltinin konsantrasyonunu ifade etmek en uygunudur.
mol kesri ben mol sayısının oranıdır i inci madde ( ben) ile toplam sayısı belirli bir çözelti miktarındaki tüm bileşenlerin molleri Σ ben:
Sulu çözeltiler söz konusu olduğunda, konsantrasyon genellikle 1 litre çözeltideki çözünenin mol sayısı - molar konsantrasyon ( İTİBAREN m):
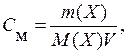 (6.2)
(6.2)
nerede V- çözeltinin hacmi, dm 3.
Bununla birlikte, termal genleşmeden kaynaklanan çözelti konsantrasyonu sıcaklığa bağlı olduğundan molar konsantrasyonun kullanımı her zaman uygun değildir. Bu bağlamda molalite de sıklıkla kullanılmaktadır. molalite ( santimetre) 1000 g çözücüdeki çözünenin mol sayısıdır:
 (6.3)
(6.3)
nerede m2 (X)çözünmüş maddenin kütlesidir, g; M(X)çözünenin molar kütlesidir, g/mol; m 1 çözücünün kütlesidir, g.
Sulu çözeltilerde mol kesri ile molalite arasında bir ilişki vardır.
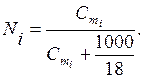 (6.4)
(6.4)
Çözeltiye geçen madde, çözeltinin bir bileşeni haline gelir, bireyselliğini kaybeder.
Çözelti özellikleri termodinamik miktarlarla karakterize edilebilir V, H, U, F, G vb. Çözeltinin bileşenlerinin molekülleri arasındaki etkileşimden dolayı, termodinamik özellikleri, kurucu maddelere değil, bir bütün olarak çözeltiye atıfta bulunmak mantıklıdır. Böylece, çözüm, iyi tanımlanmış, uygun bir şekilde karakterize edilir. basit ölçüm hacim, ancak tek tek bileşenlerin içinde hangi hacimleri kapladığını belirlemek imkansızdır.
Herhangi bir çözeltide, örneğin, sudaki bir sülfürik asit çözeltisi, sülfürik asit ve su moleküllerinin enerjisi ile birlikte, bu maddeler arasında çözeltiyi karakterize eden ve herhangi birine atfedilemeyen bir etkileşim enerjisi vardır. bileşenler. Bununla birlikte, bu bileşenin çözümün bir veya daha fazla özelliğine ne oranda katkıda bulunduğunu karakterize etmek hala önemlidir. Böyle bir özelliğe kısmi değer denir.
G. Lewis, bir bileşenin kısmi molar niceliğini, bazı kapsamlı niceliğin kısmi türevi olarak adlandırdı. g Sabit basınçta, sıcaklıkta çözeltinin bu bileşeninin mol sayısına ve kalan bileşenlerin mol sayılarına göre:
![]() (6.5)
(6.5)
Bu tanımın gerektirdiği koşullara uygunluk, örneğin, belirli bir konsantrasyonda çok büyük bir hacimde sabit ve T herhangi bir bileşenden 1 mol ekleyin. Bu durumda, çözeltinin konsantrasyonu pratik olarak değişmeyecektir ve çözeltinin özelliklerinde karşılık gelen değişiklik, eklenen bileşenin kısmi molar değeri olacaktır.
Örneğin, kısmi molar hacim denklem tarafından verilir.
![]() (6.6)
(6.6)
Çözelti, hacimde bir değişiklik olmaksızın bileşenlerden oluşuyorsa, kısmi molar hacmin molar hacmine eşit olduğu açıktır, yani "sıfır" indeksi maddenin saf halde olduğu anlamına gelir. Molar hacmin aksine, kısmi molar hacim negatif bir değer olabilir, örneğin moleküler etkileşim nedeniyle, bir bileşen bir çözeltiye eklendiğinde hacimde bir azalma meydana gelirse. Bileşenlerden bir çözeltinin oluşumu sırasında katkı gözlenirse, örneğin, aşağıdakilerden oluşan ikili bir çözelti için: 1 birinci bileşenin molleri ve n 2 ikinci mol:
![]() (6.7)
(6.7)
nerede ve saf maddelerin mol kesirleridir.
Açıkçası, bu durumda, çözüm oluşturulduğunda
Örneğin, bir çözeltinin oluşumu sırasında, entalpi katkı maddesi ise, sonuç olarak, çözelti termal bir etki olmadan oluşur. Başlangıç malzemelerinin entalpisi çözeltinin entalpisinden büyükse, çözeltinin oluşumu sırasında ısı açığa çıkar. Aksi takdirde, ısı emilecektir.
Kısmi molar miktarlar arasında kısmi molar değer özellikle önemlidir. bedava enerji
![]() (6.8)
(6.8)
bu da genellikle kimyasal potansiyel olarak adlandırılır ve şu şekilde gösterilir:
Kimyasal potansiyel, sıcaklık ve basınçla birlikte yoğun bir miktardır. Bu nedenle, sistemin farklı bölümlerindeki tüm bileşenlerin sıcaklık, basınç ve kimyasal potansiyellerinin eşitliği, termal, mekanik ve kimyasal denge koşullarını ifade eder (bkz. Bölüm 2.12).
Değer, maddenin bu fazdan ayrılma eğilimini yansıtır ve dağılımının bir ölçüsüdür. İki bitişik fazı ele alalım - bir çözelti ve onun üzerinde bir buhar. Bu aşamaların her birinde belirli bir bileşen vardır. i. dengede
Örneğin, çözeltideki bir maddenin kimyasal potansiyeli gaz fazındakinden daha büyük olsaydı, bu maddenin buharlaşması meydana gelirdi. ![]() denge kuruluncaya kadar azalır ve artar. Aksi takdirde, bileşenin bir geçişi olurdu i buhardan çözeltiye.
denge kuruluncaya kadar azalır ve artar. Aksi takdirde, bileşenin bir geçişi olurdu i buhardan çözeltiye.
Kısmi molar değerler, çözeltilerin özelliklerini karakterize eder. Çözümlerdeki dengelerin termodinamik hesaplamalarında karşılık gelen fonksiyonlarla aynı rolü oynarlar ( U, H, F, G, S vb.) saf maddeler arasındaki reaksiyonlarla ilgili hesaplamalarda. Bu bağlamda, kısmi molar miktarların tablolarının derlenmesi tavsiye edilir. Belirli bir bileşenin kısmi molar değerini belirlemek için, karşılık gelen kapsamlı özelliğin çözümün bileşimine olan bağımlılığını sabit olarak bulmak gerekir. R Toplam, T ve geri kalan bileşenlerin mol sayıları ve bu bileşenin mol sayılarına göre farklılık gösterir. İkili çözümler için, böyle bir belirleme genellikle segment yöntemi kullanılarak grafiksel olarak yapılır. Bunu yapmak için, çözeltinin bir molünün özelliğini hesaplayın.
Bir mol çözelti, her bileşenin mol sayısının mol kesrine eşit olduğu miktardır. Örneğin, 0.1 mol karbon ve 0.9 mol demir içeren sıvı demirde bir mol karbon çözeltisi. Çünkü atom kütlesi karbon 12 ve demir 55.85'tir, o zaman böyle bir çözeltinin bir molünün kütlesi 12 × 0.1 + 55.85 × 0.9 = 51.465 g olacaktır.
Çözüm özelliği g, bir köstebek ile ilgili olarak, indeks ile gösterilir. Örneğin, bir mol çözeltinin hacmi ile gösterilir.
Kısmi molar miktarları belirlemek için bir grafik yöntem, Şekil 2'de gösterilmektedir. 6.1. Birinci ve ikinci bileşenlerin molar fraksiyonları apsis ekseni boyunca çizilir ( 1 ve N2). Nokta Ö birinci saf bileşene karşılık gelir; bu noktada 1= 1 ve N2= 0. Nokta Yaklaşık 1 ikinci saf bileşene karşılık gelir; bu noktada 1= 0 ve N2= 1. Doğru üzerindeki her nokta OO 1 belirli bir bileşimin bir çözeltisine karşılık gelir.
Bir mol çözeltinin herhangi bir özelliğinin değeri y ekseninde çizilir. AB eğrisi, özelliğin çözümün bileşimine bağımlılığını ifade eder. Bir çözeltinin oluşumu sırasında özelliği, bileşenlerin özelliklerinden toplamsal olarak oluşuyorsa, bir eğri yerine bağımlılık düz bir çizgi ile ifade edilecektir. OA ve O 1 V segmentleri sırasıyla saf bileşenlerin molar özelliklerini temsil eder ve
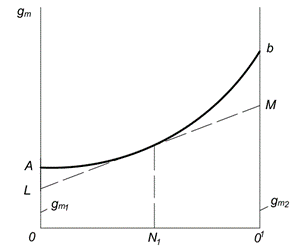
Pirinç. 6.1. Kısmi Molar Değerlerin Belirlenmesi İçin Grafik Yöntem
Belirli bir konsantrasyondaki bir çözeltideki bileşenlerin kısmi molar değerlerini bulmak için, örneğin, bir teğet çizilmelidir. LM eğriye AB OL ordinat eksenleri üzerindeki teğet tarafından kesilen Segmentten geri yüklenen ordinata karşılık gelen noktada ve yaklaşık 1M, kısmi miktarlara eşittir ve
İyi çalışmalarınızı bilgi tabanına gönderin basittir. Aşağıdaki formu kullanın
Bilgi tabanını çalışmalarında ve çalışmalarında kullanan öğrenciler, yüksek lisans öğrencileri, genç bilim adamları size çok minnettar olacaktır.
http://www.allbest.ru/ adresinde barındırılmaktadır.
ders çalışması
Kısmi molar miktarların belirlenmesi
giriiş
2.1 Analitik yöntemler
2.2 Grafik yöntemler
3. Deneysel kısım
3.1 Aletler ve reaktifler
4. Sonuçlar ve tartışma
Çözüm
bibliyografya
Başvuru
Sonuçlar
giriiş
Doğada, bir maddenin diğeriyle tek tip karışımı veya birkaç maddenin karışımı olan sayısız sistem vardır. Tüm doğal karışımlar iki gruba ayrılabilir:
1) bileşenler arasında fiziksel bir arayüz bulunan karışımlar. Bu tür karışımlara heterojen denir. Heterojen sistemler birbirinden farklı fazlardan oluşur. kimyasal bileşim ve termodinamik özellikler;
2) bileşenler arasında fiziksel bir ara yüzün olmadığı karışımlar. Bu nedenle, bu tür sistemler tüm parçalarında aynı fiziksel ve kimyasal özelliklere sahiptir. Bu tür sistemlere homojen veya çözümler denir.
Çözüm, iki veya daha fazla parçadan oluşan homojen bir sistemdir. daha fazla bileşimi belirli sınırlar içinde sürekli değişebilen bileşenler.
Çözümler üç kümelenme durumunda olabilir: gaz, sıvı ve katı. Pratikte en çok sıvı çözeltilerle karşılaşılır. Sıvı bir çözeltide, bir çözücü ve bir çözünen, termodinamik bir bakış açısından, çözeltinin tüm bileşenleri eşdeğer olmasına rağmen ayırt edilir. Bir çözücünün, bir çözeltide daha büyük miktarda bulunan bir madde anlamına geldiği anlaşılmaktadır. Bu yazıda, sıvı çözeltiler ele alınmaktadır.
Yapı ve fiziksel özellikler sıvılar, onu oluşturan parçacıkların kimyasal kimliğine ve aralarında etki eden kuvvetlerin doğasına ve yoğunluğuna bağlıdır. Sıvı sistemlerde görünürler Farklı çeşit etkileşimler.
Yapıya göre sıvı hal arasında orta katı hal kristal boyunca kesin olarak tanımlanmış periyodik bir yapıya ve hiçbir yapının olmadığı ve parçacıkların hareketinin rastgele olduğu bir gaza sahiptir. Bu nedenle, bir sıvı, bir yandan belirli bir hacmin varlığı ve diğer yandan belirli bir formun yokluğu ile karakterize edilir. Katılaşma sıcaklığına yakın bir sıvıda, iç yapının düzenliliği daha belirgin hale gelir. Aksine, sıvı kaynama noktasına yaklaştıkça, düzensizlik göreceli konum parçacıklar.
Sıvı çözeltiler, gazların, sıvıların veya sıvıların çözülmesiyle elde edilebilir. katılar uygun bir sıvı çözücü içinde. Sıvı bir çözelti oluşturulduğunda, belirli bir yapıya sahip sıvı bir çözücü, çözünen maddeye dahil edildiğinde, çözücüdekinden farklı bir parçacık düzenlemesi ile yeni bir yapı oluşur. Bu durumda, moleküller arası etkileşim kuvvetleri değişir.
Sıvı bir çözeltide, etkileşime ek olarak, aynı adlı moleküller arasındaki etkileşim, zıt adlı moleküller arasında da görülür. Moleküllerin etkileşimine, iyonlarına bozunmaları eşlik edebilir. İyonlara ayrışma olasılığı ve derecesi, çözünenin doğası ve çözücünün doğası tarafından belirlenir. İyonlara bozunma, ya ayrışma (ayırma) fenomeni veya iyonlaşma fenomeni (iyon oluşumu) ile ilişkilidir. Yani iyonik bileşikler çözündüğünde ayrışma gerçekleşir.
Oluşan iyonlar ve çözücü moleküller arasındaki etkileşimin bir sonucu olarak, solvatlar oluşur (sulu çözeltilerde - hidratlarda). İyonu çevreleyen çözücü molekülleri seti bir solvat kabuğudur. Birincil ve ikincil solvat kabukları vardır. Birincil solvat kabuğu, bir iyonun en yakın çözücü molekülleri üzerindeki etkisinin bir sonucu olarak oluşan, bağımsız hareketlerini kaybeden ve iyonla birlikte hareket eden kabuktur. Örneğin, birincil çözünme kabuğu, kuantum mekaniksel hesaplamalara göre iyon başına 5 ila 7 su molekülü içerir.
Moleküller arasındaki etkileşim genellikle diğer, daha karmaşık moleküllerin - komplekslerin oluşumuna yol açar.
Böylece çözümler çok karmaşık sistemler burada çözünen, birkaç molekülden oluşan veya kısmen veya tamamen iyonlara ayrışmış tek tek moleküller veya ortaklar şeklinde olabilir. Bu bağlamda, çözeltiler elektrolit olmayan çözeltiler ve elektrolit çözeltiler olarak ikiye ayrılır.
Çözünmeye, ısının salınması veya emilmesi eşlik eder. Bir madde çözüldüğünde, çözünen ve çözücüdeki moleküller (atomlar veya iyonlar) arasındaki bağlar kopar ve bu da enerji harcamasıyla ilişkilidir. Eşzamanlı olarak, çözme süreci ilerler, yani. Çözünen ve çözücünün tanecikleri arasında bağlar vardır. Bunu yaparken enerji açığa çıkar. Çözünmenin toplam enerji etkisi, salınan ve emilen enerji miktarlarının oranına bağlı olarak, pozitif veya negatif olabilir.
Enerji etkisine ek olarak, çözünmeye, karışık bileşenlerin hacminde bir değişiklik eşlik eder. Örneğin, alkol suda çözülürken, çözeltinin hacmi, solvatların oluşumu nedeniyle alınan toplam madde hacmine göre yaklaşık %3,5 oranında azalır.
Çözündüğünde, bazen çözeltinin renginde bir değişiklik gözlenir.
Bu çalışmanın amacı, integral ve kısmi molar çözünme ısılarını belirlemektir. çeşitli maddeler ve integral çözünme ısısının çözeltinin bileşimine bağımlılığı için bir interpolasyon denkleminin türetilmesi.
İş görevleri:
1) Kalorimetrik ölçümleri kullanarak, elde edilen çözeltinin çeşitli konsantrasyonları için integral çözünme ısısının değerlerini belirleyin;
3) çözünme ısısının çözeltinin bileşimine bağımlılığını çizin.
1. Kısmi molar miktarlar ve çözümlerin termodinamiğindeki önemi
Kısmi molar miktarlar, çözeltilerin özelliklerinin konsantrasyon bağımlılıklarını tanımlamak için kullanılan termodinamik miktarlardır. M, h bileşenlerinden oluşan bir sistemin durumunun kapsamlı bir fonksiyonu olsun, yani sistemin kütlesine (hacim, iç enerji, entalpi, entropi, Gibbs enerjisi, Helmholtz enerjisi, ısı kapasitesi, vb.) . i-inci bileşen için, Z kısmi molar değeri şu ilişki ile belirlenir:
şunlar. i bileşeninin mol sayısına göre M'nin türevine eşittir. Sabit sıcaklık T, basınç p ve diğer tüm bileşenlerin mol sayıları. Böylece, kısmi molar hacim
burada V, sistemin hacmidir; kısmi molar Gibbs enerjisi (kimyasal potansiyel)
burada G, sistemin Gibbs enerjisidir.
Kısmi molar değer, T, p sabitliği ve diğer tüm bileşenlerin mol sayısı koşulları altında sonsuz büyük miktarda bir çözeltiye 1 mol bileşen i eklendiğinde M değerindeki değişikliği karakterize eder. Bir bileşenin molar fraksiyonu x i bire eşitse, Z kısmi molar değeri, bireysel madde için M m molar değeri olur (örneğin, bileşenin kısmi molar hacmi molar hacme dönüştürülür). Z'nin değeri, sadece i-inci bileşenin doğası ile değil, aynı zamanda bir bütün olarak sistemin özellikleri ile de belirlenir, çünkü i-inci bileşenin molekülleri diğer tüm moleküller ile etkileşime girer; örtük olarak, bu değer, i-inci bileşen tanıtıldığında sistemin özelliklerindeki tüm değişiklikleri hesaba katar.
Gerçek bir çözümde, genel olarak, tüm kısmi molar miktarlar bileşime, basınca ve sıcaklığa bağlıdır. Çözüm idealse, verilen T ve p'de kısmi molar hacim, iç enerji, entalpi ve ısı kapasitesi konsantrasyon aralığı boyunca sabittir ve saf bileşenlerin karşılık gelen molar değerleriyle çakışır. Kimyasal potansiyel m id ve kısmi molar entropi S i id, saf bir maddenin karşılık gelen molar değerleri ile ilişkilidir - Gibbs enerjisi ve ilişkilerle entropi:
burada R gaz sabitidir.
Kısmi molar niceliklerin T ve p'ye bağımlılığı, karşılık gelen kapsamlı özelliklerle aynı termodinamik ilişkilerle belirlenir. Böylece, kimyasal potansiyel m i için, Gibbs enerjisi için geçerli olanlara benzer ilişkiler yerine getirilir, yani:
Bir bütün olarak sistem için fonksiyon M, karşılık gelen mol sayıları ile çarpılan bileşenlerin kısmi molar değerlerinin toplamıdır. Özellikle sistemin Gibbs enerjisi. Molar (spesifik) değer: . M m'nin molar değerinin T, p, x 1 , ... , x n-1 üzerindeki bağımlılıkları, kısmi molar miktarları bulmak için kullanılır:
Sistemin durumundaki bir değişiklikle kısmi molar miktarlardaki değişiklikler, genelleştirilmiş bir biçimde aşağıdaki gibi yazılan Gibbs-Duhem denklemi ile birbirine bağlanır:
T'de, p = const (izobarik-izotermal koşullar):
Bu denkleme göre, ikili bir sistemde, bileşim değiştiğinde kısmi molar miktarlar M1 ve M2 zıt yönlerde değişir. Varsa, M 1 (x 1) ve M 2 (x 1) eğrilerindeki uç noktalar aynı bileşimde gözlenir ve tip olarak zıttır. Örneğin, kimyasal potansiyeller için
T için, p = sabit
Bu oran, kalan bileşenlerin kimyasal potansiyellerinin konsantrasyon bağımlılığına dayalı olarak çözelti bileşeninin kimyasal potansiyelini hesaplamak için kullanılır ve ayrıca kimyasal potansiyellerin bileşime, sıcaklığa, sıcaklığa bağlılığına ilişkin deneysel verilerin termodinamik tutarlılığını kontrol etmek için kullanılır. vb.
2. Kısmi molar miktarları belirleme yöntemleri
Kısmi molar değerleri belirlemek için, çözeltinin genel kapsamlı özelliğinin bileşimine veya bileşenlerden birinin kısmi molar değerinin çözelti bileşimine bağımlılığına bağlı olması gerekir.
Kısmi molar miktarları belirleme yöntemleri analitik ve grafik olarak ikiye ayrılır.
2.1 Analitik yöntemler
Çözümün genel kapsamlı özelliğinin her bileşenin mol sayısına bağımlılığı, örneğin bir enterpolasyon denklemi şeklinde biliniyorsa, kısmi molar miktarlar, kapsamlı özellik için enterpolasyon denkleminin aşağıdakilerle türevlenmesiyle belirlenir. Bu bileşenin mol sayısına göre.
Karşılık gelen değeri elde edilen denklemde değiştirerek, belirli bir bileşimin çözümü için bu bileşenin kısmi molar değerini hesaplayın.
Bazı durumlarda, fizikokimyasal yöntemler işlevlerden yalnızca birini bulmayı mümkün kılar - . Örneğin, uçucu olmayan çözünenlerin çözeltilerinin buhar basıncından çözücünün yalnızca kısmi değeri bulunabilir. Bir bileşenin kısmi molar değerinin çözeltinin bileşimine bağımlılığı biliniyorsa, ikinci bileşenin kısmi molar değeri Gibbs-Duhem denklemi kullanılarak hesaplanabilir.
İkili bir çözelti için, çözücünün mol kesri x 1 ve çözünenin mol kesri x 2 veya x olsun.
Örneğin, tüm x değerleri aralığında bilinsin. denklemden
şunu izler:
x = 1 bileşiminden keyfi bir x = b değerine entegre etmek uygundur:
Bu, incelenen çözeltinin özelliklerinden bağımsız olarak ölçülebilen saf ikinci bileşenin molar değeridir. Bu durumda miktarın (0) sınır değerinin bilinmesi gerekir, yani. x>1 için.
2.2 Grafik yöntemler
Grafik Farklılaştırma Yöntemi
Deneysel verilere göre kısmi molar değerleri belirlemek için, çözümün genel kapsamlı özelliğinin belirli bir bileşenin mol sayısına bağımlılığının bir grafiği çizilir.
Herhangi bir noktada eğriye teğetin açısının tanjantı, bu bileşimin bir çözümünde bu bileşenin kısmi molar değerine karşılık gelecektir, çünkü
Bu yöntem, tanjant çizerken olası hatalar nedeniyle yeterince doğru değildir ve kısmi molar niceliklerden yalnızca birini belirlemenize olanak tanır.
Segment yöntemi.
Segment yöntemi, ikili çözümlerin kısmi molar değerlerini belirlemek için kullanılır. Kapsamlı Z özelliğinin bir mol çözelti için bileşime bağımlılığı deneysel olarak belirlenir ve Z - x koordinatlarında bir grafik çizilir, burada x ikinci bileşenin mol kesridir. Grafik türü herhangi biri olabilir. Görev, 0'ın tüm değerleri için ve değerleri bulmaktır. x? 1. Tanımdan = + = + . Denklemde iki bilinmeyen var - ve deneyimlerden bilinen bir değer. Tanım için gerekli ve ikinci denklem x'e göre türev alınarak elde edilir.
Önceki denklemler dikkate alındığında, son iki terimin toplamı 0'a eşittir ve sonra
Bağımlılık grafiğinin niteliksel bir analizi, eğriye teğet tarafından kesilen bölümlerin istenen değerler olduğunu ve olduğunu gösterir. Apsis tek bir segment olduğu için eğimin tanjantı segmente eşittir ve bu değerler arasındaki farktır.
Herhangi bir bileşimin bir çözümü için
ve değerleri deneysel eğriden bulunabilir.
İkinci bileşenin kısmi molar değerlerinin bilinen değerlerinden bir bileşenin kısmi molar değerinin grafiksel olarak belirlenmesi.
denklem
kısmi molar değerleri grafiksel olarak belirlemek için kullanılabilir. Grafik entegrasyon, koordinatlarda bir grafik oluşturmak için uygun olduğunda. O zamanlar:
bağımlılık eğrisi ve apsis ekseni ile sınırlanan alan tarafından kolayca belirlenir. Bağımsız kaynaklardan biliniyorsa, toplam değeri bulmak mümkündür.
2.3 İntegral çözünme ısısının bileşime interpolasyon bağımlılığının türetilmesi
Çözünmenin integral ısısının çözünenin mol sayısına bağımlılığını ampirik denklemle ifade edelim.
burada a,b,c ampirik sabitlerdir. O zamanlar
Koordinatlarda bir grafik oluşturalım, noktalarını tahmin edelim. Y ekseninde kesilen doğru parçası b'ye eşittir ve teğetin eğimli noktaya eğiminin tanjantı 2c'ye eşittir. Belirli bir mol sayısı n 2 olan bir çözelti için tam çözünme ısısını bilerek, denklemde a sabitini buluruz.
3. Deneysel kısım
3.1 Aletler ve reaktifler
1. Bir bilgisayara bağlı ULC "Termostat" modülü.
2. 100 ml beher.
5. NaNO3 kimyasal olarak saftır.
7. NH4Cl kimyasal olarak saftır.
3.2 Bir bilgisayar kullanarak ULC kontrolü
1. Evrensel denetleyici aşağıdakilere bağlanır: kişisel bilgisayarözel bir bağlantı kablosu kullanarak COM bağlantı noktası aracılığıyla.
2. Kontrolör açıldığında, ULC "Kimya" - elsms2.exe kontrol programını başlatmak gerekir.
3. Beliren başlatma penceresinde (“ULC'ye Hoş Geldiniz”), ULC - “Kontrolörle çalışma” veya “İşi yükle” seçeneğini seçmeli ve “Enter” düğmesine basarak ULC kontrol programına girmelisiniz. . İşi Yükle'yi seçtiğinizde, önceden kaydedilmiş bir laboratuvarı yükleyebilirsiniz.
5. Deney sırasında sıcaklık ölçülür, bu nedenle uygun pencerede ölçüm aralığını ve ölçüm sayısını ayarlamanız gerekir.
6. Ölçüm karıştırma ile yapıldığından karıştırma yoğunluğunu (örneğin 3) ayarlamak ve "Karıştırıcı" düğmesi ile karıştırıcıyı açmak gerekir.
7. Çalışma sırasında birkaç deney yapılabilir, bu nedenle her deney için örneğin numunenin ağırlığını belirtmek gerekir. (Daha sonra grafiğin sağ üst köşesinde numunenin ağırlığı belirtilecektir.) Bunu yapmak için, "Ek parametre" öğeleri grubunda "Genel" öğesini seçin ve "Değer" alanında ağırlığı belirtin örnek. Boyut "Boyut" alanında belirtilir.
8. "Ölçüm" butonu açılarak ölçüm başlatılır. Bu durumda, ölçüm durumu penceresi görünecektir - "Kontrolör ile veri alışverişi".
9. Sıcaklık değişimi küçük ve tekdüze olduğunda, tuz çözüldükten sonra ölçüm tamamlanmalıdır. "STOP" düğmesine basılarak ölçüm sonlandırılır. Bu durumda deneysel veriler otomatik olarak depolanır ve kurulum kontrol moduna geçer. Aşağıdaki ölçümlerin yapılabilmesi için "Mevcut durum" butonuna basılarak paragraflara uygun çalışma yapılması gerekmektedir. 5 - 8.
3.3 İş nasıl yapılır
İntegral çözünme ısılarının belirlenmesi, kalorimetre sabitinin belirlenmesiyle başlar. Bunu yapmak için 100 cm3 distile su ile doldurulmuş bir bardak kalorimetreye yerleştirilir ve içine sıcaklık sensörü sabitlenmiş bir kapakla kapatılır. Kapağın açıklığına, önceden bilinen bir çözünme ısısına (NH4Cl) sahip 2 g ezilmiş tuzun döküldüğü özel bir test tüpü yerleştirilir. Kalorimetrik bir deney yapın ve sıcaklıktaki değişikliği kaydedin. Daha sonra beherden solüsyon boşaltılır, beher çalkalanır, içine 100 ml distile su dökülür ve kalorimetreye yerleştirilir. Sıcaklıktaki değişikliği sabitlerken, araştırılan tuzun 2 g çözünmesini harcayın. Benzer şekilde 4, 6, 8, 10, 12, 16, 20 g çalışılan tuzun çözünmesini gerçekleştirin.
4. Sonuçlar ve tartışma
Kısmi molar çözünme ısılarının belirlenmesi, ısı dengesi denklemi ile gerçekleştirilir:
burada ve sırasıyla su ve tuzun kütlesi, g;
c, elde edilen çözeltinin ısı kapasitesidir, J/(HMA). Düşük konsantrasyonlarda, çözeltinin ısı kapasitesi yaklaşık olarak suyun ısı kapasitesine eşit alınabilir. Yüksek konsantrasyonlarda, çözeltinin ısı kapasitesi referans verilerden belirlenebilir. Kalorimetre sabiti aşağıdaki formülle belirlenir:
KCl'nin kısmi molar ısısının belirlenmesi:
NaCl'nin kısmi molar ısısının belirlenmesi:
NaNO 3'ün kısmi molar ısısının belirlenmesi:
, (deney aynı gün gerçekleştirildi)
Kısmi molar ısının belirlenmesi KNO 3:
Çözüm
Kalorimetrik ölçümleri kullanarak, elde edilen çözeltinin çeşitli konsantrasyonları için integral çözünme ısılarının değerini belirledik, kısmi çözünme ısılarını hesapladık, çözünme ısısının çözeltinin bileşimine bağımlılığını çizdik.
bibliyografya
kısmi molar enterpolasyon integrali
1. Stromberg A.G., Semchenko D.P. Fiziksel kimya. - M.: Kimya, 1999.
2. Fiziksel ve kimyasal miktarların kısa referans kitabı / ed. AA Ravdel, AM Ponomereva. - L.: Kimya, 1983.
3. Fiziksel kimya: I.A. Semiokhin - Moskova, MSU Yayınevi, 2001
4. Elektrolitlerin termodinamik özellikleri: Vasiliev V.P. - M. Kimya 1982.
5. Fiziksel kimya. Teorik ve pratik rehberlik: Nikolsky B.P. - 1987
6. Fiziksel kimyanın temelleri: Gorshkov V.I. - 1993
7. Kısa kurs Fiziksel Kimya: Kochergin S.M. - 1978
8. Fiziksel kimya: Zhukhovitsky A.A. - 1987
9. Fiziksel ve kolloid kimyası: Kuznetsov V.V. - 1968
10. http://www.xumuk.ru
Başvuru
Sonuçlar
NH 4 Cl 2g (kalorimetre sabiti tayini) DT = -1.207
KCl 2g DT= -0.9746
KCl 4g DT= -2.333
KCl 6g DT= -2.851
KCl 8g DT = -3.843
KCl 10g DT= -4.738
KCl 12g DT= -5.706
KCl 16g DT = -7.459
KCl 20g DT= -9.314
NH 4 Cl 2g (kolorimetre sabitinin belirlenmesi) DT \u003d -1.098
NaCl 2g DT= -0.2461
NaCl 4g DT= -0.5072
NaCl 6g DT= -0.6789
NaCl 8g DT= -0.8499
NaCl 10g DT= -1.008
NaCl 12g DT= -1.125
NaCl 16g DT = -1.303
NaCl 20g DT= -1.397
NaNO 3 2g DT = -0.7792
NaNO3 4g DT= -1.616
NaNO3 6g DT = -2.333
NaNO 3 8g DT = -3.143
NaNO3 10g DT= -3.745
NaNO3 12g DT = -4.222
NaNO3 16g DT = -5.253
NaNO 3 20g DT= -6.436
NH 4 Cl 2g (kolorimetre sabitinin belirlenmesi) DT \u003d -1.162
KNO 3 2g DT= -1.164
KNO 3 4g DT= -2.334
KNO 3 6g DT= -3.415
KNO 3 8g DT= -0.725
KNO 3 10g DT= -4.878
KNO 3 12g DT= -5.954
KNO 3 16g DT= -7.369
NH 4 Cl (kolorimetre sabitinin belirlenmesi) DT= -1.085
KNO 3 20g DT= -4.575
DH'ye karşı n i (KCl) diyagramı
DH'ye karşı n i (NaCl) diyagramı
DH'ye karşı n i (NaNO 3) diyagramı
DH'ye karşı n i (KNO 3) diyagramı
Allbest.ru'da barındırılıyor
...Benzer Belgeler
Çözüm teorisinin gelişimindeki ana yönler. termodinamik koşullarçözelti oluşumu. Kısmi molar miktarları belirleme yöntemleri. Raoult yasası, aşırı seyreltik ve ideal olmayan çözümler. Azeotropik karışımlar ve Gibbs-Konovalov yasaları.
dönem ödevi, eklendi 24/12/2014
Belirli bir miktarda propanın tam yanması için gereken hava hacminin belirlenmesi. Hess yasasının sonuçlarını kullanarak entalpi, entropi ve Gibbs enerjisindeki değişimin hesaplanması. Tanım molar kütleler oksitleyici ajan ve indirgeyici ajanın eşdeğerleri.
deneme, 02/08/2012 eklendi
Çözeltinin bileşenlerinin kısmi molar özellikleri hakkında teorik bilgilerin dikkate alınması. İkili bir çözeltide hacim, entropi, entalpi ve ısı kapasitesinin belirlenmesi. Çeşitli konsantrasyonlardaki test maddesinin sulu çözeltilerinin kütle yoğunluğunun hesaplanması.
eğitim kılavuzu, 24/05/2012 eklendi
İşaret değişimli polarizasyonda oksijensiz oksidanlı çözeltilerde bakır elektrot üzerindeki kısmi katodik ve anodik reaksiyonların karşılıklı bağlantısı. Bakırın klorür ve sülfat ortamında anot çözünmesi. Asitleştirilmiş sülfat ortamında çözünme.
tez, eklendi 12/13/2015
Propilen karbonat içinde lityum tetrafloroboratın seyreltik çözeltilerinin elektrik iletkenliğinin ölçülmesi. Sınırlayıcı molar elektriksel iletkenliklerin ve birleşme sabitlerinin hesaplanması. Tanım nicel özellikler iyon-moleküler etkileşimler.
dönem ödevi, 28/10/2011 eklendi
Polimer çözeltilerinin hazırlanması: polimer çözünme işlemi; çözeltilerin filtrelenmesi ve havasının alınması. Polimer çözelti filmlerinin üretim aşamaları. Plastikleştiriciler için genel gereksinimler. Kalıplama için çözeltinin hazırlanması. Sıvı bir film oluşumu.
dönem ödevi, eklendi 01/04/2010
İdeal yer değiştirme reaktörü. Tam karıştırma reaktörü. SO oksidasyon hızındaki değişim. Adyabatik katsayı ile sıcaklık değişiminin hesaplanması. Maddelerin denge konsantrasyonlarının hesaplanması, denge sabitleri. hesaplama kısmi basınçlar.
dönem ödevi, eklendi 11/20/2012
Çözümlerin tanımı, çeşitlerine bağlı olarak toplama durumuçözücü, çözünen parçacıkların boyutuna göre. Konsantrasyonu ifade etme yolları. Çözünürlüğü etkileyen faktörler. çözünme mekanizması. Raoult yasası ve sonucu.
sunum, eklendi 08/11/2013
Büyüyen tek kristaller sürecinin denge sabitinin hesaplanması. Cd ve Te bileşenlerinin süblimleşme süreci. Bileşenlerin kısmi buhar basınçlarının hesaplanması. Reaktörün şematik diyagramı ve sıcaklık dağılımı. Bileşenlerin oksidasyon olasılığının değerlendirilmesi.
tez, eklendi 12/11/2016
Hataların anlatım yöntemine, oluşum kaynağına ve deney koşullarına göre sınıflandırılması. Genel parametrelerin tahmini ve dağılımı rastgele değişkenler. Brüt hataları ortadan kaldırma yöntemleri. İki varyansın karşılaştırılması.
Bileşenlerden bir çözeltinin oluşumu kendiliğinden bir süreçtir. Bu nedenle, bir çözeltinin oluşumu için termodinamik koşul, P= const ve T= const Gibbs enerjisinin kaybı Δ G < 0. Такой процесс будет протекать самопроизвольно до тех пор, пока в системе не установится равновесие: растворяемый компонент (т, ж, г) растворяемый компонент (раствор). При равновесии ΔG= 0. İstisna, termodinamik olarak kararsız aşırı doygun çözeltilerdir. Termodinamik açısından, saf bir çözünen maddenin (katı, sıvı, gaz) kimyasal potansiyeli, bu maddenin çözeltideki kimyasal potansiyeline eşit olduğunda bir çözeltiye doymuş denir.
Bir çözeltinin oluşumu sırasında Gibbs enerjisindeki azalma, hem entalpi hem de entropi katkılarından kaynaklanabilir, çünkü Δ G= Δ H– TΔ S.
Çözümlere termodinamik yaklaşımın bir özelliği, çözeltilerdeki moleküler etkileşim mekanizması hakkında fikir gerektirmemesidir. Bu yaklaşımdaki ana konu, çözeltilerin özelliklerinin bileşenlerinin bileşimine ve özelliklerine bağımlılığını belirlemektir. Böyle bir bağımlılık oluşturmak için kısmi molar miktarlar kullanılır.
§ 5.5. Kısmi molar miktarlar
Nicelleştirilebilen çoğu özellik, kapsamlı ve yoğun olmak üzere iki gruba ayrılabilir.
yaygınözellikleri madde miktarı ile orantılıdır. Bunlar, örneğin, hacim ( V yaygın), kütle, iç enerji ( sen yaygın), entropi ( S yaygın), entalpi ( H yaygın), Gibbs enerjisi ( G yaygın) ve diğerleri Böylece, iki özdeş metal parçasının iç enerjisi, bir parçanın enerjisinin iki katıdır.Bir sistemin kapsamlı özellikleri, onu oluşturan parçaların kapsamlı özelliklerinden toplamsal olarak eklenir.
yoğun madde miktarına bağlı olmayan (sıcaklık ve basınç gibi) özelliklere denir. Çözeltiler için yoğun özellikler bileşim ile belirlenir. Örneğin, bir çözeltinin üzerindeki bir bileşenin buhar basıncı, konsantrasyonuna bağlıdır.Sistemin farklı bölümlerindeki yoğun özelliklerin değerleri eşitlenme eğilimindedir. Yoğun bir niceliğin ölçümü, değişimine her zaman bazı kapsamlı nicelikte bir değişikliğin eşlik ettiği gerçeğine dayanır. Bu nedenle, sıcaklığı ölçmek için, örneğin cıva gibi bir maddenin hacmindeki bir değişiklik kullanılır, yani. geniş mülk.
Çözücü ve çözünenden oluşan iki bileşenli bir çözelti düşünün. Kapsamlı özelliklerinden herhangi biri X yaygın mol sayısına bağlıdır P 1 çözücü, mol P 2 çözünen, basınç R ve sıcaklık T:
belirtmek
|
|
Kısmi molar değer içözümün -inci bileşeni (  ) bazı kapsamlı niceliğin kısmi türevi olarak adlandırılır ( X yaygın) bu bileşenin mol sayısına göre ( n i) sabit basınç, sıcaklık ve kalan bileşenlerin mol sayısı.
) bazı kapsamlı niceliğin kısmi türevi olarak adlandırılır ( X yaygın) bu bileşenin mol sayısına göre ( n i) sabit basınç, sıcaklık ve kalan bileşenlerin mol sayısı.
Aynı fikir başka bir biçimde ifade edilebilir: kısmi molar miktar ile i-inci bileşen, bir mol eklendiğinde çözeltinin bu kapsamlı özelliğindeki değişikliktir. i Bileşeni sabit basınç ve sıcaklıkta büyük miktarda çözeltiye. Çok miktarda çözelti, bir mol eklenmesi anlamına gelir. i inci bileşen, çözeltinin bileşimini pratik olarak değiştirmez.
Saf bir madde için kısmi molar değer, saf maddenin özelliğine eşittir.
|
|
burada "sıfır" indeksi, maddenin saf halde olduğu anlamına gelir.
Çözeltinin termodinamik özellikleri G yaygın ,
H yaygın ,
S yaygın ,
V yaygın vb. kısmi molar miktarlara karşılık gelir i-inci bileşen:  kısmi molar Gibbs enerjisidir;
kısmi molar Gibbs enerjisidir; 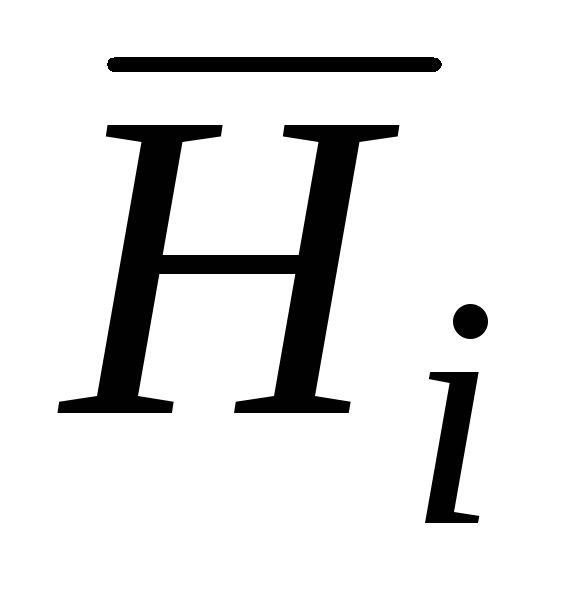 kısmi molar entalpidir;
kısmi molar entalpidir; 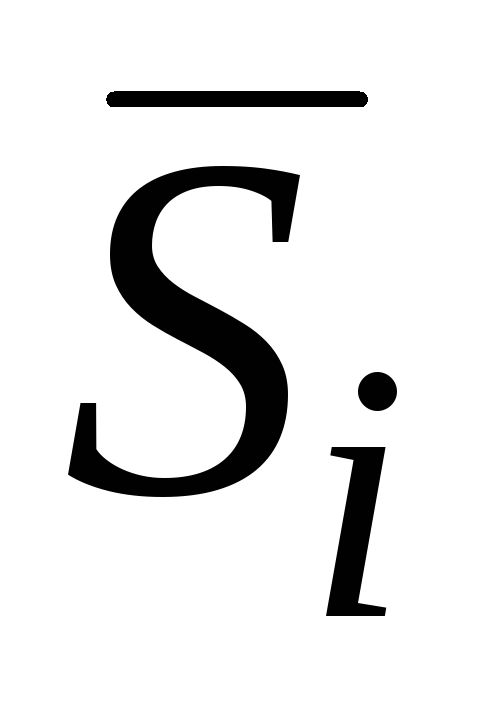 kısmi molar entropi;
kısmi molar entropi;  - kısmi molar hacim, vb.
- kısmi molar hacim, vb.
Kısmi molar miktarlar arasında en önemlisi kısmi molar Gibbs enerjisidir. 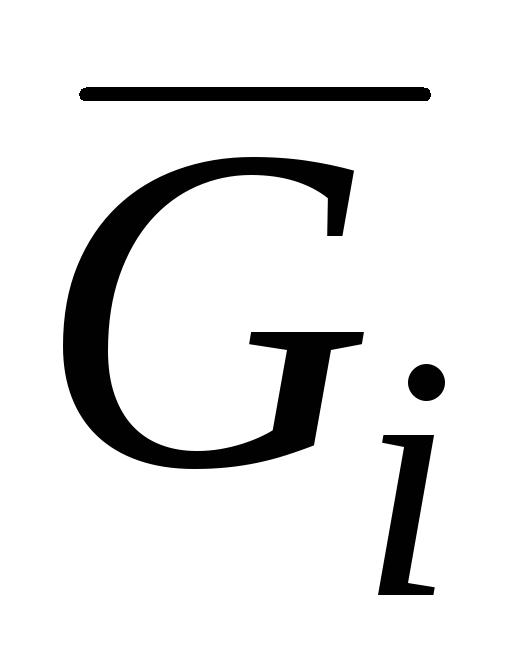 , kimyasal potansiyel ile aynıdır:
, kimyasal potansiyel ile aynıdır:
|
|
hangi denklemlerin bir karşılaştırmasından izler (3.3) ve (5.6) .
Kısmi molar niceliklerin pratik önemi, formdaki aynı termodinamik ilişkilerin, sıradan termodinamik nicelikler arasında olduğu gibi aralarında korunması gerçeğinde yatmaktadır.
Örneğin, denklemdeki Gibbs enerjisi () (G= H– TS) mol sayısına göre türevi alın n i kararlılıkla P, T ve n j, alırız
|
| |||||
|
μ i
|
kimyasal potansiyel i-inci bileşen; kısmi molar Gibbs enerjisi i-inci bileşen; kısmi molar entalpi i-inci bileşen; kısmi molar entropi i-inci bileşen. |
||||
Böylece, kısmi molar miktarların yardımıyla, bir saf madde için kimyasal termodinamiğin tüm matematiksel aparatı çözümlere uygulanabilir. Bu, çözeltinin üzerindeki bileşenlerin buhar basıncını, donma noktasındaki düşüşü ve çözeltinin kaynama noktasındaki artışı, maddelerin çözünürlüğünü içeren bir çözeltinin herhangi bir denge özelliğini termodinamik denklemlerle ifade etmeyi mümkün kılar. ozmotik basınç, bir maddenin birbiriyle karışmayan iki çözücü arasındaki dağılımı vb.
Çözüm bileşenlerinin kısmi molar değerleri arasındaki ilişkileri türetmek için denklemi entegre ederiz. (5.7) çözeltinin sabit bir bileşiminde. Bu koşul, her iki bileşenin de çözeltiye küçük porsiyonlarda ve çözeltinin bileşiminin değişmeyeceği bir oranda eklenmesi (yani aynı konsantrasyonda küçük miktarlarda çözelti eklenmesi) anlamına gelir. O zaman kısmi molar miktarlar sabit kalacaktır. nerede
|
|
Bu denklemdeki integrasyon sabiti sıfıra eşittir, çünkü P 1 = 0 ve P 2 = 0 harç özelliği X yaygın ayrıca sıfıra eşittir.
Böylece, herhangi bir çözüm için bileşenlerin özelliklerinden herhangi bir kapsamlı özellik, molar değilse, ancak kısmi molar değerler kullanılırsa, katkı ilavesiyle bulunabilir.
Bununla birlikte, çözeltinin hem miktarı hem de bileşimi aynı anda değiştirilirse, özellikteki değişiklik X yaygın denklemin türevi alınarak bulunabilir. (5.10) :
Denklemlerin her iki tarafını ayırıyoruz (5.10) ve (5.12) üzerinde P 1 + P 2. Verilen
sırasıyla elde ederiz
mol çözelti Her bileşenin mol sayısının mol fraksiyonuna eşit olduğu miktarı denir.
çözümü için i bileşenlerin toplamı tüm üzerinde yapılmalıdır i bileşenler:
Bir çözeltinin kapsamlı özelliklerindeki değişikliği karakterize eden kısmi molar miktarlar, özelliklerin aksine hem pozitif hem de negatif olabilir. Hacim değişmeden bileşenlerden çözelti oluşturulursa, bileşenin kısmi molar hacminin molar hacmine eşit olduğu açıktır. Güçlü moleküler etkileşim nedeniyle, bir bileşen bir çözeltiye eklendiğinde hacimde bir azalma meydana gelirse, kısmi molar hacim negatif bir değer olacaktır.
İkili sistemlerin kısmi molar değerleri analitik ve grafiksel yöntemlerle belirlenebilir. En çok kullanılan grafik yöntemi segmentler. Bunu yapmak için, deneysel verilere göre, kapsamlı özelliğin, örneğin çözeltinin molar hacminin bileşim üzerindeki grafiksel bir bağımlılığı oluşturulur (Şekil 5.1.).
Ardından, belirli bir kompozisyonla (örneğin, noktada ANCAK) eğriye bir teğet çizin. Bu teğetin noktalarda ordinat eksenleriyle kesişimi AT ve İTİBAREN kısmi molar miktarların değerlerini verir 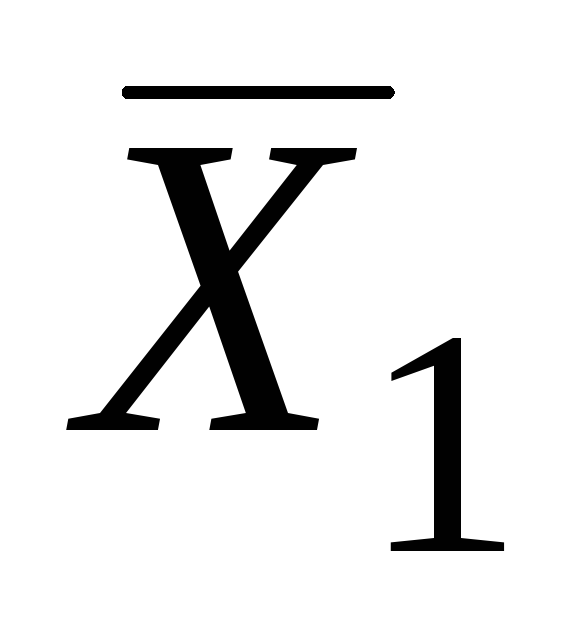 ve
ve 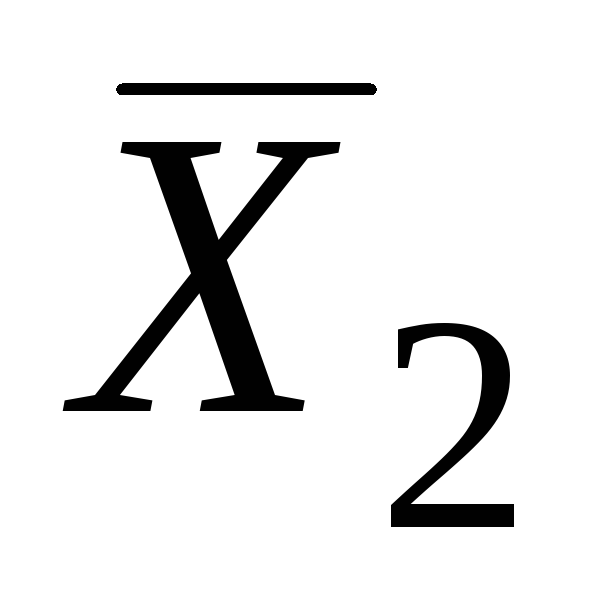 .
.
Kısmi molar değerler de çözeltinin özelliklerinin bağımlılığından belirlenebilir. X sabit sıcaklık basıncında çözünmüş bileşenin mol sayısı ve çözücü miktarı. Grafikteki eğriye teğetin eğiminin tanjantı X yaygın = f(n 2) kısmi molar değere eşittir.

Bir bileşenin kısmi molar değeri denklemden hesaplanabilir. (5.14) , diğerinin kısmi molar büyüklüğünü bilerek:
|
Bu denklemi entegre ederken,
| ||||
|
|
sistemin farklı bileşimi için kısmi molar değerler. |
|||
İntegralin değeri, koordinatlarda çizilen bir grafikten bulunur.  .
.