Moleküler fizik. Doymuş ve doymamış çiftler. İşletmenin buhar ve buhar yoğuşma tesisleri
Tablo, sıcaklığa bağlı olarak doyma çizgisi üzerindeki su buharının termofiziksel özelliklerini göstermektedir. Buhar özellikleri 0.01 ila 370°C sıcaklık aralığında tabloda verilmiştir.
Her sıcaklık, su buharının doyma durumunda olduğu basınca karşılık gelir. Örneğin, 200°C'lik bir su buharı sıcaklığında, basıncı 1.555 MPa veya yaklaşık 15.3 atm olacaktır.
Buharın özgül ısı kapasitesi, ısıl iletkenliği ve artan sıcaklıkla artması. Su buharının yoğunluğu da artar. Su buharı, bazı ısı eşanjörlerinde ısı taşıyıcı olarak buharın seçiminde olumlu bir etkiye sahip olan yüksek bir özgül ısı kapasitesi ile sıcak, ağır ve viskoz hale gelir.
Örneğin, tabloya göre, özısı su buharı KP 20°C sıcaklıkta 1877 J/(kg°)'ye eşittir ve 370°C'ye ısıtıldığında buharın ısı kapasitesi 56520 J/(kg°) değerine yükselir.
Tablo, doyma çizgisindeki su buharının aşağıdaki termofiziksel özelliklerini vermektedir:
- belirli bir sıcaklıkta buhar basıncı s 10 -5, Pa;
- buhar yoğunluğu ρ″ , kg / m3;
- özgül (kütle) entalpi h", kJ/kg;
- buharlaşma ısısı r, kJ/kg;
- buharın özgül ısı kapasitesi KP, kJ/(kg derece);
- termal iletkenlik katsayısı λ 10 2, W/(m derece);
- termal yayılım 10 6, m2/sn;
- dinamik viskozite μ 10 6, Pa s;
- kinematik viskozite 10 6, m2/sn;
- Prandtl numarası Halkla İlişkiler.
Artan sıcaklıkla, su buharının özgül buharlaşma ısısı, entalpi, termal difüzyon ve kinematik viskozitesi azalır. Bu durumda buharın dinamik viskozitesi ve Prandtl sayısı artar.
Dikkat olmak! Tablodaki ısıl iletkenlik 10 2'nin gücüne verilmiştir. 100'e bölmeyi unutmayın! Örneğin, 100°C sıcaklıkta buharın termal iletkenliği 0.02372 W/(m°)'dir.
Su buharının çeşitli sıcaklık ve basınçlarda ısıl iletkenliği
Tablo, 0 ila 700°C arasındaki sıcaklıklarda ve 0,1 ila 500 atm arasındaki basınçta su ve buharın termal iletkenlik değerlerini göstermektedir. Termal iletkenlik birimi W/(m derece)'dir.
Tablodaki değerlerin altındaki çizgi suyun buhara faz geçişini ifade etmektedir, yani çizginin altındaki sayılar buharı, üstündeki sayılar ise suyu ifade etmektedir. Tabloya göre, artan basınçla katsayının ve su buharının değerinin arttığı görülmektedir.
Not: Tablodaki ısıl iletkenlik 10 3 kuvvetine göre verilmiştir. 1000'e bölmeyi unutmayın!
Su buharının yüksek sıcaklıklarda ısıl iletkenliği
Tablo, 1400 ila 6000 K sıcaklıklarda ve 0,1 ila 100 atm basınçlarda W/(m derece) cinsinden ayrışmış su buharının termal iletkenlik değerlerini gösterir.
Tabloya göre, su buharının ısıl iletkenliği yüksek sıcaklıklar 3000...5000 K bölgesinde belirgin şekilde artar. Yüksek basınçlarda, daha yüksek sıcaklıklarda maksimum termal iletkenlik katsayısı elde edilir.
Dikkat olmak! Tablodaki ısıl iletkenlik 10 3 kuvvetine göre verilmiştir. 1000'e bölmeyi unutmayın!
Tema “Doymuş çiftler. Okul çocukları için nem ”oldukça karmaşıktır. Derslerde buna çok az dikkat edilir ve düşünülen sıvı-buhar arayüzey etkileşimi fenomeni olağandışıdır.
Yukarıdaki problemleri çözmenin temeli, buharlaşma ve yoğuşma oranları aynı olduğunda sıvının ve doymuş buharının dinamik bir denge halinde olduğu fikridir. Moleküllerin basıncı ve konsantrasyonu doymuş buhar sadece sıcaklığına bağlıdır. Ayrıca doymuş buharın özelliklerini hesaplamak için Mendeleev-Claiperon denklemini kullanabilirsiniz.
Genellikle sınavda bu tür görevler nadirdir. Bununla birlikte, görevler çok ilginçtir ve davranışlar arasındaki farkları hissetmenizi sağlar. ideal gazlar ve doymuş buharlar. Bizce, çözümlerini anladıktan sonra, bu konuyu anlamakta artık herhangi bir zorluk yaşamayacaksınız.
Görev numarası 1. Basınç, kapalı bir kaptaki doymuş buhar moleküllerinin sayısı (bölüm A, temel seviye)
Çözüm:
Tipik bir durum: kapalı bir hacimde buhar ve sıvı dengededir. Sorunun metninde doğrudan bir gösterge olmasa bile, buharın doymuş olduğu açıktır. Sıcaklık değişmez, yani buhar moleküllerinin konsantrasyonu sabittir, moleküllerin sayısı ve kütlesi hacimle orantılıdır. Hacim 3 kat azalırsa, molekül sayısı da 3 kat azalacaktır.
Cevap numarası 4.
Görev numarası 2. Kapalı bir kapta basınç, kütle, doymuş buhar moleküllerinin konsantrasyonu (bölüm A, temel seviye)

Aslında aynı problem farklı bir formülasyonda.
Görev numarası 3. Psikrometre Okumaları (Bölüm A, Başlangıç)

Çözüm:
görev aslında laboratuvar işi bir psikrometre ile nemi ölçmek için sadece yaş termometre okumasını tahmin etmeniz yeterlidir.
Çözmek için termometrelerin okumalarını okuruz: kuru - 23, ıslak -16 santigrat derece. Tabloya göre bunun %48 neme karşılık geldiğini tespit ediyoruz. Nem %7 artarsa (%55'e kadar), o zaman (tablonun aynı satırında, solda buluyoruz) termometrelerin okumalarındaki fark 6 derece olacaktır. Dolayısıyla ıslak 23-6=17 derece gösterecektir. Cevap numarası 3.
Görev numarası 4. Kapalı Bir Kapta Doymuş Buhar Basıncı (Kısım A, Yüksek Seviye)

Çözüm:
Kapalı bir hacimde buhar ve sıvı dengededir, bu nedenle buhar doymuştur. Hacim arttıkça su buharlaşacak ve buhar mümkün olduğunca uzun süre doymuş kalacaktır. Açıkçası, tüm su buharlaşacak ve hacim iki katına çıkana kadar buhar doymuş kalacaktır (çünkü sıvının kütlesi başlangıçta buharın kütlesine eşittir). Bu durumda basınç değişmez.
Buhar hacminde daha fazla bir artışla doygunluk sona erecek, parametreleri şu şekilde tanımlanabilir: izotermal süreç. Hacimde 2 kat daha fazla artış, basınçta iki kat azalmaya yol açacaktır.
Toplamda, bu sistemde hacimde 4 kat artış ile basınç 2 kat azalacaktır.
Cevap numarası 2.
Deneme testinin 2 No'lu seçeneğinde ters bir sorun vardı, ancak yalnızca şu bilinerek çözülebilirdi. 100 santigrat derecede, buhar basıncı 100 kPa'dır (1 atm), 6 numaralı problemin çözümünde kullanılır. Bir sıvının kaynamasının, doymuş buhar basıncının dış basınca eşit olduğu bir sıcaklıkta başladığını bilerek, bu basınç değerini hatırlamak kolaydır.
Görev numarası 5. Doymuş ve doygun için basıncın hacme bağımlılığı doymamış buharlar(Bölüm C, ileri seviye)

Görev numarası 6. Doymuş buharları olan kapalı bir tüpteki su seviyesi (kısım C, yüksek seviye)
Yaklaşık yarım metre uzunluğunda, bir ucu mühürlenmiş geniş bir cam tüp tamamen suyla doldurulur ve açık ucu aşağı gelecek şekilde dikey olarak yerleştirilir ve tüpün tabanı bir su kabına birkaç santimetre daldırılır. Oda sıcaklığında, tüp tamamen suyla dolu kalır. Havzadaki su yavaş yavaş ısıtılır. Lavabodaki su kaynamaya başladığında tüpteki su seviyesi nerede olacak? Cevabınızı fiziksel yasaları kullanarak açıklayın.
Çözüm.
Oda sıcaklığında, su, tüpün tüm hacmini kaplar ve dışarı akmaz, çünkü oda sıcaklığında doymuş su buharının basıncı çok düşüktür ve doymuş su buharı ile dolu bir “Toricellian boşluğu” sadece suyun üzerinde görünecektir. su sütununun yüksekliği yaklaşık 10 metre ise.
Suyun sıcaklığı arttıkça, doymuş buharının basıncı, kaynama noktasında dış atmosfer basıncına eşit olana kadar artar.
Sıcaklık kaynama noktasına yaklaştığında, suyun üzerinde doymuş su buharı ile dolu bir alan belirecektir. Sıcaklık daha da yükseldikçe tüpteki su seviyesi düşecektir. Kaynama noktasında tüpteki doymuş su buharının basıncı eşittir ve atmosferik basınç, böylece tüpteki ve lavabodaki su seviyesi aynı olacaktır.
Görev numarası 7. Doymuş buhar kütlesi (kısım A, temel)

Çözüm:
Belirli bir sıcaklıkta doymuş buhar basıncının atmosferik basınca eşit olduğu göz önüne alındığında, problem Mendeleev-Claiperon denklemi kullanılarak kolayca çözülür.
Buharlaşma sırasında, moleküllerin sıvıdan buhara geçişi ile eş zamanlı olarak, ters işlem de gerçekleşir. Sıvının yüzeyinin üzerinde rastgele hareket eden moleküllerin bir kısmı tekrar sıvıya döner.
Doymuş buhar basıncı.
Sıcaklığı sabit tutulan doymuş buhar sıkıştırıldığında, denge önce bozulmaya başlayacaktır: buhar yoğunluğu artacak ve sonuç olarak gazdan sıvıya sıvıdan gaza göre daha fazla molekül geçecektir; bu, yeni hacimdeki buhar konsantrasyonu, belirli bir sıcaklıkta doymuş buhar konsantrasyonuna karşılık gelen aynı hale gelene kadar devam edecektir (ve denge yeniden sağlanır). Bu, birim zamanda sıvıyı terk eden molekül sayısının sadece sıcaklığa bağlı olduğu gerçeğiyle açıklanır.
Böylece, doymuş buhar moleküllerinin konsantrasyonu Sabit sıcaklık hacmine bağlı değildir.
Bir gazın basıncı moleküllerinin konsantrasyonu ile orantılı olduğundan, doymuş bir buharın basıncı kapladığı hacme bağlı değildir. Baskı yapmak p 0 sıvının buharıyla dengede olduğu duruma denir. doymuş buhar basıncı.
Doymuş buhar sıkıştırıldığında, çoğu buhara dönüştürülür. sıvı hal. Bir sıvı, aynı kütleye sahip bir buhardan daha küçük bir hacim kaplar. Sonuç olarak, sabit yoğunluktaki buharın hacmi azalır.
Doymuş buhar basıncının sıcaklığa bağımlılığı.
İdeal bir gaz için, doğrusal bağımlılık basınca karşı sıcaklığa karşı sabit hacim. Basınçlı doymuş buhara uygulanır p 0 bu bağımlılık eşitlikle ifade edilir:
p 0 =nkT.
Doymuş buharın basıncı hacme bağlı olmadığından, bu nedenle yalnızca sıcaklığa bağlıdır.
Deneysel olarak belirlenen bağımlılık p 0 (T) bağımlılıktan farklı ( p 0 =nkT) için Ideal gaz.
Artan sıcaklıkla, doymuş buharın basıncı, ideal bir gazın basıncından daha hızlı artar (eğrinin kesiti). AB resimde). Bu, özellikle noktadan bir izokor çizersek belirginleşir. A(kesik çizgi). Bunun nedeni, sıvı ısıtıldığında bir kısmının buhara dönüşmesi ve buhar yoğunluğunun artmasıdır. Bu nedenle, formüle göre ( p 0 =nkT), doymuş buharın basıncı, yalnızca sıvının sıcaklığındaki bir artışın bir sonucu olarak değil, aynı zamanda buharın moleküllerinin konsantrasyonundaki (yoğunluğu) bir artıştan dolayı da artar. İdeal bir gazın ve doymuş buharın davranışındaki ana fark, sabit bir hacimde (kapalı bir kapta) sıcaklıktaki bir değişiklikle veya sabit bir sıcaklıkta hacimdeki bir değişiklikle buhar kütlesindeki değişikliktir. İdeal bir gazla böyle bir şey olamaz (ideal gazın moleküler-kinetik teorisi, faz geçişi gazdan sıvıya).
Tüm sıvının buharlaşmasından sonra, buharın davranışı ideal bir gazın davranışına karşılık gelecektir (bölüm Güneş Yukarıdaki şekilde eğri).
doymamış buhar.
Bir sıvının buharını içeren bir boşlukta, bu sıvının daha fazla buharlaşması meydana gelebilirse, bu boşluktaki buhar, doymamış.
Sıvısı ile dengede olmayan buhara doymamış buhar denir.
Doymamış buhar basit sıkıştırma ile sıvıya dönüştürülebilir. Bu dönüşüm başladığında, sıvı ile dengede olan buhar doymuş hale gelir.
Sayfa 1 / 5
7.1. Tablo 8, boşluğu dolduran su buharının basıncını verir. farklı sıcaklıklar. Bu verilerden bir tablo nasıl yapılır m hacimce su buharı kütleleri V \u003d 1 m3 farklı sıcaklıklarda su buharı ile doymuş hava Örneğin, problemi bir sıcaklıkta çözün t\u003d 50 ° C
7.2. Sıcaklıktaki p yoğunluğunu ve doymuş su buharını bulun t=50°C.

7.3. yoğunluğunun kaç katı p ve bir sıcaklıkta doymuş su buharı t= 16°C daha az yoğunluk p su.

7.4. t 1 \u003d 200 ° C sıcaklıkta kaç farklı yoğunluk p ve 1 doymuş su buharı yoğunluktan daha büyüktür p n2 t 1 \u003d 100 ° C sıcaklıkta doymuş su buharı?

7.5. kütle nedir m hacimde bulunan su buharı V Bir yaz gününde t \u003d 30 ° C sıcaklıkta ve bağıl nemde \u003d 1m 3 hava w = 0,75 ?

7.6. Kapalı bir alanda V= 1 m3 bağıl nem hava w = 0,6 sıcaklıkta t\u003d 20 ° C Kütle nedir d m Su buharının doygun hale gelmesi için yine de bu hacimden suyun buharlaşması gerekir mi?

7.7. Oda sıcaklığı / g = 18 °C, bağıl nem eş = 0,5 Metal bir su ısıtıcısına soğuk su döküldü, sıcaklık nedir? tz su ısıtıcısının buğulanmayı durduracağı su?


7.8. bir numara bul n t 1 = 30 ° C sıcaklıkta birim hacimde bulunan doymuş su buharı molekülleri.

7.9. Kütle m=0.5 g su buharı hacmi kaplar 1\u003d 10 l t \u003d 50 ° C sıcaklıkta, bağıl nem nedir w? Hacim V 1'den izotermal olarak düşürülürse, hangi kütle dm buhar yoğunlaşır? V 2 \u003d V 1/2?


7.10. Hacmi K = 1 litre olan bir bulut odası, su buharıyla doymuş hava içerir. İlk sıcaklık hazne r = 20 °C Piston hareket ettiğinde haznenin hacmi
V2 = 1.25k, . Genişleme adyabatik olarak kabul edilir ve adyabatik üs 1.4'tür. Şunları bulun: a) genleşmeden önceki su buharı basıncı; b) kütle m 1 genişlemeden önce haznedeki su buharı; c) genleşmeden önce su buharının yoğunluğu p 1; d) sıcaklık t2 genleşmeden sonra buhar (buhar yoğuşması sırasında ısı salınımından kaynaklanan sıcaklık değişimlerini ihmal edin); e) kütle dm yoğunlaştırılmış buhar; f) yoğunluk p2 su buharı
yoğunlaşmadan sonra; g) aşırı doygunluk derecesi, yani. genleşmeden sonra (ancak yoğuşmadan önce) su buharının yoğunluğunun, yoğuşmadan sonra belirlenen sıcaklıkta alanı doyuran su buharının yoğunluğuna oranı


7.11. Normal koşullar altında sıvı ve buhar halindeki suyun özgül hacmini v bulun.
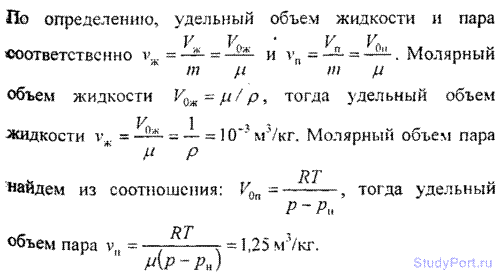
7.12. Termodinamiğin birinci yasasını ve Tablo 7'deki verileri kullanarak ve 8, buharlaşmanın özgül ısısını bulun r t = 200 ° C'de su. Su için kritik sıcaklık T'ye= 647 K, kritik basınç p= 22 MPa. Tablo 9'a göre elde edilen sonucun doğruluğunu kontrol edin.
7.13. Suyun buharlaşma ısısının hangi kısmı t \u003d 100 ° C sıcaklıkta artar? içsel enerji sistemler?

7.14. t \u003d 77 ° C sıcaklıkta benzenin buharlaşma özgül ısısı (C 6 H 6) r'ye eşittir = 398 kJ/kg. İç enerjideki değişimi bulun d W kütlenin buharlaşması sırasında dm = 20 g benzen.

7.15. Clausius-Clapeyron denklemini ve Tablo 8'deki verileri kullanarak, özgül buharlaşma ısısını bulun r
sıcaklıkta su t = 5 ° C. Tablo 9'a göre elde edilen sonucun doğruluğunu kontrol edin.


7.16. t 1 \u003d 100 ° C sıcaklıklarda doymuş cıva buhar basıncı ve t2 = 120 ° C, p 1 \u003d 37,3 Pa ve p 2 \u003d 101,3 Pa'dır.
ortalamayı bul özısı buharlaşma r belirtilen sıcaklık aralığında cıva.


7.17. Benzenin (C 6 H 6) p \u003d 0.1 MPa basıncında kaynama noktası t k \u003d 80.2 ° C'dir. Basıncı bulun p bir sıcaklıkta doymuş benzen buharı t = 15.6° C. Bu sıcaklık aralığında benzenin özgül buharlaşma ısısının ortalama değeri r = 0.4 MJ/kg olarak alınır.

7.18. t 1 \u003d 40 ° C ve t 2 \u003d 60 ° C sıcaklıklarda doymuş etil alkol buharının (C 2 H 5 OH) basıncı eşittir
p1 =17,7 kPa ve p2 =67,9 kPa. Kütle d'nin buharlaşması sırasında entropi dS'deki değişimi bulun m = 1 G bir sıcaklıkta etil alkol t\u003d 50 ° C

7.19. t 1 \u003d 50 ° C sıcaklıkta dv \u003d 1 mol bir miktar sıvının buharlaşması sırasında entropideki değişiklik dS \u003d 133J / K'dir. t 1 = 50 ° C sıcaklıkta doymuş buhar basıncı p 1 = 12.33 kPa'dır. Bir sıvının doymuş buhar basıncı, sıcaklıktaki bir değişiklikle ne kadar değişir? 1 = 50°C ila t1\u003d 51 0 C?


7.20. Hangi basınç sınırına p Pompanın su ceketinin sıcaklığı t = 15°C ise, cıva kapanı olmadan çalışan bir cıva difüzyon pompası kullanılarak kap boşaltılabilir mi? t 0 \u003d 0 ° C sıcaklıkta doymuş cıva buharının basıncı p0\u003d 0.021 Pa, bu sıcaklık aralığında cıvanın özgül buharlaşma ısısının ortalama değeri, r'ye eşit olarak alınır. = 10.08 MJ/kt.
TANIM
su buharı- bu gaz hali su.
Rengi yok, tadı yok, kokusu yok. Su doğada en çok bulunan maddedir. Gaz olarak var olmasının yanı sıra, her biri sıcaklık ve basınç tarafından belirlenen sıvı veya katı (buz) halde de olabilir (Şekil 1).
Pirinç. 1. Su durumunun şeması.
AO eğrisi buz-buhar sistemindeki dengeye, DO - aşırı soğutulmuş su-buhar sistemindeki dengeye, OC eğrisi - su-buhar sistemindeki dengeye ve OB eğrisi - içindeki dengeye karşılık gelir. buzlu su sistemi. O noktasında tüm eğriler kesişir. Bu nokta denir üçlü nokta ve buz-su-buhar sistemindeki dengeye karşılık gelir.
Su buharının ampirik formülü, suyun ampirik formülü ile örtüşür ve 2 O formuna sahiptir. Bilindiği gibi, bir molekülün moleküler ağırlığı, bağıl molekül ağırlığının toplamına eşittir. atom kütleleri molekülü oluşturan atomlar (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atom kütlelerinin değerleri tam sayılara yuvarlanır).
Mr(H20) = 2×Ar(H) + Ar(O);
Bay(H 2 O) \u003d 2 × 1 + 16 \u003d 2 + 16 \u003d 18.
Molar kütle (M), 1 mol maddenin kütlesidir. Molar kütle M ve bağıl moleküler kütle M r'nin sayısal değerlerinin eşit olduğunu göstermek kolaydır, ancak ilk değer [M] = g/mol boyutuna sahiptir ve ikincisi boyutsuzdur:
M = N A × m (1 molekül) = N A × M r × 1 a.m.u. = (NA ×1 amu) × M r = × M r .
Demek oluyor molar kütle su buharı 18 g/mol.
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | 0,5 g hidrojen gazı oluşursa, hidroklorik asit ile kaç gram çinko reaksiyona girer? |
| Çözüm | Çinkonun hidroklorik asit ile etkileşimi için reaksiyon denklemini yazıyoruz: Zn + 2HCl \u003d ZnCl2 + H2. Moleküler hidrojenin molar kütlesini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atomik kütlenin değeri bir tam sayıya yuvarlanacaktır). (H 2) \u003d 2 × Ar (H) \u003d 2 × 1 \u003d 2 g / mol anlamına gelen M \u003d Mr olduğu bilinmektedir. Hidrojen maddesi miktarını hesaplayın: n(H)=m(H)/ M(H); n (H) \u003d 0,5 / 2 \u003d 1 mol. Reaksiyon denklemine göre n (H 2) : n (Zn) \u003d 1: 1, yani n (Zn) \u003d 1 mol. Çinkonun molar kütlesini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan, bir tam sayıya yuvarlanmış nispi atom kütlesinin değeri). (Zn) = 65 g/mol anlamına gelen M = Mr olduğu bilinmektedir. Çinko kütlesini belirleyin: m(Zn) = n (Zn) × M (Zn); m(Zn) = 1 × 65 = 65 gr. |
| Cevap | Çinko kütlesi 65 g'dır. |
ÖRNEK 2
| Egzersiz yapmak | Hidrojen ile indirgendiğinde bundan 128 g bakır elde etmek için hangi kütlede bakır (II) okside ihtiyaç vardır? |
| Çözüm | Bakır (II) oksidin hidrojen ile indirgenmesi için denklemi yazıyoruz: CuO + H2 \u003d Cu + H20. Bakırın molar kütlesini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan, bir tam sayıya yuvarlanmış bağıl atom kütlesinin değeri). (Cu) = 64 g/mol anlamına gelen M = Mr olduğu bilinmektedir. Bakır madde miktarını hesaplayın: n(Cu)= m(Cu)/ M(Cu); n (Cu) \u003d 128/ 64 \u003d 2 mol. Reaksiyon denklemine göre n(Cu) :n(CuO) = 1: 1, yani n(CuO) = 2 mol. Bakır (II) oksidin molar kütlesini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atomik kütlelerin değerleri tam sayılara yuvarlanır). Bilindiği gibi, bir molekülün molar kütlesi, molekülü oluşturan atomların bağıl atom kütlelerinin toplamına eşittir (M = Mr): M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 g/mol. Bakır oksit (II) kütlesini belirleyelim: m(CuO) = n(CuO) × M(CuO); m(CuO) \u003d 2 × 80 \u003d 160 g. |
| Cevap | Bakır (II) oksidin kütlesi 160 g'dır. |






