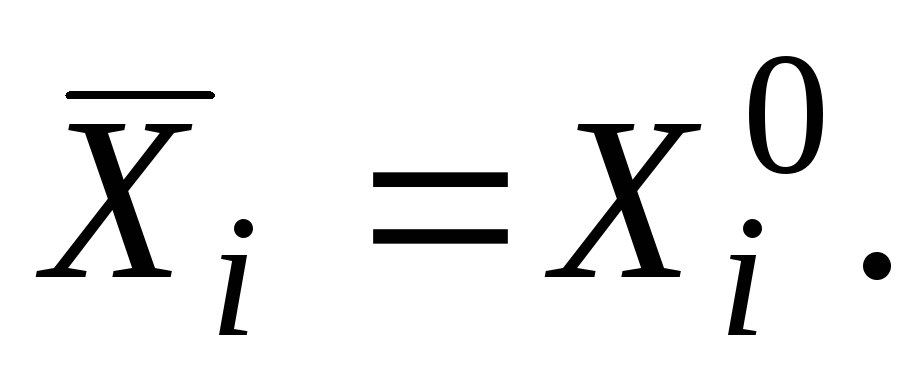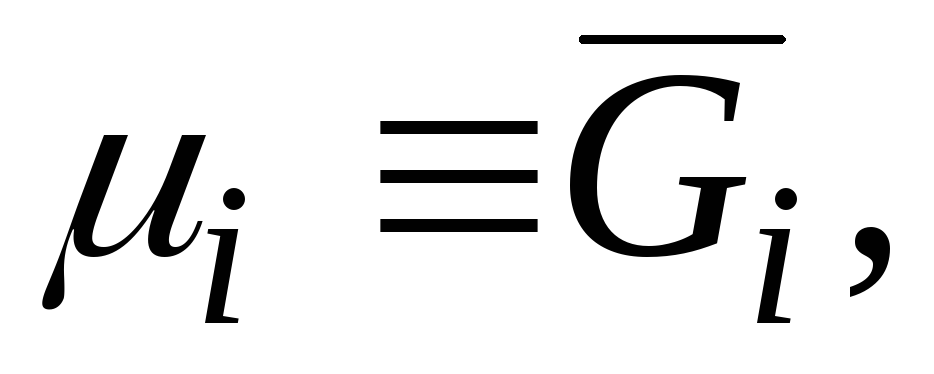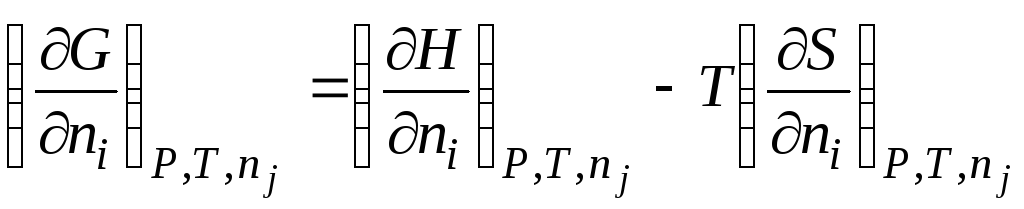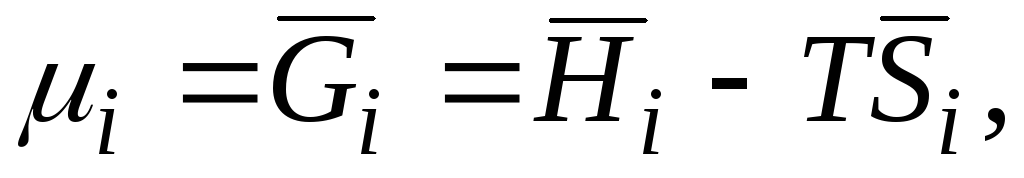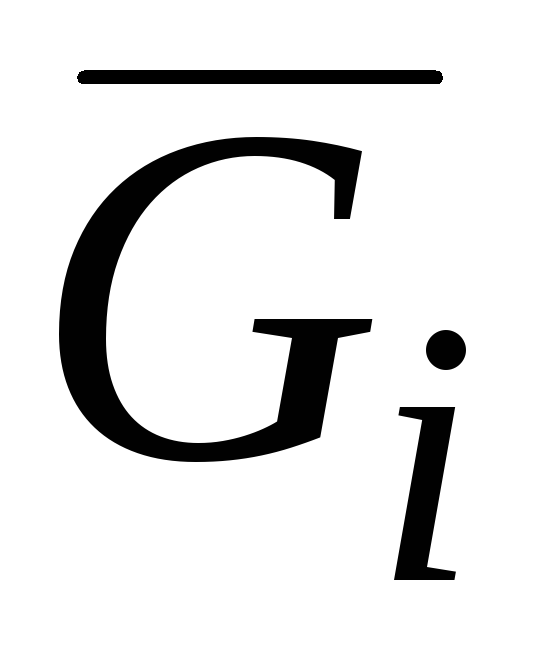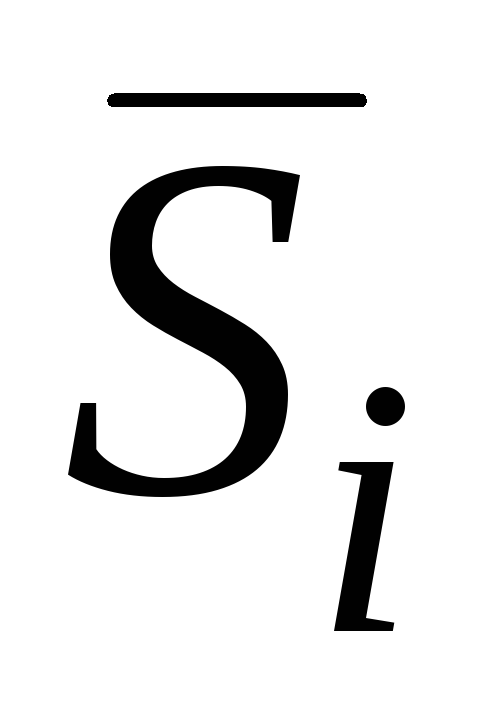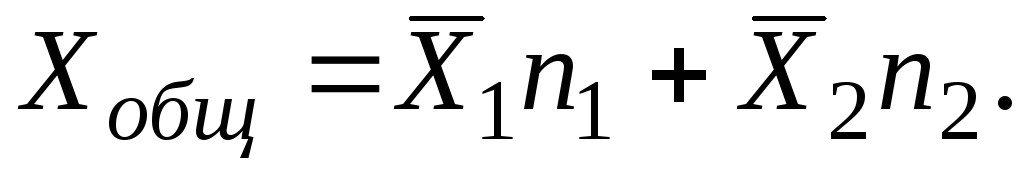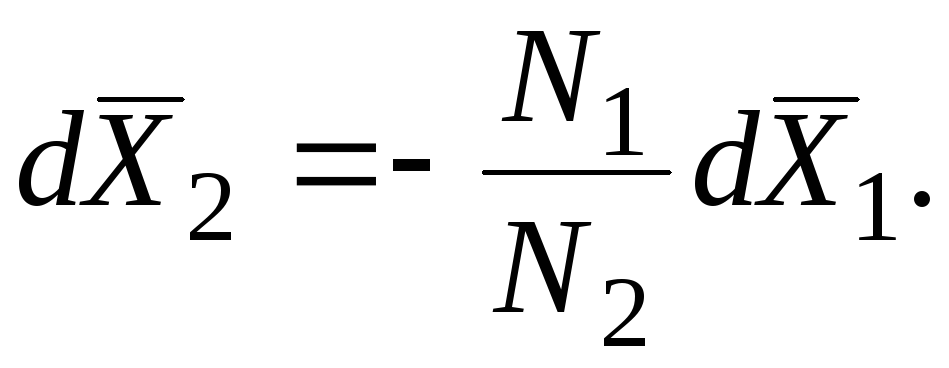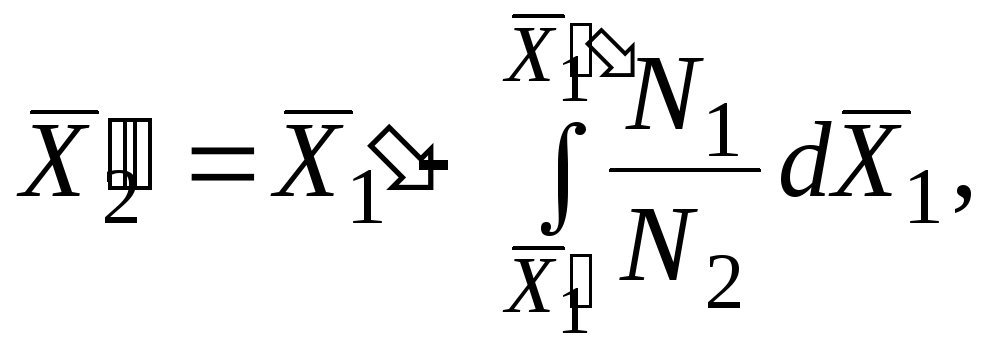Shembuj detyrash. Kimi fizike
Prona të gjera proporcionale me sasinë e lëndës. Këto përfshijnë, për shembull, vëllimin, masën, energjia e brendshme, entropia. Pra, energjia e brendshme e dy pjesëve identike të metalit është dy herë më e madhe se energjia e një pjese. Vetitë ekstensive të një sistemi përbëhen në mënyrë shtesë nga vetitë e gjera të pjesëve përbërëse të tij. Vetitë si temperatura dhe presioni që nuk varen nga sasia e lëndës quhen intensive. Për zgjidhjet, vetitë intensive përcaktohen nga përbërja. Për shembull, presioni i avullit i çdo komponenti mbi një tretësirë varet nga përqendrimi i tij. Vlerat e vetive intensive në pjesë të ndryshme të sistemit priren të barazohen. Matja e një sasie intensive bazohet në faktin se ndryshimi i saj shoqërohet gjithmonë me një ndryshim në një sasi të madhe. Pra, për të matur temperaturën, përdoret një ndryshim në vëllimin e një substance, për shembull, merkuri, d.m.th. pronë e gjerë.
G. Lewis e quajti vlerën molare të pjesshme të komponentit gi derivat i pjesshëm i disa sasive të gjera gi sipas numrit të nishaneve n i ky komponent i tretësirës në presion konstant, temperaturë dhe numra mole të përbërësve të mbetur:
gi = (∂g/∂n i) p.T.nj(j ≠ i) . (V.1)Pajtueshmëria me kushtet e kërkuara nga ky përkufizim mund të arrihet nëse, për shembull, imagjinojmë se në një vëllim shumë të madh të një zgjidhjeje të një përqendrimi të caktuar në konstante R dhe T Shtohet 1 mol nga çdo përbërës. Në këtë rast, përqendrimi i tretësirës praktikisht nuk do të ndryshojë dhe ndryshimi përkatës në vetitë e tretësirës do të jetë vlera molare e pjesshme e përbërësit të shtuar.
Për shembull, vëllimi i pjesshëm molar Vi, përcaktohet nga ekuacioni:
Vi = (∂V/∂n i) p.T.nj(j ≠ i) . (V.2)Nëse tretësira është formuar nga përbërësit pa ndryshim në vëllim, atëherë është e qartë se vëllimi molar i pjesshëm i përbërësit është i barabartë me vëllimin molar të tij, d.m.th. Vi = V
| 0 |
| i |
zgjidhje e komponentëve, vërehet aditiviteti i vëllimit, d.m.th. nuk ndryshon, atëherë për shembull, për një zgjidhje binare të përbërë nga P 1 mol e komponentit të parë dhe P 2 nishane të së dytit: V = n 1 V
| 0 |
| 1 |
| 0 |
| 2 |
| 0 |
| 1 |
| 0 |
| 2 |
Nëse, për shembull, entalpia është aditiv në formimin e një solucioni, atëherë Δ H= 0, dhe, për rrjedhojë, zgjidhja formohet pa një efekt termik. Nëse entalpia e lëndëve fillestare më shumë entalpi tretësirë, kur formohet tretësira, lirohet nxehtësia. Përndryshe, nxehtësia do të absorbohet.
Ndër sasitë molare të pjesshme, energjia molare e pjesshme Gibbs ka një rëndësi të veçantë:
G i = (∂G/∂n i) p.T.nj(j ≠ i) (V.3)i cili, siç është theksuar në kapitullin. II, i thirrur potencial kimik dhe shënohet me μ.
Potenciali kimik, së bashku me temperaturën dhe presionin, është një sasi intensive. Pra, barazia e temperaturave, presioneve dhe potencialeve kimike të të gjithë përbërësve në pjesë të ndryshme të sistemit shpreh kushtet e ekuilibrit termik, mekanik dhe kimik. Vlera G i = μ i pasqyron prirjen e një lënde për të lënë një fazë të caktuar dhe është një masë e shpërndarjes së saj.
Le të shqyrtojmë dy faza ngjitur - një zgjidhje dhe një avull mbi të. Në secilën nga këto faza ka një komponent të caktuar i. Në ekuilibër G i zgjidhje = G i avulli.
Nëse, për shembull, potencial kimik kishte më shumë substancë në tretësirë sesa në fazën e gazit, atëherë do të ndodhte avullimi i kësaj substance, në të cilën G i zgjidhja zvogëlohet, a G i par rritet derisa të vendoset ekuilibri. Përndryshe, do të kishte një tranzicion të komponentit i nga avulli në tretësirë.
Le të supozojmë se faza e avullit ka vetitë gazet ideale. Meqenëse në këtë rast nuk ka ndërveprim ndërmjet molekulave, energjia molare e pjesshme Gibbs e komponentit të gazit ose potenciali i tij kimik është i barabartë me energjinë molare Gibbs të komponentit të pastër. G i në një presion të barabartë me presionin e tij të pjesshëm në përzierje, d.m.th. μ i gaz = G i gaz = G i gazit. Kështu, sipas ekuacionit (II.28):
G i zgjidhje = μ i zgjidhje = G i = G
zakonisht shënohet μ + RT ln pi(V.4)Vlerat molare të pjesshme karakterizojnë vetitë e solucioneve. Ata luajnë të njëjtin rol në llogaritjet termodinamike të ekuilibrave në zgjidhje si funksionet përkatëse U, H, F, G, S etj. në llogaritjet që kanë të bëjnë me reaksionet ndërmjet substancave të pastra. Në këtë drejtim, këshillohet të përpilohen tabela të vlerave molare të pjesshme.
Prezantimi
Tema 6. Zgjidhje
Studimi i tretësirave është një fushë e rëndësishme e kimisë fizike, pasi si në natyrë ashtu edhe në teknologji duhet të merremi vazhdimisht me zgjidhje, dhe jo me substanca të pastra. Për shembull, metalet më të pastra të marra në teknologjinë moderne me metodat e shkrirjes me vakum dhe zona përmbajnë ende sasi të papërfillshme (10-6%) papastërtish, kryesisht metaloidë, dhe në thelb janë tretësira.
Shumica e proceseve që ndodhin në natyrë, si dhe proceset e ndryshme teknologjike në themel, ndodhin në fazën e lëngshme. Kështu që reaksionet kimike në shkrirjen e hekurit dhe të çelikut ndodhin kryesisht në tretësirë. Hekuri i lëngshëm dhe çeliku janë zgjidhje elemente të ndryshme në hekur. Në furrat e shpërthimit dhe shkrirjes së çelikut, ato ndërveprojnë me skorje të lëngshme - një zgjidhje oksidesh.
Tretësirat ujore të kripërave, acideve dhe bazave përdoren gjerësisht në hidrometalurgji për nxjerrjen e metaleve me ngjyra nga xehet.
Një zgjidhje është një sistem homogjen, homogjen me përbërje të ndryshueshme, i përbërë nga dy ose më shumë përbërës. Zgjidhjet mund të ekzistojnë në çdo gjendje grumbullimi - të ngurtë, të lëngët ose të gaztë. Karakteristika e tyre e përbashkët është njëfazore.
Zgjidhjet janë shumë të ndryshme në natyrë dhe në natyrën e ndërveprimit midis grimcave të përbërësve të tyre. Kështu, për shembull, një zgjidhje e acidit sulfurik në ujë, e cila formohet me lëshimin e një sasie të madhe nxehtësie, karakterizohet nga një ndërveprim kimik i theksuar, dhe në një zgjidhje të gazrave fisnikë të lëngshëm - argoni dhe neoni - forcat fizike. Në shumë zgjidhje reale, natyra e ndërveprimit midis grimcave është aq komplekse sa është e pamundur të ndahen aspektet e saj kimike dhe fizike.
Përbërësit e një tretësire janë një tretës (medium) dhe një tretësirë (ose disa substanca) të shpërndara në mënyrë uniforme në tretës në formën e molekulave, atomeve ose joneve. Një tretës zakonisht kuptohet si një substancë që është në të njëjtën gjendje grumbullimi si tretësira në tërësi. Nëse gjendja agregate e substancave që përbëjnë tretësirën është e njëjtë, atëherë tretësi është ai që mbizotëron në këtë sistem. Për shembull, në një tretësirë 5% të sheqerit në ujë, ky i fundit është tretës, dhe sheqeri është tretësira. Në përgjithësi, konceptet "tretës" dhe "tretësirë" janë në një farë mase të kushtëzuar. Për shembull, në tretësirat e përqendruara, dallimi midis substancës së tretur dhe tretësit është më pak i dukshëm. Për një tretësirë 50% të alkoolit etilik dhe ujit, konceptet janë të barabarta, dhe për një tretësirë që përmban 95% alkool dhe 5% ujë, kjo e fundit është një substancë e tretur. Prandaj, konceptet "tretës" dhe "tretësirë" duhet të përdoren kur aplikohen për tretësirat e holluara (jo të koncentruara). Për tretësirat e elektrolitit, uji është gjithmonë tretës, edhe nëse është shumë i vogël.
Përbërja e një tretësire ose përqendrimi i saj shprehet në mënyra të ndryshme. Është më e përshtatshme të shprehet përqendrimi i një zgjidhjeje në fraksione mole.
fraksioni i nishanit N iështë raporti i numrit të nishaneve i substanca ( n i) te numri total mole të të gjithë përbërësve në një sasi të caktuar të tretësirës Σ n i:
Në rastin e tretësirave ujore, përqendrimi zakonisht shprehet si numri i moleve të një lënde të tretur në 1 litër tretësirë - përqendrimi molar ( NGA m):
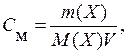 (6.2)
(6.2)
ku V- vëllimi i tretësirës, dm 3.
Sidoqoftë, përdorimi i përqendrimit molar nuk është gjithmonë i përshtatshëm, pasi përqendrimi i tretësirës për shkak të zgjerimit termik varet nga temperatura. Në këtë drejtim, shpesh përdoret edhe molaliteti. Molaliteti ( cm) është numri i moleve të një lënde të tretur në 1000 g të një tretës:
 (6.3)
(6.3)
ku m 2 (X)është masa e substancës së tretur, g; M(X)është masa molare e substancës së tretur, g/mol; m 1 është masa e tretësit, g.
Ekziston një lidhje midis fraksionit mol dhe molalitetit në tretësirat ujore
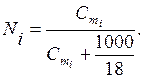 (6.4)
(6.4)
Substanca, duke kaluar në tretësirë, bëhet një përbërës i zgjidhjes, humbet individualitetin e saj.
Vetitë e tretësirës mund të karakterizohen nga sasitë termodinamike V, H, U, F, G etj. Për shkak të ndërveprimit midis molekulave të përbërësve të tretësirës, ka kuptim që karakteristikat termodinamike t'i referohen tretësirës në tërësi, dhe jo substancave përbërëse të tij. Kështu, zgjidhja karakterizohet nga një e përcaktuar mirë, e përshtatshme matje e thjeshtë vëllimi, por është e pamundur të përcaktohet se çfarë vëllimesh zënë përbërësit individualë në të.
Në çdo tretësirë, për shembull, një tretësirë e acidit sulfurik në ujë, së bashku me energjinë e molekulave të acidit sulfurik dhe ujit, ekziston një energji e ndërveprimit midis këtyre substancave, e cila karakterizon tretësirën dhe nuk mund t'i atribuohet asnjë prej komponentët. Sidoqoftë, është ende e rëndësishme të karakterizohet se në çfarë proporcioni kontribuon ky komponent në një ose një pronë tjetër të zgjidhjes. Një karakteristikë e tillë quhet vlerë e pjesshme.
G. Lewis e quajti sasinë molare të pjesshme të një përbërësi derivat të pjesshëm të një sasie të gjerë g sipas numrit të moleve të këtij përbërësi të tretësirës në presion konstant, temperaturës dhe numrit të moleve të përbërësve të mbetur:
![]() (6.5)
(6.5)
Pajtueshmëria me kushtet e kërkuara nga ky përkufizim mund të arrihet nëse, për shembull, në një vëllim shumë të madh të një zgjidhjeje të një përqendrimi të caktuar në konstante dhe T shtoni 1 mol të çdo komponenti. Në këtë rast, përqendrimi i tretësirës praktikisht nuk do të ndryshojë dhe ndryshimi përkatës në vetitë e tretësirës do të jetë vlera molare e pjesshme e përbërësit të shtuar.
Për shembull, vëllimi molar i pjesshëm jepet nga ekuacioni
![]() (6.6)
(6.6)
Nëse tretësira është formuar nga përbërësit pa ndryshim në vëllim, atëherë është e qartë se vëllimi molar i pjesshëm është i barabartë me vëllimin e tij molar, d.m.th., ku indeksi "zero" do të thotë se substanca është në gjendje të pastër. Në ndryshim nga vëllimi molar, vëllimi molar i pjesshëm mund të jetë një vlerë negative, për shembull, nëse për shkak të ndërveprimit molekular, kur një përbërës i shtohet një zgjidhjeje, ndodh një rënie në vëllim. Nëse aditiviteti vërehet gjatë formimit të një zgjidhjeje nga përbërësit, atëherë, për shembull, për një zgjidhje binare që përbëhet nga n 1 nishanet e komponentit të parë dhe n 2 nishanet e të dytës:
![]() (6.7)
(6.7)
ku dhe janë fraksionet molore të substancave të pastra.
Natyrisht, në këtë rast, kur formohet tretësira
Nëse, për shembull, gjatë formimit të një solucioni, entalpia është aditiv, atëherë, për rrjedhojë, tretësira formohet pa efekt termik. Nëse entalpia e lëndëve fillestare është më e madhe se entalpia e tretësirës, atëherë gjatë formimit të tretësirës lirohet nxehtësia. Përndryshe, nxehtësia do të absorbohet.
Ndër sasitë molare të pjesshme rëndësi të veçantë ka vlera molare e pjesshme. energji e lirë
![]() (6.8)
(6.8)
që shpesh quhet edhe potencial kimik dhe shënohet
Potenciali kimik, së bashku me temperaturën dhe presionin, është një sasi intensive. Kështu, barazia e temperaturave, presioneve dhe potencialeve kimike të të gjithë komponentëve në pjesë të ndryshme të sistemit shpreh kushtet e ekuilibrit termik, mekanik dhe kimik (shih seksionin 2.12).
Vlera pasqyron tendencën e substancës për t'u larguar nga kjo fazë dhe është një masë e shpërndarjes së saj. Le të shqyrtojmë dy faza ngjitur - një zgjidhje dhe një avull mbi të. Në secilën nga këto faza ka një komponent të caktuar i. Në ekuilibër
Nëse, për shembull, potenciali kimik i një substance në tretësirë do të ishte më i madh se në fazën e gazit, atëherë do të ndodhte avullimi i kësaj substance, në të cilin ![]() zvogëlohet dhe rritet derisa të vendoset ekuilibri. Përndryshe, do të kishte një tranzicion të komponentit i nga avulli në tretësirë.
zvogëlohet dhe rritet derisa të vendoset ekuilibri. Përndryshe, do të kishte një tranzicion të komponentit i nga avulli në tretësirë.
Vlerat molare të pjesshme karakterizojnë vetitë e solucioneve. Ata luajnë të njëjtin rol në llogaritjet termodinamike të ekuilibrave në zgjidhje si funksionet përkatëse ( U, H, F, G, S etj.) në llogaritjet që kanë të bëjnë me reaksionet ndërmjet substancave të pastra. Në këtë drejtim, këshillohet të përpilohen tabela të sasive molare të pjesshme. Për të përcaktuar vlerën molare të pjesshme të një komponenti të caktuar, është e nevojshme të gjendet varësia e vetive të gjera përkatëse nga përbërja e tretësirës në konstante. R total, T dhe numrat e moleve të komponentëve të mbetur dhe të diferencohen sipas numrit të moleve të këtij komponenti. Për zgjidhjet binare, një përcaktim i tillë zakonisht bëhet grafikisht duke përdorur metodën e segmentit. Për ta bërë këtë, llogaritni vetinë e një mol të zgjidhjes.
Një mol i një tretësire është sasia në të cilën numri i moleve të secilit përbërës është i barabartë me fraksionin e tij mol. Për shembull, një mol tretësirë karboni në hekur të lëngshëm, i cili përmban 0,1 mol karbon dhe 0,9 mol hekur. Sepse masë atomike karboni është 12, dhe hekuri është 55,85, atëherë masa e një mol të një zgjidhjeje të tillë do të jetë 12 × 0,1 + 55,85 × 0,9 = 51,465 g.
Vetia e zgjidhjes g, duke iu referuar një nishani, shënohet me indeksin . Për shembull, shënohet vëllimi i një mol të një zgjidhjeje
Një metodë grafike për përcaktimin e sasive molare të pjesshme është paraqitur në Fig. 6.1. Fraksionet molare të komponentit të parë dhe të dytë janë paraqitur përgjatë boshtit të abscisës ( N 1 dhe N 2). Pika O korrespondon me komponentin e parë të pastër; në këtë pikë N 1= 1 dhe N 2= 0. Pika Rreth 1 korrespondon me komponentin e dytë të pastër; në këtë pikë N 1= 0 dhe N 2= 1. Çdo pikë në vijë OO 1 korrespondon me një zgjidhje të një përbërje të caktuar.
Vlera e çdo vetie të një mol të një zgjidhjeje është paraqitur në boshtin y. Kurba AB shpreh varësinë e vetive nga përbërja e tretësirës. Nëse, gjatë formimit të një tretësire, vetia e saj përbëhet në mënyrë shtesë nga vetitë e përbërësve, atëherë në vend të kurbës, varësia do të shprehet me një vijë të drejtë. Segmentet OA dhe O 1 V përfaqësojnë, përkatësisht, vetitë molare të përbërësve të pastër dhe
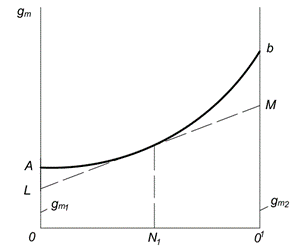
Oriz. 6.1. Metoda grafike për përcaktimin e vlerave molare të pjesshme
Për të gjetur vlerat molare të pjesshme të përbërësve në një zgjidhje të një përqendrimi të caktuar, për shembull, duhet të vizatoni një tangjente LM te kurba AB në pikën që korrespondon me ordinatën e rivendosur nga segmenti i prerë nga tangjenta në boshtet e ordinatave OL dhe rreth 1 milion, janë të barabarta me sasi të pjesshme dhe
Dërgoni punën tuaj të mirë në bazën e njohurive është e thjeshtë. Përdorni formularin e mëposhtëm
Studentët, studentët e diplomuar, shkencëtarët e rinj që përdorin bazën e njohurive në studimet dhe punën e tyre do t'ju jenë shumë mirënjohës.
Priti në http://www.allbest.ru/
Puna e kursit
Përcaktimi i sasive molare të pjesshme
Prezantimi
2.1 Metodat analitike
2.2 Metodat grafike
3. Pjesa eksperimentale
3.1 Instrumentet dhe reagentët
4. Rezultatet dhe diskutimi
konkluzioni
Bibliografi
Aplikacion
rezultatet
Prezantimi
Në natyrë, ka sisteme të panumërta që janë një përzierje uniforme e një lënde në një tjetër ose një përzierje e disa substancave. Të gjitha përzierjet natyrore mund të ndahen në dy grupe:
1) përzierjet në të cilat ekziston një ndërfaqe fizike midis përbërësve. Përzierje të tilla quhen heterogjene. Sistemet heterogjene përbëhen nga faza që ndryshojnë nga njëra-tjetra përbërje kimike dhe vetitë termodinamike;
2) përzierjet në të cilat nuk ka ndërfaqe fizike midis përbërësve. Prandaj, në të gjitha pjesët e tyre, sisteme të tilla kanë të njëjtat veti fizike dhe kimike. Sisteme të tilla quhen homogjene ose zgjidhje.
Një zgjidhje është një sistem homogjen i përbërë nga dy ose më shumë komponentë, përbërja e të cilave mund të ndryshojë vazhdimisht brenda kufijve të caktuar.
Tretësirat mund të jenë në tre gjendje grumbullimi: të gazta, të lëngëta dhe të ngurta. Në praktikë më së shpeshti haset me tretësirat e lëngëta. Në një tretësirë të lëngshme, dallohen një tretës dhe një tretësirë, megjithëse nga pikëpamja termodinamike, të gjithë përbërësit e tretësirës janë ekuivalente. Një tretës kuptohet si një substancë që është e pranishme në një tretësirë në një sasi më të madhe. Në këtë punim trajtohen tretësirat e lëngshme.
Struktura dhe vetitë fizike lëngjet varen nga identiteti kimik i grimcave që e formojnë atë dhe nga natyra dhe intensiteti i forcave që veprojnë ndërmjet tyre. Në sistemet e lëngshme, ato shfaqen lloje te ndryshme ndërveprimet.
Sipas strukturës gjendje e lëngshmeështë e ndërmjetme ndërmjet gjendje e ngurtë me një strukturë periodike të përcaktuar rreptësisht në të gjithë kristalin dhe një gaz në të cilin nuk ka strukturë dhe lëvizja e grimcave është e rastësishme. Prandaj, një lëng karakterizohet, nga njëra anë, nga prania e një vëllimi të caktuar, dhe nga ana tjetër, mungesa e një forme të caktuar. Në një lëng afër temperaturës së ngurtësimit, rregullsia e strukturës së brendshme bëhet më e theksuar. Përkundrazi, ndërsa lëngu i afrohet pikës së tij të vlimit, çrregullimi në pozicioni relativ grimcat.
Tretësirat e lëngshme mund të përftohen duke tretur gazra, lëngje ose të ngurta në një tretës të lëngshëm të përshtatshëm. Kur formohet një tretësirë e lëngshme, kur një tretës i lëngshëm që ka një strukturë të caktuar futet në substancën e tretur, formohet një strukturë e re me një rregullim të ndryshëm të grimcave sesa në tretës. Në këtë rast, forcat e ndërveprimit ndërmolekular ndryshojnë.
Në një tretësirë të lëngshme, përveç bashkëveprimit, ndërveprimi ndërmjet molekulave me të njëjtin emër shfaqet edhe ndërmjet molekulave me emra të kundërt. Ndërveprimi i molekulave mund të shoqërohet me zbërthimin e tyre në jone. Mundësia dhe shkalla e zbërthimit në jone përcaktohet nga natyra e substancës së tretur dhe natyra e tretësit. Kalbja në jone shoqërohet ose me dukurinë e disociimit (ndarjes) ose me dukurinë e jonizimit (formimi i joneve). Pra, kur përbërjet jonike treten, ndodh shpërbërja.
Si rezultat i bashkëveprimit ndërmjet joneve të formuara dhe molekulave të tretësit, formohen tretësira (në tretësirat ujore - hidratet). Grupi i molekulave të tretësit që rrethojnë jonin është një guaskë solvative. Ekzistojnë predha tretësore parësore dhe dytësore. Predha primare e tretësit është guaska e formuar si rezultat i veprimit të një joni në molekulat më të afërta të tretësit, të cilat humbasin lëvizjen e tyre të pavarur dhe lëvizin së bashku me jonin. Për shembull, guaska primare e tretësirës përmban, sipas llogaritjeve mekanike kuantike, nga 5 deri në 7 molekula uji për jon.
Ndërveprimi midis molekulave shpesh çon në formimin e molekulave të tjera, më komplekse - komplekse.
Kështu, zgjidhjet janë shumë sisteme komplekse, në të cilën lënda e tretur mund të jetë në formën e molekulave individuale ose shoqëruese, e përbërë nga disa molekula, ose pjesërisht ose plotësisht e ndarë në jone. Në këtë drejtim, tretësirat ndahen në tretësira jo elektrolite dhe tretësirë elektrolite.
Shpërbërja shoqërohet me çlirimin ose thithjen e nxehtësisë. Kur një substancë tretet, lidhjet midis molekulave (atomeve ose joneve) në lëndën e tretur dhe tretësin prishen, gjë që shoqërohet me shpenzimin e energjisë. Në të njëjtën kohë, procesi i zgjidhjes vazhdon, d.m.th. ka lidhje midis grimcave të substancës së tretur dhe tretësit. Duke vepruar kështu, energjia çlirohet. Efekti i përgjithshëm energjetik i shpërbërjes, në varësi të raportit të sasive të energjisë së çliruar dhe të absorbuar, mund të jetë pozitiv ose negativ.
Përveç efektit të energjisë, shpërbërja shoqërohet me një ndryshim në vëllimin e përbërësve të përzier. Për shembull, kur shpërndahet alkooli në ujë, vëllimi i tretësirës zvogëlohet me rreth 3.5% në krahasim me vëllimin e përgjithshëm të substancave të marra për shkak të formimit të tretësirave.
Kur shpërndahet, ndonjëherë vërehet një ndryshim në ngjyrën e tretësirës.
Qëllimi i kësaj pune është të përcaktojë nxehtësinë molare integrale dhe të pjesshme të shpërbërjes substancave të ndryshme dhe nxjerrja e një ekuacioni interpolimi për varësinë e nxehtësisë integrale të shpërbërjes nga përbërja e tretësirës.
Detyrat e punës:
1) Duke përdorur matjet kalorimetrike, përcaktoni vlerat e nxehtësisë integrale të shpërbërjes për përqendrime të ndryshme të zgjidhjes që rezulton;
3) vizatoni varësinë e nxehtësisë së tretjes nga përbërja e tretësirës.
1. Madhësitë molare të pjesshme dhe rëndësia e tyre në termodinamikën e tretësirave
Madhësitë molare të pjesshme janë sasi termodinamike që përdoren për të përshkruar varësinë e përqendrimit të vetive të tretësirave. Le të jetë M një funksion i gjerë i gjendjes së një sistemi me komponentë h, d.m.th., një veti që varet nga masa e sistemit (vëllimi, energjia e brendshme, entalpia, entropia, energjia Gibbs, energjia e Helmholtz-it, kapaciteti i nxehtësisë, etj.) . Për komponentin i-të, vlera molare e pjesshme Z përcaktohet nga relacioni:
ato. është e barabartë me derivatin e M në lidhje me numrin e moleve të komponentit i në temperaturë konstante T, presioni p dhe numrat mole të të gjithë komponentëve të tjerë. Pra, vëllimi molar i pjesshëm
ku V është vëllimi i sistemit; Energjia molare e pjesshme Gibbs (potenciali kimik)
ku G është energjia Gibbs e sistemit.
Vlera molare e pjesshme karakterizon ndryshimin në vlerën e M kur 1 mol përbërës i shtohet në një sasi pafundësisht të madhe tretësirë në kushtet e qëndrueshmërisë së T, p dhe numrit të moleve të të gjithë përbërësve të tjerë. Nëse fraksioni molar x i i përbërësit është i barabartë me një, atëherë vlera molare e pjesshme Z bëhet vlera molare M m për substancën individuale (për shembull, vëllimi molar i pjesshëm i përbërësit shndërrohet në vëllim molar). Vlera e Z përcaktohet jo vetëm nga natyra e komponentit i-të, por edhe nga vetitë e sistemit në tërësi, pasi molekulat e komponentit i-të ndërveprojnë me të gjitha molekulat e tjera; Në mënyrë implicite, kjo vlerë merr parasysh të gjitha ndryshimet në vetitë e sistemit kur futet komponenti i-të.
Në një zgjidhje reale, në përgjithësi, të gjitha sasitë molare të pjesshme varen nga përbërja, presioni dhe temperatura. Nëse zgjidhja është ideale, atëherë në T dhe p të dhëna, vëllimi molar i pjesshëm, energjia e brendshme, entalpia dhe kapaciteti i nxehtësisë janë konstante në të gjithë intervalin e përqendrimit dhe përkojnë me vlerat molare korresponduese të përbërësve të pastër. Potenciali kimik m i id dhe entropia molare e pjesshme S i id lidhen me vlerat molare korresponduese të një lënde të pastër - energjia Gibbs dhe entropia nga relacionet:
ku R është konstanta e gazit.
Varësia e sasive molare të pjesshme nga T dhe p përcaktohet nga të njëjtat marrëdhënie termodinamike si për vetitë ekstensive përkatëse. Pra, për potencialin kimik m i, relacionet plotësohen të ngjashme me ato që janë të vlefshme për energjinë Gibbs, përkatësisht:
Funksioni M për sistemin në tërësi është shuma e vlerave molare të pjesshme të përbërësve të shumëzuar me numrin përkatës të moleve. Në veçanti, energjia Gibbs e sistemit. Vlera molare (specifike): . Varësia e vlerës molare të M m nga T, p, x 1, ..., x n-1 përdoren për të gjetur sasi molare të pjesshme:
Ndryshimet në sasitë molare të pjesshme me një ndryshim në gjendjen e sistemit ndërlidhen me ekuacionin Gibbs-Duhem, i cili në një formë të përgjithësuar shkruhet si më poshtë:
Në T, p = konst (kushtet izobarike-izotermike):
Sipas këtij ekuacioni, në një sistem binar, sasitë molare të pjesshme M 1 dhe M 2 ndryshojnë në drejtime të kundërta kur ndryshon përbërja. Ekstremet në kthesat M 1 (x 1) dhe M 2 (x 1), nëse ka, vërehen në të njëjtën përbërje dhe janë të kundërta në lloj. Për shembull, për potencialet kimike
Për T, p = konst
Ky raport përdoret për të llogaritur potencialin kimik të përbërësit të tretësirës bazuar në varësinë e përqendrimit të potencialeve kimike të përbërësve të mbetur, dhe përdoret gjithashtu për të kontrolluar konsistencën termodinamike të të dhënave eksperimentale mbi varësinë e potencialeve kimike nga përbërja, temperatura, etj.
2. Metodat për përcaktimin e sasive molare të pjesshme
Për të përcaktuar vlerat molare të pjesshme, është e nevojshme varësia e vetive të përgjithshme ekstensive të tretësirës nga përbërja e tij ose varësia e vlerës molare të pjesshme të njërit prej përbërësve nga përbërja e tretësirës.
Metodat për përcaktimin e sasive molare të pjesshme ndahen në analitike dhe grafike.
2.1 Metodat analitike
Nëse dihet varësia e vetive të përgjithshme ekstensive të zgjidhjes nga numri i moleve të secilit komponent, për shembull, në formën e një ekuacioni interpolimi, atëherë sasitë molare të pjesshme përcaktohen duke diferencuar ekuacionin e interpolimit për vetinë e gjerë me në lidhje me numrin e nishaneve të këtij komponenti.
Duke zëvendësuar vlerën përkatëse në ekuacionin që rezulton, llogaritni vlerën molare të pjesshme të këtij komponenti për një zgjidhje të një përbërje të caktuar.
Në një numër rastesh, metodat fiziko-kimike bëjnë të mundur gjetjen e vetëm një prej funksioneve - . Për shembull, nga presioni i avullit të tretësirave të tretësirave jo të paqëndrueshme, mund të gjendet vetëm vlera e pjesshme e tretësit. Nëse dihet varësia e vlerës molare të pjesshme të një komponenti nga përbërja e tretësirës, vlera molare e pjesshme e komponentit të dytë mund të llogaritet duke përdorur ekuacionin Gibbs-Duhem.
Le të për një tretësirë binare, fraksioni mol i tretësit është x 1, dhe fraksioni mol i substancës së tretur është x 2 ose x.
Le të dihet, për shembull, në të gjithë gamën e vlerave x. Nga ekuacioni
vijon se:
Është e përshtatshme të integrohet nga përbërja x = 1 në një vlerë arbitrare x = b:
Kjo është vlera molare për komponentin e dytë të pastër, i cili mund të matet pavarësisht nga vetitë e tretësirës që studiohet. Në këtë rast, është e nevojshme të dihet vlera kufizuese e sasisë (0), d.m.th. për x>1.
2.2 Metodat grafike
Metoda e diferencimit grafik
Për të përcaktuar vlerat molare të pjesshme sipas të dhënave eksperimentale, është paraqitur një grafik i varësisë së vetive të përgjithshme të gjera të zgjidhjes nga numri i moleve të një komponenti të caktuar.
Tangjentja e këndit të tangjentës me lakoren në çdo pikë do të korrespondojë me vlerën molare të pjesshme të këtij komponenti në një zgjidhje të kësaj përbërjeje, pasi
Kjo metodë nuk është mjaft e saktë për shkak të gabimeve të mundshme gjatë vizatimit të tangjentëve dhe ju lejon të përcaktoni vetëm një nga sasitë molare të pjesshme.
Metoda e segmentit.
Metoda e segmentit përdoret për të përcaktuar vlerat molare të pjesshme të zgjidhjeve binare. Varësia e vetive ekstensive Z nga përbërja për një mol tretësirë përcaktohet në mënyrë eksperimentale dhe një grafik vizatohet në koordinatat Z - x, ku x është fraksioni mol i përbërësit të dytë. Lloji i grafikut mund të jetë çdo. Detyra është të gjesh vlerat e dhe për të gjitha vlerat e 0 ? x? 1. Nga përkufizimi = + = + . Ka dy të panjohura në ekuacion - dhe dhe një vlerë të njohur nga përvoja. E nevojshme për përcaktimin dhe ekuacioni i dytë fitohet me diferencim në lidhje me x.
Duke marrë parasysh ekuacionet e mëparshme, shuma e dy termave të fundit është e barabartë me 0, dhe më pas
Një analizë cilësore e grafikut të varësisë tregon se segmentet e prera nga tangjentja në kurbë janë vlerat e dëshiruara dhe. Meqenëse abshisa është një segment i vetëm, tangjentja e pjerrësisë është e barabartë me segmentin, dhe kjo është diferenca në vlera.
Për një zgjidhje të çdo përbërjeje
Vlerat e dhe mund të gjenden nga kurba eksperimentale.
Përcaktimi grafik i vlerës molare të pjesshme të një komponenti nga vlerat e njohura të vlerave molare të pjesshme të komponentit të dytë.
Ekuacioni
mund të përdoret për të përcaktuar grafikisht vlerat molare të pjesshme. Kur integrimi grafik është i përshtatshëm për të ndërtuar një grafik në koordinata. Pastaj:
përcaktohet lehtësisht nga zona e kufizuar nga kurba e varësisë dhe boshti i abshisë. Nëse dihet nga burime të pavarura, atëherë është e mundur të gjendet vlera totale
2.3 Përcaktimi i varësisë së interpolimit të nxehtësisë integrale të shpërbërjes nga përbërja
Le të shprehim varësinë e nxehtësisë integrale të shpërbërjes nga numri i moleve të substancës së tretur me ekuacionin empirik
ku a,b,c janë konstante empirike. Pastaj
Le të ndërtojmë një grafik në koordinata, të ekstrapolojmë pikat e tij. Segmenti i prerë në boshtin y është i barabartë me b, dhe tangjentja e pjerrësisë së tangjentës në pikën e lakuar është e barabartë me 2c. Duke ditur nxehtësinë integrale të tretjes për një tretësirë me një numër të caktuar molesh të lëndës së tretur n 2, gjejmë konstantën a në ekuacion.
3. Pjesa eksperimentale
3.1 Instrumentet dhe reagentët
1. Moduli ULC "Termostat" i lidhur me një kompjuter.
2. Gota 100 ml.
5. NaNO 3 kimikisht i pastër.
7. NH 4 Cl kimikisht i pastër.
3.2 Kontrolli ULC duke përdorur një kompjuter
1. Kontrolluesi universal lidhet me Kompjuter personal përmes portës COM duke përdorur një kordon të veçantë lidhës.
2. Kur kontrolluesi është i ndezur, është e nevojshme të hapni programin e kontrollit të ULC "Chemistry" - elsms2.exe.
3. Në dritaren e inicializimit që shfaqet ("Mirë se vini në ULC"), duhet të zgjidhni opsionin për të punuar me ULC - "Punoni me kontrolluesin" ose "Ngarkoni punën" dhe të futni programin e kontrollit ULC duke shtypur butonin "Enter". . Kur zgjidhni Load Job, mund të ngarkoni një laborator të ruajtur më parë.
5. Gjatë eksperimentit matet temperatura, kështu që duhet të vendosni intervalin e matjes dhe numrin e matjeve në dritaren përkatëse.
6. Meqenëse matja kryhet me përzierje, është e nevojshme të vendosni intensitetin e trazimit (për shembull 3) dhe të ndizni trazuesin me butonin "Stirrer".
7. Gjatë punës mund të kryhen disa eksperimente, prandaj për çdo eksperiment është e nevojshme të tregohet, për shembull, pesha e kampionit. (Më pas, në këndin e sipërm djathtas të grafikut, do të tregohet pesha e mostrës.) Për ta bërë këtë, në grupin e elementeve "Parametër shtesë" zgjidhni artikullin "Të përgjithshme" dhe në fushën "Vlera" specifikoni peshën. të kampionit. Dimensioni specifikohet në fushën "Dimension".
8. Matja fillon duke ndezur butonin "Matje". Në këtë rast, do të shfaqet dritarja e statusit të matjes - "Shkëmbimi i të dhënave me kontrolluesin".
9. Matja duhet të kryhet pasi të jetë tretur kripa, kur ndryshimi i temperaturës është i vogël dhe uniform. Matja përfundon duke shtypur butonin "STOP". Në këtë rast, të dhënat eksperimentale ruhen automatikisht dhe instalimi kalon në modalitetin e kontrollit. Për të kryer matjet e mëposhtme, është e nevojshme të shtypni butonin "Gjendja aktuale" dhe të kryeni punën në përputhje me paragrafët. 5 - 8.
3.3 Si të bëhet puna
Përcaktimi i nxehtësisë integrale të tretjes fillon me përcaktimin e konstantës së kalorimetrit. Për ta bërë këtë, një gotë e mbushur me 100 cm3 ujë të distiluar vendoset në një kalorimetër dhe mbyllet me një kapak me një sensor të temperaturës të fiksuar në të. Në hapjen e kapakut futet një epruvetë speciale, në të cilën paraprakisht derdhen 2 g kripë të grimcuar me nxehtësi të njohur tretjeje (NH 4 Cl). Kryeni një eksperiment kalorimetrik dhe regjistroni ndryshimin e temperaturës. Më pas tretësira derdhet nga gota, shpëlahet gota, në të hidhet 100 ml ujë të distiluar dhe vendoset në kalorimetër. Shpenzoni tretjen e 2 g të kripës së hetuar, duke rregulluar ndryshimin e temperaturës. Në mënyrë të ngjashme kryhet shpërbërja e 4, 6, 8, 10, 12, 16, 20 g të kripës së studiuar.
4. Rezultatet dhe diskutimi
Përcaktimi i nxehtësisë molare të pjesshme të shpërbërjes kryhet nga ekuacioni i bilancit të nxehtësisë:
ku dhe janë masa e ujit dhe kripës, përkatësisht, g;
c është kapaciteti termik i tretësirës që rezulton, J/(HMA). Në përqendrime të ulëta, kapaciteti termik i tretësirës mund të merret afërsisht i barabartë me kapacitetin e nxehtësisë së ujit. Në përqendrime të larta, kapaciteti termik i tretësirës mund të përcaktohet nga të dhënat e referencës. Konstanta e kalorimetrit përcaktohet nga formula:
Përcaktimi i nxehtësisë molare të pjesshme të KCl:
Përcaktimi i nxehtësisë molare të pjesshme të NaCl:
Përcaktimi i nxehtësisë molare të pjesshme të NaNO 3:
, (eksperimenti u krye në të njëjtën ditë)
Përcaktimi i nxehtësisë molare të pjesshme KNO 3:
konkluzioni
Duke përdorur matjet kalorimetrike, përcaktuam vlerën e nxehtësisë integrale të shpërbërjes për përqendrime të ndryshme të tretësirës që rezulton, llogaritëm nxehtësinë e pjesshme të shpërbërjes, skiconim varësinë e nxehtësisë së tretjes nga përbërja e tretësirës.
Bibliografi
integral i interpolimit molar të pjesshëm
1. Stromberg A.G., Semchenko D.P. Kimi fizike. - M.: Kimi, 1999.
2. Libër referimi i shkurtër i sasive fizike dhe kimike / ed. A.A. Ravdel, A.M. Ponomereva. - L .: Kimi, 1983.
3. Kimi fizike: I.A. Semiokhin - Moskë, Shtëpia Botuese MSU, 2001
4. Vetitë termodinamike të elektroliteve: Vasiliev V.P. - M. Kimi 1982.
5. Kimi fizike. Udhëzime teorike dhe praktike: Nikolsky B.P. - 1987
6. Bazat e kimisë fizike: Gorshkov V.I. - 1993
7. Kursi i shkurtër Kimi Fizike: Kochergin S.M. - 1978
8. Kimi fizike: Zhukhovitsky A.A. - 1987
9. Fizike dhe kimia e koloideve: Kuznetsov V.V. - 1968
10. http://www.xumuk.ru
Aplikacion
rezultatet
NH 4 Cl 2g (përcaktimi i konstantës së kalorimetrit) DT = -1,207
KCl 2g DT= -0,9746
KCl 4g DT= -2.333
KCl 6g DT= -2.851
KCl 8g DT = -3.843
KCl 10g DT= -4.738
KCl 12g DT= -5.706
KCl 16g DT = -7.459
KCl 20g DT= -9.314
NH 4 Cl 2g (përcaktimi i konstantës së kolorimetrit) DT \u003d -1,098
NaCl 2g DT= -0,2461
NaCl 4g DT= -0,5072
NaCl 6g DT= -0,6789
NaCl 8g DT= -0,8499
NaCl 10g DT= -1.008
NaCl 12g DT= -1.125
NaCl 16g DT = -1.303
NaCl 20g DT= -1.397
NaNO 3 2g DT = -0,7792
NaNO 3 4g DT= -1.616
NaNO 3 6g DT = -2.333
NaNO 3 8g DT = -3,143
NaNO 3 10g DT= -3.745
NaNO 3 12g DT = -4.222
NaNO 3 16g DT = -5,253
NaNO 3 20g DT= -6.436
NH 4 Cl 2g (përcaktimi i konstantës së kolorimetrit) DT \u003d -1.162
KNO 3 2g DT= -1.164
KNO 3 4g DT= -2.334
KNO 3 6g DT= -3.415
KNO 3 8g DT= -0,725
KNO 3 10g DT= -4.878
KNO 3 12g DT= -5.954
KNO 3 16g DT= -7.369
NH 4 Cl (përcaktimi i konstantës së kolorimetrit) DT= -1.085
KNO 3 20g DT= -4.575
Diagrami i DH kundrejt n i (KCl)
Diagrami i DH kundrejt n i (NaCl)
Diagrami i DH kundrejt n i (NaNO 3)
Diagrami i DH kundrejt n i (KNO 3)
Organizuar në Allbest.ru
...Dokumente të ngjashme
Drejtimet kryesore në zhvillimin e teorisë së zgjidhjeve. Kushtet termodinamike formimi i solucionit. Metodat për përcaktimin e sasive molare të pjesshme. Ligji i Raoult, zgjidhje jashtëzakonisht të holluara dhe jo ideale. Përzierjet azeotropike dhe ligjet Gibbs-Konovalov.
punim afatshkurtër, shtuar 24.12.2014
Përcaktimi i vëllimit të ajrit të nevojshëm për djegien e plotë të një sasie të caktuar të propanit. Llogaritja e ndryshimit të entalpisë, entropisë dhe energjisë Gibbs, duke përdorur pasojat e ligjit të Hesit. Përkufizimi masa molare ekuivalentët e agjentit oksidues dhe agjentit reduktues.
test, shtuar 02/08/2012
Shqyrtimi i informacionit teorik rreth vetive molare të pjesshme të përbërësve të tretësirës. Përcaktimi i vëllimit, entropisë, entalpisë dhe kapacitetit të nxehtësisë në një zgjidhje binare. Llogaritja e densitetit të masës së tretësirave ujore të substancës testuese të përqendrimeve të ndryshme.
manual trajnimi, shtuar më 24.05.2012
Lidhja e ndërsjellë e reaksioneve të pjesshme katodike dhe anodike në një elektrodë bakri në tretësirat me një oksidant pa oksigjen në polarizimin e alternuar të shenjave. Shpërndarja e anodës së bakrit në mjediset kloride dhe sulfate. Tretja në mjedise sulfate të acidifikuara.
tezë, shtuar 13.12.2015
Matja e përçueshmërisë elektrike të tretësirave të holluara të tetrafluoroboratit të litiumit në karbonat propileni. Llogaritja e përçueshmërisë elektrike molare kufizuese dhe konstantave të shoqërimit. Përkufizimi karakteristikat sasiore ndërveprimet jon-molekulare.
punim afatshkurtër, shtuar 28.10.2011
Përgatitja e tretësirave të polimerit: procesi i tretjes së polimerit; filtrimi dhe deaerimi i solucioneve. Fazat e prodhimit të filmave të tretësirës së polimerit. Kërkesat e përgjithshme për plastifikuesit. Përgatitja e tretësirës për formim. Formimi i një filmi të lëngshëm.
punim afatshkurtër, shtuar 01/04/2010
Reaktor i zhvendosjes ideale. Reaktor i plotë i përzierjes. Ndryshimi në shkallën e oksidimit të SO. Llogaritja e ndryshimit të temperaturës përmes koeficientit adiabatik. Llogaritja e përqendrimeve të ekuilibrit të substancave, konstantave të ekuilibrit. llogaritje presionet e pjesshme.
punim afatshkurtër, shtuar 20.11.2012
Përkufizimi i zgjidhjeve, llojet e tyre në varësi të gjendja e grumbullimit tretës, sipas madhësisë së grimcave të substancës së tretur. Mënyrat e shprehjes së përqendrimit. Faktorët që ndikojnë në tretshmërinë. mekanizmi i shpërbërjes. Ligji i Raoult dhe pasojat e tij.
prezantim, shtuar 08/11/2013
Llogaritja e konstantës së ekuilibrit të procesit të rritjes së kristaleve të vetme. Procesi i sublimimit të komponentëve Cd dhe Te. Llogaritja e presioneve të pjesshme të avullit të komponentëve. Diagrami skematik i reaktorit dhe shpërndarja e temperaturës. Vlerësimi i mundësisë së oksidimit të përbërësve.
tezë, shtuar 12/11/2016
Klasifikimi i gabimeve sipas mënyrës së shprehjes, burimit të shfaqjes dhe në varësi të kushteve të eksperimentit. Vlerësimi i parametrave të përgjithshëm dhe shpërndarja variablat e rastësishëm. Metodat për eliminimin e gabimeve të mëdha. Krahasimi i dy variancave.
Formimi i një zgjidhjeje nga përbërësit është një proces spontan. Prandaj, kushti termodinamik për formimin e një zgjidhjeje në P= konst dhe T= konstështë humbja e energjisë Gibbs Δ G < 0. Такой процесс будет протекать самопроизвольно до тех пор, пока в системе не установится равновесие: растворяемый компонент (т, ж, г) растворяемый компонент (раствор). При равновесии ΔG= 0. Përjashtim bëjnë zgjidhjet e mbingopura të paqëndrueshme termodinamikisht. Nga pikëpamja e termodinamikës, një tretësirë quhet e ngopur kur potenciali kimik i një lënde të tretur të pastër (të ngurtë, të lëngët, të gaztë) është i barabartë me potencialin kimik të kësaj substance në tretësirë.
Zvogëlimi i energjisë së Gibbs gjatë formimit të një zgjidhjeje mund të jetë për shkak të kontributeve të entalpisë dhe entropisë, pasi Δ G= Δ H– TΔ S.
Një tipar i qasjes termodinamike ndaj tretësirave është se nuk kërkon ide rreth mekanizmit molekular të ndërveprimit në tretësirë. Çështja kryesore në këtë qasje është vendosja e varësisë së vetive të zgjidhjeve nga përbërja dhe vetitë e përbërësve të saj. Për të krijuar një varësi të tillë, përdoren sasi molare të pjesshme.
§ 5.5. Sasitë molare të pjesshme
Shumica e pronave që mund të kuantifikohen mund të ndahen në dy grupe, të gjera dhe intensive.
të gjerë vetitë janë proporcionale me sasinë e substancave. Këto përfshijnë, për shembull, vëllimin ( V i zakonshëm), masa, energjia e brendshme ( U i zakonshëm), entropia ( S i zakonshëm), entalpi ( H i zakonshëm), energjia Gibbs ( G i zakonshëm) dhe të tjera.Kështu, energjia e brendshme e dy pjesëve identike të metalit është dy herë më e madhe se energjia e një pjese.Vetitë e gjera të një sistemi shtohen në mënyrë shtesë nga vetitë e gjera të pjesëve përbërëse të tij.
intensive quhen veti që nuk varen nga sasia e substancës (si temperatura dhe presioni). Për zgjidhjet, vetitë intensive përcaktohen nga përbërja. Për shembull, presioni i avullit të një komponenti mbi një tretësirë varet nga përqendrimi i tij. Vlerat e vetive intensive në pjesë të ndryshme të sistemit priren të barazohen. Matja e një sasie intensive bazohet në faktin se ndryshimi i saj shoqërohet gjithmonë me një ndryshim në një sasi të madhe. Pra, për të matur temperaturën, përdoret një ndryshim në vëllimin e një substance, për shembull, merkuri, d.m.th. pronë e gjerë.
Konsideroni një tretësirë me dy përbërës të përbërë nga një tretës dhe një tretësirë. Ndonjë nga vetitë e tij të gjera X i zakonshëm, varet nga numri i nishaneve P 1 tretës, nishane P 2 tretësirë, presion R dhe temperatura T:
Shënoni
|
|
Vlera molare e pjesshme i- komponenti i tretë i tretësirës (  ) quhet derivat i pjesshëm i një sasie të madhe ( X i zakonshëm) nga numri i nishaneve të këtij komponenti ( n i) në presion konstant, temperatura dhe numri i moleve të komponentëve të tjerë.
) quhet derivat i pjesshëm i një sasie të madhe ( X i zakonshëm) nga numri i nishaneve të këtij komponenti ( n i) në presion konstant, temperatura dhe numri i moleve të komponentëve të tjerë.
E njëjta ide mund të shprehet në një formë tjetër: nga sasia molare e pjesshme i Komponenti i -të është ndryshimi në këtë veti të gjerë të tretësirës kur shtohet një mol i Komponenti i një sasie të madhe tretësirë në presion dhe temperaturë konstante. Një sasi e madhe e tretësirës do të thotë se shtimi i një nishani i Komponenti i th praktikisht nuk e ndryshon përbërjen e tretësirës.
Për një substancë të pastër, vlera molare e pjesshme është e barabartë me vetinë e substancës së pastër
|
|
ku indeksi "zero" do të thotë se substanca është në gjendje të pastër.
Vetitë termodinamike të tretësirës G i zakonshëm ,
H i zakonshëm ,
S i zakonshëm ,
V i zakonshëm etj korrespondojnë me sasitë molare të pjesshme i- Komponenti i-të:  është energjia molare e pjesshme Gibbs;
është energjia molare e pjesshme Gibbs; 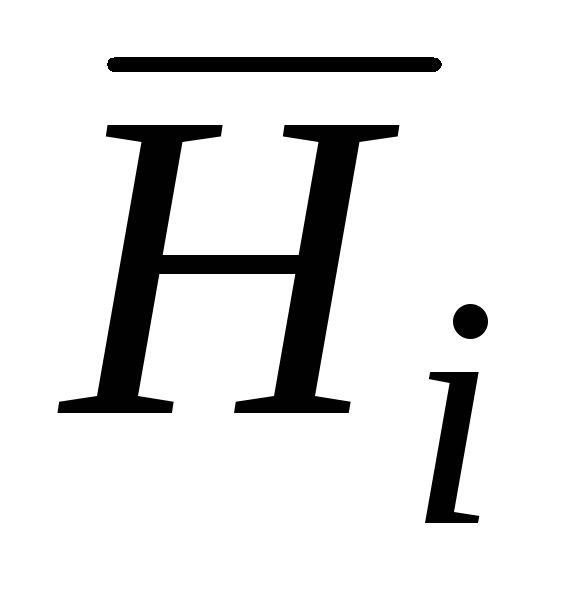 është entalpia molare e pjesshme;
është entalpia molare e pjesshme; 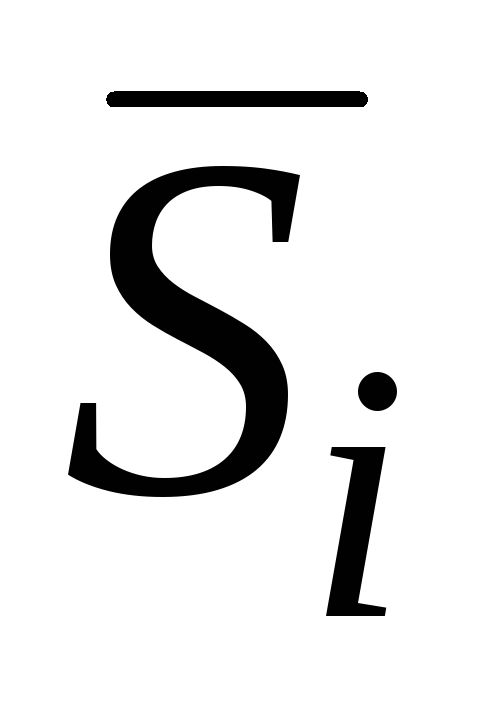 është entropia molare e pjesshme;
është entropia molare e pjesshme;  - vëllimi molar i pjesshëm etj.
- vëllimi molar i pjesshëm etj.
Ndër sasitë molare të pjesshme, më e rëndësishmja është energjia molare e pjesshme Gibbs 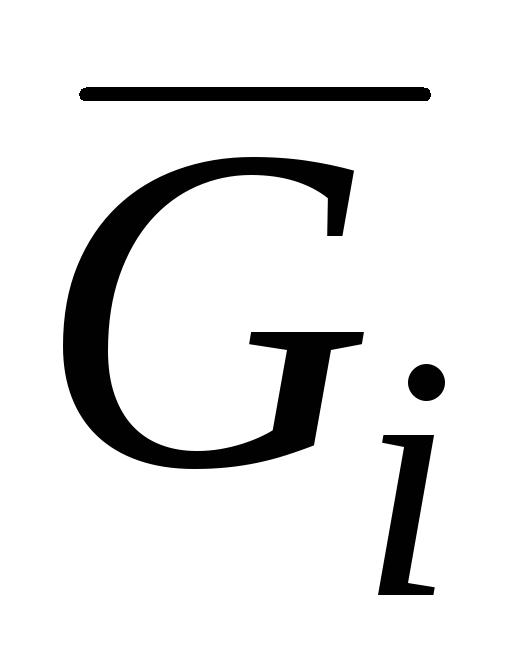 , i cili është identik me potencialin kimik:
, i cili është identik me potencialin kimik:
|
|
që rrjedh nga një krahasim i ekuacioneve (3.3) dhe (5.6) .
Rëndësia praktike e madhësive molare të pjesshme qëndron në faktin se midis tyre ruhen të njëjtat marrëdhënie termodinamike në formë si midis madhësive të zakonshme termodinamike.
Për shembull, nëse energjia Gibbs në ekuacion () (G= H– TS) merr derivatin në lidhje me numrin e nishaneve n i me qëndrueshmëri P, T dhe n j, marrim
|
| |||||
|
μ i
|
potencial kimik i-komponenti; Molar i pjesshëm i energjisë Gibbs i-komponenti; entalpi molare e pjesshme i-komponenti; entropia molare e pjesshme i-komponenti. |
||||
Kështu, me ndihmën e sasive molare të pjesshme, mund të aplikoni në zgjidhje të gjithë aparatin matematikor të termodinamikës kimike për një substancë të pastër. Kjo bën të mundur që përmes ekuacioneve termodinamike të shprehen çdo veti ekuilibri të një tretësire, të cilat përfshijnë presionin e avullit të përbërësve mbi tretësirën, uljen e pikës së ngrirjes dhe rritjen e pikës së vlimit të tretësirës, tretshmërinë e substancave, presioni osmotik, shpërndarja e një lënde midis dy tretësve të papërzier etj.
Për të nxjerrë marrëdhëniet midis vlerave molare të pjesshme të përbërësve të zgjidhjes, ne integrojmë ekuacionin (5.7) në një përbërje konstante të tretësirës. Kjo gjendje do të thotë që të dy përbërësit i shtohen tretësirës në pjesë të vogla dhe në një raport të tillë që përbërja e tretësirës të mos ndryshojë (d.m.th. shtohen sasi të vogla të një tretësire me përqendrim të njëjtë). Atëherë sasitë molare të pjesshme do të mbeten konstante. ku
|
|
Konstanta e integrimit në këtë ekuacion është e barabartë me zero, pasi në P 1 = 0 dhe P 2 = 0 pronë mortajash X i zakonshëmështë gjithashtu e barabartë me zero.
Kështu, çdo veti e gjerë mund të gjendet nga vetitë e përbërësve për çdo zgjidhje me anë të shtimit të aditivëve, nëse jo molare, por përdoren vlera molare të pjesshme.
Megjithatë, nëse sasia dhe përbërja e tretësirës ndryshohen njëkohësisht, atëherë ndryshimi në vetinë X i zakonshëm mund të gjendet duke diferencuar ekuacionin (5.10) :
I ndajmë të dyja anët e ekuacioneve (5.10) dhe (5.12) në P 1 + P 2. Duke pasur parasysh se
përkatësisht marrim
mol tretësirë quhet sasia e tij, në të cilën numri i moleve të çdo komponenti është i barabartë me fraksionin e tij mol.
Për një zgjidhje të i Përmbledhja e komponentëve duhet të bëhet mbi të gjitha i komponentët:
Sasitë molare të pjesshme që karakterizojnë ndryshimin në vetitë e gjera të tretësirës mund të jenë, në ndryshim nga vetitë, pozitive dhe negative. Nëse tretësira është formuar nga përbërësit pa ndryshim në vëllim, atëherë është e qartë se vëllimi molar i pjesshëm i përbërësit është i barabartë me vëllimin molar të tij. Nëse, për shkak të ndërveprimit të fortë molekular, kur një përbërës i shtohet një zgjidhjeje, ndodh një rënie në vëllim, atëherë vëllimi i pjesshëm molar do të jetë një vlerë negative.
Vlerat e pjesshme molare të sistemeve binare mund të përcaktohen me metoda analitike dhe grafike. Më së shpeshti përdoret metodë grafike segmente. Për ta bërë këtë, sipas të dhënave eksperimentale, ndërtohet një varësi grafike e vetive ekstensive, për shembull, vëllimi molar i tretësirës nga përbërja (Fig. 5.1.).
Pastaj, me një përbërje të caktuar (për shembull, në pikë POR) vizatoni një tangjente në kurbë. Prerja e kësaj tangjente me boshtet e ordinatave në pika AT dhe NGA jep vlerat e sasive molare të pjesshme 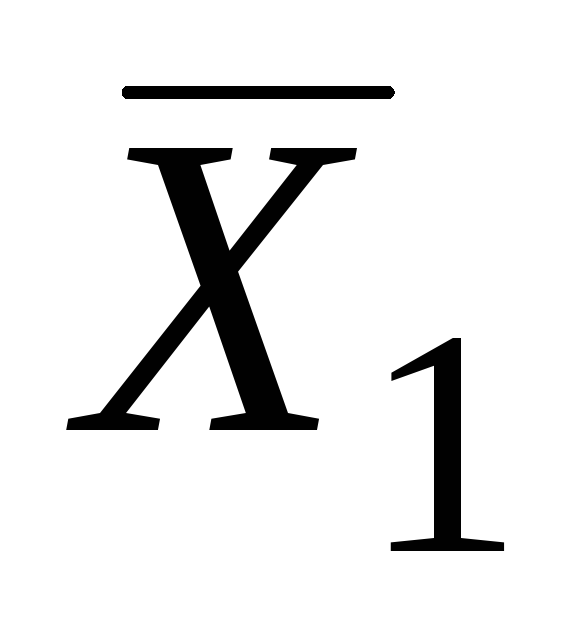 dhe
dhe 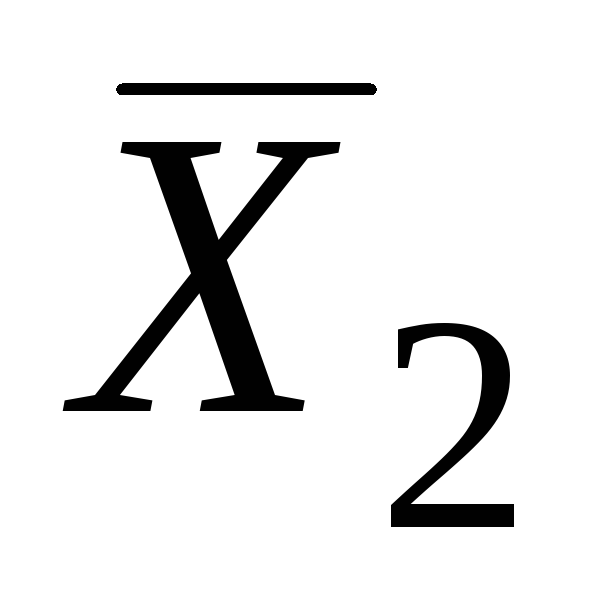 .
.
Vlerat molare të pjesshme mund të përcaktohen gjithashtu nga varësia e vetive të zgjidhjes X mbi numrin e moleve të përbërësit të tretur në presion konstant të temperaturës dhe sasinë e tretësit. Tangjentja e pjerrësisë së tangjentes me lakoren në grafik X i zakonshëm = f(n 2) është e barabartë me vlerën molare të pjesshme.

Vlera molare e pjesshme e një komponenti mund të llogaritet nga ekuacioni (5.14) , duke ditur madhësinë molare të pjesshme të tjetrit:
|
Kur integrojmë këtë ekuacion, marrim
| ||||
|
|
vlera molare të pjesshme për përbërje të ndryshme të sistemit. |
|||
Vlera e integralit gjendet nga një grafik i paraqitur në koordinata  .
.