Potenciali kimik i një lënde. Potenciali kimik
Gjatë ndryshimit të numrit të grimcave në sistem dhe të nevojshme për të përshkruar vetitë sistemet e hapura(me një numër të ndryshueshëm grimcash).
X. p. m i
i Komponenti i një sistemi shumëkomponentësh është i barabartë me derivatin e pjesshëm të cilësdo termodinamik. potencialet sipas numrit (numrit të grimcave) të këtij komponenti në post. vlerat e termodinamikës së mbetur. variablat që përcaktojnë këtë termodinamikë. potencial, p.sh. m i = (dF/dN i) T,V,N (F-energji e lirë, T- temp-ra, V- vëllimi, ji). Kështu, në sistemet me alternim numri i grimcave në shprehjen për diferencialin, për shembull. dF, shtoni vlerën:
![]()
ku R- presioni, S-entropia. Naib. vetëm X. p. shoqërohet me termodinamikë. potencial G(cm. Energjia e Gibbs):. Për një sistem me një komponent X. n. m = G/N,
d.m.th., është energjia Gibbs për grimcë. Për shkak të aditivitetit G, përveç presionit dhe temperaturës, X. p. varet vetëm nga përqendrimi i otd. komponentë, por jo në numrin e grimcave në secilin komponent. Në rastin më të thjeshtë gazet ideale m i varet vetëm nga përqendrimi i- Komponenti i saj:
ku është numri i përgjithshëm i grimcave, m ~ i-X. n. i pastër i th
komponent. Shpesh vlerat m i i përshtatshëm për t'u përdorur si termodinamikë e pavarur. në vend të variablave N i. Në variabla T, V, m i gjendja e sistemit karakterizon termodinamik. potencial
![]()
X. p. është termodinamik. parametër në Shpërndarja e madhe kanonike e Gibbs për sistemet AC numri i grimcave. Si një konstante normalizimi X. p. përfshihet në shpërndarjet e Boltzmann, Bose - Einstein dhe Fermi - Dirac për grimcat. gazet ideale(cm. fizika statistikore Në sistemet për të cilat zbatohen statistikat e Boltzmann ose Bose-Einstein, X. p. është gjithmonë negativ. Për Gazi Fermi X. p. në temperaturë zero është pozitive dhe përcakton kufirin Energjia e Fermit(cm. Sipërfaqja e Fermit) dhe temperatura e degjenerimit. Nese nje
numri i përgjithshëm i grimcave në sistem nuk është fiks, por duhet të përcaktohet nga gjendja termodinamike. ekuilibri, si p.sh fononet në trup i fortë ose për fotone në rastin e ekuilibrit termik, atëherë ekuilibri karakterizohet nga barazia me zero X. p.
Koncepti i x.p na lejon të formulojmë kushtet ekuilibri termodinamik. Një nga kushtet është që X. p. i çdo komponenti të jetë i njëjtë në decomp. faza dhe në vende të ndryshme të një faze. Kjo është për shkak të mundësisë së një rishpërndarjeje të grimcave, duke çuar në një barazim të X. p. Për sistemet në një ekst hapësinor johomogjen. fusha e ekuilibrit do të thotë se
![]()
ku m i 0 - X. p. në mungesë të një fushe, U i (r)- potencial energjia e grimcave i komponenti th në ext. fushë. Për një gaz në një fushë gravitacionale, kjo gjendje çon në një barometrike filtër për gaz. Në rast të karikimit grimcat në elektrike. fushë (p.sh. në gjysmëpërçues) vlera m i thirrur potencial elektrokimik, duke lënë emrin X. p. për m i 0 . Barazia e vlerave të X.p. për grimcat e të njëjtit komponent që janë në faza të ndryshme përcakton kushtet e ekuilibrit për tranzicionet fazore (
Termodinamika e kalimeve fazore. Përkufizimet
Le të shqyrtojmë termodinamikën e sistemeve në të cilat tranzicionet fazore. Një sistem termodinamik që mund të shkëmbejë materie me mjedisi, quhet hapur.
Sistemi termodinamik quhet homogjene ose homogjene, nëse në çdo pjesë të vogël të saj vetitë fizike substancat dhe parametrat intensivë termodinamikë janë të njëjtë ose ndryshojnë në hapësirë në mënyrë të vazhdueshme.
Sistemet termodinamike në të cilat vetitë fizike të një substance dhe parametrat intensivë ndryshojnë papritur në disa sipërfaqe brenda sistemit quhen heterogjene. Një shembull i një sistemi heterogjen është një lëng që vlon.
Zonat në një sistem heterogjen me veti dhe parametra homogjenë ose në ndryshim të vazhdueshëm quhen fazat. Në ekuilibrin e një sistemi heterogjen në mungesë të fushave të jashtme, parametrat intensivë brenda çdo faze janë konstante.
Por këta parametra intensivë nuk duhet të jenë të njëjtë në faza të ndryshme. Pra, një sistem homogjen është njëfazor.
Secila nga fazat, në rastin e përgjithshëm, mund të jetë një përzierje homogjene e substancave kimikisht të pastra, ndërmjet të cilave reaksionet kimike. Substancat kimikisht të pastra në një përzierje quhen komponentët. Fazat në rastin e përgjithshëm mund të shkëmbejnë jo vetëm energjinë në formën e punës ose nxehtësisë, por edhe materien. Shndërrimi i materies nga një gjendje fazore në një tjetër quhet tranzicioni fazor.
Le të jetë i hapur një sistem TD njëfazor me një komponent dhe vetëm substanca që përbën sistemin mund të depërtojë përmes guaskës. Dhe le të jetë sistemi në ekuilibër.
Ndryshimi energjia e brendshme Një sistem i tillë do të ndodhë jo vetëm për shkak të furnizimit me nxehtësi dhe performancës së punës në të, por edhe për shkak të një ndryshimi në masën e tij. Substanca që depërton nëpër guaskë mbart energjinë e saj të qenësishme. Pastaj ekuacionet e Gibbs-it për secilën nga katër potencialet termodinamike(5.3) dhe (5.5) duhet të plotësohen me një term më shumë në përpjesëtim me ndryshimin e masës së sistemit, d.m.th.
Vlera μ , i përcaktuar nga derivate të pjesshëm
quhet potencial kimik dhe ka kuptim të ndryshohet energjia e një sistemi termodinamik kur masa e tij ndryshon me një, duke ruajtur një konstante të një ose një çifti tjetër parametrash të pavarur të sistemit.
Le të gjejmë lidhjen e potencialit kimik me potencialet e tjera të sistemit. Për ta bërë këtë, merrni parasysh të katërtën nga shprehjet në (4.12). Energjia e lirë e Gibbsit Φ, entropia S dhe vëllimi i sistemit V ne shkruajmë përmes vlerave të tyre specifike:
Zëvendësimi i diferencialit të energjisë së lirë Gibbs me shprehjen e tij ![]() dhe duke riorganizuar kushtet, marrim:
dhe duke riorganizuar kushtet, marrim:
Sipas (4.5) për M= konstitu = 1 kg ![]() , prej nga, në funksion të arbitraritetit të diferencialit të masës d M, ne gjejme:
, prej nga, në funksion të arbitraritetit të diferencialit të masës d M, ne gjejme:
ato. Potenciali kimik i një substance është energjia e saj specifike e lirë nga Gibbs.
4.6. Kushtet për ekuilibrin termodinamik të sistemeve shumëfazore. Rregulli i fazës Gibbs
Konsideroni sistemi me një komponent, i përbërë nga dy faza ndërvepruese. Le të jetë secila nga fazat në ekuilibrin e vet të brendshëm, d.m.th. secila prej tyre karakterizohet nga grupi i vet i parametrave. Le të studiojmë çështjen e ekuilibrit midis fazave. Për ta bërë këtë, ne mbyllim të gjithë sistemin në një guaskë izoluese (Fig. 4.1). Pastaj, me një ndryshim të vogël në gjendjen e secilës prej fazave (nënsistemeve), mund të shkruhet për to identitetet termodinamike në përputhje me (4.1)
 (4.15)
(4.15)
Për shkak të aditivitetit të sasive të mëdha ![]() , mbylljen e sistemit, dhe kthyeshmërinë e procesit, kemi
, mbylljen e sistemit, dhe kthyeshmërinë e procesit, kemi
![]()
ato. Pas mbledhjes së barazive (4.5) marrim:
Për shkak të arbitraritetit të diferencialeve ![]() , faktorët në kllapa në këto diferenciale duhet të jenë të barabartë me zero, nga ku marrim kushtet e ekuilibrit termodinamik të sistemit të dëshiruar:
, faktorët në kllapa në këto diferenciale duhet të jenë të barabartë me zero, nga ku marrim kushtet e ekuilibrit termodinamik të sistemit të dëshiruar:
 (4.16)
(4.16)
Potenciali kimik, sipas përkufizimit, është në vetvete një funksion i një çifti natyror të ndryshoreve, kështu që gjendja e ekuilibrit fazor mund të shkruhet si
Lloji i funksioneve nga T dhe fq në rastin e përgjithshëm është i ndryshëm për secilën nga fazat, kështu që kushti (4.17) nuk është një identitet. Ky është një ekuacion algjebrik që lidh temperaturën dhe presionin në një sistem ekuilibri që përbëhet nga dy faza bashkëekzistuese ndërvepruese ndërmjet të cilave shkëmbehen nxehtësia, puna dhe lënda.
Kështu, në një sistem dyfazor me një komponent, temperatura dhe presioni janë të lidhura në mënyrë unike. Vëllimi i sistemit mund të marrë një vlerë arbitrare në varësi të raportit midis masave të fazave. Gjendja e ekuilibrit të një sistemi dyfazor quhet gjendja e ngopjes, dhe temperatura dhe presioni i barabartë për fazat quhen parametrat e ngopjes. T s, fq s .
Merrni parasysh ekuilibrin sistem trefazor me një komponent. Në këtë rast:
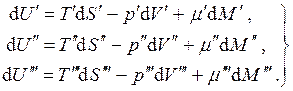 (4.18)
(4.18)
Por për sistem i mbyllur:
duke marrë parasysh atë, duke shtuar ekuacionet (4.8), marrim:
Meqenëse të gjitha diferencat këtu janë të pavarura dhe vlerat e tyre janë arbitrare, gjejmë kushtet e ekuilibrit:
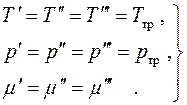 (4.19)
(4.19)
Ekuilibri kimik, d.m.th. barazia e potencialeve kimike të fazave, mund të shkruhet në formën e dy ekuacioneve algjebrike
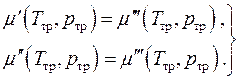 (4.20)
(4.20)
Ky është një sistem i dy ekuacioneve në dy të panjohura. Një sistem ekuilibër me një komponent mund të ekzistojë njëkohësisht në tre fazat vetëm në vlera të përcaktuara rreptësisht të presionit dhe temperaturës. Kjo gjendje e sistemit quhet pikë e trefishtë.
Për një ekuilibër sistem katërfazor me një komponent:
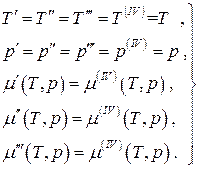 (4.21)
(4.21)
një sistem prej tre ekuacionesh në dy të panjohura. Një sistem i tillë ekuacionesh është i paqëndrueshëm, përveç rastit kur çdo dy prej tyre janë në përpjesëtim me njëri-tjetrin, d.m.th. kur dy nga katër fazat janë në fakt të padallueshme, dhe ky do të jetë tashmë një sistem trefazor. Kështu, në një sistem ekuilibër me një komponent, është e mundur bashkëjetesa e njëkohshme e jo më shumë se tre fazave. Nëse një sistem termodinamik ekuilibër është shumëkomponent, atëherë numri i fazave që bashkëekzistojnë njëkohësisht mund të jetë më shumë se tre, përkatësisht
ku nështë numri i komponentëve të sistemit. Ky rezultat quhet Rregullat e fazës Gibbs.
PLANI I LEKTORËS:
1. Pjesa organizative e ligjëratës: merret një raport për gatishmërinë e kadetëve për mësim, mungesat shënohen në ditar (koha 3-5 minuta).
2. Hyrje në seksionin "Transferimi i nxehtësisë dhe masës".
Pyetjet e ligjëratës:
mekanizmat e transferimit të nxehtësisë.
fusha e temperaturës.
gradienti i temperaturës.
Ligji themelor i përcjelljes së nxehtësisë.
· Koeficienti i përçueshmërisë termike.
· Ekuacioni diferencial i përcjelljes së nxehtësisë.
· Kushtet kufitare.
3. Përfundim.
Për klasën e ardhshme, studentët duhet:
DINI: ekuacioni diferencial përçueshmëri termike; përcaktimi i koeficientëve të nxehtësisë dhe difuzivitetit termik.
TE JESH I AFTE TE: zbatoni kushtet kufitare gjatë zgjidhjes së problemave në ekuacionin e Furierit.
KENI NJË PËRFAQËSIM: për mekanizmat e transferimit të nxehtësisë në trupa me strukturë dhe gjendje të ndryshme grumbullimi.
4. Detyrat për vetë-trajnim:
_____________/ profesor Fizika dhe Transferimi i nxehtësisë, Doktor i Fizikë-Matematikës, P.V. Skripov
Ligjërata u shqyrtua dhe u miratua në mbledhjen e departamentit
Nr. protokolli _______ datë "_____" ______ 2011
Shef i Departamentit të Fizikës dhe Transferimit të Ngrohjes
profesor, d.t.s. __________________ / N.M. barbin
"_____"______________ 2011
Energjia e lirë e sistemit (energjia Gibbs G dhe energjia e Helmholcit F) varet nga kushtet e jashtme:
Kjo varësi është e plotë për sistemet më të thjeshta që përbëhen nga një komponent.
Një sistem termodinamik mund të përbëhet nga një ose më shumë komponentë. Natyrisht, vlera e energjisë së lirë të një sistemi me shumë komponentë do të varet si nga kushtet e jashtme ( T,R, ose V), dhe për natyrën dhe sasinë e substancave që përbëjnë sistemin, d.m.th., energjia e lirë, si çdo funksion termodinamik, është një veti e gjerë e sistemit. Nëse përbërja e sistemit ndryshon me kalimin e kohës (d.m.th., ndodh një reaksion kimik në sistem), është e nevojshme të merret parasysh efekti i ndryshimit të përbërjes në vlerën e energjisë së lirë të sistemit.
Konsideroni një sistem termodinamik të përbërë nga k komponentët. Le n 1 , n 2 , …, n k- numri i nishaneve të 1, 2, ..., k komponentët. Atëherë energjia e lirë e Gibbs është një funksion i variablave të mëposhtëm:
G = f(fq, T, n 1 , n 2 , …, n k )
Diferenconi në lidhje me të gjitha variablat:
 (2.1)
(2.1)
Le të prezantojmë shënimin:
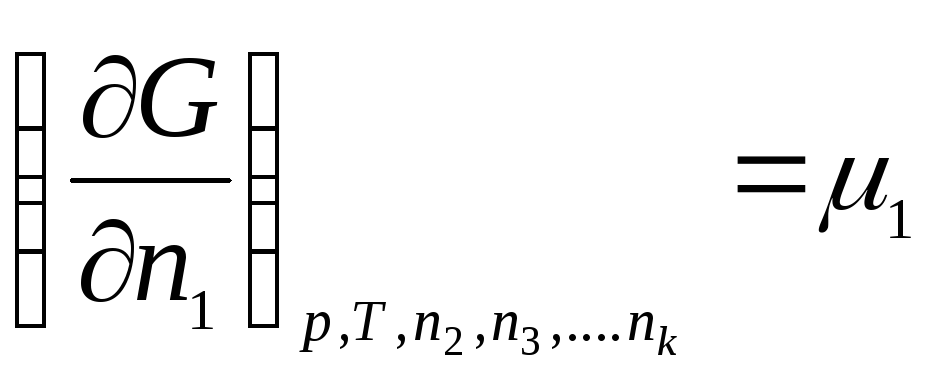
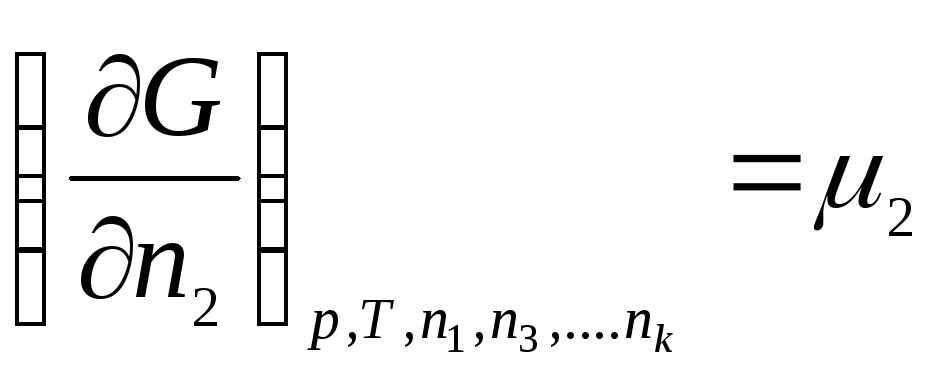
………………….
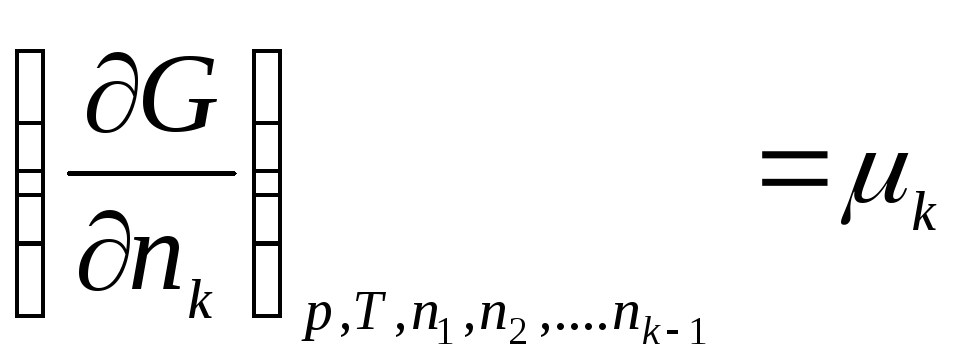 ,
,
ku μ 1 , μ 2 , …, μ k- Potencialet kimike të 1, 2, ..., k th komponentët, përkatësisht.
Në përgjithësi
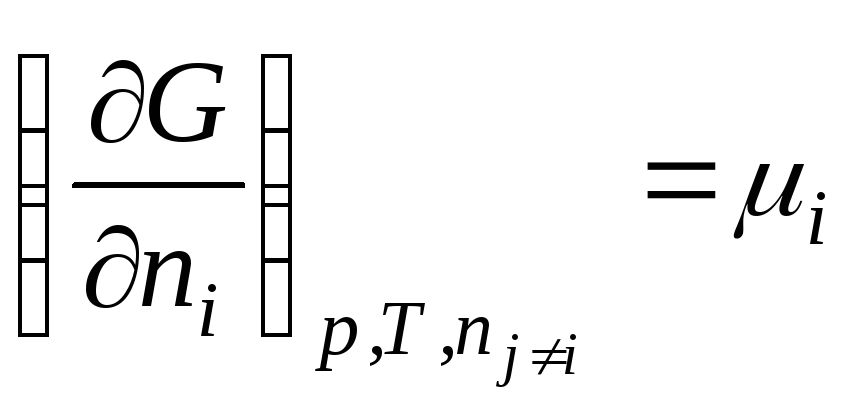 .
.
Ne marrim një shprehje të ngjashme për energjinë e lirë të Helmholtz-it:
F = f(V, T, n 1 , n 2 , …, n k )
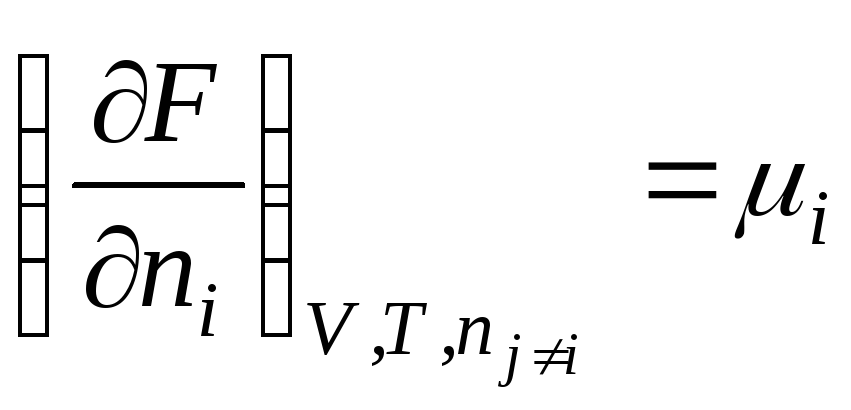 .
.
Në këtë mënyrë, potencial kimikështë derivat i pjesshëm i energjisë së lirë në lidhje me numrin e nishaneve i-komponenti i saj me qëndrueshmërinë e parametrave të jashtëm përkatës dhe numrin e moleve të të gjithë komponentëve të tjerë. Kështu, potenciali kimik është energjia molare e pjesshme Gibbs (at R, T = konst):
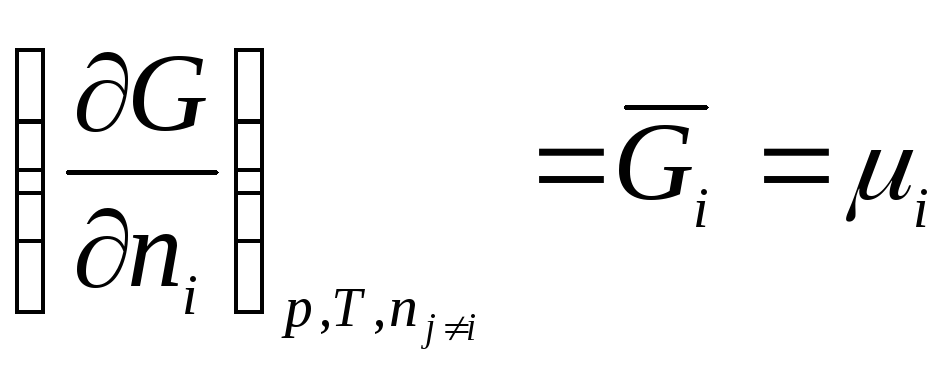 .
.
Energjia e lirë është pronë e përbashkët Sistemet, potenciali kimik karakterizon vetitë e një komponenti individual të përfshirë në sistem. Potenciali kimik është një veti intensive e sistemit, pasi nuk varet nga masa e sistemit.
Në p, T =konst ekuacioni (2.1) ka formën:
![]() .
(2.2)
.
(2.2)
Në këtë rast, ndryshimi në energjinë Gibbs, domethënë puna e dobishme e sistemit, është vetëm për shkak të një ndryshimi në përbërjen e sistemit si rezultat i një reaksioni kimik ose për shkak të shkëmbimit të materies midis sistemit. dhe mjedisin.
Ekuacioni (2.2) shpreh marrëdhënien midis vetive të përgjithshme të sistemit dhe vetive të secilit prej përbërësve të tij. Duke supozuar se potenciali kimik është një vlerë konstante, ne integrojmë ekuacionin (2.2):
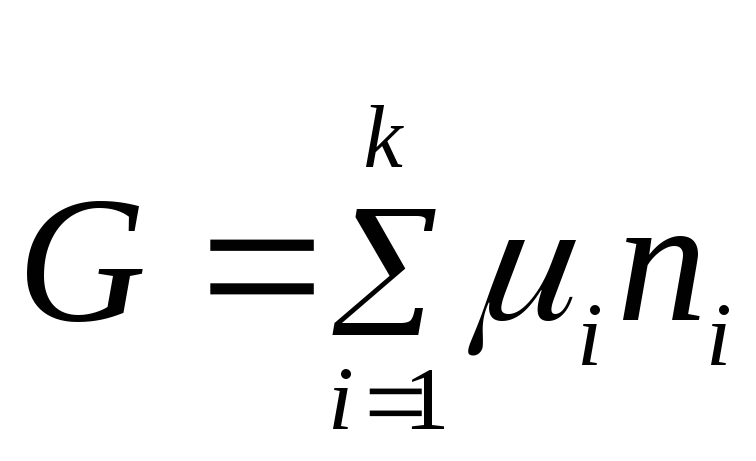 .
.
Konstanta e integrimit është zero sepse nëse të gjitha n i= 0, energjia e Gibbs është gjithashtu e barabartë me zero.
Për një substancë individuale
 ,
,
ato. Potenciali kimik i një lënde individuale është i barabartë me energjinë molare të Gibbs-it.
Në ekuilibër dG = 0 dhe ekuacioni (2.1) merr formën:
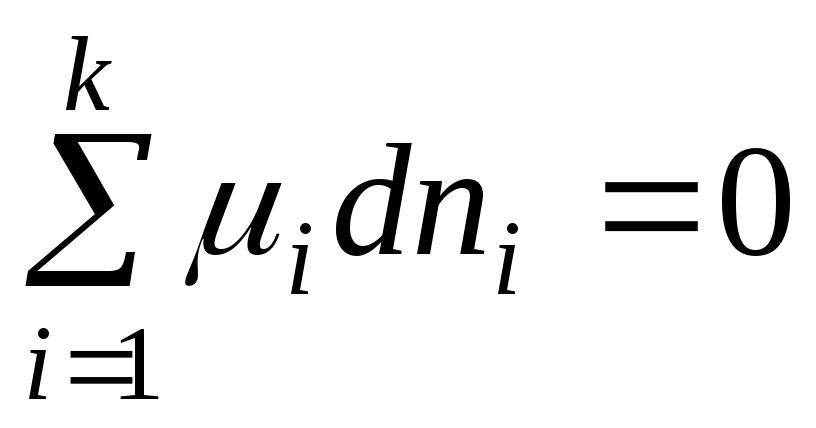 . (2.3)
. (2.3)
Ekuacioni që rezulton është një kusht i përgjithshëm ekuilibri në një sistem me përbërje të ndryshueshme në R,T =konst.
Potenciali kimik i një gazi ideal individual.
Konsideroni një sistem termodinamik që është një gaz ideal. Potenciali kimik gaz ideal barazohet me:
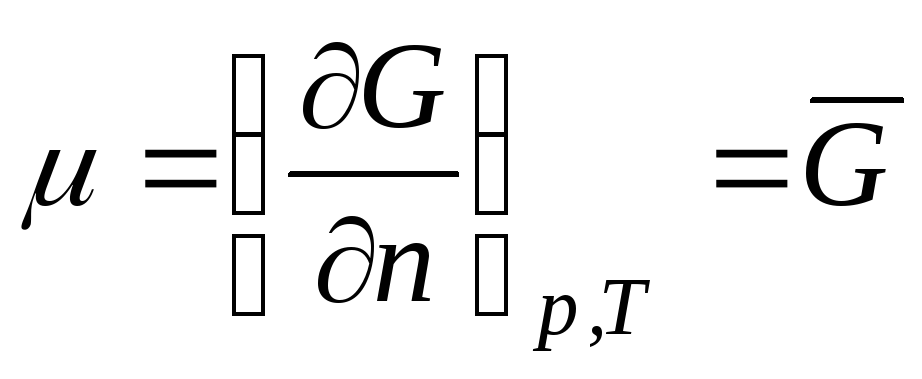 ,
,
ku  është energjia molare e Gibbsit (potenciali izobarik prej 1 mol të një gazi ideal).
është energjia molare e Gibbsit (potenciali izobarik prej 1 mol të një gazi ideal).
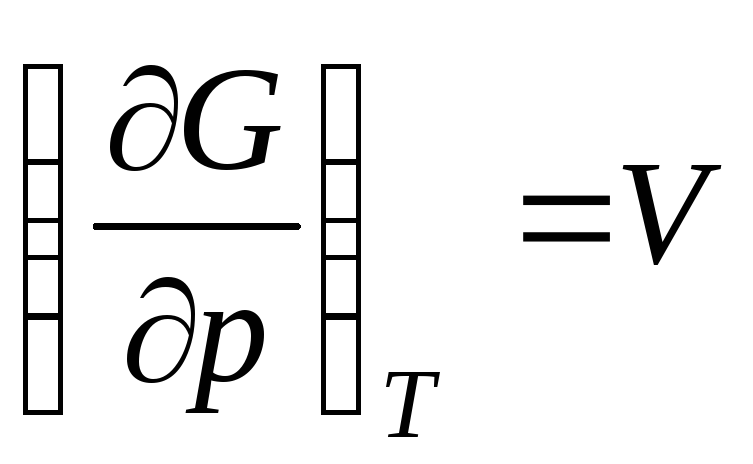 ,
,
pastaj 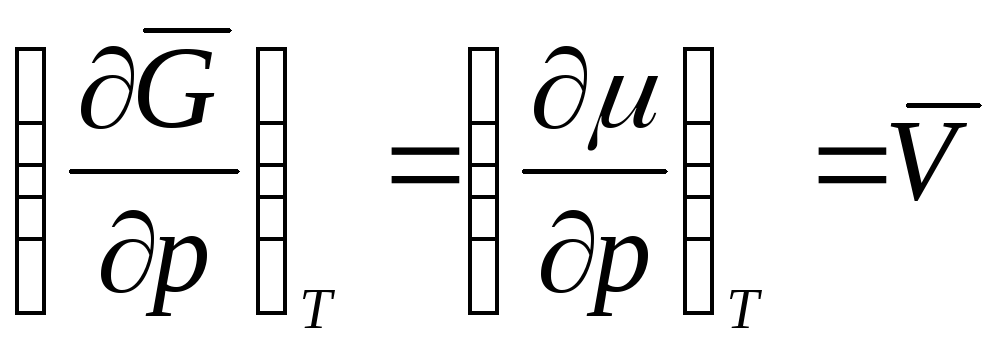 ,
,
ku  është vëllimi molar i një gazi ideal (vëllimi prej 1 mol gaz).
është vëllimi molar i një gazi ideal (vëllimi prej 1 mol gaz).
Nëse procesi po funksionon në T =konst, derivati i pjesshëm mund të zëvendësohet me totalin. Pastaj

Ekuacioni i gjendjes për 1 mol të një gazi ideal është:
 ;
;
 ,
,
![]()
Le të integrohemi në intervalin nga R 0 përpara R:
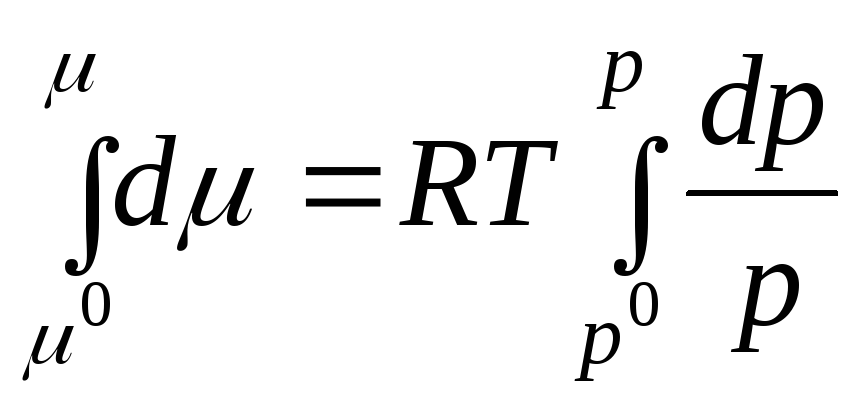
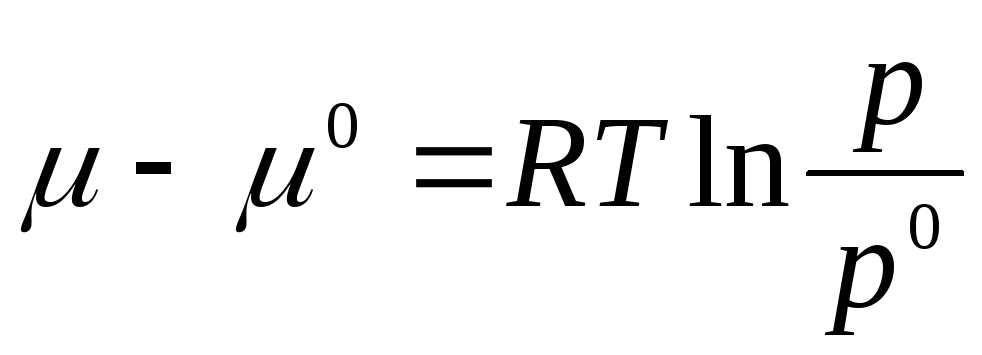
ku μ 0 , R 0 është potenciali kimik dhe presioni i një gazi ideal në gjendjen standarde.
Gjendja standarde merret si gjendja e një gazi ideal në R 0 = 1 atm.
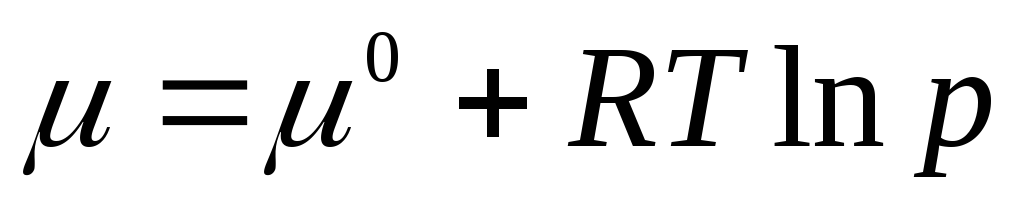 .
(2.3)
.
(2.3)
Potenciali kimik standard është potenciali kimik në një presion gazi prej 1 atm. Potenciali kimik në gjendje standarde μ 0 varet vetëm nga temperatura dhe nuk varet nga presioni, d.m.th. μ 0 = f(T). Ekuacioni (2.3) tregon se nën shenjën e logaritmit është një sasi pa dimension e barabartë me raportin e presionit R në presionin standard R 0 = 1 atm.
Sepse μ
=
 , mund të shkruhet
, mund të shkruhet
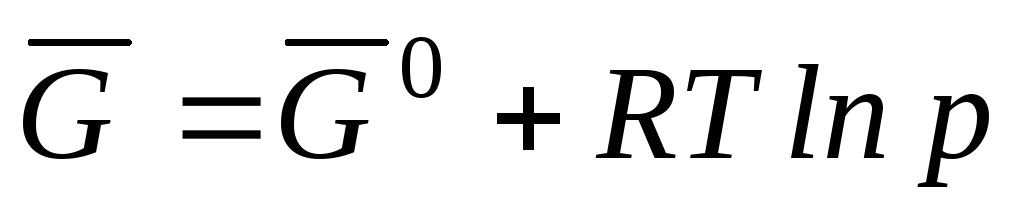
ku  është energjia molare standarde e Gibbs-it.
është energjia molare standarde e Gibbs-it.
Potenciali kimik i një komponenti të tretësirave ideale.
Nëse presioni total i përzierjes së gazit është i vogël, atëherë çdo gaz do të ushtrojë presionin e vet, për më tepër, si për shembull nëse ai i vetëm do të zinte të gjithë vëllimin. Ky presion quhet i pjesshëm. Presioni total i vëzhguar Rështë e barabartë me shumën e presioneve të pjesshme të çdo gazi (ligji i Daltonit):
 .
.
Potenciali kimik i një përbërësi të një përzierjeje ideale të gazit është:
 ,
,
ku R iështë presioni i pjesshëm i gazit.
Duke shprehur presionin e pjesshëm të një gazi R i përmes presionit total dhe fraksionit mol të gazit x i, merrni shprehjen për varësinë e potencialit kimik i-përbërësi i thtë nga fraksioni mol:
ku  është potenciali kimik i një gazi ideal në x i= 1 (d.m.th. në gjendjen individuale) në presion R dhe temperatura T;
është potenciali kimik i një gazi ideal në x i= 1 (d.m.th. në gjendjen individuale) në presion R dhe temperatura T;
 varet si nga temperatura ashtu edhe nga presioni.
varet si nga temperatura ashtu edhe nga presioni.
Për zgjidhje ideale të lëngshme ekuacioni i zbatueshëm
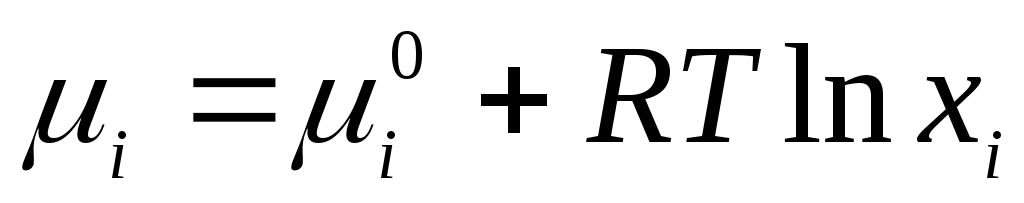 ,
,
ku 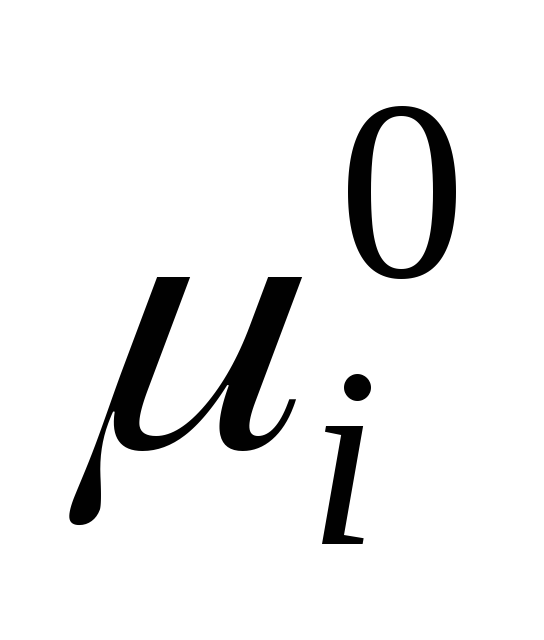 është potenciali kimik standard i një komponenti individual në gjendje të lëngët (
është potenciali kimik standard i një komponenti individual në gjendje të lëngët (  ) varet nga temperatura dhe presioni; x i është fraksioni mol i komponentit.
) varet nga temperatura dhe presioni; x i është fraksioni mol i komponentit.
Potenciali kimik i një komponenti të tretësirave reale .
Për zgjidhjet reale, të gjitha varësitë e konsideruara janë të pazbatueshme. Potenciali kimik i komponentit zgjidhje e vërtetë e gazit llogaritur duke përdorur metodën Lewis. Në këtë rast, për të ruajtur formën e ekuacioneve termodinamike, në vend të presionit të pjesshëm, ato vendosin një sasi fiktive. f i, e cila quhet fugaciteti i pjesshëm, ose paqëndrueshmëria. Pastaj
![]() ,
,
ku  është potenciali kimik i një përbërësi të një përzierjeje të vërtetë gazi në gjendje standarde.
është potenciali kimik i një përbërësi të një përzierjeje të vërtetë gazi në gjendje standarde.
Raporti i paqëndrueshmërisë me presion i pjesshëm Zgjidhja reale e gazit quhet koeficienti i paqëndrueshmërisë:
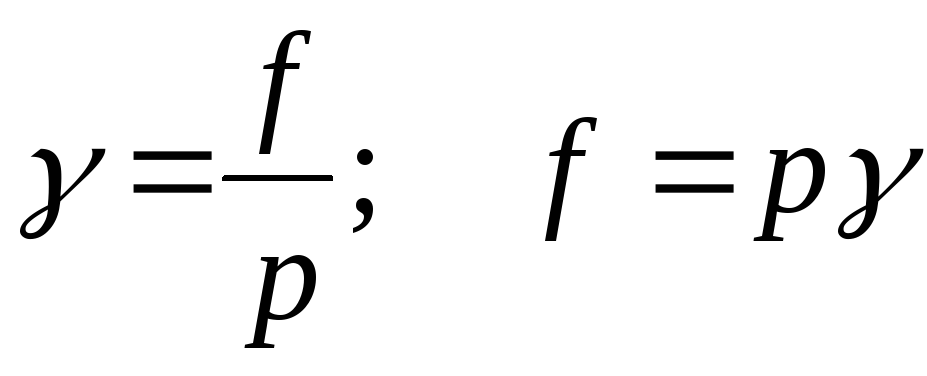 ;
;
Në mënyrë të ngjashme, për zgjidhje reale të lëngshme përqendrimi aktual zëvendësohet me vlerën fiktive përkatëse - aktivitet a i :
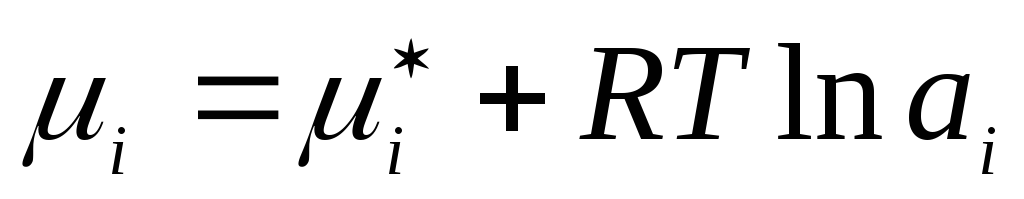 ,
,
ku  është potenciali kimik i një përbërësi të një tretësire reale të lëngshme në gjendje standarde.
është potenciali kimik i një përbërësi të një tretësire reale të lëngshme në gjendje standarde.
Aktiviteti lidhet me përqendrimin përmes koeficientit të aktivitetit:
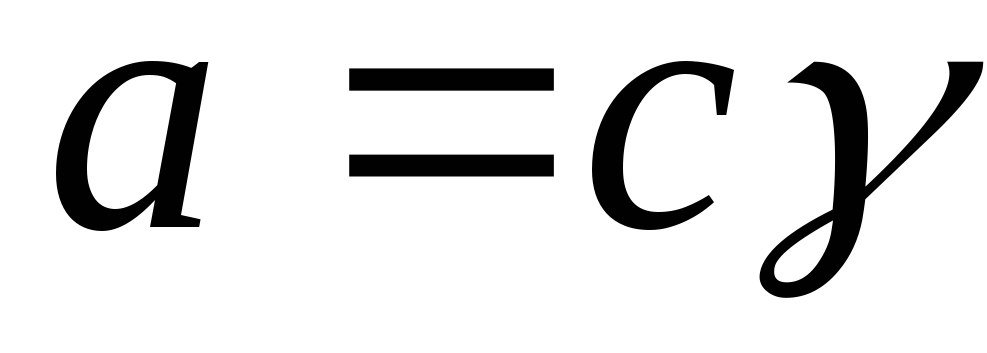 ,
,
ku γ i është koeficienti i aktivitetit.
Në varësi të metodës së shprehjes së përqendrimit të një tretësire, dallohen koeficientët e aktivitetit racional, molar dhe molar:

Koeficienti i aktivitetit varet nga përqendrimi i tretësirës. Në tretësirat e holluara pafundësisht γ → 1, a i dhe f i → c i dhe fq i përkatësisht.
Le të rishkruajmë ekuacionin për potencialin kimik në formë
 ,
,
prandaj aktiviteti termodinamik është vepër e transferimit të 1 mol i komponenti th nga zgjidhja standarde në zgjidhjen reale të dhënë.
Ka dy mënyra kryesore për të zgjedhur gjendje standarde- simetrike dhe asimetrike.
mënyrë simetrike. E njëjta gjendje standarde zgjidhet për tretësin dhe lëndën e tretur - gjendja e përbërësit të pastër në temperaturën e tretësirës. Pastaj në gjendjen standarde x i = 1, a i = 1dhe γ i = 1. Kjo metodë përdoret më shpesh për tretësirat jo elektrolitike.
mënyrë asimetrike. Për tretësin dhe lëndën e tretur zgjidhet një gjendje standarde e ndryshme. Për tretësin - si në metodën simetrike: x i → 1, a i → 1dhe γ i → 1. Për një tretësirë gjendja standarde është gjendja e materies në një tretësirë të holluar pafundësisht: x i → 0, a i → x i dhe γ i → 1. Metoda përdoret më shpesh në termodinamikën e tretësirave të elektrolitit.






