Kütle transfer süreçleri: ekstraksiyon, ekstraksiyon
Kütle transfer süreçlerinin sınıflandırılması.
İlk ve nihai ürünlerin madde alışverişi yaptığı kütle transfer süreçleri, hammaddelerde küçük konsantrasyonlarda bulunan kontrollü bir biçimde ürünler elde etmek için organize edilir. Bu işlemler kütle transfer aparatlarında gerçekleştirilir.
Kütle transferi süreçleri üç ana özelliğe göre sınıflandırılır: maddenin kümelenme durumu, faz teması yöntemi ve etkileşimlerinin doğası.
Şekil (1)'de temas eden fazların kümelenme durumuna göre kütle transferi işlemlerinin sınıflandırılması.
Üç olası fazın iki farklı kombinasyonunu hayal edebilirsiniz: gaz - sıvı, gaz - katı, sıvı - sıvı, sıvı - katı, gaz - gaz, katı - katı. Son iki kombinasyon, kütle transfer cihazlarında pratik olarak kullanılmamaktadır.
İki ayrılabilir bileşen aynı anda gaz ve
sıvı fazlar, damıtma (damıtma) ve arıtma işlemlerinde ayrılmaları mümkündür.
Damıtma (damıtma) - sıvı karışımların bileşimde farklılık gösteren fraksiyonlara ayrılması.
Rektifikasyon, birkaç bileşenden oluşan sıvı karışımları ayırmak için bir yöntemdir.Rektifikasyon, bir sıvının tekrar tekrar buharlaştırılmasına ve buharlarının yoğunlaştırılmasına veya bir karışımın tek bir buharlaşmasına ve ardından bileşenlerin çok aşamalı yoğunlaştırılmasına dayanır.Rektifikasyon kullanılır, örneğin , alkol endüstrisinde rektifiye alkol elde etmek için. Bu nedenle, sudaki bir etil alkol çözeltisi kısmen buharlaştırılırsa, buhar fazındaki alkol konsantrasyonu, kalan sıvıdakinden ve orijinal çözeltidekinden daha büyük olacaktır. Bundan sonra buhar yoğunlaştırılırsa, içinde farklı konsantrasyonlarda alkol bulunan iki sıvı elde edilecektir. Bu işlemi tekrarlamak, daha yüksek ve daha yüksek konsantrasyonlarda alkol sağlayabilir, yani. daha yüksek derecede bileşen ayrımı.
(Şekil 1) Çalışma organlarının kümelenme durumuna göre kütle transfer işlemlerinin sınıflandırılması: G-gazı; Zh - sıvı; TV.t - sağlam bir gövde.
Bileşenin, kendi aralarında çözünmeyen fazların her birinde çözünür olması durumunda, bileşenin gaz fazından sıvı faza geçiş sürecine absorpsiyon (hacimsel absorpsiyon) denir ve bunun tersi işlem olarak adlandırılır. desorpsiyon denir. Örneğin, amonyak ve hava karışımı suyla temas ettirilirse, amonyağın bir kısmı suya geçer (su amonyağı emer) ve hava kısmen temizlenir. Tersine işlemde, sulu bir amonyak çözeltisi hava ile temas ettiğinde, amonyağın bir kısmı ikincisine geçer - bir desorpsiyon işlemi meydana gelir.
Bileşenlerden birinin fazdan faza geçişi sırasında bunlardan birinde sıvı (çözücü) miktarı azalır (artarsa) bu işleme kurutma (nemlendirme) denir.Örneğin süt sıcak hava ile temas ettiğinde, su havaya geçer. Aynı zamanda süt kurutulur ve hava nemlendirilir.
Sıvı fazdan geçmeden katı halden gaz hale geçişe süblimleşme denir. Hem gazın hem de katının yalnızca katının gözeneklerinde ve yüzeyinde bulunan sıvının taşıyıcıları olduğu özel durumda, ısı verildiğinde buhara geçişine kurutma veya dondurarak kurutma denir. Özellikle sebzelerde sıvı veya buhar halindeki nem yüzeye aktarılır ve daha sonra yüzeyden uzaklaştırılır, yani. tipik kurutma işlemi. Ters işlem - karışımın bileşenlerinin gaz fazından katı hale geçişi - adsorpsiyon işlemi (yüzey absorpsiyonu) veya iyon değişimi işlemi olarak adlandırılır.Adsorpsiyon örneği, su buharı parçacıklarının penetrasyonudur. hava ile karışımından silika jel granüllerine ve bunların gözeneklerinde tutulmasından; hava kurutulurken.
Gaz fazı, adsorban tarafından değişen derecelerde adsorbe edilen birkaç bileşenin bir karışımıysa, karışımı fraksiyonel adsorpsiyon ile ayırmak mümkündür.
Bir sıvı-sıvı sisteminde ayrılırken, birbiri içinde çözünmeyen iki sıvı temas ettirilir ve bunların her biri, ayrılan bileşeni farklı bir ölçüde çözer. Örnek: etil alkol ve izobütanolün karışımlarını suyla temas ettirerek ayrılması. Bu durumda izobütanol aktif olarak suya geçer. Bundan sonra izobutanolün sulu çözeltisi, izobütanol miktarının önemli ölçüde azaldığı etil alkol ile karışımından ayrılırsa, o zaman işlem, ayrılan izobutanol ve alkol karışımının tatlı su ve izobutanol ile yeni bir temasıyla tekrarlanabilir. ondan daha yüksek bir konsantrasyon elde edilebilir. Bu işleme sıvı ekstraksiyonu denir.
Fraksiyonel kristalizasyon işlemlerinde özellikle saf maddeler elde edilir. Çözeltiden düşen ve orijinal çözeltiden daha az miktarda kirletici içeren kristaller, çözelti içinde çözünür. saf çözücü ve çözeltiden tekrar kristalleşir. Bu durumda kirleticilerin bir kısmı tekrar ayrıştırılır.
Sıvı-katı sisteminde her iki faz da nötr maddeler ise ve ayrılan bileşen katıdan sıvıya geçiyorsa katı sistemde ayırma işlemine ekstraksiyon denir. vücut sıvısı. Bu sürecin bir örneği, meyve suyunun pancardan suya geçişidir.
Bir maddenin sıvı fazdan katının yüzeyine aktarılmasının ters işlemi, adsorpsiyon ve diğer değişim süreçlerinde ve hacimde - ters ekstraksiyon işlemlerinde gerçekleşir.Adsorpsiyon örneği, suyun safsızlıklardan arındırılmasıdır. bu safsızlıkları emen bir aktif karbon memesinden geçirildiğinde. Geri çıkarmanın bir örneği, et veya balığın tuzlanması olabilir.
Faz teması yöntemine göre, kütle transferi prosesleri doğrudan faz teması, membranlar üzerinden temas ve görünür faz sınırı olmayan proseslere ayrılır.Eğer fazlar arasına membranlar kurulursa, ayırma prosesi membran teknolojileri alanına aittir.
Fazların etkileşiminin doğasına göre, kütle transfer süreçleri ve aparatları periyodik ve sürekli olarak ayrılır. Ek olarak, sürekli süreçlerde, bileşenlerin doğrudan akış, karşı akım, çapraz akış ve birleşik hareketini organize etmek mümkündür.Prosesin özel organizasyonuna bağlı olarak, sürece dahil olan maddelerin konsantrasyonlarında çeşitli değişiklikler meydana gelir. aparatın uzunluğu boyunca ve zaman içinde işlem yapmak mümkündür. Süreçlerin birleştirilmesiyle çeşitlilikleri artırılır.
Kütle transfer aparatı hesaplamaları
Kütle transfer cihazlarının mühendislik hesaplamaları fenomenolojik bağımlılıkları kullanır. arasındaki ampirik bağlantı katsayılarını yaygın olarak kullanırlar. itici güç fenomenlerin fiziksel veya kimyasal özüne derinlemesine nüfuz etmeden süreç ve reaksiyonlar. Kütle transfer süreçlerinin itici gücü, konsantrasyonlardaki farktır.
Çözeltinin konsantrasyonu (karışım). Bir çözeltideki belirli bir bileşenin nispi miktarına konsantrasyonu denir. Çözünen madde konsantrasyonu yüksek olan çözeltilere konsantre, konsantrasyonu düşük olan çözeltilere seyreltik denir.
Konsantrasyonları ifade etmenin aşağıdaki yolları en yaygın olarak kullanılır:
Kütle - bir çözeltinin 100 kütle birimindeki bir çözünenin kütle birimlerinin sayısı. Örneğin, %15'lik bir sodyum klorür çözeltisi, 100 gr'ı 15 gr sodyum klorür ve 85 gr su içeren bir çözeltidir;
hacimsel molar - çözeltinin birim hacmi başına çözünen maddenin mol sayısı;
kütle molar - 1000 g çözücüde çözünen maddenin mol sayısı;
bağıl mol (mol kesri) - söz konusu maddenin mol sayısının çözeltideki tüm maddelerin toplam mol sayısına oranı.
Sistemdeki denge konsantrasyonuna ulaşılır ulaşılmaz kütle transfer süreci duracaktır.
Faz dengesi Kütle transfer aparatındaki süreçlerin dengesi için ana koşul, fazların dengesidir. Örneğin, termodinamik parametrelerdeki bir değişikliğin bir sonucu olarak maddelerin durumu dengeden saptığında, geçici bir dengeyi yeniden kurma süreci gerçekleşir (Le Chatelier ilkesi).
Denge durumu, yalnızca sıcaklık ve basıncın dış etkenlerden etkilendiği bir denge termodinamik sisteminin S serbestlik derecesi sayısının K bileşenlerinin sayısına eşit olduğu girişinde tartışılan Gibbs faz kuralına uyar. eksi faz sayısı Ф artı iki:
S=K-F +2.
Bilindiği gibi serbestlik derecesi sayısı, termodinamik dengenin mümkün olduğu herhangi bir değer için bağımsız değişkenlerin (sıcaklık, basınç, konsantrasyon) sayısıdır. Örneğin, sadece su buharından oluşan bir sistemde (bileşen sayısı K = 1, sayı Ф = 1), elimizde S = 1-1 + 2 = 2 vardır. Bu sistemin iki parametresi, örneğin sıcaklık ve basınç, dengeyi bozmadan, yani yeni bir faz oluşmadan geniş bir aralıkta değişebilir. Aynı sistemde yeni bir faz (bir sıvı) belirirse, faz sayısı Ф=2'ye ve ardından S=1-2+2=1'e eşit olacaktır. Bu sistemde, bir denge durumunda, örneğin sıcaklık gibi yalnızca bir parametre bağımsız olarak değişebilir. Basınç daha sonra ayarlanan sıcaklığa karşılık gelen bir seviyeye ayarlanacaktır. Bu, ya sıvıdan buharın ilave buharlaşması nedeniyle ya da buharın bir kısmının yoğunlaşmasının bir sonucu olarak olacaktır.Böyle bir sisteme ıslak denir. doymuş buhar. Aynı sistemde üçüncü bir faz ortaya çıkarsa - katı bir cisim (buz), o zaman Ф=3, S=0 Bu durumda, sistem tüm özgürlükten yoksundur, yani. yalnızca kesin olarak sabit bir değerde gerçekleştirilebilir. basınç ve sıcaklık - karşılık gelen kritik parametrelerde üçlü nokta su buharı durum diyagramında
Çok bileşenli sistemlerde sıcaklık ve basınca ek olarak bileşenlerin konsantrasyonları da değişir. İkili bir su - alkol karışımı için, K=2, S=2-2=2'ye sahibiz, yani. denge koşulları, iki parametrede keyfi bir değişiklikle gerçekleştirilebilir. Atmosfer basıncında bu parametreler, bir veya iki bileşenin sıcaklığı ve konsantrasyonu veya bileşenlerden birinin basıncı ve konsantrasyonu olabilir. Bir ikili sistemin denge durumları, karışımın basıncı ve sıcaklığı bağımlı parametreler olduğunda, bir bileşenin konsantrasyonunun diğerinin konsantrasyonuna bağımlılığı ve ayrıca birinin konsantrasyonuna ve konsantrasyonunun bağımlılığı olarak sunulur. keyfi bir sıcaklıkta onunla ilişkili diğer bileşen.
Koordinatlardaki izobar diyagramının iki eğrisi vardır - kaynama eğrisi ve yoğunlaşma eğrisi. Üzerindeki izoterm, kaynayan sıvının konsantrasyonuna ve bileşimin buharından gelen kondensat konsantrasyonuna karşılık gelir. Buhar ve sıvı fazların miktarları, bölümlerin oranıyla ters orantılıdır. Diyagramdaki nokta şuna karşılık gelir: kızgın buhar sıcaklık bileşimi.
Malzeme denge denklemleri. Çalışma hattı denklemi.
Dikey olarak monte edilen ve bileşenlerin iki fazının birbirine doğru hareket ettiği H yüksekliğinde bir karşı akım cihazı örneğini kullanarak kütle aktarım aparatındaki malzeme dengesini ele alalım.
Yukarıdan, ikinci bileşen C2H'nin başlangıç konsantrasyonuna sahip m2H kg/s sıvı cihaza girer ve nihai C2K konsantrasyonuna sahip m2H kg/s sıvı alttan çıkarılır. Aşağıdan, ilk bileşen C1H'nin başlangıç konsantrasyonuna sahip m1H kg/s gaz girer ve nihai C1K konsantrasyonuna sahip m1K kg/s gaz yukarıdan çıkarılır.
Durağan koşullarda kayıpları ihmal ederek, malzeme denklikleri denklemlerini yazabiliriz:
m2H + m1H = m2K + m1K;
m 2H C 2H + m 1H C 1H = m 2K C 2K + m 1K C 1K .
m 2 C 2 + m 1H C 1H = m 2K C 2K + m 1 C 1.
Son denklem, sürecin çalışma çizgisinin denklemi olarak adlandırılır. Aparatın tüm bölümlerinde istenen bileşenin konsantrasyonları arasında bir ilişki kurar. Bu, eğimli bir doğrunun denklemidir.
m2 / m1
Çalışma çizgisi denklemi düz bir AB çizgisi olarak gösterilmiştir ve gaz halinden sıvıya ve sıvıdan gaza geçiş süreçleri için denge çizgileri sırasıyla 0 (E) G - F ve 0 (E) F'dir. - G. Çalışma ve denge çizgilerinin bağıl konumuna göre maddenin geçiş yönüne karar verilebilir. Çalışma çizgisi denge çizgisinin üzerindeyse, gazdaki ilk bileşenin konsantrasyonu denge olandan daha yüksektir ve sıvıda denge olandan daha düşüktür, yani. C 11> (C 11 *) g - f; 21'den< (С 21 *) г _ ж.
Bu durumda bileşen gaz fazından sıvıya geçecektir.
Kütle aktarım katsayısı. Kütle aktarımı sürecindeki itici güç, akışın merkezindeki ve AC'nin faz sınırındaki konsantrasyonlardaki farktır ve sistemin reaksiyonu, aktarılan maddenin kütle akışıdır. Fenomenolojik bağımlılıktaki ilişkileri şu şekilde temsil edilir:
DM = ? C.
Neresi? - devamlı.
Cihazları bir sabitten hesaplarken? cihazın kendisini karakterize eden bir faktör tahsis edin. Bu, kütle transfer yüzey alanı F'dir. O zaman şunları elde ederiz:
DM=? C? F; ? F=?.
Kalıcı? kütle transfer katsayısı denir. Şeker pancarı üretiminin difüzyon cihazları için
? \u003d 1.5 - 10- 7 ... 8,5 10 - 6 m / s.
Kriter bağımlılıkları.
Difüzyon süreçlerindeki Prandtl kriteri, aparatlarda akış hızları oluşturma süreçlerinde konsantrasyon gevşemesi süreçlerinin bulunmaması nedeniyle ortaya çıkan hız ve konsantrasyon profillerindeki farkı karakterize eder. 5 gecikme oldukça önemli olabilir. Spesifik tipte kriterl kütle transferi denklemleri (örnek olarak verilmiştir):
Nu D \u003d 3.8- 10 -4 Re l, 38 Pr D
bitki materyallerinin parçacıklarından kütle transfer katsayısını hesaplamak;
0,0066 Yeniden Pr 0,5
Re W = 4...80'de film sulanan bir kolondaki kütle transfer katsayısını hesaplamak için.
TRANSFER ÜNİTE SAYISI
Birinci fazın ekstrakte edilebilir bileşenini ikinciye aktarma işlemini düşünün.fazlar, C konsantrasyonunda indeksin ilk basamağı ile gösterilir. A noktasına karşılık gelen aparatın girişinde, maddenin konsantrasyonu ilk aşama C 1n'dir.
Grafikte, C 1 =f(C 2) denklemi olan AB doğrusu sürecin çalışma doğrusudur. Prosesin çalışma çizgisi, aparatın herhangi bir bölümünde prosesi hesaplamak için kullanılan bileşenin konsantrasyonları arasında bir ilişki kurar.
Eğri C 1 \u003d f (C 2) bir denge çizgisidir, ilk aşamadaki herhangi bir bileşenin (örneğin, gaz fazındaki alkol) her bir konsantrasyonunun denge durumu, aynı bileşenin kesin olarak tanımlanmış bir konsantrasyonuna karşılık gelir. 2. faz (örneğin, ikinci sıvı fazdaki alkol). Her sıcaklık ve basıncın kendi denge eğrisi vardır.
Cihaza giren ilk fazın, gerileyen 2. faz ile ilk aşamada dengeye geldiğini varsayarsak, o zaman birinci fazın konsantrasyonu C 12'ye eşit olacaktır.
vb.................
Akış hızı, bir maddenin bir fazdan diğerine transfer hızı ile belirlenen teknolojik işlemlere kütle transferi denir, ve bu işlemlerin gerçekleştiği aygıtlar, toplu değişim aygıtlarıdır. .
Kimyasal ve teknolojik süreçler arasında kütle transfer süreçleri özel bir yere sahiptir.
Kimya endüstrisinin çoğu üretim tesisinde, kütle transferi ve reaksiyon aparatları aşağıdaki şemaya göre bağlanmıştır.
(Şek. 4.1).
Pirinç. 4.1. Bir kütle transfer aparatı ile teknolojik sürecin şeması
Hammadde, kısmen reaksiyon ürünlerine dönüştürüldüğü reaktöre girer, çünkü kimyasal reaksiyonlar Hedef ürünleri elde etmek için sonuna kadar ilerlemeyin. Reaksiyona katılmayan reaktörden çıkan reaksiyon ürünleri ve hammaddelerin karışımı, kütle transfer ayırma ekipmanına gönderilir. Ekipmanda karışım, reaksiyon ürünlerine ve reaksiyona girmemiş ham maddelere ayrılır, bunlar reaktöre geri gönderilir ve reaksiyon ürünleri daha sonraki işlemler için beslenir.
Reaksiyon ve ayırma aparatları arasında yakın bir teknolojik bağlantı olduğu sonucu çıkar. Bu bağlantının yasası: reaksiyon aparatı üzerindeki yük ne kadar düşükse, yani. besleme stoğunun reaksiyon ürünlerine dönüşümü ne kadar düşükse, ayırma aparatı üzerindeki yük o kadar büyüktür ve bunun tersi de geçerlidir.
Reaksiyon ve ayırma aparatı üzerindeki yüklerin optimal kombinasyonu, minimum üretim maliyetlerini garanti eder. Bu nedenle, kimyasal üretimin temeli - reaktör - sadece optimal olarak çalışan bir ayırma aparatı ile birlikte optimal olarak çalışır. Bu bağlamda, kimya endüstrisindeki kütle değişim aparatının çalışması, reaktörün çalışmasından daha az önemli değildir.
Ayırma aparatında çeşitli işlemler gerçekleştirilebilir. Bunlardan başlıcaları ve en önemlileri absorpsiyon, rektifikasyon, ekstraksiyon, kristalizasyon, adsorpsiyon, kurutma, iyon değişim süreçleri ve membran ayırma.
absorpsiyon gazların veya buharların sıvı emiciler - adsorbanlar tarafından seçici olarak emilmesine dayanan bir ayırma işlemidir. Bu işlem, bir gaz karışımından herhangi bir maddeyi veya madde kompleksini çıkarmanın gerekli olduğu birçok endüstride kullanılmaktadır. Absorpsiyon işlemi sırasında Bir maddenin veya madde grubunun gaz (buhar) fazından sıvı hale geçişi desorpsiyon.
düzeltme sıvıların karışımını ayırma işlemine denir. çeşitli sıcaklıklar uygun basınçta kaynama, buhar ve sıvı akışlarının karşı akım hareketinin bir sonucu olarak saf veya zenginleştirilmiş bileşenlere dönüşür. süreç vardır büyük önem sıvı homojen karışımların saf bileşenlere veya bunların gruplarına kısmen veya tamamen ayrılmasını gerektiren endüstrilerde. Düzeltme işlemi sırasında, bir maddenin veya madde grubunun sıvı fazdan buhar fazına geçişi veya tersi.
çıkarma Bir sıvıda çözünmüş bir madde veya madde grubunun, birinciyle karışmayan veya kısmen karışan başka bir sıvı ile ekstraksiyonuna dayanan ayırma işlemine ayırma işlemi denir. İşlem, bir çözünen veya bir grup maddenin bir çözeltiden çıkarılması gerektiğinde kullanılır. Bu süreçte var bir maddenin bir sıvı fazdan başka bir sıvı faza geçişi.
adsorpsiyon sıvılarda çözünmüş gazların, buharların veya maddelerin katı gözenekli bir emici tarafından seçici olarak emilmesine dayanan bir ayırma işlemidir - karışımlarından bir veya daha fazla maddeyi emebilen bir adsorban . Proses, bir gaz, buhar veya çözünmüş madde karışımından bir veya başka bir maddenin çıkarılmasının gerekli olduğu endüstrilerde kullanılır. bu süreçte maddeler gaz veya sıvı fazdan katı hale geçer. Ters işlem denir desorpsiyon.
iyon değişim süreci bazılarının yeteneğine dayalı olarak bir çözeltiden bir madde çıkarma işlemidir. katılar(iyon değiştiriciler) hareketli iyonlarını çıkarılan maddenin iyonlarıyla değiştirmek için. İşlem, çözeltilerden maddeleri çıkarmak için kullanılır. , düşük konsantrasyona sahip. bu süreçte maddeler sıvı halden katı hale geçer.
kurutma katı ıslak malzemelerden nemin buharlaştırılarak uzaklaştırılması işlemi olarak adlandırılır. İşlem, ıslak doğal maddelerin işlenmeden önce kurutulması gereken veya üretimin son aşamasında bitmiş maddeler olan endüstriler için gereklidir. Bu süreçte var nemin katı ıslak malzemeden buhar veya gaz fazına geçişi.
kristalizasyon Katı faz (kristaller) formundaki bir maddenin sıvı fazdan ayrılmasına dayanan ayırma işlemi olarak adlandırılır. İşlem, yüksek saflıkta maddelerin elde edilmesinin gerekli olduğu durumlarda gerçekleşir. Bu süreçte var bir maddenin sıvı fazdan katı faza geçişi. Ters işlem - çözülme.
Membran ayırma bazı ince filmlerin (yarı geçirgen zarlar) bazı maddeleri geçirme ve diğerlerini tutma yeteneğine dayanır. bu süreçte maddeler orijinal sıvı veya gazdan yarı geçirgen bir zardan geçer zarın arkasındaki sıvı veya gaz fazına geçer.
Akış hızı, bir maddenin (kütlenin) bir fazdan diğerine transfer hızı ile belirlenen teknolojik işlemlere kütle transferi denir ve bu işlemleri gerçekleştirmek için aparata kütle transfer aparatı denir.
Kütle transfer süreçlerinin sınıflandırılması
Gıda teknolojisinde, esas olarak aşağıdaki kütle aktarım süreçleri kullanılır: gaz (buhar) ile sıvı, gaz ve katı arasında ve ayrıca iki sıvı faz arasında.
düzeltme- Farklı uçuculuktaki bileşenlerden oluşan bir sıvı karışımın, buhar ve sıvı akışlarının karşı akım etkileşimi sonucunda saf veya zenginleştirilmiş bileşenlere ayrılması. Rektifikasyon, etil alkol üretiminde ve uçucu yağların ayrıştırılmasında kullanılır. Damıtma ve arıtma sırasında bazı maddeler sıvıdan buhara, bazıları ise buhardan sıvıya geçer.
absorpsiyon- sıvı emiciler - emiciler tarafından gazların veya buharların seçici olarak emilmesi.
Proses, karbonatlı sular, bira ve bazı şarap çeşitlerinin üretiminde, üzüm şırası ve meyve suyunun sülfatlanmasında fermantasyonu önlemek için, pancar suyunun çözünmeyen kalsiyum karbonat oluşumu ile doymasında kullanılmaktadır.
adsorpsiyon- katı bir emici - adsorbanın yüzeyi tarafından sıvılarda çözünen gazların, buharların veya maddelerin seçici olarak emilmesi.
Proses, şarabın berraklaştırılması, boyalardan ve diğer safsızlıklardan su-alkol çözeltilerinin saflaştırılması, şeker üretiminde meyve sularının ve şurupların renklerinin giderilmesi için kullanılır.
Ters işlem - desorpsiyon- adsorpsiyondan sonra gerçekleştirilir ve genellikle absorbe edilen maddeyi absorbe ediciden yeniden oluşturmak için kullanılır.
Kurutma- buharlaşma yoluyla ıslak malzemelerden nemin uzaklaştırılması. Bu işlem, nemli doğal maddelerin işlenmeden önce kurutulması veya bitmiş ürünün kurutulması gereken gıda endüstrisinin tüm dallarında kullanılır. Kurutma işlemi sırasında nem, buhar veya gaza dönüştürülür.
kristalizasyon- katı fazı kristaller şeklinde çözeltilerden veya eriyiklerden ayırma işlemi.
İşlem, şeker ve kristalli glikoz, sitrik asit, sodyum glukanat üretiminde kullanılır. Kristalleşme sürecinde, madde kristalin yüzeyine hareket eder ve kristalden geçişi sıvı hal kristal haline gelir. Ters işlem - katı bir kristal fazın bir çözeltiye geçişine çözünme denir.
Temel konseptler
Bir maddenin (veya birkaç maddenin) sınırları boyunca bir fazdan diğerine denge sağlama yönünde geçişine denir. kütle Transferi, veya kütle Transferi.
Bir maddenin bir fazdan faz sınırına veya ters yön, yani bir aşamada, denir kütle Transferi.
Çoğu durumda, kütle transferinde üç madde yer alır: birinci fazı oluşturan bir dağıtıcı madde (veya maddeler); ikinci fazı oluşturan bir dağıtıcı madde (veya maddeler); bir fazdan diğerine geçen dağıtılabilir madde (veya maddeler).
İlk aşamayı arayalım G (Gaz fazı) , ikinci L (sıvı faz) ve dağıtılan madde M. Düşünülen tüm kütle aktarım süreçleri tersine çevrilebilir olduğundan, dağıtılan madde fazdan geçebilir. G içinde L ve bunun tersi, bu maddenin dağıtım aşamalarındaki konsantrasyonuna bağlı olarak.
Dağıtılacak maddenin başlangıçta sadece fazda olduğunu varsayalım. G ve konsantrasyona sahiptir. fazda L
ilk anda dağıtılmış madde yoktur ve bu nedenle bu fazdaki konsantrasyonu 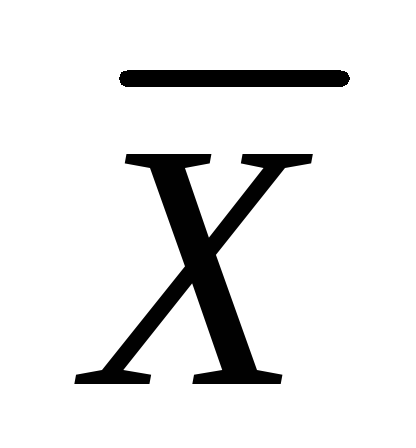 = 0.
= 0.
Dağıtıcı fazlar temas ettirilirse, dağıtılan maddenin fazdan transferi G fazda L ve ikincisinde dağıtılan maddenin belirli bir konsantrasyonu bulunacaktır. 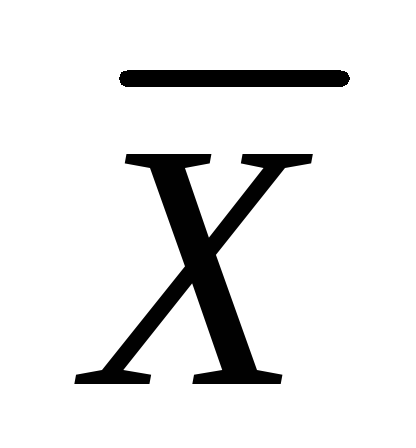 > 0. Maddenin ortaya çıkışından beri M fazda L başlar ve faza ters geçişi G, ancak belirli bir ana kadar parçacıkların sayısı M, fazdan temas yüzeyinin biriminden birim zaman başına geçen G fazda L fazdan geçen parçacık sayısından daha fazla L içinde G; sürecin nihai sonucu geçiştir M faz dışı G fazda L.
> 0. Maddenin ortaya çıkışından beri M fazda L başlar ve faza ters geçişi G, ancak belirli bir ana kadar parçacıkların sayısı M, fazdan temas yüzeyinin biriminden birim zaman başına geçen G fazda L fazdan geçen parçacık sayısından daha fazla L içinde G; sürecin nihai sonucu geçiştir M faz dışı G fazda L.
Belirli bir süre sonra dağıtılan maddenin fazdan geçiş hızı G fazda L ve tam tersi aynı hale gelir. Böyle bir duruma denir denge . Denge durumunda, her özel durumda, sistemin dengesi olarak adlandırılan dağıtılmış maddenin konsantrasyonları arasında kesin olarak tanımlanmış bir ilişki vardır. dengeli . Denge konsantrasyonları, bir sürecin akış hızını belirlemek için çok önemlidir.
Sayfa 1
Kütle transfer süreçleri, akışların etkileşiminden - süreçlerin stokastik doğasından - önemli ölçüde değişen bir serbest faz arayüzü ile karakterize edilir. Stokastik bileşenin hesaba katılması, aparatın geometrik parametrelerini etkileyen temas bölgesinin uzunluğu boyunca bileşen konsantrasyonlarının dağılımını belirlemeyi mümkün kılar.
İki fazlı gaz-sıvı sistemlerinde kütle transfer işlemleri petrol ve gaz endüstrisinde yaygın olarak kullanılmaktadır. Bu tür işlemler, yağ ve kondensatın ayrılması ve stabilizasyonu, absorpsiyon gazı arıtımı ve glikollerin rejenerasyonudur. Sabit Modeller bu süreçlerin basitleştirilmiş bir versiyonu bu paragrafta tartışılan tek bir kavram şemasına göre inşa edilmiştir.
Kütle transfer süreçleri (düzeltme, absorpsiyon, ekstraksiyon vb.) en enerji ve metal yoğun işlemler arasındadır: enerjinin %50'sinden fazlası bunların uygulanmasına harcanır, teknolojik hat ekipmanının toplam kütlesinin yaklaşık %15'i harcanır. kolon aparatı.
Kütle aktarım işlemleri, kural olarak, tesisatların iletişiminde bu cihazların dışında gerçekleştirilir ve kendiliğinden ilerler ve bunların verimliliği, emülsiyon hareketinin rastgele parametreleri tarafından belirlenir. Bu koşullar altında, arka thiottymtt olmayan brongttymum kabukları olan önemli sayıda damlacık, çökeltme aparatına girerek, çalışmasının verimliliğini arttırır.
Kütle transfer süreçleri - bir maddenin bir faz içinde veya fazlar arasında, konsantrasyonlarının bir gradyanı nedeniyle transferi olan ve değişmeden ilerleyen çözünme, kristalizasyon, kurutma, damıtma, düzeltme, absorpsiyon, ekstraksiyon, desorpsiyon kimyasal bileşim. Bunu yapmak için servis yapın: kristalleştiriciler, kurutucular, damıtıcılar, doğrultucular, emiciler, çıkarıcılar, emiciler.
Maddelerin saflaştırılması ve karışımların ayrılması için yaygın olarak kullanılan kütle transfer işlemleri çok çeşitlidir. Onlar farklı toplama durumu etkileşimli fazlar, aparattaki hareketlerinin doğası, paralel ısı transfer işlemlerinin varlığı. Pratikte kullanılan çok çeşitli kütle transfer cihazlarının nedeni budur. Bir dereceye kadar, hesaplama yöntemleri de farklıdır. Bu bölümde en yaygın kütle transfer süreçleri tartışılmaktadır: karşı akım kolonlarında absorpsiyon, desorpsiyon ve sıvı ekstraksiyonu, ikili ve çok bileşenli sistemlerin sürekli damıtılması, periyodik adsorpsiyon ve sabit bir sorbent yataklı aparat.
Kütle transfer süreçleri, difüzyon sonucunda bir maddenin bir fazdan diğerine geçişi ile ilişkilidir.
Kütle aktarım süreçleri genellikle mekanik ve hidromekanik süreçlerle birleştirilir. Örneğin, katı ürünlerin tam veya kısmi fraksiyonel çözünmesi, kırma ile birleştirilir. Böyle bir kombinasyon, çözünme sürecini önemli ölçüde hızlandırır ve fraksiyonel çözünme durumunda, hedef bileşenlerin hammaddeden ekstraksiyon derecesini önemli ölçüde artırmayı mümkün kılar.
Kütle aktarım işlemleri, kural olarak, tesisatların iletişiminde bu cihazların dışında gerçekleştirilir ve kendiliğinden ilerler ve bunların verimliliği, emülsiyon hareketinin rastgele parametreleri tarafından belirlenir. Bu koşullar altında, tahrip edilmemiş zırh mermilerine sahip önemli sayıda damlacık, yerleştirme ekipmanına girerek verimliliğini azaltır. Damla oluşturucunun kütle değişim bölümü, belirli bir damlacıkların varlığını sağlayan koşullar altında, oluşum su kürecikleri ile bir emülsifiye edici madde (0 999 veya daha fazla olasılıkla) içeren su damlacıkları arasında etkili kütle aktarımı gerçekleştirmek üzere tasarlanmıştır. akışta boyut.
Rusya Federasyonu Eğitim ve Bilim Bakanlığı
Durum Eğitim kurumu daha yüksek
mesleki Eğitim
"Volgograd Eyaleti Teknik Üniversite»
ÖLÇEK
disipline göre: Süreçler ve cihazlar
Öğrenci Abramov Sergey İvanoviç
Grup EZK-379k
Çalışmayı kontrol ettim ________________________________
Volgograd 2012
Soru numarası 1 Genel özellikler ve sınıflandırma kütle transfer süreçleri
Soru No. 30 Sıvı ve gazın devridaimi ile absorpsiyon şeması
bibliyografya
1.Kütle transfer işlemlerinin genel özellikleri ve sınıflandırılması Kütle aktarım süreçleri, maddenin bir fazdan diğerine aktarılmasının ana rolü oynadığı süreçlerdir. Bu süreçlerin itici gücü farktır. kimyasal potansiyeller. Diğer tüm işlemlerde olduğu gibi, itici güç kütle transferi, sistemin dinamik denge durumundan sapma derecesini karakterize eder. Bu aşamada madde, konsantrasyonu daha yüksek olan bir noktadan daha düşük olan bir noktaya aktarılır. Bu nedenle, mühendislik hesaplamalarında, itici güç genellikle yaklaşık olarak konsantrasyon farkı cinsinden ifade edilir ve bu da kütle transfer işlemlerinin hesaplamalarını büyük ölçüde basitleştirir. Kütle transfer süreçleri endüstride yaygın olarak kullanılmaktadır: sıvı ve gaz homojen karışımların ayrılması için, onları konsantre etmek çevreyi korumak doğal çevre(öncelikle temizlik için atıksu ve kapalı gazlar). sınıflandırma ve Genel özellikleri. En yaygın olanları aşağıdaki kütle transfer süreçleridir: absorpsiyon Damıtma ve düzeltme Ekstraksiyon (sıvı) adsorpsiyon İyon değişimi Katılardan çözünme ve ekstraksiyon kristalizasyon Membran süreçleri Yukarıda sıralanan tüm süreçlerde ortak olan, bir maddenin (veya maddelerin) bir fazdan diğerine geçişidir. Bir maddenin (veya birkaç maddenin) dengeyi sağlama yönünde bir fazdan diğerine geçiş sürecine kütle transferi denir. Maddenin faz içinde - fazdan faz sınırına veya tam tersi - arayüzden faza transferine kütle transferi denir (faz içindeki ısı transferi - ısı transferi sürecine benzer şekilde). Kütle transfer süreçleri genellikle tersine çevrilebilir. Ayrıca, bir maddenin geçiş yönü, maddenin fazlar içindeki konsantrasyonları ve denge koşulları tarafından belirlenir. Kütle aktarım süreçlerinin ana kinetik denklemi, kimyasal ve teknolojik süreçlerin genel kinetik yasalarına dayanan kütle aktarım denklemidir. İşlem hızı [kg/(m2 cinsinden) c)] itici güce eşittir Δ, R direncine bölünür: dM/dF = Δ/ R, burada dM birim zamanda bir fazdan diğerine geçen madde miktarıdır; dF - faz temas yüzeyi. 1/R = K'yi ifade ederek, temel kütle transfer denklemini elde ederiz dM =K Δ dF K katsayısı - kütle transfer katsayısı (ısı transfer sürecine benzer şekilde), bir maddenin bir fazdan diğerine aktarılması sürecinin hızını karakterize eder. Kütle aktarım katsayısının boyutu: [K]= = [kg/sn Δ· m2] yani, kütle transfer katsayısı K, birliğe eşit bir itici kuvvetle, faz temas yüzeyinin bir biriminden birim zamanda fazdan faza dağıtılan maddenin ne kadarının geçtiğini gösterir. İtici gücün boyutu Δ farklı olabilir ve K'nin boyutu buna bağlıdır. Genellikle, kütle transfer denklemi, faz temas yüzeyi F'yi ve bu yüzeye dayalı olarak kütle transfer aparatının boyutlarını belirlemek için kullanılır. M / (K Δ)
Kütle transferi süreçleri şu şekilde ayrılır: serbest faz sınırına sahip sistemlerde kütle transferi (gaz-sıvı, buhar-sıvı, sıvı-sıvı); sabit faz temas yüzeyi olan sistemlerde kütle transferi (gaz - katı, buhar - katı, sıvı - katı sistemler); yarı geçirgen bölmeler (zarlar) yoluyla kütle transferi. Serbest faz sınırı ile karakterize edilen işlemler, teknolojide absorpsiyon, desorpsiyon, damıtma ve doğrultma ve sıvı ekstraksiyonu gibi yaygın olarak kullanılan işlemleri içerir. Bu işlemlerde, faz temas sınırı genellikle hareketlidir, faz temas yüzeyinin boyutu hidrodinamik duruma bağlıdır, bu da serbest faz sınırına sahip sistemlerdeki kütle aktarım mekanizmasını katı fazlı sistemler için aktarım mekanizmasından önemli ölçüde ayıran hidrodinamik duruma bağlıdır. Serbest faz sınırı olan kütle transfer işlemleri, fazların kütle transferine katılımı ilkesine göre iki gruba ayrılır. I grubu - en az 3 maddenin katıldığı işlemler: 1) 1. faz Fu'yu oluşturan bir dağıtıcı madde (veya maddeler) (örneğin, amonyak bir amonyak-hava karışımından su tarafından emildiğinde, hava doğrudan katılmaz. kütle transferinde); 2) 2. faz Fx'i (içindeki su) oluşturan bir dağıtıcı ajan (veya maddeler) bu örnek); 3) bir fazdan diğerine geçen dağıtılmış M maddesi (absorpsiyon, desorpsiyon, ekstraksiyon işlemleri). I grup prosesler (damıtma ve rektifikasyon), fazları oluşturan maddelerin kütle transfer proseslerine katıldığı ve dağıtılan maddenin taşıyıcısı olarak kabul edilemeyeceği proseslerdir. Sürecin yönü, itici gücü, çalışma ve denge konsantrasyonlarının oranına bağlıdır. Kütle transfer süreçlerine katılan fazların konsantrasyonları farklı boyutlara sahip olabilir (kg/kg, kmol/m3 vb.). Genellikle fazların bileşimi, kütle veya mol fraksiyonları, bağıl veya hacim konsantrasyonları olarak ifade edilir. No. Konsantrasyon Bileşen konsantrasyonunun tanımı Gaz (buhar) fazındaki sıvı fazda ), kg А/kg ВХУ5Hacim molar konsantrasyonu, kmol А/m3 (А+В)СхСу6Hacim kütle konsantrasyonu, kg А/m3 (А +В)СхСу Dengedeki fazların bileşimi arasındaki ilişki: y* = f(x) burada y*, gaz (buhar) fazındaki hedef bileşenin denge göreli mol kesridir Bu bağımlılığın grafiği denge çizgisidir. y* = mr x, burada mr = y*/x dağılım katsayısıdır Dağılım katsayısı, dengedeki fazların bileşimlerinin oranıdır. Dağılım katsayısı -tg α- denge çizgisinin eğimi tana=m R Kütle aktarım işlemlerinin malzeme denklikleri, gerçekleştirilme biçimlerine bağlıdır. Fazların tek, sürekli ve adım etkileşimini ayırt eder. Sürekli kütle transfer aparatlarında, proses sürekli faz teması ile (örneğin, esasen bir boru-boru ısı değiştiricisi olan film tipi absorpsiyon aparatlarında, bir sıvı filminin aktığı boruların iç yüzeyleri boyunca gerçekleşebilir). ve gaz bu sıvıya doğru hareket eder). Bu durumda, fazlar içinde dağıtılan maddenin konsantrasyonları monoton olarak değişir. Şekil 1. Karşı akış (a) ve ileri akış (b) koşullarında fazların sürekli teması ile malzeme dengesinin hazırlanması üzerine Teknolojide en sık kullanılan sürekli bir karşı akım ile (Şekil 1, a), sonsuz küçük bir yola sahip aparatın keyfi bir bölümü için malzeme dengesi aşağıdaki ilişkilerle ifade edilir: un> uk - gaz fazındaki bileşenin mol kesri хк> хн - sıvı fazdaki bileşenin mol kesri M g \u003d G (un- uk) - gaz fazından geçen bileşenin molar akış hızı M W = L(xk-xn) - sıvı faza geçen bileşenin molar akış hızı. Aynı bileşen gaz fazından sıvıya geçtiğinden, M g \u003d M f (un-uk) = L(xk-xn) (7.8) Hedef bileşenin mevcut bileşimlerinin X ve Y olduğu aparatın keyfi bir bölümü için, aparatın üst kısmı için malzeme dengesi denklemi: (un-y) = L(xk-x) Aparatın yüksekliği boyunca G ve L değerlerinde küçük bir değişiklik ile Oran, sürekli bir karşı akım kütle transfer sürecinin çalışma çizgisinin denklemi (çalışma konsantrasyonları çizgisinin denklemi) olarak adlandırılır. Aparatın keyfi bir bölümünde etkileşen fazların bileşimleri arasındaki ilişkiyi ifade eder. L/G = sabit ile çalışma hattı düz. L/G ≠ sabit ise, çalışma çizgisi düz bir çizgiden sapar. Akışta iki tür kütle transferi vardır - moleküler ve konvektif. Moleküler difüzyon, sabit bir ortamda dağıtılmış bir maddenin iç katmanlar bu (birinci) fazın arayüze ve onu geçtikten sonra, ilk ile temas halinde olan diğer fazın tüm hacmine dağılımı. İç sürtünme kuvvetleri tarafından direnen moleküllerin (iyonlar, atomlar) termal hareketinin bir sonucudur. Moleküler difüzyon, Fick'in birinci yasası ile tanımlanır: dM= -DdFd τ ds /dp Tüm difüzyon yüzeyi F için, Fick'in birinci yasası şu şekilde ifade edilir: M = -D Fτ ds /dp burada D moleküler difüzyon katsayısıdır; F - difüzyon yönüne dik yüzey; ds/dp, yayılan maddenin yolunun n birim uzunluğu başına maddenin konsantrasyon gradyanıdır; eksi işareti, difüzyon yolunun uzunluğu boyunca ds/dp konsantrasyon gradyanında bir azalma ile ilişkilidir. Moleküler difüzyon katsayısı D, yayılan maddenin doğasına bağlıdır. Bu nedenle, sürecin dinamikleri ile ilgili değildir ve bir maddenin herhangi bir ortama nüfuz etme yeteneğini karakterize eder. [D]= [m2/s] ifadesinden boyutunu bulalım, buradan moleküler difüzyon katsayısı D'nin, bire eşit konsantrasyon gradyanında birim yüzey boyunca birim zamanda ne kadar maddenin yayıldığını gösterdiği çıkar. Moleküler difüzyon katsayısı D, termal difüzyona benzerdir. α.
D değerleri referans kitaplarında bulunur veya hesaplanır. Difüzyon katsayısı sıcaklığa (artan sıcaklıkla artar) ve gazlar için - basınca (artan basınçla, D g azalır) bağlıdır. Gaz ortamı D g ≈ 1 cm2/s için, yoğunlaştırılmış (sıvı) ortam için h ≈ 1 s/gün, buradan sıvılarda moleküler difüzyonu takip eder ve hatta dahası katılar- süreç çok yavaş. Konvektif transfer (konvektif difüzyon), türbülanslı faz hareketi koşulları altında akışın parçacıklarını hareket ettirerek maddenin hareketi (transferi) ile karakterize edilir. Türbülanslı titreşimlerin etkisi altında maddenin konvektif aktarımına bazen türbülanslı difüzyon denir. Konvektif kütle transferi, bir sıvı veya gazın hareketi sırasında bir maddenin transfer edilmesi işlemidir. Bu işlem, mekanik olarak - sıvı veya gaz akışının makro hacimli parçacıkları gibi gerçekleşir. Kütle transferi ve konveksiyon, doğal ve zorlamalı veya zorlamalı olarak ayrılır. Doğal kütle transferi ile sıvının hareketi, yoğunluk farkı nedeniyle meydana gelir. farklı noktalar sıvı ve zorlandığında - bir pompa, karıştırıcı vb. kullanarak akışın dışarıdan hareketi için enerji harcaması nedeniyle. Doğal kütle transferinin yavaş bir süreç olduğu ve teknolojide nadir olduğu açıktır, ancak çoğu zaman zorunlu kütle transferinin eşlik ettiği bir süreçtir. Newton'un ampirik soğutma yasasına (veya ısı transfer denklemine) benzer şekilde, kütle transfer denklemi aşağıdaki forma sahiptir: M = β (хgr - x) dFdτ burada β, orantılılık-kütle transfer katsayısının katsayısıdır. τ = 1 s'de kütle transferinin tüm yüzeyi F için sabit bir süreçle, denklem M = β F (хgr-x) şeklini alır. Fu fazı için, kütle transfer denklemi M = β F (хgr-х) denklemine benzer olacaktır, ancak buna karşılık gelen konsantrasyonların yer değiştirmesi olacaktır. Kütle aktarım katsayısının boyutu: [β] = [M / F (y-ugl)] = [m / s]. Kütle transfer katsayısı, kütle transfer katsayısının aksine, konveksiyon ve faz içindeki maddenin transfer hızını karakterize eder. moleküler difüzyon eşzamanlı. 2. Sıvı ve gazın devridaimi ile absorpsiyon şeması Gazların absorpsiyonu (lat. Absorbtio, absorpsiyondan absorpsiyon), gazların ve buharların hacimsel absorpsiyonu<#"30" src="doc_zip3.jpg" />
nerede Р2 - basınç<#"34" src="doc_zip4.jpg" />
burada KH, sıcaklıkla değişen Henry katsayısıdır. Absorpsiyon basınç altında, ancak x * 2 -> 0 altında gerçekleştirilirse, gaz çözünürlüğü Krichevsky - Kazarnovsky denklemi kullanılarak hesaplanabilir: nerede Kf - katsayısı. fiziksel çözünürlük, x2 -> 0 ve P -> -> 0'da KH'ye eşit; f*2 - gaz uçuculuğu; - sonsuz seyreltmede sıvı fazda çözünmüş gazın kısmi molar hacmi; R, evrensel gaz sabitidir; Po1 basıncı doymuş buharlar <#"20" src="doc_zip7.jpg" />(0.05-0.1) molar fraksiyon (seyreltik çözeltiler), daha sonra düşük basınçlar Sechenov denklemi geçerlidir: burada A1,2-katsayısı, çözeltinin bileşiminden bağımsız, absorpsiyon Pirinç. 1. Bazı gazların çözünürlüğünün x2* bağımlılığı<#"27" src="doc_zip10.jpg" />
gaz absorpsiyonunun çözünmesinin termal etkisi nerede. Çözelti absorpsiyon sırasında ısınırsa, . Sıcaklık değiştikçe, genellikle sabit kalır veya biraz değişir. Bir gazın karışık bir çözücü (düşük polariteli bileşenler içeren) içindeki çözünürlüğü şu bağıntıdan tahmin edilebilir: burada KN.si, KN.N- Henry katsayısı karşılık gelir. bir çözücü karışımı içindeki bir gaz için ve bu gazın saf çözücü bileşenleri içindeki çözeltileri için; - çözücü bileşenlerinin aktivite katsayısı (mol fraksiyonları, çözünmüş gaz içermeyen bir çözücü karışımına atıfta bulunur). Gazların çözünürlüğü hakkında bazı veriler<#"18" src="doc_zip17.jpg" />ve Lennard-Jones absorpsiyon potansiyeli Bu parametreler gazların çözünürlüğünü tahmin etmek için kullanılabilir<#"32" src="doc_zip19.jpg" />
1 m3 absorban başına normal koşullara (20 °C, 0.1 MPa) indirgenmiş 1 m3 gazdaki çözünürlük nerede; kv - Boltzmann sabiti; P0, T0 - sırasıyla basınç<#"31" src="doc_zip21.jpg" /> Gazlar için Lennard-Jones potansiyelinin (K cinsinden) parametrelerinin değerleri aşağıdadır.<#"24" src="doc_zip23.jpg" />ve sıvılar: Gaz çözünmesi AH'nin termal etkisi, artan ile doğrusal olarak değişir; sırasıyla, az çözünür gazların çözünürlüğü<#"21" src="doc_zip27.jpg" />, esas olarak He, Ne, H2, N2, CO, Ar, O2 ve NO, artan sıcaklıkla (sulu çözeltiler hariç) ve yüksek çözünürlüğe sahip gazların çözünürlüğü artar<#"21" src="doc_zip28.jpg" />azalır. Sonsuz seyreltik çözeltiler için tipik örnekler, Şek. 2. H2S, COS, SO2, HC1, NH3, C12 gibi gazların çözünürlüğü, solvent molekülleri ile spesifik etkileşim nedeniyle genellikle denklem (1) ile hesaplanandan çok daha yüksektir. Kimyasal absorpsiyonda, absorbanın absorpsiyon kapasitesi (absorbanın birim hacmi tarafından absorbe edilen gazın sınırlayıcı miktarına tekabül eden kapasite) ve fiziksel absorpsiyondan daha fazla Geri dönüşü olmayan bir reaksiyonda (örneğin, CO2 NaOH tarafından absorbe edildiğinde) Na2C03 oluşumu ile çözeltiler, çözeltide reaksiyona girmemiş emici olduğu sürece çözelti üzerindeki gazın denge basıncı sıfırdır ve emme kapasitesi reaksiyonun stokiyometrisi ile belirlenir. Tersinir bir reaksiyonla, basınç<#"30" src="doc_zip30.jpg" /> kütle transfer işlemi absorpsiyon sıvı gaz burada Kx = ASKfKP gaz-sıvı sisteminin denge sabitidir; Kp, reaksiyonun denge sabitidir; - emicinin denge dönüşüm derecesi; x1 - emicinin başlangıç konsantrasyonu; h, reaksiyona giren gazın 1 molü başına reaksiyon ürünlerinin mol sayısıdır; j, 1 mol çözünmüş gaz ile etkileşime giren emicinin mol sayısıdır; Stokiyometriye bağlı olarak A5 katsayısı. Absorpsiyon hızlandırma faktörü oldukça büyük olabilir. Bu nedenle, CO2'nin dolu bir kolonda fazlar, sıcaklık ve basınç açısından aynı yüklerde 2 N kullanılarak emilmesi durumunda. sulu bir KOH çözeltisi (karbonat formunda çözeltide% 15 K bulunur), alabilirsiniz fiziksel ile karşılaştırıldığında CO2'nin su tarafından emilmesi. Sıvı transfer direnci ve sonsuz reaktivitesi olmayan varsayımsal ideal bir çözücü, Arttırmak ve (bazen birkaç kez) yerel gradyanların neden olduğu yüzey taşınımının etkisi altında oluşabilir. yüzey gerilimi Bazı durumlarda, özellikle eşzamanlı olarak kütle aktarımı sonucunda ortaya çıkan. reaksiyonların seyri (örneğin, CO2'nin sulu monoetanolamin çözeltileri tarafından emilmesi sırasında). Yeni kimyasal sorbentler seçilirken bu dikkate alınmalıdır. Anlam reaksiyon yüzey taşınımının ortaya çıkmasına neden oluyorsa, bu, faz sınırına yakın konvektif mikro akış sürecine maruz kalma koşulları altında bulunan fiziksel absorpsiyon sırasında kütle transfer katsayısı temelinde belirlenmelidir. Absorpsiyon oranını hesaplarken, genellikle varsayımla belirlenen kütle transfer katsayısını kullanın. yüzey bileşimleri ve dolayısıyla varsayımsal olarak. itici güçler. Genellikle gazdaki konsantrasyona atıfta bulunulan kütle aktarım katsayısının, Kg [kmol / (m2 * MPa * s)] itici kuvvetten (y2-y*2) kaynaklandığı varsayılır, burada y*2, ortalama hacimsel bileşim x2 olan bir sıvı ile dengeye karşılık gelen, gazdaki emilen bileşenin molar fraksiyonu; y2, absorpsiyon aparatının belirli bir bölümündeki gazın ortalama hacimsel bileşimidir. Sonra şunu elde ederiz: Benzer şekilde, itici gücü (x * 2 - x2) ve kütle aktarım katsayısı Kzh'yi bulabilirsiniz. (2) ve (3) ifadelerinden aşağıdaki gibidir: burada m = (y2,gr - y*2)/(x2,gr - x2), x2, y2 ila x2,gr, y2,gr konsantrasyon aralığındaki denge çizgisinin eğimidir. (4) nolu ifade yerel kütle transfer katsayısı için yazılmıştır ve bu katsayının denge doğrusunun eğimine bağlı olduğunu göstermektedir. Denge çizgisinin eğiminin çalışma konsantrasyonu aralığında neredeyse sabit kaldığı durumlarda, denklem (4) kullanılarak kütle transfer katsayısının hesaplanması en uygun yöntemdir. Eğri bir denge çizgisi ile m'nin konsantrasyona bağımlılığını hesaba katmak gerekir. Absorpsiyon, emiciler, plaka şekilli, paketlenmiş (eski adı yıkayıcılar), film, döner film ve sprey olarak adlandırılan kütle transfer cihazlarında gerçekleştirilir. Emicideki malzeme akışlarının şeması, Şek. 3. Aparatın herhangi bir yatay bölümündeki gaz y2 ve sıvı içindeki absorbe edilen bileşenin konsantrasyonları arasındaki ilişki, malzeme denge denkleminden (çalışma çizgisi denklemi olarak adlandırılır) bulunur. Genel olarak, bu denklem şu şekildedir: burada L ve G, sıvı akış hızları ve gaz absorpsiyonudur. Absorpsiyon sırasında faz hacimleri çok az değiştiğinde, çalışma çizgisi düz bir çizgidir: Burada, "n" indeksi, karşı akım soğurucunun veya soğurulan soğurumun alt bölümünü belirtir. Absorpsiyonun termal etkileri, çalışma ve denge [y* = f(x*2)] hatlarının seyri üzerinde önemli bir etkiye sahip olabilir. Çalışma hattının seyri, çözücü buharlaşmasının yoğunluğuna (özellikle desorpsiyon sırasında) büyük ölçüde bağlı olabilir. Absorpsiyona önemli bir ısı salınımı eşlik ediyorsa ve absorbe edilen malzeme miktarı yeterince büyükse, solvent kolondan geçerken çok ısınabilir. Örnekler - konsantre H2SO4 ile havayla kurutma, çözünme<#"416" src="doc_zip42.jpg" /> Pirinç. 3. Soğurucudaki malzeme akışlarının şeması ve çalışma ve denge hatlarının soğuğu (a-ters akışlı, 6-ileri akışlı): AG-çalışma hattı; OS-denge çizgisi; ve - itici güç gaz fazında yukarı ve aşağı. aosoroer'ın kesitleri ve sahnede gaz ve sıvı fazlarında. Harici ısı temini veya uzaklaştırma olmadığında, aynı gaz ve sıvı sıcaklıklarında ve emicinin buharlaşması ve yoğunlaşması ve diğer gazların çözünme ısısı dikkate alınmadan<#"24" src="doc_zip45.jpg" />Cp, çözeltinin ısı kapasitesi olduğunda, söz konusu bölümdeki gaz konsantrasyonundaki değişikliktir. Genellikle ara yüzeydeki ve hacimdeki sıvının sıcaklığının aynı olduğu varsayılır. Çözünmüş gazın en yüksek konsantrasyonu ve buna bağlı olarak en yüksek ısı salınımı, faz temas yüzeyinin yakınında gözlemlendiğinden, gerçek dengeyi belirleyen arayüz yüzeyinin sıcaklığı, genellikle sıvı kütlesinin sıcaklığından önemli ölçüde farklıdır. Bu fenomen için muhasebe yöntemleri geliştirilmektedir. Soğurucudaki gaz bileşiminde istenen değişikliği elde etmek için gereken kütle aktarım yüzeyini F hesaplamak için yerel kütle aktarım hızları kullanılabilir [bkz. ref. denklem (3)1 absorbe edilen bileşen için malzeme dengesi denklemi ile birlikte. Aparatın yüksekliği boyunca sabit bir kütle aktarım katsayısı ile: burada G, gazın molar kütle hızıdır, kmol/(m2*s); R-toplam sayı gaz fazında transfer birimleri: Bu önemli parametre sadece sürecin teknolojik moduna bağlıdır, çalışma ve denge çizgilerinin konumu ile belirlenir ve absorpsiyon itici kuvvetinin nasıl etkilediğini gösterir.<#"21" src="doc_zip50.jpg" />. Artışla, aparatın boyutları azalır, ancak gaz karışımının zayıf çözünür bileşenlerinin enerji tüketimi ve çözünme derecesi artar, bu da ya onların kaybına ve ekstrakte edilen gazın kirlenmesine ya da ayırma için ek maliyetlere yol açar. çözünmüş gazların Soğurucular, özellikle disk soğurucular hesaplanırken, genellikle aşama verimliliği veya dengeye yaklaşma derecesi kavramı kullanılır. Bu değer, bileşimde fiilen gerçekleşen değişikliğin, dengeye ulaşıldığında meydana gelecek olan değişikliğe oranı olarak tanımlanabilir: burada "in" indeksi tepeyi gösterir. karşı akım aparatının emilim bölümü Bu, birçok kademeli kontak cihazında başarılmıştır. Bu, bu tür cihazların malzeme analizinde bir denge aşaması kavramının kullanılmasının meşru olduğu anlamına gelir. Teorik plakaların sayısını hesaplayarak ve aşamanın verimliliğini bilerek, belirli bir ayırma derecesi sağlamak için gereken gerçek aşamaların sayısını belirlemek mümkündür. Absorpsiyon süreçleri teknolojisinin temelleri. Absorpsiyon genellikle bir absorpsiyon-desorpsiyon döngüsü (döngüsel bir süreç) şeklinde gerçekleştirilir, ancak desorpsiyon adımı<#"159" src="doc_zip56.jpg" /> Pirinç. 4. Absorpsiyon-desorpsiyon döngüsünün şematik diyagramı: 1 - emici; 2-pompa; 3-soğurucu; 4 - buzdolabı; 5-ısı eşanjörü; 6-kazan; 7 - kapasitör. Fizik absorpsiyon genellikle bir sıcaklıkta gerçekleştirilir çevre(20-40°C) veya düşük sıcaklıklarda, çünkü yüksek çözünürlüğe sahip gazların çözünürlüğü<#"38" src="doc_zip57.jpg" />
absorpsiyon işleminin hızına bağlı olarak, absorberden gaz çıkışında dengeye yaklaşma derecesi nerededir. Genel olarak: burada G2, özütlenen gaz absorpsiyonunun miktarıdır Tersinir olmayan bir reaksiyonda, minimum dolaşımdaki absorber miktarı aşağıdakilerden belirlenir. stokiyometrik denklem tepkiler ve bulun. Sıvı ve gaz akış hızlarının oranı aşağıdaki denklemle belirlenir: Açık döngü süreçleriyle, genellikle sirkülasyon süreçleriyle - x2, x2'de, p (rejenere çözeltideki gaz konsantrasyonu). En basit durumda (ve için) elimizde: . Çözünürlük Henry yasası ile açıklanıyorsa, bu durumda, dolaşımdaki emicinin miktarı, çıkarılan gazın miktarına bağlı değildir.Soğurma Emicinin çıkışında dengeye ulaşıldığında Önemli bir süreç parametresi sözdedir. absorpsiyon faktörü: tam gaz ekstraksiyonunda 1'dir Bu faktör, gaz fazındaki ekstrakte edilen bileşenin gerçek ve denge konsantrasyonlarının sıvıdaki konsantrasyonuna bağımlılığını ifade eden çalışma ve denge çizgilerinin eğim açılarının oranına eşittir. , sırasıyla. Parametre A, aynı zamanda, çözünebilir gaz absorpsiyonunun tamamen çıkarılması için gereken minimum ile karşılaştırıldığında, dolaşımdaki emici miktarının fazlalığını karakterize eder. Desorpsiyon modu<#"18" src="doc_zip71.jpg" />emicinin çıkışındaki denge durumundan belirlenir (karşı akım ile). Desorpsiyon sırasında aynı çözeltide elde edilebilecek minimum gaz konsantrasyonu<#"30" src="doc_zip73.jpg" />,
nerede Р ve Рpar - toplam basınç<#"20" src="doc_zip74.jpg" />sadece desorberden çözümün çıkışında değil, aynı zamanda herhangi bir bölümünde de denklem (5)'e uygunluk koşulundan bulunur. Gazın jeneratörden çıktığı ters akım aparatının üst kısmı genellikle sınırlayıcıdır. O zaman = G2Ф*, burada Ф* = р*buhar/p2*(t,x2,в) - buhar basıncı oranı<#"28" src="doc_zip76.jpg" />,
çözünmüş gazların basınçlarının toplamı nerede. Desorpsiyon modu<#"29" src="doc_zip78.jpg" />
Desorpsiyon sırasında bir çalışma hattı oluşturma<#"160" src="doc_zip79.jpg" /> Pirinç. 5. Denge (/) ve çalışma (2, 3) e.sorpsiyon çizgileri<#"64" src="doc_zip80.jpg" />
nerede ve termal etkiler emici buharlaşma ve desorpsiyon; - absorpsiyonlu ısı eşanjörünün soğuk ucundaki rejenere ve doymuş çözeltiler arasındaki sıcaklık farkı. desorpsiyon basıncı<#"59" src="doc_zip84.jpg" />
sonra Qrel artan sıcaklıkla artar. Aksi takdirde, Qotd azalır ve belirli bir ısı akış hızında, artan desorpsiyon basıncı ile rejenerasyon kötüleşmez, ancak emicinin termokimyasal stabilitesi ve Qload'daki bir artış tarafından belirlenen belirli bir sınıra kadar iyileşir. Gaz desorpsiyonu için enerji maliyetleri bibliyografya 1. Kafarov V. V., Kütle transferinin temelleri, 3. baskı, M., 1979 2. Rudobashta S.P., Katı fazlı sistemlerde kütle transferi, M., 1980 Sherwood T.K., Pigford R., Wilkie C., Kütle transferi, çev. İngilizceden, M., 1982 Planovsky A.N., Nikolaev P.I., Kimyasal ve petrokimya teknolojisi süreçleri ve aparatları, 3. baskı, M., 1987 Brownshtein B. I., Shchegolev V. V., Hidrodinamik, kolon aparatlarında kütle ve ısı transferi, L., 1988 Ramm V.M., Gazların absorpsiyonu, 2. baskı, M., 1976 Proses gazlarının saflaştırılması, absorpsiyon, editör T.A. Semenova I. L. Laites, 2. baskı, M., 1977 Kafarov V.V. - Kitle Transferinin Temelleri, 3. baskı. M.: Yüksek Lisans, 1979. 439'lar. Sherwood T., Pigford R., Wilkie C., Kütle transferi, çev. İngilizceden., M., 1981. Kasatkin A.G. Kimya teknolojisinin temel süreçleri ve aygıtları. - M: Kimya, 1971 - 832'ler. Ioffe I.L. Kimyasal teknolojinin süreçleri ve aygıtlarının tasarlanması: teknik okullar için bir ders kitabı. - L: Kimya, 1991 - 352'ler. Aleksandrov I.A. Doğrultma ve emme aparatları - M.: Kimya, 1978 - 277s. Dytnersky Yu.I. Kimyasal teknolojinin prosesleri ve aparatları. - M.: Kimya 1995 - 368'ler. Bu çalışmanın hazırlanması için http://www.xumuk.ru/ sitesinden materyaller kullanılmıştır.






