Pikat e shkrirjes dhe të vlimit të ujit janë përkatësisht të barabarta. Nxehtësia latente specifike e shkrirjes së një trupi të ngurtë
1. VETITË DHE STRUKTURA E UJIT
1.1. Anomalitë e vetive të ujit
Vetëm në fund të shekullit të 18-të dhe në fillim të shekullit të 19-të. u bë i vetëdijshëm se çfarë përbën një substancë të quajtur ujë. Eksperimentet e G. Cavendish, A. Lavoisier, A. Humboldt, J.L. Gay-Lussac vërtetoi se uji formohet nga dy vëllime hidrogjeni dhe një vëllim oksigjeni, d.m.th. ka një formulë kimike H 2 O dhe pesha molekulare 18. Megjithatë, gradualisht u bë e qartë se pothuajse në të gjithë parametrat fiziko-kimikë kjo substancë është unike, e ndryshme nga komponimet e tjera natyrore.
Pikat e shkrirjes dhe vlimit të ujit
Ato bazohen në sistemet e pranuara të referencës së temperaturës.
Përzgjedhja e ujit për të krijuar shkallë të temperaturës.
Celsius(1701-44). Shkalla Celsius -1741 Pikat e vlimit dhe shkrirjes së ujit në presioni atmosferik përkatësisht e barabartë me 100 o C dhe 0 o C,
Réaumur(1683-1757). Shkalla Réaumur e 1730. Pika e vlimit të ujit merret si 80 o (1 o C \u003d 5/4 o R).
Fahrenheit(1686-1736). Pika e shkrirjes së akullit merret si 32 o F, pika e vlimit të ujit është 180 o F (t o C \u003d 5/9 t o F - 32).
Zbulimi i ligjit periodikD.I. Mendeleev (1869). Mospërputhja midis parametrave fizikë të ujit dhe ligjit periodik.
Mospërputhja me ligjin periodik mund të shihet nga një krahasim i pikave të vlimit dhe shkrirjes së përbërjeve të hidrogjenit të elementeve të grupit të oksigjenit. Të dhënat për H 2 Se janë marrë nga grafiku. Për ujin, mund të shihet se, nëse ligji periodik do të ishte konsistent, pika e shkrirjes së ujit do të ishte rreth minus 90 o, dhe pika e vlimit do të ishte rreth -70 o. Uji në kushte "normale" do të ishte një gaz toksik, me erë të keqe. Jeta në Tokë do të ishte e pamundur.
Falë këtyre vetive “anormale”, uji mbron jetën dhe rregullon regjimin termik dhe gazor të planetit tonë.
Kapaciteti termik i ujit
Kapaciteti specifik termik i ujit është më i larti nga të gjitha lëngjet. Dhe këtu uji merret si standard: për të ngrohur 1 g ujë me 1 o C për të shpenzuar 1 kalori energji termike (kalori - nxehtësi, lat.). Për krahasim: gips - 0,27, balta e thatë 0,22 kalori. (1 kalori = 4,187 J.). Kapaciteti specifik i nxehtësisë i akullit dhe avullit është gjysma - 0,5 cal/g. gradë. Nxehtësitë latente të shkrirjes dhe avullimit të ujit janë gjithashtu jashtëzakonisht të mëdha - 79 dhe 539 kalori. Kështu, për të kthyer 1 g akull me temperaturë 0 ° C në avull, duhet të shpenzoni 79 + 100 + 539 = 718 kalori nxehtësie. Për shkak të një kapaciteti kaq të lartë të nxehtësisë, uji është rregulluesi kryesor i regjimit termik në planetin tonë. Ndikimi i Oqeanit Botëror prek pothuajse të gjitha pikat e Tokës, madje edhe ato më të largëtat nga bregu i detit, të karakterizuara nga e ashtuquajtura klimë kontinentale. Trupat e mëdhenj të ujit, dhe mbi të gjitha, Oqeani Botëror, janë rregullatorët e regjimit termik të Tokës. Për shtresën e tokës, qarkullimi vjetor i nxehtësisë është 1,5-3 kcal / cm 2, për shembull, Deti Baltik dhe i Zi 48-52. Në mungesë të rezervuarëve, temperatura do të rritej në verë, dhe në dimër do të binte me disa qindra gradë dhe jeta në tokë do të ishtee pamundur; përkundrazi, nëse Toka do të mbulohej plotësisht nga oqeani, amplituda vjetore e ajrit do të ndryshonte nga 0 në ekuator në 5-6 o C në pole. Ndikimi i oqeanit shtrihet në të gjithë planetin, duke përfshirë polet e ftohtë në Antarktidë.
Kapaciteti i lartë i nxehtësisë së ujit shoqërohet me tregues të tillë si nxehtësia latente e shkrirjes, komponenti 333.7 10 3 J/kg, dhe nxehtësia latente e avullimit, komponenti 2258.10 3 J/kg, d.m.th. Duhet një sasi e madhe energjie për të kthyer 1 kg akull në lëng dhe 1 kg ujë të lëngshëm në avull. Kjo dëshmon për intensitetin e lartë energjetik të ujit, i cili paracakton rolin e tij ekskluziv si akumulues energjie në rrjedhën e proceseve natyrore.
Konstanta dielektrike ujë ( )
Vlera konstante dielektrike sepse uji është më i larti nga të gjithë lëngjet dhe është i barabartë me 80,1 në një temperaturë prej 20 o C. në një temperaturë prej rreth 0 o C është rreth 82. Kjo do të thotë se kur kripërat treten në ujë, forca e bashkëveprimit elektrik ndërmjet Grimcat e ngarkuara në mënyrë të kundërt zvogëlohen me 80 herë, duke bërë që kripërat të shpërbëhen në jone. Shumica e tretësve nuk kanë më shumë se 50, lëngjet jopolare (benzina, vajguri) jo më shumë se 3. Kjo veti e ujit paracakton fenomenin disociimi elektrolitik, d.m.th. aftësia e kripërave, acideve, alkaleve për t'u zbërthyer në tretësirat ujore në jone të ngarkuar në mënyrë të kundërt. Uji është inert si tretës. Ai sjell lëndë ushqyese për organizmat e gjallë dhe largon toksinat dhe nuk ka asgjë për ta zëvendësuar atë. Se. dhe pa këtë veti të ujit jeta në tokë do të ishtee pamundur.
Uji shpërndan mineralet, por ato rilindin nëse uji avullohet. Kjo veçori ka një rëndësi kolosale gjeologjike dhe biologjike, duke paracaktuar cikle ujore të rendeve të ndryshme, të cilat zhvillohen në pak orë (në organizmat e gjallë) dhe zgjasin për shumë miliona vjet në zorrët e Tokës (gjeologjike). Me sa duket, shfaqja e jetës në Tokë është kryesisht për shkak të kësaj vetie mahnitëse të ujit.
Dendësia e ujit .
Të gjitha substancat kanë një densitet maksimal në pikën e shkrirjes së tyre, përveç ujit. Dendësia maksimale e ujit(1,0 g / cm 3) korrespondon me t-re 3,98 o; dendësia e akullit 0,918 g/cm3; vetëm uji nuk zhytet në shkrirjen e tij; Thales i Miletit tërhoqi vëmendjen për këtë. Kur uji ngrin, formohet një kore e hollë mbrojtëse akulli, e cila siguron ruajtjen e trupave ujorë, kryesisht Oqeanin Botëror, rregullatorin kryesor të regjimit ajror të planetit. Dhe pa këtë veti të ujit jeta do të merrte një formë krejtësisht tjetër.
1.2. Ide për strukturën e fshehur të ujit
Struktura e ujit. Vitet tridhjetë e shekullit të njëzetë sollën një zbulim të ri të madh në lidhje me studimin e ujit: fizikanët anglezë J. Bernal dhe R. Fowler, në bazë të studimeve me rreze X dhe spektroskopike, vërtetuan se molekulat e ujit janë të renditura në një mënyrë të caktuar. , çdo molekulë uji është e rrethuar nga katër të tjera në një katërkëndor. Kështu, u vërtetua deklarata e bërë në fund të shekullit të 18-të. V. Roentgen mendoi për strukturën komplekse të ujit të lëngshëm dhe ekzistencën e lidhjeve shtesë midis molekulave individuale. Shkencëtarët e quajnë këtë fenomen struktura e ujit, megjithëse është e qartë se është e pamundur ta identifikosh plotësisht atë me rrjetën kristalore të trupave të ngurtë, pasi uji i lëngshëm është një përzierje e molekulave monomere dhe polimerike, lidhjet midis monomerëve individualë janë dinamike: ato shfaqen vazhdimisht, prishen, forcohen, dobësohen.
Arsyeja kryesore për ekzistencën e strukturës së ujit është një lloj i veçantë i lidhjes midis atomeve individuale - hidrogjeni. Kjo lidhje është e natyrës elektrostatike, por është më e dobët se normalja. lidhje valence ndërmjet atomeve të hidrogjenit dhe oksigjenit duke formuar monomere të veçantë. Në çdo monomer H 2 O, distanca midis atomeve të hidrogjenit dhe oksigjenit është 0.1 nm dhe këndi i formuar midis lidhjeve të valencës është rreth 105º. Në një lidhje hidrogjeni, distanca midis atomeve rritet në 0.176 nm, dhe nuk është rreptësisht konstante.
Ekzistojnë disa modele të strukturës së ujit bazuar në idenë e lidhjes së monomerëve individualë me lidhje hidrogjeni. J. Bernal dhe R. Fowler sugjeruan ekzistencën e tre llojeve të rregullimit molekular: a) strukturat që i afrohen rrjetës kristalore të akullit ekzistojnë në temperatura nga 0 në 4ºС; b) strukturat si kuarci, mbizotërojnë në një temperaturë prej 4-200ºС; c) strukturat e mbushura ngushtë tipike për lëngjet normale (pothuajse pa lidhje hidrogjeni) shfaqen në temperatura mbi 200 ºС [Blokh A.M. Struktura e ujit dhe proceset gjeologjike.L., 1969, f.216].
Një qasje interesante për interpretimin e veçorive strukturore të ujit u propozua nga fizikani italian M. Angeno (1967). Sipas ideve të tij, çdo molekulë uji mund të marrë pjesë në jo më shumë se dy, por të ashtuquajturat lidhje kolektive, hidrogjenore, si rezultat i të cilave kombinimi i lidhjeve valente dhe hidrogjenit formon lidhje. tipe te ndryshme(Fig. 1).
Oriz. 1. Agregatet molekulare në ujë të lëngshëm (sipas M. Ajendo).
Këto lidhje mund të formojnë zinxhirë, unaza dhe sisteme më komplekse që formohen, shkatërrohen dhe shkëmbejnë vazhdimisht molekula. ku numri total urat e hidrogjenit në sistem mbeten konstante dhe llojet e mundshme të agregateve janë të pranishme në ujë në përmasa të ndryshme në një ekuilibër statik të përcaktuar nga temperatura. Unaza prej gjashtë molekulash duket se po i afrohen strukturës së akullit.
Nga pikëpamja e strukturës strukturore të ujit të lëngët, të gjitha të tij veti anormale. Nevoja për të shkatërruar lidhjet e hidrogjenit paracakton intensitetin e lartë të energjisë së ujit, si rezultat i të cilit pikat e shkrirjes dhe vlimit, kapaciteti i nxehtësisë dhe nxehtësitë latente të shkrirjes dhe avullimit bëhen anormalisht të larta. Kur uji ftohet në intervalin e temperaturës nga 4 në 0ºС, struktura ristrukturohet nga paketimi më i dendur tetragonal në gjashtëkëndor akulli. Lidhja e fortë midis molekulave të ujit e bën atë inerte ndaj substancave të tretura. Meqenëse struktura e ujit formohet nga lidhje elektrostatike, ai ndikohet nga fusha të ndryshme (temperatura, gjeodinamike, magnetike, elektrike).
Me rritjen e temperaturës, struktura e ujit fillon të prishet. Vlerësimet e autorëve të ndryshëm, të cilët llogaritin përqindjen e molekulave me lidhje hidrogjeni të ruajtura, janë të afërta: rreth gjysma e molekulave janë të strukturuara në ujë të ftohtë, me arritjen e temperaturës 100°C, lidhjet strukturore mbahen në rreth 30% të molekulave. , dhe kur afrohet temperatura kritike (374°C), molekulat e strukturuara zhduken.
Kur ushtrohet presion, molekulat e lëngjeve afrohen me njëra-tjetrën dhe viskoziteti i tyre rritet. Uji sillet krejt ndryshe. Fazat e para të ngarkesave çojnë në ristrukturimin e strukturës së ujit, mbushjen e zbrazëtirave ndërmolekulare, shoqëruar me një ulje të viskozitetit të tij dhe vetëm duke u nisur nga presionet prej rreth 100 MPa (mjaftueshëm i lartë për kushtet natyrore) fillon një rritje graduale e viskozitetit.
1.3. Varietetet e ujit
Vetitë strukturore të ujit dhe ekzistenca e disa izotopeve të oksigjenit dhe hidrogjenit janë arsyeja pse uji mund të formojë shumë lloje fiziko-kimike. Ja disa prej tyre.
Ide për ujin e aktivizuar
Eksperimentet e shkencëtarëve të Novosibirsk (F.A. Letnikov dhe të tjerë) për trajtimin e ujit në autoklava në temperatura 300-400 ºС dhe presione deri në 100 MPa treguan se kjo rrit fuqinë tretës të ujit për shumë minerale (në sulfide, gips, kuarc). pH zvogëlohet, përçueshmëria elektrike rritet. Ndikimi i temperaturës dhe presionit në ndryshimin e strukturave të ujit i çoi ekspertët në idenë e mundësisë së simulimit të vetive të ujit të vendosur në thellësi të mëdha (d.m.th. në temperatura dhe presione të larta) dhe çoi në zbulimin e thirrur ujë të aktivizuar . Pas trajtimit të ujit në autoklava Zbulimi i një gjendjeje të aktivizuar në ujin e burimeve termale minerale sugjeron se vetitë shëruese të disa llojeve të ujërave minerale mund të lidhen jo vetëm me përbërjen e tyre kimike, por edhe me një rritje të aktivitetit biologjik të ujit. gjatë aktivizimit të tij. Zbulimi i fenomenit të aktivizimit jo vetëm që bën të mundur shpjegimin e disa vetive të solucioneve hidrotermale, por gjithashtu hap perspektiva për përgatitjen artificiale të ujërave minerale.
Ndikimi i fushës elektrike
Kur futet uji në fushe elektrike mund të ndodhin ndryshime të caktuara në strukturën e tij. Pra, rryma elektrike dobëson lidhjet strukturore dhe pas trajtimit të ujit me rrymë elektrike alternative, shkalla e avullimit rritet, sipas të dhënave të pakta që disponojmë, me 11-18%. Është vënë re ndikimi i fushave elektrike në intensitetin e përthithjes së rrezeve të dritës nga uji.
Ndikimi i fushës magnetike
Ndikimi pozitiv në trupin e njeriut të ujit që ka qenë në fushë magnetike, u vu re në mesjetë. Në vitin 1945, inxhinieri belg T. Vermayern patentoi një mënyrë të thjeshtë për të reduktuar intensitetin e formimit të shkallës në kaldaja me avull duke përdorur trajtimin paraprak magnetik të ujit. Aktualisht, kjo metodë e trajtimit të shkallës përdoret shumë gjerësisht. Mjafton t'i referohemi përvojës së shumë termocentraleve (Rostovskaya, Astrakhanskaya, etj.), termocentraleve shtetërore të rretheve (Simferopolskaya, Saratovskaya), fabrikave, minierave dhe ndërmarrjeve të tjera.
Kur njomni farat e shumë kulturave bujqësore, luleve dhe frutave me ujë të magnetizuar, mbirja e tyre rritet në mënyrë dramatike. Aktualisht, industria vendase prodhon edhe pajisje speciale për magnetizimin e ujit, të rekomanduara për ndërmarrjet bujqësore dhe kopshtarët.
Uji- II . Në fillim të viteve 60 të shekullit XX. N.N. Fedyakin zbuloi një fenomen jashtëzakonisht interesant: kur avulli i ujit kondensohet në kapilarë të hollë kuarci (5-20 mikronë në diametër), formohet një lëng, i cili ndryshon ndjeshëm nga uji i zakonshëm në veti. Më vonë, ky lëng, i quajtur ujë-II, u studiua nga studiues të mëdhenj rusë dhe të huaj, në veçanti, nga një ekip i madh shkencëtarësh të kryesuar nga B.V. Deryagin. U zbulua se uji-II është një lëng viskoz me një densitet prej rreth 1 g/cm 3 dhe një indeks thyerjeje prej 1.49 (kundrejt 1.33 për ujin e zakonshëm). Ky lëng kalon në gjendje të ngurtë me ftohjen në minus 35÷40 ºС pa kërcim vëllimi. Pika e vlimit të ujit-II në presionin atmosferik është afërsisht 250 ºС. Water-II ka një spektër unik absorbimi infra të kuqe që nuk korrespondon me asnjë prej tyre substancave të njohura. Gjendja e modifikuar e substancës së përftuar është e qëndrueshme dhe ruhet gjatë distilimit (kjo procedurë është përdorur për të gërryer pjesët e ujit-II). U vërtetua se substanca e sapopërfituar korrespondon rreptësisht me formulën H 2 O; kuarci, me sa duket, luan rolin e një katalizatori në sintezën e ujit-II.
Studimi i ujit-II udhëhoqi B.V. Deryagin dhe bashkëpunëtorët e tij arritën në përfundimin se është e mundur të kemi një lloj të veçantë lidhjeje të fortë molekulare midis hidrogjenit dhe oksigjenit, i cili formon polimere të përbërë nga 6-10 molekula monomerike H2O. Është ende e vështirë të përcaktohet roli i ujit-II në sistemet natyrore , por është e qartë se studimi i tij premton perspektiva të caktuara në studimin e proceseve të thella gjeologjike.
Ujë i rëndë. Aktualisht, njihen tre izotope të hidrogjenit (1 H-protium, 2 H-deuterium D, 3 H-tritium T) dhe tre izotope oksigjeni (16 O, 17 O, 18 O). Kjo do të thotë se mund të ketë një numër të konsiderueshëm të llojeve të ujit me kombinime të ndryshme të izotopeve. Më e qëndrueshme prej tyre është i ashtuquajturi ujë i rëndë D 2 O, i përmbajtur si papastërti në ujin e zakonshëm në të qindtat e përqindjes. Sipas vetive të tij, uji i rëndë ndryshon dukshëm nga uji i zakonshëm: dendësia maksimale shënohet në t=11,2 ºС dhe është 1,056 g/cm 3 ; viskoziteti është 20% më i lartë; konstanta dielektrike është 0,3-0,5% më e ulët. Pika e shkrirjes së ujit të rëndë është 3.8 ºС; pika e vlimit 101.4 ºС. Duke gjykuar nga të dhënat e dhëna dhe një sërë të dhënash të tjera, lidhja e deuteriumit është edhe më e fortë se lidhja hidrogjenore.Uji i rëndë përdoret si moderator neutron në reaktorët bërthamorë. Uji i rëndë është toksik, qeniet e gjalla dhe bimët vdesin në të. Disa shkencëtarë e lidhin evolucionin e jetës në planetin tonë me ndryshimet në përqendrimin e deuteriumit në ujë: në veçanti, përqendrimi më i ulët i deuteriumit në ujë në krahasim me përqendrimin modern të deuteriumit në ujë shpjegon ekzistencën e barngrënësve gjigantë në Mesozoik. Megjithatë, këto dispozita janë të diskutueshme.
Shembujt e dhënë këtu të varieteteve të ujit, të paracaktuara nga struktura dhe izotopia e tij komplekse, tregojnë se sa të pashtershme janë perspektivat për shfaqjen e zbulimeve të reja në studimin e një substance kaq të mahnitshme si uji.
ESE
"Trupat që shkrihen"
E kryer:
Prisyazhnyuk Olga 9-A
Kontrolluar:
Nevzorova Tatyana Igorevna
Prezantimi
Llogaritja e sasisë së nxehtësisë
Shkrirja
Nxehtësia specifike e shkrirjes
Shkrirja e metaleve
Pika e shkrirjes dhe e vlimit të ujit
shkrihet
Interesante për shkrirjen
Përfundim (përfundime)
Lista e literaturës së përdorur
Prezantimi
Gjendja agregate - një gjendje e materies e karakterizuar nga veti të caktuara cilësore: aftësia ose paaftësia për të ruajtur vëllimin dhe formën, praninë ose mungesën e rendit me rreze të gjatë dhe të shkurtër, dhe të tjera. Një ndryshim në gjendjen e grumbullimit mund të shoqërohet me një ndryshim të ngjashëm me kërcimin në energjinë e lirë, entropinë, densitetin dhe vetitë e tjera fizike bazë.
Ekzistojnë tre gjendje kryesore të grumbullimit: të ngurtë, të lëngët dhe të gaztë. Ndonjëherë nuk është mjaft e saktë të klasifikohet plazma si një gjendje grumbullimi. Ka gjendje të tjera grumbullimi, për shembull, kristalet e lëngëta ose kondensata Bose-Einstein.
Ndryshimet në gjendjen e grumbullimit janë procese termodinamike të quajtura tranzicione fazore. Dallohen varietetet e mëposhtme: nga të ngurta në të lëngshme - shkrirje; nga lëngu në të gaztë - avullimi dhe zierja; nga e ngurtë në të gaztë - sublimimi; nga e gaztë në të lëngshme ose të ngurtë - kondensimi. Një tipar dallues është mungesa e një kufiri të mprehtë të kalimit në gjendjen plazmatike.
Për të përshkruar gjendje të ndryshme në fizikë, përdoret një koncept më i gjerë i një faze termodinamike. Dukuritë që përshkruajnë kalimet nga një fazë në tjetrën quhen dukuri kritike.
E ngurtë: Një gjendje e karakterizuar nga aftësia për të ruajtur vëllimin dhe formën. Atomet e një trupi të ngurtë bëjnë vetëm dridhje të vogla rreth gjendjes së ekuilibrit. Ka porosi me rreze të gjatë dhe me rreze të shkurtër.
Lëng: Gjendja e një lënde në të cilën ka ngjyeshmëri të ulët, domethënë e ruan mirë vëllimin, por nuk është në gjendje të ruajë formën e saj. Lëngu merr lehtësisht formën e enës në të cilën vendoset. Atomet ose molekulat e një lëngu dridhen pranë gjendjes së ekuilibrit, të kyçur nga atome të tjera dhe shpesh hidhen në vende të tjera të lira. Ekziston vetëm porosi me rreze të shkurtër.
Gaz: Një gjendje e karakterizuar nga kompresueshmëri e mirë, e mungesës së aftësisë për të ruajtur vëllimin dhe formën. Gazi tenton të zërë të gjithë vëllimin e dhënë për të. Atomet ose molekulat e një gazi sillen relativisht lirshëm, distancat midis tyre janë shumë më të mëdha se madhësia e tyre.
Gjendje të tjera: Pas ftohjes së thellë, disa (jo të gjitha) substanca kalojnë në një gjendje superpërçuese ose superfluide. Këto gjendje, natyrisht, janë faza të veçanta termodinamike, por vështirë se meritojnë të quhen gjendje të reja agregate të materies për shkak të jouniversalitetit të tyre. Substancat johomogjene si pastat, xhelat, suspensionet, aerosolet, etj., të cilat në kushte të caktuara demonstrojnë vetitë si të lëndëve të ngurta ashtu edhe të lëngjeve dhe madje edhe të gazeve, zakonisht klasifikohen si materiale të shpërndara dhe jo në ndonjë gjendje agregate specifike të materies.
Shkrirja
Oriz. 1. Gjendja e lëndës së pastër (diagrami)

Oriz. 2. Temperatura e shkrirjes së një trupi kristalor

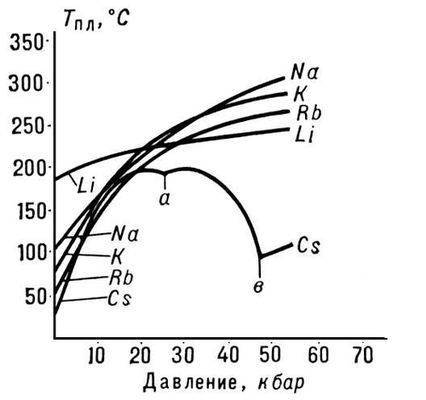
Oriz. 3. Pika e shkrirjes së metaleve alkaline
Shkrirja - kalimi i një lënde nga një gjendje kristalore (e ngurtë) në një gjendje të lëngshme; ndodh me thithjen e nxehtësisë (kalimi fazor i rendit të parë). Karakteristikat kryesore të P. të substancave të pastra janë pika e shkrirjes (Tmelt) dhe nxehtësia që është e nevojshme për zbatimin e procesit P. (nxehtësia e shkrirjes Qmelt).
Temperatura e P. varet nga presioni i jashtëm p; në diagramin e gjendjes së një lënde të pastër, kjo varësi përshkruhet nga kurba e shkrirjes (lakorja e bashkëjetesës së fazave të ngurta dhe të lëngshme, AD ose AD "në figurën 1). Shkrirja e lidhjeve dhe tretësirave të ngurta ndodh, si rregull. , në intervalin e temperaturës (me përjashtim të eutektikës me një shkrirje konstante) Varësia e temperaturës së fillimit dhe mbarimit të P. të një lidhjeje nga përbërja e saj në një presion të caktuar përshkruhet në diagramet e gjendjes me vija të veçanta (liquidus dhe kurbat solidus, shih Sistemet binare) nga një gjendje e ngurtë kristalore në një lëng izotropik ndodh në faza (në një interval të caktuar temperaturash), secila fazë karakterizon një fazë të caktuar në shkatërrimin e strukturës kristalore.
Prania e një temperature të caktuar P. është një shenjë e rëndësishme e strukturës së saktë kristalore të trupave të ngurtë. Mbi këtë bazë dallohen lehtë nga trupat e ngurtë amorfë, të cilët nuk kanë Tm fiks. Lëndët e ngurta amorfe kalojnë në gjendje të lëngët gradualisht, duke u zbutur me rritjen e temperaturës (shih Gjendja amorfe). Tungsteni ka temperaturën më të lartë midis metaleve të pastër (3410°C), dhe mërkuri ka temperaturën më të ulët (-38,9°C). Komponimet veçanërisht zjarrduruese përfshijnë: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), etj. Si rregull, për substancat me të lartë Tm karakterizohet nga vlera më të larta të Qm. Papastërtitë e pranishme në substancat kristalore ulin Tm-në e tyre. Kjo përdoret në praktikë për të marrë lidhjet me shkrirje të ulët (shih, për shembull, aliazhin e drurit me shkrirje = 68 °C) dhe përzierjet ftohëse.
P. fillon kur substanca kristalore arrin në Tpl. Nga fillimi i P. deri në përfundimin e tij, temperatura e substancës mbetet konstante dhe e barabartë me Tmelt, pavarësisht transferimit të nxehtësisë në substancë (Fig. 2). Në kushte normale, nuk është e mundur të nxehet një kristal në T > shkrihet (shiko Mbinxehja), ndërsa gjatë kristalizimit është relativisht e lehtë të arrihet superftohje e konsiderueshme e shkrirjes.
Natyra e varësisë së Tm nga presioni p përcaktohet nga drejtimi i ndryshimeve vëllimore (DVm) në P. (shih ekuacionin Clapeyron-Clausius). Në shumicën e rasteve, P. e një lënde shoqërohet me një rritje të vëllimit të tyre (zakonisht me disa për qind). Nëse është kështu, atëherë një rritje e presionit çon në një rritje të Tm (Fig. 3). Megjithatë, në disa substanca (uji, një numër i metaleve dhe metalideve, shih Fig. 1), gjatë P., ndodh një rënie në vëllim. Temperatura e P. e këtyre substancave ulet me rritjen e presionit.
P. shoqërohet me një ndryshim të vetive fizike të substancës: rritje të entropisë, e cila pasqyron çrregullimin e strukturës kristalore të substancës; një rritje në kapacitetin e nxehtësisë, rezistencën elektrike [me përjashtim të disa gjysmëmetaleve (Bi, Sb) dhe gjysmëpërçuesve (Ge), të cilët kanë një përçueshmëri elektrike më të lartë në gjendje të lëngët]. Gjatë P., rezistenca në prerje bie pothuajse në zero (valët elastike tërthore nuk mund të përhapen në shkrirje, shih Lëngu), zvogëlohet shpejtësia e përhapjes së zërit (valët gjatësore) etj.
Sipas paraqitjeve molekulare dhe kinetike, P. kryhet si më poshtë. Kur nxehtësia aplikohet në një trup kristalor, energjia e dridhjeve (amplituda e lëkundjes) e atomeve të tij rritet, gjë që çon në një rritje të temperaturës së trupit dhe kontribuon në formimin e llojeve të ndryshme të defekteve në kristal (nyjet e paplotësuara të rrjetës kristalore - vendet e lira; shkeljet e periodicitetit të grilës nga atomet e ngulitura midis nyjeve të saj, etj., shih Defektet në kristale). Në kristalet molekulare, çrregullimi i pjesshëm i orientimit të ndërsjellë të boshteve të molekulave mund të ndodhë nëse molekulat nuk kanë një formë sferike. Një rritje graduale e numrit të defekteve dhe shoqërimi i tyre karakterizon fazën e parashkrirjes. Kur arrihet Tmelt, krijohet një përqendrim kritik i defekteve në kristal dhe fillon kristalizimi; rrjeta kristalore shpërthen në rajone submikroskopike lehtësisht të lëvizshme. Nxehtësia e dhënë gjatë P. përdoret jo për të ngrohur trupin, por për të thyer lidhjet ndëratomike dhe për të shkatërruar rendin me rreze të gjatë në kristale (shih Rendi me rreze të gjatë dhe rend me rreze të shkurtër). Në vetë rajonet submikroskopike, nga ana tjetër, rendi me rreze të shkurtër në renditjen e atomeve nuk ndryshon ndjeshëm në pikën e shkrirjes (numri i koordinimit të shkrirjes në Tmelt në shumicën e rasteve mbetet i njëjtë me atë të kristalit). Kjo shpjegon vlerat më të ulëta të nxehtësisë së shkrirjes Qm në krahasim me nxehtësinë e avullimit dhe ndryshimin relativisht të vogël në një numër të vetive fizike të substancave gjatë P të tyre.
Procesi i pirolizës luan një rol të rëndësishëm në natyrë (piroliza e borës dhe akullit në sipërfaqen e tokës, mineralizimi i mineraleve në thellësitë e saj, e kështu me radhë) dhe në teknologji (prodhimi i metaleve dhe lidhjeve, derdhja e mykut, etj.) .
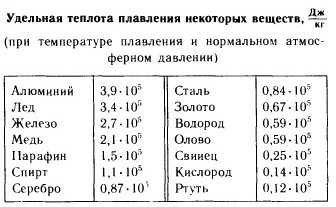
Nxehtësia specifike e shkrirjes
Nxehtësia specifike e shkrirjes (gjithashtu: entalpia e shkrirjes; ekziston gjithashtu një koncept ekuivalent i nxehtësisë specifike të kristalizimit) - sasia e nxehtësisë që duhet t'i jepet një njësie të masës së një lënde kristaline në një proces ekuilibër izobarik-izotermik në mënyrë për ta transferuar atë nga një gjendje e ngurtë (kristalore) në një lëng (e njëjtë sasia e nxehtësisë që çlirohet gjatë kristalizimit të një lënde). Nxehtësia e shkrirjes është një rast i veçantë i nxehtësisë së një tranzicioni fazor të rendit të parë. Dalloni nxehtësinë specifike të shkrirjes (J/kg) dhe molare (J/mol).
Nxehtësia specifike e shkrirjes tregohet nga formula e llogaritjes së shkronjës (gërma greke lambda). ngrohje specifike pika e shkrirjes:
ku është nxehtësia specifike e shkrirjes, është sasia e nxehtësisë së marrë nga substanca gjatë shkrirjes (ose e lëshuar gjatë kristalizimit), është masa e substancës shkrirëse (kristalizuese).
Shkrirja e metaleve
Gjatë shkrirjes së metaleve, duhet të respektohen disa rregulla. Supozoni se ata do të shkrijnë plumbin dhe zinkun. Plumbi do të shkrihet shpejt, duke pasur një pikë shkrirjeje prej 327°; zinku, nga ana tjetër, do të mbetet i fortë për një kohë të gjatë, pasi pika e tij e shkrirjes është mbi 419 °. Çfarë do të ndodhë me një mbinxehje të tillë? Do të fillojë të mbulohet me një film me ngjyrë të ylbertë, dhe më pas sipërfaqja e saj do të fshihet nën një shtresë pluhuri që nuk shkrihet. Plumbi digjet nga mbinxehja, oksidohet duke u kombinuar me oksigjenin në ajër. Ky proces, siç e dini, ndodh në temperaturë të zakonshme, por kur nxehet, shkon shumë më shpejt. Kështu, në kohën kur zinku fillon të shkrihet, do të ketë mbetur shumë pak plumb metalik. Lidhja do të rezultojë të jetë një përbërje krejtësisht e ndryshme, siç pritej, dhe një sasi e madhe plumbi do të humbasë në formën e mbeturinave. Është e qartë se fillimisht duhet të shkrijmë zinkun më zjarrdurues dhe më pas të hedhim plumbin në të. E njëjta gjë do të ndodhë nëse zinku lidhet me bakër ose bronz, duke ngrohur fillimisht zinkun. Zinku do të digjet në kohën kur bakri shkrihet. Kjo do të thotë që gjithmonë duhet të shkrini metalin me një pikë shkrirjeje më të lartë.
Por kjo nuk mund të shmangë furinë. Nëse një aliazh i ngrohur siç duhet mbahet në zjarr për një kohë të gjatë, një film përsëri formohet në sipërfaqen e metalit të lëngshëm si rezultat i tymit. Është e qartë se metali më i shkrirë do të kthehet përsëri në një oksid dhe përbërja e prizës do të ndryshojë; Kjo do të thotë që metali nuk mund të mbinxehet për një kohë të gjatë pa nevojë. Prandaj, ata përpiqen në çdo mënyrë të mundshme të reduktojnë mbetjet e metalit, duke e vendosur atë në një masë kompakte; copa të vogla, tallash, ashkla fillimisht "paketohen", copa pak a shumë të së njëjtës madhësi shkrihen, nxehen në një temperaturë të mjaftueshme dhe sipërfaqja metalike mbrohet nga kontakti me ajrin. Për këtë qëllim, mjeshtri mund të marrë një boraks ose thjesht të mbulojë sipërfaqen e metalit me një shtresë hiri, i cili gjithmonë do të notojë sipër (për shkak të gravitetit të tij specifik më të ulët) dhe nuk do të ndërhyjë gjatë derdhjes së metalit. Kur metali ngurtësohet, ndodh një fenomen tjetër, ndoshta i njohur edhe për mjeshtrit e rinj. Metali, duke u ngurtësuar, zvogëlohet në vëllim, dhe kjo rënie ndodh për shkak të grimcave të brendshme të metalit, ende jo të ngurtësuara. Një prerje pak a shumë domethënëse në formë hinke, e ashtuquajtura zgavra e tkurrjes, formohet në sipërfaqen e derdhjes ose brenda saj. Zakonisht, myku bëhet në atë mënyrë që në ato vende të derdhjes të formohen vrima tkurrjeje, të cilat më pas hiqen, duke u përpjekur të mbrojnë sa më shumë vetë produktin. Është e qartë se vrimat e tkurrjes prishin derdhjen dhe ndonjëherë mund ta bëjnë atë të papërdorshëm. Pas shkrirjes, metali nxehet pak në mënyrë që të jetë më i hollë dhe më i nxehtë dhe për këtë arsye mbush më mirë detajet e mykut dhe nuk ngrin para kohe nga kontakti me një myk më të ftohtë.
Meqenëse pika e shkrirjes së lidhjeve është zakonisht më e ulët se pika e shkrirjes së metaleve më zjarrduruese të metaleve përbërëse të aliazhit, ndonjëherë është e dobishme të bëhet e kundërta: së pari shkrihet metali më i shkrirë, dhe më pas më refraktar. Megjithatë, kjo lejohet vetëm për metalet që nuk janë të oksiduara fort, ose me kusht që këto metale të mbrohen nga oksidimi i tepërt. Duhet të merret më shumë metal sesa kërkohet për vetë sendin, në mënyrë që të mbushë jo vetëm kallëpin, por edhe kanalin sprue. Është e qartë se së pari duhet të llogarisni sasinë e kërkuar të metalit.
Pika e shkrirjes dhe e vlimit të ujit
Vetia më befasuese dhe e lumtur e ujit për natyrën e gjallë është aftësia e tij për të qenë një lëng në kushte "normale". Molekulat e komponimeve shumë të ngjashme me ujin (për shembull, molekulat H2S ose H2Se) janë shumë më të rënda, por formojnë një gaz në të njëjtat kushte. Kështu, uji duket se kundërshton ligjet e tabelës periodike, e cila, siç e dini, parashikon kur, ku dhe cilat veti të substancave do të jenë afër. Në rastin tonë, nga tabela rezulton se vetitë e përbërjeve të hidrogjenit të elementeve (të quajtura hidride) të vendosura në të njëjtat kolona vertikale duhet të ndryshojnë në mënyrë monotonike me rritjen e masës së atomeve. Oksigjeni është një element i grupit të gjashtë të kësaj tabele. Në të njëjtin grup janë squfuri S (me peshë atomike 32), seleni Se (me peshë atomike 79), teluri Te (me peshë atomike 128) dhe polonium Po (me peshë atomike 209). Për rrjedhojë, vetitë e hidrideve të këtyre elementeve duhet të ndryshojnë në mënyrë monotone kur kalojnë nga elementët e rëndë në ato më të lehta, d.m.th. në sekuencën H2Po → H2Te → H2Se → H2S → H2O. Kjo është ajo që ndodh, por vetëm me katër hidridet e para. Për shembull, pikat e vlimit dhe shkrirjes rriten me rritjen e peshës atomike të elementeve. Në figurë, kryqet shënojnë pikat e vlimit të këtyre hidrideve, dhe rrathët shënojnë pikat e shkrirjes.

Siç shihet, ndërsa pesha atomike zvogëlohet, temperaturat ulen në mënyrë mjaft lineare. Zona e ekzistencës së fazës së lëngshme të hidrideve bëhet gjithnjë e më e "ftohtë", dhe nëse hidridi i oksigjenit H2O do të ishte një përbërje normale, e ngjashme me fqinjët e tij në grupin e gjashtë, atëherë uji i lëngshëm do të ekzistonte në intervalin prej - 80 ° C deri -95 ° C. Në më shumë Në temperatura të larta, H2O do të ishte gjithmonë një gaz. Për fat të mirë për ne dhe gjithë jetën në Tokë, uji është anormal, nuk njeh një model periodik, por ndjek ligjet e veta.
Kjo shpjegohet mjaft thjesht - shumica e molekulave të ujit janë të lidhura me lidhje hidrogjeni. Janë këto lidhje që dallojnë ujin nga hidridet e lëngëta H2S, H2Se dhe H2Te. Nëse nuk do të ishin, atëherë uji do të vlonte tashmë në minus 95 ° C. Energjia e lidhjeve hidrogjenore është mjaft e lartë dhe ato mund të thyhen vetëm në një temperaturë shumë më të lartë. Edhe në gjendje të gaztë, një numër i madh molekulash H2O ruajnë lidhjet e tyre hidrogjenore, duke u kombinuar për të formuar dimerët (H2O)2. Lidhjet plotësisht hidrogjenore zhduken vetëm në një temperaturë të avullit të ujit prej 600 °C.
Kujtoni se zierja konsiston në faktin se flluskat e avullit formohen brenda një lëngu të valë. Në presion normal, uji i pastër vlon në 100 "C. Nëse nxehtësia furnizohet përmes sipërfaqes së lirë, procesi i avullimit të sipërfaqes do të përshpejtohet, por avullimi vëllimor karakteristik i vlimit nuk ndodh. Zierja mund të kryhet edhe duke ulur pjesën e jashtme. presioni, pasi në këtë rast avulli i presionit i barabartë me presionin e jashtëm arrihet në një temperaturë më të ulët. Në majë të një mali shumë të lartë, presioni dhe, rrjedhimisht, pika e vlimit janë aq të ulëta sa uji bëhet i papërshtatshëm për gatim - temperatura e kërkuar e ujit nuk arrihet. Me një presion mjaft të lartë, uji mund të nxehet aq shumë sa që në të mund të shkrijë plumbin (327°C) dhe megjithatë nuk do të vlojë.
Përveç pikave të vlimit të shkrirjes super të mëdha (dhe procesi i fundit kërkon shumë nxehtësi shkrirjeje për një lëng kaq të thjeshtë), vetë diapazoni i ekzistencës së ujit është anormal - njëqind gradë me të cilën këto temperatura ndryshojnë - një diapazon mjaft i madh. për një lëng me peshë molekulare kaq të ulët si uji. Kufijtë e vlerave të lejuara të hipotermisë dhe mbinxehjes së ujit janë jashtëzakonisht të mëdha - me ngrohje ose ftohje të kujdesshme, uji mbetet i lëngshëm nga -40 ° C në +200 ° C. Kjo e zgjeron gamën e temperaturës në të cilën uji mund të mbetet i lëngshëm në 240 °C.
Kur akulli nxehet, temperatura e tij fillimisht rritet, por që nga momenti i formimit të përzierjes së ujit dhe akullit, temperatura do të mbetet e pandryshuar derisa i gjithë akulli të shkrihet. Kjo shpjegohet me faktin se nxehtësia e furnizuar me shkrirjen e akullit shpenzohet kryesisht vetëm në shkatërrimin e kristaleve. Temperatura e shkrirjes së akullit mbetet e pandryshuar derisa të gjitha kristalet të shkatërrohen (shih nxehtësinë latente të shkrirjes).
shkrihet
Shkrirja është një gjendje e shkrirë e lëngshme e substancave në temperatura brenda kufijve të caktuar larg nga pika kritike e shkrirjes dhe e vendosur më afër pikës së shkrirjes. Natyra e shkrirjes përcaktohet në thelb nga lloji i lidhjeve kimike të elementeve në substancën e shkrirë.
Shkrirja përdoret gjerësisht në metalurgji, prodhimin e qelqit dhe fusha të tjera të teknologjisë. Shkrirja zakonisht ka një përbërje komplekse dhe përmban përbërës të ndryshëm ndërveprues (shih diagramin fazor).
Shkrihet janë
1. Metalik (Metalet (emri vjen nga latinishtja metallum - minierë, minierë) - grup elementësh me veti karakteristike metalike, si përçueshmëri e lartë termike dhe elektrike, koeficient pozitiv i temperaturës së rezistencës, duktilitet i lartë dhe shkëlqim metalik);
2. Jonik (Ion (greqishtja e lashtë ἰόν - vrapim) - grimcë e ngarkuar elektrike monoatomike ose poliatomike e formuar si rezultat i humbjes ose shtimit të një ose më shumë elektroneve në një atom ose molekulë. Jonizimi (procesi i formimit të joneve) mund të ndodhin në temperatura të larta, nën ndikimin e një fushe elektrike);
3. Gjysmëpërçues me lidhje kovalente ndërmjet atomeve (Gjysëmpërçuesit - materiale që për nga përçueshmëria e tyre zënë një vend të ndërmjetëm midis përçuesve dhe dielektrikëve dhe ndryshojnë nga përçuesit në një varësi të fortë të përçueshmërisë nga përqendrimi i papastërtisë, temperatura dhe lloje të ndryshme të rrezatimit. vetia kryesore e këtyre materialeve është rritja e përçueshmërisë elektrike me rritjen e temperaturës);
4. Shkrirja organike me lidhjet van der Waals;
5. Polimer i lartë (Polymers (greqisht shumë- - shumë; μέρος - pjesë) - substanca inorganike dhe organike, amorfe dhe kristalore të përftuara nga përsëritja e përsëritur e grupeve të ndryshme atomesh, të quajtura "njësi monomerike", të lidhura në makromolekula të gjata me anë kimike ose koordinimi. obligacione)
Shkrirjet sipas llojit të përbërjeve kimike janë:
1. Kripë;
2.Oksid;
3. Oksid-silikat (skorje) etj.
Shkrihet me veti të veçanta:
1.Eutektik
Interesante për shkrirjen
Kokrra akulli dhe yje.
Merrni një copë akulli të pastër në një dhomë të ngrohtë dhe shikoni të shkrihet. Do të bëhet shpejt e qartë se akulli, i cili dukej monolit dhe homogjen, ndahet në shumë kokrra të vogla - kristale individuale. Në vëllimin e akullit, ato janë të vendosura rastësisht. Një pamje po aq interesante mund të shihet kur akulli shkrihet nga sipërfaqja.
Sillni një copë të lëmuar akulli në llambë dhe prisni derisa të fillojë të shkrihet. Kur shkrirja prek kokrrat e brendshme, aty do të fillojnë të shfaqen modele shumë të imta. Me një xham zmadhues të fortë, mund të shihni se ato kanë formën e flokeve gjashtëkëndore të borës. Në fakt, këto janë depresione të shkrira të mbushura me ujë. Forma dhe drejtimi i rrezeve të tyre korrespondojnë me orientimin e kristaleve të akullit. Këto modele quhen "yjet e Tyndall" sipas fizikanit anglez që i zbuloi dhe i përshkroi ato në 1855. "Yjet e Tyndall", të ngjashme me flokët e dëborës, janë në të vërtetë gropa në sipërfaqen e akullit të shkrirë, me madhësi rreth 1.5 mm, të mbushura me ujë. Në qendër të tyre janë të dukshme flluska ajri, të cilat kanë lindur për shkak të ndryshimit në vëllimet e akullit të shkrirë dhe ujit të shkrirë.
A E DINI?
Ekziston një metal, i ashtuquajturi aliazh i drurit, i cili mund të shkrihet lehtësisht edhe në ujë të ngrohtë (+68 gradë Celsius). Pra, kur përzieni sheqerin në një gotë, një lugë metalike e bërë nga kjo aliazh do të shkrihet më shpejt se sheqeri!
Substanca më zjarrduruese, karbidi i tantalit TaCO-88, shkrihet në një temperaturë prej 3990°C.
Në vitin 1987, studiuesit gjermanë ishin në gjendje ta ftohnin ujin në -700C duke e mbajtur atë në gjendje të lëngshme.
Ndonjëherë, që bora në trotuare të shkrihet më shpejt, spërkatet me kripë. Shkrirja e akullit ndodh sepse formohet një tretësirë kripe në ujë, pika e ngrirjes së së cilës është më e ulët se temperatura e ajrit. Zgjidhja thjesht rrjedh nga trotuari.
Është interesante se këmbët bëhen më të ftohta në trotuarin e lagësht, pasi temperatura e tretësirës së ujit të kripur është më e ulët se ajo e borës së pastër.
Nëse e derdhni çajin nga një çajnik në dy gota: me sheqer dhe pa sheqer, atëherë çaji në një filxhan me sheqer do të jetë më i ftohtë, sepse. shpërbërja e sheqerit (shkatërrimi i rrjetës së tij kristalore) gjithashtu konsumon energji.
Në ngrica të forta, për të rivendosur butësinë e akullit, shesh patinazhi ujitet me ujë të nxehtë.Uji i nxehtë shkrin shtresën e hollë të sipërme të akullit, nuk ngrin aq shpejt, ka kohë të përhapet dhe sipërfaqja e akullit është shumë e lëmuar.
Përfundim (përfundime)
Shkrirja është kalimi i një lënde nga një gjendje e ngurtë në një gjendje të lëngshme.
Kur nxehet, temperatura e substancës rritet, dhe shpejtësia e lëvizjes termike të grimcave rritet, ndërsa energjia e brendshme e trupit rritet.
Kur temperatura e një trupi të ngurtë arrin pikën e shkrirjes, rrjeta kristalore e lëndës së ngurtë fillon të prishet. Kështu, pjesa kryesore e energjisë së ngrohësit, e përcjellë në trupin e ngurtë, shpenzohet në zvogëlimin e lidhjeve midis grimcave të substancës, d.m.th., në shkatërrimin e rrjetës kristalore. Në këtë rast, energjia e ndërveprimit midis grimcave rritet.
Substanca e shkrirë ka një rezervë më të madhe të energjisë së brendshme sesa në gjendjen e ngurtë. Pjesa e mbetur e nxehtësisë së shkrirjes shpenzohet për të bërë punë për të ndryshuar vëllimin e trupit gjatë shkrirjes së tij.
Gjatë shkrirjes, vëllimi i shumicës së trupave kristalorë rritet (me 3-6%) dhe zvogëlohet gjatë ngurtësimit. Por, ka substanca në të cilat, kur shkrihen, vëllimi zvogëlohet, dhe kur ngurtësohet, rritet. Këto përfshijnë, për shembull, ujin dhe gize, silikon dhe disa të tjerë. . Kjo është arsyeja pse akulli noton në sipërfaqen e ujit, dhe giza e ngurtë - në shkrirjen e tij.
Lëndët e ngurta të quajtura amorfe (qelibar, rrëshirë, qelqi) nuk kanë një pikë shkrirjeje specifike.
Sasia e nxehtësisë e nevojshme për të shkrirë një substancë është e barabartë me produktin e nxehtësisë specifike të shkrirjes shumëfishin e masës së substancës.
Nxehtësia specifike e shkrirjes tregon se sa nxehtësi nevojitet për të kthyer plotësisht 1 kg të një lënde nga një gjendje e ngurtë në një gjendje të lëngshme, e marrë me shpejtësinë e shkrirjes.
Njësia e nxehtësisë specifike të shkrirjes në SI është 1J/kg.
Gjatë procesit të shkrirjes, temperatura e kristalit mbetet konstante. Kjo temperaturë quhet pika e shkrirjes. Çdo substancë ka pikën e vet të shkrirjes.
Pika e shkrirjes për një substancë të caktuar varet nga presioni atmosferik.
Lista e literaturës së përdorur
Të dhënat nga enciklopedia e lirë elektronike "Wikipedia"
en./wiki/Main_page
Faqja "Klasa! Fizikë për kureshtarët" class-fizika.narod/8_11.htm
Faqja e internetit "Vetitë fizike të ujit"
gjithçka për ujin/temperaturën e vlimit.php
Vendi "Metalet dhe strukturat"
metalokonstruksion/osnovy-plavleniya-metallov/
Abstrakte të ngjashme:
Vetia kryesore e një lëngu është një ndryshim në formë nën ndikimin e veprimit mekanik. Lëngje ideale dhe reale. Koncepti i lëngjeve të Njutonit. Metoda për përcaktimin e vetive të një lëngu. Formimi i sipërfaqes së lirë dhe tensioni sipërfaqësor.
Kamçatka Akademia Shtetërore flota e peshkimit ABSTRAKT Me temën: “Ekuilibri fazor dhe transformimet fazore"Shkruar nga: Marrë nga: studenti i IEF Isakov A.Ya.
Kjo nganjëherë quhet nxehtësi latente (Nxehtësia latente quhet sepse procesi i shkrirjes (dhe ngurtësimit) ndodh në temperaturë konstante, ngrohja (ftohja) duket se mungon, megjithëse thithja (lirimi) i nxehtësisë vazhdon). Nxehtësia latente specifike e shkrirjes —është sasia e nxehtësisë e nevojshme për të kthyer një njësi të masës të ngurta në një lëng pa ndryshim të temperaturës. Është gjithashtu sasia e energjisë së nxehtësisë që lëshohet kur një masë njësi e një lëngu kthehet në një të ngurtë pa ndryshim në temperaturë.
Studimi. Përcaktoni nxehtësinë latente specifike të shkrirjes së akullit
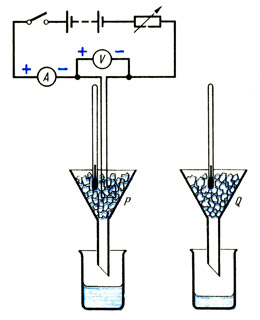 Vendosni sasi të barabarta akulli i thyer në dy hinka identike P dhe Q (shih Fig.). Nëse akulli është marrë nga ngrirja, atëherë duhet të prisni derisa të arrijë një temperaturë prej 0 o C dhe të fillojë të shkrihet. Vendoseni ngrohësin e zhytjes të lidhur me ampermetrin, voltmetrin dhe reostatin në hinkën P në mënyrë që të mbulohet plotësisht me akull.
Vendosni sasi të barabarta akulli i thyer në dy hinka identike P dhe Q (shih Fig.). Nëse akulli është marrë nga ngrirja, atëherë duhet të prisni derisa të arrijë një temperaturë prej 0 o C dhe të fillojë të shkrihet. Vendoseni ngrohësin e zhytjes të lidhur me ampermetrin, voltmetrin dhe reostatin në hinkën P në mënyrë që të mbulohet plotësisht me akull.
Menjëherë pas ndezjes së ngrohësit, vendosni gota të thata me peshë të njohur nën hinkat P dhe Q. Regjistroni leximet e ampermetrit dhe voltmetrit dhe, nëse është e nevojshme, përdorni një reostat për t'i mbajtur ato konstante gjatë eksperimentit. Pas disa minutash, kur të jetë grumbulluar pak ujë në gotën nën hinkën P, shënoni orën, hiqni gotat dhe fikni ngrohësin. Përcaktoni masën e gotave me përmbajtjen e tyre.
Në nxehtësinë latente specifike l ka njësinë J x kg -1. Nëse një substancë me masë m kalon nga gjendje e ngurtë në lëng, atëherë përvetësimi i sasisë së nxehtësisë ΔQ përcaktohet me formulën ΔQ = mƖ.
Supozoni se marrim rezultatet e mëposhtme:
masa e gotës nën P para eksperimentit = m 1 kg
masa e gotës nën P pas eksperimentit = m 2 kg
masa e akullit të shkrirë në P gjatë eksperimentit = (m 2 -m 1) kg
masa e xhamit nën Q para eksperimentit = m 3 kg
masa e qelqit nën Q pas eksperimentit = m 4 kg
masa e akullit të shkrirë në Q gjatë eksperimentit = (m 4 - m 3) kg
Leximi i ampermetrit = I, A
Leximi i voltmetrit = V, V
Koha gjatë së cilës ngrohësi është ndezur = t min = 60t s
Kontrolli i gypit Q. Kjo ju lejon të përcaktoni masën e akullit që u shkri në temperaturën e dhomës gjatë eksperimentit. Do të ishte logjike të supozohet se akulli me të njëjtën masë do të shkrihet në P. Kështu, masa shtesë e akullit të shkrirë nga ngrohësi është:
(m 2 - m 1) - (m 4 - m 3) \u003d m.
Nëse Ɩ - nxehtësia latente specifike e shkrirjes akull, atëherë energji termale, e nevojshme që akulli të shkrihet, do të jetë ml J. Duhet të jetë e barabartë me energji elektrike transmetohet nga ngrohësi, i cili është VI x 60t. Prandaj ml = VI x 60t Ɩ = Vl x 60t / m J x kg -1
Vlera e nxehtësisë specifike të shkrirjes së akullit është 336,000 J x kg -1, ose 336,000 J energji termike e nevojshme për të shkrirë 1 kg akull në 0 °C. E njëjta sasi nxehtësie lirohet kur 1 kg ujë ngrin në 0°C.
Nese nje akull fillestar nën 0°C, do të nevojitet nxehtësi shtesë për të ngritur temperaturën në 0°C përpara se akulli të fillojë të shkrihet.
Shumë shtëpi kanë bodrume dhe perimet shpesh ruhen atje për dimër. Për shkak të vetive izoluese të tokës, bodrumi mbetet relativisht i ftohtë në verë dhe relativisht i ngrohtë në dimër. Kur pritet një dimër i ashpër, në bodrum vendoset një fuçi me ujë. Kur ngrin, energjia e nxehtësisë latente e lëshuar ndihmon në mbajtjen e temperaturës në bodrum afër 0 ° C, gjë që mbron perimet nga ngrirja.






