Sa është presioni i avullit të ngopjes. Varësia e presionit të avullit të ngopur nga temperatura. Duke zier
Tema: Bazat e teorisë kinetike molekulare
Mësimi: Varësia nga presioni avull i ngopur nga temperatura. Duke zier
Në mësimet e mëparshme, ne prezantuam konceptin e një gazi ideal si një model në të cilin të gjithë ligjet e gazit që kemi studiuar. Megjithatë, kjo nuk do të thotë se fizika molekulare dhe, në veçanti, teoria molekulare-kinetike është e kufizuar vetëm në studimin e gazet ideale. Për gazet reale, llogaritjet tona mbi temën "bazat e teorisë molekulare-kinetike", natyrisht, janë të vlefshme. Megjithatë, marrëdhënia ndërmjet parametrave të gazeve reale pritet të ketë një formë paksa të ndryshme nga kjo marrëdhënie për gazet ideale.
Konsideroni një gaz të tillë të vërtetë si avulli i ngopur. Kujtojmë që quhet vetëm traget i paracaktuar gjendje e gaztë një substancë e caktuar (më shpesh, kur thonë "avull", nënkuptojnë saktësisht avujt e ujit). Avulli i ngopur nënkupton sa vijon:
Përkufizimi. Avull i ngopur Një avull në ekuilibër dinamik me lëngun e tij. Kjo do të thotë, numri i molekulave të lëngshme që largohen nga lëngu gjatë një periudhe të caktuar kohore është mesatarisht i barabartë me numrin e molekulave të avullit që kthehen përsëri në lëng (shih Fig. 1). Ekziston gjithmonë një zonë me avull të ngopur mbi çdo sipërfaqe të lëngshme. Për të krijuar një zonë më të gjerë, molekulat e avullit duhet të parandalohen të dalin në mjedis (mbyllni hermetikisht enën).
Për të kuptuar dallimet midis avullit të ngopur dhe një gazi ideal, duhet të imagjinoni dy eksperimente.
Fillimisht, marrim një enë të mbyllur hermetikisht me ujë dhe fillojmë ta ngrohim. Me rritjen e temperaturës, molekulat e lëngshme do të kenë një rritje energjia kinetike, dhe një numër në rritje i molekulave do të jetë në gjendje të shpëtojë nga lëngu (shih Fig. 2), prandaj, përqendrimi i avullit do të rritet dhe, rrjedhimisht, presioni i tij. Pra, pozicioni i parë:

Oriz. 2. T 2 > T 1
Megjithatë, kjo dispozitë është mjaft e pritshme dhe jo aq interesante sa vijon. Nëse vendosni një lëng me avull i ngopur nën pistonin e lëvizshëm dhe filloni ta ulni këtë piston, atëherë, padyshim, përqendrimi i avullit të ngopur do të rritet për shkak të një rënie në vëllim. Sidoqoftë, pas njëfarë kohe, avulli do të lëvizë me lëngun në një ekuilibër të ri dinamik duke kondensuar një sasi të tepërt avulli dhe presioni nuk do të ndryshojë në fund. Pozicioni i dytë i teorisë së avullit të ngopur:
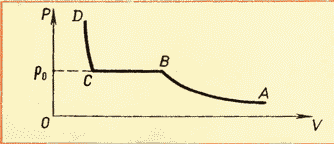
Tani, duhet të theksohet se presioni i avullit të ngopur, megjithëse varet nga temperatura, si një gaz ideal, por natyra e kësaj varësie është disi e ndryshme. Fakti është se, siç e dimë nga ekuacioni bazë i MKT, presioni i gazit varet si nga temperatura ashtu edhe nga përqendrimi i gazit. Prandaj, presioni i avullit të ngopur varet nga temperatura në mënyrë jolineare derisa të rritet përqendrimi i avullit, domethënë derisa të avullojë i gjithë lëngu. Grafiku më poshtë (Fig. 3) tregon natyrën e varësisë së presionit të avullit të ngopur nga temperatura,

Oriz. 3
për më tepër, kalimi nga një seksion jolinear në atë linear nënkupton vetëm pikën e avullimit të të gjithë lëngut. Meqenëse presioni i një gazi të ngopur varet vetëm nga temperatura, është e mundur të përcaktohet absolutisht pa mëdyshje se cila do të jetë presioni i avullit të ngopur në një temperaturë të caktuar. Këto raporte (si dhe vlerat e densitetit të avullit të ngopur) janë renditur në një tabelë të veçantë.
Tani le ta kthejmë vëmendjen tek e rëndësishmja procesi fizik si zierje. Në klasën e tetë, zierja ishte përcaktuar tashmë si një proces avullimi më intensiv se avullimi. Tani do ta zgjerojmë disi këtë koncept.
Përkufizimi. Duke zier- procesi i avullimit që ndodh në të gjithë vëllimin e lëngut. Cili është mekanizmi i zierjes? Fakti është se gjithmonë ka ajër të tretur në ujë, dhe si rezultat i rritjes së temperaturës, tretshmëria e tij zvogëlohet dhe formohen mikroflluska. Meqenëse fundi dhe muret e enës nuk janë krejtësisht të lëmuara, këto flluska ngjiten pas parregullsive në pjesën e brendshme të enës. Tani seksioni ujë-ajër ekziston jo vetëm në sipërfaqen e ujit, por edhe brenda vëllimit të ujit, dhe molekulat e ujit fillojnë të kalojnë në flluska. Kështu, avulli i ngopur shfaqet brenda flluskave. Më tej, këto flluska fillojnë të notojnë, duke u rritur në vëllim dhe duke marrë një numër më të madh molekulash uji në vetvete dhe shpërthejnë pranë sipërfaqes, duke lëshuar avull të ngopur në mjedis (Fig. 4).
Oriz. 4. Procesi i zierjes ()
Kushti për formimin dhe ngjitjen e këtyre flluskave është pabarazia e mëposhtme: presioni i avullit të ngopur duhet të jetë më i madh ose i barabartë me presionin atmosferik.
Kështu, meqenëse presioni i avullit të ngopjes varet nga temperatura, pika e vlimit përcaktohet nga presioni mjedisi: sa më i vogël të jetë, aq më e ulët temperatura vlon lëngu dhe anasjelltas.
Në mësimin tjetër, ne do të fillojmë të shqyrtojmë vetitë e trupave të ngurtë.
Bibliografi
- Myakishev G.Ya., Sinyakov A.Z. Fizika molekulare. Termodinamika. - M.: Bustard, 2010.
- Gendenstein L.E., Dick Yu.I. Klasa e 10-të e fizikës. - M.: Ileksa, 2005.
- Kasyanov V.A. Klasa e 10-të e fizikës. - M.: Bustard, 2010.
- Physics.ru ().
- Chemport.ru ().
- Narod.ru ().
Detyre shtepie
- Faqe 74: Nr 546-550. Fizika. Libri i detyrave. Klasat 10-11. Rymkevich A.P. - M.: Bustard, 2013. ()
- Pse alpinistët nuk mund të ziejnë vezë në lartësi?
- Cilat janë disa mënyra për të ftohur çajin e nxehtë? Arsyetoni ato në aspektin fizik.
- Pse duhet të reduktohet presioni i gazit në djegës pas ujit të vluar?
- * Si mund të ngrohet uji mbi njëqind gradë Celsius?
Njohja me izotermat e një gazi real në temperatura të ndryshme (shih Fig. 6.4) na lejon të konkludojmë se se presioni i avullit të ngopjes rritet me rritjen e temperaturës. Meqenëse presioni i avullit të ngopjes nuk varet nga vëllimi, prandaj varet vetëm nga temperatura. Megjithatë, varësia p (T), gjetur eksperimentalisht, nuk është proporcional, si në një gaz ideal në vëllim konstant(Ligji i Charles). Me rritjen e temperaturës, presioni i avullit të ngopur rritet më shpejt se presioni i një gazi ideal (Fig. 6.5, seksioni i kurbës AB). Kjo bëhet veçanërisht e dukshme nëse vizatojmë një izokore përmes pikës POR(vija e nderprere). Pse po ndodh kjo?
Kur një lëng nxehet me avull në një enë të mbyllur, një pjesë e lëngut kthehet në avull. Ndërsa temperatura rritet, shpejtësia e avullimit rritet dhe ekuilibri midis lëngut dhe avullit është i shqetësuar. Përqendrimi i molekulave dhe, rrjedhimisht, densiteti i avullit rritet. Kjo vazhdon derisa dendësia e avullit të rritet aq shumë sa që procesi i kondensimit të balancojë procesin e avullimit. Si rezultat, sipas formulës p =nkT presioni i avullit të ngopur rritet jo vetëm për shkak të rritjes së temperaturës, por edhe për shkak të rritjes së përqendrimit të molekulave (densitetit) të avullit. Në këtë rast, roli kryesor në rritjen e presionit të avullit të ngopur luhet nga rritja e përqendrimit të molekulave të avullit, dhe jo rritja e temperaturës së tij.
Dallimi kryesor në sjelljen e një gazi ideal dhe avullit të ngopur është se kur ndryshon temperatura e avullit në një enë të mbyllur (ose kur vëllimi i avullit ndryshon në një temperaturë konstante), masa e avullit ndryshon. Lëngu pjesërisht shndërrohet në avull ose, anasjelltas, avulli kondensohet pjesërisht. NGA gaz ideal nuk ndodh asgje e tille.
Kur i gjithë lëngu avullon, avulli, pas ngrohjes së mëtejshme, do të pushojë së qeni i ngopur dhe presioni i tij në vëllim konstant do të rritet në përpjesëtim të drejtë me temperaturën absolute në përputhje me ligjin e Charles (shih Fig. 6.5, seksioni BC).
Izotermat e një gazi real, të marra në mënyrë eksperimentale, përshkruajnë gjendjen e gazit, ekuilibrin ndërmjet gazit dhe lëngut dhe gjendjen e lëngshme. Ato mund të përdoren për të gjurmuar varësinë e presionit të avullit të ngopur nga temperatura.
§ 6.4. temperaturë kritike. Situata kritike
Substanca mund të jetë në gjendje e lëngët jo në asnjë temperaturë. Ka një kufi.
Temperatura kritike
Në temperatura mjaft të larta, seksioni horizontal i izotermës së një gazi të vërtetë (shih Fig. 6.4) bëhet shumë i shkurtër dhe në një temperaturë të caktuar kthehet në një pikë (në Fig. 6.4 - pika TO). Kjo temperaturë quhet kritike. Temperatura kritike është temperatura në të cilën ndryshojnë vetitë fizike ndërmjet një lëngu dhe një avulli në ekuilibër dinamik me të. Çdo substancë ka temperaturën e vet kritike. Për shembull, temperatura kritike për dioksidin e karbonit CO 2 është t te = 31 ° С, dhe për ujë - t te = 374 °С.
Situata kritike
Gjendja që korrespondon me një pikë TE, në të cilin pjesa horizontale e izotermës kthehet në një temperaturë T = T te , quhet gjendje kritike (pika kritike). Presioni dhe vëllimi në këtë gjendje quhen kritike. Presioni kritik për dioksidin e karbonit është 7.4 10 6 Pa (73 atm), dhe për ujin 2.2 10 7 Pa (218 atm). Në gjendje kritike, lëngu ka një vëllim maksimal dhe avull të ngopur- presion maksimal.
Varësia e presionit të avullit të ngopur nga temperatura. Gjendja e avullit të ngopur përshkruhet përafërsisht nga ekuacioni i gjendjes së një gazi ideal (3.4), dhe presioni i tij përcaktohet afërsisht nga formula
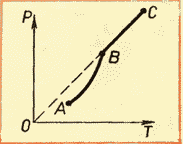
Ndërsa temperatura rritet, presioni rritet. Meqenëse presioni i avullit të ngopjes nuk varet nga vëllimi, prandaj varet vetëm nga temperatura.
Megjithatë, kjo varësi e gjetur eksperimentalisht nuk është drejtpërdrejt proporcionale, si në një gaz ideal me vëllim konstant. Me rritjen e temperaturës, presioni i avullit të ngopur rritet më shpejt se presioni i një gazi ideal (Fig. 52, seksioni i kurbës AB).
Kjo ndodh për arsyen e mëposhtme. Kur një lëng nxehet me avull në një enë të mbyllur, një pjesë e lëngut kthehet në avull. Si rezultat, sipas formulës (5.1), presioni i avullit rritet jo vetëm për shkak të rritjes së temperaturës, por edhe për shkak të rritjes së përqendrimit të molekulave (densitetit) të avullit. Dallimi kryesor në sjelljen e një gazi ideal dhe avullit të ngopur është se kur temperatura e avullit në një enë të mbyllur ndryshon (ose kur vëllimi ndryshon në temperaturë konstante) masa e avullit ndryshon. Lëngu pjesërisht shndërrohet në avull ose, anasjelltas, avulli kondensohet pjesërisht. Asgjë e tillë nuk ndodh me një gaz ideal.
Kur i gjithë lëngu avullon, avulli, pas ngrohjes së mëtejshme, do të pushojë së qeni i ngopur dhe presioni i tij në vëllim konstant do të rritet në proporcion të drejtë me temperaturë absolute(Seksioni BC në figurën 52).
Duke zier. Varësia e presionit të avullit të ngopjes nga temperatura shpjegon pse pika e vlimit të një lëngu varet nga presioni. Kur zien, formohen flluska avulli që rriten me shpejtësi në të gjithë vëllimin e lëngut, të cilat notojnë në sipërfaqe. Natyrisht, një flluskë avulli mund të rritet kur presioni i avullit të ngopur brenda tij tejkalon pak presionin në lëng, që është shuma e presionit të ajrit në sipërfaqen e lëngut (presioni i jashtëm) dhe presioni hidrostatik i kolonës së lëngshme.
Zierja fillon në një temperaturë në të cilën presioni i avullit të ngopjes në flluska është i barabartë me presionin në lëng.
Sa më i madh të jetë presioni i jashtëm, aq më e lartë është pika e vlimit. Kështu, në një presion në një kazan me avull që arrin Pa, uji nuk zihet as në një temperaturë prej 200°C. Në institucionet mjekësore, uji i vluar në enë të mbyllura hermetikisht - autoklavë (Fig. 53) - ndodh gjithashtu në presion të ngritur. Prandaj, pika e vlimit është shumë më e lartë se 100 ° C. Autoklavat përdoren për sterilizimin e instrumenteve kirurgjikale, veshjeve, etj.
Në të kundërt, duke ulur presionin, ne ulim kështu pikën e vlimit. Duke pompuar ajrin dhe avujt e ujit nga balona, mund ta bëni ujin të vlojë në temperaturën e dhomës (Fig. 54). Kur ngjiten në male Presioni i atmosferës zvogëlohet. Prandaj, pika e vlimit zvogëlohet. Në lartësi


7134 m (Maja e Leninit në Pamirs) presioni është afërsisht i barabartë me Pa (300 mm Hg). Pika e vlimit të ujit atje është rreth 70 °C. Është e pamundur të gatuash, për shembull, mish në këto kushte.
Dallimi në pikat e vlimit të lëngjeve përcaktohet nga ndryshimi në presionin e tyre avujt e ngopur. Sa më i lartë të jetë presioni i avullit të ngopur, aq më e ulët është pika e vlimit të lëngut përkatës, pasi në temperatura më të ulëta presioni i avullit të ngopur bëhet i barabartë me presionin atmosferik. Për shembull, në 100 ° C, presioni i avullit të ujit të ngopur është (760 mm Hg), dhe avulli i merkurit është vetëm 117 Pa (0,88 mm Hg). Mërkuri vlon në 357°C në presion normal.
temperaturë kritike. Me një rritje të temperaturës, njëkohësisht me një rritje të presionit të avullit të ngopur, rritet edhe dendësia e tij. Dendësia e një lëngu në ekuilibër me avullin e tij, përkundrazi, zvogëlohet për shkak të zgjerimit të lëngut kur nxehet. Nëse në një figurë vizatojmë kthesa për varësinë e densitetit të lëngut dhe avullit të tij nga temperatura, atëherë për lëngun kurba do të ulet, dhe për avullin do të rritet (Fig. 55).
Në një temperaturë të caktuar, të quajtur kritike, të dyja kthesat bashkohen, d.m.th., dendësia e lëngut bëhet e barabartë me densitetin e avullit.

Temperatura kritike është temperatura në të cilën zhduken ndryshimet në vetitë fizike midis lëngut dhe avullit të tij të ngopur.
Në temperaturën kritike, densiteti (dhe presioni) i avullit të ngopur bëhet maksimal, dhe dendësia e lëngut në ekuilibër me avull bëhet minimale. Nxehtësia specifike avullimi zvogëlohet me rritjen e temperaturës dhe bëhet zero në temperaturën kritike.
Çdo substancë ka temperaturën e vet kritike. Për shembull, temperatura kritike e ujit, ndërsa monoksidi i karbonit të lëngshëm (IV)






