Sasia e nxehtësisë e nevojshme për shkrirjen e akullit në ujë. Nxehtësia specifike e shkrirjes
Gjatë shkrirjes, rrjeta hapësinore shkatërrohet trup kristalor. Ky proces konsumon një sasi të caktuar energjie nga një burim i jashtëm. Si rezultat, energjia e brendshme e trupit rritet gjatë procesit të shkrirjes.
Sasia e nxehtësisë e nevojshme për të lëvizur një trup nga gjendje e ngurtë në një lëng në pikën e tij të shkrirjes quhet nxehtësia e shkrirjes.
Në procesin e ngurtësimit të trupit, përkundrazi, energjia e brendshme e trupit zvogëlohet. Trupi u jep nxehtësi trupave përreth. Sipas ligjit të ruajtjes së energjisë, sasia e nxehtësisë së përthithur nga një trup gjatë shkrirjes (në temperaturën e shkrirjes) është e barabartë me sasinë e nxehtësisë që lëshohet nga ky trup gjatë ngurtësimit (në temperaturën e ngurtësimit).
Nxehtësia specifike e shkrirjes
Nxehtësia e shkrirjes varet nga masa e substancës së shkrirjes dhe vetitë e saj. Varësia e nxehtësisë së shkrirjes nga lloji i substancës karakterizohet nga nxehtësia specifike e shkrirjes së kësaj substance.
Nxehtësia specifike e shkrirjes së një lënde është raporti i nxehtësisë së shkrirjes së një trupi nga kjo substancë me masën e trupit.
Le të shënojmë nxehtësinë e shkrirjes përmes P pl , pesha e trupit t dhe nxehtësia specifike e shkrirjes me shkronjën λ . Pastaj
Kështu, për të shkrirë një trup kristalor me një masë m, e marrë në temperaturën e shkrirjes, sasia e nxehtësisë së kërkuar është e barabartë me
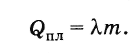 (8.8.2)
(8.8.2)
Nxehtësia e kristalizimit
Sipas ligjit të ruajtjes së energjisë, sasia e nxehtësisë që çlirohet gjatë kristalizimit të një trupi (në temperaturën e kristalizimit) është e barabartë me
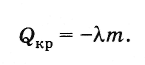 (8.8.3)
(8.8.3)
Nga formula (8.8.1) rezulton se nxehtësia specifike e shkrirjes në SI shprehet në xhaul për kilogram.
Nxehtësia specifike e shkrirjes së akullit është mjaft e lartë, 333.7 kJ/kg. Nxehtësia specifike Plumbi i shkrirjes është vetëm 23 kJ / kg, dhe ari - 65.7 kJ / kg.
Formulat (8.8.2) dhe (8.8.3) përdoren në zgjidhjen e problemeve për përpilimin e ekuacioneve të bilancit të nxehtësisë në rastet kur kemi të bëjmë me shkrirjen dhe ngurtësimin e trupave kristalorë.
Roli i nxehtësisë së shkrirjes së akullit dhe kristalizimit të ujit në natyrë
Thithja e nxehtësisë gjatë shkrirjes së akullit dhe lirimi i saj gjatë ngrirjes së ujit kanë një efekt të rëndësishëm në ndryshimin e temperaturës së ajrit, veçanërisht pranë trupave ujorë. Të gjithë ju me siguri e keni vënë re se gjatë reshjeve të mëdha të borës, zakonisht fillon ngrohja.
Shume e rendesishme rëndësi të madhe nxehtësia specifike e shkrirjes së akullit. Edhe në fund të shekullit XVIII. Shkencëtari skocez D. Black (1728-1799), i cili zbuloi ekzistencën e nxehtësisë së shkrirjes dhe kristalizimit, shkroi: "Nëse akulli nuk do të kishte një nxehtësi të konsiderueshme shkrirjeje, atëherë në pranverë e gjithë masa e akullit do të duhej të shkrihej. në pak minuta ose sekonda, pasi nxehtësia nga ajri transferohet vazhdimisht në akull. Por atëherë pasojat e kësaj do të ishin të tmerrshme: në fund të fundit, edhe në situatën ekzistuese, përmbytjet e mëdha dhe rrjedhat e forta të ujit ndodhin kur masa të mëdha akulli dhe bore shkrihen.
Grykë rakete hapësinore
Le të japim një shembull teknik interesant të përdorimit praktik të nxehtësisë së shkrirjes dhe avullimit. Në prodhimin e hundës për raketë hapësinore Duhet të kihet parasysh se rryma e gazrave që del nga gryka e raketës ka një temperaturë prej rreth 4000 °C. Në natyrë, praktikisht nuk ka materiale që, në formën e tyre të pastër, mund të përballojnë një temperaturë të tillë. Prandaj, është e nevojshme të drejtoheni në të gjitha llojet e mashtrimeve për të ftohur materialin e hundës gjatë djegies së karburantit.
Gryka është bërë nga metalurgjia pluhur. Pluhuri metalik zjarrdurues (volframi) vendoset në zgavrën e kallëpit. Pastaj i nënshtrohet ngjeshjes. Pluhuri shkrihet, duke rezultuar në një strukturë poroze të ngjashme me shtufin. Pastaj ky "shtuf" është i ngopur me bakër (pika e tij e shkrirjes është vetëm 1083 ° C).
Materiali që rezulton quhet pseudoaliazh. Figura 8.31 tregon një fotografi të mikrostrukturës së pseudoaliazhit. Në sfondin e bardhë të kornizës së tungstenit, janë të dukshme përfshirjet e bakrit me formë të parregullt. Kjo aliazh, sado e pabesueshme mund të duket, mund të funksionojë për një kohë të shkurtër edhe në temperaturën e gazrave të formuar gjatë djegies së karburantit, d.m.th., mbi 4000 ° C.

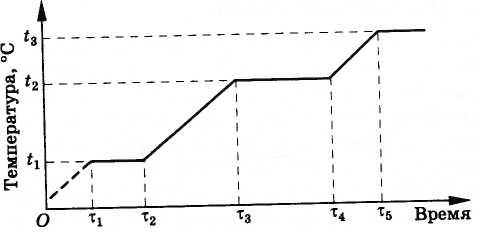
Kjo ndodh në mënyrën e mëposhtme. Fillimisht, temperatura e aliazhit rritet derisa të arrijë pikën e shkrirjes së bakrit t 1 (Fig. 8.32). Pas kësaj, temperatura e hundës nuk do të ndryshojë derisa i gjithë bakri të shkrihet (intervali kohor nga τ 1 deri në τ 2 ). Në të ardhmen, temperatura rritet përsëri derisa bakri të vlojë. Kjo ndodh në një temperaturë t 2 = 2595 °С, më e ulët se pika e shkrirjes së tungstenit (3380 °С). Derisa i gjithë bakri të vlojë, temperatura e grykës nuk do të ndryshojë përsëri, pasi bakri që avullohet merr nxehtësi nga tungsteni (intervali kohor nga τ 3 deri në τ 4 ). Natyrisht, hunda nuk do të funksionojë për aq kohë sa dëshironi. Pasi bakri të jetë avulluar, tungsteni do të fillojë të nxehet përsëri. Sidoqoftë, motori i raketës funksionon vetëm për disa minuta, dhe gjatë kësaj kohe hunda nuk ka kohë të nxehet dhe shkrihet.
[redakto | redakto tekstin wiki]
Nga Wikipedia, Enciklopedia e Lirë
Nxehtësia specifike e shkrirjes(gjithashtu: entalpia e shkrirjes; ekziston edhe një koncept ekuivalent nxehtësia specifike e kristalizimit) - sasia e nxehtësisë që duhet të raportohet në një njësi të masës substancë kristalore në një proces ekuilibër izobarizotermik për ta transferuar atë nga gjendja e ngurtë (kristaline) në atë të lëngshme (e njëjta sasi nxehtësie lirohet gjatë kristalizimit të një lënde).
Nxehtësia e shkrirjes - rast i veçantë ngrohtësi tranzicioni fazor Unë i sjellshëm.
Dalloni nxehtësinë specifike të shkrirjes (J/kg) dhe molare (J/mol).
Nxehtësia specifike e shkrirjes shënohet me shkronjën (gërma greke lambda) Formula për llogaritjen e nxehtësisë specifike të shkrirjes: , ku është nxehtësia specifike e shkrirjes, është sasia e nxehtësisë që merr substanca gjatë shkrirjes (ose e çliruar gjatë kristalizimit), është masa e substancës shkrirëse (kristalizuese).
Trupi i fortë është gjendja e grumbullimit një substancë e karakterizuar nga qëndrueshmëria e formës dhe natyra e lëvizjes termike të atomeve që bëjnë dridhje të vogla rreth pozicioneve të ekuilibrit. Të dallojë trupat e ngurtë kristalorë dhe amorfë (shih rendin me rreze të gjatë dhe me rreze të shkurtër). Kristalet karakterizohen nga periodiciteti hapësinor në rregullimin e pozicioneve të ekuilibrit të atomeve. Në trupat amorfë, atomet dridhen rreth pikave të vendosura rastësisht. Sipas koncepteve klasike, një gjendje e qëndrueshme (me një minimum energji potenciale) i një trupi të ngurtë është kristalor. trup amorfështë në gjendje metastabile dhe me kalimin e kohës duhet të kalojë në një gjendje kristalore, por koha e kristalizimit është shpesh aq e gjatë saqë metastabiliteti nuk shfaqet fare.Atomet dhe molekulat që përbëjnë një të ngurtë janë të mbushura dendur së bashku. Me fjalë të tjera, molekulat e një trupi të ngurtë praktikisht ruajnë pozicionin e tyre të ndërsjellë në raport me molekulat e tjera dhe mbahen së bashku nga ndërveprimet ndërmolekulare. Shumë lëndë të ngurta përmbajnë struktura kristalore. Në mineralogji dhe kristalografi, një strukturë kristalore i referohet një renditje të caktuar atomesh në një kristal. Struktura kristalore përbëhet nga qeliza elementare, një grup atomesh të rregulluar në një rend të veçantë, i cili përsëritet periodikisht në të gjitha drejtimet e rrjetës hapësinore. Distancat ndërmjet elementeve të kësaj rrjete në drejtime të ndryshme quhen parametri i kësaj rrjete. Struktura kristalore dhe simetria luajnë një rol në përcaktimin e një sërë vetive të tilla si ndarja e kristalit, struktura e brezit elektronik dhe vetitë optike. Kur ushtrohet forcë e mjaftueshme, secila nga këto veti mund të thyhet, duke shkaktuar deformim të përhershëm. Lëndët e ngurta kanë energji termike, prandaj atomet e tyre bëjnë lëvizje lëkundëse. Mirëpo kjo lëvizje është e papërfillshme dhe nuk mund të vërehet apo ndjehet në kushte normale.Gjendja kristalore
Atomet që përbëjnë gazet, lëngjet dhe trupat e ngurtë kanë shkallë të ndryshme të rendit. Në një gaz, atomet dhe grupet e vogla të atomeve të lidhura për të formuar molekula janë në lëvizje të rastësishme të vazhdueshme. Nëse gazi ftohet, atëherë arrihet temperatura në të cilën molekulat afrohen me njëra-tjetrën sa më shumë që të jetë e mundur dhe formohet një lëng. Por atomet dhe molekulat e një lëngu ende mund të rrëshqasin në lidhje me njëri-tjetrin. Kur ftohen disa lëngje, si uji, arrihet një temperaturë në të cilën molekulat ngrijnë në palëvizshmërinë relative të gjendjes kristalore. Kjo temperaturë, e cila është e ndryshme për të gjitha lëngjet, quhet pika e ngrirjes. (Uji ngrin në 0 ° C; në të njëjtën kohë, molekulat e ujit janë të lidhura rregullisht me njëra-tjetrën, duke formuar një figurë të rregullt gjeometrike.) Çdo grimcë e një substance (atom ose molekulë) në një gjendje kristalore ka të njëjtin mjedis si çdo tjetër grimca e të njëjtit lloj në të gjithë kristalin. Me fjalë të tjera, ai është i rrethuar nga grimca të përcaktuara mirë të vendosura në distanca të përcaktuara mirë prej tij. Është ky rregullim i renditur tredimensional që është karakteristik për kristalet dhe i dallon ato nga trupat e tjerë të ngurtë.
Gjendja amorfe është e ndërmjetme midis kristalores dhe gazit: grimcat janë të renditura më pak të rregullta sesa në një kristal, por gjithashtu më pak rastësisht sesa në gaz.
Përkthyer nga greqishtja, "amorf" do të thotë "pa formë". Këto substanca morën një emër të tillë sepse, ndryshe nga kristalet, ato natyrisht nuk kanë formën e poliedrës.
Nëse shkrirja ftohet me shpejtësi e lartë, atëherë lëngu ngurtësohet pa filluar të kristalizohet. Atomet thjesht nuk kanë kohë të rreshtohen në një grilë dhe të ruajnë rregullimin kaotik karakteristik të një lëngu. Megjithatë, ajo nuk është më e lëngshme, por të ngurta. Viskoziteti i tij është shumë më i madh se ai i një lëngu dhe është i afërt me atë të një kristali.
Shkalla e ftohjes që kërkohet për të marrë një gjendje amorfe varet shumë nga natyra e substancës, kryesisht nga viskoziteti i saj: shkrihet më viskoz
më shpesh ngrijnë në formën e syzeve. Pra, xhami i zakonshëm mund të merret thjesht duke ftohur shkrirjen në ajër. Është praktikisht e pamundur të merren metale të pastra në një gjendje amorfe, dhe disa lidhje janë të mundshme. Me shpejtësi ftohjeje që tejkalojnë një milion gradë në sekondë, ishte e mundur të përftoheshin "xhama metalikë" - lidhje metalike amorfe (AMS).
AMS kanë veti të larta magnetike dhe pothuajse asnjë humbje magnetike, kështu që ato janë të domosdoshme për prodhimin e bërthamave të transformatorëve, kokave magnetike për regjistrimin e zërit dhe videove, etj.
Sukseset në zhvillimin e shumë fushave të teknologjisë janë kryesisht për shkak të krijimit të llojeve të reja të syzeve dhe materialeve të bazuara në to. Për shkak të homogjenitetit të gjendjes amorfe dhe mungesës së defekteve të natyrshme në kristal, gotat kanë një numër karakteristikash jashtëzakonisht të rëndësishme: transparencë në vargje të ndryshme të dridhjeve elektromagnetike, rezistencë kimike, qëndrueshmëri, fortësi, izolues elektrik dhe veti të tjera fizike dhe kimike. Xhama të tillë përdoren gjerësisht në jetën e përditshme, në ndërtim, në prodhimin e tubave me rreze katodike, izolatorëve elektrikë për linjat e tensionit të lartë, fibrave të ndryshme të xhamit, fibrave optike, lubrifikantëve të xhamit etj.
Trajtimi i ujit
Filtrat e shtambës, fishekë
Karakteristikat e akullit për modifikimet e tij
Mesazh:
Përshëndetje Oleg, unë jam student i vitit të dytë të shtetit Kuzbass instituti teknik, duke bërë punë shkencore. Dhe u përballa me një problem: nuk mund t'i gjej askund vetitë e akullit për të gjitha modifikimet e tij (nxehtësia specifike e shkrirjes, rezistenca specifike, shpejtësia e përhapjes së tërthortë dhe gjatësore valët e zërit, Koeficient thithjen e këtyre valëve, tendencën për plasaritje, si dhe vetitë mekanike). A mund të më "hedhni" informacionin e njohur për këto çështje, për të cilat do t'ju jem sinqerisht mirënjohës.
Përshëndetje Dmitry.
Fatkeqësisht e tillë informacion të plotë për vetitë fizike dhe mekanike, nuk kam, pasi nuk kam studiuar në mënyrë specifike akullin dhe vetitë e tij. Ja çfarë di për këtë temë:
Në natyrë, njihen 14 modifikime të akullit. Vërtetë, gjithçka, përveç akullit që është i njohur për ne, i cili kristalizohet në singoninë gjashtëkëndore dhe përcaktohet si akulli I, formohet në kushte ekzotike - në temperatura shumë të ulëta (rreth -110150 0 C) dhe presione të larta, kur këndet e lidhjeve hidrogjenore në molekulën e ujit ndryshojnë dhe formohen sisteme, përveç gjashtëkëndore. Kushtet e tilla të kujtojnë kushtet kozmike dhe nuk gjenden në Tokë. Për shembull, në temperatura nën -110 ° C, avulli i ujit precipiton në një pllakë metalike në formën e oktaedronëve dhe kubeve me madhësi disa nanometra - ky është i ashtuquajturi akull kub. Nëse temperatura është pak mbi -110 °C dhe përqendrimi i avullit është shumë i ulët, një shtresë jashtëzakonisht e dendur akull amorf.
Disa të dhëna mbi modifikimet strukturore të akullit, temperaturës, presionit, densitetit dhe përshkueshmërisë janë paraqitur në Tabelën 1 dhe Tabelën 2.
Tab. një . - Disa të dhëna për strukturat e modifikimeve të akullit
Shënim. 1A=10 -10 m.
Tab. 2 . - Temperatura, presioni, dendësia dhe konstanta dielektrike akull të ndryshëm
Kristalet e të gjitha modifikimeve të akullit janë ndërtuar nga molekulat e ujit H 2 O, të lidhura me lidhje hidrogjeni në një kornizë tre-dimensionale ( oriz. një ). Molekula e ujit mund të imagjinohet thjesht si një tetraedron (piramidë me bazë trekëndore). Në qendër të tij është një atom oksigjeni, në dy kulme - nga një atom hidrogjeni, elektronet e të cilit janë të përfshirë në formimin lidhje kovalente me oksigjen. Dy kulmet e mbetura janë të zëna nga çifte elektronet e valencës oksigjen, të cilët nuk marrin pjesë në formimin e lidhjeve intramolekulare, prandaj quhen të vetmuar.
Fig.1 . Struktura e akullitI.
Akulli është më i studiuari Imodifikimi natyror. Në strukturën e akullit, çdo molekulë uji merr pjesë në 4 lidhje të drejtuara në majat e tetraedrit. Kur një proton i një molekule ndërvepron me një palë elektrone oksigjeni të pandarë të një molekule tjetër, lind një lidhje hidrogjeni, e cila është më pak e fortë se një lidhje intramolekulare, por mjaft e fuqishme për të mbajtur molekulat ngjitur të ujit afër. Çdo molekulë mund të formojë njëkohësisht katër lidhje hidrogjeni me molekula të tjera në kënde të përcaktuara rreptësisht të barabarta me 109 ° 28 "të drejtuara në kulmet e tetraedrit, të cilat nuk lejojnë krijimin e një strukture të dendur gjatë ngrirjes. Në të njëjtën kohë, në strukturat e akullit I, Ic, VII dhe VIII ky katërkëndor është i saktë. Në strukturat e akullit II, III, V dhe VI tetraedrat janë dukshëm të shtrembëruara. Në strukturat e akullit VI, VII dhe VIII Mund të dallohen 2 sisteme të ndërthurura të lidhjeve hidrogjenore. Kjo skelë e padukshme e lidhjeve hidrogjenore i rregullon molekulat në një rrjet rrjetë, të ngjashëm në strukturë me një huall mjalti me kanale të zbrazëta. Nëse akulli nxehet, struktura e rrjetit do të shembet: molekulat e ujit fillojnë të bien në zbrazëtirat e rrjetit, duke çuar në një strukturë të lëngshme më të dendur - prandaj, uji më i rëndë se akulli.
Pjesa më e madhe në strukturën e akullit dhe vetitë e tij duket e pazakontë. Në nyjet e rrjetës kristalore të akullit, atomet e oksigjenit janë rregulluar në mënyrë të rregullt, duke formuar gjashtëkëndësha të rregullt dhe atomet e hidrogjenit zënë një sërë pozicionesh përgjatë lidhjeve. Prandaj, janë të mundshme 6 orientime ekuivalente të molekulave të ujit në lidhje me fqinjët e tyre. Disa prej tyre janë të përjashtuara, pasi prania e 2 protoneve në të njëjtën kohë në të njëjtën lidhje hidrogjeni nuk ka gjasa, por mbetet një pasiguri e mjaftueshme në orientimin e molekulave të ujit. Kjo sjellje e atomeve është atipike, pasi në një lëndë të ngurtë të gjithë i binden të njëjtit ligj: ose të gjithë atomet janë të renditur, dhe pastaj është një kristal, ose rastësisht, dhe më pas është një substancë amorfe. Një strukturë e tillë e pazakontë mund të realizohet në shumicën e modifikimeve të akullit - I, III, V, VI dhe VII(dhe me sa duket në Unë C), dhe në strukturën e akullit II, VIII dhe IX molekulat e ujit janë të renditura në mënyrë orientuese. Sipas J. Bernal, akulli është kristalor në raport me atomet e oksigjenit dhe i qelqtë në raport me atomet e hidrogjenit.
Megjithatë, akulli i zakonshëm, i cili formohet gjatë presioni atmosferik dhe shkrihet në 0 ° C - substanca më e njohur, por ende e pa kuptuar plotësisht. Në lidhje me e përhapur uji dhe akulli në Tokë, ndryshimi midis vetive të akullit dhe vetive të substancave të tjera luan një rol të rëndësishëm në proceset natyrore. Për shkak të densitetit të tij më të ulët se ai i ujit, akulli formon një mbulesë lundruese në sipërfaqen e ujit, e cila mbron lumenjtë dhe rezervuarët nga ngrirja e poshtme. Marrëdhënia midis shpejtësisë së rrjedhës dhe stresit në akullin polikristalor është hiperbolike; me një përshkrim të përafërt të tij me një ekuacion të fuqisë, eksponenti rritet me rritjen e tensionit.
Për më tepër, shpejtësia e rrjedhjes së akullit është drejtpërdrejt proporcionale me energjinë e aktivizimit dhe në përpjesëtim të kundërt me temperaturë absolute, kështu që me uljen e temperaturës, akulli në vetitë e tij afrohet absolutisht trup i fortë. Mesatarisht, në një temperaturë afër shkrirjes, rrjedhshmëria e akullit është 106 herë më e lartë se ajo e shkëmbinjve. Për shkak të rrjedhshmërisë së tij, akulli nuk grumbullohet në një vend, por vazhdimisht lëviz në formën e akullnajave.
Akulli është i vështirë për t'u shkrirë, pa marrë parasysh sa e çuditshme tingëllon. Nëse nuk do të kishte lidhje hidrogjeni që lidhin molekulat e ujit, ai do të shkrihej në -90°C. Në të njëjtën kohë, gjatë ngrirjes, uji nuk zvogëlohet në vëllim, siç ndodh me shumicën substancave të njohura, dhe rritet - për shkak të formimit të një strukture rrjeti të akullit.
Për shkak të reflektueshmërisë shumë të lartë të akullit (0,45) dhe borës (deri në 0,95), sipërfaqja e mbuluar prej tyre është mesatarisht rreth 72 milionë hektarë në vit. km 2 në gjerësi të larta dhe të mesme të të dy hemisferave - merr nxehtësi diellore 65% më pak se norma dhe është një burim i fuqishëm ftohjeje sipërfaqen e tokës, e cila në masë të madhe përcakton zonalitetin klimatik modern gjerësor. Në verë, në rajonet polare, rrezatimi diellor është më i madh se në brezin ekuatorial, megjithatë, temperatura mbetet e ulët, pasi një pjesë e konsiderueshme e nxehtësisë së absorbuar shpenzohet në shkrirjen e akullit, i cili ka një nxehtësi shkrirjeje shumë të lartë.
Veti të tjera të pazakonta të akullit përfshijnë gjenerimin rrezatimi elektromagnetik kristalet e saj në rritje. Dihet se shumica e papastërtive të tretura në ujë nuk transferohen në akull kur ai fillon të rritet; ngrijnë. Prandaj, edhe në pellgun më të ndotur, filmi i akullit është i pastër dhe transparent. Në këtë rast, papastërtitë grumbullohen në kufirin e mediave të ngurta dhe të lëngshme, në formën e dy shtresave. ngarkesat elektrike shenjë të ndryshme, të cilat shkaktojnë një ndryshim të rëndësishëm potencial. Shtresa e ngarkuar e papastërtive lëviz së bashku me kufirin e poshtëm akull i ri dhe lëshon valë elektromagnetike. Falë kësaj, procesi i kristalizimit mund të vëzhgohet në detaje. Kështu, një kristal që rritet në gjatësi në formën e një gjilpëre rrezaton ndryshe nga ai i mbuluar me procese anësore, dhe rrezatimi i kokrrave në rritje ndryshon nga ai që ndodh kur kristalet plasariten. Nga forma, sekuenca, frekuenca dhe amplituda e pulseve të rrezatimit, mund të përcaktohet shpejtësia me të cilën ngrin akulli dhe çfarë lloj strukture akulli fitohet.
Tab. 3 . - Disa veti të akullit I
| Prona | Kuptimi | shënim |
| Kapaciteti i nxehtësisë, kal/(G°C) nxehtësia e shkrirjes, kal/g Nxehtësia e avullimit, kal/g | Zvogëlohet fuqishëm me uljen e temperaturës |
|
| Koeficienti i zgjerimit termik, 1/°C | 9,1 10 -5 (0°C) | |
| Përçueshmëri termike, kal/(cm sek°C) | ||
| Indeksi i thyerjes: për një rreze të zakonshme për traun e jashtëzakonshëm | ||
| Përçueshmëri elektrike specifike, ohm -1 · cm -1 | Energjia e dukshme e aktivizimit 11 kcal/mol |
|
| përçueshmëria elektrike sipërfaqësore, ohm -1 | Energjia e dukshme e aktivizimit 32 kcal/mol |
|
| Moduli i Young dynes/cm | 9 10 10 (-5°C) | Polikristaline akull |
| Rezistenca, Mn/m 2 : dërrmuese | Akull polikristalor Akull polikristalor Akull polikristalor |
|
| Viskoziteti mesatar efektiv, pz | Akull polikristalor |
|
| Eksponent i ligjit të fuqisë së rrjedhës | ||
| Energjia e aktivizimit gjatë deformimit dhe relaksimit mekanik, kcal/mol | Rritje lineare me 0.0361 kcal/(nishan°C) 0 deri në 273,16 K |
Shënim. 1 kalori / (g ° C) \u003d 4,186 kjl(kg(TO) ; 1 ohm -1 cm -1 =100 sim/m; 1 dynes/cm=10 -3 n/m; 1 kal/(cm(sek°С)=418.68 e marte/(m(TO) ; 1 pz= 10 -1 n(sek/m 2 .
Natyrore akullI zakonisht shumë më i pastër se uji, sepse tretshmëria e substancave (përveç NH 4 F) në akull është jashtëzakonisht e ulët. Ice II, nga ana tjetër, stabilizohet vetëm në prani të gazrave gjurmë; në formën e tij të pastër, askush nuk e mori atë për shkak të paqëndrueshmërisë së tij. Nëse, për shembull, krijohet presion me ndihmën e heliumit, ai me siguri do të shpërndahet në ujë të ngrirë. Ka prova që argoni, një tjetër gaz inert i përshtatshëm për t'u përdorur në këtë strukturë, është gjithashtu i aftë të formojë zgjidhje të ngurta me akull. Sidoqoftë, askush nuk ka studiuar në mënyrë specifike komponime të tilla klathrate të akullit me gazra fisnikë.
Modifikimet e Ice II, III dhe V ruhet për një kohë të gjatë në presion atmosferik, nëse temperatura nuk kalon -170°C. Kur nxehet në afërsisht -150 ° C, akulli shndërrohet në akull kubUnë C.
E vendosur akull II në diagramin e gjendjes ndërmjet Akull III dhe akull IX. Ato ndryshojnë nga njëri-tjetri në renditjen e protoneve, ndërsa korniza e tyre e oksigjenit është e njëjtë: spirale të disa molekulave të ujit, sikur të varura në boshtet e molekulave të tjera të ujit. Kur probabilitetet që një proton të zërë një vend apo një tjetër janë të barabarta, akulli do të çrregullohet.
Oriz. 2. diagrami i gjendjes akull kristalor
Sidoqoftë, të gjitha eksperimentet me akullnajat ekzotike, si rregull, shoqërohen me ftohjen e tyre në temperaturat e akullit të thatë, azotit të lëngshëm dhe madje edhe heliumit, si dhe me ngjeshjen në një presion prej mijëra atmosferash. Pamje e përgjithshme rezultatet mund të merren duke shikuar Foto, ku tregohet diagrami i gjendjes së akullit kristalor.
Shumë akullnajë me presion të lartë mund të ruhen në presion normal. Për ta bërë këtë, ato ftohen në azot të lëngshëm, dhe më pas presioni lirohet. Ishte në akull kaq të ngurtësuar që u kryen studimet kryesore. Ata treguan se struktura e tyre është shumë e larmishme.
Struktura e akullit të parë me presion të lartë, Akull II, u identifikuan në agimin e kërkimeve në këtë fushë, kur instrumentet e para të fuqishme për difraksionin e rrezeve X u shfaqën në vitin 1964. Siç doli, ky akull përbëhet nga kolona të zbrazëta të formuara nga cikle të valëzuara me gjashtë lidhje. Çdo kolonë është e rrethuar nga gjashtë kolona të njëjta, të zhvendosura në lidhje me njëra-tjetrën me një të tretën e periudhës. Struktura e këtij akulli mund të merret nëse një pjesë e hualleve të akullit I h thyhet dhe shndërrohet në korniza të hapura që lidhin pjesën tjetër të hualleve të mjaltit. Në këtë rast, madhësia e kanaleve gjashtëkëndore që rezultojnë rritet shumë - është akulli II që ka kanalet më të gjera, diametri i tyre është 3 Å. Kanale të tilla mund të përmbajnë molekula helium, neoni dhe madje edhe hidrogjen.
Oriz. 3 . Struktura e akullitII
Hidratet e gazit fisnik, si heliumi, mund të merren nga akulli II në dy mënyra. Së pari, aplikoni (në një atmosferë heliumi) një presion prej 0,28-0,5 GPa në ujë dhe ftohni atë në 250-270 K. Edhe pse akulli III dhe V janë të qëndrueshëm në këtë zonë të diagramit, një hidratim do të merret bazuar në akullin II. Interesante, protonet në të tashmë janë të renditura. (Zakonisht, ato porositen vetëm kur akulli tashmë i formuar është ftohur fort.)
Së dyti, është e mundur të shpërndahet helium akull I h në temperaturë dhe presion të ulët prej 0,3 GPa. Shfaqja e heliumit çon në zgjerimin e rrjetës kristalore, dhe më pas ngrohja e saj në 180K ndihmon që t'i nënshtrohet një transformimi strukturor.
Lehtësia relative e marrjes së solucioneve të ngurta në akull II, si dhe potenciali i tij i lartë si ruajtje e hidrogjenit të gaztë (një molekulë gazi për gjashtë molekula uji) tërheq vëmendjen e shkencëtarëve praktikë: mundësia e aplikimit të tij në hidrogjen. energjia po diskutohet në mënyrë aktive.
Kur avulli i ujit kondensohet në një nënshtresë më të ftohtë, akull amorf. Të dyja këto forma të akullit Ice II dhe akulli amorf mund të shndërrohen në mënyrë spontane në akull gjashtëkëndor për më tepër, sa më e lartë të jetë temperatura.
Modifikimi Ice IVështë një fazë metastabile e akullit. Formohet shumë më lehtë dhe është veçanërisht i qëndrueshëm nëse uji i rëndë i nënshtrohet presionit.
Kurba e shkrirjes së akullit V dhe VII testuar deri në presionin 20 H/m 2 (200 mijë kgf/cm 2 ). Nën këtë presion, akulli VII shkrihet në 400°C.
Akull VIIIështë një formë e porositur me temperaturë të ulët Akull VII.
Akull IX- faza metastabile që ndodh gjatë superftohjes Akull III dhe në thelb përfaqëson formën e tij me temperaturë të ulët.
Polimorfizmi i akullit u zbulua për herë të parë nga G. Tamman në vitin 1900 dhe u studiua në detaje nga P. Bridgeman në 1912. Tabela. Figura 3 dhe 4 paraqesin disa të dhëna mbi strukturat e modifikimeve të akullit dhe disa nga vetitë e tyre.
Dy modifikimet e fundit të akullit - XIII dhe XIV- shkencëtarët nga Oksfordi zbuluan kohët e fundit, në 2006. Supozimi se kristalet e akullit me rrjeta monoklinike dhe rombike duhet të ekzistojnë ishte i vështirë për t'u konfirmuar: viskoziteti i ujit në një temperaturë prej -160 ° C është shumë i lartë dhe është e vështirë që molekulat e ujit të pastër të superftohur të bashkohen në një sasi të tillë. se formohet një bërthamë kristalore. Kjo u arrit me ndihmën e një katalizatori - acidi klorhidrik, i cili rriti lëvizshmërinë e molekulave të ujit në temperatura të ulëta. Në natyrën tokësore, modifikime të tilla të akullit nuk mund të formohen, por ato mund të ndodhin në satelitët e ngrirë të planetëve të tjerë.
DISA VETITË FIZIKE DHE MEKANIKE TË AKULLIT.
Stabiliteti i akullitështë një fenomen multifaktorial që varet nga shumë faktorë që duhet të merren parasysh në llogaritjet:
FORTËSIA E AKULLIT. Aftësia e akullit për t'i rezistuar depërtimit të një trupi tjetër që nuk merr deformime të përhershme. Përkufizohet si raporti i ngarkesës vepruese P me sipërfaqen e dhëmbëzimit S të formuar. Fortësia H = P/S është vlera mesatare e presionit në gropë. Në varësi të temperaturës së akullit dhe kohës së aplikimit të ngarkesës (koha e shkurtër korrespondon me fortësinë dinamike, koha e gjatë me ngurtësinë statike), vlerat e H mund të ndryshojnë më shumë se një renditje e madhësisë.
TEKSTURA AKULL. Një tipar i strukturës së akullit, për shkak të rregullimit hapësinor të ajrit, përfshirjeve minerale dhe organike.
Duke marrë parasysh përfshirjet e ajrit, akulli ndahet në monolit(pa përfshirje të dukshme) dhe poroze(me prani përfshirjesh, të cilat mund të kenë një shpërndarje uniforme, me shtresa dhe vertikalisht fibroze).
Sipas madhësisë së përfshirjeve, akulli ndahet në vezikulare imët(përfshirje më pak se 0,2 mm), flluskë mesatare(përfshirje nga 0,2 në 0,5 mm), i trashë-flluska(përfshirje nga 0,5 në 1,0 mm), zgavër e madhe(përfshirje mbi 1,0 mm).
Forma e përfshirjeve është ovale, tubulare, e degëzuar dhe transformuese. Sipas origjinës së tyre, përfshirjet ndahen në parësore (autogjene), dytësore (ksenogjenike) dhe me teksturë (kataklastike).
TEMPERATURA E SHKRIHJES SË AKULLIT. Temperatura në të cilën akulli shkrihet me presion të jashtëm konstant. Shkrirja akulli i detit nuk ndodh në një temperaturë të caktuar, si me akullin e freskët, por vazhdimisht, nga momenti kur temperatura është nën 0 ° C deri në pikën e ngrirjes uji i detit dhënë kripësi.
Ndryshimi i temperaturës në akull në kohën kur i jepet nxehtësia
1 - 2 - ngrohje me akull;2 - 3 - shkrirja e akullit:3 - 4- ngrohje me ujë;t pl - temperatura e shkrirjes së akullit.
Shkrirja e akullit në presionin atmosferik ndodh në një temperaturë prej 0,01°C (0°C supozohet në llogaritjet praktike). Sasia e nxehtësisë që duhet t'i jepet 1 kg akull në pikën e shkrirjes për ta kthyer atë në ujë quhet nxehtësia specifike e shkrirjes L sq. Nxehtësia specifike e shkrirjes së akullit të ujërave të ëmbla në kushte normale është e barabartë me nxehtësinë specifike të kristalizimit të ujit 33,3·10 4 J/kg.
PËRQËNIA TERMIKE E AKULLIT (Koeficienti i përçueshmërisë termike). Një parametër që karakterizon shkallën e ndryshimit të temperaturës së akullit në proceset termike jo-stacionare. Difuziviteti termik i akullit
a= λ/Cpρ),
ku Cp - ngrohje specifike akull në presion konstant, ρ - dendësia e akullit, λ - koeficienti i përçueshmërisë termike, numerikisht i barabartë me rritjen e temperaturës së një njësie vëllimi akulli si rezultat i një fluksi nxehtësie që korrespondon me koeficientin e përçueshmërisë termike Cp .
Ice II është romboedral. Ajo ka ngjashmëri, jo për t'u habitur, me Ice I, sepse përbëhet nga unaza të valëzuara gjashtë-anëtarëshe të bashkuara me një unazë tjetër poshtë saj. Megjithatë, unazat fqinje nuk formojnë një rrjet të plotë gjashtëkëndor, por në vend të akseve rrethuese të trefishta të vidhave. Diagrami më poshtë tregon unazat në Ice I (majtas) dhe Ice II (djathtas). Lartësitë e unazave rreth boshteve të vidhave tregohen në diagramin e djathtë. Meqenëse unazat mbyllin vende të lira, struktura Ice II në fakt ka më pak hapësirë boshe dhe është më e dendur. Dendësia është 1.17 gm/cc.
Nëse struktura e mësipërme duket e njohur, duhet. Atomet e oksigjenit kanë të njëjtin rregullim si atomet e karbonit në diamant. Kjo formë akulli quhet Ice Ic.
Në të majtë është një qelizë njësi kubike e Ice Ic, me vetëm oksigjenin e treguar. Lidhjet O-H-O janë në ngjyrë portokalli.
Diagrami i mëposhtëm tregon marrëdhënien e qelizës njësi kubike me shtresat e ngushta të paketimit.
Ic Ic formohet nga avulli nën rreth -80 C dhe duket të jetë një formë metastabile akulli, megjithëse ka pothuajse të njëjtën densitet si Ice Ih. Ice Ih nuk ndryshon në Ice Ic në temperatura shumë të ulëta, por Ice Ic kthehet lehtësisht në Ice Ih kur ngrohet mbi -80 C. Ice Ic mund të formohet në retë jashtëzakonisht të larta dhe disa veçori halo që nuk shpjegohen lehtësisht për sa i përket akullit gjashtëkëndor i janë atribuar Ice Ic .
Tregohet struktura e Ice II. Ekzistojnë dy grupe unazash me shkallë paksa të ndryshme valëzimi, të paraqitura në të gjelbër dhe blu të çelur. Për sa i përket dimensioneve të boshtit c, një grup është i përqendruar në lartësitë 0, 1/3, 2/3 dhe një, tjetri në 1/6, 1/2 dhe 5/6. Të dy grupet në mënyrë të alternuar vertikalisht dhe janë grupuar rreth boshteve të vidhave me tre fish. Nëse i shënojmë dy grupet e unazave si P dhe Q, atëherë unazat janë të lidhura rreth çdo boshti trefish në mënyrën P-Q-P-Q-P-Q-. Lidhjet në të dy llojet e unazave janë të kuqe dhe vjollcë, ndërlidhjet janë blu e errët.
Ice II është tetragonal. Qeliza njësi është kubike në dimensione (6,83 Angstromunits në një anë) por tetragonale në simetri. Dendësia është 1.14 gm/cc. Lidhjet tetraedrale O-H-O janë disi të shtrembëruara. Në diagramin më poshtë, atomet e oksigjenit tregohen në ngjyrë blu me atome më të mëdha më afër shikuesit. Lidhjet O-H-O janë me ngjyrë të kuqe, me vija më të trasha më afër shikuesit. Lidhjet që përfundojnë me një shigjetë janë duke treguar poshtë në një nivel më të thellë, ato me skajet e theksuara tregojnë deri në një nivel më të lartë. Tregohen disa nivele të strukturës. Atomet e paraqitura si të njëjtën madhësi mund të jenë në të vërtetë lartësi paksa të ndryshme. Për shembull, grupet në formë L të tre atomeve në një kënd të drejtë janë në fakt pak të anuar në raport me rrafshin e diagramit. Sheshet e anuar të oksigjenit rrethojnë akset e katërfishta të vidhave.
Në të majtë është një pamje e sipërme e strukturës Ice Ih. Pikat e kuqe në disa atome shënojnë një shtresë B me lidhje O-H-O që tregojnë deri në shtresën tjetër B. Atome të tjera janë në një shtresë A dhe kanë lidhje O-H-O që tregojnë poshtë në shtresën tjetër A.
Polimorfe të akullit me presion të lartë
Akulli shfaq një numër të madh polimorfesh siç tregohet në të majtë. Akulli në çajin tuaj është Ice I.
Ice I konvertohet në Ice II ose Ice III në rreth 2 kb. Në bazën e kapakut të akullit të Antarktikut (5 km i trashë) presioni është vetëm rreth 0,5 kb. Pra, akulli në tokë nuk bëhet kurrë aq i trashë sa të shndërrohet në një fazë më të dendur. Ne arrijmë presione më të larta në kore, por në temperatura shumë përtej pikave të shkrirjes së çdo lloji akulli.
Megjithatë, fazat e dendura të akullit pothuajse me siguri ekzistojnë në brendësi të satelitëve të mëdhenj në Sistemin Diellor të jashtëm, dhe ndoshta prodhohen lehtësisht nga metamorfizmi i goditjes gjatë ndikimeve meteoroidale.
Ice V është monoklinik. Në diagramin më poshtë, atomet e oksigjenit tregohen në ngjyrë blu me atome më të mëdha më afër shikuesit. Lidhjet O-H-O janë me ngjyrë të kuqe, me vija më të trasha më afër shikuesit. Lidhjet që përfundojnë me një shigjetë janë duke treguar poshtë në një nivel më të thellë, ato me skajet e theksuara tregojnë deri në një nivel më të lartë. Tregohen disa nivele të strukturës. Atomet e paraqitura si të njëjtën madhësi mund të jenë në të vërtetë lartësi paksa të ndryshme. Qeliza e njësisë tregohet në gri (një grup skajesh shkon horizontalisht dhe fshihet kryesisht nga atomet dhe lidhjet, por është aty. Shikoni nga afër).
Ice VI është tetragonal, me a = 6,27 njësi Angstrom dhe c = 5,79 - gati kub. Dendësia është 1.31 gm/cc. Ajo mund të përshkruhet si një "vetë-clathrate". Një clathrate është një molekulë e rrethuar nga një kafaz i molekulave të ujit. Në Ice VI, ka grupe prej pesë molekulash uji, një molekulë qendrore në një kafaz tetraedral me katër të tjera. Qendrat e grupimeve shtrihen në qoshet dhe qendrat e rrjetës tetragonale të përqendruar te trupi, dhe molekulat përreth janë 3/8c mbi dhe poshtë molekulës qendrore.
Strukturat e mbushura ngushtë nuk lejojnë shumë mirë lidhjet tetraedrale. Akulli VI dhe Ice VII e arrijnë dendësinë e tyre duke pasur dy rrjeta të ndërthurura por të shkëputura. Në këtë diagram O-H-O lidhjet në dy rrjetet e veçanta tregohen me të kuqe dhe vjollcë.
Atomet e oksigjenit tregohen në ngjyrë blu me atome më të mëdha më afër shikuesit. Dy rrjetet e lidhjeve O-H-O janë në ngjyrë të kuqe dhe vjollcë, me vija më të trasha më afër shikuesit. Lidhjet që përfundojnë me një shigjetë tregojnë poshtë në një nivel më të thellë, ato me skaje të theksuara drejtohen në një nivel më të lartë. Janë paraqitur disa nivele të strukturës.
Në një farë mënyre, Ice VII është më i lehtë për t'u kuptuar, sepse përbëhet nga dy rrjeta akulli që ndërthuren.
Dy grupet e grilave të ndërthurura janë paraqitur në portokalli dhe të kuqe. Qeliza njësi përbëhet nga tetë kube me qendër trupin.
Ice VII ka një dendësi prej 1,66 gm/cc.
Qeliza e njësisë Ice VII përbëhet nga kube me qendër trupin, të cilët janë të paketuar mirë. Një strukturë akulli e bazuar në molekulat e ujit të mbushura ngushtë do të kërkonte lidhje shumë të shtrembëruara dhe llogaritjet teorike sugjerojnë se IceVII është forma e qëndrueshme deri në të paktën 200 kilobar. Në gravitetin e tokës, 200 kilobar do të korrespondonin me një thellësi prej rreth 1500 kilometrash akulli, duke marrë parasysh ndryshimet e fazës.
Në presione jashtëzakonisht të larta, ne mund të presim që molekulat e ujit të prishen plotësisht dhe të formohet një strukturë e mbushur ngushtë me lidhje jonike.






