Tensioni sipërfaqësor i ujit
Pjesa kryesore.
Për të kuptuar vetitë dhe modelet bazë gjendje e lëngshme substancave, duhet të merren parasysh aspektet e mëposhtme:
Struktura e lëngut. Lëvizja e molekulave të lëngëta.
Një lëng është diçka që mund të rrjedhë.
Në renditjen e grimcave të lëngshme vërehet i ashtuquajturi rendi me rreze të shkurtër. Kjo do të thotë që në lidhje me çdo grimcë, është renditur vendndodhja e fqinjëve të saj më të afërt.
Megjithatë, ndërsa dikush largohet nga një grimcë e caktuar, renditja e grimcave të tjera në lidhje me të bëhet gjithnjë e më pak e renditur dhe shumë shpejt rendi në renditjen e grimcave zhduket plotësisht.
Molekulat e lëngshme lëvizin shumë më lirshëm se molekulat e ngurta, megjithëse jo aq lirshëm sa molekulat e gazit.
Çdo molekulë e lëngut për ca kohë lëviz aty-këtu, pa u larguar, megjithatë, nga fqinjët e saj. Por herë pas here një molekulë e lëngshme del nga mjedisi i saj dhe shkon në një vend tjetër, duke u futur në një mjedis të ri, ku përsëri për disa kohë bën lëvizje të ngjashme me lëkundjet. Merita e rëndësishme në zhvillimin e një sërë problemesh në teorinë e gjendjes së lëngshme i takon shkencëtarit sovjetik Ya.I. Frenkel.
Sipas Frenkel, lëvizja termike në lëngje ka karakterin e mëposhtëm. Çdo molekulë lëkundet rreth një pozicioni të caktuar ekuilibri për ca kohë. Herë pas here, molekula ndryshon vendin e saj të ekuilibrit, duke u hedhur në një pozicion të ri, të ndarë nga ai i mëparshmi me një distancë të rendit të madhësisë së vetë molekulave. Kjo do të thotë, molekulat lëvizin ngadalë brenda lëngut, duke qëndruar një pjesë të kohës pranë vendeve të caktuara. Kështu, lëvizja e molekulave të një lëngu është diçka si një përzierje e lëvizjeve në një të ngurtë dhe në një gaz: lëvizje lëkundëse në një vend zëvendësohet nga një kalim i lirë nga një vend në tjetrin.
Presioni i lëngshëm
Përvoja e përditshme na mëson se lëngjet veprojnë me forca të njohura në sipërfaqen e trupave të ngurtë në kontakt me to. Këto forca quhen forca të presionit të lëngjeve.
Duke mbuluar me gisht hapjen e një rubineti të hapur me ujë, ndjejmë forcën e presionit të lëngut në gisht. Dhimbje veshi përjetuar nga një notar pas zhytjes thellësi e madhe, shkaktuar nga forcat e presionit të ujit në daullja e veshit veshi. Termometrat e detit të thellë duhet të jenë shumë të fortë në mënyrë që presioni i ujit të mos mund t'i shtypë ato.
Presioni në një lëng është për shkak të një ndryshimi në vëllimin e tij - ngjeshja. Në lidhje me një ndryshim në vëllim, lëngjet kanë elasticitet. Forcat elastike në një lëng janë forca të presionit. Kështu, nëse një lëng vepron me forca presioni mbi trupat në kontakt me të, kjo do të thotë se ai është i ngjeshur. Meqenëse dendësia e një lënde rritet gjatë ngjeshjes, mund të thuhet se lëngjet kanë elasticitet në lidhje me një ndryshim në densitet.
Presioni në një lëng është pingul me çdo sipërfaqe të vendosur në lëng. Presioni në lëng në thellësinë h është i barabartë me shumën e presionit në sipërfaqe dhe një vlerë proporcionale me thellësinë:
Për shkak të faktit se lëngjet mund të transmetojnë presion statik, praktikisht jo më pak se dendësia e tyre, ato mund të përdoren në pajisje që japin një fitim në forcë: presa hidraulike.
Ligji i Arkimedit
Forcat e presionit veprojnë në sipërfaqen e një trupi të ngurtë të zhytur në një lëng. Meqenëse presioni rritet me thellësinë, forcat e presionit përpjetë në pjesën e poshtme të lëngut janë më të mëdha se forcat zbritëse në majë, dhe ne mund të presim që rezultanta e forcave të presionit të jetë lart. Forca rezultante e presionit mbi një trup të zhytur në një lëng quhet forca mbështetëse e lëngut.
Nëse një trup i zhytur në një lëng lihet në vetvete, atëherë ai do të fundoset, do të mbetet në ekuilibër ose do të notojë në sipërfaqen e lëngut, në varësi të faktit nëse forca mbështetëse është më e vogël se forca e gravitetit që vepron në trup, e barabartë me ajo ose më e madhe se ajo.
Parimi i Arkimedit thotë se një trup në një lëng i nënshtrohet një force lëvizëse lart të barabartë me peshën e lëngut të zhvendosur. Një trup i zhytur në një lëng i nënshtrohet një force lëvizëse (të quajtur forca e Arkimedit)
![]()
ku ρ është dendësia e lëngut (gazit), është nxitimi renie e lire, a V- vëllimi i trupit të zhytur (ose pjesa e vëllimit të trupit nën sipërfaqe).
Nëse një trup i zhytur në një lëng është i varur nga një peshore, atëherë peshore tregon ndryshimin midis peshës së trupit në ajër dhe peshës së lëngut të zhvendosur. Prandaj, ligjit të Arkimedit ndonjëherë i jepet formulimi i mëposhtëm: një trup i zhytur në një lëng humbet aq shumë në peshën e tij sa peshon lëngu i zhvendosur prej tij.
Është interesante të theksohet një fakt i tillë eksperimental se, duke qenë brenda një lëngu tjetër të një më të madh gravitet specifik, lëngu sipas ligjit të Arkimedit "humb" peshën e tij dhe merr formën e tij natyrale, sferike.
Avullimi
Në shtresën sipërfaqësore dhe pranë sipërfaqes së lëngut veprojnë forca që sigurojnë ekzistencën e sipërfaqes dhe nuk lejojnë që molekulat të largohen nga vëllimi i lëngut. Për shkak të lëvizjes termike, disa nga molekulat kanë shpejtësi mjaft të lartë për të kapërcyer forcat që mbajnë molekulat në lëng dhe largohen nga lëngu. Ky fenomen quhet avullim. Vërehet në çdo temperaturë, por intensiteti i tij rritet me rritjen e temperaturës.
Nëse molekulat që kanë lënë lëngun hiqen nga hapësira afër sipërfaqes së lëngut, atëherë, në fund, i gjithë lëngu do të avullojë. Nëse molekulat që kanë lënë lëngun nuk hiqen, ato formojnë avull. Molekulat e avullit që kanë rënë në zonën afër sipërfaqes së lëngut tërhiqen në lëng nga forcat e tërheqjes. Ky proces quhet kondensim.
Kështu, nëse molekulat nuk hiqen, shkalla e avullimit zvogëlohet me kalimin e kohës. Me një rritje të mëtejshme të densitetit të avullit, arrihet një situatë ku numri i molekulave që largohen nga lëngu në një kohë të caktuar do të jetë i barabartë me numrin e molekulave që kthehen në lëng në të njëjtën kohë. Vjen një gjendje ekuilibri dinamik. Avulli në një gjendje ekuilibri dinamik me një lëng quhet i ngopur.
Ndërsa temperatura rritet, densiteti dhe presioni i avullit të ngopur rritet. Sa më e lartë të jetë temperatura, aq më shumë molekulat e një lëngu kanë energji të mjaftueshme për avullim dhe aq më e madhe duhet të jetë dendësia e avullit në mënyrë që kondensimi të mund të jetë i barabartë me avullimin.
Duke zier
Kur një lëng nxehet në një temperaturë në të cilën presioni avujt e ngopur e barabartë me presionin e jashtëm, vendoset një ekuilibër midis lëngut dhe tij avull i ngopur. Kur një sasi shtesë e nxehtësisë i komunikohet lëngut, masa përkatëse e lëngut shndërrohet menjëherë në avull. Ky proces quhet zierje.
Zierja është avullimi intensiv i një lëngu, i cili ndodh jo vetëm nga sipërfaqja, por në të gjithë vëllimin e tij, brenda flluskave të avullit që rezultojnë. Për të kaluar nga lëngu në avull, molekulat duhet të marrin energjinë e nevojshme për të kapërcyer forcat tërheqëse që i mbajnë ato në lëng. Për shembull, për të avulluar 1 g ujë në një temperaturë prej 100 ° C dhe një presion që korrespondon me presionin atmosferik në nivelin e detit, kërkohet të shpenzohen 2258 J, nga të cilat 1880 shkojnë për të ndarë molekulat nga lëngu, dhe pjesa tjetër shkon. të punojë për të rritur volumin e zënë nga sistemi, kundër forcave presioni atmosferik(1 g avull uji në 100 ° C dhe presion normal zë një vëllim prej 1,673 cm 3, ndërsa 1 g ujë në të njëjtat kushte është vetëm 1,04 cm 3).
Pika e vlimit është temperatura në të cilën presioni i avullit bëhet i barabartë me presionin e jashtëm. Me rritjen e presionit, pika e vlimit rritet, dhe me uljen e presionit, ajo zvogëlohet.
Për shkak të ndryshimit të presionit në lëngun me lartësinë e kolonës së tij, duke vluar nivele të ndryshme në një lëng ndodh, në mënyrë rigoroze, në temperatura të ndryshme. Vetëm një temperaturë të caktuar avull i ngopur mbi sipërfaqen e lëngut të vluar. Temperatura e saj përcaktohet vetëm nga presioni i jashtëm. Është kjo temperaturë që nënkuptohet kur flasim për pikën e vlimit.
Pikat e vlimit të lëngjeve të ndryshme janë shumë të ndryshme nga njëra-tjetra, dhe kjo përdoret gjerësisht në teknologji, për shembull, në distilimin e produkteve të naftës.
Sasia e nxehtësisë që duhet të furnizohet për të kthyer në mënyrë izotermale një sasi të caktuar lëngu në avull, me një presion të jashtëm të barabartë me presionin e avujve të tij të ngopur, quhet nxehtësia latente e avullimit. Zakonisht kjo vlerë lidhet me një gram, ose një nishan. Sasia e nxehtësisë e nevojshme për avullimin izotermik të një mol lëngu quhet nxehtësia latente molare e avullimit. Nëse kjo vlerë pjesëtohet me peshën molekulare, atëherë specifike nxehtësi latente avullimi.
Tensioni sipërfaqësor i lëngut
Vetia e një lëngu për të zvogëluar sipërfaqen e tij në minimum quhet tension sipërfaqësor. Tensioni sipërfaqësor është një fenomen i presionit molekular në një lëng, i shkaktuar nga tërheqja e molekulave të shtresës sipërfaqësore ndaj molekulave brenda lëngut. Në sipërfaqen e një lëngu, molekulat përjetojnë forca që nuk janë simetrike. Në molekulën brenda lëngut, mesatarisht, forca e tërheqjes, kohezioni, vepron mesatarisht në mënyrë të njëtrajtshme nga të gjitha anët. Nëse sipërfaqja e lëngut rritet, atëherë molekulat do të lëvizin kundër veprimit të forcave mbajtëse. Kështu, forca që synon të shkurtojë sipërfaqen e lëngut vepron në drejtim të kundërt me forcën e jashtme tërheqëse në sipërfaqe. Kjo forcë quhet forca e tensionit sipërfaqësor dhe llogaritet me formulën:
Koeficienti i tensionit sipërfaqësor ()
Gjatësia e kufirit të sipërfaqes së lëngshme
Vini re se lëngjet që avullohen lehtësisht (eteri, alkooli) kanë një tension më të ulët sipërfaqësor sesa lëngjet jo të paqëndrueshme (merkuri). Tensioni sipërfaqësor i hidrogjenit të lëngshëm dhe, veçanërisht, i heliumit të lëngshëm është shumë i ulët. Në metalet e lëngëta, tensioni sipërfaqësor, përkundrazi, është shumë i lartë. Dallimi në tensionin sipërfaqësor të lëngjeve shpjegohet me ndryshimin në forcat kohezive të molekulave të ndryshme.
Matjet e tensionit sipërfaqësor të një lëngu tregojnë se tensioni sipërfaqësor varet jo vetëm nga natyra e lëngut, por edhe nga temperatura e tij: me një rritje të temperaturës, diferenca në densitetin e lëngut zvogëlohet, dhe për këtë arsye koeficienti i tensioni sipërfaqësor - zvogëlohet.
Për shkak të tensionit sipërfaqësor, çdo vëllim lëngu tenton të zvogëlojë sipërfaqen, duke reduktuar kështu energjinë potenciale. Tensioni sipërfaqësor është një nga forcat elastike përgjegjëse për lëvizjen e valëzimeve në ujë. Në fryrje, graviteti sipërfaqësor dhe tensioni sipërfaqësor i tërheqin grimcat e ujit poshtë, duke tentuar ta bëjnë sipërfaqen përsëri të lëmuar.
Filma të lëngshëm
Të gjithë e dinë se sa e lehtë është të heqësh shkumën nga uji me sapun. Shkuma është një grup flluskash ajri të kufizuar nga filmi më i hollë i lëngut. Një film i veçantë mund të merret lehtësisht nga lëngu që formon shkumë.
Këta filma janë shumë interesantë. Ato mund të jenë jashtëzakonisht të holla: në pjesët më të holla, trashësia e tyre nuk i kalon njëqind e mijëta e milimetrit. Pavarësisht hollësisë së tyre, ato ndonjëherë janë shumë të qëndrueshme. Filmi i sapunit mund të shtrihet dhe deformohet, dhe një rrjedhë uji mund të rrjedhë përmes filmit të sapunit pa e shkatërruar atë.
Si mund të shpjegohet stabiliteti i filmave? Një kusht i domosdoshëm për formimin e një filmi është shtimi i substancave të tretshme në të në një lëng të pastër, për më tepër, ato që ulin shumë tensionin sipërfaqësor.
Në natyrë dhe teknologji, ne zakonisht takohemi jo me filma individualë, por me një koleksion filmash - shkumë. Shpesh mund të shihni në përrenj, ku përrenj të vegjël bien në ujë të qetë, një formim të bollshëm shkume. Në këtë rast, aftësia e ujit për të shkumëzuar shoqërohet me praninë në ujë të një lënde organike të veçantë të çliruar nga rrënjët e bimëve. Në pajisjet e ndërtimit përdoren materiale që kanë strukturë qelizore, si shkuma. Materialet e tilla janë të lira, të lehta, nuk përçojnë mirë nxehtësinë dhe zërin dhe janë mjaft të fortë. Për prodhimin e tyre, substancave që nxisin shkumëzimin u shtohen solucioneve nga të cilat formohen materialet e ndërtimit.
duke u lagur
Pikat e vogla të merkurit të vendosura në një pjatë qelqi marrin një formë sferike. Ky është rezultat i forcave molekulare që tentojnë të zvogëlojnë sipërfaqen e lëngut. Mërkuri i vendosur në sipërfaqen e një trupi të ngurtë nuk formon gjithmonë pika të rrumbullakëta. Përhapet mbi pllakën e zinkut dhe sipërfaqja totale e rënies padyshim që do të rritet.
Një rënie e anilinës është gjithashtu sferike vetëm kur nuk prek murin e enës prej qelqi. Sapo prek murin, ajo ngjitet menjëherë në xhami, duke u shtrirë përgjatë tij dhe duke marrë një sipërfaqe të madhe të përbashkët.
Kjo shpjegohet me faktin se në rastin e kontaktit me një trup të ngurtë, forcat ngjitëse të molekulave të lëngshme me molekulat e trupit të ngurtë fillojnë të luajnë një rol të rëndësishëm. Sjellja e një lëngu do të varet nga ajo se cila është më e madhe: ngjitja midis molekulave të lëngshme ose ngjitja e një molekule të lëngshme në një molekulë të ngurtë. Në rastin e merkurit dhe qelqit, forcat kohezive midis molekulave të merkurit dhe qelqit janë të vogla në krahasim me forcat kohezive midis molekulave të merkurit dhe merkuri mblidhet në një pikë.
Një lëng i tillë quhet jo lagësht të ngurta. Në rastin e merkurit dhe zinkut, forcat kohezive midis molekulave të lëngut dhe të ngurtës tejkalojnë forcat kohezive që veprojnë midis molekulave të lëngut dhe lëngu përhapet mbi të ngurtë. Në këtë rast, lëngu quhet duke u lagur të ngurta.
Nga kjo rrjedh se, duke folur për sipërfaqen e një lëngu, duhet të kemi parasysh jo vetëm sipërfaqen ku lëngu kufizohet me ajrin, por edhe sipërfaqen që kufizohet me lëngje të tjera ose me një trup të ngurtë.
Në varësi të faktit nëse lëngu i lag ose jo muret e enës, forma e sipërfaqes së lëngut në pikën e kontaktit me murin e ngurtë dhe gazin ka një formë ose një tjetër. Në rastin e mosnjohjes, forma e sipërfaqes së lëngshme në buzë është e rrumbullakët, konveks. Në rastin e njomjes, lëngu në buzë merr një formë konkave.
Dukuritë kapilare
Në jetë, ne shpesh kemi të bëjmë me trupa të shpuar nga shumë kanale të vogla (letër, fije, lëkurë, të ndryshme Materiale Ndertimi, tokë, pemë). Në kontakt me ujin ose lëngje të tjera, trupa të tillë shpesh i thithin ato. Kjo është baza për veprimin e një peshqiri gjatë tharjes së duarve, veprimit të fitilit në një llambë vajguri etj. Fenomene të ngjashme mund të vërehen edhe në tuba të ngushtë xhami. Tubat e ngushta quhen kapilarë ose flokë.
Kur një tub i tillë zhytet me një skaj në një enë të gjerë në një enë të gjerë, ndodh si më poshtë: nëse lëngu lag muret e tubit, atëherë ai do të ngrihet mbi nivelin e lëngut në enë dhe, për më tepër, më i lartë, aq më i ngushtë është tubi; nëse lëngu nuk i lag muret, atëherë, përkundrazi, niveli i lëngut në tub vendoset më i ulët se në një enë të gjerë. Ndryshimi në lartësinë e nivelit të lëngut në tuba ose boshllëqe të ngushta quhet kapilariteti. Në një kuptim të gjerë, dukuritë kapilare kuptohen si të gjitha fenomenet për shkak të ekzistimit të tensionit sipërfaqësor.
Lartësia e rritjes së lëngut në tubat kapilar varet nga rrezja e kanalit në tub, tensioni sipërfaqësor dhe dendësia e lëngut. Midis lëngut në kapilar dhe në enën e gjerë, vendoset një ndryshim i tillë niveli h në mënyrë që presioni hidrostatik rgh të balancojë presionin kapilar:
ku s është tensioni sipërfaqësor i lëngut
R është rrezja kapilar.
Lartësia e ngritjes së një lëngu në një kapilar është në proporcion me tensionin sipërfaqësor të tij dhe në përpjesëtim të zhdrejtë me rrezen e kanalit kapilar dhe densitetin e lëngut (ligji i Jurinit)
Përgjigjet në pyetje
1. Çfarë është tensioni sipërfaqësor dhe në çfarë njësi matet? Cilat janë arsyet e shfaqjes së saj?
Tensioni sipërfaqësor është një karakteristikë termodinamike e ndërfaqes midis dy fazave në ekuilibër, e përcaktuar nga puna e formimit izotermokinetik të kthyeshëm të një sipërfaqeje njësi të kësaj ndërfaqeje, me kusht që temperatura, vëllimi i sistemit dhe potencialet kimike të të gjithë përbërësve në të dyja fazat të mbeten. konstante.
Tensioni sipërfaqësor ka një kuptim fizik të dyfishtë - energji (termodinamike) dhe forcë (mekanike). Përkufizimi i energjisë (termodinamike): tensioni sipërfaqësor është puna specifike e rritjes së sipërfaqes kur ajo shtrihet, me kusht që temperatura të jetë konstante. Përkufizimi i forcës (mekanike): Tensioni sipërfaqësor është forca që vepron për njësi gjatësi të një linje që kufizon sipërfaqen e një lëngu.
Forca e tensionit sipërfaqësor drejtohet në mënyrë tangjenciale në sipërfaqen e lëngut, pingul me seksionin e konturit në të cilin vepron dhe është në proporcion me gjatësinë e këtij seksioni. Koeficienti i proporcionalitetit - forca për njësi gjatësi të konturit - quhet koeficienti i tensionit sipërfaqësor. Ajo matet në njuton për metër. Por është më e saktë të përkufizohet tensioni sipërfaqësor si energjia (J) për njësi thyerje të sipërfaqes (m²). Në këtë rast, shfaqet një kuptim i qartë fizik i konceptit të tensionit sipërfaqësor.
E matur në J/m2.
2. Si varet tensioni sipërfaqësor nga natyra e substancës që formon sipërfaqen?
Tensioni sipërfaqësor varet nga natyra e lëngut, d.m.th. në forcat e tërheqjes ndërmjet molekulave të një lëngu të caktuar dhe në temperaturë (tensioni sipërfaqësor zvogëlohet me rritjen e temperaturës).
3. Si dhe pse varet tensioni sipërfaqësor nga temperatura? Cila është pika kritike e vlimit?
Me rritjen e temperaturës, tensioni sipërfaqësor zvogëlohet dhe është i barabartë me zero në temperaturën kritike. Varësia më e famshme empirike e tensionit sipërfaqësor nga temperatura u propozua nga Lorand Eötvös, i ashtuquajturi rregulli Eötvös (eng. Eö tvö s rregullat). Aktualisht, është marrë një përfundim mbi varësinë teorike të tensionit sipërfaqësor nga temperatura në rajon deri në temperatura kritike, gjë që konfirmon rregullin Eötvös.
4. Cilat metoda përdoren për përcaktimin e tensionit sipërfaqësor të lëngjeve dhe trupave të ngurtë? Cila është baza për matjen e tensionit sipërfaqësor të lëngjeve me metodën e presionit më të madh të një flluskë ajri?
Metodat për përcaktimin e tensionit sipërfaqësor ndahen në statike dhe dinamike. Në metodat statike, tensioni sipërfaqësor përcaktohet në një sipërfaqe të formuar që është në ekuilibër. Metodat dinamike shoqërohen me shkatërrimin e shtresës sipërfaqësore. Në rastin e matjes së tensionit sipërfaqësor të tretësirave (veçanërisht polimereve ose surfaktantëve), duhet të përdoren metoda statike. Në disa raste, ekuilibri në sipërfaqe mund të ndodhë brenda disa orësh (për shembull, në rastin e zgjidhjeve të koncentruara të polimereve me viskozitet të lartë). Metodat dinamike mund të aplikohen për të përcaktuar tensionin sipërfaqësor ekuilibër dhe tensionin dinamik sipërfaqësor. Për shembull, për një zgjidhje sapuni pas përzierjes, tensioni sipërfaqësor është 58 mJ / m², dhe pas vendosjes - 35 mJ / m². Kjo do të thotë, tensioni sipërfaqësor ndryshon. Derisa të vendoset një ekuilibër, ai do të jetë dinamik.
Metodat statike:
Metoda e ngritjes së kapilarëve
Metoda Wilhelmy
metoda e rënies sesile
Metoda për përcaktimin me formën e një pike të varur.
Metoda e rënies rrotulluese
Metodat dinamike:
Metoda Du Nouy (metoda e grisjes së unazës).
Metoda stalagmometrike ose e numërimit të pikave.
Metoda e presionit maksimal të flluskës.
Metoda jet oshiluese
Metoda e valës në këmbë
Metoda e valës së udhëtimit
5. Çfarë quhet adsorbim dhe si karakterizohet në aspektin sasior? Shkruani ekuacionin themelor të adsorbimit të Gibbs-it dhe përcaktoni adsorbimin e tepërt (D).
Adsorbimi - një rritje në përqendrimin e një lënde të tretur në ndërfaqen e dy fazave (fazë e ngurtë - e lëngshme, faza e kondensuar - gaz) për shkak të forcave të pakompensuara të ndërveprimit ndërmolekular në ndarjen e fazës. Adsorbimi është një rast i veçantë i thithjes, procesi, e kundërta e adsorbimit - desorbimi.
Adsorbimi fizik është një proces spontan që shkon me një ulje të energjisë së sipërfaqes së lirë dhe përshkruhet nga ekuacioni Gibbs: Г i = - (dσ/dμ i) t, ku Г i është teprica e komponentit i në shtresën sipërfaqësore në krahasim me përqendrimi i tij në ekuilibër në fazën më të madhe; σ - tensioni sipërfaqësor; μ i - potenciali kimik i komponentit i-të; T është temperatura. Adsorbimi fizik nga tretësirat mund të jetë pozitiv (në të cilin substanca e tretur përthithet) ose negative (në të cilën tretësi absorbohet). Substancat që thithin pozitivisht që shkaktojnë një ulje të tensionit sipërfaqësor quhen sipërfaqësore-aktive (surfaktantë), dhe negativisht - sipërfaqësore-joaktive (SIV).
Vlera e tepërt e adsorbimit të Gibbs u llogarit me formulën:
G= [( Me-Me R)V]/m
ku Г është adsorbimi i tepërt i Gibbs, mmol/g; Me– përqendrimi fillestar i dimetilaminës, mmol/dm3; Me R– përqendrimi ekuilibër i dimetilaminës, mmol/dm3; Vështë vëllimi i tretësirës testuese, dm 3; mështë masa e kampionit adsorbent, g.
6. Cilat substanca quhen sipërfaqësore aktive, cila është struktura e molekulave të tyre?
Surfaktantë ( surfaktant) - komponime kimike që, duke u përqëndruar në ndërfaqen e fazave termodinamike, shkaktojnë ulje të tensionit sipërfaqësor.
Karakteristika kryesore sasiore e surfaktantëve është aktiviteti sipërfaqësor - aftësia e një substance për të reduktuar tensionin sipërfaqësor në kufirin e fazës - ky është derivati i tensionit sipërfaqësor në lidhje me përqendrimin e surfaktantit pasi C tenton në zero. Sidoqoftë, surfaktantët kanë një kufi të tretshmërisë (të ashtuquajturat përqendrimi kritikmicelizimi ose CMC), me arritjen e të cilit, kur një surfaktant i shtohet një tretësire, përqendrimi në kufirin e fazës mbetet konstant, por në të njëjtën kohë, ndodh vetëorganizimi i molekulave të surfaktantit në një tretësirë me shumicë (formimi ose grumbullimi i micelës ). Si rezultat i këtij grumbullimi, formohen të ashtuquajturat micela. Një tipar dallues i formimit të micelës është turbullira e solucionit surfaktant. Tretësirat ujore të surfaktantëve, gjatë formimit të micelës, fitojnë gjithashtu një nuancë kaltërosh (ngjyrë xhelatinoze) për shkak të përthyerjes së dritës nga micelat.
Si rregull, surfaktantët janë komponime organike që kanë amfifilikestrukturën, pra molekulat e tyre përmbajnë një pjesë polare, një përbërës hidrofil (grupet funksionale -OH, -COOH, -SOOOH, -O-, etj., ose, më shpesh, kripërat e tyre -ONa, -COONa, -SOOONa etj. .) dhe një pjesë jopolare (hidrokarbure), një përbërës hidrofobik. Një shembull i një surfaktant është sapuni i zakonshëm (një përzierje e kripërave të natriumit të acideve yndyrore karboksilike -oleate, stearat natriumi, etj.) dhe SMS (detergjentë sintetikë), si dhe alkoole, acide karboksilike, amine, etj.
Përgjigjet në pyetje
1. Përcaktoni termat: adsorbim, adsorbues, adsorbues, adsorbues.
Adsorbimi (latin. ad- në, në; sorbeo- Unë thith) - një rritje në përqendrimin e një solucioni të tretur në ndërfaqen e dy fazave (fazë e ngurtë-lëngtë, faza e kondensuar - gaz) për shkak të forcave të pakompensuara të ndërveprimit ndërmolekular në ndarjen e fazës. Adsorbimi është një rast i veçantë i absorbimit, procesi i kundërt i adsorbimit - desorbimi.
Adsorbentët janë materiale natyrale ose artificiale shumë të shpërndara me një sipërfaqe të madhe specifike, në të cilën substancat absorbohen nga gazrat ose lëngjet në kontakt me të. Adsorbentët përdoren në maskat e gazit, si bartës të katalizatorëve, për pastrimin e gazeve, alkooleve, vajrave, për ndarjen e alkooleve, në rafinimin e vajit dhe në mjekësi për thithjen e gazeve dhe helmeve.
Substanca e përthithur, e cila është ende në vëllimin e fazës, quhet adsorbent, absorbohet - adsorboj.
2. Cilat janë veçoritë e adsorbimit në ndërfaqen solid-lëng?
Gjatë adsorbimit në ndërfaqen solid-lëng, teprica e substancës së përthithur bëhet funksion i përqendrimit molar të tretësirës.Adsorbimi nga tretësirat ka dallime të konsiderueshme nga adsorbimi i gazit. Kjo është për shkak të arsyeve të mëposhtme:
jo vetëm substanca e tretur mund të absorbohet në adsorbent, por edhe vetë tretësi. Sa më mirë të jetë përthithja e tretësit, aq më e vështirë do të jetë përthithja e substancës së tretur;
tretësi mund të shpërndajë adsorbentin. Sa më mirë tretësi të shkrin adsorbentin, aq më i vështirë vazhdon adsorbimi në të;
shpejtësia e përthithjes nga tretësira varet nga shpejtësia e difuzionit. Si rezultat i varfërimit të substancës së nxjerrë në shtresat ujore ngjitur me adsorbentin, adsorbimi i mëtejshëm përcaktohet nga shkalla e difuzionit të substancës së përthithur në adsorbent. Siç dihet, difuzioni në lëngje është një proces mjaft i ngadaltë, prandaj, për të përshpejtuar adsorbimin, përdoret përzierja e tretësirës.
Këto tre karakteristika sjellin gabime të rëndësishme në izotermën e përthithjes.
Rregulli i shtrirjes së polaritetit (M.A. Rebinder): në adsorbuesit polare, absorbohen më mirë adsorbatet polare nga tretësit jopolarë, dhe në adsorbuesit jopolarë, adsorbuesit jopolarë nga tretësit polare absorbohen më mirë.
Thithja e një lënde të tretur nga një tretësirë varet nga struktura e saj.
3. Cila është sipërfaqja specifike, çfarë metodash për përcaktimin e saj dini?
Sipërfaqja specifike e sipërfaqes është një karakteristikë mesatare e dimensioneve të zgavrave të brendshme (kanaleve, poreve) të një trupi poroz ose grimcave të një faze të grimcuar të një sistemi të shpërndarë.
Sipërfaqja specifike shprehet si raport i sipërfaqes totale të një trupi poroz ose të shpërndarë në një mjedis të caktuar me vëllimin ose masën e tij. Sipërfaqja specifike është proporcionale me shpërndarjen ose, e cila është e njëjtë, në përpjesëtim të kundërt me madhësinë e grimcave të fazës së shpërndarë.
Sipërfaqja specifike më së shpeshti përcaktohet nga sasia e gazit inert të përthithur nga materiali dhe nga përshkueshmëria e ajrit të shtresës së pluhurit ose materialit poroz. Metodat e adsorbimit ofrojnë të dhënat më të besueshme.
Për të përcaktuar sipërfaqen specifike dhe shpërndarjen e poreve përgjatë rrezeve të trupave porozë sipas teorisë BET me metodën e thithjes së azotit në temperaturën e azotit të lëngët, kompania italiane Carlo Erba prodhoi pajisjen Sorptomatic (koha e matjes është afërsisht një mostër për ditë).
Së pari, le të diskutojmë vetitë e veçanta që kanë molekulat e shtresës afër sipërfaqes së një lëngu në krahasim me molekulat në masë.
Oriz. 1. Dallimi midis molekulave të shtresës afër sipërfaqes dhe molekulave në pjesën më të madhe të lëngut
Konsideroni dy molekula A dhe B. Molekula A është brenda lëngut, molekula B është në sipërfaqen e tij (Fig. 1). Molekula A është e rrethuar nga molekula të tjera të lëngshme në mënyrë të barabartë, kështu që forcat që veprojnë në molekulën A nga molekulat që bien në sferën e ndërveprimit ndërmolekular kompensohen, ose rezultanti i tyre është zero.
Çfarë ndodh me molekulën B, e cila ndodhet në sipërfaqen e lëngut? Kujtojmë se përqendrimi i molekulave të gazit që është mbi lëngun është shumë më i vogël se përqendrimi i molekulave të lëngshme. Molekula B është e rrethuar nga njëra anë nga molekula të lëngshme dhe nga ana tjetër nga molekula gazi shumë të rrallë. Meqenëse shumë molekula të tjera veprojnë mbi të nga ana e lëngut, rezultanta e të gjitha forcave ndërmolekulare do të drejtohet brenda lëngut.
Kështu, në mënyrë që një molekulë nga thellësia e lëngut të futet në shtresa sipërfaqësore, ju duhet të bëni punë kundër forcave ndërmolekulare të pakompensuara.
Mos harroni se puna është ndryshim. energji potenciale marrë me shenjën minus.
Kjo do të thotë se molekulat e shtresës afër sipërfaqes, në krahasim me molekulat brenda lëngut, kanë energji të tepërt potenciale.
Kjo energji e tepërt është një përbërës i energjisë së brendshme të lëngut dhe quhet energjia sipërfaqësore. Përcaktohet si dhe matet, si çdo energji tjetër, në joule.
Natyrisht, sa më e madhe të jetë sipërfaqja e lëngut, aq më shumë molekula të tilla kanë energji të tepërt potenciale, dhe për rrjedhojë aq më e madhe është energjia sipërfaqësore. Ky fakt mund të shkruhet si marrëdhënia e mëposhtme:
,
ku është sipërfaqja dhe është faktori i proporcionalitetit, të cilin do ta quajmë tensioni sipërfaqësor, ky koeficient karakterizon një ose një lëng tjetër. Le të shkruajmë një përkufizim rigoroz të kësaj sasie.
Tensioni sipërfaqësor i një lëngu (koeficienti i tensionit sipërfaqësor të një lëngu) është sasi fizike, i cili karakterizon një lëng të caktuar dhe është i barabartë me raportin e energjisë sipërfaqësore me sipërfaqen e lëngut
Koeficienti i tensionit sipërfaqësor matet në njuton të ndarë me një metër.
Le të diskutojmë se nga varet koeficienti i tensionit sipërfaqësor të një lëngu. Për të filluar, le të kujtojmë se koeficienti i tensionit sipërfaqësor karakterizon energjinë specifike të bashkëveprimit të molekulave, që do të thotë se faktorët që ndryshojnë këtë energji do të ndryshojnë edhe koeficientin e tensionit sipërfaqësor të lëngut.
Pra, koeficienti i tensionit sipërfaqësor varet nga:
1. Natyra e lëngut (për lëngjet "të paqëndrueshme", si eteri, alkooli dhe benzina, tensioni sipërfaqësor është më i vogël se ai i "jo të paqëndrueshëm" - uji, merkuri dhe metalet e lëngëta).
2. Temperatura (sa më e lartë të jetë temperatura, aq më i ulët është tensioni sipërfaqësor).
3. Prania e surfaktantëve që ulin tensionin sipërfaqësor (surfaktantë), si p.sh. sapuni ose pluhuri larës.
4. Vetitë e një gazi që ngjitet me një lëng.
Vini re se koeficienti i tensionit sipërfaqësor nuk varet nga sipërfaqja, pasi për një molekulë individuale afër sipërfaqes është absolutisht e parëndësishme se sa nga të njëjtat molekula janë përreth. Kushtojini vëmendje tabelës, e cila tregon koeficientët e tensionit sipërfaqësor substancave të ndryshme, në një temperaturë:
Tabela 1. Koeficientët e tensionit sipërfaqësor të lëngjeve në kufi me ajrin, në
Pra, molekulat e shtresës afër sipërfaqes kanë energji të tepërt potenciale në krahasim me molekulat në pjesën më të madhe të lëngut. Në kursin e mekanikës, u tregua se çdo sistem priret në një minimum të energjisë potenciale. Për shembull, një trup i hedhur nga një lartësi e caktuar do të priret të bjerë poshtë. Përveç kësaj, ju ndiheni shumë më rehat duke u shtrirë, sepse në këtë rast qendra e masës së trupit tuaj është e vendosur sa më poshtë. Në çfarë çon dëshira për të reduktuar energjinë e saj potenciale në rastin e një lëngu? Meqenëse energjia e sipërfaqes varet nga sipërfaqja, kjo do të thotë se është energjikisht e pafavorshme që çdo lëng të ketë një sipërfaqe të madhe. Me fjalë të tjera, në gjendje të lirë, lëngu do të tentojë të minimizojë sipërfaqen e tij.
Kjo është e lehtë për t'u verifikuar duke eksperimentuar me një film sapuni. Nëse një kornizë teli zhytet në një zgjidhje me sapun, atëherë mbi të formohet një film sapuni dhe filmi merr një formë të tillë që sipërfaqja e tij të jetë minimale (Fig. 2).


Oriz. 2. Shifrat nga një zgjidhje me sapun
Ju mund të verifikoni ekzistencën e forcave të tensionit sipërfaqësor duke përdorur një eksperiment të thjeshtë. Nëse një fije lidhet në unazën e telit në dy vende dhe në mënyrë të tillë që gjatësia e fillit të jetë disi më e madhe se gjatësia e kordës që lidh pikat e lidhjes së fillit, dhe unaza e telit zhytet në sapun. tretësirë (Fig. 3a), filmi i sapunit do të shtrëngojë të gjithë sipërfaqen e unazës dhe filli do të shtrihet në film sapuni. Nëse tani filmi është thyer në njërën anë të fillit, filmi i sapunit që mbetet në anën tjetër të fillit do të tkurret dhe do ta shtrijë fillin (Fig. 3b).

Oriz. 3. Eksperimentoni për të zbuluar forcat e tensionit sipërfaqësor
Pse ndodhi kjo? Fakti është se zgjidhja e sapunit që mbetet sipër, domethënë lëngu, tenton të zvogëlojë sipërfaqen e saj. Kështu, filli tërhiqet lart.
Pra, ne jemi të bindur për ekzistencën e forcës së tensionit sipërfaqësor. Tani le të mësojmë se si ta llogarisim atë. Për ta bërë këtë, le të bëjmë një eksperiment mendimi. Le të ulim një kornizë teli, njëra nga anët e së cilës është e lëvizshme, në tretësirën me sapun (Fig. 4). Ne do të shtrijmë filmin e sapunit, duke vepruar në anën e lëvizshme të kornizës me forcë. Kështu, ekzistojnë tre forca që veprojnë në shiritin e tërthortë - një forcë e jashtme dhe dy forca të tensionit sipërfaqësor që veprojnë përgjatë secilës sipërfaqe të filmit. Duke përdorur ligjin e dytë të Njutonit, ne mund ta shkruajmë atë
![]()
Oriz. 4. Llogaritja e forcës së tensionit sipërfaqësor
Nëse janë nën ndikim forcë e jashtme traversa do të lëvizë një distancë, atëherë kjo forcë e jashtme do të bëjë punën
Natyrisht, për shkak të kryerjes së kësaj pune, sipërfaqja e filmit do të rritet, që do të thotë se do të rritet edhe energjia sipërfaqësore, të cilën mund ta përcaktojmë përmes koeficientit të tensionit sipërfaqësor:
Ndryshimi i zonës, nga ana tjetër, mund të përcaktohet si më poshtë:
ku është gjatësia e pjesës së lëvizshme të kornizës së telit. Duke pasur parasysh këtë, mund të shkruajmë se puna e forcës së jashtme është e barabartë me
Duke barazuar pjesët e duhura në (*) dhe (**), marrim një shprehje për forcën e tensionit sipërfaqësor:
Kështu, koeficienti i tensionit sipërfaqësor është numerik e barabartë me forcën tensioni sipërfaqësor, i cili vepron për njësi gjatësi të vijës që kufizon sipërfaqen
Pra, ne kemi parë edhe një herë se lëngu tenton të marrë një formë të tillë që sipërfaqja e tij të jetë minimale. Mund të tregohet se për një vëllim të caktuar, sipërfaqja do të jetë minimale për një sferë. Kështu, nëse nuk veprojnë forca të tjera mbi lëngun ose veprimi i tyre është i vogël, lëngu do të priret të marrë një formë sferike. Kështu, për shembull, uji do të sillet në mungesë peshe (Fig. 5) ose flluska sapuni (Fig. 6).

Oriz. 5. Uji në gravitet zero

Oriz. 6. Flluska sapuni
Prania e forcave të tensionit sipërfaqësor mund të shpjegojë gjithashtu pse një gjilpërë metalike "shtrihet" në sipërfaqen e ujit (Fig. 7). Gjilpëra, e cila vendoset me kujdes në sipërfaqe, e deformon atë, duke rritur kështu sipërfaqen e kësaj sipërfaqeje. Kështu, lind një forcë e tensionit sipërfaqësor, e cila tenton të zvogëlojë një ndryshim të tillë në zonë. Forca rezultante e tensionit sipërfaqësor do të drejtohet lart dhe do të kompensojë forcën e gravitetit.
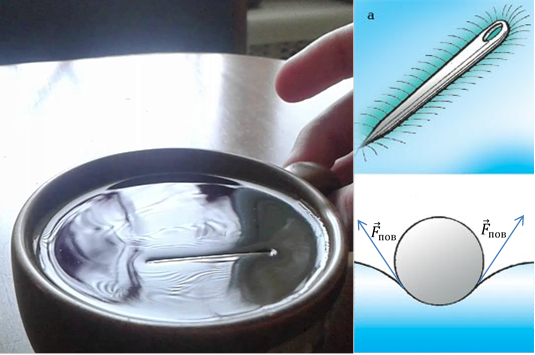
Oriz. 7. Gjilpërë në sipërfaqen e ujit
Parimi i funksionimit të pipetës mund të shpjegohet në të njëjtën mënyrë. Pika, mbi të cilën vepron forca e gravitetit, tërhiqet poshtë, duke rritur kështu sipërfaqen e saj. Natyrisht, lindin forca të tensionit sipërfaqësor, rezultanta e të cilave është e kundërt me drejtimin e gravitetit dhe që nuk lejojnë që pikëza të shtrihet (Fig. 8). Kur shtypni kapakun e gomës të pipetës, krijoni presion shtesë që ndihmon me gravitetin, duke bërë që pika të bjerë poshtë.
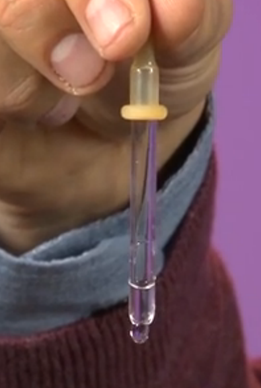
Oriz. 8. Si funksionon pipeta
Le të marrim një shembull tjetër nga Jeta e përditshme. Nëse zhytni një furçë bojë në një gotë me ujë, qimet e saj do të fryhen. Nëse tani e hiqni këtë furçë nga uji, do të vini re se të gjitha qimet janë ngjitur me njëri-tjetrin. Kjo për faktin se sipërfaqja e ujit që ngjitet në furçë do të jetë më pas minimale.
Dhe një shembull tjetër. Nëse dëshironi të ndërtoni një kështjellë me rërë të thatë, nuk ka gjasa të keni sukses, pasi rëra do të shkërmoqet nën ndikimin e gravitetit. Megjithatë, nëse e lagni rërën, ajo do të ruajë formën e saj për shkak të tensionit sipërfaqësor të ujit midis kokrrave të rërës.
Së fundi, vërejmë se teoria e tensionit sipërfaqësor ndihmon për të gjetur analogji të bukura dhe të thjeshta kur zgjidhen probleme më komplekse. detyrat fizike. Për shembull, kur ju duhet të ndërtoni një strukturë të lehtë dhe në të njëjtën kohë të fortë, fizika e asaj që ndodh në flluskat e sapunit vjen në shpëtim. Dhe ishte e mundur të ndërtohej modeli i parë adekuat i bërthamës atomike duke e krahasuar atë bërthama atomike një pikë lëngu të ngarkuar.
Bibliografi
- G. Ya. Myakishev, B. B. Bukhovtsev, N. N. Sotsky. "Fizika 10". - M.: Arsimi, 2008.
- Ya. E. Geguzin "Bubbles", Biblioteka Kvant. - M.: Nauka, 1985.
- B. M. Yavorsky, A. A. Pinsky "Bazat e fizikës" vëll. 1.
- G. S. Landsberg "Libër shkollor elementar i fizikës" vëll. 1.
- Nkj.ru ().
- Youtube.com ().
- Youtube.com ().
- Youtube.com ().
Detyre shtepie
- Pasi të keni zgjidhur detyrat për këtë mësim, do të jeni në gjendje të përgatiteni për pyetjet 7,8,9 të GIA dhe pyetjet A8, A9, A10 të Provimit të Unifikuar të Shtetit.
- Gelfgat I.M., Nenashev I.Yu. "Fizika. Përmbledhja e problemave nota 10 "5.34, 5.43, 5.44, 5.47 ()
- Bazuar në problemin 5.47, përcaktoni koeficientin e tensionit sipërfaqësor të tretësirës së ujit dhe sapunit.
Lista e pyetjeve dhe përgjigjeve
Pyetje: Pse tensioni sipërfaqësor ndryshon me temperaturën?
Përgjigje: Me rritjen e temperaturës, molekulat e lëngut fillojnë të lëvizin më shpejt, dhe për këtë arsye, molekulat i kapërcejnë më lehtë forcat e mundshme të tërheqjes. Kjo çon në një ulje të forcave të tensionit sipërfaqësor, të cilat janë forca potenciale që lidhin molekulat e shtresës afër sipërfaqes së lëngut.
Pyetje: A varet koeficienti i tensionit sipërfaqësor nga dendësia e lëngut?
Përgjigje: Po, po, sepse energjia e molekulave të shtresës afër sipërfaqes së lëngut varet nga dendësia e lëngut.
Pyetje: Cilat janë mënyrat për të përcaktuar koeficientin e tensionit sipërfaqësor të një lëngu?
Përgjigje: AT kursi shkollor studioni dy mënyra për të përcaktuar koeficientin e tensionit sipërfaqësor të një lëngu. E para është metoda e grisjes së telit, parimi i saj përshkruhet në problemin 5.44 nga detyre shtepie, e dyta është metoda e numërimit të pikave e përshkruar në problemin 5.47.
Pyetje: Pse flluskat e sapunit shemben pas pak?
Përgjigje: Fakti është se pas një kohe, nën veprimin e gravitetit, flluska bëhet më e trashë në fund sesa në krye, dhe më pas, nën ndikimin e avullimit, shembet në një moment. Kjo rezulton që e gjithë flluska të jetë si tullumbace, shembet nën veprimin e forcave të pakompensuara të tensionit sipërfaqësor.
Molekulat e një lëngu janë të vendosura shumë afër njëra-tjetrës, kështu që forcat e tërheqjes arrijnë një vlerë të konsiderueshme. Çdo molekulë përjeton tërheqje nga molekulat fqinje.
Nëse molekula është brenda lëngut (Fig. 16), atëherë rezultanta e forcave që veprojnë mbi të është zero. Situata është e ndryshme nëse molekula është në shtresën sipërfaqësore të lëngut. Dendësia e avullit (ose gazit) me të cilin kufizohet lëngu është shumë herë më e vogël se dendësia e lëngut, prandaj rezultanta e forcave që veprojnë nga ana e molekulave të avullit do të jetë gjithashtu shumë më e vogël se rezultanta e forcave që veprojnë nga ana e molekulave të lëngëta. Si rezultat, çdo molekulë e vendosur në shtresën sipërfaqësore do të ndikohet nga një forcë e drejtuar brenda lëngut.
Oriz. 16. Shfaqja e forcave të tensionit sipërfaqësor
Kur një molekulë kalon nga thellësia e lëngut në shtresën sipërfaqësore, mbi molekulë kryhet punë negative nga forcat që veprojnë mbi të në këtë shtresë. ku energjia kinetike molekula zvogëlohet, duke u kthyer në potencial. Kështu, molekulat në shtresën sipërfaqësore kanë energji potenciale shtesë. Shtresa sipërfaqësore në tërësi ka energji shtesë, e cila hyn pjesë integrale në energjia e brendshme lëngjeve.
Prania e kësaj energjie shtesë bën që lëngu të tentojë të zvogëlojë sipërfaqen e tij. Lëngu sillet sikur të ishte i mbyllur në një film elastik të shtrirë që tenton të tkurret. Në fakt, nuk ka film, shtresa sipërfaqësore përbëhet nga të njëjtat molekula si i gjithë lëngu.
Le të veçojmë mendërisht një seksion në sipërfaqen e lëngshme të kufizuar nga një kontur i mbyllur i gjatësisë l. Tendenca e këtij seksioni për t'u tkurrur çon në faktin se ai do të veprojë në pjesën tjetër të sipërfaqes me forca tangjenciale me sipërfaqen. Këto forca quhen forca të tensionit sipërfaqësor. Për kuantifikimi forcat sipërfaqësore sjellin një vlerë të quajtur koeficienti i tensionit sipërfaqësor (ose tensioni sipërfaqësor).
Koeficienti i tensionit sipërfaqësor (α) është një sasi fizike skalare e barabartë me raportin e modulit të forcës së tensionit sipërfaqësor F, duke vepruar në kufirin e shtresës sipërfaqësore me gjatësinë l, në këtë gjatësi:
 (33)
(33)
Për të ndryshuar sipërfaqen e shtresës sipërfaqësore në temperaturë konstante nga shuma dS, duhet bërë punë
δA = αdS, (34)
ku α është koeficienti i tensionit sipërfaqësor.
Kur ndryshoni zonën nga S1 përpara S2 puna do të jetë e barabartë me:
A = α(S2 – S1). (35)
Gjatë kryerjes së punës A, energjia e shtresës sipërfaqësore ndryshon me sasinë ΔW.
A= ΔW.= α(S2 – S1) = αdS.
![]() (36)
(36)
Dimensioni α:
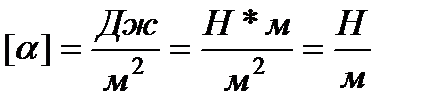 .
.
Kështu, mund të jepet një përkufizim tjetër i koeficientit të tensionit sipërfaqësor.
Koeficienti i tensionit sipërfaqësor është një sasi fizike skalare e barabartë me raportin e ndryshimit të energjisë potenciale të shtresës sipërfaqësore me ndryshimin në sipërfaqen e kësaj shtrese.
Koeficienti i tensionit sipërfaqësor varet nga përbërje kimike lëngu dhe temperatura e tij. Ndërsa temperatura rritet, α zvogëlohet dhe zhduket në temperaturën kritike.
Tensioni sipërfaqësor varet ndjeshëm nga papastërtitë e pranishme në lëngje. Substancat që ulin tensionin sipërfaqësor të një lëngu quhen surfaktantë. Sapuni është surfaktanti më i njohur për ujin. Zvogëlon ndjeshëm tensionin e tij sipërfaqësor (afërsisht nga 7.5*10 -2 në 4.5*10 -2 N/m). Në lidhje me ujin, eteret, alkoolet, vaji, etj. janë aktive sipërfaqësore. Nga pikëpamja molekulare, ndikimi i surfaktantëve shpjegohet me faktin se forcat e tërheqjes midis molekulave të një lëngu janë më të mëdha se forcat e tërheqjes midis molekulave të një lëngu dhe një papastërtie. Molekulat e lëngshme në shtresën sipërfaqësore tërhiqen në lëngje me forcë më të madhe se molekulat e papastërtive. Si rezultat, molekulat e lëngshme lëvizin nga shtresa sipërfaqësore thellë në të, dhe molekulat e surfaktantit zhvendosen në sipërfaqe.
Surfaktantët përdoren si agjentë njomëse, reagentë flotues, agjentë shkumëzues, dispersant - reduktues të fortësisë, aditivë plastifikues, modifikues kristalizimi etj.
Gjithçka që është thënë për kushtet e veçanta në të cilat gjenden molekulat e shtresës sipërfaqësore vlen tërësisht edhe për trupat e ngurtë. Prandaj, lëndët e ngurta, si lëngjet, kanë tension sipërfaqësor.
Kur merren parasysh dukuritë në ndërfaqe mjedise të ndryshme duhet pasur parasysh se energjia sipërfaqësore e një lëngu ose të ngurtë varet jo vetëm nga vetitë e lëngut ose të ngurtës së dhënë, por edhe nga vetitë e substancës me të cilën ato kufizohen. Në mënyrë rigoroze, është e nevojshme të merret parasysh energjia totale e sipërfaqes α 12 e dy substancave që ngjiten me njëra-tjetrën. Vetëm nëse një substancë është e gaztë, nuk reagon kimikisht me një substancë tjetër dhe tretet pak në të, mund të flasim thjesht për energjinë sipërfaqësore (ose koeficientin e tensionit sipërfaqësor) të trupit të dytë të lëngët ose të ngurtë.

Oriz. 17. Kufiri i trupit të lëngët, të gaztë dhe të ngurtë
Nëse tre substanca kufizohen me njëra-tjetrën njëherësh: e ngurtë, e lëngët dhe e gaztë (Fig. 17), atëherë i gjithë sistemi merr një konfigurim që korrespondon me minimumin e energjisë totale potenciale (sipërfaqja, në fushën e gravitetit, etj.) . Në veçanti, kontura përgjatë së cilës kufizohen të tre substancat është e vendosur në sipërfaqen e një trupi të ngurtë në atë mënyrë që shuma e projeksioneve të të gjitha forcave të tensionit sipërfaqësor të aplikuara në secilin element të konturit në drejtimin në të cilin elementi kontur mund të lëvizë (d.m.th., në drejtimin e tangjentes në sipërfaqen e një trupi të ngurtë) ishte e barabartë me zero. Nga fig. 17 rrjedh se kushti i ekuilibrit për një element konturor me gjatësi Δl do të shkruhet si më poshtë:
Δlα TG = Δlα TG + Δlα TG cosθ (37)
ku α TG, α TG dhe α ZhG janë koeficientët e tensionit sipërfaqësor në kufijtë: e ngurtë - gaz, e ngurtë - e lëngshme dhe e lëngshme - gaz.
Këndi θ i matur brenda lëngut midis tangjenteve me sipërfaqen e lëndës së ngurtë dhe me sipërfaqen e lëngut quhet këndi i kontaktit. Sipas (37)
 . (38)
. (38)
Këndi i kontaktit përcaktohet nga shprehja (38) vetëm me kushtin që
 . (39)
. (39)
Nëse (39) nuk është i kënaqur, d.m.th. |α TG – α TG | > α ZhG, nuk mund të vendoset ekuilibër për asnjë vlerë të θ. Kjo ndodh në dy raste.
1) α TG > α TG + α FG. Pavarësisht se sa i vogël është këndi θ, forca α TG peshon më shumë se dy të tjerat (Fig. 18, a). Në këtë rast, lëngu përhapet pafundësisht mbi sipërfaqen e një trupi të ngurtë - ka lagja e plotë. Zëvendësimi i sipërfaqes së ngurtë - gaz me dy sipërfaqe, të ngurtë - të lëngët dhe të lëngshëm - të gaztë, rezulton të jetë energjikisht i favorshëm. Me lagështimin e plotë, këndi i kontaktit është zero.
2) α TG > α TG + α FG. Pavarësisht se sa afër është këndi θ me π, forca α TL peshon më shumë se dy të tjerat (Fig. 18,b). Zëvendësimi i sipërfaqes së ngurtë-lëngshme me dy sipërfaqe, të ngurtë-gaz dhe të lëngët-gaz, rezulton të jetë energjikisht i favorshëm. Me mosnjohje të plotë, këndi i kontaktit është i barabartë me π .

Oriz. 18. Lagim i plotë dhe mos lagim i plotë
Nëse plotësohet kushti (39), këndi i kontaktit mund të dalë i mprehtë ose i mpirë, në varësi të raportit midis α TG dhe α TG. Nëse α TG > α TG, atëherë cosθ > 0 dhe këndi θ është akut (Fig. 19a). Në këtë rast, bëhet lagja e pjesshme. Nëse α TG< α ТЖ, то cosθ < 0, и угол θ - тупой (рис. 19,б). В этом случае имеет место частичное несмачивание.

Fig.19. Lagim i pjesshëm dhe jo lag i pjesshëm
Tensioni sipërfaqësor i ujit është një nga vetitë më interesante të ujit.
Këtu është një përkufizim i këtij termi nga një burim kompetent.
Tensioni sipërfaqësor është...
Enciklopedia e Madhe Mjekësore
Tensioni sipërfaqësor (P. n.) është forca tërheqëse me të cilën çdo seksion i filmit sipërfaqësor (sipërfaqja e lirë e një lëngu ose ndonjë ndërfaqe ndërmjet dy fazave) vepron në pjesët ngjitur të sipërfaqes. Presioni i brendshëm dhe P. n. Shtresa sipërfaqësore e lëngut sillet si një membranë e shtrirë elastike. Sipas idesë së zhvilluar nga Kap. arr. Laplace (Laplace), kjo veti e sipërfaqeve të lëngshme varet nga "forcat molekulare të tërheqjes, duke u zvogëluar me shpejtësi me distancën. Brenda një lëngu homogjen, forcat që veprojnë në secilën molekulë nga molekulat që e rrethojnë janë të balancuara reciproke. Por pranë sipërfaqes, forca rezultante e tërheqjes molekulare drejtohet nga brenda; ai tenton të tërheqë molekulat sipërfaqësore në pjesën më të madhe të lëngut. Si rezultat, e gjithë shtresa sipërfaqësore, si një film elastik i shtrirë, ushtron një presion shumë të rëndësishëm në masën e brendshme të lëngut në drejtimin normal me sipërfaqen. Sipas vlerësimeve, ky “presion i brendshëm”, nën të cilin ndodhet e gjithë masa e lëngut, arrin në disa mijëra atmosfera. Ajo rritet në një sipërfaqe konvekse dhe zvogëlohet në një sipërfaqe konkave. Për shkak të prirjes së energjisë së lirë në minimum, çdo lëng tenton të marrë një formë në të cilën sipërfaqja e tij - vendi i veprimit të forcave sipërfaqësore - ka vlerën më të vogël të mundshme. Sa më e madhe të jetë sipërfaqja e lëngut, aq më e madhe është zona e zënë nga filmi i sipërfaqes së tij, aq më e madhe është sasia e energjisë së sipërfaqes së lirë të çliruar gjatë tkurrjes së tij. Tensioni me të cilin çdo seksion i filmit të sipërfaqes kontraktuese vepron në pjesët ngjitur (në drejtim paralel me sipërfaqen e lirë) quhet tension i tensionit. Në ndryshim nga tensioni elastik i një trupi të shtrirë elastik, P. n. nuk dobësohet pasi filmi i sipërfaqes është i ngjeshur. … Tensioni sipërfaqësor është i barabartë me punën që duhet bërë për të rritur me një sipërfaqen e lirë të lëngut. P. n. vërehet në kufirin e një lëngu me një gaz (edhe me avullin e vet), me një lëng tjetër të papërziershëm ose me një trup të ngurtë. Në të njëjtën mënyrë, një trup i ngurtë ka një P. n. në ndërfaqen me gazet dhe lëngjet. Ndryshe nga P. n., një lëng i prerë (ose trup i ngurtë) ka në sipërfaqen e tij të lirë, në kufi me një mjedis të gaztë, tension në kufirin e brendshëm të dy fazave të lëngshme (ose të lëngshme dhe të ngurta), është e përshtatshme të caktohet një term i veçantë. i adoptuar në letërsinë gjermane, termi "tension kufitar" (Grenzflachenspannung). Nëse treten në lëng, uleni atë P. n., atëherë energji e lirë zvogëlohet jo vetëm duke zvogëluar madhësinë e sipërfaqes kufitare, por edhe përmes adsorbimit: një substancë aktive sipërfaqësore (ose kapilare) mblidhet në një përqendrim të shtuar në shtresën sipërfaqësore ...
…Enciklopedi e madhe mjekësore. 1970
Të gjitha sa më sipër mund të përmblidhen në këtë mënyrë - molekulat që ndodhen në sipërfaqen e çdo lëngu, përfshirë ujin, tërhiqen nga pjesa tjetër e molekulave brenda lëngut, si rezultat i të cilave lind tensioni sipërfaqësor. Theksojmë se ky është një kuptim i thjeshtuar i kësaj prone.
Tensioni sipërfaqësor i ujit
Për një kuptim më të mirë të kësaj vetie, ne paraqesim disa manifestime të tensionit sipërfaqësor të ujit në jetën reale:
- Kur shohim sesi uji pikon nga maja e rubinetit dhe nuk derdhet, ky është tensioni sipërfaqësor i ujit;
- Kur një pikë shiu gjatë fluturimit merr një formë të rrumbullakosur, pak të zgjatur, ky është tensioni sipërfaqësor i ujit;
- Kur uji në një sipërfaqe të papërshkueshme nga uji merr një formë sferike, ky është tensioni sipërfaqësor i ujit;
- Grumbullimet që ndodhin kur fryn era në sipërfaqen e trupave ujorë janë gjithashtu një manifestim i tensionit sipërfaqësor të ujit;
- Uji në hapësirë merr një formë sferike për shkak të tensionit sipërfaqësor;
- Insekti strider i ujit qëndron në sipërfaqen e ujit falë kësaj vetie të ujit;
- Nëse një gjilpërë vendoset me kujdes në sipërfaqen e ujit, ajo do të notojë;
- Nëse lëngjet me densitet dhe ngjyrë të ndryshme derdhen në mënyrë alternative në një gotë, do të shohim që ato nuk përzihen;
- Flluskat e ylberta të sapunit janë gjithashtu një manifestim i mrekullueshëm i tensionit sipërfaqësor.
Koeficienti i tensionit sipërfaqësor
Fjalor shpjegues terminologjik politeknik
Koeficienti i tensionit sipërfaqësor është forca lineare e tensionit sipërfaqësor në sipërfaqen e një lëngu ose në ndërfaqen midis dy lëngjeve të papërziershëm.
Terminologjike politeknike Fjalor. Përpiluar nga: V. Butakov, I. Fagradyants. 2014
Më poshtë japim vlerat e koeficientit të tensionit sipërfaqësor (C.T.S.) për lëngje të ndryshme në një temperaturë prej 20 ° C:
- K. p. n. aceton - 0,0233 Njuton / Metër;
- K. p. n. benzinë - 0,0289 Njuton / Metër;
- K. p. n. ujë i distiluar - 0,0727 Njuton / Metër;
- K. p. n. glicerinë - 0,0657 Njuton / Metër;
- K. p. n. vajguri - 0,0289 Njuton / Metër;
- K. p. n. merkur - 0,4650 Njuton / Metër;
- K. p. n. alkool etilik - 0,0223 Njuton / Metër;
- K. p. n. eter - 0,0171 Njuton / Metër.
Koeficienti i tensionit sipërfaqësor të ujit
Koeficienti i tensionit sipërfaqësor varet nga temperatura e lëngut. Le të paraqesim vlerat e saj për temperatura të ndryshme ujë.
- Në një temperaturë prej 0 ° C - 75,64 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 10 ° C - 74,22 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 20 ° C - 72,25 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 30°C - 71,18 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 40 ° C - 69,56 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 50 ° C - 67,91 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 60 ° C - 66,18 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 70 ° C - 64,42 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 80 ° C - 62,61 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 90°C - 60,75 σ, 10 -3 Njuton / Metër;
- Në një temperaturë prej 100°C - 58,85 σ, 10 -3 Njuton / Metër.






