Energjia Gibbs e substancave të thjeshta. energji gibbs
Kimisti fizik holandez van't Hoff propozoi një teori të re të afinitetit kimik, e cila, pa shpjeguar natyrën e afinitetit kimik, kufizohet në tregimin e metodës së matjes së tij, d.m.th. kuantifikimi afiniteti kimik.
van't Hoff përdor si masë të afinitetit kimik punën maksimale Ayax ose për reaksionet që ndodhin në ose përkatësisht.
Puna maksimale është e barabartë me energjinë që duhet të aplikohet në sistem për të ndaluar reaksionin, domethënë për të kapërcyer forcat e afinitetit kimik. Meqenëse reaksioni vazhdon në drejtim të punës maksimale pozitive, shenja ose përcakton drejtimin e rrjedhës spontane të ndërveprimit kimik.
Puna maksimale në vëllim konstantështë e barabartë me
Diferenca quhet energjia Helmholtz e sistemit dhe shënohet me shkronjën Kështu,
Puna maksimale në presion konstantështë e barabartë me
Diferenca quhet energjia Gibbs e sistemit dhe shënohet me shkronjën Kështu,
![]()
Energjia Gibbs e një reaksioni kimik.
Funksioni termodinamik i energjisë së Gibbs-it të gjendjes së sistemit Ndryshimi në energjinë e Gibbs-it në sistem gjatë rrjedhës reaksion kimik quhet energjia Gibbs e një reaksioni kimik. Sipas ekuacioneve (IV.20) dhe (IV.21),
![]()
Bazuar në (IV.21), energjia Gibbs e një reaksioni kimik karakterizon drejtimin dhe kufirin e ecurisë spontane të reaksionit në kushte të temperaturës dhe presionit konstant.
Energjia e Helmholcit të një reaksioni kimik.
Energjia e Helmholcit është gjithashtu një funksion termodinamik i gjendjes së sistemit.Ndryshimi i energjisë së Helmholcit në një sistem gjatë një reaksioni quhet energjia e Helmholcit të një reaksioni kimik. Sipas (IV.18) dhe (IV.19),
ku dhe janë ndryshimi në funksionet termodinamike përkatëse gjatë reaksionit që vazhdon në dhe temperaturën T.
Vlera [shih ekuacioni (IV. 19)] karakterizon drejtimin dhe kufirin e rrjedhës spontane të reaksioneve në kushte izokoriko-izotermike.
Në fig. IV.3 tregon lidhjen ndërmjet funksioneve kryesore termodinamike të gjendjes së sistemit.
Energjia e Gibbs-it e formimit të komponimeve kimike.
Energjia Gibbs e një reaksioni kimik, duke qenë një ndryshim në funksionin termodinamik të gjendjes së sistemit, mund të llogaritet nga diferenca
![]()
(indekset "2" dhe "1" i referohen përkatësisht gjendjeve përfundimtare dhe fillestare të sistemit). Gjatë llogaritjes së energjisë së Gibbs-it të një reaksioni kimik sipas ekuacionit (IV.24), duhet pasur parasysh se - shuma e energjive të Gibbs-it të formimit të të gjitha produkteve të reaksionit, - shuma e energjive të Gibbs-it të formimit. e të gjitha substancave fillestare. Energjia standarde e Gibbs-it e një reaksioni kimik llogaritet nga diferenca midis shumave të energjive standarde të Gibbs-it të formimit të produkteve të reaksionit dhe materialeve fillestare.
Edukimi standard i Gibbs Energjisë përbërje kimike quaj energjinë Gibbs të reaksionit të formimit të një moli të këtij komponimi, i cili është në gjendje standarde, nga ajo përkatëse
Oriz. IV.3. Raporti i funksioneve më të rëndësishme termodinamike
substanca të thjeshta, që gjenden edhe në shtetet standarde dhe fazat dhe modifikimet që janë termodinamikisht të qëndrueshme në një temperaturë të caktuar (Tabela IV.3).
Energjitë standarde të Gibbs-it të formimit të substancave të thjeshta merren të barabarta me zero nëse ato gjendjet agregate dhe modifikimet janë të qëndrueshme në kushte standarde dhe 298.16 K.
Drejtimi dhe kufijtë e rrjedhës spontane të reaksioneve kimike.
Në përputhje me (IV. 19) dhe (IV.21), puna maksimale pozitive A ose korrespondon me vlerat negative të energjisë Helmholtz dhe energjisë Gibbs të reaksioneve kimike. Me fjalë të tjera, kur temperaturë konstante dhe presionit, reaksioni vazhdon spontanisht në drejtimin që korrespondon me zvogëlimin e energjisë Gibbs të sistemit. Prandaj, kushti për rrjedhën spontane të një reaksioni kimik në të dhënë dhe T është pabarazia.
Kufiri i rrjedhës spontane të reaksionit në, d.m.th., kushti i ekuilibrit, është arritja e vlerës minimale për të dhënat dhe T të funksionit.
Në temperaturë dhe vëllim konstant, reaksioni vazhdon spontanisht në drejtimin që i përgjigjet zvogëlimit të energjisë së Helmholtz-it të sistemit.Prandaj, kushti për spontan
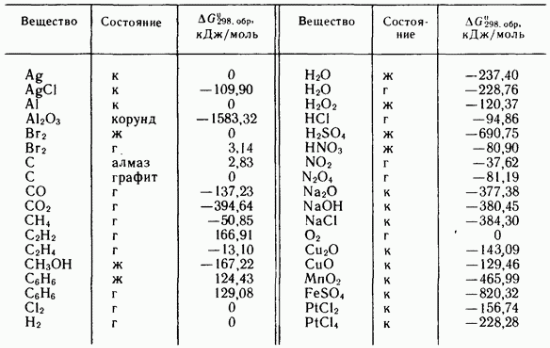
Tabela IV.3, Energjitë standarde të Gibbs-it të formimit të disa substancave dhe komponimeve të thjeshta në 298,16 K
rrjedha arbitrare e një reaksioni kimik për V dhe T të dhënë është pabarazia
Kufiri i rrjedhës spontane të reaksionit në, d.m.th., kushti i ekuilibrit, është arritja e vlerës minimale për vlerat e dhëna V dhe T të funksionit.
Nëse gjatë ndryshimit përbërje kimike Sistemi korrespondon me një rritje të energjisë Gibbs, që do të thotë se një reagim spontan nuk ndodh. Pabarazia
do të thotë se reagimi mund të vazhdojë spontanisht vetëm në drejtim i kundërt, që korrespondon me uljen e energjisë Gibbs të sistemit. Nuk është e vështirë të llogaritet energjia standarde e Gibbs-it të një reaksioni kimik në 298,16 K dhe kështu të zbulohet shenja e ndryshimit të funksionit.
Kështu, për shembull, duke përdorur të dhënat e dhëna në tabelë. IV.3, mund të llogaritet energjia standarde Gibbs e reaksionit në 298,16 K (për 1 mol
Vlera rezultuese e energjisë Gibbs të reaksionit plotëson pabarazinë (IV.25). Kjo do të thotë se në 101 kPa dhe 298 K, procesi i bashkëveprimit të oksidit të natriumit me ujin mund të vazhdojë spontanisht në drejtim të prodhimit (k).
Megjithatë energji standarde Gibbs-i i një reaksioni kimik nuk mund të jetë një kriter për drejtimin ose kufirin e shfaqjes spontane të një ndërveprimi kimik në kushte të ndryshme nga standardi. Është gjithashtu e pamundur të zëvendësohet sasia me sasinë.E gjithë kjo e ndërlikon disi përdorimin e energjisë Gibbs për të vlerësuar proceset që ndodhin në kushte reale.
Nga ekuacioni (IV.22) rezulton se kur energjia Gibbs e një reaksioni kimik është sa më e vogël, aq më e vogël dhe më e madhe.Afiniteti më i madh kimik i substancave për njëra-tjetrën manifestohet në reaksionet që vazhdojnë me çlirimin e nxehtësisë dhe janë shoqëruar me një rritje të entropisë së sistemit Nga ekuacioni (IV.22) rezulton gjithashtu se proceset endotermike që ndodhin me një ulje të entropisë nuk mund të ndodhin në mënyrë spontane, pasi vlera është gjithmonë pozitive në këtë rast. Ndërveprimet endotermike mund të vazhdojnë spontanisht vetëm nëse ndërveprime të tilla lehtësohen nga një rritje e temperaturës, pasi kjo rrit vlerën e faktorit të entropisë së procesit.
Këtu do të gjeni shembuj të detyrave për llogaritjen e parametrave të tillë termodinamikë si entalpia, entropia, . Përcaktimi i mundësisë së rrjedhjes spontane të procesit, si dhe përpilimi i ekuacioneve termokimike.
Detyra për pjesën Bazat e termodinamikës me zgjidhje
Detyra 1. Llogaritni entalpinë standarde dhe entropinë standarde të një reaksioni kimik. Përcaktoni se në cilin drejtim në 298 °K (përpara ose mbrapa) do të vazhdojë reaksioni. Llogaritni temperaturën në të cilën të dy drejtimet e reaksionit janë njësoj të mundshme.
Fe 2 O 3 (c) + 3H 2 \u003d 2Fe (c) + 3H 2 O (g)
Δ Hrrethi = ΣH 0 kon– ΣH 0 ref kJ/mol
Përdorimi i të dhënave të referencës entalpi standarde substanca, gjejmë:
Δ Hrrethi= 2 Δ H 0 Fe +3 Δ H 0 H2 O - Δ H 0 Fe2 O3 - 3 Δ H 0 H2 \u003d 2 0 + 3 (- 241,82) - (-822,16) - 3 0 \u003d 96,7 kJ / mol
Δ Srrethi=Σ S 0 kon– Σ S 0 ref J/(mol K)
Përdorimi i të dhënave të referencës entropitë standarde substanca, gjejmë:
Δ Srrethi= 2 Δ S 0 Fe + 3 Δ S 0 H2 O - Δ S 0 Fe2 O3 - 3 Δ S 0 H2 = 2 27,15 + 3 188,7 – 89,96 – 3 131 = 137,44 J/(mol K)
ΔG = Δ H – TΔS\u003d 96,7 - 298 137,44 / 1000 \u003d 55,75 kJ / mol
Në T=298°K, ΔG> 0 - reaksioni nuk vazhdon spontanisht, d.m.th. reaksioni do të vazhdojë në drejtim të kundërt.
ΔG = Δ H – TΔS= 0, pastaj
T= — (ΔG – Δ H) / ∆S= — (0-96,7)/0,137 = 705,83K
Në T = 705,83 K, reaksioni do të vazhdojë me probabilitet të barabartë si në drejtimin përpara ashtu edhe në drejtim të kundërt.
Detyra 2. Llogaritni energjinë e Gibbs-it dhe përcaktoni mundësinë që reaksioni të ndodhë në temperaturat 1000 dhe 3000 K.
Ekuacioni i reagimit për djegien e disulfidit të karbonit të lëngshëm është si më poshtë:
CS 2 (l) + 3O 2 \u003d CO 2 + 2SO 2
Ne llogarisim efektin e nxehtësisë së reaksionit duke zëvendësuar të dhënat e referencës së entalpive standarde të substancave në shprehjen:
Δ Hrrethi = ΣH 0 kon– ΣH 0 ref kJ/mol
Δ Hrrethi= 2 Δ H 0 SO2+ Δ H 0 CO2- Δ H 0 CS2 - 3 Δ H 0 O2 \u003d 2 (-296,9) + 3 (- 393,5) - 87 - 3 0 \u003d -1075,1 kJ / mol
Ato. gjatë djegies 1 nishan lirohet disulfidi i karbonit 1075,1 kJ ngrohjes
dhe kur digjet x nishanet lirohet disulfidi i karbonit 700 kJ ngrohjes
Le të gjejmë X:
x\u003d 700 1 / 1075,1 \u003d 0,65 mol
Pra, nëse 700 kJ nxehtësi lirohet si rezultat i reaksionit, atëherë 0,65 mol CS 2 do të hyjnë në reaksion
Detyra 4. Llogaritni efektin termik të reaksionit të reduktimit të oksidit të hekurit (II) me hidrogjenin, bazuar në ekuacionet termokimike të mëposhtme:
1. FeO (c) + CO (g) \u003d Fe (c) + CO 2 (g); ΔH 1 = -18,20 kJ;
2. CO (g) + 1 / 2O 2 (g) \u003d CO 2 (g) ΔH 2 \u003d -283,0 kJ;
3. H 2 (g) + ½ O 2 (g) \u003d H 2 O (g) ΔH 3 \u003d -241,83 kJ.
Reaksioni i reduktimit të oksidit të hekurit (II) me hidrogjen ka formën e mëposhtme:
4. FeO (c) + H 2 (g) = Fe (c) + H 2 O (g)
Për të llogaritur efektin termik të reaksionit, është e nevojshme të aplikohet , d.m.th. reaksioni 4. mund të merret duke shtuar reaksionet 1. dhe 2. dhe duke zbritur reaksionin 1.:
Δ Hrrethi= Δ H 1 + Δ H 3 – Δ H 2 \u003d -18,2 - 241,3 + 283 \u003d 23 kJ
Në këtë mënyrë, efekti termik i reaksionit reduktimi i oksidit të hekurit (II) me hidrogjen është i barabartë me
Δ Hrrethi= 23 kJ
Detyra 5. Reaksioni i djegies së benzenit shprehet me barazimin termokimik:
C 6 H 6 (g) + 7½ O 2 (g) \u003d 6CO 2 (g) + 3H 2 O (g) - 3135,6 kJ.
Llogaritni nxehtësinë e formimit të benzenit të lëngët. Përcaktoni vlerën kalorifike të benzenit të lëngshëm, me kusht që kushtet standarde të jenë të njëjta me ato normale.
Efekti termik i reaksionit është:
Δ Hrrethi = ΣH 0 kon– ΣH 0 ref kJ/mol
Në rastin tonë Δ Hrrethi= - 3135.6 kJ, gjejmë nxehtësinë e formimit të benzenit të lëngët:
Δ Hrrethi= 6 Δ H 0 Me O2 + 3 Δ H 0 H2 O - Δ H 0 C6 H6 - 7,5 Δ H 0 O2
-Δ H 0 C6 H6= Δ Hrrethi- 3 (-241,84) + 6 (- 393,51) - 7,5 0 \u003d - 3135,6 - 3 (-241,84) + 6 (- 393,51) - 7, 5 0 \u003d - 49,02 kJ / mol
Δ H 0 C6 H6 = 49,02 kJ/mol
Vlera kalorifike benzeni i lëngshëm llogaritet me formulën:
PT= Δ Hrrethi 1000 / M
M(benzen) = 78 g/mol
PT= - 3135,6 1000 / 78 = - 4,02 10 4 kJ / kg
Vlera kalorifike benzen i lëngët P T = - 4,02 10 4 kJ / kg
Detyra 6. Reaksioni i oksidimit të alkoolit etilik shprehet me barazimin:
C 2 H 5 OH (g) + 3.0 O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g).
Përcaktoni nxehtësinë e formimit C 2 H 5 OH (l), duke ditur ΔH x.r. = - 1366,87 kJ. Shkruani një ekuacion termokimik. Përcaktoni nxehtësinë molare të avullimit C 2 H 5 OH (g) → C 2 H 5 OH (g), nëse dihet nxehtësia e formimit C 2 H 5 OH (g), e barabartë me –235,31 kJ mol -1.
Bazuar në të dhënat e dhëna, ne shkruajmë ekuacioni termokimik:
C 2 H 5 OH (g) + 3O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g) + 1366,87 kJ
efekt termik reagimet barazohet me:
Δ Hrrethi = ΣH 0 kon– ΣH 0 ref kJ/mol
Në rastin tonë Δ Hrrethi= - 1366,87 kJ.
Përdorimi i të dhënave të referencës nxehtësitë e formimit të substancave, gjejmë nxehtësinë e formimit C 2 H 5 OH (l):
Δ Hrrethi= 2 Δ H 0 Me O2 + 3 Δ H 0 H2 O - Δ H 0 C2 H5 OH (l) - 3 Δ H 0 O2
- 1366,87 \u003d 2 (-393,51) + 3 (-285,84)- Δ H 0 C2 H5 OH - 3 0
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
Δ H 0 C2 H5 OH(g) = Δ H 0 C2 H5 OH(l) + Δ H 0 avullimi
Δ H 0 avullim = Δ H 0 C2 H5 OH (g) - Δ H 0 C2 H5 OH (l)
Δ H 0 avullimi\u003d - 235,31 + 277,36 \u003d 42,36 kJ / mol
Përcaktuam se nxehtësia e formimit të C 2 H 5 OH (l) është e barabartë me
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
dhe nxehtësia molare e avullimit C 2 H 5 OH (l) → C 2 H 5 OH (g) është
Δ H 0 avullimi= 42,36 kJ/mol
Detyra 7. Si mund të shpjegohet se në kushte standarde, një reaksion ekzotermik është i pamundur:
CO 2 (g) + H 2 (g) ↔ CO (g) + H 2 O (g)?
Llogaritni ΔG të këtij reaksioni. Në çfarë temperaturash këtë reagim bëhet spontan?
Llogaritni ΔG ky reagim:
ΔG = Δ H – TΔS
Për ta bërë këtë, së pari përcaktojmë Δ Hdhe ∆S reagimet:
Δ Hrrethi = ΣH 0 kon– ΣH 0 ref kJ/mol
Përdorimi i të dhënave të referencës entalpi standarde substanca, gjejmë:
Δ Hrrethi= Δ H 0 H2 O(l) + Δ H 0 CO- Δ H 0 CO2 - Δ H 0 H2 \u003d -110,5 + (-285,8) - (393,5) - 0 \u003d -2,8 kJ / mol
Δ Srrethi=Σ S 0 kon– Σ S 0 ref J/(mol K)
Në mënyrë të ngjashme, duke përdorur të dhënat e referencës entropitë standarde substanca, gjejmë:
Δ Srrethi= Δ S 0 H2 O(l) + Δ S 0 CO- Δ S 0 CO2 - Δ S 0 H2 \u003d 197,5 + 70,1 - 213,7 - 130,52 \u003d -76,6 J / (mol K)
Le të gjejmë Energjia e Gibbs në kushte standarde
ΔGrrethi= Δ H – TΔS\u003d -2,8 + 298 76,6 / 1000 \u003d 20 kJ / mol> 0,
pra reagimi është spontan nuk shkon.
Gjeni në çfarë temperaturash bëhet ky reaksion spontane.
Në një gjendje ekuilibri ΔGrrethi = 0 , pastaj
T = Δ H/ ∆S = -2,8 / (-76,6 1000) \u003d 36,6 K
Detyra 8. Duke llogaritur në bazë të të dhënave tabelare ΔG dhe ΔS, përcaktoni efektin termik të reaksionit:
2 NO (g) + Cl 2 (g) ↔ 2 NOCl (g).
Në temperaturë dhe presion konstant, ndryshimi Energjia e Gibbs
ΔG = Δ H – TΔS
Bazuar në të dhënat tabelare, ne llogarisim ∆G dhe ∆S
ΔG 0 rrethi= Σ ΔG 0 prod — Σ ΔG 0 ref
ΔGrrethi= 2 ΔG 0 NOCl(G) — 2 ΔG 0 NR(G) — ΔG 0 Cl2(d)
ΔGrrethi= 2 66,37 — 2 89,69 – 0 = — 40,64 kJ/mol
ΔGrrethi < 0 , pra reagimi është spontan.
Δ Srrethi=Σ S 0 kon– Σ S 0 ref J/(mol K)
Δ Srrethi = 2 ∆S 0 NOCl(G) — 2 ∆S 0 NR(G) — ∆S 0 Cl2(d)
Δ Srrethi = 2 261,6 — 2 210,62 – 223,0 = -121,04 J/(mol K)
Le të gjejmë Δ H :
Δ H = ΔG + TΔS
Δ H = - 40,64 + 298 (-121,04 / 1000) \u003d - 76,7 kJ / mol
Efekti termik i reaksionit Δ H = - 76,7 kJ / mol
Detyra 9. Me çfarë do të bashkëveprojë më intensivisht (për 1 mol) klorur hidrogjeni i gaztë: me alumin apo me kallaj? Jepni përgjigjen tuaj duke llogaritur ΔG 0 për të dy reaksionet. Produktet e reaksionit janë kripa e ngurtë dhe hidrogjeni i gaztë.
Llogaritni ∆G0 për reaksionin e bashkëveprimit të klorurit të hidrogjenit të gaztë (për 1 mol) me aluminin
2Al (t) + 6HCl (g) \u003d 2AlCl 3 (t) + 3H 2
ΔG 0 rrethi= Σ ΔG 0 prod — Σ ΔG 0 ref kJ/mol
ΔG 0 rrethet1= 2 ΔG 0 AlCl 3 (t) + 3 ΔG 0 H2 — 2 ΔG 0 Al(t) - 6ΔG 0 HCl(G)
ΔG 0 rrethet1= 2 (-636.8) + 3 0 — njëzet - 6(-95,27) = -701,98 kJ/mol
Në reaksion marrin pjesë 2 mol Al(t). ΔGrrethet1 1 mol Al(t) është i barabartë me
ΔG 0 qarku 1 \u003d -701,98 / 2 \u003d -350,99 kJ / mol
Llogaritni ∆G0 për reaksionin e bashkëveprimit të klorurit të hidrogjenit të gaztë (për 1 mol) me kallaj:
Sn (t) + 2HCl (g) \u003d SnCl 2 (t) + H 2
ΔG 0 rrethet2 =ΔG 0 SnCl 2 (t) + ΔG 0 H2 — ΔG 0 Sn(t) — 2ΔG 0 HCl(G)
ΔG 0 qarku 2 \u003d -288,4 + 0- 0- 2 (-95,27) \u003d -97,86 kJ / mol
Të dyja reagimet kanë ΔG 0 <0 , prandaj, ato rrjedhin spontanisht në drejtimin përpara, por kloruri i gaztë i hidrogjenit do të ndërveprojë më intensivisht me aluminin, sepse
ΔG 0 qarku 1˂ ΔG 0 qarku 2
Problemi 10. Pa iu drejtuar llogaritjeve, përcaktoni cilat shenja (>0,<0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 HBr (g) + O 2 (g) ↔ 2 H 2 O (g) + 2 Br 2 (g)
Si do të ndikojë një rritje e temperaturës në drejtimin e një reaksioni kimik?
Në temperaturë dhe presion konstant Ndryshimi i energjisë së Gibbs lidhur me entalpinë dhe entropinë me shprehjen:
ΔG = Δ H – TΔS
është një masë e çrregullimit të sistemit. Vlera e entropisë është sa më e madhe, aq më i madh është çrregullimi në sistem (sa më shumë substanca të gazta). Në këtë reaksion, numri i moleve të gazeve në anën e djathtë është 5, dhe në anën e majtë është 4, që do të thotë se entropia e sistemit zvogëlohet. ∆S˂0.
Prandaj, sipas gjendjes së problemit, reagimi vazhdon në drejtimin përpara ΔG˂0.
Në kushte normale TΔS ˂˂ ΔH, pra në këtë rast ∆H˂0është një reaksion ekzotermik.
Kur temperatura rritet mund të vijë një kohë kur vlerat TΔS dhe Δ H bëhet i njëjtë, atëherë sistemi do të vijë në ekuilibër ΔG=0. Nëse temperatura rritet ndjeshëm, atëherë faktori i entropisë do të mbizotërojë TΔS, atëherë reagimi nuk do të vazhdojë më spontanisht ΔG>0.
Për të zgjidhur një nga problemet kryesore të termodinamikës kimike - për të vendosur mundësinë themelore të proceseve spontane - është e nevojshme të kemi një kriter sasior objektiv. Më sipër u tregua se forcat që veprojnë në procese të ndryshme (përfshirë ato kimike) janë dy tendenca konkurruese ose dy faktorë të kundërt:
1. Energjia, ose entalpia, për shkak të dëshirës së sistemit për të shkuar në gjendjen me energjinë më të ulët, për shembull, në p = konst, ulni entalpinë (𝛥H< 0);
2. Strukturore, ose entropia, për shkak të dëshirës së sistemit për të kaluar në një gjendje me një shkallë maksimale të çrregullimit, d.m.th. rrisin entropinë (𝛥S>0).
Nëse shkalla e çrregullimit nuk ndryshon gjatë reaksionit (𝛥S=0), atëherë drejtimi i procesit përcaktohet nga ndryshimi i entalpisë dhe procesi vazhdon spontanisht në drejtim të zvogëlimit të entalpisë (𝛥H< 0).
Nëse procesi ndodh pa ndryshuar entalpinë (𝛥H=0), atëherë entropia është faktori që përcakton drejtimin e reaksionit dhe procesi do të rritet spontanisht në drejtim të rritjes së tij (𝛥S > 0).
Nëse entalpia dhe entropia ndryshojnë njëkohësisht, atëherë drejtimi i rrjedhës spontane të procesit përcaktohet nga totali forca lëvizëse reagimet. Një reagim spontan vazhdon në drejtimin në të cilin totali forca lëvizëse sistemet do të ulen.
Duke pasur parasysh veprimin e njëkohshëm të këtyre dy faktorëve të kundërt, një forcë e tillë lëvizëse (funksioni i gjendjes) për reaksionet që ndodhin në temperaturë dhe presion konstant është energjia Gibbs (G), e quajtur gjithashtu potenciali izobarik-izotermik, ose energjia e lirë.
Si kriter për përcaktimin e drejtimit të rrjedhës spontane të proceseve kimike (kur p=const, ndryshimi në energjinë Gibbs 𝛥G ose
𝛥G=G 2 - G 1 (1,27)
Në varësi të shenjës së ndryshimit të saj, janë të mundshme tre raste.
1. 𝛥G< 0, реакция термодинамически возможна.
Në temperaturë dhe presion konstant, reaksionet kimike vazhdojnë spontanisht vetëm në drejtim të zvogëlimit të energjisë Gibbs në sistem (𝛥G< 0).
Kjo dispozitë lidhet me parimin e energjisë minimale, i cili qëndron në themel të ligjit të dytë të termodinamikës, një nga formulimet e të cilit thotë:
"Nxehtësia nuk mund të kalojë në mënyrë të pavarur nga një trup më pak i nxehtë në një trup më të nxehtë, vetëm procesi i kundërt është i mundur spontanisht."
2. 𝛥G > 0, reaksioni është termodinamikisht i pamundur;
3. 𝛥G = 0, të dyja reaksionet e drejtpërdrejta dhe të kundërta janë termodinamikisht të mundshme.
Mungesa e një ndryshimi në energjinë Gibbs është një kusht termodinamik për vendosjen e ekuilibrit kimik në sistemin e reaksionit.
Energjia e Gibbs-it lidhet me entalpinë, entropinë dhe temperaturën si më poshtë:
Ndryshimi në energjinë Gibbs (𝛥G) shkruhet më pas si:
𝛥G = 𝛥Н – Т𝛥S (1.28)
Nga ekuacioni 1.28 rezulton se mundësia e reaksioneve kimike spontane varet nga raporti i vlerave 𝛥Н dhe Т𝛥S. Në këtë rast, katër raste kryesore janë të mundshme:
1. Nëse 𝛥Н< 0, а 𝛥S >0, atëherë energjia e Gibbs-it do të jetë gjithmonë negative (𝛥G< 0). Такие реакции термодинамически возможны при любой температуре.
2. Nëse 𝛥Н > 0 dhe 𝛥S< 0, то всегда 𝛥G >0. Reaksione të tilla termodinamikisht janë të pamundura në çdo temperaturë.
3. Nëse 𝛥Н > 0 dhe 𝛥S > 0, atëherë reaksioni është i mundur vetëm në temperatura të larta, kur | 🝛N |< | Т𝛥S |.
4. Nëse 𝛥Н<0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | >| T𝛥S |.
Për kryerjen e llogaritjeve të ndryshme termodinamike, si dhe në rastin e funksioneve të tjera termodinamike, prezantohet një koncept i veçantë: energjia standarde e Gibbs-it e formimit të një substance (𝛥G° mostra 298). Ky është ndryshimi i energjisë Gibbs në reaksionin e formimit të një moli të një përbërjeje nga substancat e thjeshta përkatëse, kur të gjitha substancat pjesëmarrëse janë në gjendje standarde dhe reaksioni zhvillohet në kushte standarde (zakonisht matet në kJ / mol). ku:
Energjia standarde e Gibbs-it e formimit të substancave të thjeshta me kusht merret e barabartë me zero.
Librat e referencës zakonisht japin vlerat e energjive standarde Gibbs të formimit të një substance në 298 K. Duke ditur vlerat e 𝛥H dhe 𝛥S, mund të llogaritet vlera e 𝛥G në temperatura të tjera dhe, në përputhje me rrethanat, të parashikohet mundësia ose pamundësia e një reagimi spontan.
Energjia Gibbs është një funksion i gjendjes së sistemit. Prandaj, ndryshimi i tij në rrjedhën e një reaksioni kimik të caktuar varet vetëm nga natyra, gjendja fizike ose agregate e substancave fillestare dhe produkteve të reaksionit, sasia e tyre dhe nuk varet nga fazat e ndërmjetme të reaksionit ose nga mënyra se si sistemi i caktuar i reaksionit arriti në gjendjen përfundimtare, d.m.th.
Gjatë përmbledhjes, domosdoshmërisht merret parasysh numri i moleve (v) të të gjitha substancave pjesëmarrëse.
Shembulli 1. Llogaritni  reaksion, bazuar në nxehtësinë standarde të formimit.
reaksion, bazuar në nxehtësinë standarde të formimit.






