Tabela e energjisë Gibbs e vlerave standarde. Entalpitë standarde të formimit të substancave, entropitë standarde dhe energjitë standarde të Gibbs-it të formimit të substancave
Entalpia standarde molare e formimit të një substance ΔH o6p, m (298 K) është ndryshimi i entalpisë gjatë formimit të një moli të një lënde të caktuar nga elementët e saj përbërës në gjendjet e tyre standarde në një temperaturë prej 298 K dhe një presion prej një atmosferë.
Le ta krahasojmë këtë përkufizim me shembujt e dhënë më sipër. Ne u siguruam
se oksidimi i hidrogjenit mund të përfaqësohet nga të paktën tre të ndryshme ekuacionet stekiometrike. Kështu, ne njohim të paktën tre entalpi molare standarde të ndryshme:
a) ΔH°t (298 K, 2H20(l.)) = - 571,6 kJ/mol
b) ΔH°t (298 K, H20(l.)) = - 285,8 kJ/mol
c) ΔH°t (298 K, H2O(T.)) = - 241,8 kJ/mol
Cila nga këto vlera korrespondon me entalpinë standarde molare të formimit të ujit? Vlera (c) nuk mund të korrespondojë me të, pasi gjendja standarde e ujit në 298 K nuk është një gjendje avulli (e gaztë), që korrespondon me përcaktimin H20 (g). Entalpia standarde molare e formimit të ujit mund të ketë një nga dy vlerat e mbetura, ndryshimi midis të cilave përcaktohet nga mënyra se si shkruhet ekuacioni i reaksionit. Megjithatë, meqenëse përkufizimi i mësipërm i entalpisë standarde molare të formimit tregon se ajo korrespondon me ndryshimin e entalpisë për mol të substancës së formuar, duhet zgjedhur opsioni (b). Në këtë mënyrë, Entalpia standarde molare e formimit të ujit\u003d - 285,8 kJ / mol.
Në tabelë. Tabela 5.1 liston entalpitë standarde molare të formimit të disa substancave të zakonshme në gjendjet e tyre standarde. Vini re se tabela përfshin jo vetëm substanca, por edhe disa jone. Jonet dhe shumë komponime nuk mund të përftohen me sintezë të drejtpërdrejtë nga elementët që i formojnë ato. Megjithatë, entalpitë e tyre standarde të formimit mund të llogariten duke përdorur ligjin e Hess-it (për të cilin do të mësojmë në seksionin 5.3).
Shumica e komponimeve karakterizohen nga entalpi negative të formimit. Prandaj, ato quhen komponime ekzotermike. Vetëm disa komponime kanë një entalpi pozitive të formimit. Ato quhen komponime endotermike. Një shembull i një përbërje endotermike është benzeni.
Vëmendje duhet t'i kushtohet faktit që entalpitë e formimit të përbërjeve të ngurta, si rregull, kanë vlera negative më të mëdha (në vlerë absolute) sesa entalpitë e formimit të gazeve. Entalpia standarde molare e formimit të një substance ose joni është një masë e qëndrueshmërisë së saj në krahasim me elementët që formojnë një përbërje të caktuar. Sa më shumë (në vlerë absolute) të jetë vlera negative e entalpisë së formimit të një përbërjeje, aq më i qëndrueshëm është ky përbërës.
Sipas përkufizimit, entalpia standarde molare e formimit të çdo elementi në gjendjen e tij standarde në 298 K është zero. Për shembull, ΔH (298 K, 02 (g)) = 0.
Tabela 5.1. Entalpitë standarde molare të formimit
Substanca |
ΔН(298 K), kJ/mol |
Substanca |
D298 K), kJ/mol |
Grupi i komponentëve për llogaritjen e vetive ideale të gazit sipas Benson
Cikloalkanet
Hidrokarburet e acetilenit
hidrokarburet aromatike
Entalpia e formimit
Parashikimi i entalpisë së formimit
Parashikimi i përbërjeve organike me metodën Benson për atomet me mjedisin e tyre të parë
Disa grupe shumëvalente të metodës Benson për gjendjen ideale të gazit
PREZANTIMI
Zgjidhja më e mirë për zhvillimin e proceseve të teknologjisë kimike dhe pajisjeve për zbatimin e tyre është e mundur vetëm me informacion të besueshëm mbi vetitë fiziko-kimike dhe termodinamike të përbërjeve kimike. Një informacion i tillë shpesh përbën 50 deri në 90% të inputit të projektimit.
Për praktikë, preferohen të dhënat eksperimentale. Gjatë viteve, një sasi e madhe e të dhënave të tilla janë mbledhur dhe përpunuar. Ky informacion është i disponueshëm në shumë përmbledhje dhe libra referimi. Në disa prej tyre jepen të gjitha vlerat e njohura aktualisht të karakteristikave termodinamike dhe fiziko-kimike dhe jepet analiza kritike e tyre. Të tjerat përmbajnë vetëm vlera të rekomanduara nga autorët, shpesh duke qenë ose vlera mesatare ose rezultat i përpunimit statistikor të të gjithë grupit të informacionit të grumbulluar. Megjithatë, përparimi i shpejtë i teknologjisë dhe futja e gjithnjë e më shumë substancave dhe materialeve të reja në terren shkaktojnë një hendek të madh midis nevojës për të dhëna dhe disponueshmërisë së tyre. Përcaktimi i vlerave eksperimentale në parametra të gjerë të gjendjes dhe përbërjeve është shpesh i vështirë, dhe ndonjëherë thjesht i pamundur.
Për këtë arsye, inxhinieri shpesh detyrohet të mbështetet në një sërë metodash për llogaritjen dhe parashikimin e vetive të substancave. Duhet të kihet parasysh se termat "llogaritje" dhe "parashikim" shpesh përdoren në mënyrë të ndërsjellë, megjithëse i dyti prej tyre mbart një njohje të sinqertë të faktit se rezultati mund të jetë vetëm pjesërisht i saktë. Llogaritjet mund të bazohen në teori, në korrelacionin e vlerave eksperimentale ose në një kombinim të të dyjave.
Entalpia e formimit
Entalpia e formimit është vetia kryesore e përdorur në zgjidhjen e shumë problemeve teorike dhe praktike. Njohja e entalpive të formimit të reaktantëve bën të mundur llogaritjen e efekteve termike të reaksioneve me interes, gjë që është e nevojshme kur vlerësohet ndryshimi i temperaturës adiabatike në zonën e reagimit, duke formuar kërkesat për dizajnin e reaktorit dhe veçoritë teknologjike. procesi kimik. Entalpitë e formimit të substancave janë të nevojshme gjatë kryerjes së një analize sasiore termodinamike të proceseve, përcaktimit të shkallës teorike të shndërrimit të reagentëve, zgjedhjes së kushteve për kryerjen e tyre. transformimi kimik etj. Cilësia e analizës termodinamike të kryer në masë të madhe varet nga besueshmëria e informacionit mbi entalpitë e formimit të substancave.
Njësitë e entalpisë janë kJ/mol dhe J/mol. Në literaturën referente të viteve të mëparshme, entalpitë e formimit shpesh paraqiten në kcal/mol (1 cal = 4,184 J, 1 kcal = 4,184 kJ).
Entalpia e formimit () e lidhjes në kuptimin e ngushtë është standarde ndryshimi i entalpisë në reaksionin e formimit të një lënde të caktuar nga elementët ose substanca të thjeshta. Substancat e thjeshta janë elemente kimike që janë në temperaturën e konsideruar në fazën e tyre natyrore dhe gjendjet kimike.
Si gjendje standarde e një substance, zgjidhet një gjendje e tillë në të cilën kjo substancë është e qëndrueshme në një presion standard prej 1 atm (101325 Pa). Gjendja e kondensuar e një lënde është standarde deri në ato temperatura në të cilat presioni i saj avull i ngopur arrin 1 atm. Mbi këto temperatura, gjendja ideale e gazit është zgjedhur si standard.
Për substancat e thjeshta të përfshira në formimin e molekulave të shumicës së përbërjeve organike, gjendja standarde në 298.15 K është:
për karbon - grafit;
për hidrogjenin, oksigjenin, azotin, fluorin dhe klorin - një gaz diatomik ideal;
për bromin, një lëng diatomik;
për jodin dhe squfurin - një gjendje kristalore, përkatësisht diatomike dhe monatomike.
Vlerat absolute të entalpisë nuk mund të përcaktohen pasi ato përfshijnë vlera absolute energjia e brendshme. Nevoja për të përcaktuar entalpitë e formimit të përbërjeve kërkonte arritjen e një marrëveshjeje ndërkombëtare, sipas së cilës vlerat e elementeve dhe substancave të thjeshta në gjendjen standarde merreshin të barabarta me zero.
Madhësia dhe shenja e substancave me një strukturë molekulare komplekse mund të jenë të ndryshme. Kjo shpjegohet si më poshtë. Formimi i materies nga atomet e lira shoqërohet gjithmonë me lëshimin e energjisë, substancat që rezultojnë janë negative. Megjithatë, kur një substancë formohet nga substanca të thjeshta të përbëra nga molekula diatomike (H 2, O 2, N 2, Cl 2, etj.) ose në gjendje të kondensuar (karbon, brom, etj.), një sasi e caktuar energjie është kërkohet për të thyer lidhjet në molekulat e këtyre substancave të thjeshta ose për t'i transferuar ato në një gjendje të gaztë. Si rezultat, entalpia e formimit mund të jetë pozitive dhe negative, dhe e barabartë me zero.
Në rastin e përgjithshëm, vlera dhe shenja nuk japin bazë për ndonjë deklaratë në lidhje me stabilitetin termodinamik të një substance, pasi kjo varet jo vetëm nga entalpia, por edhe nga përbërësi i entropisë së ndryshimit të energjisë së lirë gjatë formimit të kësaj. substancës. Sidoqoftë, për të krahasuar qëndrueshmërinë termodinamike të përfaqësuesve të të njëjtit grup homolog ose komponimeve me një strukturë molekulare të ngjashme, mund të jetë mjaft informuese, në përafrimin e parë, të analizohen entalpitë e tyre të formimit. Në këtë rast, një substancë me një entalpi më të ulët të formimit ka një stabilitet më të madh termodinamik.
Për shumicën e komponimeve, reaksionet e formimit të tyre nga substanca të thjeshta nuk mund të kryhen në praktikë. Burimi kryesor i informacionit faktik për entalpitë e formimit të përbërjeve organike janë të dhënat eksperimentale mbi entalpitë e djegies së tyre (), të marra me metodën kalorimetrike. Akumuluar deri më sot dhe vlerat e rekomanduara dhe janë të përfshira në përmbledhje. Deri më tani, informacioni i referencës është dhënë ekskluzivisht nga të dhënat kalorimetrike. Metodat moderne të parashikimit empirik bazohen gjithashtu vetëm në të dhënat kalorimetrike. Në të njëjtën kohë, duhet të theksohet se informacioni unik për sa i përket gamës së substancave të përfshira, vëllimit të studimeve të kryera dhe saktësisë së karakteristikave termodinamike të marra përmbahet në rezultatet e studimit të ekuilibrit kimik. Sipas mendimit tonë, përdorimi efektiv i këtij informacioni do të zgjerojë ndjeshëm aftësitë prognostike të metodave për llogaritjet masive të substancave organike.
PARASHIKIMI I ENTALPIVE TË FORMIMIT
Metodat kryesore për parashikimin e entalpive të formimit të përbërjeve organike i referohen, domethënë ato karakterizojnë vetinë e një substance në gjendjen e një gazi ideal me një presion prej 1 atm. dhe një temperaturë prej 298.15 K, e cila shpesh quhet standard. Ndër metodat e llogaritjes së masës, vëmendje e veçantë duhet t'i kushtohet metodave të mekanikës molekulare dhe metodave shtesë (lat. shtesë- shtesë). Shumica e metodave gjysmë empirike nuk ofrojnë cilësinë e kërkuar të parashikimit. Metodat jo-empirike nuk japin qasje të drejtpërdrejtë në entalpitë e formimit të substancave dhe, për më tepër, janë ende të paarritshme për llogaritjen e vetive të substancave organike me një strukturë molekulare komplekse.
Në grupin e metodave të mekanikës molekulare, ne kemi grumbulluar përvojë të konsiderueshme në përdorimin e metodës MMX (bazuar në fushë force Ellinger). Metoda është dëshmuar mirë në aplikimin e alkaneve. Megjithatë, edhe për përbërjet aromatike, këshillohet që të përdoret jo për llogaritjen e entalpive të formimit, por për vlerësimin e efekteve të ndërveprimit të zëvendësuesve në molekulë, d.m.th. për dallimet në entalpitë e formimit të izomerëve. Për shumicën e komponimeve organohalogjene, oksigjen, azot dhe squfur që përmbajnë, metoda jep vlerësime të njëanshme. Megjithatë, kjo metodë duhet të përdoret në të gjitha rastet për vlerësimin e shprehur të një prone. Si çdo metodë tjetër, ajo kërkon që rezultatet të mbështeten nga informacioni i marrë nga një metodë tjetër parashikimi. Metoda e mekanikës molekulare ka një ndërfaqe të shkëlqyer dhe është jashtëzakonisht efektive si një burim informacioni për strukturën e molekulave dhe parametrat e tyre gjeometrikë.
Në mungesë të të dhënave referuese për parashikimin, aktualisht përdoren gjerësisht metoda të ndryshme shtesë. Që nga krijimi i metodave kryesore shtesë për parashikimin e vetive të substancave organike në gjendjen e një gazi ideal, ka kaluar një periudhë e konsiderueshme kohore, por ato ruajnë rëndësinë e tyre, pavarësisht metodave gjithnjë e më të aksesueshme të modelimit molekular. Këto metoda janë efektive në ato raste kur vetia ndryshon në mënyrë lineare me një ndryshim në numrin e fragmenteve të të njëjtit lloj në molekulë. Rreptësisht aditiv është, për shembull, pesha molekulare e një substance. Për entalpitë e formimit të përbërjeve organike, qasja aditiv është në shumë raste vetëm një përafrim në llogaritje. Fakti është se edhe në një grup homolog ndryshon në mënyrë jolineare me një ndryshim në numrin e atomeve të karbonit në molekulë (Fig. 1.1).
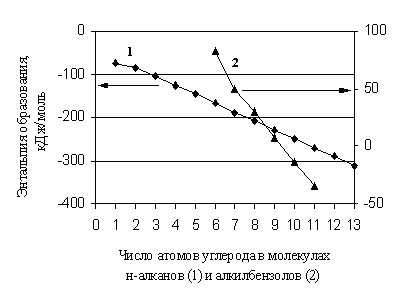
Oriz. 1.1. Varësia e entalpisë së formimit të n-alkaneve dhe benzeneve alkil nga numri i atomeve të karbonit në molekulat e tyre
Kështu, diferenca homologe nuk është një vlerë konstante, veçanërisht për anëtarët e parë të grupeve homologe. Në të njëjtën mënyrë, me një rritje të numrit të zëvendësuesve të të njëjtit lloj në molekulat e substancave organike, është shumë shpesh e nevojshme të flitet për një devijim nga aditiviteti në. Megjithatë, kur futen korrigjimet për jo-shtesë, metodat e këtij grupi funksionojnë mjaft të kënaqshme nëse shkalla dhe thellësia e detajimit të tyre janë të mjaftueshme dhe korrespondojnë me saktësinë e eksperimentit modern.
Në varësi të ideologjisë së adoptuar, bartësit e informacionit strukturor dhe sasior në metodat shtesë mund të jenë atomet, grupet e atomeve ose lidhjet që përbëjnë një molekulë. Shumica e metodave të parashikimit janë ndërtuar në atë mënyrë që, ndërsa baza e të dhënave mbi entalpitë e formimit zgjerohet, është relativisht e lehtë të përsosen vlerat e kontributeve të pjesshme ose të futen korrigjime të reja.
Qasja e përgjithshme për parashikimin e entalpive të formimit të substancave përfshin llogaritjen me kalimin pasues, nëse është e nevojshme, në entalpitë ideale të formimit të gazit në temperatura të tjera ose k , d.m.th. ndaj një vetie të materies në gjendje reale.
Nga shumëllojshmëria e metodave të llogaritjes së aditivëve, ne konsiderojmë dy; Metoda e grupit të Bensonit për atomet me mjedisin e tyre të parë dhe metoda e Tatevskit për lidhjet.
Parashikimi i përbërjeve organike me metodën Benson për atomet me mjedisin e tyre të parë
Duhet pranuar se nga të gjitha llojet e skemave të aditivëve për parashikimin e entalpive të formimit të substancave organike, metoda Benson përdoret më gjerësisht për një periudhë të gjatë. Kjo ndoshta shpjegohet me faktin se kjo metodë mbulon gamën më të gjerë të komponimeve. Për vlerësimin e shpejtë të shumicës dërrmuese të përbërjeve pa përfshirjen e ndonjë mjeti teknik, metoda, ndoshta, nuk ka të barabartë. Është mjaft e qartë se çmimi i universalitetit të tij është saktësia e parashikimit. Prandaj, kur përdorni metodën, është e nevojshme të jeni të vetëdijshëm për kufizimet e saj të pashmangshme. Ne do të përpiqemi të tërheqim vëmendjen e përdoruesve të mundshëm tek ato kryesore, të cilat janë rezultat i testimit tonë të gjerë të metodës.
Metoda Benson zakonisht quhet metoda grupore, megjithëse atom me shoqërinë e tij të parë. Metoda u zhvillua nga autori për të llogaritur vetitë e mëposhtme ideale të gazit të substancave: kapaciteti i nxehtësisë në temperatura që janë shumëfish të 100 gradë, entalpia e formimit dhe entropia.
Entalpia e sistemit. kushte standarde. Entalpia e formimit të një substance. Entalpia e reaksionit. Reaksionet endotermike dhe ekzotermike.
Entalpia e sistemit (nga greqishtja enthalpo I ngrohje) është ϶ᴛᴏ një funksion me një vlerë H të gjendjes së një sistemi termodinamik me parametra të pavarur entropie S dhe presion P, i cili lidhet me energjinë e brendshme U nga relacioni H. =U+PV, ku V është vëllimi i sistemit.Në kimi, më shpesh konsiderohen procese izobarike (P = konst), dhe efekti termik në këtë rast quhet ndryshimi i entalpisë së sistemit ose entalpia e procesit: Qp = ∆H; ∆H=∆U+P∆V. Entalpia ka dimensionin e energjisë (kJ). Vlera e tij është proporcionale me sasinë e substancës; entalpia e një sasie njësi të një substance (mol) matet në kJ∙mol–1. Në një sistem termodinamik, nxehtësia e çliruar e një procesi kimik konsiderohet të jetë negative (proces ekzotermik, ΔH< 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH >0. Ekuacionet e reaksioneve kimike që tregojnë entalpinë e procesit quhen termokimike. Vlerat numerike të entalpisë ΔH tregohen me presje në kJ dhe i referohen të gjithë reaksionit, duke marrë parasysh koeficientët stoikiometrikë të të gjithë reaktantëve. Meqenëse reaktantët mund të jenë të ndryshëm gjendjet e grumbullimit, atëherë tregohet me indeksin e poshtëm djathtas në kllapa: (t) - i ngurtë, (k) - kristalor, (g) - i lëngët, (d) - i gaztë, (p) - i tretur. Për shembull, ndërveprimi i H2 dhe Cl2 i gaztë prodhon dy mol HCl të gaztë. Ekuacioni termokimik shkruhet si më poshtë: Kur H2 dhe O2 e gaztë ndërveprojnë, H2O e formuar mund të jetë në tre gjendje grumbullimi, të cilat do të ndikojnë në ndryshimin e entalpisë: 298K. gjendje standarde Funksioni termodinamik, për shembull, entalpia, tregohet me nënshkrime dhe mbishkrime: nënshkrimi zakonisht hiqet: Δ.
Entalpia e formimit (nxehtësia e formimit), entalpia e reaksionit të formimit të një lënde (ose tretësire) të caktuar nga substancat e dhëna fillestare. Entalpia e formimit të një përbërjeje kimike quhet entalpi e reaksionit të formimit të një përbërjeje të caktuar nga substanca të thjeshta. Si substanca të thjeshta zgjedhin elementet kimike në fazën e tyre natyrore dhe gjendjen kimike në një temperaturë të caktuar. Pra, në 298 K, për klorin, klori i gaztë, i përbërë nga molekula C12, është një substancë e thjeshtë, dhe për kaliumin, kaliumi metalik. Entalpia e formimit të KCl të ngurtë në 298 K është entalpia e reaksionit: K(i ngurtë) + 1/2Cl2= KCl(i ngurtë) Entalpia e formimit të KCl(i ngurtë) në 500 K korrespondon me reaksionin: K( lëng) + 1/2Cl2 = KCl (i ngurtë), pasi gjendja fazore natyrore (substancë e thjeshtë) për kaliumin nuk është më një kristal, por një lëng (temperatura e shkrirjes K 336,66 K).
Entalpia e formimit duhet të përcaktohet në çdo temperaturë. Entalpitë standarde të formimit korrespondojnë me reaksionet e formimit në të cilat substancat e thjeshta dhe përbërësi që rezulton janë nën presion prej 1 atm (1,01 x 105 Pa). Sipas përkufizimit, për të gjitha substancat e thjeshta në çdo temperaturë = 0. Për shumicën e kim. lidhje. entalpia e formimit - negative. sasive.
Njësitë matëse të entalpisë së formimit janë J / g, J / mol.Në termodinamikën e tretësirave (shkrirjeve), entalpia e formimit kuptohet si ndryshimi i entalpisë gjatë formimit izotermik-izobarik prej 1 mol (1 g. ) të një tretësire (shkrirjeje) të një përbërjeje të caktuar nga përbërës të pastër. Pra, në sistemin me dy komponentë KF-A1F3, entalpia e formimit të një shkrirjeje me përbërje molare 50% korrespondon me procesin: 1/2KF (lëng) + 1/2A1F3 (lëng) = KF-A1F3 (shkrirë, 50 mol.%).
Reaksionet endotermike (nga greqishtja tjetër ἔνδον - brenda dhe θέρμη - nxehtësi) - reaksione kimike të shoqëruara me thithjen e nxehtësisë. Për reaksionet endotermike, ndryshimi në entalpi dhe energjia e brendshme janë pozitive (ΔH > 0, ΔU > 0), pra, produktet e reaksionit përmbajnë më shumë energji se përbërësit origjinalë. Reaksionet endotermike përfshijnë: reaksionet e reduktimit të metaleve nga oksidet, elektrolizën ( energjia elektrike absorbohet ), shpërbërja elektrolitike (për shembull shpërbërja e kripërave në ujë), jonizimi, fotosinteza Reaksionet endotermike janë e kundërta e reaksioneve ekzotermike.
Reaksion ekzotermik - një reaksion kimik i shoqëruar me lëshimin e nxehtësisë. E kundërta e një reaksioni endotermik Sasia totale e energjisë në një sistem kimik është jashtëzakonisht e vështirë të matet ose të llogaritet. Nga ana tjetër, ndryshimi i entalpisë ΔH në reaksion kimik shumë më e lehtë për t'u matur ose numëruar. Për këto qëllime, përdoren kalorimetra. Vlera e matur e ΔH lidhet me energjinë e lidhjes së molekulave si më poshtë: ΔH = energjia e shpenzuar për thyerjen e lidhjeve - energjia e çliruar kur formohen lidhjet në produktet e reaksionit.Për reaksionet ekzotermike, kjo formulë jep një vlerë negative për ΔH, pasi vlera më e madhe zbritet nga vlera më e vogël. Gjatë djegies së hidrogjenit, për shembull: 2H2 + O2 → 2 H2O, ndryshimi i entalpisë është ΔH = -483,6 kJ për një mol O2.
Djegia e karburantit në oksigjenin atmosferik.
Djegia e barutit.
Shtimi i acidit sulfurik të koncentruar në ujë.
Oksidimi i yndyrave dhe karbohidrateve në organizmat e gjallë.
Djegia adiabatike
Entalpia e sistemit. kushte standarde. Entalpia e formimit të një substance. Entalpia e reaksionit. Reaksionet endotermike dhe ekzotermike. - koncepti dhe llojet. Klasifikimi dhe veçoritë e kategorisë "Entalpia e sistemit. Kushtet standarde. Entalpia e formimit të lëndës. Entalpia e reaksionit. Reaksionet endotermike dhe ekzotermike." 2014, 2015.
Ekuacionet bazë të termodinamikës kimike dhe ekuilibrit kimik
1.Q=DE+P-ekuacioni i ligjit të parë të termodinamikës
2.W=PDV
3. Q v = DE v -nxehtësia e procesit izokorik
4. Q p = DH p -nxehtësia e procesit izobarik
5. DH p = DE + PDV -ekuacioni i ligjit të parë të termodinamikës për proceset izobarike
6. DH = å n DH 0 298 arr. prod. reagojnë. - å n DH 0 298 arr. ref. substanca - P Pasoja e parë e ligjit të Hesit
7. DH = å n DH 0 298 djegie. Eksodi. në. - å n DH 0 298 e djegur prod. reagimet - nëpërfundimi i dytë i ligjit të Hesit
8.Q=W-ekuacioni i ligjit të parë të termodinamikës për biosistemet
9.DS = ¾¾ -entropia në funksion të gjendjes së sistemit
10.DS ³ 0 -ekuacioni i ligjit të dytë të termodinamikës
11 S = å n S 0 298 vazhdim. R. - å n S 0 298 ref. në. -Llogaritja e entropisë së reaksionit
12. DG 0 = DH 0 - TDS 0 -ekuacionet për llogaritjen e energjisë Gibbs
13. DG 0 = å n DG 0 298 prod. R. - å n DG 0 298 ref. në.(x)
14. DG 0 \u003d - 2,3RT lg Ks - ekuacioni izotermik i reaksionit kimik në kushte standarde
15. - ekuacioni izotermik i reaksionit kimik
16. - konstanta e ekuilibrit kimik e shprehur në terma të përqendrimeve ekuilibër të një substance
17. - konstanta e ekuilibrit kimik të shprehur në terma të ekuilibrit presione të pjesshme substancave
18. - ekuacioni izobar
19. - llogaritja e efektit termik nga vlerat e konstanteve
Tabela 1
| Substanca | Entalpia standarde e formimit kJ/mol | Entropia standarde J/mol×K | Energjia standarde e Gibbs-it e formimit kJ/mol |
| substancave inorganike | |||
| C (grafit) | +6 | ||
| CO (g) | -110 | +198 | -137 |
| CO 2 (g) | -393,5 | +214 | -394 |
| Cl 2 (g) | +223 | ||
| Cl 2 O (g) | +76 | +266 | +94 |
| FeСО 3 (tv) | -753 | +96 | -680 |
| H 2 (g) | +131 | ||
| HCl (g) | -92 | +187 | -95 |
| HI (g) | +24 | +206 | -1 |
| HNO 2 (zgjidhje) | -119 | +153 | -56 |
| HNO 3 (l) | -174 | +156 | -81 |
| H 2 O (l) | -286 | +70 | -237 |
| H 2 O 2 (l) | -187 | +110 | -120 |
| H 2 S (g) | -21 | +206 | -34 |
| H 2 SO 4 (l) | -814 | +157 | -690 |
| KNO 3 (TV) | -495 | +133 | -395 |
| KOH (zgjidhje) | -477 | +92 | -441 |
| N 2 (d) | +192 | ||
| NH 3 (g) | -46 | +192 | -16 |
| H 2 O (g) | +82 | +220 | +104 |
| JO (g) | +91 | +211 | +87 |
| JO 2 (g) | +33 | +240 | +51 |
| N 2 O 3 (g) | +11 | +356 | +115 |
| Na 2 O 2 (TV) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (TV) | -1117 | +225 | -1043 |
| O 2 (g) | +205 | ||
| SO 2 (g) | -297 | +248 | -300 |
| SO 3 (g) | -396 | +257 | -371 |
| çështje organike | |||
| Metan (g) | -75 | +186 | -51 |
| Etan (g) | -85 | +229 | -33 |
| Etileni (g) | +52 | +219 | +68 |
| Acetilen (g) | +227 | +201 | +209 |
| Benzeni (w) | +49 | +173 | +125 |
| Cikloheksan (l) | -156 | +204 | +27 |
| Klorometan (g) | -86 | +234 | -63 |
| Diklormetani (g) | -95 | +270 | -69 |
| Triklorometan (g) | -101 | +296 | -69 |
| Tetraklorur karboni (g) | -100 | +310 | -58 |
| Metanol (w) | -239 | +127 | -166 |
| Etanol (w) | -277 | +161 | -174 |
| Dietil eter (l) | -279 | +253 | -123 |
| Acetaldehid (g) | -166 | +264 | -133 |
| Aceton (w) | -247 | +199 | -154 |
| Jon piruvat (tretësirë) | + | -559 | |
| L-acidi laktik (tretësirë) | -686 | +222 | -539 |
| Saharozë (TV) | -2222 | +360 | -1545 |
| D-glukoza (tretësirë) | -1264 | +269 | -917 |
| Nitrobenzeni (w) | +16 | +224 | +146 |
| Anilinë (w) | +31 | +191 | +149 |
| L-leucine (tretësirë) | -643 | +208 | -362 |
| Glicinë (tretësirë) | -523 | +159 | -380 |
| D,L-leucilglicina (tretësirë) | + | -464 | |
| Glicylglycine (tretësirë) | -734 | +231 | -492 |
Entalpitë standarde të djegies së substancave organike, kJ/mol
Nxehtësia specifike oksidimi i plotë i substancave në trup, kJ/g.
Detyrat mësimore:
Detyra 1 Në trupin e njeriut, reagimi i oksidimit të alkoolit etilik zhvillohet në dy faza. E para është oksidimi i alkoolit etilik në acetaldehid me pjesëmarrjen e enzimës së alkoolit dehidrogjenaza vazhdon sipas ekuacionit: C 2 H 5 OH + ½ O 2 \u003d CH 3 COH + H 2 O.
Llogaritni DH 0 të reaksionit duke përdorur përfundimin e parë të ligjit të Hesit nëse
DN 0 arr. (C2H5OH) \u003d - 278 kJ / mol;
DN 0 arr. (CH 3 COH) \u003d - 166 kJ / mol;
DN 0 arr. (H 2 O) \u003d - 286 kJ / mol.
Zgjidhja: DH 0 = å n DH 0 - å n DН 0 inverse ref.in.in; DH = (-166+ (-286)-(-278)) = - 174 kJ/mol
Përgjigju: efekti termik i reaksionit DH = -174 kJ/mol, d.m.th. proces ekzotermik.
Detyra 2. Nxehtësia e djegies së glukozës është -2810 kJ/mol, nxehtësia e djegies së alkoolit etilik është -1366 kJ/mol. Bazuar në këto të dhëna, llogaritni efektin termik të procesit biokimik të fermentimit të glukozës:
C 6 H 12 O 6 \u003d 2C 2 H 5 OH + 2CO 2
Zgjidhja: Efekti termik i këtij reaksioni mund të llogaritet duke zbatuar përfundimin e dytë të ligjit të Hesit:
DH = ån DH 0 djeg. Eksodi. substanca - å n DH 0 djegie. prod. reagimet
DH \u003d -2810 - 2 ∙ (-1366) \u003d - 78 kJ / mol
Përgjigje: efekti termik i procesit të fermentimit është - 78 kJ / mol.
Detyra 3. Llogaritni entropinë standarde të reaksionit:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
glicinë glicinë glicilglicinë
Nëse S 0 (glicilglicina) = 231 J / mol × K;
S 0 (glicinë) \u003d 159 J / mol × K;
S 0 (H 2 O) \u003d 70 J / mol × K;
Zgjidhja:
DS \u003d S 0 298 (hl-hl) + S 0 298 (H 2 O) - 2 S 0 298 (glicine) \u003d (231 + 70) - (159 + 159) \u003d -17 J / mol × K
Përgjigje: DS 0 298 \u003d - 17 J / mol × K, d.m.th. entropia do të ulet.
Detyra 4. Nxehtësia e djegies së karbohidrateve, proteinave dhe yndyrave është 17, 17 dhe 39 kJ
përkatësisht. Kërkesa mesatare ditore për proteina, yndyra dhe karbohidrate për studentët meshkuj është 113, 106 dhe 451 g. Cila është kërkesa ditore e nxënësve meshkuj për energji?
Zgjidhja: Llogaritni sa energji lirohet gjatë oksidimit të karbohidrateve, proteinave dhe yndyrave
DH = (451×17) + (113×17) + (106×39) = 13722 kJ.
Përgjigje: Kërkesa ditore e energjisë është 13722 kJ.
Detyra 5. Pse procesi i denatyrimit të proteinave në 40 0 C është spontan nëse reaksioni është endotermik dhe efekti termik është 2830 J/mol? Vlera DS për këtë reaksion është 288 J/mol∙K
Zgjidhja: Për të përcaktuar drejtimin e procesit, është e nevojshme të dihet madhësia e ndryshimit të energjisë Gibbs, e llogaritur nga ekuacioni: DG 0 = DH 0 - TDS 0 . Llogaritja tregon se DG< 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Përgjigje: Sepse DG< 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Detyra 6. Llogaritni energjinë e Gibbs-it, e cila është një kriter për spontanitetin e proceseve, për reaksionin e glikolizës në kushte standarde: C 6 H 12 O 6 (tretësirë) ® 2C 3 H 6 O 3 (tretësirë) (acidi laktik).
Zgjidhja:
Nga tabela e vlerave termodinamike shkruajmë energjinë standarde të Gibbs-it për pjesëmarrësit në procesin kimik: ∆G 0 (C 6 H 12 O 6) = -917 kJ / mol; ∆G 0 (C 3 H 6 O 3) = -539 kJ / mol. Duke përdorur 1 konkluzion nga ligji i Hesit, ne llogarisim energjinë e Gibbs:
ΔG 0 = 2×ΔG 0 (C 3 H 6 O 3) - ΔG 0 (C 6 H 12 O 6)
ΔG 0 \u003d 2 (-539) - (-917) \u003d -161 kJ / mol
Përgjigje: sepse ∆G0< 0, то реакция протекает самопроизвольно в drejtimi përpara.
Detyra 7. Llogaritni ndryshimin e energjisë Gibbs në 25 0 C duke përdorur vlerat standarde të entalpive të formimit dhe entropive absolute për këtë reaksion: CO + 2H 2 = CH 3 OH
DН 0 arr CH 3 OH \u003d -293 kJ / mol S 0 (CH 3 OH) \u003d 127 J / mol × K
DH 0 arr CO \u003d - 110 kJ / mol. S 0 (CO) \u003d 198 J / mol × K
S 0 (H 2) \u003d 131 J / mol × K
Zgjidhja: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 arr. pr reak. - ånDH 0 arr. ref. substancave
DH 0 \u003d - 293 - (-110) \u003d - 183 kJ / mol
DS 0 = å n S 0 vazhdim. p - å n S 0 rezultat. substancave
DS 0 \u003d 127 - (198 + 2 (131) \u003d - 333 J / mol × K
DG 0 \u003d - 183,5 kJ / mol - (298K × 0,333 kJ / mol × K) \u003d - 83,8 kJ / mol
Përgjigje: DG 0 \u003d - 83,8 kJ / mol
Detyra 8. Llogaritni konstantën e ekuilibrit në 310 K për reaksionin ATP + AMP ↔ 2ADP nëse energji e lirë Reaksioni Gibbs ΔG°=-2,10kJ/mol.
Zgjidhja: në ekuilibër DG 0 = - 2.3RT log Ks
K c \u003d 10 0,354 \u003d 2,26
Përgjigje: Kc = 2,26
Detyra 9. Konstanta e ekuilibrit të reaksionit: PCl 5 (g) "PCl 3 (g) + Cl 2 (g) në 250 0 C është 2. Në cilin drejtim vazhdon reaksioni në përqendrimet e mëposhtme: C (PCl 5) \u003d C (PCl 3) \u003d 2 mol/l; C (Cl 2) \u003d 4 mol / l?
Zgjidhja: Për të përcaktuar drejtimin e reaksionit, përdorim ekuacionin e izotermisë
Llogaritni Ps
Sepse P s > K s, pastaj DG > 0
konkluzioni: reaksioni nuk mund të vazhdojë spontanisht në drejtimin përpara, sepse DG>0.
Detyra 10. Konstanta e ekuilibrit të reaksionit 2SO 2 (g) + O 2 (g) Û 2SO 3 (g) në një temperaturë prej 627 0 C është 2,3 ∙ 10 -7, DH 0 = 376,5 kJ / mol. Llogaritni konstantën e ekuilibrit në 727 0 С.
Zgjidhja: ne përdorim ekuacionin e izobarit të një reaksioni kimik:
T 1 \u003d 273 + 627 \u003d 900 K
T2 = 273 + 727 = 1000K
Përgjigje: Konstanta e ekuilibrit në 727 0 C është 3.56 × 10 -5.
Detyra 11. Për reaksionin H 2 O (g) + CO (g) ® CO 2 (g) + H 2 (g), konstantet e ekuilibrit kimik janë: në 800 0 C Kp = 2.87, në 1000 0 C Kp = 1.39. Llogaritni efektin termik të këtij reaksioni.
Zgjidhja: Duke zbatuar ekuacionin e izobarit të një reaksioni kimik, llogarisim DH
Le të marrim T 1 = 800 + 273 = 1073 K
T 2 \u003d 1000 + 273 \u003d 1273 K
Përgjigje: DH = -39,16 kJ/mol.
Detyrat për zgjidhje të pavarur:
Detyra 1. Duhen 40 kJ për të avulluar 1 mol ujë. Sa nxehtësi do të humbet në ditë kur 720 g ujë lirohen përmes lëkurës?
Përgjigje: 1600 kJ
Detyra 2. Peroksid hidrogjeni (H 2 O 2) në formën e një tretësire me një fraksion masiv prej 3%. përdoret në mjekësi për trajtimin e plagëve. Vërtetoni se procesi i dekompozimit të peroksidit të hidrogjenit në prani të enzimës katalazë është spontan, duke përdorur vlerat e entropisë standarde të formimit të substancave fillestare dhe produkteve të reaksionit për të llogaritur:
S0298 (H2O2) =110 J/mol×K; S 0 298 (H 2 O) \u003d 70 J / mol × K; S 0 298 (O 2) = 205 J / mol × K.
Përgjigje: Δ S = 62,5 J/mol × K
Detyra 3. Kur digjet metani me një vëllim prej 2 m 3, lirohet 79600 kJ nxehtësi. Llogaritni nxehtësinë standarde të djegies së metanit.
Përgjigje: 891.52 kJ/mol
Detyra 4. Llogaritni energjinë standarde të Gibbs për procesin e oksidimit të glukozës sipas të dhënave të mëposhtme: DH 0 arr (C 6 H 12 O 6) \u003d - 1264,4 kJ / mol; DH 0 arr (CO 2) \u003d - 393 kJ / mol;
DH 0 arr (H 2 O) \u003d - 286 kJ / mol. Ndryshimi në entropinë e të gjithë sistemit reagues është 0,259 kJ/mol×K
Përgjigje: DG \u003d - 2886,8 kJ / mol.
Detyra 5. Llogaritni entalpinë standarde të formimit të etanolit duke përdorur entalpitë standarde të kërkuara të djegies.
Përgjigje: DN 0 arr. = -273 kJ/mol
Detyra 6. Konstanta e ekuilibrit të reaksionit N 2 0 4 (g) ↔ 2N0 2 (g) në 25°C është 0,1. Në cilin drejtim do të vazhdojë reaksioni në përqendrimet e mëposhtme të substancave:
a) C (N0 2) \u003d C (N 2 0 4) \u003d 0,1 mol / l;
b) C (N0 2) \u003d 0,01 mol / l; C (N 2 0 4) \u003d 0,02 mol / l?
Detyra 7. Për reaksionin H 2 + I 2 ® 2HI në 444 0 C, konstanta e ekuilibrit është 50. Përcaktoni drejtimin e procesit nëse përzierja fillestare ka përbërjen e mëposhtme: C (H 2) \u003d 2 mol / l, C ( HI) \u003d 10 mol/l.
Përgjigje: Gjendja e ekuilibrit, sepse ∆G=0.
Detyra 8. Llogaritni konstantën e ekuilibrit nëse DG 0 298 për këtë reaksion është 4,478 kJ/mol.
Përgjigje: 6,1
Detyra 9. Konstanta e ekuilibrit të dekompozimit të një lënde medicinale në një autoklavë në 413K është 0,396∙10 5 Pa, dhe në 443K është 1,286∙10 5 Pa. Llogaritni efektin termik të reaksionit.
Përgjigje: 59,6 kJ/mol.
Detyra 10. Duke përdorur vlerën ΔG°, përcaktoni nëse ekziston rreziku i helmimit të pacientit kur përdoret si a drogë oksid nitrik (I), oksid nitrik toksik (II) mund të formohet nga reaksioni: 2N 2 O + O 2 = 4NO. Të gjitha substancat janë në gjendje e gaztë. Shihni tabelën për të dhënat e referencës.






