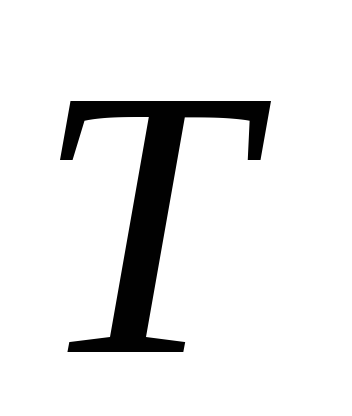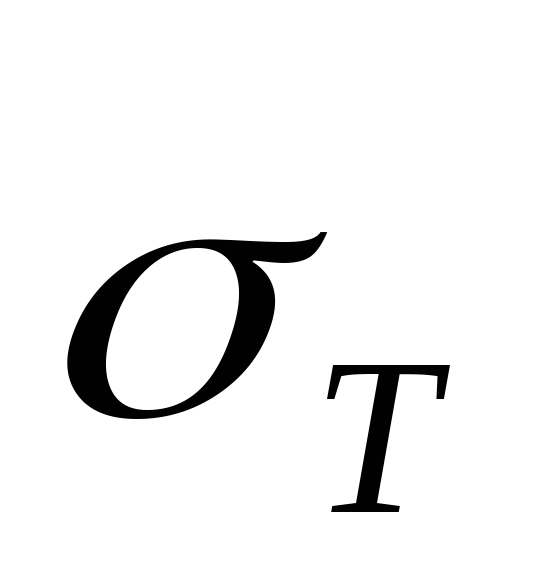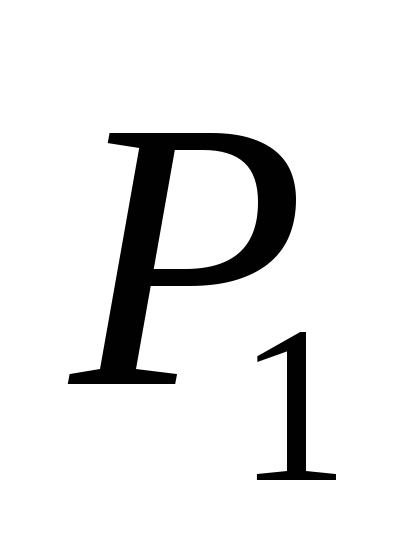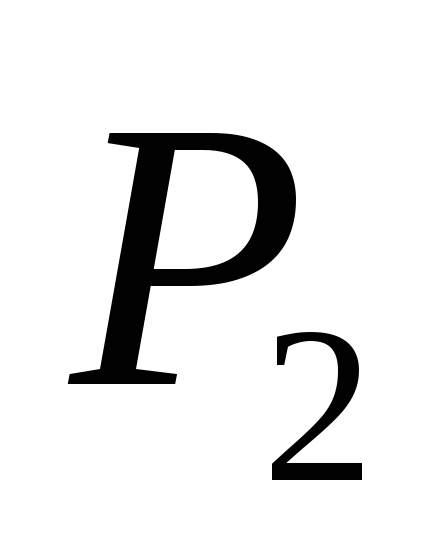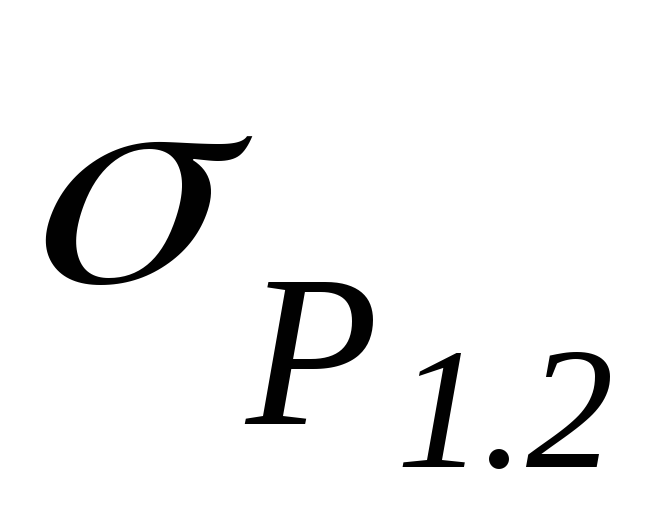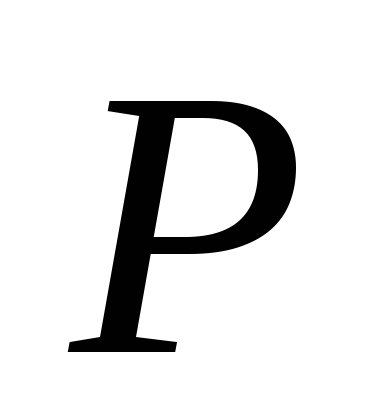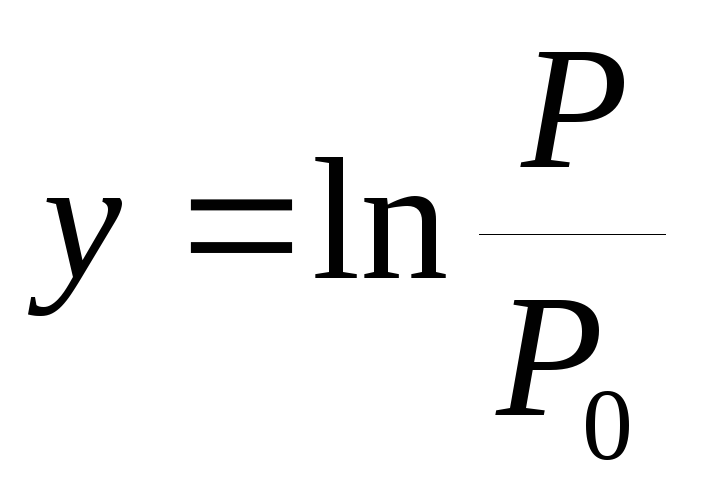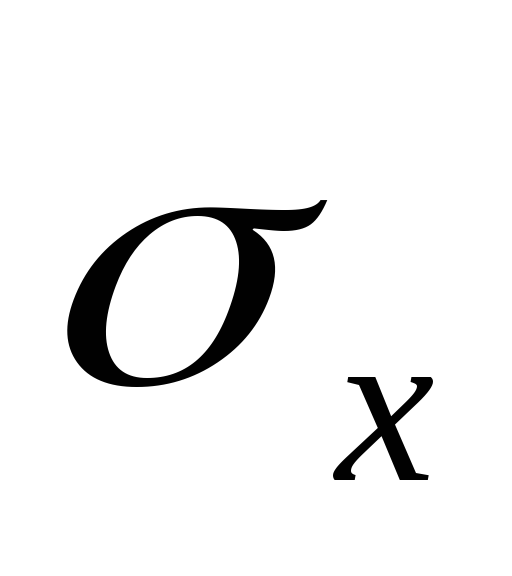Capacitate termică specifică de condensare a vaporilor de apă. Determinarea căldurii specifice de vaporizare
Lucrări de laborator №4.
Determinarea căldurii de vaporizare a unui lichid
1. Scurtă teorie
Evaporarea este trecerea unei substanțe de la starea lichidă la starea gazoasă. În timpul evaporării, moleculele zboară de pe suprafața lichidului, formând vapori deasupra acestuia. Doar cele mai rapide molecule pot zbura din lichid în spațiul înconjurător, deoarece numai ele sunt capabile să depășească forțele atractive care acționează în stratul de suprafață al lichidului. Ca urmare a plecării moleculelor rapide, lichidul este răcit. Pentru a-și menține temperatura constantă, este necesară o sursă de căldură.
Cantitatea de căldură care trebuie transmisă unei substanțe pentru a o schimba stare lichidaîn gazos temperatura constantași presiune constantă, se numește căldură de vaporizare (sau căldură de vaporizare).
Căldura de vaporizare a lichidelor poate fi măsurată direct cu un calorimetru. Această metodă, totuși, nu oferă rezultate precise din cauza pierderii necontrolate de căldură, care este greu de făcut mic. În această lucrare, pentru a determina căldura de evaporare, folosim o metodă indirectă bazată pe ecuația Clausius-Clapeyron:
 . (1)
. (1)
Aici P
este presiunea vaporilor saturați a lichidului la temperatură T
,T este temperatura absolută a lichidului și a vaporilor, 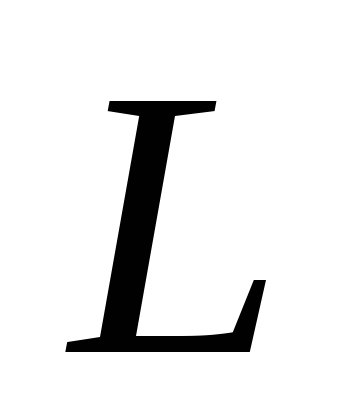 - caldura specifica de vaporizare a lichidului,
- caldura specifica de vaporizare a lichidului, 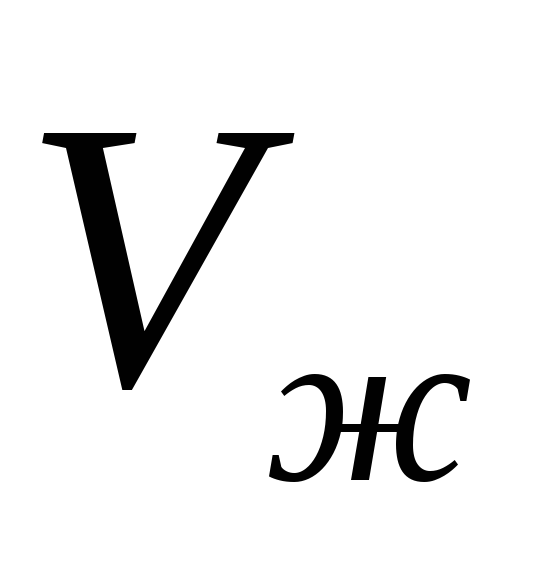 - volum specific de lichid,
- volum specific de lichid, 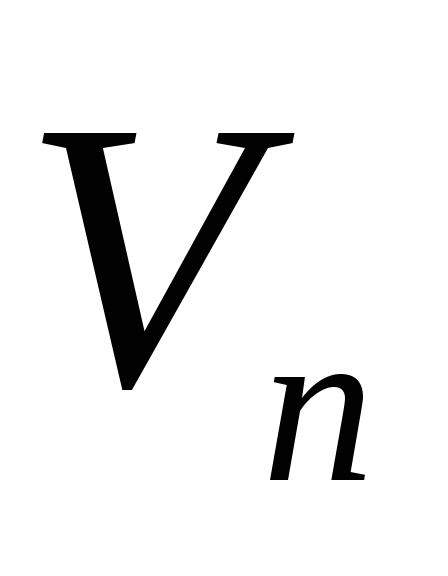 - volum specific de abur.
- volum specific de abur.
Dacă se cunoaşte dependenţa căldurii specifice de evaporare 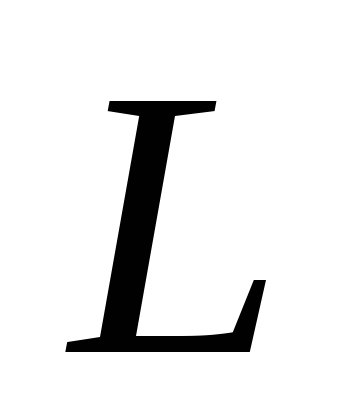 și volume specifice
și volume specifice 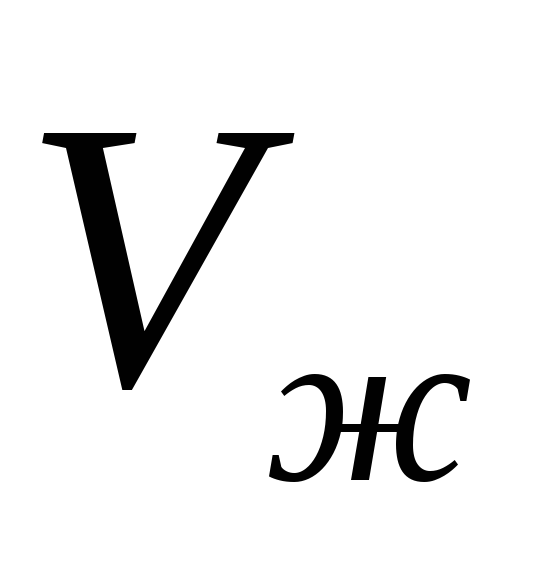 și
și 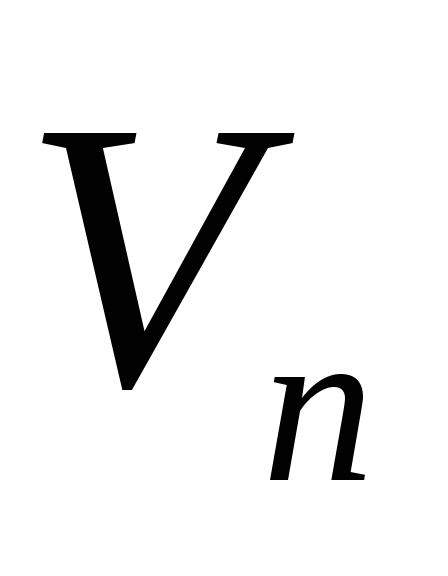 de temperatură, atunci ecuația (1) poate fi integrată și dependența presiunii vaporilor saturați de temperatură poate fi găsită în mod explicit. În cea mai aproximativă aproximare, putem presupune că valoarea
de temperatură, atunci ecuația (1) poate fi integrată și dependența presiunii vaporilor saturați de temperatură poate fi găsită în mod explicit. În cea mai aproximativă aproximare, putem presupune că valoarea 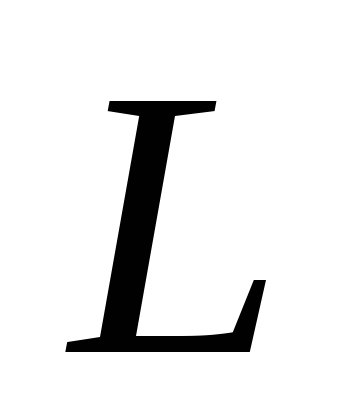 nu depinde de temperatură, iar volumul specific de lichid în comparație cu volumul specific de vapori poate fi neglijat. În plus, putem presupune că ecuația de stare a gazului ideal (ecuația Mendeleev-Clapeyron) este aplicabilă vaporilor, din care exprimăm volum specific pereche:
nu depinde de temperatură, iar volumul specific de lichid în comparație cu volumul specific de vapori poate fi neglijat. În plus, putem presupune că ecuația de stare a gazului ideal (ecuația Mendeleev-Clapeyron) este aplicabilă vaporilor, din care exprimăm volum specific pereche: 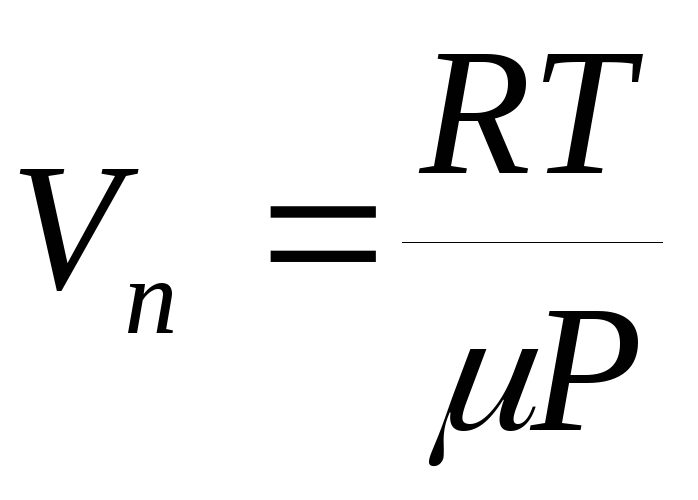 .
.
În aproximarea acceptată, ecuația (1) se va transforma într-o ecuație diferențială:
 ,
,
integrând care, obținem:
 , (2)
, (2)
Unde 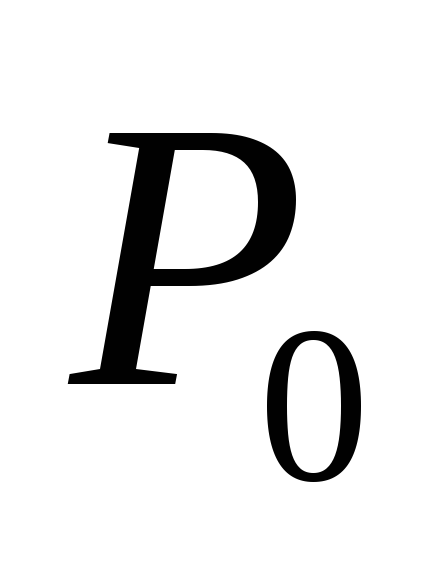
 .
.
Relația (2) face posibilă determinarea căldurii specifice de vaporizare, cunoscând dependența presiunii vaporilor saturați de temperatură. Lucrarea de față de laborator este dedicată determinării căldurii specifice de evaporare a apei.
2. Configurare experimentală. Tehnica experimentală
Experimentul se desfășoară pe configurația prezentată schematic în figură. Configurația constă dintr-un termostat umplut cu apă, elemente de încălzire, un sistem de răcire (nu este prezentat în figură), două baloane cu gaze de testare și instrumente de măsură.
H  elemente de incalzire H servesc la creșterea temperaturii în sistem. Pentru încălzirea uniformă a sistemului, apa este amestecată constant cu aerul furnizat de compresor La. Pornirea și oprirea elementelor de încălzire și a compresorului se realizează cu ajutorul panoului de control PU. Înainte de a porni macaralele La 1
și La 2
deschide, apoi inchide. Acest lucru este necesar pentru ca presiunea din baloane la momentul inițial să devină egală cu presiunea atmosferică. Termometrul măsoară temperatura T apa in care sunt scufundate baloane cu aer uscat si umed. Parametrii de instalare sunt astfel încât apa să fie încălzită lent, iar gazul din baloane are timp să se încălzească la aceeași temperatură ca și apa din sistem. Manometre M 1
și M 2
arată excesul de presiune din baloane cu aer uscat, respectiv umed.
elemente de incalzire H servesc la creșterea temperaturii în sistem. Pentru încălzirea uniformă a sistemului, apa este amestecată constant cu aerul furnizat de compresor La. Pornirea și oprirea elementelor de încălzire și a compresorului se realizează cu ajutorul panoului de control PU. Înainte de a porni macaralele La 1
și La 2
deschide, apoi inchide. Acest lucru este necesar pentru ca presiunea din baloane la momentul inițial să devină egală cu presiunea atmosferică. Termometrul măsoară temperatura T apa in care sunt scufundate baloane cu aer uscat si umed. Parametrii de instalare sunt astfel încât apa să fie încălzită lent, iar gazul din baloane are timp să se încălzească la aceeași temperatură ca și apa din sistem. Manometre M 1
și M 2
arată excesul de presiune din baloane cu aer uscat, respectiv umed.
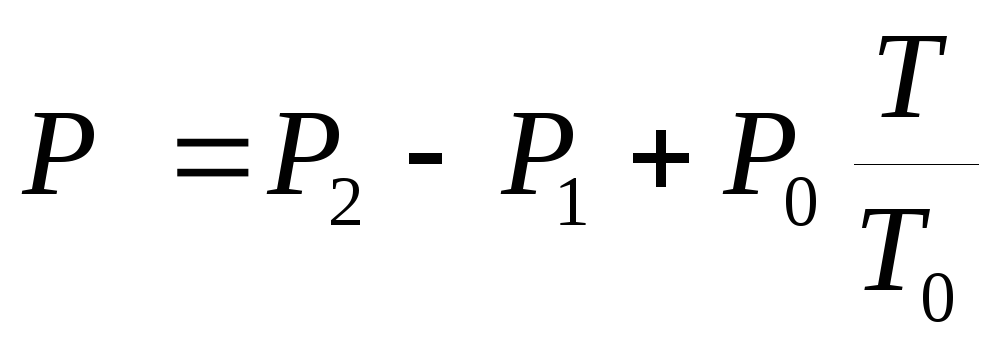 , (3)
, (3)
Unde P 1
și P 2
- indicatii ale manometrelor M 1
și M 2
respectiv, T– temperatura din sistem 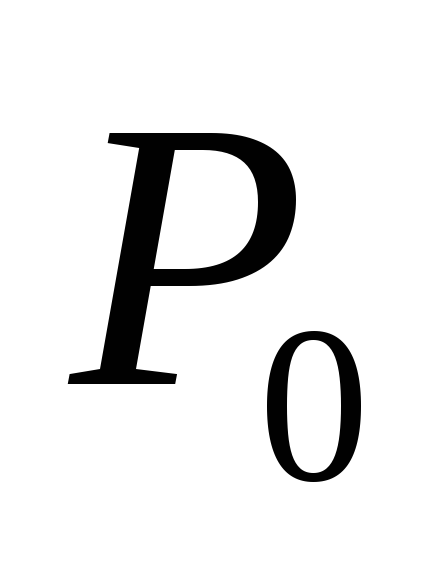 presiunea aburului saturat la temperatura initiala
presiunea aburului saturat la temperatura initiala  (această valoare este considerată cunoscută).
(această valoare este considerată cunoscută).
Conform experienței, este construit un grafic de dependență  din
din 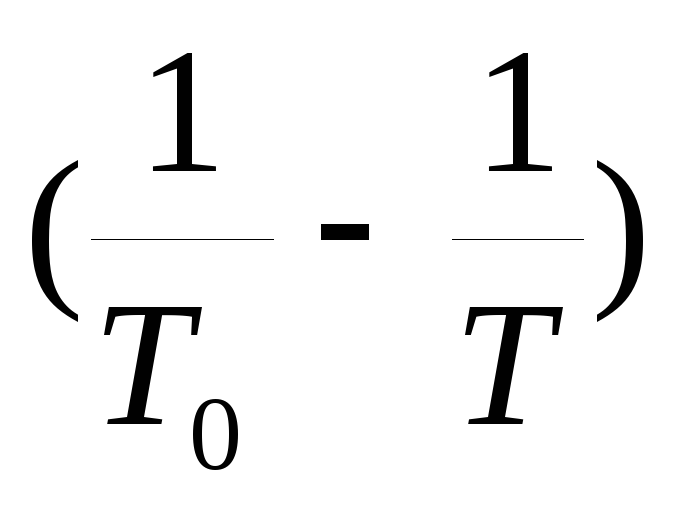 .
.
Conform ecuației (2), punctele experimentale trebuie să se afle pe o dreaptă care trece prin origine. Conform graficului, se determină panta acestei drepte  iar caldura specifica de vaporizare a apei se gaseste.
iar caldura specifica de vaporizare a apei se gaseste.
Ecuația (2) arată că  și, prin urmare:
și, prin urmare: 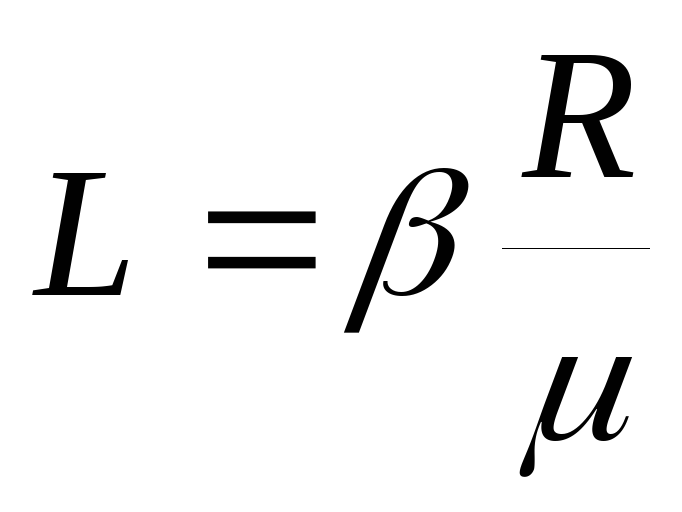 .
.
3. Măsurători. Prelucrarea rezultatelor măsurătorilor
1. Familiarizați-vă cu dispozitivul de instalare și elementele acestuia.
2. Eliminați dependența manometrelor P 1 și P 2 pe temperatură și calculați pentru fiecare temperatură presiunea vaporilor de saturație P folosind formula (3). Faceți un tabel pe baza experienței dvs.:
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
|
3. Grafic presiunea vaporilor de saturație în funcție de temperatură P(T)și un grafic al logaritmului rapoartelor de presiune y=  din valoare x =
din valoare x =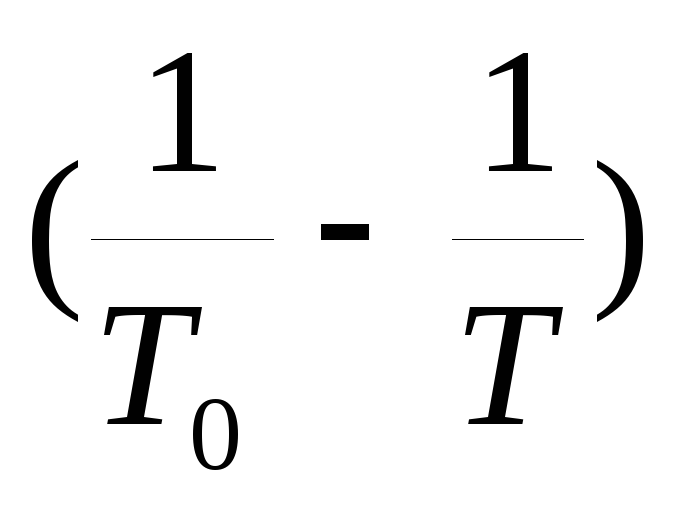 .
.
Pentru a construi ultimul grafic, trebuie să completați tabelul:
|
| ||||||
|
| ||||||
|
| ||||||
|
|
De coeficient unghiular grafic determină căldura de vaporizare Lși estimați eroarea rezultatului.
4. Comparați rezultatul cu valoarea tabelului.
4. Întrebări de securitate
Cum se numește căldura specifică de vaporizare a unui lichid?
Deduceți ecuația Clausius-Clapeyron.
Ce ipoteze au fost făcute la derivarea relației (2)? Deduceți acest raport.
Azeotrop- termen folosit pentru a desemna un amestec de lichide ale căror faze lichide și gazoase, în condiții de echilibru termodinamic, au aceeași compoziție. Punctul de fierbere al amestecului este constant.
Punctul de azeotropie- temperatura la care fierbe un amestec de lichide si vapori de aceeasi compozitie ca si amestecul lichid.
Vid(sau gaz rarefiat) - starea unui mediu gazos în care presiunea sa este semnificativ mai mică decât presiunea atmosferică.
Deflegmator - schimbator de caldura pentru condensarea partiala a aburului. În coloanele de distilare, servește la formarea refluxului necesar pentru irigarea elementelor de contact ale coloanei.
Evaporare Vaporizarea are loc de pe suprafața liberă a unui lichid. Moleculele unui lichid la aceeași temperatură se mișcă cu viteze diferite. Dacă o moleculă suficient de rapidă se află la suprafața lichidului, atunci poate depăși atracția moleculelor învecinate și poate zbura din lichid. Moleculele care scapă de pe suprafața lichidului formează vapori. Concomitent cu evaporarea, moleculele sunt transferate din vapori în lichid. Fenomenul de transformare a vaporilor in lichid se numeste condensare.
Dacă nu există niciun aflux de energie în lichid din exterior, atunci lichidul care se evaporă este răcit. Condensarea vaporilor este însoțită de eliberarea de energie.
Viteza de evaporare a unui lichid depinde de tipul de lichid și de temperatura acestuia, de suprafața sa, de mișcarea maselor de aer (vânt) pe suprafața lichidului.
Fierbere- procesul de vaporizare care are loc în întregul volum al lichidului. La fierbere, evaporarea are loc în bule de aer dizolvate în lichid. Odată cu creșterea presiunii în bule, acestea plutesc la suprafață și izbucnesc. Aceste bule conțin nu numai aer, ci și vapori de apă, deoarece lichidul se evaporă în interiorul acestor bule.
Formarea centrului de fierbere- aparitia si cresterea bulelor de vapori pe suprafata incalzita in contact cu lichidul.
Punct de fierbere este punctul de fierbere la presiune normală.
vaporizare - faza de tranzitie primul fel; trecerea unei substanţe dintr-un lichid sau stare solidăîn stare gazoasă.
Într-un volum închis, vaporizarea continuă până când spațiul de deasupra lichidului sau solidului este umplut cu vapori având o presiune de echilibru la o temperatură dată (presiune de saturație). Cea mai mare parte a căldurii de vaporizare este cheltuită pentru ruperea legăturilor dintre particule, o parte din ea merge la munca efectuată în timpul expansiunii aburului.
Temperatura de fierbere este temperatura la care fierbe lichidul.
Temperatura de fierbere:
Depinde de natura fluidului și de presiunea externă; și
Situat între punct tripluși temperatura critică.
La presiune constantă, fiecare lichid are propriul său punct de fierbere.
Odată cu creșterea presiunii atmosferice, punctul de fierbere al unui lichid crește, iar căldura specifică de vaporizare scade.
Căldura de evaporare- cantitatea de căldură care trebuie transmisă unei substanțe pentru a o transfera din stare lichidă în stare gazoasă la o temperatură constantă.
Căldura de vaporizare- cantitatea de căldură care trebuie transmisă unei substanțe la presiune și temperatură constantă pentru a o transfera din stare lichidă în stare gazoasă.
În SI, căldura de vaporizare este măsurată în J.
Căldura specifică de vaporizare- cantitatea de căldură care trebuie transmisă la 1 kg dintr-o substanță pentru a o transfera din stare lichidă în stare gazoasă la o temperatură constantă.
Căldura specifică de vaporizare se măsoară în J/kg.
Căldura specifică de vaporizare este cantitatea de căldură necesară pentru a transforma 1 kg de lichid în vapori la o temperatură constantă. Această valoare este notată cu litera L sau litera r și este exprimată în jouli pe kilogram (J/kg).
Odată cu creșterea temperaturii, valoarea căldura specifică vaporizarea este redusă.
Căldura specifică de vaporizare - căldura de vaporizare, calculată pe unitatea de masă a unei substanțe.
Căldura specifică de vaporizare scade odată cu creșterea temperaturii și devine zero la temperatura critică.
Căldura specifică de vaporizare arată câtă energie trebuie să fie distribuită unui kilogram de lichid luat la temperatura de fierbere pentru a-l transforma complet în abur la această temperatură (pentru condensare: câtă energie este eliberată de un kilogram de abur luat la temperatura de condensare, transformându-se complet într-un lichid).
La aceeași presiune, punctul de fierbere și punctul de condensare ale aceleiași substanțe sunt aceleași.
Condens abur - procesul de întoarcere a moleculelor de vapori într-un lichid se numește condensare a vaporilor.
Condensator- un schimbător de căldură în care vaporii sunt condensați, în timp ce degajă căldură către răcitor.
condensator de apă Un condensator care folosește apă ca lichid de răcire.
Condensator PIPE IN PIPE- un condensator format din două tuburi concentrice, cu aburul care circulă cel mai adesea în golul inelar, iar răcitorul în tubul central.
Schimb de căldură sau transfer de căldură- procesul de tranziție energie interna de la un corp la altul ca urmare a contactului termic fără a lucra.
Echilibru termic- starea sistemului în care parametrii macroscopici ai acestuia nu se modifică în timp. La echilibru termic, volumul și presiunea nu se modifică, nu are loc schimbul de căldură, nu există transformări reciproce ale lichidelor și gazelor, lichidelor și solide, Stop reacții chimiceși altele.În stare de echilibru termic, temperatura este aceeași în toate părțile sistemului.
Căldura specifică- (litera c mică) - o caracteristică a unei substanțe, care arată cât de multă căldură este necesară pentru a încălzi 1 kg dintr-o substanță cu 1 grad (sau eliberată atunci când 1 kg dintr-o substanță se răcește cu 1 grad). Se măsoară în J/kg K sau J/kg 0C. Date din tabel.
schimbător de căldură- un aparat conceput pentru a transfera căldură între două medii separate unul de celălalt.
Schimbător de căldură cu carcasă și tub- un schimbător de căldură format dintr-un mănunchi de țevi plasate într-o carcasă, unul dintre fluide curgând prin țevi, iar celălalt în spațiul dintre țevi și suprafața interioară a carcasei.
țeavă de căldură- un volum închis, de obicei sub formă de tub, umplut parțial cu un lichid și vaporii acestuia și folosit pentru a transfera căldură între cele două secțiuni extreme ale sale prin evaporarea lichidului din secțiunea fierbinte și condensarea vaporilor în cea rece. Lichidul condensat este returnat la punctul fierbinte prin forțe gravitaționale sau capilare printr-un dispozitiv adecvat care acționează ca un FIȚI.
Presiune parțială- (partialis - partial) - presiunea pe care ar avea-o un gaz care face parte dintr-un amestec de gaze daca singur ar ocupa un volum egal cu volumul amestecului de aceeasi temperatura.
punct de condensare Temperatura la care vaporii de apă din aer devin saturați.
Fază- starea de echilibru a materiei, care diferă în proprietăți fizice din alte stări posibile ale aceleiaşi substanţe. O substanță are faze: una este gazoasă, una lichidă și mai multe faze solide (de exemplu, gheața poate fi în cinci modificări diferite, ceea ce înseamnă că are cinci faze solide).
faza de tranzitie- trecerea unei substante de la o faza la alta.
Semnificația fizică a gradientului de temperatură este rata maximă de creștere a temperaturii pe distanță. Acesta este un vector îndreptat în direcția creșterii temperaturii, numeric egal cu prima derivată a temperaturii în raport cu distanța. Gradientul de temperatură se măsoară în grade pe metru. Gradientul de temperatură este diferit de zero dacă există o diferență de temperatură.
Ejector- un dispozitiv care crește debitul unui mediu într-o secțiune de îngustare pentru a crea presiune redusăși astfel provocând un aflux al unui alt mediu acolo.
Sirop De obicei, o soluție de zahăr în apă.
Saramură- de obicei o soluție de sare în apă.
Introduceți elevii fenomenul de fierbere. Să învețe să explice procesul de fierbere pe baza moleculară - teoria cinetică. Luați în considerare caracteristicile fizice ale fierberii. Determinați metoda de calcul a căldurii în procesul studiat.
Descarca:
Subtitrările slide-urilor:
Prezentarea a fost pregătită de profesorul de fizică Starkova Evgenia Evgenievna MOU Burevestnikovskaya școala secundară
Tema lecției:
Ce proces se numește vaporizare?
Ce este evaporarea?
La ce temperatură are loc evaporarea?
1. De ce apa se evaporă mai repede dintr-o farfurie decât dintr-un vas?
2. De ce a fost deranjat echilibrul cântarului?
3. De ce nivelurile diferitelor fluide au devenit diferite după câteva zile?
Ce proces se numește condensare?
Este energia absorbită sau eliberată în timpul condensului?
Fierberea este o tranziție intensă a unui lichid în vapori, care are loc odată cu formarea de bule de vapori pe întregul volum al lichidului la o anumită temperatură.
Punctul de fierbere al unor substanțe, 0C (la normal presiune atmosferică)
Hidrogen
-253
Apă
100
Oxigen
-183
Mercur
357
Lapte
100
Conduce
1740
Eter
35
Cupru
2567
Alcool
78
Fier
2750
Punctul de fierbere depinde de presiunea exercitată pe suprafața liberă a lichidului
Pe măsură ce presiunea scade, punctul de fierbere al unui lichid scade.
Pe măsură ce presiunea crește, punctul de fierbere al unui lichid crește.
Căldura specifică de vaporizare.
Cantitate fizica, care arată câtă căldură este necesară pentru a transforma un lichid cu masa de 1 kg în vapori fără a modifica temperatura, se numește căldură specifică de vaporizare.
Căldura specifică de vaporizare se notează L, măsurată în J/kg
Căldura specifică de vaporizare a anumitor substanțe, J/kg (la punctul de fierbere și presiunea atmosferică normală)
Pentru a transforma apa cu o mască de 1 kg în abur la o temperatură de 100 0C, este nevoie de 2,3 * 106 J de energie.
Condensând, aburul eliberează cantitatea de energie care a intrat în formarea sa
Calculul cantității de căldură necesară pentru a transforma un lichid în abur
Pentru a calcula cantitatea de căldură necesară pentru a vaporiza un lichid de orice masă, luată la punctul de fierbere, trebuie să înmulțiți căldura specifică de vaporizare cu masa
Q=lm
Q – cantitatea de căldură, J L – căldura specifică de vaporizare, J/kg m – greutatea corporală, kg
Cantitatea de căldură eliberată de abur, condensând la punctul de fierbere, este determinată de aceeași formulă
Q
3 *106 J
?
4,5*107 J
L
2,3*106 J/kg
2,3*106 J/kg
?
m
?
0,8 kg
19 kg
1,3 kg
1,84 * 106 J
2,3 * 106 J/kg
Graficele arată procesele de încălzire și fierbere a unor mase identice de apă și alcool.
20
40
60
80
100
DAR
LA
DIN
La
M
t, 0c
t, s
1. Indicați graficul de încălzire și fierbere construit pentru alcool
2. Calculați cantitatea de căldură care este absorbită în timpul procesului MC. Se presupune că masa apei este de 5 kg.
Manualul A.V. Peryshkin§18, §20Ex. 10 Nr. 3.4
Previzualizare:
Lecție de fizică în clasa a VIII-a.
Subiect: Fierbere. Căldura specifică de vaporizare și condensare.
Scopul lecției: Introduceți elevii fenomenul de fierbere. Să învețe să explice procesul de fierbere pe baza teoriei molecular-cinetice. Luați în considerare caracteristicile fizice ale fierberii. Determinați metoda de calcul a căldurii în procesul studiat.
Demo: 1 .Observarea procesului de încălzire și fierbere a apei într-un balon de sticlă.(Video)
2 . Apa clocotita la presiune redusa (video).
3 . Observarea procesului de condensare (video).
Echipament: calculator, proiector multimedia.
Pașii lecției:
- E Atingeți pentru a actualiza cunoștințele
- Etapa motivațională
- Etapa creării de noi cunoștințe
- Etapa de aplicare a cunoștințelor dobândite
- Teme pentru acasă
Structura lecției
- Etapa de actualizare a cunoștințelor.
Org.moment.
Examinare teme pentru acasă sub forma unui sondaj oral:
În ultima lecție am învățat două fenomene fizice Acestea sunt evaporarea și condensarea. Să ne amintim care sunt.
Slide 2. Ce proces se numește vaporizare?
Ce este evaporarea?
La ce temperatură are loc evaporarea?
Slide 3. Viteza de evaporare depinde de mai mulți factori. Să le lămurim răspunzând la următoarele întrebări:
Prin urmare, viteza de evaporare depinde de:
- din suprafata.
- asupra temperaturii lichidului.
- Dintr-un fel de lichid.
slide 4. Ce vezi pe ecran? ( roua si norii).
Ce proces a dus la formarea de rouă și nori?
Ce proces se numește condensare?
Este energia absorbită sau eliberată în timpul condensului? ( iese în evidență).
- etapa motivațională.
Bine făcut! Acum să ne uităm la imaginile prezentate pe ecran:
Slide 5. Spune-mi ce vezi? ( peste abur de apa)
slide 6. Ce vedem aici? (apă clocotită, abur deasupra apei)
Slide 7. Ce unește datele de imagine? ( abur)
Bun! În ultima lecție, am învățat că există două moduri prin care un lichid poate trece stare gazoasă, evaporare și fierbere.
Astăzi vom lua în considerare a doua metodă de formare a aburului - fierberea.
- Etapa creării de noi cunoștințe.
slide 8. Vă demonstrez un videoclip cu experiența „Încălzire și fierbere apă într-un balon de sticlă”.
Când este încălzită, evaporarea apei de la suprafață crește, uneori puteți observa chiar și ceață deasupra acesteia. Acești vapori de apă se condensează în aer pe măsură ce se răcește.
Odată cu o creștere suplimentară a temperaturii, vom observa apariția a numeroase bule mici în apă. Dimensiunea lor crește treptat. Acestea sunt bule de aer care se dizolvă în apă. Când este încălzit, excesul de aer este eliberat din apă sub formă de bule. Ele conțin abur saturat pe măsură ce apa se evaporă în aceste bule de aer.
Pe măsură ce apa se încălzește și mai mult, bulele devin mai mari și mai numeroase. Pe măsură ce dimensiunea bulelor crește, crește și forța arhimediană, împingându-le din apă și plutesc. În acest moment, se aude un zgomot, de obicei înainte de fierbere. La o anumită temperatură, pe măsură ce se apropie de suprafața lichidului, volumul bulelor crește brusc. La suprafață, explodează, iar aburul saturat din ele scapă în atmosferă - apa fierbe.
Scoatem lampa cu spirt de sub balon. Ce vedem? (fierberea se oprește)
Pentru a continua fierberea, este necesar să furnizați energie lichidului care fierbe.
slide 9. Fierberea este o tranziție intensă a unui lichid în vapori, care are loc odată cu formarea de bule de vapori pe întregul volum al lichidului la o anumită temperatură. (scriind într-un caiet)
Temperatura la care fierbe un lichid se numește punct de fierbere. (scriind într-un caiet)
slide 10. În timpul fierberii, temperatura lichidului nu se modifică.
Diferitele lichide au puncte de fierbere diferite.
Slide 11. Punctul de fierbere depinde de presiunea exercitată pe suprafața liberă a lichidului.
Demonstrez un videoclip cu experiența „Fierbere sub presiune redusă”
Pe măsură ce presiunea scade, punctul de fierbere al unui lichid scade
(În regiunile muntoase la altitudini mari, la presiune atmosferică scăzută, apa fierbe la temperaturi mai mici de 100 de grade Celsius. Este nevoie de mai mult timp să aștepți până se gătește o astfel de cină.)
Pe măsură ce presiunea crește, punctul de fierbere al unui lichid crește
(La gătit, presiunea din interiorul oalei – „oala sub presiune” – este de aproximativ 200 kPa, iar supa dintr-o astfel de oală se va găti mult mai repede).
slide 12. Căldura specifică de vaporizare.
slide 13. Căldura specifică de vaporizare variază de la substanță la substanță.
slide 14. În contact cu un obiect rece, vaporii de apă se condensează. În acest caz, energia absorbită în timpul formării aburului este eliberată.
Demonstrez un videoclip cu experiența „Observarea procesului de condensare”.
Condensând, aburul eliberează cantitatea de energie care a intrat în formarea sa.
slide 15. Calculul cantității de căldură necesară pentru a transforma un lichid în abur.
- Etapa de aplicare a cunoștințelor dobândite.
(După prezentarea de material nou, este recomandabil să se efectueze sarcini de întărire)
slide 16.
Lucrul cu o formulă pentru calcularea cantității de căldură necesară pentru a transforma un lichid de orice masă în vapori
Q = Lm.
Raspunsuri:
diapozitivul 17. Lucrul cu diagrame.
Rezultat . Astăzi la lecție ne-am familiarizat cu fenomenul fierberii. Am învățat să explicăm procesul de fierbere pe baza teoriei molecular-cinetice. Am luat în considerare caracteristicile fizice ale fierberii și am determinat metoda de calcul a căldurii în procesul studiat.
- Teme pentru acasă
(Profesorul notează cei mai activi elevi, notele)