Naftalen je kristalna supstanca čija je tačka topljenja. Metode za proučavanje toplotnih fenomena na osnovu strukture materije
Vratimo se na grafikon topljenja i kristalizacije naftalena (Sl. 198) i razmotrimo onaj njegov dio koji se odnosi na hlađenje naftalena.
Kada se rastopljeni naftalen ohladi, njegova temperatura se smanjuje. Ali kako čim se naftalen počne stvrdnjavati, smanjenje temperature prestaje, iako naftalen nastavlja da predaje svoju unutrašnju energiju tijelima koja ga okružuju. Na kraju krajeva, njegova temperatura je viša od temperature ovih tijela. I dok se sav naftalen ne stvrdne, njegova temperatura se ne mijenja. Ali čim se sve stvrdne, temperatura će ponovo početi da pada.
Ovaj fenomen se vidi u svakom kristalno telo. Zašto se temperatura kristalnog tijela ne smanjuje tokom njegovog skrućivanja?
Već znamo da je pri temperaturi skrućivanja unutrašnja energija tijela u tečnom stanju veća od njegove unutrašnja energija u čvrstom stanju. Tokom cijelog procesa stvrdnjavanja oslobađa se višak unutrašnje energije i nadoknađuje energiju izgubljenu zbog hlađenja. Stoga prosječna energija molekula, a samim tim i temperatura tijela ostaju nepromijenjeni sve dok dok se proces očvršćavanja ne završi. Od ovog trenutka, temperatura čvrstog tijela će se početi smanjivati, jer se gubitak unutrašnje energije u njemu više neće obnavljati.
Pažljivo sprovedeni eksperimenti pokazuju da se tokom skrućivanja kristalne supstance oslobađa tačno ista količina toplote koja se apsorbuje tokom njenog topljenja. dakle, pri očvršćavanju vode težine 1 kg na temperaturi od 0 ° C Oslobađa se 3,4 10 6 J. Ali potpuno ista količina toplote potrebna je za otapanje leda težine 1 kg na temperaturi od 0 °C.
Pitanja.
- Kako objasniti da u procesu skrućivanja tvari njena temperatura 0 ostaje konstantna?
- Koliko energije se oslobađa kada se 1 kg vode stvrdne?
Vježbe.
- Led koji se topi je doveden u prostoriju sa temperaturom od 0°C. Hoće li se led u ovoj prostoriji nastaviti topiti?
- Komadići leda plutaju u kanti vode. Ukupna temperatura vode i leda je 0°C. Hoće li se led otopiti ili voda smrznuti? Od čega zavisi?
- Koliko energije je potrebno da se otopi 4 kg leda na 0°C?
- Koliko je energije potrebno da se 20 kg olova otopi na tački topljenja? Koliko je energije potrebno za ovo ako početna temperatura olovo 27°C?
Zadaci.
- Stavite dvije identične konzerve na šporet. U jednu sipajte 0,5 kg vode, u drugu stavite 0,5 kg snega. Obratite pažnju na to koliko je vremena potrebno da voda stane kuvano u obe banke. Napišite kratak prikaz svog iskustva i objasnite rezultate.
- Pripremite izvještaj na temu "Ljevanje metala" čitajući takav pasus na kraju udžbenika.
Mnogo pažnje je posvećeno međusobnim transformacijama tečnosti i gasova. Sada razmotrite transformaciju čvrstih tela u tečnosti i tečnosti u čvrste materije.
Topljenje kristalnih tijela
Topljenje je transformacija tvari iz čvrstog u tekuće stanje.
Postoji značajna razlika između topljenja kristalnih i amorfnih tijela. Da bi se kristalno tijelo počelo topiti, mora se zagrijati na temperaturu koja je sasvim specifična za svaku supstancu, koja se naziva tačka topljenja.
Na primjer, pod normalnim atmosferski pritisak tačka topljenja leda je 0 °C, naftalena - 80 °C, bakra - 1083 °C, volframa - 3380 °C.
Da bi se tijelo istopilo, nije dovoljno zagrijati ga do tačke topljenja; potrebno je nastaviti sa dopremanjem toplote u njega, odnosno povećati njegovu unutrašnju energiju. Tokom topljenja, temperatura kristalnog tijela se ne mijenja.
Ako se tijelo nastavi zagrijavati nakon što se otopi, temperatura njegovog topljenja će se povećati. Navedeno se može ilustrovati grafikom zavisnosti telesne temperature od vremena njenog zagrevanja (slika 8.27). Parcela AB odgovara zagrevanju čvrstog tela, horizontalnog preseka sunce- proces topljenja i dijagram CD - zagrevanje taline. Zakrivljenost i nagib presjeka parcele AB i CD zavise od uslova procesa (masa zagrejanog tela, snaga grejača, itd.).
Prijelaz kristalnog tijela iz čvrstog u tekuće stanje događa se naglo, naglo - bilo tekuće ili čvrsto tijelo.
Topljenje amorfnih tijela
Amorfna tijela se uopće ponašaju drugačije. Kada se zagreju, postepeno, kako temperatura raste, omekšaju i na kraju postaju tečni, ostajući homogeni tokom čitavog vremena zagrevanja. Ne postoji određena temperatura prijelaza iz čvrstog u tečnost. Na slici 8.28 prikazan je dijagram temperature u odnosu na vrijeme tokom prijelaza amorfnog tijela iz čvrstog u tečno stanje.

Stvrdnjavanje kristalnih i amorfnih tijela
Prijenos materije iz tečno stanje u čvrstu supstancu naziva se skrućivanjem ili kristalizacijom(za kristalna tijela).
Također postoji značajna razlika između očvršćavanja kristalnih i amorfnih tijela. Kada se rastopljeno kristalno tijelo (talina) ohladi, ono nastavlja ostati u tekućem stanju sve dok mu temperatura ne padne na određenu vrijednost. Na ovoj temperaturi, koja se naziva temperatura kristalizacije, tijelo počinje kristalizirati. Temperatura kristalnog tijela se ne mijenja tokom skrućivanja. Brojna zapažanja su to pokazala kristalna tijela se tope i skrućuju na istoj temperaturi određenoj za svaku supstancu. Daljnjim hlađenjem tijela, kada se cijela talina stvrdne, temperatura tijela će se ponovo smanjiti. Prethodno je ilustrovano grafikom zavisnosti telesne temperature od vremena njegovog hlađenja (slika 8.29). Parcela ALI 1 AT 1 odgovara tečnom hlađenju, horizontalni dio AT 1 OD 1 - proces kristalizacije i dijagram C 1 D 1 - hlađenje čvrstog tijela nastalog kristalizacijom.

Supstance iz tečnog u čvrsto stanje tokom kristalizacije takođe naglo prelaze bez međustanja.
Stvrdnjavanje amorfnog tijela, kao što je smola, odvija se postepeno i podjednako u svim njegovim dijelovima; smola ostaje homogena, odnosno stvrdnjava amorfna tela- to je samo njihovo postepeno zgušnjavanje. Ne postoji određena temperatura očvršćavanja. Slika 8.30 prikazuje grafikon temperature očvršćavanja smole u odnosu na vrijeme.
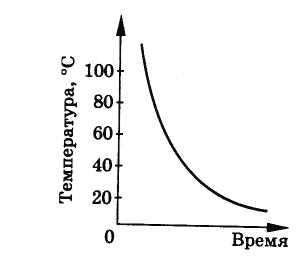
Na ovaj način, amorfne tvari nemaju određenu temperaturu, topljenje i skrućivanje.
Topljenje - prijelaz tijela iz kristalnog čvrsto stanje u tečnost. Topljenje nastaje uz apsorpciju specifične topline fuzije i to je fazni prelaz prva vrsta.
Sposobnost topljenja se odnosi na fizička svojstva supstance
Pri normalnom pritisku volfram ima najvišu tačku topljenja među metalima (3422°C), jednostavne supstance općenito - ugljik (prema različitim izvorima 3500 - 4500 ° C) i među proizvoljnim tvarima - hafnijev karbid HfC (3890 ° C). Možemo pretpostaviti da helijum ima najnižu tačku topljenja: pri normalnom pritisku, on ostaje tečan na proizvoljno niskim temperaturama.
Mnoge supstance pri normalnom pritisku nemaju tečnu fazu. Kada se zagreju, odmah prolaze kroz sublimaciju gasovitom stanju.
Slika 9 – Otapanje leda
Kristalizacija je proces faznog prijelaza tvari iz tekućeg u čvrsto kristalno stanje uz nastanak kristala.
Faza je homogeni deo termodinamičkog sistema odvojen od ostalih delova sistema (drugih faza) interfejsom, prolaskom kroz koji hemijski sastav, struktura i svojstva materije se mijenjaju u skokovima.
Slika 10 – Kristalizacija vode sa stvaranjem leda
Kristalizacija je proces odvajanja čvrste faze u obliku kristala od rastvora ili taline; u hemijskoj industriji proces kristalizacije se koristi za dobijanje materija u čistom obliku.
Kristalizacija počinje kada se postigne određeni granični uvjet, na primjer, prehlađenje tekućine ili prezasićenost pare, kada se gotovo trenutno pojavljuju mnogi mali kristali - centri kristalizacije. Kristali rastu spajanjem atoma ili molekula iz tekućine ili pare. Rast kristalnih lica odvija se sloj po sloj, rubovi nepotpunih atomskih slojeva (stepenica) pomiču se duž lica tokom rasta. Ovisnost brzine rasta od uslova kristalizacije dovodi do različitih oblika rasta i kristalnih struktura (poliedarskih, lamelarnih, igličastih, skeletnih, dendritičnih i drugih oblika, pencil strukture itd.). U procesu kristalizacije neminovno nastaju različiti defekti.
Na broj centara kristalizacije i brzinu rasta značajno utiče stepen prehlađenja.
Stepen prehlađenja je nivo hlađenja tečnog metala ispod temperature njegovog prelaska u kristalnu (čvrstu) modifikaciju. Potrebno je nadoknaditi energiju latentna toplota kristalizacija. Primarna kristalizacija je formiranje kristala u metalima (i legurama) tokom prelaska iz tečnog u čvrsto stanje.
Specifična toplota taljenje (također: entalpija topljenja; postoji i ekvivalentan koncept specifične toplote kristalizacije) - količina toplote koja se mora preneti jednoj jedinici mase kristalne supstance u ravnotežnom izobarično-izotermnom procesu da bi se prenela iz čvrstog (kristalnog) stanja u tečno (ista količina toplote se oslobađa tokom kristalizacije supstance).
Količina toplote tokom topljenja ili kristalizacije: Q=ml
> Isparavanje i ključanje. Specifična toplota isparavanja
Isparavanje je proces prijelaza tvari iz tekućeg u plinovito stanje (para). Proces isparavanja je obrnut od procesa kondenzacije (prijelaz iz parnog u tečno stanje. Isparavanje (vaporizacija), prijelaz tvari iz kondenzirane (čvrste ili tekuće) faze u plinovitu (para); faza prvog reda tranzicija.
U višoj fizici postoji detaljniji koncept isparavanja
Isparavanje je proces u kojem se površina tečnosti ili čvrsto teločestice (molekule, atomi) izlete (odvajaju se), dok Ek > Ep.
Slika 11 - Isparavanje preko šolje čaja
Specifična toplota isparavanja (vaporizacija) (L) -- fizička količina, koji pokazuje količinu toplote koja se mora preneti 1 kg supstance uzete na tački ključanja da bi se prešla iz tekućeg u gasovito stanje. Specifična toplota isparavanja se meri u J/kg.
Vrenje je proces isparavanja u tečnosti (prelazak supstance iz tečnog u gasovito stanje), sa pojavom granica razdvajanja faza. Tačka ključanja pri atmosferskom pritisku obično se navodi kao jedna od glavnih fizičko-hemijskih karakteristika hemijski čiste supstance.
Vrenje je fazni prijelaz prvog reda. Ključanje se događa mnogo intenzivnije od isparavanja s površine, zbog stvaranja žarišta isparavanja, zbog oba dostigla temperaturu ključanje i prisustvo nečistoća.
Na proces formiranja mehurića može uticati pritisak, zvučni talasi, jonizacija. Konkretno, mjehurić komora radi na principu ključanja mikrovolumena tekućine od jonizacije tokom prolaska nabijenih čestica.
Slika 12 - Kipuća voda
Količina toplote tokom ključanja, isparavanja tečnosti i kondenzacije pare: Q=mL






