Formula nezasićene pare. Zasićena i nezasićena para
Nezasićene i zasićene pare
Iznad slobodne površine tekućine uvijek se nalaze pare te tekućine koje nastaju isparavanjem. Ako prostor iznad slobodne površine tekućine nije ograničen nikakvim zidovima, molekule ili atomi isparene tvari, čineći haotično toplinsko kretanje, udaljavaju se od površine tekućine. Uklanjanje čestica pare s površine tekućine olakšava fenomen difuzije, kao i prirodna ili umjetna konvekcija zračnih slojeva. Koncentracija čestica pare pri konstantna temperatura u ovim uslovima može varirati u širokom rasponu, kako u pravcu smanjenja tako i u pravcu povećanja. Takvi parovi se nazivaju nezasićeni.
Drugačija slika se uočava ako postoji ograničen prostor iznad slobodne površine tečnosti. Da li je ispunjen bilo kojim drugim gasovitim materijama, osim parama tečnosti koja isparava, ili ne, nije bitno. Važno je napomenuti da se proces isparavanja u zatvoreni prostor može odvijati samo do određene granice. Što je veća koncentracija molekula ili atoma tvari koja isparava u stanju pare, to će biti veći pritisak ovih para na konstantnoj temperaturi. U ovom slučaju, sve veći broj molekula ili atoma može se vratiti kroz slobodnu površinu natrag u tekućinu. Ako je količina prostora koja se daje pari dovoljno mala, a tekućina dovoljno velika, može se uspostaviti dinamička ravnoteža: broj čestica koje izlaze iz tekućine u jedinici vremena jednak je broju čestica koje se vraćaju u tekućinu u istom vremenskom periodu . U tom slučaju će konstantna masa pare biti iznad tečnosti, a veća koncentracija njenih čestica u ovim uslovima ne može se postići. Takva para se naziva zasićena.
Pritisak zasićena para neke supstance na datoj temperaturi može imati jednu - jedinu definitivnu vrednost.
Smanjenje volumena prostora koji se daje zasićenoj pari date tvari na konstantnoj temperaturi dovodi do kondenzacije dijela pare u tekućinu, budući da koncentracija njenih čestica ne može preći određenu vrijednost. Ova izotermna kompresija zasićene pare razlikuje se od kompresije nezasićenih para, koje se ponašaju kao obični idealni plinovi. Boyle-Mariotteov zakon, dakle, ne vrijedi za zasićene pare.
Gay–Lussacov zakon se također ne primjenjuje na zasićene pare, budući da je volumen koji im se daje nezavisan od temperature.
Nije primjenjivo na zasićenu paru i Charlesov zakon. Sa porastom temperature idealnih gasova ili nezasićene pare u izohornom procesu, prosjek kinetička energija njihovih čestica, što dovodi do njihovog češćih sudara međusobno i sa zidovima posude, tj. do povećanja pritiska.
Moguće je sa sigurnošću govoriti da data zatvorena posuda sadrži upravo zasićenu paru neke supstance samo ako posuda sadrži tu supstancu u tečno stanje a masa njegove tečne faze se ne menja.
Na primjer, pred nas stavljaju zatvorenu staklenu posudu i traže da bez mjerenja utvrdimo da li sadrži zasićenu ili nezasićenu vodenu paru.
Da biste odgovorili na ovo pitanje, morate pričekati nekoliko minuta kako bi sadržaj posude imao vremena da dođe u termodinamičku ravnotežu s okolnim zrakom. To je uzrokovano činjenicom da ne znamo na koju temperaturu je posuda dovedena iz prostorije, a promjena temperature pare pri konstantnom volumenu može dovesti paru iz nezasićenog stanja u zasićeno i obrnuto. . Ako nakon uspostavljanja ravnoteže nema kondenzacije vode na unutrašnjim stijenkama posude, moramo reći da na temperaturi na kojoj se vrši promatranje posuda sadrži nezasićenu paru. Ako se kapljice vode pojave na zidovima posude, para je zasićena.
Vodena para u vazduhu
Zemljina atmosfera uvijek sadrži vodenu paru. S njihovim prisustvom treba vrlo često računati. Posebno se mora precizno procijeniti vlažnost zraka u zatvorenim ili slabo ventiliranim prostorijama, komorama za sušenje itd.
Za kvantifikacija Sadržaj vodene pare u zraku koristi dvije vrijednosti - apsolutnu vlažnost (f) i relativnu vlažnost (B).
Apsolutna vlažnost se zove fizička količina, mjereno masom vodene pare sadržane u jednom kubnom metru zraka. Na ovaj način, apsolutna vlažnost poklapa se s dimenzijom gustoće, ali u praksi obično koriste jedinicu - 1 g / m 3.
Ova posljednja okolnost je zbog činjenice da se apsolutna vlažnost zraka f, izražena u g/m 3 , u brojčanoj vrijednosti malo razlikuje od parcijalnog tlaka vodene pare p pod istim uvjetima, mjerenog u milimetrima žive.
Procentualni odnos parcijalnog pritiska p vodene pare u vazduhu prema pritisku zasićene vodene pare p n.p. na datoj temperaturi naziva se relativna vlažnost:
Prilikom izračunavanja relativne vlažnosti po ovoj formuli, tlak p i p n.s. moraju se mjeriti u istim jedinicama. Obično se ne mjere u paskalima, već u milimetrima žive. Vrijednost p n.s se utvrđuje iz tabela.
Temperatura na kojoj zrak postaje zasićen vodenom parom tokom hlađenja naziva se tačka rose.
Predavanje #2
OSNOVE PRIJENOSA TOPLOTE
Prijenos topline je nauka koja proučava obrasce procesa prijenosa topline između tijela i raspodjelu topline unutar jednog tijela. Proučavanje zakona prenosa toplote neophodno je za kontrolu tokova toplote koji se javljaju skoro svuda u radnim procesima mašina, motora, aparata itd.
U teoriji prijenosa topline razmatraju se dva glavna pitanja:
I. Određivanje količine toplote koja se prenosi sa jednog tela na drugo ili sa jednog dela tela na drugi pod datim uslovima.
II. Određivanje temperature u različitim dijelovima tijela uključenim u proces prijenosa topline.
Neophodan i dovoljan uslov za prenos toplote je temperaturna razlika.
Toplota se prenosi na tri načina: kondukcijom, konvekcijom i zračenjem.
Toplotna provodljivost je proces distribucije toplotne energije direktnim kontaktom pojedinih delova tela sa različitim temperaturama.
Konvekcija je proces prijenosa energije pri pomicanju volumena tekućine ili plina u prostoru iz područja s jednom temperaturom u područje s različitom temperaturom.
Zračenje (prijenos topline zračenja) je proces prijenosa energije elektromagnetnim valovima. Prijenos topline zračenjem je dvostruka transformacija energije: toplije tijelo zrači energiju u obliku elektromagnetskih oscilacija, drugo manje zagrijano tijelo apsorbira energiju i zagrijava se.
Obično se razmjena toplote između tijela odvija na sva tri načina istovremeno. Njihova kombinacija može biti najrazličitija. U ovom slučaju, jedna metoda može prevladati nad drugom, ovisno o uvjetima pod kojima se odvija prijenos topline.
Međutim, prilikom proučavanja procesa prijenosa topline treba jasno razlikovati i posebno razmotriti različite metode prijenosa topline (toplotna provodljivost, konvekcija i zračenje), budući da se pokoravaju različitim zakonima.
Procesi prijenosa topline u uređajima za toplinsku tehniku mogu se odvijati iu stacionarnom (stacionarnom) i nestacionarnom (nestacionarnom) načinu rada. Stacionarni (stalni) termički režim je režim u kojem temperatura u bilo kojoj tački tijela ne ovisi o vremenu. Stacionarnom režimu uvek prethodi nestacionarni režim.
Procesi koji se odvijaju u nestacionarnim termičkim uslovima (procesi grejanja i hlađenja) su veoma složeni i njihovo razmatranje nije uključeno u program ovog predmeta. Stoga se ovdje razmatraju samo stacionarni procesi prijenosa topline.
TOPLOTNA PROVODNOST
Osnovni koncepti
Toplotna provodljivost je molekularni prijenos topline u unutrašnjosti kontinuum zbog prisustva temperaturne razlike.
Ovaj način prijenosa topline odvija se uglavnom u čvrstim tvarima unutar jednog tijela i između dva tijela kada dođu u dodir jedno s drugim. Toplotna provodljivost se takođe može izvesti kroz sloj tečnosti ili gasa. Međutim, gasovi i tečnosti, sa izuzetkom rastopljenih metala, su veoma loši provodnici toplote.
temperaturno polje. Proces provođenja toplote, kao i druge vrste prenosa toplote, odvija se samo pod uslovom da temperatura nije ista na različitim tačkama tela. Kao što znate, temperatura je parametar stanja tijela i karakterizira stupanj njegovog zagrijavanja. Skup vrijednosti temperature u svim tačkama razmatranog prostora u ovog trenutka vrijeme se naziva temperaturno polje. Matematički, temperaturno polje se izražava kao funkcija koordinata
Površina u svim tačkama čija je temperatura ista naziva se izotermna.
Jer dvije osobe ne mogu biti u istoj tački u prostoru u isto vrijeme. različite temperature, tada se različite izotermne površine nikada ne seku. Svi oni ili završavaju na površini tijela, ili su u cijelosti smješteni unutar njega.
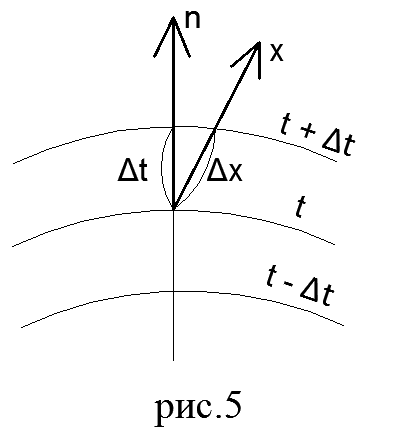 Fourierov zakon. Toplotni tok je količina toplote Q koja u jedinici vremena prolazi kroz proizvoljnu površinu. Vektor toplotnog toka je uvijek usmjeren u smjeru opadanja temperature.
Fourierov zakon. Toplotni tok je količina toplote Q koja u jedinici vremena prolazi kroz proizvoljnu površinu. Vektor toplotnog toka je uvijek usmjeren u smjeru opadanja temperature.
Kvantitativno, intenzitet prenosa toplote karakteriše gustina toplotnog toka q.
Gustoća toplotnog toka ili specifični toplotni tok je količina toplote koja prolazi kroz jedinicu površine F u jedinici vremena τ:
Relacija (51) izražava osnovni zakon toplotne provodljivosti i naziva se Fourierov zakon.
Znak minus na desnoj strani relacije (51) znači da su vektori toplotnog toka i temperaturnog gradijenta usmjereni u suprotnim smjerovima.
Koeficijent proporcionalnosti λ u izrazu (51) je fizički parametar supstance, nazvan koeficijent toplotne provodljivosti. Karakterizira sposobnost tvari da provodi toplinu.
Dimenzija koeficijenta toplotne provodljivosti određuje se iz izraza (51):
Posljedično, vrijednost koeficijenta toplinske provodljivosti numerički je jednaka specifičnom protoku topline kroz zid jedinične debljine pri temperaturnoj razlici od 1 o C. Što je veći λ, to je tvar bolji provodnik topline.
Metali su dobri provodnici toplote; suvi, mirni vazduh je loš provodnik toplote. Lagani porozni materijali ne provode dobro toplinu, jer su im pore ispunjene zrakom. Materijali čija je toplotna provodljivost manja od 0,2 W/(m-deg) nazivaju se toplotnoizolacionim. Voda ima slabu toplotnu provodljivost, međutim, toplotna provodljivost mokrog materijala naglo raste u poređenju sa toplotnom provodljivošću u suvom stanju. To je zbog činjenice da voda provodi toplinu 20-25 puta bolje od zraka. Stoga, punjenje pora tijela vodom naglo smanjuje njegova svojstva toplinske izolacije.
Eksperimentalno se utvrđuje vrijednost koeficijenta toplinske provodljivosti λ za svako tijelo. Rezultati su sažeti u tabelama koje se koriste u proračunima.
Toplotna provodljivost zida
Ravni jednostruki zid. Na slici 6 prikazan je ravan jednoslojni zid debljine δ od homogenog materijala (cigla, metal, drvo ili bilo koji drugi).
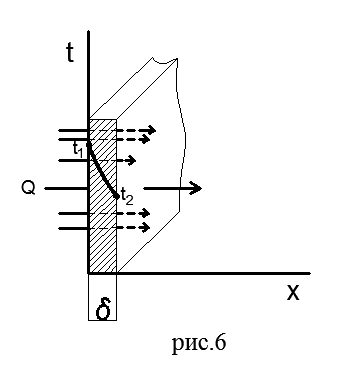 Pretpostavimo da koeficijent toplotne provodljivosti materijala λ ne zavisi od temperature. Na vanjskim površinama zida održavaju se stalne temperature t 1 >t 2; temperatura se mijenja samo u smjeru x ose, koja je okomita na ravan zida, tj. temperaturno polje je jednodimenzionalno, a temperaturni gradijent je jednak dt/dx.
Pretpostavimo da koeficijent toplotne provodljivosti materijala λ ne zavisi od temperature. Na vanjskim površinama zida održavaju se stalne temperature t 1 >t 2; temperatura se mijenja samo u smjeru x ose, koja je okomita na ravan zida, tj. temperaturno polje je jednodimenzionalno, a temperaturni gradijent je jednak dt/dx.
Nađimo gustinu toplotnog toka koji prolazi kroz dati zid i ustanovimo prirodu promjene temperature duž debljine zida.
Odaberimo unutar zida elementarni sloj debljine dx omeđen sa dvije izotermne površine. Fourierova jednadžba za ovaj sloj ima oblik
Nakon integracije
Iz ove jednačine se može odrediti gustina toplotnog toka koji prolazi kroz razmatrani zid. Stavljajući u jednačinu (53) x=δ, dobijamo t= t2, gdje
| | (54) |
Gustoća toplotnog toka u ravnom zidu direktno je proporcionalna koeficijentu toplotne provodljivosti λ, temperaturnoj razlici () i obrnuto proporcionalna debljini zida δ. Treba imati na umu da se protok toplote ne određuje apsolutnom vrednošću temperatura, već njihovom razlikom – temperaturnom razlikom.Jednačina (54) je formula za proračun toplotne provodljivosti ravnog zida. Povezuje četiri veličine q, λ, δ i :
Odnos debljine zida i koeficijenta toplotne provodljivosti δ/λ naziva se toplotni otpor zida.
Jednadžba (55) pokazuje da je specifični toplinski tok direktno proporcionalan temperaturnoj razlici i obrnuto proporcionalan toplinskom otporu zida. Zaista, što je veći nazivnik razlomka u jednačini (55), tj. δ/λ, to je niža gustina toplotnog toka q. Posljedično, s povećanjem debljine stijenke δ ili sa smanjenjem toplinske provodljivosti λ, gustina toplinskog toka q opada.
Odredivši gustinu toplotnog fluksa po formuli (54), možemo odrediti ukupnu količinu toplote Q u džulima koju je površina F prenijela kroz ravan zid za vrijeme τ:
Ova jednačina je jednačina prave linije. Dakle, pri konstantnoj vrijednosti koeficijenta toplinske provodljivosti, temperatura se linearno mijenja po debljini homogenog zida. U slučajevima kada toplinska provodljivost ovisi o temperaturi, ona je varijabla i formule za proračun su nešto složenije.
Lekcija #2/5 2
Tema br. 26: „Model strukture tečnosti. Zasićena i nezasićene pare. Vlažnost vazduha."
1 Model strukture fluida
Tečnost jedna od agregatna stanja supstance. Glavno svojstvo tekućine, koje je razlikuje od drugih agregatnih stanja, je sposobnost da neograničeno mijenja svoj oblik pod djelovanjem tangencijalnih mehaničkih naprezanja, čak i proizvoljno malih, uz praktično održavanje volumena.
Fig.1
Tečno stanje se obično smatra srednjim izmeđučvrsta i gasovita : gas ne zadržava ni zapreminu ni oblik, ali čvrsta materija zadržava oboje.
molekule tečnosti nemaju određen položaj, ali u isto vrijeme nemaju punu slobodu kretanja. Između njih postoji privlačnost, dovoljno jaka da ih drži blizu.
Supstanca u tečnom stanju postoji u određenom intervalu temperature , ispod kojeg ulazičvrsto stanje(dolazi do kristalizacije ili transformacija u amorfno stanje čvrstog stanja staklo), iznad u gasovito (dolazi do isparavanja). Granice ovog intervala zavise od pritisak.
Sve tečnosti se obično dele na čiste tečnosti i mješavine . Neke mješavine tečnosti su neophodne za život: krv, morska voda itd. Tečnosti mogu obavljati funkciju rastvarači.
Fluidnost je glavno svojstvo tečnosti. Ako primenite na deo fluida u ravnoteži spoljna sila , tada postoji tok čestica fluida u smjeru u kojem se primjenjuje ova sila: fluid teče. Dakle, pod djelovanjem neuravnoteženih vanjskih sila, tekućina ne zadržava oblik i relativni raspored dijelova, te stoga poprima oblik posude u kojoj se nalazi.
Za razliku od plastičnih čvrstih materija, tečnosti nemajugranica popuštanja: dovoljno je primijeniti proizvoljno malu vanjsku silu da tečnost prostruji.
Jedno od karakterističnih svojstava tečnosti je da ima određeni iznos ( sa nepromenjenim spoljni uslovi). Tečnost je izuzetno teško mehanički komprimovati jer, za razliku od gas , između molekula ima vrlo malo slobodan prostor. Pritisak koji se vrši na tečnost zatvorenu u posudi prenosi se bez promene na svaku tačku zapremine ove tečnosti ( Pascalov zakon , važi i za gasove). Ova karakteristika, zajedno sa vrlo niskom kompresibilnošću, koristi se u hidrauličnim mašinama.
Tečnosti obično povećavaju zapreminu (šire se) kada se zagreju i smanjuju zapreminu (skupljaju) kada se ohlade. Međutim, postoje izuzeci, npr. vode skuplja se kada se zagrije, pri normalnom pritisku i na temperaturama između 0°C i približno 4°C.
Pored toga, tečnosti (poput gasova) karakterišu viskozitet . Definiše se kao sposobnost odupiranja pomeranju jednog od delova u odnosu na drugi, odnosno kao unutrašnje trenje.
Kada se susedni slojevi tečnosti pomeraju jedan u odnosu na drugi, neizbežno dolazi do sudara molekula poredtermičko kretanje. Postoje sile koje usporavaju uređeno kretanje. U tom slučaju kinetička energija uređenog kretanja pretvara se u toplotnu energiju haotičnog kretanja molekula.
Tečnost u posudi, pokrenuta i prepuštena sama sebi, postepeno će prestati, ali će njena temperatura rasti.U pari, poput gasa, gotovo da se mogu zanemariti sile kohezije i kretanje smatrati slobodnim letenjem molekula i njihovim sudarom međusobno i sa okolnim tijelima (zidovi i tekućina koja prekriva dno posude). U tečnosti, molekuli, kao i u čvrstom stanju, snažno interaguju, držeći jedni druge. Međutim, dok u čvrstom tijelu svaki molekul zadržava neograničeno dugo određeni položaj ravnoteže unutar tijela i njegovo kretanje se svodi na oscilaciju oko tog ravnotežnog položaja, priroda kretanja u tekućini je drugačija. Molekuli tekućine kreću se mnogo slobodnije od čvrstih molekula, iako ne tako slobodno kao molekuli plina. Svaki molekul u tečnosti se kreće napred-nazad neko vreme, ne udaljujući se, međutim, od svojih suseda. Ovo kretanje podsjeća na oscilaciju čvrste molekule oko ravnotežnog položaja. Međutim, s vremena na vrijeme molekul tekućine izbije iz svog okruženja i premjesti se na drugo mjesto, padajući u novo okruženje, gdje opet neko vrijeme izvodi kretanje slično oscilaciji.
Dakle, kretanje tečnih molekula je nešto poput mješavine kretanja u čvrstom tijelu i u plinu: "oscilatorno" kretanje na jednom mjestu zamjenjuje se "slobodnim" prijelazom s jednog mjesta na drugo. U skladu s tim, struktura tekućine je nešto između strukture čvrstog tijela i strukture plina. Što je viša temperatura, tj. što je veća kinetička energija molekula tečnosti, to je veća uloga koju ima "slobodno" kretanje: kraći su intervali "oscilatornog" stanja molekula i češće "slobodno" kretanje. " prelaze, tj. što više tečnost liči na gas. Kad dosta visoke temperature karakteristična za svaku tečnost (tzv. kritična temperatura), svojstva tečnosti se ne razlikuju od svojstava visoko komprimovanog gasa.
2 Zasićene i nezasićene pare i njihova svojstva
Iznad slobodne površine tekućine uvijek se nalaze pare te tekućine. Ako posuda s tekućinom nije zatvorena, tada koncentracija čestica pare pri konstantnoj temperaturi može varirati u širokom rasponu u smjeru smanjenja i povećanja.
Proces isparavanja u zatvorenom prostoru(zatvorena posuda sa tečnošću)može se pojaviti na datoj temperaturi samo do određene granice. To je zbog činjenice da se kondenzacija pare događa istovremeno s isparavanjem tekućine. Prvo, broj molekula emitovanih iz tečnosti u 1 s, više broja molekuli se vraćaju nazad, a gustina, a time i pritisak pare, raste. To dovodi do povećanja stope kondenzacije. Nakon nekog vremena, dolazi do dinamičke ravnoteže, pri kojoj gustina pare nad tekućinom postaje konstantna.
Para koja je u dinamičkoj ravnoteži sa svojom tečnošću naziva se zasićena para. Para koja nije u dinamičkoj ravnoteži sa svojom tekućinom naziva se nezasićena.
Iskustvo pokazuje da se nezasićene pare pokoravaju svemu gasni zakoni , a što su tačnije, to su dalje od zasićenja.Za zasićene pare karakteristične su sljedeće osobine:
- gustina i pritisak zasićene pare na datoj temperaturi to su maksimalna gustina i pritisak koji para može imati na datoj temperaturi;
- gustina i pritisak zasićene pare zavise od vrste supstance. Što je niža specifična toplota isparavanja tečnosti, ona brže isparava i veći je pritisak i gustina njenih para;
- pritisak i gustina zasićene pare su jedinstveno određeni njenom temperaturom (ne zavise od toga kako je para dostigla ovu temperaturu: tokom zagrevanja ili tokom hlađenja);
- pritisak i gustina pare brzo rastu sa porastom temperature (slika 1, a, b).
Iskustvo pokazuje da kada se tečnost zagreje, nivo tečnosti u zatvorenoj posudi opada. Zbog toga se povećava masa i gustina pare. Jače povećanje pritiska zasićene pare u poređenju sa idealnim gasom (Gay-Lussacov zakon nije primenjiv na zasićenu paru) objašnjava se činjenicom da ovde pritisak raste ne samo zbog povećanja prosečne kinetičke energije molekula (kao u idealnom plinu), ali i zbog povećanja koncentracije molekula;
- pri konstantnoj temperaturi, pritisak i gustina zasićene pare ne zavise od zapremine. Slika 2 prikazuje za usporedbu izoterme idealnog plina (a) i zasićene pare (b).

Rice. 2
Iskustvo pokazuje da se tokom izotermnog širenja nivo tečnosti u posudi smanjuje; broj molekula pare se mijenja tako da gustina pare ostaje konstantna.
3 Vlažnost
Vazduh koji sadrži vodenu paru naziva se mokro . Za karakterizaciju sadržaja vodene pare u vazduhu uvodi se niz veličina: apsolutna vlažnost, pritisak vodene pare i relativna vlažnost.
apsolutna vlažnostρ zrakom se naziva vrijednost brojčano jednaka masi vodene pare sadržane u 1 m 3 vazduh (tj. gustina vodene pare u vazduhu pod datim uslovima).
Pritisak vodene pare str je parcijalni pritisak vodene pare sadržane u vazduhu. SI jedinice za apsolutnu vlagu i elastičnost su, respektivno, kilogram po kubnom metru (kg/m 3) i paskal (Pa).
Ako se zna samo apsolutna vlažnost ili pritisak vodene pare, još uvek je nemoguće proceniti koliko je vazduh suv ili vlažan. Za određivanje stepena vlažnosti vazduha potrebno je znati da li je vodena para blizu ili daleko od zasićenja.
relativna vlažnost zrak φ naziva se postotnim odnosom apsolutne vlažnosti i gustineρ 0 zasićena para na datoj temperaturi (ili omjeru pritiska vodene pare i pritiska p0 zasićena para na datoj temperaturi):
Što je relativna vlažnost niža, što je para dalje od zasićenja, to je intenzivnije isparavanje. Pritisak zasićene pare p0 na datoj tabličnoj vrijednosti temperature. Elastičnost vodene pare (a time i apsolutna vlažnost) određena je tačkom rose.
Sa izobaričnim hlađenjem do temperature tp para postaje zasićena i njeno stanje je predstavljeno tačkom AT . Temperatura t p na kojoj vodena para postaje zasićena naziva se tačka rose . Kada se ohladi ispod tačke rose, počinje kondenzacija pare: pojavljuje se magla, rosa pada, prozori se zamagljuju.
4 Merenje vlažnosti
Koristi se za merenje vlažnosti vazduha merni instrumenti higrometri. Postoji nekoliko vrsta higrometara, ali glavni su: kosa i psihrometrijski.
Pošto je teško direktno izmeriti pritisak vodene pare u vazduhu, meri se relativna vlažnost vazduha.na indirektan način.
Princip radahigrometar za kosuna osnovu svojstva odmašćene dlake (ljudske ili životinjske)promenite njegovu dužinuzavisno od vlažnosti vazduha u kome se nalazi.

Kosa razvučen preko metalnog okvira. Promjena dužine kose prenosi se na strelicu koja se kreće duž skale. Higrometar za kosu zimi je glavni instrument za mjerenje vanjske vlažnosti.
Precizniji higrometar je psihrometrijski higrometar psihrometar
(prema drugim grčkim "psychros" znači hladno).
Poznato je da je relativna vlažnost zavisi brzina isparavanja.
Što je niža vlažnost vazduha, to lakše isparava vlaga.

Psihrometar ima dva termometra . Jedan je običan, zove se suho. Mjeri temperaturu okolnog zraka. Tikvica drugog termometra je umotana u fitilj od tkanine i spuštena u posudu s vodom. Drugi termometar ne pokazuje temperaturu vazduha, već temperaturu mokrog fitilja, otuda i naziv navlaženo termometar. Što je niža vlažnost vazduha, to intenzivnije vlaga isparava iz fitilja, što se veća količina topline u jedinici vremena odvodi od navlaženog termometra, to su njegova očitanja manja, dakle, veća je razlika između očitavanja suhog i navlaženog termometra.
Tačka rose se određuje pomoću higrometara. Hidrometar kondenzacije je metalna kutija ALI , prednji zid To koji je dobro uglačan (slika 2) U kutiju se ulije tečni etar koji lako isparava i ubaci termometar. Propuštanje vazduha kroz kutiju pomoću gumene kruške G , izazivaju snažno isparavanje etra i brzo hlađenje kutije. Termometar mjeri temperaturu pri kojoj se kapljice rose pojavljuju na uglačanoj površini zida. To . Pritisak u području uz zid može se smatrati konstantnim, jer ovo područje komunicira s atmosferom, a smanjenje tlaka uslijed hlađenja kompenzira se povećanjem koncentracije pare. Pojava rose ukazuje da je vodena para postala zasićena. Poznavajući temperaturu vazduha i tačku rose, možete pronaći parcijalni pritisak vodene pare i relativnu vlažnost.
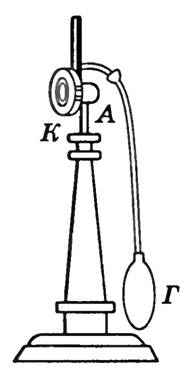
Rice. 2
5 zadataka za samostalno rješavanje
Zadatak 1
Napolju pada hladna jesenja kiša. U kom slučaju će se veš okačen u kuhinji brže sušiti: kada je prozor otvoren ili kada je zatvoren? Zašto?
Zadatak 2
Vlažnost vazduha je 78%, a očitavanje po suvom termometru je 12°C. Koju temperaturu pokazuje mokri termometar?(Odgovor: 10 °C.)
Zadatak 3
Razlika između očitavanja suhog i mokrog termometra je 4°C. Relativna vlažnost vazduha 60%. Koja su očitanja suhih i mokrih sijalica?(Odgovor: t c -l9 ° C, t m \u003d 10 ° C.)
Procesi isparavanja i kondenzacije su kontinuirani i međusobno paralelni.
U otvorenoj posudi količina tečnosti se vremenom smanjuje, jer. isparavanje prevladava nad kondenzacijom.
Para koja se nalazi iznad površine tečnosti kada isparavanje prevlada nad kondenzacijom, ili para u odsustvu tečnosti, naziva se nezasićeni.
U hermetički zatvorenoj posudi nivo tečnosti se ne menja tokom vremena, jer isparavanje i kondenzacija se međusobno nadoknađuju: koliko molekula izleti iz tekućine, koliko ih se u nju vrati u isto vrijeme, između pare i njene tekućine dolazi do dinamičke (pokretne) ravnoteže.
Para koja je u dinamičkoj ravnoteži sa svojom tečnošću naziva se zasićen.
Na datoj temperaturi, zasićena para tečnosti ima najveća gustina ( ) i stvara maksimalni pritisak ( ) koju para te tečnosti može imati na toj temperaturi.
Pritisak i gustina zasićene pare na istoj temperaturi zavise od vrste supstance: veći pritisak stvara zasićenu paru tečnosti koja brže isparava. Na primjer, i
Svojstva nezasićenih para: Nezasićene pare se pokoravaju gasnim zakonima Boylea - Mariotte, Gay-Lussac, Charles, a na njih se može primijeniti jednačina stanja idealnog plina.
Svojstva zasićene pare:1. Sa konstantnom zapreminom, sa povećanjem temperature, pritisak zasićene pare raste, ali ne u direktnoj proporciji (Charlesov zakon nije ispunjen), pritisak raste brže od pritiska idealnog gasa. , sa porastom temperature ( ) , masa pare se povećava, pa se stoga povećava koncentracija molekula pare () i pritisak zasićene pare će se otopiti iz dva razloga (
3 1 – nezasićena para ( idealan gas);
2 2 - zasićena para; 3 - nezasićena para,
1 dobijen iz zasićene pare u istom
zapremine pri zagrevanju.
2. Pritisak zasićene pare pri konstantnoj temperaturi ne zavisi od zapremine koju zauzima.
Sa povećanjem zapremine, masa pare se povećava, a masa tečnosti opada (deo tečnosti prelazi u paru), sa smanjenjem zapremine pare ona postaje manja, a tečnost postaje veća (deo pare prelazi u tečnost), gustina i koncentracija molekula zasićene pare ostaju konstantne, dakle, a pritisak ostaje konstantan ().
tečnost
(sat. para + tečnost)
Nezasićene pare
Zasićene pare ne poštuju Boyleove zakone o plinu - Mariotte, Gay-Lussac, Charles, jer masa pare u procesima ne ostaje konstantna, već sve gasni zakoni dobijeno za konstantnu masu. Jednačina stanja idealnog plina može se primijeniti na zasićenu paru.
dakle, zasićena para se može pretvoriti u nezasićenu paru, bilo zagrijavanjem na konstantan volumen ili povećanje njegovog volumena na konstantnoj temperaturi. Nezasićena para se može pretvoriti u zasićenu paru ili hlađenjem pri konstantnoj zapremini ili komprimovanjem na konstantnoj temperaturi.
Kritična situacija
Prisustvo slobodne površine u tečnosti omogućava da se naznači gde se nalazi tečna faza supstance, a gde gasovita. Oštra razlika između tečnosti i njene pare objašnjava se činjenicom da je gustina tečnosti mnogo puta veća od gustine pare. Ako se tekućina zagrijava u hermetički zatvorenoj posudi, tada će se zbog širenja njena gustoća smanjiti, a gustina pare iznad nje povećati. To znači da se razlika između tečnosti i njene zasićene pare izglađuje i potpuno nestaje na dovoljno visokoj temperaturi. Temperatura na kojoj se razlikuju fizička svojstva između tečnosti i njene zasićene pare, a njihove gustine postaju iste, naziva sekritična temperatura.
Za formiranje tečnosti iz gasa, prosečna potencijalna energija privlačenje molekula mora premašiti njihovu prosječnu kinetičku energiju.
Kritična temperatura – Maksimalna temperatura pri čemu se para pretvara u tečnost. Kritična temperatura ovisi o potencijalnoj energiji molekularne interakcije i stoga je različita za različite plinove. Zbog jake interakcije molekula vode, vodena para se može pretvoriti u vodu čak i na temperaturi od . Istovremeno, ukapljivanje azota se dešava samo na temperaturi nižoj od = -147˚, jer molekule dušika slabo međusobno djeluju.
Drugi makroskopski parametar koji utiče na prelaz para-tečnost je pritisak. S povećanjem vanjskog tlaka tijekom kompresije plina, prosječna udaljenost između čestica se smanjuje, sila privlačenja između njih se povećava i, shodno tome, prosječna potencijalna energija njihove interakcije.
Pritisakzasićena para na svojoj kritičnoj temperaturi naziva se kritičan. Ovo je najveći mogući pritisak pare zasićenja date supstance.
Stanje materije sa kritičnim parametrima se zove kritičan(kritična tačka) . Svaka supstanca ima svoju kritičnu temperaturu i pritisak.
AT kritično stanje specifična toplota isparavanja i koeficijent površinski napon tečnosti. Na temperaturama iznad kritičnih, čak i na vrlo visoki pritisci nemoguće je gas pretvoriti u tečnost, tj. iznad kritične temperature, tečnost ne može postojati. Na superkritičnim temperaturama moguće je samo stanje pare materije.
Ukapljivanje gasova je moguće samo na temperaturama ispod kritične temperature. Za ukapljivanje, plinovi se hlade do kritične temperature, na primjer, adijabatskom ekspanzijom, a zatim izotermno komprimiraju.
Kipuće
Spolja, fenomen izgleda ovako: iz cjelokupnog volumena tekućine, brzo rastući mjehurići se dižu na površinu, pucaju na površinu, a para se ispušta u okolinu.
MKT objašnjava ključanje ovako: u tečnosti uvek postoje mehurići vazduha u kojima dolazi do isparavanja iz tečnosti. Ispostavilo se da je zatvoreni volumen mjehurića ispunjen ne samo zrakom, već i zasićenom parom. Pritisak zasićene pare u njima kada se tečnost zagreje raste brže od pritiska vazduha. Kada pritisak zasićene pare u mjehurićima u dovoljno zagrijanoj tekućini postane veći od vanjskog tlaka, oni se povećavaju u volumenu, a sila uzgona, koja premašuje njihovu gravitaciju, podiže mjehuriće na površinu. Plutajući mjehurići počinju pucati kada, na određenoj temperaturi, pritisak zasićene pare u njima premaši pritisak iznad tečnosti. Temperatura tečnosti pri kojoj je pritisak njene zasićene pare u mjehurićima jednak ili veći od vanjskog pritiska tečnosti naziva se tačka ključanja.
Tačka ključanja različitih tečnosti je različita, jer pritisak zasićene pare u njihovim mehurićima se poredi sa istim spoljnim pritiskom na različitim temperaturama. Na primjer, pritisak pare zasićenja u mjehurićima jednak je normalnom atmosferskom pritisku za vodu na 100°C, za živu na 357°C, za alkohol na 78°C, za etar na 35°C.
Tačka ključanja ostaje konstantna tokom procesa ključanja, jer sva toplota koja se dovodi do zagrejane tečnosti troši se na isparavanje.
Tačka ključanja zavisi od spoljašnjeg pritiska na tečnost: sa povećanjem pritiska, temperatura raste; kako pritisak opada, temperatura se smanjuje. Na primjer, na nadmorskoj visini od 5 km, gdje je tlak 2 puta niži od atmosferskog, tačka ključanja vode je 83 ° C, u kotlovima parnih mašina, gdje je tlak pare 15 atm. (), temperatura vode je oko 200˚S.
Vlažnost vazduha
U vazduhu uvek ima vodene pare, pa se može govoriti o vlažnosti vazduha koju karakterišu sledeće vrednosti:
1.Apsolutna vlažnost je gustina vodene pare u vazduhu (ili pritisak koji ova para stvara ( .
Apsolutna vlažnost ne daje predstavu o stepenu zasićenosti vazduha vodenom parom. Ista količina vodene pare različita temperatura stvara drugačiji osjećaj vlage.
2.Relativna vlažnost je omjer gustine (pritiska) vodene pare sadržane u zraku na datoj temperaturi i gustine (pritiska) zasićene pare na istoj temperaturi : ili
je apsolutna vlažnost na datoj temperaturi; - gustina, pritisak zasićene pare na istoj temperaturi. Gustoća i pritisak zasićene vodene pare na bilo kojoj temperaturi može se naći u tabeli. Tabela pokazuje da što je temperatura vazduha viša, to mora biti veća gustina i pritisak vodene pare u vazduhu da bi on bio zasićen.
Znajući relativnu vlažnost, možete razumjeti koliko posto vodene pare u zraku na datoj temperaturi je daleko od zasićenja. Ako je para u zraku zasićena, onda . Ako a , tada u vazduhu nema dovoljno pare do stanja zasićenja.
O činjenici da para u vazduhu postaje zasićena, sudi se po pojavi vlage u vidu magle, rose. Temperatura na kojoj vodena para u zraku postaje zasićena naziva se tačka rose.
Para u vazduhu se može učiniti zasićenom dodavanjem pare usled dodatnog isparavanja tečnosti bez promene temperature vazduha, ili snižavanjem njene temperature sa količinom pare u vazduhu.
Normalna relativna vlažnost vazduha, najpovoljnija za čoveka, je 40 - 60%. Velika važnost ima poznavanje vlage u meteorologiji za vremensku prognozu. U tkanju, konditorskoj proizvodnji potrebna je određena vlažnost zraka za normalan tok procesa. Čuvanje umjetničkih djela i knjiga zahtijeva održavanje vlažnosti na potrebnom nivou.
Instrumenti za vlažnost:
1. Hidrometar kondenzacije (omogućava vam da odredite tačku rose).
2. Higrometar za kosu (na osnovu dužine kose bez masnoće u odnosu na vlažnost) mjeri relativnu vlažnost u procentima.
3. Psihrometar se sastoji od dva suva i mokra termometra. Vlažna sijalica je umotana u krpu umočenu u vodu. Zbog isparavanja iz tkanine, temperatura navlaženog je niža od temperature suvog. Razlika u očitanjima termometra ovisi o vlažnosti okolnog zraka: što je zrak suvlji, to je intenzivnije isparavanje iz tkanine, veća je razlika u očitanjima termometra i obrnuto. Ako je vlažnost vazduha 100%, onda su očitavanja termometara ista, tj. razlika u očitanjima je 0. Za određivanje vlažnosti pomoću psihrometra koristi se psihrometrijska tablica.
Topljenje i kristalizacija
Prilikom topljenja čvrsto telo rastojanje između čestica koje formiraju kristalnu rešetku se povećava, a sama rešetka je uništena. Proces topljenja zahtijeva energiju. Kada se čvrsto tijelo zagrije, povećava se kinetička energija vibrirajućih molekula i, shodno tome, amplituda njihovih oscilacija. Na određenoj temperaturi, tzv tačka topljenja, poremećen je red u rasporedu čestica u kristalima, kristali gube oblik. Supstanca se topi od čvrsto stanje u tečno stanje.
Tokom kristalizacije dolazi do konvergencije molekula koji formiraju kristalnu rešetku. Kristalizacija se može dogoditi samo kada tečnost oslobodi energiju. Kada se rastopljena tvar ohladi, prosječna kinetička energija i brzina molekula se smanjuju. Privlačne sile mogu zadržati čestice blizu ravnotežnog položaja. Na određenoj temperaturi, tzv temperatura očvršćavanja (kristalizacije), svi molekuli su u položaju stabilne ravnoteže, njihov raspored postaje uređen - formira se kristal.
Topljenje čvrste supstance se dešava na istoj temperaturi na kojoj se supstanca skrućuje.
Svaka supstanca ima svoju tačku topljenja. Na primjer, tačke topljenja za helijum su -269,6˚S, za živu -38,9˚S, za bakar 1083˚S.
Tokom procesa topljenja, temperatura ostaje konstantna. Količina topline koja se dovodi izvana ide na uništavanje kristalne rešetke.
Tokom procesa stvrdnjavanja, iako se toplina uklanja, temperatura se ne mijenja. Energija koja se oslobađa tokom kristalizacije koristi se za održavanje konstantne temperature.
Dok se sva supstanca ne otopi ili dok se sva supstanca ne očvrsne, tj. sve dok čvrsta i tečna faza supstance postoje zajedno, temperatura se ne menja.
TV+tečnost tekućina + tv
, gdje je - količina topline, - količina topline potrebna za otapanje tvari koja se oslobađa tijekom kristalizacije mase tvari
- specifična toplota fuzije– količina topline potrebna da se otopi 1 kg tvari na njenoj tački.
Kolika je količina toplote utrošena pri topljenju određene mase supstance, ista količina toplote se oslobađa prilikom kristalizacije ove mase.
Također se zove specifična toplota kristalizacija.
Na tački topljenja, unutrašnja energija supstance u tečnom stanju je veća unutrašnja energija iste mase materije u čvrstom stanju.
At veliki broj Kada se supstanca topi, njen volumen se povećava, a gustoća se smanjuje. Prilikom stvrdnjavanja, naprotiv, volumen se smanjuje, a gustoća se povećava. Na primjer, čvrsti kristali naftalena tonu u tekući naftalen.
Neke tvari, na primjer, bizmut, led, galijum, liveno gvožđe, itd., skupljaju se kada se otape, a šire kada se skrućuju. Ova odstupanja od opšte pravilo objašnjeno strukturnim karakteristikama kristalnih rešetki. Dakle, voda je gušća od leda, led pliva u vodi. Ekspanzija vode tokom smrzavanja dovodi do razaranja stijena.
Promena zapremine metala tokom topljenja i očvršćavanja je od suštinskog značaja u poslovanju livnice.
Iskustvo to pokazuje promjena vanjskog pritiska na solidan utiče na tačku topljenja supstance. Za one supstance koje se šire tokom topljenja, povećanje spoljašnjeg pritiska dovodi do povećanja tačke topljenja, jer. ometa proces topljenja. Ako se tvari stisnu tijekom topljenja, onda za njih povećanje vanjskog tlaka dovodi do smanjenja temperature topljenja, jer pomaže u procesu topljenja. Samo veoma veliko povećanje pritiska primetno menja tačku topljenja. Na primjer, da biste snizili tačku topljenja leda za 1˚C, pritisak se mora povećati za 130 atm. Tačka topljenja supstance je normalna atmosferski pritisak pozvao tačka topljenja supstance.






