Specifična entalpija pare. Velika enciklopedija nafte i gasa
Stranica 1
Gustina zasićene pare na istoj temperaturi oštro se razlikuju za različite tvari. Na sobnoj temperaturi, gustina zasićene pare vode je 13 mm, a gustina zasićene pare žive samo 0,005 mm.
Gustina zasićene pare u ravnoteži sa solidan, raste sa porastom temperature.
Gustoća zasićenih para proizvoda, ovisno o temperaturi, određuje se iz tabela.
Vrijednost gustine zasićene pare zavisi samo od temperature (tabela) i ne zavisi od zauzete zapremine.
Vrijednost gustine zasićene pare pri nadpritisku u separatoru od 0 7 kgf / szh2 preuzeta je iz tabela, dozvoljeni napon parnog prostora separatora je prosječan u okviru preporučenih vrijednosti. Usvojen je separator zapremine 0,7 m3, prečnika 600 mm kotlovnice Biysk - 1 kom.
Pritisak i gustina zasićene pare u pravcu ose x prema površini tečnosti se ne menjaju, dok se u beskonačno tankom slogu pare neposredno uz tečnost, broj molekula sve vreme smanjuje usled kondenzacije. . Da bi se nadoknadio ovaj gubitak, mora postojati molarno ili molekularno kretanje čestica pare u tečnost, međutim, oba su moguća samo ako postoji neka razlika u gustoći ili pritisku u pravcu x ose, ali nijedno od toga nije moguće.
Da li gustina zasićene pare zavisi od temperature.
Proces stvaranja pare iz tekuće ili čvrste faze naziva se isparavanje. Ako se para formira na suprotan način, tada se proces naziva kondenzacija.
Par se može posmatrati kao idealan gas ako je u uslovima nizak pritisak i visoke temperature. U skoro 99 slučajeva od 100, kada se koristi reč „para“, oni razumeju ili podrazumevaju vodenu paru, u svim ostalim slučajevima obično dolazi do pojašnjenja.
Postoje dvije vrste stanja pare hemijska jedinjenja, koji ne sadrži nečistoće:
- nezasićena para, tj. para koja još nije u dinamičkoj ravnoteži sa tečnošću. Ako je površina tečnosti nezasićena para, tada proces isparavanja prevladava nad procesom kondenzacije. Zato će se u ovom slučaju volumen tekućine u posudi postepeno smanjivati.
- zasićena para, tj. para koja je u dinamičkoj ravnoteži sa tečnošću, što jednostavno znači sledeće: nijedan od procesa - isparavanje ili kondenzacija - ne prevladava jedan nad drugim. Ako je zapremina fiksna i temperatura je ista u oba slučaja, neće biti zapremine u datoj posudi. više pare nego prvobitno. Ova ravnoteža može biti poremećena ako se para iznad tečnosti sabije uz pomoć klipa: kondenzacija će prevladati nad isparavanjem. Vrijedi zapamtiti da je ovaj proces privremena pojava i da će se nastaviti sve dok se ponovo ne uspostavi dinamička ravnoteža.
Vrijeme uspostavljanja dinamičke ravnoteže između pare i tekućine značajno ovisi o gustini pare, što je povezano s razlikom u silama međumolekulske interakcije.
Ovisnost promjene gustine, kao i drugih fizičkih karakteristika vodene pare (zasićene) od temperature, data je u tabeli:
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Izračunajte gustinu a) za kiseonik; b) azot; c) vazduhom sledećih gasova: bor-fluorida BF 3 i azot-oksida (V). |
| Rješenje |
M r (BF 3) = A r (B) + 3 × A r (F) = 11 + 3 × 19 = 11 + 57 = 68. D vazduh (BF 3) = M r (BF 3) / M r (vazduh) = 68/29 = 2,345; D O2 (BF 3) = M r (BF 3) / M r (O 2) = 68 / 32 = 0,875; D N2 (BF 3) = M r (BF 3) / M r (N 2) = 68 / 28 = 1. M r (N 2 O 5) = 2 × A r (N) + 5 × A r (O) = 2 × 14 + 5 × 16 = 28 + 80 = 108. D zrak (N 2 O 5) = M r (N 2 O 5) / M r (vazduh) = 108/29 = 3,724; D O2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (O 2) = 108 / 32 = 3,375; D N2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (N 2) = 108 / 28 = 3,857. |
| Odgovori | Gustine bor fluorida u vazduhu, kiseoniku i azotu su 2,345, 0,875 i 1, respektivno; gustine azotnog oksida (V) u vazduhu, kiseoniku i azotu su 3,724, 3,375 i 3,857, respektivno. |
PRIMJER 2
| Vježbajte | Izračunajte gustinu a) za kiseonik; b) azot; c) vazduhom sledeći gasovi: ugljen monoksid (IV) i bromovodonik HBr. |
| Rješenje | Da bi se izračunala relativna gustina jednog gasa od drugog, potrebno je podeliti relativnu molekulsku masu prvog gasa sa relativnom molekulskom masom drugog gasa. Relativna molekulska težina zraka uzima se jednakom 29 (uzimajući u obzir sadržaj dušika, kisika i drugih plinova u zraku). Treba napomenuti da se koncept "relativne molekularne težine zraka" koristi uvjetno, jer je zrak mješavina plinova. M r (HBr) = A r (H) + A r (Br) = 1 + 80 = 81. D zrak (HBr) = M r (HBr) / M r (vazduh) = 81 / 29 = 2,7931; D O2 (HBr) = M r (HBr) / M r (O 2) = 81 / 32 \u003d 2,5313; D N2 (HBr) = M r (HBr) / M r (N 2) = 81 / 28 = 2,8929. M r (O 2) = 2 × A r (O) = 2 × 16 = 32. M r (N 2) = 2 × A r (N) = 2 × 14 = 28. M r (CO 2) \u003d A r (C) + 2 × A r (O) = 12 + 2 × 16 = 12 + 32 = 44. D zrak (CO 2) = M r (CO 2) / M r (vazduh) = 44 / 29 = 1,5172; D O2 (CO 2) = M r (CO 2) / M r (O 2) = 44 / 32 = 1,375; D H2 (CO 2) = M r (CO 2) / M r (N 2) = 44 / 28 = 1,5714. |
| Odgovori | Gustine bromovodonika u vazduhu, kiseoniku i azotu su 2,7931, 2,5313 i 2,8929; gustine ugljen monoksida (IV) u vazduhu, kiseoniku i azotu su 1,5172, 1,375 i 1,5714, respektivno. |
Već smo primetili da kako temperatura raste, gustina zasićene pare raste (videti §6.3). Gustoća tekućine u ravnoteži sa svojom parom, naprotiv, opada zbog njenog širenja pri zagrijavanju.
U tabeli 2 prikazane su vrijednosti gustine vode i njene zasićene pare za različite temperature.
tabela 2
Ako na jednoj slici nacrtamo krivulje za zavisnost gustine tečnosti i njene zasićene pare od temperature, tada će za tečnost kriva pasti naniže, a za paru ići nagore (slika 6.6). Na kritičnoj temperaturi obje krive se spajaju, odnosno gustina tekućine postaje jednaka gustini pare. Nestaje razlika između tečnosti i pare.
Gas i para
Reči "gas" i "para" koristili smo mnogo puta. Ovi pojmovi su nastali u vrijeme kada se vjerovalo da se para može pretvoriti u tečnost, ali gas ne. Nakon što su svi gasovi kondenzovani (videti § 6.7), nema osnova za takvu dvojnu terminologiju. Para i plin su jedno te isto, nema suštinske razlike između njih. Kada ljudi govore o pari neke tečnosti, obično misle da je njena temperatura manja od kritične i da se kompresijom može pretvoriti u tečnost. Samo iz navike govorimo o vodenoj pari, a ne o vodenom gasu, o zasićenoj pari, a ne o zasićenom gasu, i tako dalje.
Eksperimentalno proučavanje kritičnog stanja
Eksperimente na proučavanju kritičnog stanja izveo je 1863. ruski naučnik MP Avenarius. Uređaj sa kojim se može posmatrati kritično stanje (Avenarius uređaj) sastoji se od vazdušne kupke (slika 6.7) i zatvorene staklene cevi (ampule) sa tečnim etrom u kadi. Zapremina ampule (njen kapacitet) jednaka je kritičnoj zapremini etra ulivenog u epruvetu. Prostor iznad etra u ampuli ispunjen je zasićenom parom etra.
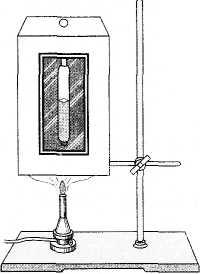
Uz pomoć plinskog plamenika ili drugog grijača, zračna kupka se zagrijava. Stanje etra se posmatra kroz stakleni prozor u uređaju.
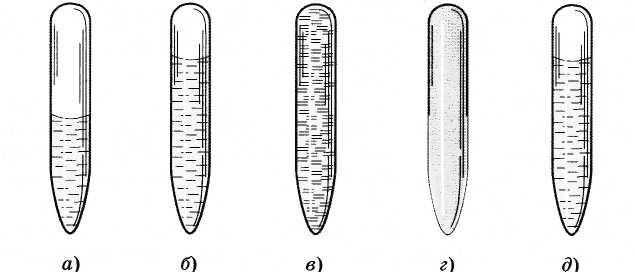
Na sobnoj temperaturi možete jasno vidjeti granicu između tekućine i pare (slika 6.8, a). Kako se kritična temperatura približava, zapremina tečnog etra se povećava, a granica tečnost-para postaje slabo izražena, nestabilna (slika 6.8, b).
Pri približavanju kritično stanje granica između njih potpuno nestaje (slika 6.8, in).
Kada se ohladi, pojavljuje se gusta magla koja ispunjava cijelu cijev (slika 6.8, G). Ovo su kapljice tečnosti. Zatim se spajaju i ponovo postoji granica između tečnosti i pare (slika 6.8, e).
Za eksperiment je odabran etar, jer ima relativno nizak kritični pritisak (oko 36 atm). Njegova kritična temperatura je takođe niska: 194 °C.
Ako komprimirate plin, održavajući njegovu temperaturu iznad kritične (vidi sliku 6.4, izoterma T3), i, kao i ranije, počnite sa veoma velikim zapreminama, onda će smanjenje zapremine dovesti do povećanja pritiska u skladu sa jednačinom stanja idealnog gasa. Međutim, ako je došlo do kondenzacije pare na temperaturi ispod kritične pri određenom tlaku, tada se formiranje tekućine u posudi neće primijetiti. Iznad kritične temperature, gas se ne može pretvoriti u tečnost ni pod kojim pritiskom.
Ovo je glavno značenje koncepta kritične temperature.






