Struktura molekula Struktura molekula
STRUKTURA MOLEKULA
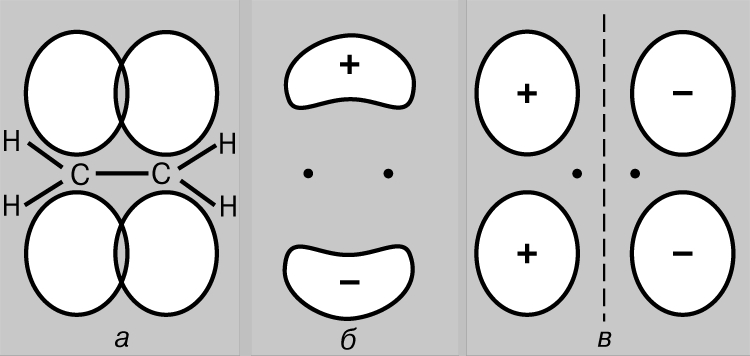
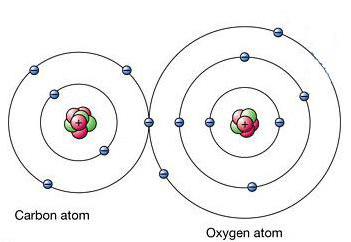
STRUKTURA MOLEKULA- (molekularna struktura), međusobni raspored atoma u molekulima. Tokom hemijske reakcije dolazi do preuređivanja atoma u molekulima reagensa i nastaju nova jedinjenja. Stoga je jedan od temeljnih kemijskih problema razjasniti raspored atoma u početnim spojevima i prirodu promjena u formiranju drugih spojeva iz njih. Prve ideje o strukturi molekula bile su zasnovane na analizi hemijskog ponašanja materije. Ove ideje su postale složenije kako se akumuliralo znanje o hemijskim svojstvima supstanci. Primena osnovnih zakona hemije omogućila je određivanje broja i vrste atoma koji čine molekul datog jedinjenja; ova informacija je sadržana u hemijskoj formuli. Vremenom su kemičari shvatili da jedna hemijska formula nije dovoljna da se precizno okarakteriše molekul, jer postoje molekuli izomera koji imaju iste hemijske formule, ali različita svojstva. Ova činjenica navela je naučnike na ideju da atomi u molekulu moraju imati određenu topologiju, stabilizovanu vezama između njih. Ovu ideju prvi je iznio 1858. njemački hemičar F. Kekule. Prema njegovim idejama, molekul se može prikazati pomoću strukturne formule, koja ukazuje ne samo na same atome, već i na veze između njih. Interatomske veze takođe moraju odgovarati prostornom rasporedu atoma. Faze u razvoju ideja o strukturi molekula metana prikazane su na Sl. 1. Struktura r odgovara savremenim podacima: molekul ima oblik pravilnog tetraedra, u čijem se središtu nalazi atom ugljika, a na vrhovima - atomi vodonika.
Rice. 1. ČETIRI METODE ZA SLIKU MOLEKULA METANA. A - hemijska formula. Navedeni su samo broj i vrsta atoma; b - strukturnu formulu; c - realna šema molekula; d - prostorni raspored atoma u molekulu.
Takve studije, međutim, nisu govorile ništa o veličini molekula. Ove informacije su postale dostupne tek razvojem odgovarajućih fizičkih metoda. Najvažnija od njih bila je difrakcija rendgenskih zraka. Od razbacanih slika x-zrake na kristalima je postalo moguće odrediti tačan položaj atoma u kristalu, a za molekularne kristale bilo je moguće lokalizirati atome u jednoj molekuli. Druge metode uključuju difrakciju elektrona dok prolaze kroz plinove ili pare i analizu rotacijskih spektra molekula. Sve ove informacije su samo opšta ideja o strukturi molekula. priroda hemijske veze omogućava vam istraživanje modernog kvantna teorija. I iako se molekularna struktura još ne može izračunati s dovoljno visokom preciznošću, svi poznati podaci o kemijskim vezama mogu se objasniti. Čak je i predviđeno postojanje novih vrsta hemijskih veza.
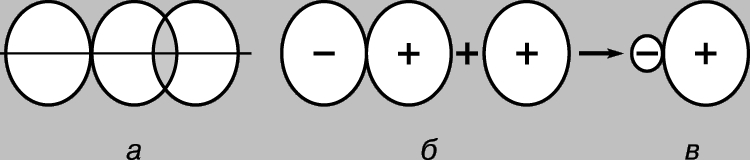
Jednostavna kovalentna veza. Molekul vodonika H 2 sastoji se od dva identična atoma. Prema fizička mjerenja dužina veze - rastojanje između jezgara atoma vodonika (protona) - je 0,70 (1 = 10-8 cm), što odgovara poluprečniku atoma vodonika u osnovnom stanju, tj. u najnižem energetskom stanju. Veza između atoma može se objasniti samo pretpostavkom da su njihovi elektroni lokalizirani uglavnom između jezgara, formirajući oblak negativno nabijenih vezivnih čestica i držeći pozitivno nabijene protone zajedno. Razmotrimo dva atoma vodika u osnovnom stanju, tj. stanje u kojem su njihovi elektroni na 1s orbitali. Svaki od ovih elektrona se može zamisliti kao talas, a orbitala kao stajaći talas. Kada se atomi približe jedan drugom, orbitale počinju da se preklapaju (slika 2), i, kao iu slučaju običnih talasa, dolazi do interferencije – superpozicije talasa (talasnih funkcija) u oblasti preklapanja. Ako su predznaci valnih funkcija suprotni, tada se valovi međusobno uništavaju tijekom interferencije (destruktivna interferencija), a ako su isti, onda se dodaju (konstruktivna interferencija). Kada se atomi vodika međusobno približavaju, moguća su dva ishoda u zavisnosti od toga da li su valne funkcije u fazi (slika 2a) ili u antifazi (slika 2b). U prvom slučaju će se pojaviti konstruktivna interferencija, u drugom - destruktivna, a pojavit će se dvije molekularne orbitale; jedan od njih karakteriše velika gustina u oblasti između jezgara (slika 2c), dok se drugi karakteriše niskom gustinom (slika 2d) - zapravo, čvor sa nultom amplitudom koji razdvaja jezgra.
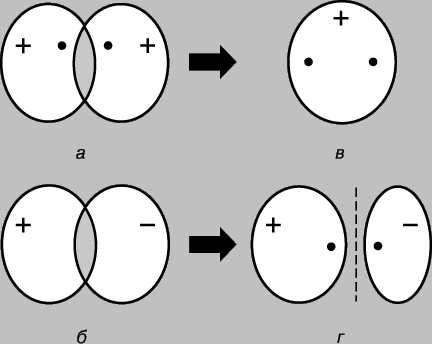
Rice. 2. REZULTATI PREKLAPANJA 1S ORBITALA ATOMA VODONIKA. a - faze valnih funkcija se poklapaju; uočava se konstruktivna interferencija, i kao rezultat se formira molekularna orbitala velike gustine u području između jezgara (c); b - faze valnih funkcija se ne poklapaju; dolazi do destruktivne interferencije, što rezultira formiranjem molekularne orbitale male gustoće između atoma (r).
Dakle, kada se atomi vodika približavaju i međusobno djeluju, 1s orbitale formiraju dvije molekularne orbitale, a dva elektrona moraju ispuniti jednu od njih. Elektroni u atomima uvijek nastoje zauzeti najstabilniji položaj – onaj u kojem je njihova energija minimalna. Za orbitalu prikazanu na sl. 2c, velika gustina je karakteristična u području između jezgara, a svaki elektron koji zauzima ovu orbitalu će većinu vremena biti blizu pozitivno nabijenih jezgara, tj. njegov potencijalna energijaće biti mali. Naprotiv, orbitala prikazana na Sl. 2d, maksimalna gustoća se javlja u područjima koja se nalaze lijevo i desno od jezgara, a energija elektrona u ovoj orbitali će biti visoka. Dakle, elektroni imaju manju energiju kada zauzmu orbitalu unutra, a ta energija je čak i manja od one koju bi imali da su atomi beskonačno udaljeni jedan od drugog. Pošto u ovom slučaju postoje samo dva elektrona, oba mogu zauzeti energetski povoljniju orbitu ako su im spinovi antiparalelni (Paulijev princip). Dakle, energija sistema koji se sastoji od dva atoma vodika opada kako se atomi približavaju jedan drugom, a da bi se potom atomi uklonili jedan od drugog potrebna je energija, jednak energiji formiranje stabilne molekule vodonika H2. Imajte na umu da je neophodan uslov za postojanje molekule vodika preferencijalna lokalizacija elektrona između jezgara u skladu sa onim što smo već rekli gore. Molekularna orbitala c naziva se orbitala vezivanja, a orbitala r se naziva orbitala labavljenja. Razmotrimo sada pristup dva atoma helijuma (atomski broj 2). I ovdje preklapanje 1s orbitala rezultira formiranjem dvije molekularne orbitale, od kojih jedna odgovara nižoj, a druga višoj energiji. Ovaj put, međutim, potrebno je postaviti 4 elektrona u orbitale, po 2 elektrona iz svakog atoma helija. Samo dva od njih mogu ispuniti niskoenergetsku veznu orbitalu, druga dva moraju zauzeti orbitalu visoke energije r. Smanjenje energije zbog povoljne lokalizacije prvog para približno je jednako povećanju energije uslijed nepovoljnog poziciju drugog para. Sada približavanje atoma ne daje dobit u energiji, a molekularni helij He2 se ne formira. Ovo se može zgodno ilustrovati dijagramom (slika 3); različite orbitale na njemu su predstavljene u obliku nivoi energije gde se mogu naći elektroni. Potonje su označene strelicama koje pokazuju gore i dolje kako bi se razlikovali smjerovi okretanja. Dva elektrona mogu zauzeti istu orbitalu samo ako su njihovi spinovi antiparalelni.
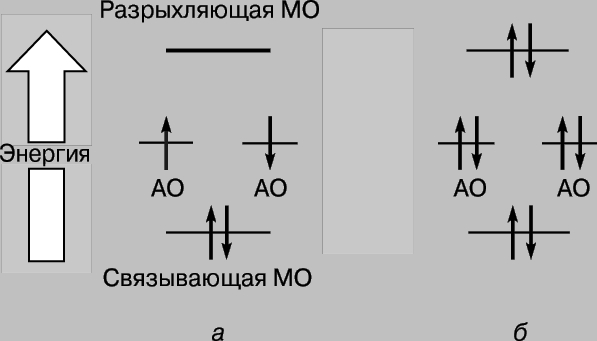
Rice. 3. PROMENE ENERGIJE ELEKTRONA tokom formiranja (a) molekula vodonika i (b) helijuma. Elektroni su prikazani strelicama usmjerenim gore i dolje kako bi se razlikovali njihovi spinovi. Niskoenergetske molekularne orbitale su vezne, dok su visokoenergetske molekularne orbitale antivezujuće.
Ovi opći principi su ispunjeni u formiranju molekula iz atoma. Čim se dva atoma približe tako blizu da se njihove atomske orbitale (AO) počnu preklapati, pojavljuju se dvije molekularne orbitale (MO): jedna se vezuje, druga labavi. Ako svaki od AO ima samo jedan elektron, oba mogu zauzeti vezni MO sa nižom energijom od AO i formirati hemijsku vezu. Veze ovog tipa, koje se danas nazivaju kovalentne, odavno su poznate kemičarima (ideja o kovalentnoj vezi bila je osnova oktetne teorije veze koju je formulirao američki fizikalni hemičar G. Lewis 1916. godine). Njihovo formiranje objašnjeno je socijalizacijom para elektrona međusobnom interakcijom atoma. Prema modernim konceptima, snaga veze zavisi od stepena preklapanja odgovarajućih orbitala. Sve navedeno sugerira da se veze između atoma mogu formirati tokom socijalizacije ne samo dva, već i jednog ili tri elektrona. Međutim, one će biti slabije od konvencionalnih kovalentnih veza iz sljedećih razloga. Kada se formira jednoelektronska veza, energija samo jednog elektrona opada, a u slučaju stvaranja veze kao rezultat socijalizacije tri elektrona, energija dva od njih opada, dok trećeg, naprotiv, raste, kompenzujući smanjenje energije jednog od prva dva elektrona. Kao rezultat toga, nastala veza od tri elektrona je dvostruko slabija od uobičajene kovalentne veze. Socijalizacija jednog i tri elektrona se dešava tokom formiranja molekularni ion molekule vodonika H 2+ i HHe. Općenito, veze ovog tipa su rijetke, a odgovarajući molekuli su visoko reaktivni.
Valence. Donatorsko-akceptorske veze. Sve gore navedeno pretpostavlja da atomi mogu formirati onoliko kovalentnih veza koliko ima orbitala koje zauzima jedan elektron, ali to nije uvijek slučaj. (U prihvaćenoj šemi AO punjenja prvo navedite broj ljuske, zatim tip orbitale, a zatim, ako ima više od jednog elektrona u orbitali, njihov broj (superscript). Dakle, oznaka (2s) 2 znači da s-orbitala druge ljuske sadrži dva elektrona.) Atom ugljika u osnovnom stanju (3P) ima elektronsku konfiguraciju (1s) 2 (2s) 2 (2px)(2py), dok dvije orbitale nisu popunjene , tj. sadrže jedan elektron. Međutim, dvovalentna jedinjenja ugljika su vrlo rijetka i imaju visoku kemijsku aktivnost. Ugljik je obično četverovalentan, a to je zbog činjenice da je potrebno vrlo malo energije da se pređe u pobuđeno 5S stanje (1s) 2 (2s) (2px)(2py)(2pz) sa četiri prazne orbitale. Troškovi energije povezani s prijelazom 2s elektrona na slobodnu 2p orbitalu su više nego nadoknađeni energijom koja se oslobađa tokom formiranja dvije dodatne veze. Za formiranje nepopunjenih AO potrebno je da ovaj proces bude energetski povoljan. Atom dušika s elektronskom konfiguracijom (1s) 2 (2s)2(2px)(2py)(2pz) ne formira petovalentna jedinjenja, jer je energija potrebna za prijenos 2s elektrona na 3d orbitalu da bi se formirala petovalentna konfiguracija (1s ) 2 (2s )(2px)(2py)(2pz)(3d) je prevelik. Slično, atomi bora sa uobičajenom konfiguracijom (1s) 2 (2s)2(2p) mogu formirati trovalentna jedinjenja u (1s) 2 (2s)(2px)(2py) pobuđenom stanju, što se dešava kada 2s elektron pređe na 2p -AO, ali ne formira petovalentna jedinjenja, budući da prelazak u pobuđeno stanje (1s)(2s)(2px)(2py)(2pz), zbog prelaska jednog od 1s-elektrona u više visoki nivo, zahtijeva previše energije. Interakcija atoma sa stvaranjem veze između njih događa se samo u prisustvu orbitala sa bliskim energijama, tj. orbitale sa istim glavnim kvantnim brojem. Relevantni podaci za prvih 10 elemenata periodnog sistema su sažeti u nastavku. Valentno stanje atoma je stanje u kojem formira hemijske veze, kao što je 5S stanje za četvorovalentni ugljenik.
Ovi uzorci su prikazani u sljedećim primjerima:
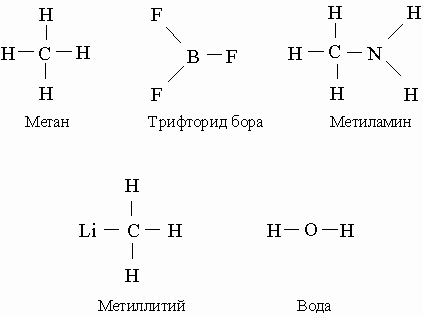
Sve navedeno vrijedi samo za neutralne atome. Joni i odgovarajući atomi imaju različite brojeve elektrona; joni mogu imati istu valenciju kao i drugi atomi sa istim brojem elektrona. Dakle, ioni N + i B imaju isti broj elektrona (šest) kao neutralni atom ugljika, te su, prema tome, četverovalentni. Amonijum joni NH 4 + i bor hidrid BH 4 - formiraju kompleksne soli iu svojim elektronska konfiguracija slično metanu CH 4 . Pretpostavimo sada da se molekuli amonijaka NH 3 i bor trifluorida BF 3 približavaju jedni drugima. Kada elektron prijeđe s atoma dušika na atom bora, dobijamo dva jona, NH 3 + i BF 3 -, svaki sa praznom orbitalom, što može dovesti do stvaranja kovalentne veze. Molekul H 3 N-BF 3 je elektronski analog 1,1,1-trifluoroetana H 3 C-CF 3 . Veze nastale kao rezultat interatomskog prijenosa elektrona nakon čega slijedi formiranje kovalentne veze nazivaju se donor-akceptorske veze.
Geometrija molekula. Hibridizacija. Sve atomske orbitale, osim s, sferno su asimetrične, a stepen njihovog preklapanja sa AO drugih atoma zavisi od međusobne orijentacije orbitala. Dakle, p-AO će se preklapati sa AO drugog atoma u većina, ako se potonji nalazi duž svoje ose (slika 4a). To znači da veze nastale kao rezultat AO preklapanja moraju imati specifičnu geometriju. Zamislite atom ugljika u 5S stanju. Ima po jedan elektron u tri p-orbitale i u četvrtoj, sferno simetričnoj s-orbitali. Čini se da će se tri veze koje on formira razlikovati od četvrte, dok će p-veze biti locirane u međusobno okomitim smjerovima duž p-AO osi. Zapravo, postoji još jedna, potpuno simetrična slika. Najlakši način da se to objasni je kako slijedi. Skup orbitala (2s)+(2px)+(2py)+(2pz) je određena količina "orbitalnog prostora" sposobnog da zadrži četiri para elektrona. Ekvivalentan opis ove situacije možemo dobiti tako što pomiješamo sve orbitale i podijelimo njihov zbir na četiri jednaka dijela, tako da će svaka od rezultirajućih mješovitih ili hibridnih orbitala imati jedan par elektrona. Stoga se 5S stanje ugljika može predstaviti kao (1s)2(t 1)(t 2)(t 3)(t 4), gdje su t i hibridne orbitale, što uspješno objašnjava formiranje simetrične četverovalentne molekule ugljika. Hajde da sada razmotrimo šta se dešava kada se p-AO pomeša sa s-AO. Jačanje jedne polovine p-bučice tokom interferencije će uvek biti praćeno slabljenjem njene druge polovine (slika 4b), što rezultira formiranjem asimetrične hibridne orbitale (slika 4c). On će se efektivno preklapati sa drugim orbitalama orijentisanim u istom pravcu, uz formiranje dovoljno jakih veza. Ovo je jedan od razloga zašto atom ugljika radije stvara veze putem AO hibridizacije. Ali postoji još jedan razlog. Zamislite tipično četverovalentno jedinjenje ugljika, kao što je metan CH 4 . U njemu se svaki atom vodika drži blizu atoma ugljika pomoću para zajedničkih elektrona. Ovi parovi se međusobno odbijaju, a optimalna konfiguracija molekula je takva da su na maksimalnoj mogućoj udaljenosti jedan od drugog. U ovom slučaju, atomi vodika će se nalaziti na vrhovima pravilnog tetraedra, a atom ugljika će biti u njegovom centru. Takva geometrija se može realizovati korišćenjem tzv. sp 3 hibridne orbitale, od kojih je svaka formirana od 1/4 2s-AO i jedne od 2p-AO. Sve ove orbitale su identičnog oblika, lako formiraju veze i usmjerene su od atoma ugljika u središtu pravilnog tetraedra do njegova četiri vrha (slika 1d).
Rice. 4. PREklapanje p ORBITALE SA ORBITALOM DRUGOG ATOMA je najefikasnije kada je ova druga orijentisana duž iste ose (a). Preklapanje atomske p-orbitale sa s-orbitalom (b) dovodi do formiranja asimetrične "bučice" (c).
Atom dušika mogao bi formirati veze samo uz pomoć 2p-AO, uglovi između kojih bi bili 90°, ali je međusobno odbijanje parova veznih elektrona i parova nevezujućih elektrona 2. ljuske minimizirano ako je "tetraedar" sp3 orbitale učestvuju u formiranju veza. Ovdje se, međutim, pojavljuje još jedna karakteristika. Za N+ jon, konfiguracije (1s)2(2s)(2p)3 i (1s)2(t) 4 , gdje su t sp 3 hibridni AO, su zaista ekvivalentne. Druga stvar je neutralni atom dušika čiji 7. elektron može zauzeti ili 2s-AO, i tada će se dobiti konfiguracija (1s)2(2s)(2p) 4, ili t-AO u konfiguraciji (1s )2(t) 5 . Budući da se 2s-AO nalazi ispod 2p-AO i stoga ispod bilo koje sp-hibridizirane orbitale, prva konfiguracija je energetski povoljnija i očekivalo bi se da bi, pod jednakim ostalim stvarima, trovalentni dušik preferirao "nehibridiziranu" konfiguraciju. Međutim, međusobno odbijanje elektronskih parova očigledno je dovoljno da dođe do hibridizacije, u kojoj su uglovi veze u takvom azotnom spoju kao što je amonijak NH3 bliski odgovarajućim uglovima u pravilnom tetraedru, tj. do 109°. Isto važi i za dvovalentni kiseonik u sastavu molekule vode H 2 O. U svim ovim slučajevima, vezani atomi zauzimaju tri (ili dva) vrha tetraedra, a parovi usamljenih elektrona 2. ljuske zauzimaju preostale vrhove . Slično razmišljanje se odnosi i na druge tipične elemente grupa IV, V i VI periodnog sistema. Četverovalentni elementi grupe IV (Si, Ge, Sn i Pb) uvijek formiraju tetraedarske strukture, međutim, ostali elementi grupa V i VI (P, S, As, Se, Sb, Te) se razlikuju od dušika i kisika i formiraju jedinjenja sa veznim uglovima, blizu 90°. Očigledno zbog veća veličina ovi atomi međusobnog odbijanja valentnih elektrona nije dovoljno da omogući hibridizaciju uočenu za N i O.
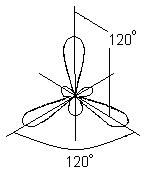
Veze koje uključuju d-orbitale. Za razliku od dušika, atom fosfora može formirati pet kovalentnih veza. U osnovnom stanju, fosfor ima konfiguraciju (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)(3p z) i trovalentan je, formirajući, poput dušika, jedinjenja PF-a 3 tip. Međutim, u ovom slučaju je moguće učešće 3s elektrona u formiranju veza, jer d-AO (3d) imaju isti princip kvantni broj. Zaista, poznata su i jedinjenja petovalentnog fosfora tipa PF 5, gde je fosfor u valentnom stanju +5, u skladu sa elektronskom konfiguracijom (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)( 3p y)(3p z )(3d); veze u ovom slučaju nastaju kao rezultat sp 3 d-hibridizacije (tj. kao rezultat miješanja jednog s-, tri p- i jednog d-AO). Trokutasta bipiramida je optimalna struktura sa stanovišta smanjenja međusobnog odbijanja parova valentnih elektrona (slika 5a). Sumpor može biti ne samo dvovalentan, već i tetra- (SF4) i heksavalentan (SF 6), a nalazi se u stanjima (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)( 3p z)(3d) i (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)(3p y)(3p z)(3d 1)(3d 2), respektivno. U jedinjenjima četverovalentnog sumpora, međusobno odbijanje elektrona 3. ljuske optimizirano je hibridizacijom orbitala svih njenih elektrona. Struktura jedinjenja ovog tipa je slična onoj kod PF 5, ali jedan od vrhova trouglaste bipiramide zauzima par usamljenih elektrona 3. ljuske (slika 5b). U heksavalentnim jedinjenjima sumpora, međusobno odbijanje elektrona je minimizirano tokom sp 3 d 2 hibridizacije, kada su sve orbitale ekvivalentne i usmjerene prema vrhovima pravilnog oktaedra (slika 5c).
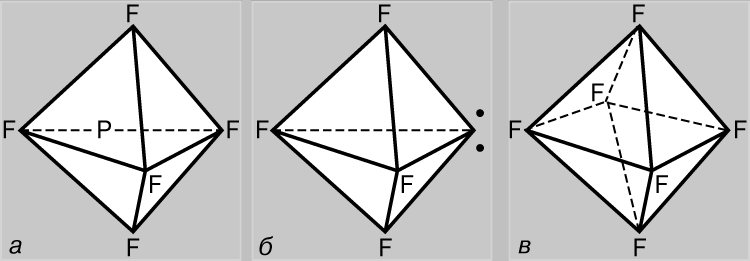
Rice. 5. FOSFOR PENTAFLUORID (a) nastaje uz učešće 3s elektrona. Molekul sumpornog tetrafluorida (b) ima sličan oblik, ali jedan od vrhova trouglaste bipiramide zauzima par nepodijeljenih elektrona 3. ljuske (tačke). U sumpor heksafluoridu (c), sve orbitale su ekvivalentne i usmjerene na vrhove pravilnog oktaedra.
Do sada smo razmatrali samo one elemente periodnog sistema u kojima su ljuske sa d-orbitalama ili potpuno popunjene ili potpuno slobodne. Zadržimo se sada na prijelaznim elementima u kojima ove ljuske nisu u potpunosti ispunjene. Energija elektrona u različitim orbitalama 3. ljuske raste sljedećim redoslijedom: 3s
Višestruke veze. Jedno od poznatih jedinjenja ugljika je etilen C2H4, u kojem je svaki atom ugljika vezan za samo tri druga atoma. Po analogiji s borom, može se pretpostaviti da će takva geometrija biti optimalna, u kojoj sp 2 hibridne orbitale leže u istoj ravni. U ovom slučaju, svaki atom ugljika će imati jednu neiskorištenu (u sp 2 hibridizaciji) p-orbitalu, koja sadrži jedan od četiri valentna elektrona. Ako svih šest atoma etilena leže u istoj ravni, tada se dva neiskorištena p-AO preklapaju jedan s drugim kao što je prikazano na slici. 6, a. Ovo preklapanje dovodi do formiranja para MO: jednog vezivanja (slika 6b) i jednog labavog MO (slika 6c). Pošto svaki od njih sadrži samo jedan elektron, oni mogu formirati niskoenergetski vezni MO. Tako nastaje dodatna veza između atoma ugljika, a strukturna formula etilena ima oblik
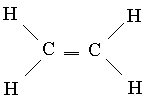
Ovaj novi tip veze razlikuje se od onih formiranih preklapanjem orbitala duž linije veze atoma u dva aspekta. Linkovi poslednjeg tipa, pojedinačni C-C konekcije, su aksijalno simetrične, te stoga na njih ne utiče rotacija grupa koje povezuju. Nasuprot tome, preklapanje p-orbitala zavisi od toga da li svih šest atoma u molekulu etilena leži u istoj ravni, budući da p-AO moraju biti paralelni za optimalno preklapanje. Dakle, ako se rotacija oko jedne C-C veze može odvijati relativno slobodno, onda je oko C=C dvostruke veze to vrlo teško. Zaista, molekul etilena je kruta ravna struktura. Druga razlika se tiče stepena orbitalnog preklapanja. Unakrsno preklapanje p-AO je relativno neefikasno, pa je stoga ova vrsta vezivanja slaba. Stoga je etilen reaktivniji od zasićenih spojeva koji imaju samo jednostruke veze.
Rice. 6. AKO SVIH ŠEST ATOMA ETILENA leže u istoj ravni, onda dva neiskorištena atomske p-orbitale učestvuju u poprečnom preklapanju (a). To dovodi do formiranja para molekularnih orbitala - vezivanje (b) i labavljenje (c).
Veze nastale kada se orbitale preklapaju duž linije veze atoma (uzdužno preklapanje) nazivaju se s-vezama, a kada se poprečno preklapaju - p-vezama. Molekuli nekih jedinjenja, kao što je C 2 H 2 acetilen, sadrže trostruke veze. U njima je svaki atom ugljika povezan sa svojim susjedom s-vezama koje formiraju sp-hibridne orbitale. Oni su kolinearni, tako da četiri atoma u molekulu acetilena leže na istoj pravoj liniji. Preostali p-AO atoma ugljika, kada se preklapaju, formiraju dvije p-veze.
aromatična jedinjenja. Molekul benzena C6H6 je predstavljen kao šestočlani prsten atoma ugljika, od kojih svaki ima vezan atom vodonika (slika 7a). Budući da svaki atom ugljika ima tri susjeda, može se pretpostaviti da su odgovarajuće veze nastale kao rezultat sp 2 hibridizacije i da leže u istoj ravni pod uglom od 120° jedna prema drugoj. Zaista, molekula benzena je ravna struktura. Neiskorišteni p-AO atoma ugljika mogu formirati p-veze (slika 7b), ali za benzen je situacija složenija nego u gore navedenim slučajevima kada su veze nastale kao rezultat preklapanja AO parova. U benzenu, 2p-AO svakog atoma ugljika mora se podjednako efikasno preklapati sa 2p-AO svih susjednih atoma. (Ovdje možemo povući analogiju s interferencijom višestrukih valova upoređujući preklapanje orbitala u molekuli benzena sa preklapanjem valova difrakiranih na dva proreza ili na difrakcijskoj rešetki.) Kao rezultat, za benzen dobijamo skup prstenastih molekula orbitale koje pokrivaju svih šest atoma ugljika (slika 7, V). ukupna energija sistemi sa takvom elektronskom konfiguracijom su manji nego ako p-AO formiraju obične p-veze u parovima. Zaista, benzen je stabilniji i manje aktivan nego što bi se moglo očekivati na osnovu njegove "klasične" strukture (slika 7d). Sve veze u njegovoj molekuli su simetrične, a njihove dužine su iste, a po jačini zauzimaju međupoziciju između jednostruke i dvostruke veze. Poznata su i druga jedinjenja u kojima p-elektroni učestvuju u formiranju "višecentričnih" MO i za koje slične karakteristike dužina veza i hemijska aktivnost.
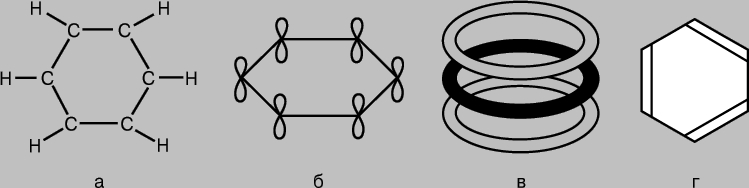
Rice. 7. MOLEKULA BENZENA C 6 H 6 je šestočlani prsten atoma ugljenika, od kojih je svaki povezan sa atomom vodonika (a). "Ekstra" p-orbitale atoma ugljika se preklapaju sa formiranjem p-veza (b), što rezultira skupom prstenastih molekularnih orbitala koje pokrivaju svih šest atoma (c). Kao rezultat toga, benzen je stabilniji i manje aktivan spoj nego što bi se moglo očekivati od njegove "klasične" strukture (d).
Jedinjenja koja sadrže multicentrične veze. Čak i u tako jednostavnim molekulima kao što je CH4, pojedinačne molekularne orbitale nužno interaguju jedna s drugom. Stoga se ideja o lokaliziranim dvocentralnim kovalentnim vezama može smatrati samo aproksimacijom. Međutim, po pravilu su ove interakcije slabe, jer je stepen orbitalnog preklapanja mali (sa izuzetkom p-MO u aromatičnim i srodnim jedinjenjima). Ipak, ne može se isključiti postojanje molekula sa višestruko preklapajućim AO odgovornim za formiranje veza kroz dijeljenje elektrona sa tri ili više atoma. Primjer je diboran B 2 H 6 , koji ima šest parova valentnih elektrona; ovo nije dovoljno za formiranje sedam veza potrebnih za stvaranje klasične strukture H3B-BH3. H. Longe-Higgins je predložio strukturu diborana, prikazanu na sl. 8, a. U ovoj strukturi, centralni atomi vodika povezani su vezama od tri centra koje nastaju kao rezultat preklapanja sp3 hibridnih orbitala dva atoma bora sa 1s-AO atoma vodika (slika 8b). Četiri od šest parova valentnih elektrona uključena su u formiranje običnih s-veza sa "terminalnim" atomima vodika, a dva para - veza sa tri centra. Složeniji primjer multicentrične veze pruža molekula dibenzenkroma (slika 8c). Benzinski prstenovi u ovoj molekuli povezani su s atomom metala pomoću složenih multicentričnih orbitala, koje nastaju kao rezultat preklapanja p-MO benzena sa 3d-, 4s- i 4p-AO centralnog atoma. Poznata su i druga slična jedinjenja koja imaju sendvič strukturu.
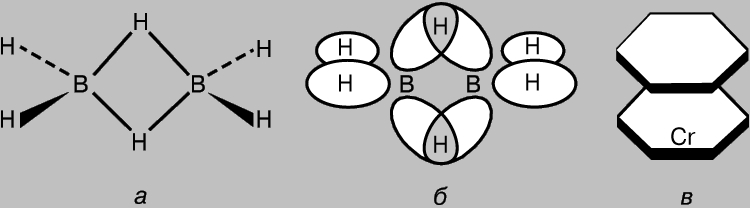
Rice. 8. U DIBORANE-u (a), atomi vodonika su povezani vezama od tri centra koje nastaju kao rezultat preklapanja sp3 hibridnih orbitala dva atoma bora sa 1s atomskom orbitalom vodonika (b). Složeniji primjer formiranja veza ovog tipa je molekula dibenzenkroma (c).
izgledi. Do danas se opći principi strukture molekula mogu smatrati uspostavljenim. Razvijene su fizikalno-hemijske metode za određivanje strukture složenih molekula, uključujući i biološke. U bliskoj budućnosti napredak je moguć u dva povezana pravca. Treba očekivati, prvo, povećanje tačnosti kvantnomehaničkih proračuna i, drugo, poboljšanje eksperimentalne metode mjerenja odgovarajućih molekularnih parametara.
LITERATURA
Kondratiev V.N. Struktura atoma i molekula. M., 1959 Coulson C. Valence. M., 1965. Slater J. Elektronska struktura molekule. M., 1965. Cartmell E., Fouls G. Valencija i struktura molekula. M., 1979
Ugljen monoksid, poznat i kao ugljen monoksid, ima veoma jak molekularni sastav, inertan je u svom hemijska svojstva i slabo je rastvorljiv u vodi. Ovo jedinjenje je takođe neverovatno otrovno; kada uđe u respiratorni sistem, spaja se sa hemoglobinom u krvi i prestaje da prenosi kiseonik do tkiva i organa.
Hemijska imena i formule
Ugljen monoksid je poznat i pod drugim imenima, uključujući ugljen monoksid II. U svakodnevnom životu se obično naziva ugljen monoksid. Ovaj ugljen monoksid je otrovan gas bez boje, ukusa i mirisa. Njegova hemijska formula je CO, a masa jednog molekula je 28,01 g/mol.

Uticaj na tijelo
Ugljični monoksid se spaja s hemoglobinom i formira karboksihemoglobin, koji nema kapacitet za nošenje kisika. Udisanje njegovih para uzrokuje oštećenje centralnog nervnog sistema (centralni nervni sistem) i gušenje. Nastali nedostatak kisika uzrokuje glavobolju, vrtoglavicu, smanjen broj otkucaja srca i disanja, što dovodi do nesvjestice i kasnije smrti tijela.

Toksičan gas
Ugljični monoksid nastaje djelomičnim sagorijevanjem tvari koje sadrže ugljik, na primjer u motorima unutrašnjim sagorevanjem. Jedinjenje sadrži 1 atom ugljika kovalentno vezan za 1 atom kisika. Ugljični monoksid je vrlo toksičan i jedan je od najčešćih uzroka trovanja sa smrtnim ishodom u svijetu. Izlaganje može uzrokovati oštećenje srca i drugih organa.
Koje su prednosti ugljičnog monoksida?
Unatoč ozbiljnoj toksičnosti, ugljični monoksid je izuzetno koristan - zahvaljujući modernim tehnologijama, iz njega se stvara niz vitalnih proizvoda. Ugljični monoksid, iako se danas smatra zagađivačem, uvijek je bio prisutan u prirodi, ali ne u količinama kao što je, na primjer, ugljični dioksid.
Varaju se oni koji vjeruju da spoj ugljični monoksid ne postoji u prirodi. CO se rastvara u rastopljenom vulkanskom kamenu pod visokim pritiscima u Zemljinom omotaču. Sadržaj ugljičnih oksida u vulkanskim plinovima varira od manje od 0,01% do 2%, ovisno o vulkanu. Budući da prirodno stanje ovog spoja nije konstantna vrijednost, nije moguće precizno izmjeriti emisije prirodnog plina.

Hemijska svojstva
Ugljični monoksid (formula CO) odnosi se na okside koji ne stvaraju soli ili indiferentne okside. Međutim, na temperaturi od +200 o S reaguje sa natrijum hidroksidom. Tokom toga dolazi do stvaranja natrijum formata:
NaOH + CO = HCOONa (sol mravlje kiseline).
Svojstva ugljičnog monoksida temelje se na njegovoj redukcijskoj sposobnosti. Ugljen monoksid:
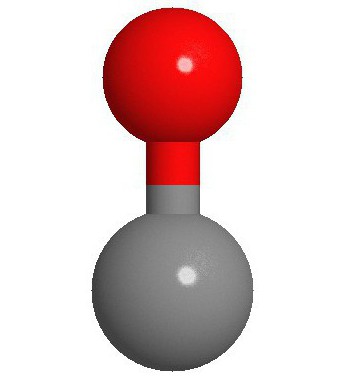
Struktura molekula
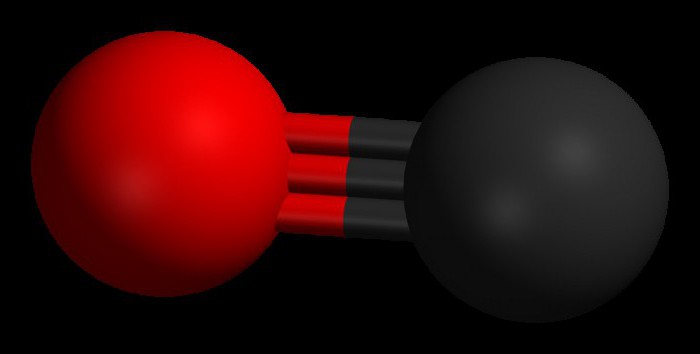
Dva atoma koji čine molekul ugljičnog monoksida (CO) povezana su trostrukom vezom. Dva od njih nastaju fuzijom p-elektrona atoma ugljika s kisikom, a treći nastaje zbog posebnog mehanizma zbog slobodne 2p orbitale ugljika i 2p elektronskog para kisika. Ova struktura daje molekulu visoku čvrstoću.
Malo istorije
Još Aristotela iz antičke grčke opisao otrovne pare proizvedene sagorevanjem uglja. Mehanizam same smrti nije bio poznat. Međutim, jedna od drevnih metoda pogubljenja bila je zaključavanje počinitelja u parnoj sobi, gdje je bio tinjajući ugalj. Grčki ljekar Galen je sugerirao da se u sastavu zraka dešavaju određene promjene koje uzrokuju štetu kada se udiše.
Tokom Drugog svetskog rata, gas sa ugljen-monoksidom korišćen je kao gorivo za motorna vozila u delovima sveta gde su benzin i dizel bili oskudni. Ugrađeni su vanjski (uz nekoliko izuzetaka) generatori na drveni ugalj ili plin, a mješavina atmosferskog dušika, ugljičnog monoksida i male količine drugih plinova dovedena je u plinsku miješalicu. Bio je to takozvani drveni plin.
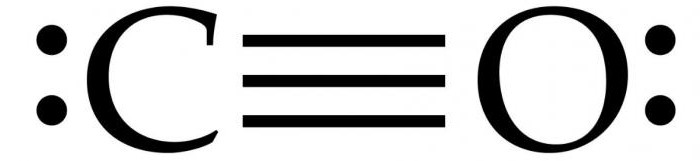
Oksidacija ugljen monoksida
Ugljični monoksid nastaje prilikom djelomične oksidacije spojeva koji sadrže ugljik. CO nastaje kada nema dovoljno kisika za proizvodnju ugljičnog dioksida (CO 2 ), kao što je kada peć ili motor s unutarnjim sagorijevanjem rade u zatvorenom prostoru. Ako je prisutan kisik, kao i neke druge atmosferske koncentracije, ugljični monoksid gori, emitirajući plavo svjetlo, stvarajući ugljični dioksid, poznat kao ugljični dioksid.
Ugljeni gas, koji se široko koristio do 1960-ih za unutrašnje osvetljenje, kuvanje i grejanje, imao je CO kao dominantnu komponentu goriva. Neki procesi u moderne tehnologije, kao što je taljenje gvožđa, i dalje proizvode ugljen monoksid kao nusproizvod. Samo jedinjenje CO se oksidira u CO 2 na sobnoj temperaturi.
Postoji li CO u prirodi?
Postoji li ugljični monoksid u prirodi? Jedan od njegovih prirodnih izvora su fotohemijske reakcije koji se dešavaju u troposferi. Očekuje se da će ovi procesi moći proizvesti oko 5×10 12 kg supstance e godišnje. Među ostalim izvorima, kao što je već spomenuto, su vulkani, šumski požari i druge vrste sagorijevanja.
Molekularna svojstva
Ugljen monoksid ima molarna masa 28,0, što ga čini nešto manje gustim od vazduha. Dužina veze između dva atoma je 112,8 mikrometara. Ovo je dovoljno blizu da obezbedi jednu od najjačih hemijskih veza. Oba elementa u CO spoju zajedno imaju oko 10 elektrona u jednoj valentnoj ljusci.
U pravilu, dvostruka veza se javlja u organskim karbonilnim jedinjenjima. karakteristična karakteristika CO molekula je da jaka trostruka veza nastaje između atoma sa 6 zajedničkih elektrona u 3 vezane molekularne orbitale. Budući da 4 zajednička elektrona dolaze iz atoma kisika, a samo 2 iz ugljika, jednu vezanu orbitalu zauzimaju dva elektrona iz O 2, formirajući dativnu ili dipolnu vezu. Ovo uzrokuje C ← O polarizaciju molekula s malim "-" nabojem na ugljiku i malim "+" nabojem na kisiku.
Preostale dvije vezane orbitale zauzimaju jednu nabijenu česticu iz ugljika i jednu iz kisika. Molekul je asimetričan: kiseonik ima veću elektronsku gustinu od ugljenika i takođe je blago pozitivno naelektrisan u poređenju sa negativnim ugljenikom.
Potvrda
U industriji se ugljen monoksid CO dobiva zagrijavanjem ugljičnog dioksida ili vodene pare s ugljem bez pristupa zraku:
CO 2 + C \u003d 2CO;
H 2 O + C \u003d CO + H 2.
Posljednja rezultirajuća smjesa naziva se i voda ili sintetski plin. U laboratorijskim uslovima, ugljen monoksid II izlaganjem organskih kiselina koncentrovanoj sumpornoj kiselini, koja deluje kao sredstvo za dehidrataciju:
HCOOH \u003d CO + H 2 O;
H 2 C 2 O 4 \u003d CO 2 + H 2 O.
Glavni simptomi i pomoć za trovanje CO
Da li ugljen monoksid izaziva trovanje? Da, i veoma jaka. Trovanje ugljičnim monoksidom najčešća je pojava u svijetu. Najčešći simptomi:
- osjećaj slabosti;
- mučnina;
- vrtoglavica;
- umor;
- razdražljivost;
- slab apetit;
- glavobolja;
- dezorijentacija;
- oštećenje vida;
- povraćati;
- nesvjestica;
- konvulzije.
Izloženost ovom toksičnom plinu može uzrokovati značajnu štetu, što često može dovesti do dugotrajnih kroničnih stanja. Ugljen monoksid može ozbiljno oštetiti fetus trudnice. Žrtvama, na primjer, nakon požara, treba odmah pružiti pomoć. hitno je pozvati hitnu pomoć, dati pristup svježem zraku, skinuti odjeću koja ograničava disanje, smiriti se, zagrijati. Teška trovanja se po pravilu leče samo pod nadzorom lekara, u bolnici.
Aplikacija
Ugljenmonoksid je, kao što je već pomenuto, otrovan i opasan, ali je jedno od osnovnih jedinjenja koje se u savremenoj industriji koristi za organsku sintezu. CO se koristi za proizvodnju čistih metala, karbonila, fosgena, ugljičnog sulfida, metil alkohol, formamid, aromatične kiseline. Ova supstanca se takođe koristi kao gorivo. Uprkos svojoj toksičnosti i otrovnosti, često se koristi kao sirovina za proizvodnju razne supstance u hemijskoj industriji.
Ugljični monoksid protiv ugljičnog dioksida: u čemu je razlika?
Ugljični monoksid i ugljični dioksid (CO i CO 2) često se miješaju jedan za drugog. Oba gasa su bez mirisa i boje, i oba negativno utiču na kardiovaskularni sistem. Oba gasa mogu ući u organizam putem udisanja, kože i očiju. Ova jedinjenja, kada su izložena živom organizmu, imaju niz uobičajenih simptoma - glavobolje, vrtoglavicu, konvulzije i halucinacije. Većini ljudi je teško uočiti razliku i ne shvataju da izduvni gasovi automobila emituju i CO i CO 2 . U zatvorenom prostoru, povećanje koncentracije ovih plinova može biti opasno po zdravlje i sigurnost osoba koje su im izložene. Koja je razlika?
U visokim koncentracijama, oba mogu biti fatalna. Razlika je u tome što je CO 2 uobičajeni prirodni plin potreban za sav biljni i životinjski svijet. CO nije uobičajen. To je nusproizvod sagorevanja goriva bez kiseonika. Kritična kemijska razlika je u tome što CO 2 sadrži jedan atom ugljika i dva atoma kisika, dok CO ima samo jedan. Ugljični dioksid nije zapaljiv, dok je veća vjerovatnoća da će se monoksid zapaliti.
Ugljični dioksid se prirodno pojavljuje u atmosferi: ljudi i životinje udišu kisik i izdišu ugljični dioksid, što znači da živa bića mogu podnijeti male količine. Ovaj plin je također neophodan za provedbu fotosinteze biljaka. Međutim, ugljični monoksid se ne pojavljuje prirodno u atmosferi i može uzrokovati zdravstvene probleme čak i pri niskim koncentracijama. Gustina oba gasa je takođe različita. Ugljični dioksid je teži i gušći od zraka, dok je ugljični monoksid nešto lakši. Ovu njihovu osobinu treba uzeti u obzir prilikom ugradnje odgovarajućih senzora u kuće.
Pod hemijskom vezom se misli različite vrste interakcije koje uzrokuju stabilno postojanje dvo- i poliatomskih jedinjenja: molekula, jona, kristalne supstance. Po svojoj prirodi, kemijska veza je interakcija između pozitivno nabijenih jezgara i negativno nabijenih elektrona, kao i elektrona međusobno. Glavne vrste hemijskih veza: kovalentne, jonske, metalne. Za opisivanje kovalentne veze koriste se dvije metode - metoda valentne veze (MVS) i molekularna orbitalna metoda (MMO).
VS metoda se zasniva na sljedećim odredbama:
1. Samo nespareni elektroni dva atoma sa suprotno usmerenim spinovima učestvuju u formiranju kovalentne veze (mehanizam razmene za stvaranje veze) ili elektronskog para od jednog atoma
Donor i slobodna orbitala drugog atoma - akceptora (donor-akceptorski mehanizam).
2. Kovalentna hemijska veza između dva atoma nastaje kao rezultat preklapanja atomske orbitale sa formiranjem elektronskih parova (socijalizacija dva elektrona).
Prema teoriji valentnih veza, kovalentna veza je usmjerena prema maksimalnom preklapanju atomskih orbitala atoma u interakciji.
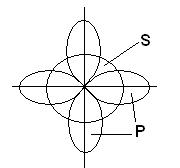
Geometrijska (prostorna) struktura molekule koja se sastoji od više od dva atoma je posljedica međusobnog dogovora atomske orbitale uključene u formiranje hemijskih veza. Molekul AB 2 može imati linearnu ![]() , ili ugaona struktura (a). Molekul AB 3 može imati oblik pravilnog trougla (b), trigonalne piramide (c). Molekul AB 4 je oblika tetraedra (d).
, ili ugaona struktura (a). Molekul AB 3 može imati oblik pravilnog trougla (b), trigonalne piramide (c). Molekul AB 4 je oblika tetraedra (d).
A) 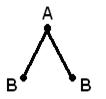 b)
b) 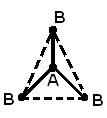 V)
V) 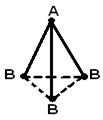 G)
G) 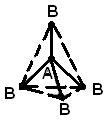
Prostorna struktura molekula određena je tipom hibridizacije valentnih orbitala centralnog atoma i brojem nepodijeljenih elektronskih parova sadržanih u sloju valentnog elektrona.
Primjer 1 Opišite strukturu molekula sa stanovišta metode valentnih veza: a) RN 3 , b) BBr 3 . Koje atomske orbitale su uključene u formiranje hemijskih veza? Navedite vrstu hibridizacije (ako dođe do hibridizacije). Kakva je prostorna struktura ovih molekula?
Rješenje. a) Formiranje PH 3 molekula.
Napišimo elektronske formule atoma koji formiraju PH 3 molekul u osnovnom (normalnom) stanju: 15 R 1s 2 2s 2 2p 6 3s 2 3p 3 ; 1 H 1s 1
Elektronsko-grafske formule vanjskog nivoa ovih atoma:
U ovoj molekuli, centralni atom je atom fosfora, u kojem samo p orbitale učestvuju u formiranju tri hemijske veze, koje se nalaze na istom podnivou i imaju isti oblik i istu energiju. Posljedično, nema hibridizacije u PH 3 molekulu.
Za vizualni prikaz valentnih shema može se koristiti sljedeća metoda. Elektroni koji se nalaze na vanjskom elektronskom sloju označeni su tačkama koje se nalaze oko hemijskog simbola atoma. Elektroni zajednički za dva atoma prikazani su tačkama postavljenim između njihovih hemijskih simbola; dvostruka ili trostruka veza se označava sa dva ili tri para zajedničkih tačaka, respektivno. Koristeći ove oznake, formiranje PH 3 molekula može se predstaviti na sljedeći način:
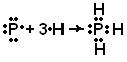 H
H
ê
Ova shema se može napisati drugačije: H - P - H, gdje svaki par elektrona koji veže dva atoma odgovara jednoj crtici koja predstavlja kovalentna veza u strukturnim formulama.
p – elektronski oblaci atoma fosfora orijentisani su u međusobno okomitim pravcima (duž koordinatnih osa) –p x, p y, p z i imaju oblik bučice. Na atomu vodika u formiranju hemikalije R-N komunikacije uključen je s-elektron, koji ima sferni oblik oblaka. Kada se formira PH 3 molekula, oblaci p-elektrona atoma fosfora se preklapaju sa s-elektronskim oblacima tri atoma vodika:
U skladu sa zahtjevima metode valentnih veza, tri veze
P - H treba da se nalazi pod uglovima blizu 90 °C. Stoga, prostorni raspored pojedinačnih veza određuje geometrijsku strukturu molekula. Molekula PH 3 treba da ima oblik trigonalne piramide:
Na vrhu piramide je atom fosfora, a na vrhu baze su atomi vodonika.
b) Formiranje molekula BBr 3. U molekulu VVr 3, centralni atom je atom bora.
Elektronske formule atoma:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Elektronske grafičke formule eksternog nivoa imaju oblik:
Budući da je bor u spoju trovalentan, zapisujemo elektronsko-grafsku formulu atoma bora u pobuđenom stanju:
U formiranju tri hemijske veze u molekuli BBr 3 sudjeluju jedna s- i dvije p-orbitale koje se nalaze na različitim podnivoima i imaju drugačiji oblik i različitu energiju
U ovom slučaju, umjesto originalne jedne s- i dvije p-orbitale pobuđenog atoma bora, formiraju se tri ekvivalentne hibridne orbitale (sp 2 - hibridizacija). Sa sp 2 hibridizacijom, hibridni elektronski oblaci su raspoređeni u pravcima koji leže u istoj ravni i orijentisani su pod uglovima od 120° jedan prema drugom:
Ova vrsta hibridizacije odgovara formiranju ravne trouglaste molekule. Kada se formira molekula BBr 3, tri hibridne orbitale atoma bora se preklapaju sa p-elektronskim orbitalama tri atoma broma:
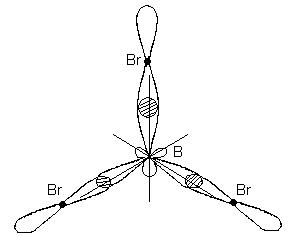
Molekul BBr 3 ima oblik ravnog pravilnog trougla sa atomom bora u centru i atomima broma na vrhovima. Sve tri B-Br veze u molekulu BBr 3 su ekvivalentne.
Primjer 2 Nacrtajte energetske sheme za formiranje molekula F 2 i molekulskog jona F 2 + koristeći molekularnu orbitalnu metodu. Koliko je elektrona u veznim i antivezujućim orbitalama? Koji je red veze u ovim česticama? Navedite njihovu magnetnu karakteristiku (paramagnetizam ili dijamagnetizam).
Rješenje. Prema teoriji molekularnih orbitala (MMO), molekul se smatra skupom pozitivno nabijenih jezgara i negativno nabijenih elektrona, gdje se svaki elektron kreće u polju drugih elektrona i svih jezgara.
Opisati molekul prema MMO teoriji znači odrediti tip njegovih orbitala, njihove energije i odrediti prirodu distribucije elektrona po orbitalama.
Kada se formira molekul, nastaju dvije vrste molekularnih orbitala - vezivanje i labavljenje. Ako je prilikom formiranja molekule od atoma prijelaz elektrona na molekularnu orbitalu praćen smanjenjem energije, tada je takva molekularna orbitala povezivanje. Ako je prijelaz elektrona na molekularnu orbitalu praćen povećanjem energije, tada će takva molekularna orbitala biti labavljenje.
Elektroni u molekulima nalaze se u s- i p-molekularnim orbitalama. s-orbitale se mogu formirati preklapanjem s - atomskih orbitala i preklapanjem 2p x - atomskih orbitala. U tom slučaju nastaju molekularne orbitale: s-vezivanje (s st) i s-olabavljenje (s raz). Kada se atomske orbitale 2p y i 2p z preklapaju, formiraju se molekularne orbitale: p sv2Py, p sv2P z i p puta2Py, p puta2P z. Redoslijed postavljanja elektrona u molekularne orbitale je isti kao i u slučaju atomskih orbitala, odnosno odgovara principu najmanje energije, Paulijevom principu, Hundovom pravilu.