Energija elektrona je maksimalna na energetskom nivou. Proračun broja atomskih orbitala na podnivoima
1. Periodični sistem elemenata kao oblik odraza periodičnog zakona . Formulacije periodičnog zakona. Glavne zakonitosti punjenja atomskih orbitala elektronima i formiranja perioda. s -, str -, d - if -elementi i njihova lokacija u periodnom sistemu. Struktura periodnog sistema: mali i veliki periodi, glavne i sekundarne podgrupe. Položaj lantanida i aktinida. Savremeni oblici periodnog sistema. Periodični zakon kao osnova razvoja neorganske hemije. Opštenaučni značaj periodičnog zakona.
1 With. 41–46; 2 With. 46–55; 4 With. 30–40; 5 . With. 6–8, 21–32; 8 With. 105–106; 11 With. 75–203.
Periodični zakon modernim terminima: „Svojstva atoma hemijskih elemenata, kao i sastav i svojstva supstanci koje oni formiraju, u periodičnoj su zavisnosti od naelektrisanja. atomska jezgra».
Grafički izraz periodnog zakona je tabela periodnog sistema elemenata. Postoji samo jedan periodični zakon, a poznato je više od 500 oblika periodnog sistema elemenata od kojih su najčešći kratak period(8 ćelija) , poludugi period(18 ćelija) i dug period(32 ćelije).
Hemijski elementi su raspoređeni u periodnom sistemu prema rastućem naboju jezgara njihovih atoma. Periodični sistem se sastoji od periodi i grupe.
Period- broj elemenata raspoređenih po rastućem naboju jezgara njihovih atoma, čija elektronska konfiguracija vanjskog energetskog nivoa varira od ns 1 (alkalni metal) do ns 2 np 6 (plemeniti gas). Za prvi period - od 1 s 1 (vodonik) do 1 s 2 (helijum). Prvi, drugi i treći period se nazivaju mala(ili kratko), ostalo - veliki(ili dugo). Ukupno ima 7 perioda.
Fizičko značenje broja perioda – jednako je broj energetskih nivoa u atomima hemijskih elemenata u datom periodu. Na primjer, u atomima elemenata 4. perioda, koji su u nepobuđenom stanju, elektroni su raspoređeni na 4 energetska nivoa (4 elektronske ljuske).
Grupa – vertikalni red elemenata koji imaju slične elektronska struktura atoma i pokazuju slična svojstva. Po pravilu, broj grupe označava broj elektrona u atomu elementa koji može učestvovati u formiranju hemijske veze.
2. Periodičnost svojstava atoma hemijskih elemenata. Faktori koji određuju prirodu promjene hemijska svojstva elementi. "Konfiguracija" i "struktura" elektronskih ljuski atoma, njihova promjena u periodima i grupama. Radijusi atoma i iona, omjer njihovih vrijednosti. Efektivni (kovalentni, jonski, metalni) i orbitalni radijusi. Promjena polumjera atoma i jona po periodima i grupama.
Energija jonizacije (jonizacioni potencijal) i afinitet prema elektronu. Faktori koji određuju njihove vrijednosti: radijus atoma, konfiguracija vanjske elektronske ljuske, efektivni naboj atomskog jezgra. Obrasci promjene energije jonizacije i afiniteta elektrona u periodima i grupama.
Koncept elektronegativnosti. Promjena elektronegativnosti atoma u periodima i grupama. Utjecaj razlike u elektronegativnosti atoma na prirodu kemijske veze između njih. Promjene hemijskih svojstava elemenata u grupama i periodima u zavisnosti od strukture elektronske školjke, kao i atomski radijusi.
1 With. 46–51; 2 With. 51–52, 94–98, 423; 99–103; 4 With. 40–46; 5 With. 6–9, 49–53; 7 With. 81–90; 8 With. 106–112; 11 With. 63–67.
Najvažniji faktori koji određuju hemijska svojstva atoma hemijskih elemenata su konfiguracija i struktura njihovih elektronskih omotača. Sukcesivno povećanje naboja atomskih jezgara dovodi do periodične promjene elektronske konfiguracije njihovih vanjskih elektronskih omotača od ns 1 to ns 2 np 6. Posljedica toga je periodična promjena karakteristika atoma kao što su kovalentni, ionski i metalni radijus, energija ionizacije, afinitet prema elektronu, oksidacijsko stanje, atomski volumen itd.
Strogo govoreći, veličina bilo kojeg atoma je beskonačna, budući da postoji nenulta vjerovatnoća da će se njegovi elektroni naći na proizvoljno velikoj udaljenosti od jezgra. Međutim, postoji glavni maksimum na krivulji radijalne raspodjele elektronske gustine za bilo koju orbitalu. Na osnovu toga, koncept orbitalni radijus atom. On je jednak teoretski izračunato udaljenost od jezgra do glavnog maksimuma na krivulji radijalne distribucije za vanjsku orbitalu.
Govoreći o veličini atoma, najčešće to misle efektivnoradijus. Njegove vrijednosti određuju eksperimentalno metode elektronografije ili difrakcije rendgenskih zraka, koje omogućavaju pronalaženje međunuklearnih udaljenosti u molekulima, ionskim i metalnim kristalima. Na osnovu svojih vrijednosti, izračunavaju u skladu s tim kovalentne, jonske i metalne atomski radijusi.
Vrijednost efektivnog polumjera atoma zavisi od mnogih faktora: strukture supstance, prirode hemijske veze, stepena oksidacije elementa itd. podataka i stoga različitih autora može jako varirati.
Obrazac promjene vrijednosti atomskih radijusa kemijskih elemenata ima periodični karakter.
U periodima kako se naboj atomskih jezgri povećava (povećanje atomskog broja) radijus atoma se smanjuje. Na primjer, osam elemenata 3. perioda (samo s- i R-elementi), radijus se smanjuje sa 190 pm (za natrijum) na 99 pm (za hlor), tj. skoro 2 puta, a za deset d-elementi 4. perioda, radijus se smanjuje sa 164 pm (za skandijum) na 153 pm (za cink), odnosno za samo 7%.
U grupama kako se naboj jezgara povećava, radijus atoma povećava, dok u grupama A ( s- i str-elementi), takvo povećanje se javlja u većoj mjeri nego u grupama B ( d- i f-elementi).
d-Elementi 5. i 6. perioda, koji se nalaze u istoj grupi, imaju skoro iste atomske poluprečnike. Na primjer, atomski radijusi cirkonija i hafnija su 160 pm odnosno 150 pm, dok su oni molibdena i volframa 139 pm i 141 pm, respektivno. Razlog za takvu blizinu poluprečnika je što je u 6. periodu 14 f-elementi u čijim atomima je ispunjena treća spoljašnjost 4 f-energetski podnivo, koji snažno "zaklanja" vanjske elektrone od jezgra. Kao rezultat toga, povećanje naboja atomskih jezgara ima mali utjecaj na veličinu atomskih radijusa. Ovaj efekat se zove kompresija lantanida.
Energija jonizacije (E i on. ) – minimalna energija potrebna za uklanjanje 1 elektrona iz izolovanog atoma ALI , koji je u osnovnom energetskom stanju:
A 0 → A + + e – – E i on.
Razlikovati prvi ( E 1), drugi ( E 2) i naknadne energije jonizacije koje odgovaraju odvajanju prvog, drugog i narednih elektrona. Jedinica za energiju jonizacije je kJ/mol.
jonizacioni potencijal (I ) –najmanji napon (razlika potencijala) električnog polja pri kojem se elektron odvaja od izolovanog atoma.
Razlikovati prvi ( I 1), drugi ( I 2) i naknadni jonizacioni potencijali koji odgovaraju odvajanju prvog, drugog i narednih elektrona. Jedinica jonizacionog potencijala je elektron volt, eV. Jedan eV odgovara 96,486 kJ/mol.
Vrijednost energije ionizacije atoma (i njegovog jonizacionog potencijala) ovisi o mnogim faktorima: naboju jezgra, radijusu atoma, konfiguraciji elektronske ljuske atoma.
Elektronski afinitet (E cf. ) – energija koja se oslobađa ili apsorbuje kao rezultat vezivanja elektrona na neutralni izolovani atom A 0:
A 0 + e – → A – ± E cf.
Dodavanje elektrona atomu je praćeno oslobađanje energije(+e up.), ako to rezultira atomska čestica sa stabilnom elektronskom ljuskom. To je tipično, na primjer, za atome halogena. Ako se kao rezultat vezivanja elektrona na atom formira atomska čestica s nestabilnom elektronskom ljuskom, tada je afinitet prema elektronu takvog atoma negativan, tj. energija se apsorbuje(– e up.). To je svojstveno, na primjer, atomima metala.
elektronegativnost (χ) – uslovna vrijednost koja karakterizira sposobnost atoma da hemijsko jedinjenje privući valentnih elektrona(uobičajeni elektronski parovi).
Vrijednost elektronegativnosti atoma u najjednostavnijem slučaju određuje se na osnovu njegovog jonizacionog potencijala i afiniteta prema elektronu.
Postoje različite skale u kojima se vrijednosti χ elemenata mogu donekle razlikovati (elektronegativnost prema Paulingu, prema Mullikenu, prema Allred-Rochovu, itd.). Na većini skala, fluor je najelektronegativniji element, a francij najmanje elektronegativan.
Sa povećanjem atomskog broja U periodu elektronegativnost raste, dok se u grupi po pravilu smanjuje. Na primjer, elektronegativnost kisika je veća od elektronegativnosti ugljika, jer se nalaze u istom periodu, ali kisik se nalazi desno od ugljika. Elektronegativnost barijuma je niža od one magnezijuma, jer se njegove vrednosti smanjuju od vrha do dna u grupi.
Ako dva atoma imaju iste vrijednosti χ, tada se između njih formira kovalentna nepolarna kemijska veza. Ako se elektronegativnost atoma ne razlikuje mnogo (razlika u vrijednostima elektronegativnosti Δχ ne prelazi 1,5), tada između atoma nastaje kovalentna polarna veza. Uobičajeni elektronski parovi koji ga formiraju uvijek se pomjeraju u atom s većim χ, uslijed čega dobiva djelomični negativni naboj (δ–). U skladu s tim, drugi atom dobiva djelomični pozitivan naboj (δ+).
Posljedica rješavanja Schrödingerove jednadžbe za atom vodonika su tri kvantna broja koja karakteriziraju ponašanje elektrona u atomu. Ove iste kvantni brojevi jedinstveno karakteriziraju stanje elektrona bilo kojeg atoma periodnog sistema elemenata.
Glavni kvantni broj n određuje energiju elektrona i veličinu oblaka elektrona. Energija elektrona uglavnom zavisi od udaljenosti elektrona od jezgra: što je elektron bliži jezgru, to je njegova energija manja. Stoga možemo reći da glavni kvantni broj određuje lokaciju elektrona na jednom ili drugom nivo energije(kvantni sloj). Glavni kvantni broj ima vrijednosti niza cijelih brojeva od 1 do Kada je vrijednost glavnog kvantnog broja jednaka jedan, elektron se nalazi na prvom energetskom nivou koji se nalazi na minimalnoj mogućoj udaljenosti od jezgra. ukupna energija od takvog elektrona je najmanji.
Elektron na energetskom nivou najdalje od jezgra ima maksimalna energija. Stoga, tokom prijelaza elektrona sa udaljenijeg energetskog nivoa na bliži, oslobađaju se dijelovi (kvantovi) energije. Nivoi energije su označeni velikim slovima prema šemi:
Orbitalni kvantni broj Prema kvantnomehaničkim proračunima, elektronski oblaci se razlikuju ne samo po veličini, već i po obliku. Oblik elektronskog oblaka karakterizira orbitalni ili azimutalni kvantni broj. Različiti oblici elektronskih oblaka izazivaju promjenu energije elektrona unutar jednog energetskog nivoa, odnosno njegovo cijepanje na energetske podnivoe. Svaki oblik elektronskog oblaka odgovara određenoj vrijednosti mehaničkog momenta elektrona, određenog orbitalnim kvantnim brojem:
![]()
Orbitalni kvantni broj l. može imati vrijednosti od 0 do svih vrijednosti. Energetski podnivoi su označeni slovima:
Uz vrijednost glavnog kvantnog broja jednaku jedan, orbitalni kvantni broj ima samo jednu vrijednost, jednaku nuli. Ova vrijednost karakterizira elektronske oblake koji imaju sfernu simetriju (vidi sliku 1.3). Elektroni čiji je orbitalni kvantni broj nula nazivaju se -elektroni.
Samo -elektroni mogu biti na prvom energetskom nivou, njegova uslovna notacija Kada je vrijednost glavnog kvantnog broja jednaka dva, orbitalni kvantni broj ima dva značenja: Orbitalni broj,
jednak jedan odgovara obliku u obliku bučice elektronskog oblaka (oblik zapremine osam) (slika 1.4. Elektroni čiji je orbitalni kvantni broj jednak jedan nazivaju se -elektroni.
Drugi energetski nivo može sadržavati S- i -elektrone, koji formiraju dva podnivoa: Kada je vrijednost glavnog kvantnog broja tri, orbitalni kvantni broj ima tri vrijednosti: Orbitalni kvantni broj jednak dva odgovara više složenog oblika oblaci elektrona (slika 1.5). Elektroni sa orbitalnim kvantnim brojem dva nazivaju se d-elektroni.
Treći energetski nivo može sadržavati -elektrone, koji formiraju tri podnivoa: Kada je vrijednost glavnog kvantnog broja četiri, orbitalni kvantni broj ima četiri vrijednosti: Orbitalni broj jednak tri odgovara još složenijem obliku oblaka. elektroni,
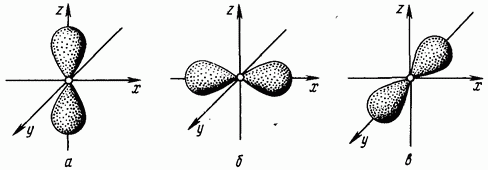
Rice. 1.4. Elektronski -oblaci -orbitalni; -orbitalna; u - -orbitalnoj

Rice. 1.5. Elektronski d-oblaci - orbitalni; -orbitalna; c - orbitalna; - -orbitalna; - -orbitalna
čiji je orbitalni kvantni broj tri, nazivaju se -elektroni.
Četvrti energetski nivo može sadržati i -elektrone, koji formiraju četiri podnivoa;
Magnetski kvantni broj Iz rješenja Schrödingerove jednačine slijedi da su elektronski oblaci orijentirani u prostoru. Prostornu orijentaciju elektronskih oblaka karakteriše magnetni kvantni broj.
Eksterno magnetsko ili električno polje mijenja prostornu orijentaciju elektronskih oblaka, pa se, kada su izloženi magnetskom ili električnom polju, energetski podnivoi elektrona dijele. u magnetnom i električna polja uočeno je cijepanje atomskih spektralnih linija.
Magnetski kvantni broj poprima bilo koju cjelobrojnu numeričku vrijednost od do uključujući 0. Dakle, broj mogućih vrijednosti magnetskog kvantnog broja je ako je vrijednost orbitalnog kvantnog broja nula, magnetni kvantni broj ima samo jedan vrijednost, jednaka nuli (vidi sliku 1.3). Sa orbitalnim kvantnim brojem jednakim jedan, magnetni kvantni broj ima tri vrijednosti: Tri vrijednosti magnetskog broja karakteriziraju tri stanja -elektrona, što odgovara orijentaciji -oblaka u prostoru u tri međusobno okomite ravnine duž koordinate ose (vidi sliku 1.4).
Sa orbitalnim kvantnim brojem jednakim dva, magnetni kvantni broj ima pet vrijednosti: . Pet vrijednosti magnetskog kvantnog broja odgovara pet prostornih položaja oblaka d-elektrona (slika 1.5). Orbitalni kvantni broj jednak tri odgovara sedam vrijednosti magnetnog broja i sedam prostornih položaja oblaka.
Atomske orbitale (AO). Na osnovu koncepata kvantnih brojeva, moguće je precizirati definiciju orbitale elektrona u atomu. Skup položaja elektrona u atomu, karakteriziran određenim vrijednostima kvantnih brojeva, naziva se atomska orbitala.
2. ELEKTRONSKA STRUKTURA ATOMA. HEMIJSKA VEZA
Svako stabilno stanje elektrona u atomu karakteriziraju određene vrijednosti kvantnih brojeva: n, l, ml, ms, koji se nazivaju: glavni, orbitalni, magnetni i spin.
Stanje elektrona u atomu, koje odgovara određenim vrijednostima kvantnih brojeva n, ℓ, ml, naziva se atomska orbitala (a.o.). Inače, atomska orbitala je prostor u kojem će se najvjerovatnije zadržati elektron.
U zavisnosti od vrednosti orbitalnog kvantnog broja, prihvaćena je sledeća oznaka energetskih podnivoa:
– s podnivo (n/a) |
||
ℓ= 2 – d -*- ℓ= 3 – f -*-
Svaka vrsta atomske orbitale ima svoj oblik elektronskog oblaka. S je sferna orbitala, p je orbitala u obliku bučice, d je orbitala u obliku rozete, a f je orbitala još složenijeg oblika.
Broj orbitala svake vrste određen je brojem načina da se one orijentišu u prostoru, tj. broj vrijednosti magnetskog kvantnog broja - ml. Magnetski kvantni broj ima (2ℓ + 1) vrijednosti
(Tabela 2.1).
Proračun broja atomskih orbitala na podnivoima | Tabela 2.1 |
||||
Oznaka | Broj vrijednosti | ||||
podnivo | |||||
2;-1;0; + 1; + 2 | |||||
3;-2;-1;0; + 1;+2;+3 | |||||
Grafički, atomska orbitala je prikazana ili -. Broj (z) atomskih orbitala na energetskom nivou je za.o. = n2, gdje je n glavni kvantni broj.
Prema Paulijevom principu, atom ne može imati dva elektrona karakterizirana istim skupom kvantnih brojeva. Iz ovoga slijedi da svaka atomska orbitala može biti zauzeta sa najviše dva elektrona, a njihovi spinski kvantni brojevi moraju biti različiti, što se označava sa ↓.
Dakle, ukupan broj elektrona na energetskom nivou određen je formulom ze = 2n2. Broj elektrona u podnivou određen je formulom 2(2ℓ + 1). Proračun broja elektrona i strukture nivoa može se prikazati u obliku tabele. 2.2.
Poznavajući strukturu svakog podnivoa i nivoa, moguće je sastaviti elektronske formule elemenata.
Stabilno (nepobuđeno) stanje višeelektronskog atoma odgovara takvoj raspodjeli elektrona po atomskim orbitalama, u kojoj je energija atoma minimalna. Stoga se atomske orbitale popunjavaju redom sukcesivnog povećanja njihove energije. Redoslijed kojim su atomske orbitale ispunjene elektronima određen je pravilima Klečkovskog, koja uzimaju u obzir ovisnost energije orbitale o vrijednostima i glavnog (n) i orbitalnog (ℓ) kvantnog broja. Prema ovim pravilima, atomske orbitale se popunjavaju elektronima redom uzastopnog povećanja zbira (n + 1) (prvo pravilo Klečkovskog), a za iste vrijednosti ove sume, redom od sukcesivno povećanje glavnog broja n (drugo pravilo Klečkovskog).
Postavljanje elektrona u atomske orbitale unutar jednog energetskog podnivoa određeno je Hundovim pravilom, prema kojem minimalna energija atoma odgovara takvoj raspodjeli elektrona u atomskim orbitalama datog podnivoa, na kojoj apsolutna vrijednost ukupnog spina atoma je maksimum; sa bilo kojim drugim rasporedom elektrona, atom će biti u pobuđenom stanju, tj. imaće veću energiju.
Zadaci i vježbe
2.1. Kako se označava stanje elektrona: a) sa n=4, ℓ=2; b) sa n=5, ℓ=3.
Rješenje: Prilikom snimanja energetskog stanja, broj označava broj podnivoa (n), a slovo prirodu podnivoa (s, p, d, f). Za n=4 i ℓ=2 pišemo 4d; za n=5 i ℓ=3 pišemo 5f.
Tabela 2.2
Proračun broja elektrona
Oznaka | Ze = 2(2ℓ + 1) | Ze = 2n2 | Struktura |
|||||
podnivo | ||||||||
2 12 | ||||||||
2 22 | s2 p6 |
|||||||
Kraj stola. 2.2
Oznaka | Ze = 2(2ℓ + 1) | Ze = 2n2 | Struktura |
|||||||||
podnivo | ||||||||||||
2(2 2 + 1) = 10 | ||||||||||||
2 42 = 32 | s 2p 6d 10f 14 |
|||||||||||
2.2. Koliko orbitala odgovara trećem energetskom nivou? Koliko je elektrona na ovom nivou? Na koliko podnivoa se ovaj nivo dijeli?
Rješenje: Za treći energetski nivo n = 3, broj atomskih orbitala je 9 (32); ovaj broj orbitala je zbir 1(s) + 3(p) + 5(d) = 9. Prema Paulijevom principu, broj elektrona na ovom nivou je 18. Treći energetski nivo je podijeljen na tri podnivoa : s, p, d (broj podnivoa je isti kao i broj vrijednosti glavnog kvantnog broja).
Sve hemijski elementi mogu se klasifikovati u zavisnosti od prirode podnivoa koji se popunjavaju u 4 tipa:
s-elementi - punjenje elektronima ns - podnivo; p-elementi - punjenje elektronima np - podnivo; d- elementi - punjenje elektronima (n-1) d - podnivo; f-elementi - punjenje elektronima (n-2) f - podnivo.
Da biste napisali elektronsku formulu elementa, morate: arapskim brojem označiti broj energetskog nivoa, napisati doslovno vrijednost podnivoa, napisati broj elektrona kao eksponent.
Na primjer: 26 FeIV 1s2 2s2 2p6 3s2 3p6 4s2 3d6 .
Elektronska formula je sastavljena uzimajući u obzir konkurenciju podnivoa, tj. minimalna energetska pravila. Isključujući posljednju elektronsku
formula će biti napisana: 26 Fe1V 1s2 2s2 2p6 3s2 3p6 3d6 4s2 . Maksimalna valencija elementa određena je brojem valentnih orbitala i zavisi od elektronskog tipa elementa i broja perioda.
Elektronska struktura elemenata po periodima i maksimalna valencija prikazani su u tabeli. 2.3.
Tabela 2.3 Elektronska struktura i maksimalna valencija elemenata
Valence | ||||||||||||||||
Struktura | ||||||||||||||||
orbitale | ||||||||||||||||
1s 1-2 | ||||||||||||||||
1s 22s 1-22p 1-6 | ||||||||||||||||
1s2 2s2 2p6 3s1-2 | 3d) | |||||||||||||||
3p 1-6 | ||||||||||||||||
4d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s 1-23d 1-104p 1-6 | ||||||||||||||||
5d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s2 3d10 4p6 5s1-2 | ||||||||||||||||
4d 1-105p 1-6 | ||||||||||||||||
6f) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | 6d) | |||||||||||||||
4s2 3d10 4p6 5s2 | ||||||||||||||||
4d 105p 66s 1-10 | ||||||||||||||||
5d 14f 1-145d 2-10 | ||||||||||||||||
6p 1-6 | ||||||||||||||||
2.3. Koji podnivo je ispunjen u atomu elektronima nakon popunjavanja podnivoa: a) 4p; b) 4s?
R Rješenje: a) Podnivo 4p odgovara zbiru (n + l) jednakom 4+1 = 5. Isti zbir n+l karakterizira podnivoe 3d (3+2 = 5)
i 5s (5+0 = 5). Međutim, 3d stanje odgovara manjoj vrijednosti n (n = 3) od 4p stanja, tako da će se 3d podnivo popuniti ranije od 4p podnivoa. Dakle, nakon popunjavanja podnivoa 4p, podnivo 5s će biti popunjen, što odgovara jednoj većoj vrijednosti n (n=5).
b) podnivo 4s odgovara zbiru n+l = 4+0 = 4. Isti zbir n+l karakteriše podnivo 3r, ali popunjavanje ovog podnivoa prethodi punjenju podnivoa 4s, jer ovo drugo odgovara većoj vrijednosti glavnog kvantnog broja. Dakle, nakon podnivoa 4s, podnivo sa zbirom (n+l) = 5 će biti popunjen, štaviše, iz svih mogućih kombinacija n+ℓ koje odgovaraju ovoj sumi (n=3, ℓ=2; n=4, ℓ =1; n= 5, ℓ=0), prva će biti implementirana kombinacija sa najnižom vrijednošću glavnog kvantnog broja, tj. 4s podnivo će biti praćen 3d podnivoom.
Zaključak: Dakle, popunjavanje podnivoa d zaostaje za jedan kvantni nivo, popunjavanje podnivoa zaostaje za dva kvantna nivoa.
2.4. Elektronska struktura atoma opisana je formulom 1s 2 2s2 2p6 3s2 3d7 4s2 . Šta je ovaj element?
R Rješenje: Ovaj element pripada elektronskom tipu
d-elementi 1U period, jer 3d podnivo izgrađuju elektroni; broj elektrona 3d7 ukazuje da je ovo sedmi element po redu. Ukupan broj elektrona je 27, što znači da je serijski broj 27. Ovaj element je kobalt.
2.5. Zašto se fosfor i vanadijum nalaze u istoj grupi periodnog sistema? Zašto su raspoređeni u različite podgrupe?
R Rješenje: Elektronske konfiguracije P 1s atoma 2 2s2 2p3 3s 2 3p 3 ; V 1s2 2s2 2p6 3s2 3p6 4s 2 3d 3 . Valentni elektroni su podvučeni.
Ovi elementi imaju isti broj valentnih elektrona - 5. Dakle, P i V se nalaze u istoj 5. grupi. Istovremeno, ovi elementi nisu elektronski parnjaci, jer. grade različite podnivoe, tako da ih ne treba stavljati u istu podgrupu.
hemijska veza je rezultat kvantno mehaničke interakcije elektrona.
Prema prirodi distribucije elektronske gustine između atoma, hemijske veze se dele na kovalentne nepolarne, polarne i jonske (metalna veza ostvarena u metalima se ovde ne razmatra). Ako nema pomaka para elektrona, tada se veza približava kovalentnoj nepolarnoj. Kovalentnu polarnu vezu izvodi zajednički par elektrona pomaknutih (polariziranih) u jezgro jednog od partnerskih atoma. Jonska veza se smatra izuzetno polarizovanom kovalentna veza. Za procjenu sposobnosti atoma datog elementa da privuče zajednički elektronski par k sebi, koristi se vrijednost relativne elektronegativnosti (χ) (tablica 5). Što je veća razlika u elektronegativnosti (Δχ), to je veća polarizacija veze (veća je jonizacija veze). Vjeruje se da ako je Δχ > 1,9, onda je veza jonska.
2.6. Izračunajte razliku u relativnoj elektronegativnosti atoma za H-O i E-O veze u jedinjenjima E(OH)2, gdje su E elementi Ca, Sr, Ba, i odredite:
a) šta N-O veza ili E-O se u svakom molekulu odlikuje većim stepenom jonizma; b) kakva je priroda jonizacije ovih molekula u vodenom rastvoru?
Odluka: a) Izračunajte Δχ za odnos između E-O i H-O:
Δχ Ca-O = 3,5 - 1,04 = 2,46 ΔχSr-O = 3,5 - 0,99 = 2,51 Δχ Ba-O = 3,5 - 0,90 = 2,60 Δχ H-O = 3,5 - 2,1 = 2,1
Iz poređenja Δχ vidimo da E-O komunikacija može se smatrati jonskom, H-O veza je polarna.
b) jonizacija u vodenim rastvorima će se vršiti duž najjonske veze, tj. prema shemi: E (OH) 2 ↔ E2 + + 2OH- (prema tipu
osnova).
Jačina hemijske veze karakteriše energija (kJ/mol) i
dužina (nm ili A) veze. Što je veća energija veze i što je njena dužina kraća, to je veza jača.
Hemijska veza, tj. zajednički elektronski par se može formirati na dva načina: razmjenom i mehanizmom donor-akceptor. Hemijsku vezu karakteriziraju tri glavna svojstva:
1) ima određeni pravac u prostoru. Sa ove tačke gledišta, σ iπ obveznice. Ugao formiran pravcima dvije σ-veze naziva se valentni ugao. Ako π veza kombinuje nekoliko atoma, naziva se nelokalizovana;
2) teži zasićenju, zbog čega čestice imaju određeni sastav i strukturu. Moguće: koordinacija

nezasićena, koordinativno zasićena, valentno-zasićena i valentno-nezasićena stanja atoma;
3) može se polarizirati pod utjecajem različitih faktora (u zavisnosti od elektronegativnosti atoma, kao i pod utjecajem vanjskog električnog ili magnetskog polja, pod djelovanjem drugih polarnih molekula).
Da bi se objasnila geometrijska struktura molekula, koristi se koncept hibridizacije atomskih orbitala centralnog atoma. Prema ovom konceptu, formiranju σ-veza prethodi promjena oblika i energije atomskih orbitala. Formiraju se hibridne orbitale, sposobne za dublje preklapanje, a time i jače veze. Za elemente elektronskog tipa s i p, orbitale, uključujući nepodijeljene elektronske parove, mogu učestvovati u hibridizaciji.
2.7. Pokažite stvaranje veze u molekulu BF3 i BF4 - jonu. Objasnite strukturu ovih čestica.
Rješenje: 1. Sastavite elektronske formule atoma i io-
novo: B 1s2 2s2 2p1 ; F 1s2 2s2 2p5 ; F- 1s2 2s2 2p6 .
2. Pokažimo distribuciju elektrona po valentnim orbitalama. U ovom slučaju uzimamo u obzir stupanj oksidacije atoma bora u spoju (uvjetno možemo pretpostaviti da broj nesparenih elektrona u atomu odgovara stupnju oksidacije).
3. Pokazaćemo formiranje svih mogućih veza, ukazati ćemo na mehanizam njihovog formiranja:
Mehanizmom razmjene formirane su 3 σ-veze Na osnovu valentnih mogućnosti atoma
bora i njegovu sklonost zasićenju, prikazaćemo formiranje π-veze mehanizmom donor-akceptor. Ali, jer ova veza ujedinjuje više od dva atoma
mov, neće biti lokalizovan.
U BF4 - jonu nastaju 4 σ-veze, od kojih tri razmjenom i jedna donor-akceptorskim mehanizmom.

4. Izračunajte višestrukost veze kao omjer ukupan broj veze saσ-veze. U molekulu BF3, multiplicitet veze je 1⅓; u BF4 jonu, multiplicitet veze je 1.
5. Definirajmo stanje centralnog atoma u smislu zasićenja
mostovi. U molekuli BF3 maksimalna valencija se manifestuje zbog σ i π veza, stoga je stanje atoma bora zasićeno valentnošću.
U BF 4 - jonu, maksimalna valencija se manifestuje zbog σ-veza, stoga je stanje atoma bora koordinativno zasićeno.
6. Hajde da definišemo prirodu veze B-F u smislu polariteta. Jer razlika u vrijednosti elektronegativnosti (Δχ) je 4,0-2,0 = 2,0, tj. više od 1,9, veza se može smatrati jonskom.
7. Odredimo vrstu hibridizacije atomskih orbitala centralnog atoma i geometrijski oblik čestica.
U molekuli BF 3, s i 2p orbitale su uključene u formiranje σ-veza, otuda i tip sp2 hibridizacije. Molekul je trokutastog oblika
struktura. U BF4 - jonu, jedna s i tri p orbitale su uključene u formiranje σ-veza, pa otuda tip sp3 hibridizacije. Jon ima tetraedarski oblik.
8. Opišimo grafički strukturu čestica
2.8. Pokažite stvaranje veza u molekuli SO3, objasnite strukturu molekula.
Rješenje: Elektronske formule elemenata
S 1s2 2s2 2p6 3s2 3p4 O 1s2 2s2 2p4 .
Jer oksidacijsko stanje atoma sumpora je +6, pokazaćemo raspodjelu elektrona po valentnim orbitalama pobuđenog atoma sumpora.
Atom sumpora formira 3 σ-veze (zbog jedne s i dvije p-atomske orbitale) i 3 π-veze (zbog jedne p- i dvije d-atomske orbitale) mehanizmom razmjene.
Posljedično, atom je valentno zasićen, koordinativno nezasićen; višestrukost veze 6/3 = 2. S-O veza polarni, uobičajeni elektronski parovi se pomjeraju u kisik (Δχ = 0,5). Sp2 tip hibridizacije. Molekul ima strukturu trougla.

3. SLOŽENA JEDINJENJA
Složena jedinjenja igraju važnu ulogu u životu živih organizama. Joni Na, K, Ca, Mg, koji obavljaju važne fiziološke funkcije u organizmu, nalaze se u krvi, limfi i tkivnim tečnostima u obliku kompleksnih jedinjenja. Fe, Zn, Mn, Cu joni formiraju kompleksna jedinjenja sa proteinima i deo su enzima i vitamina. Gvožđe je deo hemoglobina. Hemoglobin je veza između proteina globina i kompleksa hema. U hemu, centralni jon je Fe2+.
Složena jedinjenja nazivaju se molekularna jedinjenja, čija kombinacija komponenti dovodi do stvaranja kompleksnih jona sposobnih za slobodno postojanje kako u kristalu tako iu rastvoru. U molekulima složenih spojeva razlikuju se unutrašnje i vanjske sfere. Unutrašnja sfera je zatvorena u uglastim zagradama i sastoji se od centralnog atoma ili jona, nazvanog agens za stvaranje kompleksa, i atoma, jona ili molekula koordiniranih oko nje, zvanih ligandi.
Broj liganada koordinisanih oko agensa za stvaranje kompleksa određuje njegov koordinacioni broj (c.h.). Potonji pokazuje broj σ-veza koje nastaju između f.p. i ligande.
Veza između k.č. | k.o. i njegovo oksidaciono stanje |
||
Oksidacijsko stanje | |||
Molecule c.s. električno neutralan. Naelektrisanje unutrašnje sfere jednak naboju spoljašnje sa suprotnim predznakom. Naelektrisanje kompleksnog jona je jednako algebarskom zbiru naelektrisanja k.o. i ligande.
Klasifikacija složenih spojeva
1. Po prirodi naboja kompleksnog jona
- kationski: nastaje zbog koordinacije oko pozitivno nabijenog c.o. molekule neutralnog liganda
Cl2; Cl3;
- anjonski: agens za stvaranje kompleksa - pozitivni joni, da li-
bande su K2 anioni; Na2 ;
- neutralna: formirana koordinacijom oko neutralnog f.r. neutralni ligandi o ili uz istovremenu koordinaciju oko pozitivno nabijenog c.o.
negativno nabijenih i neutralnih liganda
2. Po prirodi liganada
Hidrati ili akvakompleksi Cl3 ;
Amonijak SO4 ;
- kiseli kompleksi K 2 ;
- Na hydroxocomplexes.
3. Po broju k.o.
Mononuclear Cl2 ;
Polinuklearni [(NH 3 )4 Co\ / OH OH / \ Co(NH3 )4 ]Cl4 .
Pravila za imenovanje složenih jedinjenja
1) ime k.s. počnite s katjonom;
2) u nazivu kompleksnog jona, prvo su naznačeni ligandi, a zatim centralni atom. Završetak "o" se dodaje imenima anionskih liganada, molekularni ligandi se nazivaju kao
odgovarajućih slobodnih molekula. Izuzetak: NH3 - amin; H2O - voda; CO - karbonil;
3) kompleksirajući agens u kationskom i neutralnom c.s. naziva se ruskim imenom elementa, u anionskom - latinskim imenom s dodatkom završetka "at";
4) oksidacijsko stanje k.o. označeno arapskim brojem i stavljeno
zagrade iza njegovog naziva. K3 – kalijum heksanitritokobaltat (+3); Cl3 - heksaakvahrom (+3) hlorid; o je gvožđe pentakarbonil (0).
Ponašanje kompleksnih jedinjenja u rastvoru
U rješenjima c.s. ponaša se kao jak elektrolit i u potpunosti se disocira na kompleksni ion i jone vanjske sfere:
Cl → + + Cl-
Kompleksni joni jonizuju reverzibilno i postepeno: + ↔ + + NH3
+ ↔ Ag+ + NH3 ili ukupno: + ↔ Ag+ + 2NH3
Konstanta jonizacijske ravnoteže kompleksnog jona naziva se konstanta nestabilnosti
Za gnijezdo. = | |
Zavisi samo od prirode spoja i temperature; je dat u referentnim knjigama (vidi tabelu 6).
4. HEMIJSKA RAVNOTEŽA
Hemijska ravnoteža je stanje koje odgovara jednakosti brzina naprijed i obrnuto:
U ovom slučaju, promjena Gibbsove energije je nula
Go=O; ΔΗο = T Dakle
Stanje hemijske ravnoteže ostaje nepromenjeno pri konstanti spoljni uslovi. Kada se ti uslovi (temperatura, pritisak, koncentracije) promene, ravnoteža se narušava da bi se ponovo uspostavila, ali pod novim uslovima.
Pomeranje ravnoteže je u skladu sa Le Chatelierovim principom: ako se u ravnotežnom sistemu promeni jedan od uslova koji određuju položaj ravnoteže, tada se ravnoteža pomera u pravcu procesa koji slabi efekat udara. Dakle, sa povećanjem koncentracije reagensa, ravnoteža se pomera ka procesu koji će uzrokovati potrošnju ovih reagensa. Razlog ovakvog ponašanja ravnotežnog sistema je povećanje broja sudara čestica navedenih reagensa, što uzrokuje ubrzanje prednje ili obrnute reakcije.
U gasnim sistemima, povećanje koncentracije reagensa se javlja sa povećanjem pritiska ili smanjenjem zapremine sistema. Dakle, povećanjem ukupnog pritiska u sistemu, jedna od dve reverzibilne reakcije koja se javlja uz učešće većeg broja molova gasa, tj. ravnoteža se pomiče u pravcu stvaranja manjeg broja molova.
Sa povećanjem temperature, brzina i naprijed i nazad reakcije raste, ali se brzina endotermne povećava u većoj mjeri.
reakcije, jer ima veći temperaturni koeficijent.
Zadaci i vježbe
4.1. Pokažite smjer pomaka ravnoteže sa smanjenjem koncentracije H2 u ravnotežnom sistemu:
CO + H2 O↔ CO2 + H2 Rješenje: Sa smanjenjem CH 2, prema principu Le-
Chatelier, direktna reakcija mora prevladati, jer u ovom slučaju, količina H2 će se povećati, a ravnoteža će se ponovo uspostaviti.
4.2. U kom pravcu će se ravnoteža PC15 ↔ PC13 + C12 - 31 kJ mol-1 pomeriti sa povećanjem temperature i pritiska?
Rješenje: Kako temperatura raste, ravnoteža će se pomjeriti udesno, jer direktna reakcija teče uz apsorpciju toplote, tj. je
endotermni. Kako pritisak raste, broj sudara molekula PC13 i C12 će biti veći od PC15, tako da će se ravnoteža pomjeriti ulijevo.
4.3. Pod kojim uslovima u ravnotežnom sistemu
N2 g + 3H2 g ↔ 2NH3 g + 22 kJ mol-1 da li je moguće maksimizirati prinos NH3?
Rješenje: Za povećanje izlaza NH3, tj. da bi se ravnoteža pomerila udesno, potrebno je:
1) povećati pritisak gasne mešavine, jer u ovom slučaju se povećava brzina direktne reakcije, jer više madeži;
2) povećati koncentraciju N 2 i H2 i smanjuju koncentraciju NH3, uklanjajući ga iz reakcione sfere;
3) sniziti temperaturu reakcione smjese, jer reakcija o-
Formiranje NH3 je egzotermno.
Kvantitativna karakteristika stanja hemijske ravnoteže je konstanta ravnoteže, koja odražava zakon delovanja mase.
Konstanta ravnoteže povezana je sa Gibbsovom energijom relacijom RTlnK
= -∆G oko . Za proces aA + bB ↔ cC + dD konstanta koncentracije
ravnoteža ima oblik: Ks = [C] c [D] d , gdje je [A], [B], [C], [D] – ravnoteža [A]a [B]b
nye koncentracije u mol/l; a b c d stehiometrijski koeficijenti.
Za gasne sisteme napišite konstantu K | |||||||
parcijalni pritisci gasova i smeša.
Konstante Kc i Kp karakteriziraju ravnotežne procese u razrijeđenim otopinama elektrolita i neelektrolita iu plinskim sistemima pri pritiscima blizu 101,3 kPa (idealni plinovi).
Za koncentrirane otopine i neidealne plinove treba koristiti vrijednosti aktivnosti:
K a = a C ca D da A a a B b
Konstanta ravnoteže zavisi od prirode reagensa i temperature, ali ne zavisi od koncentracija komponenti ravnotežnog sistema.
U heterogenim sistemima koncentracija čvrste faze je uključena u vrijednost konstante ravnoteže, jer je konstantna vrijednost.
Ako se reakcije odvijaju u vodenim otopinama uz sudjelovanje vode, tada je koncentracija vode velika i konstantna i praktički neće utjecati na stanje ravnoteže.
Zapisujemo konstante ravnoteže procesa: 4HC1g + O2 g ↔ 2H2 Og + 2C12 g
PH 2 | P S2 1 |
||||||||||||||
4 2 2 | |||||||||||||||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||||||||||||
Prilikom rješavanja problema potrebno je jasno definirati stanje agregacije reagujućih supstanci, kao i za razlikovanje početnih koncentracija supstanci od ravnotežnih.
C ravnoteža \u003d C početni - C potrošeno
4.4. 1 mol H2 i 1 mol I2 pomiješani su u posudi kapaciteta 1 l na 410°C. Izračunajte pri kojim koncentracijama se uspostavlja hemijska ravnoteža ako je konstanta ravnoteže 48?
Rješenje: H 2 + I 2 ↔ 2HI
Pretpostavimo da se u reakciji potroši X molova H2 i I2. Tada je nastalo 2X mola HI, tj. HI = 2 mol/l. U ovom slučaju ==
1 - X. Zapišimo: Ks = | (2x)2 | ||||
(1−x)2 |
|||||
Dobijamo jednačinu: 44X2 - 96X + 48 = 0 Rješavajući je, dobijamo X = 0,776. Izračunajte ravnotežne koncentracije: HI = 2X = 2 0,776 = 1,552 mol/l
1 - X \u003d 0,222 mol / l.
4.5. U reverzibilnoj reakciji CO + C12 ↔ COC12 uspostavljene su sljedeće ravnotežne koncentracije (mol/l): = 0,1; = 0,4; = 4. Izračunajte Crav. i početne koncentracije C12 i CO.
Rješenje: K = | |||||

Nalazimo početne koncentracije: Cish. = Comp. + Sizeexp. . Za formiranje 4 mol COC12, prema jednadžbi reakcije, 4
mol CO i C12. Dakle, početne koncentracije su: CCO = 0,1 + 4 = = 4,1 mol/l; CC1 2 = 0,4 + 4 = 4,4 mol / l.
4.6. Odrediti zapreminski sastav smjese u trenutku ravnoteže za reakciju Cgrafit + O2 g ↔ CO2 g, ako je na 1300 °C Equn. = 0,289.
Rješenje: K p \u003d P R CO 2
Neka X označava sadržaj CO2 u volumnim udjelima (procentima). Tada će sadržaj O2 biti (100-X). Zamijenite u jednačinu:
K = 0,289 = (100 X - X); X = 22,42 vol.%. Sadržaj O2 će biti
5. HEMIJSKA KINETIKA
Hemijska kinetika proučava brzinu i mehanizam hemijskih reakcija, kao i uticaj različitih faktora na brzinu. prosječna brzina hemijska reakcija mjereno promjenom koncentracije reaktanata u jedinici vremena:
V = ±C 2 − C 1 ,
τ2−τ1
gdje su C2 i C1 koncentracije tvari (mol/l) koje odgovaraju vremenu τ2 i τ1 (u s ili min). Za heterogene sisteme, brzina se meri
promjena koncentracije po jedinici površine čvrste faze (1 cm2 ili 1 m2).
Brzina hemijske reakcije zavisi od sledećih glavnih faktora:
- priroda i stanje supstanci koje reaguju;
- priroda sredine u kojoj se reakcija odvija;
Catalyst;
- koncentracija reagujućih supstanci, a za gasove i pritisak;
Temperature.
Hemijska aktivnost tvari ovisi o strukturi atoma ili molekula, prirodi intramolekularnih i intermolekularnih veza. Najveću aktivnost imaju radikali, nešto niža za jone i molekule. Stanje agregacije reagensa i stepen disperznosti takođe su od velike važnosti.
Gotovo uvijek, tvari reagiraju sa medijumom (rastvaračem), formirajući solvate (hidrate). Osim toga, rastvarač može imati katalitičko djelovanje.
Katalizatori općenito ubrzavaju kemijske reakcije mijenjajući njihovu putanju. U ovom slučaju, novi put reakcije odgovara nižoj energiji aktivacije. Energija aktivacije (Ea) je minimalna energija koju čestice reagujućih supstanci moraju imati da bi izvršile interakciju. Vrijednost Ea određena je hemijskom prirodom supstanci.
Utjecaj koncentracije, pritiska i temperature na brzinu kemijske reakcije je kvantificiran.
Zakon glumačkih masa izražava ovisnost brzine kemijske reakcije o koncentraciji reaktanata: brzina reakcije je direktno proporcionalna koncentracijama reaktanata podignutim na stepen njihovih stehiometrijskih koeficijenata. Za reakciju
aA + vV → S V = KCA a CB b ,

gdje su CA i CB molarne koncentracije reagensa A i B;
a i b su stehiometrijski koeficijenti za A i B;
To - konstanta brzine ove reakcije, koja odražava uticaj prirode supstanci. Zavisi od temperature, ali ne ovisi o koncentraciji tvari.
Za plinske sisteme, umjesto koncentracija, možete koristiti vrijednost
nas parcijalni pritisci: V = KPA a PB b .
U heterogenim sistemima, koncentracije kristalnih supstanci su konstantne vrijednosti i uključene su u konstantu brzine. Razlog povećanja brzine reakcije s povećanjem koncentracije reaktanata može se objasniti povećanjem ukupnog broja sudara čestica, a time i povećanjem broja aktivnih sudara. Napišimo izraze za stope sljedećih reakcija:
a) 2H2 g + O2 g \u003d 2H2 Og
V=KC | V=KP | |||||
b) CaOcr + CO2 g \u003d CaCO3 cr | ||||||
V=KCCO2 | V = KPCO 2 | |||||
c) Rastvor FeCl3 + 3KSCN p-p = Fe(SCN)3 p-p | V = KC FeCl3 C 3 KSCN |
|||||
d) 2AgCO3 kr | V=K |
|||||
→ 2Agcr + 2CO2 g + O2 g |
||||||
Zakon masovne akcije važi samo za jednostavne reakcije sa malo reda i molekularnosti.
Red reakcije se shvata kao zbir eksponenata pri koncentracijama u izrazu zakona delovanja mase. Molekularnost reakcije je određena minimalnim brojem molekula uključenih u čin interakcije. Na osnovu molekularnosti, reakcije se dijele na jednomolekularne (monomolekularne), dvomolekularne (bimolekularne) i tromolekularne (trimolekularne). Više molekularne reakcije su rijetke, jer takve reakcije se odvijaju u nekoliko faza.
Jednomolekularne reakcije uključuju reakcije raspadanja i unutarmolekulskih preuređivanja, za njih V = K·C. Dvomolekularne reakcije uključuju reakcije u kojima se interakcija događa kada se dva molekula sudare, za njih V \u003d K C1 C2; za tromolekularne reakcije V = K·C1 ·C2 ·C3 . Na osnovu reda reakcije razlikuju se prvi, drugi i treći red, kao i nulti i razlomak.
trećeg reda V = K·C3 , V = K·C1 2 ·C2 , V = K·C1 ·C2 2 .
Reakcije su nultog reda ako se koncentracija tvari ne mijenja tokom cijelog procesa, a brzina je konstantna vrijednost. To je moguće u heterogenim sistemima gdje kristalna supstanca stupa u interakciju s površinom, a koncentracija ostaje konstantna vrijednost. Za reakciju nultog reda, V = K·Co. Reakcija ima frakcioni red ako se proces odvija u nekoliko faza, od kojih svaka ima zanemarljivu brzinu.
Zadaci i vježbe
5.1. Odredite molekularnost i red reakcije:
S12 g + 2NOg = 2NOClg
Rješenje: 1 mol C12 i 2 mola NO ulaze u reakciju, dakle, naznačena reakcija je trimolekularna. Postupak utvrđivanja
koristimo jednačinu: V = KCCl 2 C2 NO . Odgovor je trećeg reda.
5.2. Izračunajte brzinu rastvaranja gvožđe (II) hidroksida u 0,02 M H2SO4 na K = 40. Odredite molekularnost i red reakcije.
Rješenje: Reakcija će teći prema jednadžbi:
Fe(OH)2 cr + H2 SO4 p-p = FeSO4 p-p + 2H2 Ozh
V \u003d KCH 2 SO 4, jer Fe(OH)2 je u kristalnoj fazi. Molekularnost reakcije je 2, red je 1. Izračunajte brzinu reakcije:
V \u003d 40 0,02 \u003d 0,8 mol / min l.
5.3. U rastvoru koji sadrži 1 mol SnCl 2 i 2 mol FeCl3, reakcija se odvija prema jednadžbi:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
Koliko puta će se brzina reakcije smanjiti nakon reakcije
ruet 0,65 mol SnCl2?
Rješenje: Izračunajte brzinu reakcije u početnoj
Nakon što reaguje 0,65 mol SnCl2, koncentracije će biti
imaju sljedeće vrijednosti: SSnCl2 = 1 - 0,65 = 0,35 mol/l; SFeCl3 = = 2 - 1,3 = 0,7 mol/l. U ovom slučaju, brzina reakcije će biti jednaka:
V1 = K 0,35 0,72 = 0,17 K.
Odnos brzine | |||||
5.4. Kako će se promijeniti brzina reakcije CO2 + C12 g = COC12 g ako se zapremina mješavine plina prepolovi?
Rješenje: Početna brzina reakcije će biti:
Vo = K CCO CC1 2 . Uz prepolovljenje volumena, koncentracije svega
komponente će se udvostručiti i brzina se može izračunati na sljedeći način: V 1= K 2C CO2C Cl2 = 4KC COC Cl2
Sasvim je očito da se sa smanjenjem volumena za 2 puta brzina reakcije povećava za 4 puta.
Utjecaj temperature na brzinu kemijske reakcije je također kvantificiran. Sa povećanjem temperature, brzina bilo koje reakcije se povećava, što se objašnjava povećanjem broja aktivnih čestica čija energija dostiže ili prelazi energiju aktivacije Ea. Temperaturna zavisnost konstante brzine reakcije izražava se kao
Arrheniusova jednadžba: 2.303 lg | |||||||||
Ovdje K1 i K2 | su konstante brzine ove reakcije za apsolutno |
||||||||
temperature T1 i T2; | |||||||||
Ea | je energija aktivacije; | ||||||||
je gasna konstanta. | |||||||||
U praksi se za proračune koristi Van't Hoffovo pravilo, prema kojem se, s povećanjem temperature za 10 °, brzina ili konstanta brzine reakcije povećava za 2-4 puta.
Vt 2 | Kt 2 | t2 − t1 | ||||||
= γ 10 , |
||||||||
gdje je Vt1 i Vt2 | su brzine reakcije na temperaturama t1 i t2; |
|||||||
Kt1 , Kt2 | su konstante brzine; | |||||||
γ je temperaturni koeficijent.
Van't Hoffovo pravilo daje manje tačne rezultate od Arrheniusove jednačine, jer γ se može smatrati konstantnim samo u malom temperaturnom rasponu. Za neorganske reakcije γ = 2-4, za enzimske reakcije γ = 7-8.
5.5. Temperaturni koeficijent brzine razlaganja HI u temperaturnom opsegu 356-376o C je 2. Izračunajte konstantu brzine ove reakcije na 376o C, ako je na 356o C 8,09·10-5.
Rješenje: | Napišimo matematički izraz pravila |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van't Hoff: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V 376 | K 376 | 376− 356 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
= γ 10 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.7. Pesticid se razlaže u vodi na 25°C tokom 10 dana. Na kojoj temperaturi treba čuvati zatrovanu vodu da nakon 1 sata postane bezopasna ako je temperaturni koeficijent reakcije hemijske razgradnje 3?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Skup stanja elektrona u atomu iste vrijednosti n pozvao nivo energije. Broj nivoa na kojima se elektroni nalaze u osnovnom stanju atoma poklapa se sa brojem perioda u kojem se element nalazi. Brojevi ovih nivoa su označeni brojevima: 1, 2, 3, ... (rjeđe - slovima K, L, M, ...).
Energetski podnivo- skup energetskih stanja elektrona u atomu, karakteriziranih istim vrijednostima kvantnih brojeva n i l. Podnivoi su označeni slovima: s, str, d, f... Prvi energetski nivo ima jedan podnivo, drugi - dva podnivoa, treći - tri podnivoa i tako dalje.
Ako su orbitale na dijagramu označene kao ćelije (kvadratni okviri), a elektroni kao strelice (ili ↓), tada možete vidjeti da glavni kvantni broj karakterizira nivo energije (EU), kombinaciju glavnog i orbitalnog kvanta brojevi - energetski podnivo (EPL), skup glavnih, orbitalnih i magnetnih kvantnih brojeva - atomska orbitala, a sva četiri kvantna broja su elektron.
Svaka orbitala odgovara određenoj energiji. Oznaka orbitale uključuje broj energetskog nivoa i slovo koje odgovara odgovarajućem podnivou: 1 s, 3str, 4d itd. Za svaki energetski nivo, počevši od drugog, postojanje tri jednake energije str orbitale smještene u tri međusobno okomita smjera. Na svakom energetskom nivou, počevši od trećeg, postoji pet d-orbitale složenijeg četverolisnog oblika. Počevši od četvrtog energetskog nivoa, pojavljuju se još složeniji oblici. f-orbitale; Ima ih sedam na svakom nivou. Atomska orbitala sa elektronskim nabojem raspoređenim po njoj se često naziva elektronskim oblakom.
Pitanje 12.
Horizontalna periodičnost
Takve fizička svojstva, kao energija ionizacije i afinitet elektrona, ispoljava se i horizontalna periodičnost, povezana s periodičnom promjenom broja elektrona na posljednjim energetskim podnivoima:
Pitanje 13.
Pitanje 14.
Magnetne karakteristike atoma
Elektron ima svoj vlastiti magnetni moment, koji je kvantiziran u smjeru paralelnom ili suprotnom primijenjenom magnetskom polju. Ako dva elektrona koji zauzimaju istu orbitalu imaju suprotno usmjerene spinove (prema Paulijevom principu), onda se međusobno poništavaju. U ovom slučaju se kaže da su elektroni upareni. Atomi sa samo uparenim elektronima istiskuju se iz magnetnog polja. Takvi atomi se nazivaju dijamagnetički. Atomi koji imaju jedan ili više nesparenih elektrona uvlače se u magnetsko polje. Zovu se dijamagnetski.
Magnetski moment atoma, koji karakteriše intenzitet interakcije atoma sa magnetsko polje, je praktično proporcionalan broju nesparenih elektrona.
Posebnosti elektronska struktura atomi razni elementi se ogledaju u energetskim karakteristikama kao što su energija jonizacije i afinitet prema elektronu.
Energija jonizacije
Energija (potencijal) jonizacije atoma Ei je minimalna energija potrebna za uklanjanje elektrona iz atoma u beskonačnost prema jednadžbi
X = X + + e− . Njegove vrijednosti su poznate za atome svih elemenata periodnog sistema. Na primjer, energija ionizacije atoma vodika odgovara prijelazu elektrona iz 1 s- energetski podnivo (−1312,1 kJ/mol) do podnivoa sa nultom energijom i iznosi +1312,1 kJ/mol.
U promeni prvih jonizacionih potencijala, koja odgovara uklanjanju jednog elektrona atoma, periodičnost je jasno izražena povećanjem rednog broja atoma:
Pri kretanju s lijeva na desno duž perioda, energija jonizacije, općenito govoreći, postepeno raste, dok se povećanjem serijskog broja unutar grupe smanjuje. Minimalni prvi jonizacioni potencijali imaju alkalni metali, maksimalno - plemeniti gasovi.
Za isti atom, druga, treća i slijedeća energija jonizacije uvijek se povećavaju, budući da se elektron mora odvojiti od pozitivno nabijenog jona. Na primjer, za atom litija, prva, druga i treća energija jonizacije su 520,3, 7298,1 i 11814,9 kJ/mol, respektivno.
Redoslijed odvajanja elektrona je obično obrnut od redoslijeda naseljenosti orbitala elektronima u skladu s principom minimalne energije. Međutim, elementi koji su popunjeni d-orbitale su izuzeci - prije svega ne gube d-, a s-elektroni.
afinitet prema elektronu
Afinitet atoma prema elektronu A e - sposobnost atoma da pridruže dodatni elektron i pretvore se u negativni ion. Mjera afiniteta prema elektronu je energija koja se oslobađa ili apsorbira u procesu. Afinitet elektrona jednak je energiji jonizacije negativnog jona X − : X − = X + e −
Atomi halogena imaju najveći afinitet prema elektronu. Na primjer, za atom fluora, dodavanje elektrona je praćeno oslobađanjem 327,9 kJ/mol energije. Za određeni broj elemenata, afinitet elektrona je blizu nule ili negativan, što znači da za ovaj element ne postoji stabilan anjon.
Obično se afinitet elektrona za atome različitih elemenata smanjuje paralelno s povećanjem njihove energije ionizacije. Međutim, postoje izuzeci za neke parove elemenata:
Objašnjenje za ovo može se dati na osnovu manjih veličina prvih atoma i veće odbijanja elektrona u njima.
Pitanje 15.
Pitanje 16.
Horizontalna periodičnost
Horizontalna periodičnost se sastoji u pojavljivanju maksimalnih i minimalnih vrijednosti svojstava jednostavne supstance i veze unutar svakog perioda. Posebno je uočljiv za elemente grupe VIIIB i lantanoide (na primjer, lantanodi s parnim serijskim brojevima su češći od onih s neparnim).
U takvim fizičkim svojstvima kao što su energija jonizacije i afinitet elektrona, manifestuje se i horizontalna periodičnost, povezana sa periodičnom promjenom broja elektrona na posljednjim energetskim podnivoima.






