Raspored elektrona po energetskim nivoima je tabela. Raspored elektrona u energetskim nivoima
|
l= 0, 1, ... do n-1 |
m = - l; 0;+ l | |||
|
l= 0(s) | ||||
|
l= 0(s), l= 1(p) |
m = -1, 0, +1 |
| ||
|
l= 0(s), l= 1(p) l= 1(d) |
m = -1, 0, +1 m = -2, -1, 0, +1,+2 |
|
Napomena: Tabela prikazuje maksimalni mogući broj elektrona na energetskom nivou.
Elektronska formula
Elektroni ispunjavaju orbitale atoma po rastućoj energiji. Što je orbitala bliža jezgru (energetski nivo sa manjim brojem), to je elektron jače privučen jezgrom, takav raspored je za njega povoljniji.
Na primjer, atomski broj atoma ugljika je šest, što znači da je nuklearni naboj +6, broj elektrona je također šest. Ovi elektroni se nalaze na dva energetska nivoa (broj perioda). Prvi energetski nivo atoma ugljenika je potpuno ispunjen: postoje dva elektrona sa suprotnim spinovima (1s 2) u jednoj orbitali (vidi tabelu 7). Preostala četiri elektrona zauzimaju drugi energetski nivo, sa dva na svojim preferiranim s orbitalama i dva u p orbitalama (2s 2 2p 2).
Raspodjela elektrona preko nivoi energije a podnivoi se povinuju:
1. Paulijev princip
2. Vladavina Klečkovskog
3. Hundovo pravilo.
Paulijev princip. 1925. P. Pauli je postulirao princip da atom ne može imati dva elektrona koji imaju potpuno isti skup kvantni brojevi: n l, gospođa. Iz toga proizlazi da svaka orbitala ne može imati više od dva elektrona i moraju imati suprotne spinove, tj. dopuna je dozvoljena, a dopuna i nije dozvoljena.
Vladavina V. Klečkovskog. Povećanje energije i, shodno tome, punjenje orbitale događa se po redu povećanja sume kvantnih brojeva n + l, i kada jednak zbiru n+ l u rastućem redoslijedu od n.
Na primjer, Ca +20)))) 1s 2s 2p 3s 3p 3d 4s 4p 4d
niz energetskih podnivoa
ako je s = 0, p = 1, d = 2
Posljedično, popunjavanje nivoa i podnivoa elektronima se događa po rastućem zbroju n i l: 1s 2 2s 2 2p 6 3s 2 3p 6 3 d 0 4s 2
Izuzetak su neki d i f elementi, kod kojih se uočava takozvani pad (pad elektrona sa s podnivoa na predeksterni d ili f). Na primjer, Cu, Ag, Cr, Pd, Pt.
Hundovo pravilo.Popunjavanje orbitala p, d, f podnivoa u normalnom stanju atoma počinje sa pojedinačnim elektronima sa istim spinovima. Nakon što pojedinačni elektroni zauzmu sve orbitale podnivoa, orbitale su ispunjene drugim elektronima sa suprotnim spinovima. Na primjer, elektronska struktura atom dušika ima sljedeću strukturu 1s2s2p
Svojstva elemenata zavise od elektronske konfiguracije valentnih elektrona. Valentni elektroni se po pravilu nalaze na vanjskom energetskom nivou (broj perioda), broj valentnih elektrona se može odrediti brojem grupe (sa izuzetkom d elemenata grupe VIII). Na primjer, atom dušika ima pet valentnih elektrona (grupa V), koji se nalaze na drugom energetskom nivou (element je u drugom periodu).
Svi elementi PSE prema strukturi valentnih elektrona mogu se podijeliti na s-, p-, d-, f- elemente, inače se nazivaju familije:
s-elementi su u grupama I, II (glavne podgrupe)
str-elementi su u grupama III-VIII (glavne podgrupe)
d-elementi su u grupama I-VIII (sporedne podgrupe)
f-elementi se klasifikuju kao lantanidi i aktinidi.
Svi elementi porodice imaju sličnu strukturu:
s-elementi u nepobuđenom stanju imaju valentne elektrone samo na s-podnivou.
p-elementi u nepobuđenom stanju imaju valentne elektrone na vanjskim s i p-podnivoima.
d-elementi u nepobuđenom stanju imaju valentne elektrone na vanjskim s i pred-vanjskim d-podnivoima.
Slična elektronska konfiguracija elemenata porodice osigurava sličnost hemijskih svojstava elemenata ove porodice.
DEFINICIJA
Scandium nalazi se u četvrtom periodu grupe III sekundarne (B) podgrupe periodnog sistema.
Odnosi se na elemente d-familije. Metal. Oznaka - sc. Redni broj - 21. Odnosnik atomska masa- 44.956 amu
Elektronska struktura atoma skandijuma
Atom skandijuma se sastoji od pozitivno nabijenog jezgra (+21), unutar kojeg se nalazi 21 proton i 24 neutrona, a 21 elektron se kreće u četiri orbite.
Fig.1. Shematska struktura atoma skandijuma.
Raspodjela elektrona u orbitalama je sljedeća:
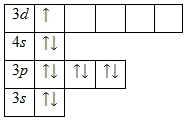
1s 2 2s 2 2str 6 3s 2 3str 6 3d 1 4s 2 .
Vanjski energetski nivo atoma skandijuma sadrži 3 elektrona, koji su valentni. Oksidacijsko stanje skandijuma je +3. Energetski dijagram osnovnog stanja ima sljedeći oblik:
Primjeri rješavanja problema
PRIMJER 1
PRIMJER 2
| Vježbajte | Element galijum ima dva prirodna izotopa 69 Ga i 71 Ga. Izračunajte masene udjele ovih izotopa u prirodnom galiju ako je relativna atomska masa elementa 69,72. |
| Rješenje | Izotopi su atomi istog hemijskog elementa koji se razlikuju maseni brojevi(isti broj protona, ali različiti - neutroni). Uzmimo kao x broj atoma izotopa galija 69 Ga u svakih sto atoma prirodnog klora, tada će broj atoma izotopa 71 Ga biti jednak (100-x). Masa atoma izotopa 69 Ga bit će jednaka 69x, a 71 Ga - 71 × (100-x). Napravimo jednačinu: 69x + 74x(100x) = 69,72x100%. Nađimo x: 69x + 7400 - 74x = 6972; |
| Odgovori | Sadržaj izotopa 69 Ga u prirodnom hloru je 85,6%, a izotopa 71 Ga 14,4%. |
I. Elektronske formule atoma hemijski elementi sastavljaju se sljedećim redoslijedom:
· Prvo, brojem elementa u tabeli D. I. Mendeljejeva, određuje se ukupan broj elektrona u atomu;
· Zatim, prema broju perioda u kojem se element nalazi, određuje se broj energetskih nivoa;
· Nivoi su podijeljeni na podnivoe i orbitale i ispunjeni elektronima u skladu sa Princip najmanje energije
· Radi praktičnosti, elektroni se mogu podijeliti na energetske razine pomoću formule N=2n2 a s obzirom na to:
1. kod elemenata glavne podgrupe ( s-; str -elementi), broj elektrona na vanjskom nivou jednak je broju grupe.
2. kod elemenata bočne podgrupe obično spolja dva elektron (sa izuzetkom atomaCu, Ag, Au, Cr, Nb, Mo, Ru, Rh, čiji spoljni nivo jedan elektron, atPdna spoljašnjem nivou nula elektroni);
3. broj elektrona na pretposljednjem nivou je ukupan broj elektrona u atomu minus broj elektrona na svim ostalim nivoima.
II. Nalog za punjenje elektronom atomske orbitale odlučan :
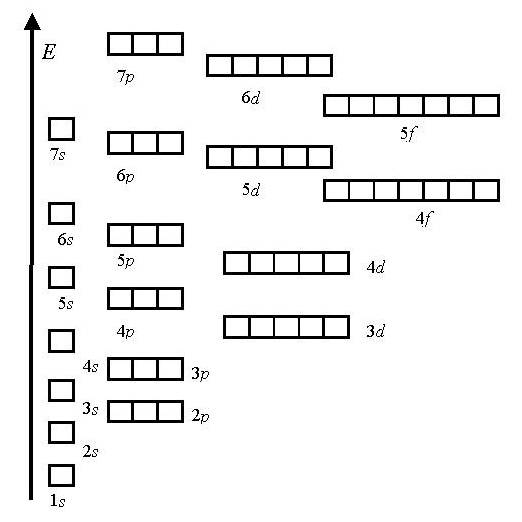
1.Princip najmanje energije
Energetska skala:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. Stanje atoma sa potpuno ili napola ispunjenim podnivoom (tj. kada postoji jedan nespareni elektron u svakoj orbitali) je stabilnije.
Ovo objašnjava "neuspjeh" elektrona. Dakle, sljedeća raspodjela elektrona odgovara stabilnom stanju atoma hroma:
Cr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 , ali ne 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4 ,
tj. dolazi do "kvara" elektrona iz 4 s-podnivo na 3 d-podnivo.
PROVERITE SE: Elektronske formule elemenata.
Preuzmite modul: sprave za obuku“Popunjavanje elektronskih ljuski atoma elemenata” sadrži periodni sistem hemijskih elemenata i dijagram koji prikazuje distribuciju elektrona u atomu.
Pozvani ste da odredite hemijski element po elektronskoj strukturi atoma.
1. Odredi u glavnim podgrupama koje grupe periodnog sistema postoje hemijski elementi čije su elektronske šeme atoma prikazane u prvoj koloni tabele.
Elektronska kola Grupe 1 2 3 4 5 6 7 2nd 4th SCH I E X ALI B At 2. 8. 2 AT I To M H O P 2nd 1st M OD S F YU ALI I 2. 8. 5. R B T AT I E G 2. 8. 1 H D I I To W M 2. 8. 7 L O AT H At P E 2. 8. 3 R T OD X C H F 2nd 3rd SCH S To E M H To 2. 8. 6 O I ALI AT OD I O 2nd 5th YU P R M Y AT X 2. Odrediti u koje glavne podgrupe su hemijski elementi periodnog sistema čiji je broj protona i neutrona dat u prvoj koloni tabele.
Broj protona i neutrona Grupe 1 2 3 4 5 6 7 13r 14n ALI G E G O OD B 12p 12n AT L SCH To I P H 15r 16n B O P E E To At 19r 20n M C At ALI D S E 17p18n Y W F L W L E 6p 6n To M I H YU YU I 8p 8n P OD T D H T AT
Preuzmite modul i pokrenite tjede na temu „Periodični zakon i periodični sistem hemijskih elemenata
D. I. Mendeljejev i struktura atoma"
Preuzmite modul i pokrenite t jede na temu "Osnovne informacije o strukturi atoma." Modul uključuje 10 testnih pitanja na tu temu. Posebno ste pozvani da konstruišete elektronsku formulu atoma sumpora prenošenjem numeričkih i alfabetskih oznaka u odgovarajuću zonu.
Zadaci za popravljanje
3. Kakav je sastav jezgra atoma?
5. Uporedite izotope.
6. Zapišite shemu za formiranje jona Na +1.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite shemu za formiranje jona O -2.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope.
6. Zapišite šemu formiranja jona S-2
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite šemu za formiranje jona Mg +2.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite šemu formiranja Si +4 jona.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite shemu za formiranje jona Al +3.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite shemu za formiranje Cl -1 jona.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
1. Zapišite položaj elementa u periodičnom sistemu hemijskog elementa D. I. Mendeljejeva.
2. Odrediti naboj jezgra, ukupan broj elektrona.
3. Kakav je sastav jezgra atoma?
4. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima).
5. Uporedite izotope ![]() .
.
6. Zapišite šemu za formiranje K +1 jona.
7. Nacrtajte dijagram raspodjele elektrona po slojevima (nivoima) u jonu.
Periodični sistem hemijskih elemenata je strogo uređen skup hemijskih elemenata, njihova prirodna klasifikacija, koja je tabelarni ili drugi grafički izraz periodnog zakona.
Poznat je veliki broj različitih verzija tablica periodnog sistema. Međutim, samo oni od njih za koje se pokazalo da su bliski tabeli koju je sastavio D.I. Mendeljejev. Trenutno se uglavnom koriste dva oblika periodnog sistema: dugoperiodični i kratkoperiodični.
Vertikalni grafovi periodnog sistema se nazivaju grupe, i one horizontalne periodi. Forma kratkog perioda sastoji se od osam grupa i sedam perioda. Porodice lantanida i aktinida nalaze se ispod tabele.
Razdoblje - sekvencijalni niz elemenata u čijim atomima je isti broj energetskih nivoa ispunjen elektronima (broj nivoa je jednak broju perioda). Razdoblja sadrže 2, 8, 8, 18, 32 i 32 elementi. Posljednji period nije završen. Različiti broj elemenata u periodima objašnjava se različitim redoslijedom punjenja energetskih podnivoa. Elementi koji su ispunjeni elektronima s- podnivo se nazivaju s- elementi za koje se popunjava R- podnivo - R- elementi za koje se popunjava d- i f- podnivoi - respektivno d- i f- elementi. Razdoblja počinju alkalnim metalima, u čijim atomima, na novom elektronskom nivou, s- elektron. Periodi se završavaju elementima čiji su atomi potpuno popunjeni str- podnivo spoljašnjeg nivoa sa šest elektrona (inertni gasovi), osim prvog perioda, koji se završava helijumom, u kome je nivo izgrađen za 2 s- elektroni. U 4. i 5. periodu između s- i str- elementi postavljeni 10 d- elemenata, au 6. i 7. periodu - 10 d- elementi i 14 f- elementi.
Periodični sistem se sastoji od 8 grupa (ili 32 grupe u verziji sistema za duži period). Grupe su označene rimskim brojevima I - VIII i sastoji se od dvije podgrupe: ALI i B.
Svaka grupa se sastoji od elemenata čiji atomi imaju sličnu strukturu elektronske ljuske. Na primjer, kalijum 4 s 1 (IA), i bakar - 3d 10 4 s 1 (I B). Ovi elementi na vanjskoj strani 4 s- Svaki podnivo ima jedan elektron. Elementi koji su dio iste grupe se nazivaju elektronski analozi.
Elementi koji su dio jedne podgrupe su puni elektronski analozi, budući da imaju istu strukturu elektronskih nivoa. Na primjer, elementi I A grupe imaju opštu formulu ns 1 , i elementi I B -(n-1)d 10 ns 1 .
Od objavljivanja Periodnog sistema elemenata, u njemu se pojavilo više od 40 novih elemenata. Na osnovu periodičnog zakona, vještački su dobijeni transuranski elementi sa atomskim brojem od 93 do 105 (ukupno 15). Njihova proizvodnja zasniva se na korištenju najtežeg elementa koji postoji na Zemlji - uranijuma-238, čija su jezgra "izgrađena" bombardiranjem neutronima. Tako se dobijaju elementi do fermija 100 Fm 257 u nuklearnim reaktorima. Transuranidi nastaju i u termonuklearnim eksplozijama.
Svi elementi sa atomskim brojem preko 100 proizvode se u akceleratorima. Teška atomska jezgra (mete) bombarduju se teškim jonima. Nakon emisije neutrona, oba se spajaju, formirajući nove elemente sa zbirom atomskih brojeva komponenti. Periodični sistem se razvija, otkrivaju se novi elementi. Prema teoriji vjerovatnoće, izračunatoj savremenom kompjuterskom tehnologijom, predviđa se da bi 8. period trebalo da sadrži 50 elemenata, među kojima će se pojaviti nova grupa hemijski sličnih elemenata, koja se sastoji od 18 elemenata, do sada nazvanih oktadekanoidi. (Z=121-138). Gornja granica moguće stabilnosti, kako se može odrediti trenutnim nivoom znanja, bliska je atomskom broju 174. Međutim, to nije granica, jer, na primjer, iz Seaborgovog dijagrama stabilnosti kemijskih elemenata, postojanje mogućih elemenata sa atomskim brojem do 500.







