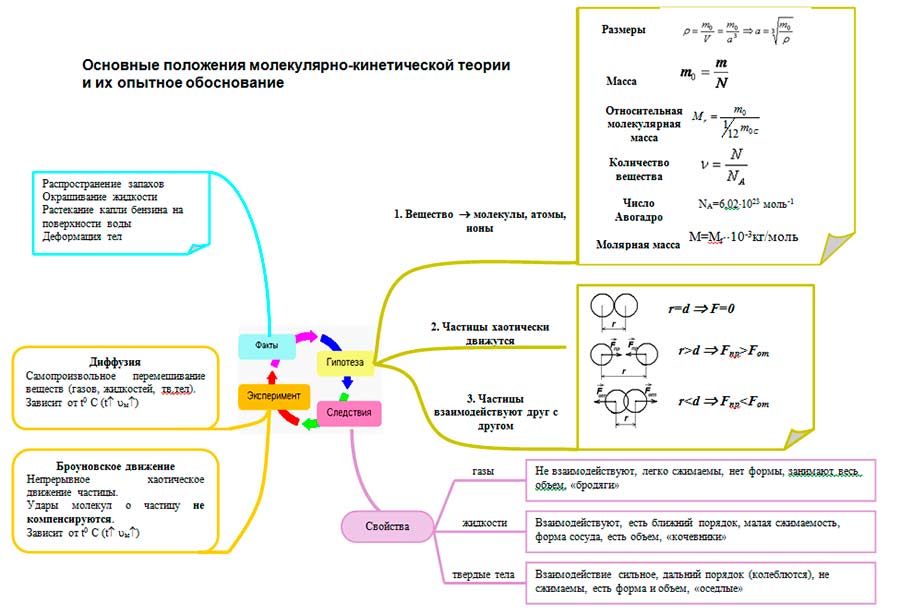
Formulirajte glavne odredbe molekularne kinetike. Sva tijela su sastavljena od čestica – atoma, molekula, jona. Osnovne odredbe teorije molekularne kinetike
Osnovne odredbe teorije molekularne kinetike
Koji je glavni zadatak molekularne fizike? Šta je molekularna kinetička teorija? Formulirajte glavne odredbe molekularno-kinetičke teorije. Koja zapažanja i eksperimenti potvrđuju glavne odredbe molekularne kinetičke teorije? Šta je molekul? atom?
Koji je glavni zadatak molekularne fizike? Objasnite svojstva makroskopskih tijela i termičke procese koji se u njima odvijaju na osnovu ideje da se sva tijela sastoje od zasebnih, nasumično pokretnih čestica.
Šta je molekularna kinetička teorija? Molekularno-kinetička teorija (MKT) je teorija koja razmatra strukturu supstance sa stanovišta tri glavne približno ispravne odredbe.
Formulirajte glavne odredbe molekularno-kinetičke teorije. sva tijela su sastavljena od čestica, između kojih postoje praznine čestice su u kontinuiranom haotičnom kretanju čestice međusobno djeluju
Koja zapažanja i eksperimenti potvrđuju glavne odredbe molekularne kinetičke teorije? Difuzija Brownovo kretanje Eksperimenti Dunoyera i Sterna
Šta je molekul? atom? Molekul je nezavisna čestica, obavezna komponenta svake supstance koja ima sve hemijske i fizička svojstva ovu supstancu. Bilo koja molekula sastoji se od najjednostavnijih nezavisnih čestica - atoma. Atom - najmanja moguća čestica od bilo kojeg od najjednostavnijih hemijske supstance naziva elementima.
Glavne odredbe molekularne kinetičke teorije podvrgnute su opsežnoj eksperimentalnoj provjeri. Najpoznatiji eksperimenti koji pokazuju molekularnu strukturu supstance i potvrđuju molekularnu kinetičku teoriju su Dunoyerov eksperiment i Oto Stern eksperiment (1888. - 1969.), izvedeni 1911. odnosno 1920. godine. U ovim eksperimentima molekularni snopovi su nastajali isparavanjem različitih metala, pa su stoga molekuli proučavanih plinova bili atomi ovih metala. Takvi eksperimenti omogućili su provjeru predviđanja molekularno-kinetičke teorije, koje ona daje za slučaj plinova, čiji se molekuli mogu smatrati materijalne tačke, odnosno za jednoatomne gasove.
Dunoyerov eksperiment Šema Dunoyerovog eksperimenta s molekularnim snopovima prikazana je na sl. 1. Staklena posuda, čiji je materijal odabran tako da obezbjeđuje visok vakuum, podijeljena je na tri odjeljka 1, 2 i 3 sa dvije pregrade sa dijafragmama 4. U odjeljku 1 nalazio se plin, koji je u u ovom eksperimentu korištena je natrijeva para dobivena zagrijavanjem. Molekuli ovog gasa mogli su slobodno da lete kroz rupe na dijafragmi, kolimirajući molekularni snop 5, odnosno dozvoljavajući mu da prođe samo unutar malog čvrstog ugla. U odjeljcima 2 i 3 stvoren je ultra-visok vakuum, tako da atomi natrijuma mogu letjeti kroz njih bez sudara s molekulima zraka. Neraspršeni molekularni snop ostavio je trag 6 na krajnjoj stijenci posude. Ali čak iu slučaju ultravisokog vakuuma, molekularni snop se raspršio na rubovima dijafragme 4. Stoga je na kraju postojalo područje "penumbra" 7 stijenke posude, u kojoj su čestice koje su se raspršile ostavile tragove. Kako se vakuum u odjeljku 3 pogoršavao, područje 7 se povećavalo. Iz veličine razmazivanja traga raspršenih atoma natrijuma bilo je moguće procijeniti dužinu njihovog slobodnog puta. Takve je procjene napravio Max Born (1882 - 1970) na osnovu rezultata eksperimenata sličnih Dunoyerovim.
Eksperiment Otta Sterna Jedan od najpoznatijih eksperimenata s molekularnim snopovima bili su Sternovi eksperimenti, u kojima je po prvi put bilo moguće izvršiti direktna mjerenja molekularnih brzina. Najpoznatija shema Sternovog eksperimenta prikazana je na sl. 2. Na osi dva koaksijalna cilindra 2 i 3 nalazio se platinasti navoj 1, na koji je nanesena kap srebra, au cilindru 2 paralelno sa njegovom osom. Cilindri su se mogli okretati oko svoje ose. U Sternovim eksperimentima, ugaona brzina njihove rotacije bila je 2...3 hiljade obrtaja u minuti. Kada se provuče kroz platinastu nit električna struja zagrejala se maksimalna temperatura oko 1200 oS. Kao rezultat toga, srebro je počelo da isparava, njegovi atomi su proletjeli kroz prorez 4 cilindra 2 i taložili se na površinu cilindra 3, ostavljajući na njemu trag 5. sektor koji odgovara njihovoj pravolinijskoj distribuciji. Rotacija cilindara dovela je do zakrivljenosti putanje molekula u referentnom okviru povezanom s cilindrima i, kao rezultat, do promjene položaja atoma srebra koji su se smjestili na vanjski cilindar. Analizirajući gustinu staloženih molekula, bilo je moguće procijeniti karakteristike distribucije molekula po brzini, posebno maksimalne i minimalne brzine koje odgovaraju ivicama staze, kao i pronaći najvjerovatniju brzinu koja odgovara maksimalnoj gustina staloženih molekula.
Rice. 1 - Šema Dunoyerovog eksperimenta 1 - odjeljak ispunjen plinom 2 i 3 - odjeljci sa ultravisokim vakuumom 4 - pregrade sa dijafragmama 5 - molekularni snop 6 - trag neraspršenog snopa 7 - trag raspršenih molekula
Slika 2 - Šema Sternovog eksperimenta 1 - izvor molekula 2 i 3 - rotirajući cilindri 4 - prorez koji ograničava molekularni snop 5 - trag molekulskog snopa
Difuzija Difuzija je pojava međusobnog prodiranja molekula jedne tvari između molekula druge. Difuzija se može javiti u gasovima (vrlo brzo), u tečnostima (brzo), u metalima (veoma sporo).
Braunovo kretanje Braunovo kretanje je toplotno kretanje čestica suspendovanih u tečnosti ili gasu. Uzroci Brownovog kretanja su: 1. Nasumično kretanje molekula 2. Odstupanje od prosječne vrijednosti pritiska koji oni proizvode. Utvrđeno je sljedeće: 1. Braunovo kretanje se vrši na bilo kojem t i traje neograničeno. 2. Brownove čestice prave nasumične putanje. 3. Priroda kretanja Brownove čestice ne zavisi od njene prirode Braunovo kretanje je direktan dokaz slučajnog kretanja molekula.
Okruženi smo raznim stvarima. Možemo vidjeti da su ili čvrste tvari ili tekućine ili plinovi. Mnogo je pitanja o svemu što nas okružuje. Daje odgovore na mnoga pitanja molekularno kinetička teorija.
Molekularno-kinetička teorija je skup pogleda koji se koriste za opisivanje uočenih i izmjerenih svojstava tvari na temelju proučavanja svojstava atoma i molekula date supstance, njihove interakcije i kretanja.
Osnovne odredbe teorije molekularne kinetike
Sva tijela su sastavljena od čestica – atoma, molekula, jona.
Sve čestice su u kontinuiranom haotičnom termičkom kretanju.
Između čestica bilo kojeg tijela postoje sile interakcije - privlačenja i odbijanja.
Dakle, u molekularno-kinetičkoj teoriji, predmet proučavanja je sistem koji se sastoji od velikog broja čestica - makrosistem. Da bi se objasnilo ponašanje takvog sistema, zakoni mehanike nisu primjenjivi. Stoga je glavna metoda istraživanja statistička metoda proučavanje svojstava materije.
Za objašnjavanje i predviđanje pojava važno je znati glavne karakteristike molekula:
- Dimenzije

Procjena veličine molekula može se napraviti kao veličina kocke a koja sadrži jedan molekul, na osnovu gustine čvrste tvari ili tečne supstance i masa jednog molekula:

- Masa molekula
Odnos mase supstance m na broj molekula N u ovoj supstanci:
- Relativna molekulska težina
Omjer mase molekula (ili atoma) date supstance i 1/12 mase atoma ugljika:
- Količina supstance
Količina supstance je jednaka omjeru broja čestica N u tijelu (atomi - u atomskoj tvari, molekuli - u molekuli) na broj molekula u jednom molu supstance NALI:

- Avogadrova konstanta
Broj molekula sadržanih u 1 molu supstance.
- Molarna masa
Molarna masa supstance je masa supstance uzeta u količini od 1 mol.
AT međunarodni sistem jedinicama izražava se molarna masa supstance kg/mol.
- Interakcija (kvantitativna zasnovana na iskustvima)

Interakciju molekula karakterizira i privlačenje i odbijanje u isto vrijeme: na udaljenostima r
Teorija molekularne kinetike omogućava razumijevanje zašto supstanca može biti u plinovitom, tekućem i čvrstom stanju. Sa stanovišta MKT-a, agregatna stanja se razlikuju u pogledu vrijednost prosječne udaljenosti između molekula i prirode kretanja molekula u odnosu na druge.
Glavne odredbe molekularne kinetičke teorije više puta su potvrđivane raznim fizičkim eksperimentima. Na primjer, istraživanje:
A) difuzija
B) Brownovo kretanje
Kratak sažetak
Molekularno-kinetička teorija objašnjava strukturu i svojstva tijela na osnovu kretanja i interakcije atoma, molekula i jona. MKT se zasniva na tri pozicije, koji su u potpunosti eksperimentalno i teorijski potvrđeni:
1) sva tijela se sastoje od čestica - molekula, atoma, jona;
2) čestice su u neprekidnom haotičnom toplotnom kretanju;
3) između čestica bilo kojeg tijela postoje sile interakcije - privlačenja i odbijanja.
Molekularna struktura supstance potvrđuje se direktnim posmatranjem molekula u elektronskim mikroskopima, kao i otapanjem čvrstih materija u tečnostima, kompresibilnošću i permeabilnosti supstance. Toplotno kretanje - Brownovo kretanje i difuzija. Prisustvo snage i elastičnosti međumolekulske interakcije čvrste materije, površinski napon tečnosti.
Referentni nacrt za lekciju:
Pitanja za samokontrolu u bloku "Osnovne odredbe molekularno-kinetičke teorije i njihova eksperimentalna utemeljenost"
- Formulirajte glavne odredbe molekularno-kinetičke teorije.
- Koja zapažanja i eksperimenti potvrđuju glavne odredbe molekularne kinetičke teorije?
- Šta je molekul? atom?
- Šta se naziva relativna molekulska težina? Koja formula izražava ovaj koncept?
- Kolika je količina supstance? Koja formula izražava ovaj koncept? Koja je jedinica količine neke supstance?
- Šta se naziva Avogadrova konstanta?
- Kolika je molarna masa supstance? Koja formula izražava značenje ovog koncepta? Šta je jedinica molarna masa?
- Kakva je priroda međumolekularnih sila?
- Koja su svojstva molekularnih sila?
- Kako sile interakcije zavise od udaljenosti između njih?
- Opišite prirodu kretanja molekula u plinovima, tekućinama i čvrstim tvarima.
- Koja je priroda pakovanja čestica u gasovima, tečnostima i čvrstim materijama?
- Kolika je prosječna udaljenost između molekula u plinovima, tekućinama i čvrstim tvarima?
- Navedite glavna svojstva gasova, tečnosti, čvrstih materija.
- Šta se naziva Brownovo kretanje?
- Šta ukazuje na Brownovo kretanje?
- Šta se zove difuzija? Navedite primjere difuzije u plinovima, tekućinama i čvrstim tvarima.
- 18. Kako brzina difuzije zavisi od temperature tijela?
DEFINICIJA
atom - najmanja čestica date hemijski element. Svi atomi koji postoje u prirodi predstavljeni su u Mendeljejevljevom periodičnom sistemu elemenata.
Atomi se spajaju u molekul hemijske veze na osnovu električna interakcija. Broj atoma u molekulu može biti različit. Molekul se može sastojati od jednog, dva, tri ili čak nekoliko stotina atoma.
DEFINICIJA
Molekula- najmanja čestica date supstance koja ima njena hemijska svojstva.
Teorija molekularne kinetike- doktrina o strukturi i svojstvima materije zasnovana na konceptu postojanja atoma i molekula.
Osnivač molekularne kinetičke teorije je M.V. Lomonosov (1711-1765), koji je formulisao njegove glavne odredbe i primenio ih da objasni različite termalne pojave.
Osnovne odredbe teorije molekularne kinetike
Glavne odredbe ICT-a:
- sva tijela u prirodi sastoje se od najmanjih čestica (atoma i molekula);
- čestice su u neprekidnom haotičnom kretanju, što se naziva termičkim;
- čestice međusobno djeluju: sile privlačenja i odbijanja djeluju između čestica, koje zavise od udaljenosti između čestica.
Teoriju molekularne kinetike potvrđuju mnoge pojave.
Mešanje različitih tečnosti, rastvaranje čvrstih materija u tečnostima, objašnjava se mešanjem molekula raznih vrsta. U tom slučaju, volumen smjese može se razlikovati od ukupne zapremine njenih sastavnih komponenti. što ukazuje na različite veličine molekularnih spojeva.
DEFINICIJA
Difuzija- fenomen prodiranja dvije ili više susjednih supstanci jedna u drugu.
Difuzija se najintenzivnije odvija u plinovima. Širenje mirisa je zbog difuzije. Difuzija ukazuje da su molekuli u stalnom haotičnom kretanju. Takođe, fenomen difuzije ukazuje da postoje praznine između molekula, tj. materija je diskretna.
DEFINICIJA
Brownovo kretanje- toplotno kretanje najmanjih mikroskopskih čestica suspendovanih u tečnosti ili gasu.
Ovu pojavu je prvi uočio engleski botaničar R. Brown 1827. Dok je posmatrao polen cvijeća suspendiran u vodi kroz mikroskop, vidio je da svaka čestica polena pravi brze nasumične pokrete, krećući se na određenoj udaljenosti. Kao rezultat pojedinačnih kretanja, svaka čestica polena kretala se cik-cak putanjom (slika 1a).
Fig.1. Braunovo kretanje: a) trajektorije kretanja pojedinačnih čestica suspendovanih u tečnosti; b) prijenos impulsa pomoću molekula tekućine na suspendiranu česticu.
Dalja istraživanja Brownovog kretanja u različitim tekućinama i različitim čvrstim česticama pokazala su da to kretanje postaje sve intenzivnije što je manja veličina čestica i što je temperatura eksperimenta viša. Ovo kretanje nikada ne prestaje i ne zavisi ni od kakvih spoljašnjih uzroka.
R. Brown nije mogao objasniti uočeni fenomen. Teoriju Brownovog kretanja izgradio je A. Einstein 1905. godine i dobila eksperimentalnu potvrdu u eksperimentima francuskog fizičara J. Perrina (1900-1911).
Molekuli tečnosti koji su u stalnom haotičnom kretanju, pri sudaru sa suspendovanom česticom prenose joj neki impuls (slika 1, b). U slučaju čestice velike veličine broj molekula koji ga napadaju sa svih strana je velik, njihovi udari se kompenzuju u svakom trenutku vremena, a čestica ostaje praktično nepomična. Ako je veličina čestica vrlo mala, onda se udari molekula ne kompenzuju - s jedne strane, može udariti više molekula nego s drugim, uslijed čega će se čestica početi kretati. Upravo takvo kretanje pod utjecajem nasumičnih udara molekula izvode Brownove čestice. Iako su Brownove čestice milijarde puta veće od mase pojedinačnih molekula i kreću se vrlo malim brzinama (u poređenju sa brzinama molekula), njihovo kretanje se još uvijek može promatrati pod mikroskopom.
Primjeri rješavanja problema
PRIMJER 1
PRIMJER 2
Teorija molekularne kinetike nazvana doktrina o strukturi i svojstvima materije zasnovana na ideji postojanja atoma i molekula kao najmanjih čestica hemijskih supstanci.
Teorija molekularne kinetike se zasniva na tri glavne tačke:
1.
Sve tvari - tekuće, čvrste i plinovite - formirane su od najsitnijih čestica - molekula, koje se same sastoje od atoma.
Molekule i atomi su električno neutralne čestice. Pod određenim uslovima, molekuli i atomi mogu dobiti dodatne električni naboj i pretvaraju se u pozitivne ili negativne ione.
2. Atomi i molekuli su u neprekidnom haotičnom kretanju.
3. Čestice međusobno djeluju silama koje su električne prirode. Gravitaciona interakcija između čestica
zanemariv.
Najupečatljivija eksperimentalna potvrda ideja molekularne kinetičke teorije o nasumičnom kretanju atoma i molekula je Brownovo kretanje.
Brownovo kretanje - e to je toplotno kretanje najmanjih mikroskopskih čestica suspendovanih u tečnosti ili gasu. Otkrio ga je engleski botaničar R. Brown.
Brownove čestice se kreću pod utjecajem slučajnih sudara molekula. Zbog haotičnog termičkog kretanja molekula, ovi udari nikada ne uravnotežuju jedan drugog. Kao rezultat toga, brzina Brownove čestice nasumično se mijenja u veličini i smjeru, a njena putanja je složena cik-cak kriva.
Stalno haotično kretanje molekula neke supstance manifestuje se i u još jednom lako uočljivom fenomenu - difuzija.
difuzijom Fenomen prodiranja dvije ili više susjednih supstanci jedna u drugu naziva se.
Proces se najbrže odvija u plinu ako je heterogen po sastavu. Difuzija dovodi do stvaranja homogene smjese, bez obzira na gustinu komponenti. Dakle, ako se u dva dijela posude, odvojena pregradom, nalaze kisik O 2 i vodik H 2, tada nakon uklanjanja pregrade počinje proces međusobnog prodiranja plinova jedan u drugi, što dovodi do stvaranja eksplozivna smjesa - eksplozivni plin.
Difuzija i Brownovo kretanje su povezani fenomeni. Međusobno prožimanje supstanci koje dodiruju jedna u drugu i nasumično kretanje najmanjih čestica suspendiranih u tekućini ili plinu nastaju zbog haotičnog toplinskog kretanja molekula.
Definirajte pojam "toplotni kapacitet". Koje se vrste toplotnih kapaciteta koriste u termotehničkim proračunima. Objasnite šta određuje toplotni kapacitet gasova? Zapišite Mayerovu jednačinu.
Toplotni kapacitet- vrijednost jednaka omjeru topline dovedene tijelu ili odvedene iz njega i odgovarajuće promjene njegove temperature: C= , [J/K]
gdje je C toplinski kapacitet; Q je dovedena (ili odvedena) toplota; ∆T je promjena tjelesne temperature.
U termičkim proračunima primijeniti različite vrste smanjeni toplotni kapaciteti (koji se odnose na jedinicu mase, količine i zapremine)
Maseni (ili specifični) toplotni kapacitet je omjer toplinskog kapaciteta tijela i njegove mase: c \u003d,
gdje je c maseni toplinski kapacitet; m - tjelesna težina.
molarni toplotni kapacitet je omjer toplinskog kapaciteta i količine tvari: µ c = ,
gdje je μ c molarni toplinski kapacitet; n je količina supstance.
Volumetrijski toplotni kapacitet je odnos toplotnog kapaciteta prema 1 m 3 gasa u normalnim uslovima: c`=,
gdje je c` volumetrijski toplinski kapacitet; v 0 je zapremina gasa u normalnim uslovima.
U SI, maseni toplinski kapacitet c mjeri se u J / kg * K, molarni toplinski kapacitet µ s - J / mol * K, volumetrijski toplinski kapacitet c "- J / m 3 * K.
Toplotni kapaciteti gasova i para su promenljivi; za idealnih gasova zavise od njihove temperature, a za stvarne gasove i pare takođe od njihovog pritiska.
Toplotni kapacitet gasova u velikoj meri zavisi od uslova u kojima se greju ili hlade. Među ovim procesima u tehnologiji najvažniji su procesi koji se odvijaju konstantan volumen gas (izohorni proces) i at konstantan pritisak gas (izobarni proces).
U tom smislu, razlikovati toplotni kapacitet pri konstantnoj zapremini(sa v) i toplotni kapacitet pri konstantnom pritisku(sa p).
Kvantitativni odnos između c p i c v postavlja se pomoću Mayerove jednadžbe: sa p − sa v = R, gdje je R univerzalna plinska konstanta.
Dakle, razlika između izobarnog i izohornog toplotnog kapaciteta za sve plinove je konstantna vrijednost i jednaka je univerzalnoj plinskoj konstanti.
Definirajte pojam " disperzovanim sistemima". Navedite dvije glavne karakteristike disperznih sistema. Kako se klasifikuju disperzni sistemi? Koristeći svaku karakteristiku, opišite disperzne sisteme.
raspršen nazivaju se sistemi koji se sastoje od mnogo malih čestica raspoređenih u tečnom, čvrstom ili gasovitom mediju.
Sve disperzne sisteme karakteriše dvije glavne karakteristike: visoka fragmentacija (disperzija) i heterogenost.
Heterogenost disperznih sistema se manifestuje u činjenici da se ovi sistemi sastoje od dve (ili više) faza. Svi dispergovani sistemi se sastoje od kontinuirane faze - disperzioni medij i diskontinuirana faza (čestice) - disperzovana faza.
Visoka disperzija daje tvarima nove kvalitativne karakteristike: povećanu reaktivnost i topljivost, intenzitet boje, raspršivanje svjetlosti itd.
Klasifikacija dispergovanih sistema izvedeno na osnovu različitih karakteristika, i to: 1) po veličini čestica, 2) po stanju agregacije dispergirane faze i disperzionog medija, 3) po prirodi interakcije čestica dispergirane faze sa svakim drugo i sa medijumom.
U zavisnosti od veličine čestica disperzni sistemi su podeljeni u grupe:
1) grubi sistemi - sistemi u kojima čestice imaju veličinu od 1000 nm ili više;
2) koloidni sistemi - čestice su veličine od 1 do 500 nm.
3) prava rješenja - čestice imaju veličinu do 1 nm.
Prema agregacijskom stanju dispergirane faze i disperzione sredine sistemi su klasifikovani na sledeći način:
S obzirom na odnos koloidnih čestica prema disperzionom mediju razlikovati liofilne i liofobne sisteme ( sa grčkog "philia" - ljubav, "phobia" - mržnja).
Liofilni sistemi- one u kojima su koloidne čestice povezane s molekulima disperzijskog medija i imaju njihovu ljusku (ako je disperzioni medij voda, sistemi se nazivaju hidrofilni). Na primjer, liofilni koloidni sistemi uključuju otopine nastale rastvaranjem prirodnih ili sintetičkih spirala. To su otopine proteina, škroba, etera celuloze i raznih smola, prirodnih i sintetičkih.
Liofobni sistemi(hidrofobni) - oni kod kojih su koloidne čestice slabo vezane za molekule disperzijskog medija ili otapala. Na primjer, liofobni sistemi uključuju solove plemenitih metala, solove sumpora, solove željeza i aluminija hidroksida itd. Ove sisteme karakteriše agregatna nestabilnost i zahtevaju stabilizaciju.
7. Definirajte pojam "hemijske ravnoteže". Formulirajte Le Chatelierov princip. Obrazložite kako promjene tlaka utiču na ravnotežni položaj reakcije: N 2 +3H 2 ⇄2NH 3 . Za ovaj proces napišite izraz za konstantu ravnoteže i predvidite njenu vrijednost ako su ravnotežne koncentracije reaktanata dušika, vodika i amonijaka 3 mol/l, 9 mol/l, 4 mol/l, respektivno.
Hemijska ravnoteža
Za sistem u hemijskoj ravnoteži, koncentracije reagensa, temperatura i drugi parametri sistema se ne menjaju tokom vremena.
Le Chatelierov princip: ako se na sistem u stanju ravnoteže djeluje izvana, mijenjajući bilo koji od uvjeta ravnoteže (temperaturu, tlak, koncentraciju), tada se intenziviraju procesi u sistemu, usmjereni na kompenzaciju (ili slabljenje) vanjskog utjecaja.
Reakcija N 2 + 3H 2 ⇄ 2NH 3 odvija se uz učešće gasovitih materija i reverzibilan je. Pritisak značajno utiče na položaj ravnoteže u takvim reakcijama, jer praćeni su promjenom volumena zbog promjene količine tvari pri prijelazu iz polaznih tvari u produkte reakcije: s povećanjem tlaka, ravnoteža se pomiče u smjeru u kojem je ukupan broj molova gasova se smanjuje i obrnuto.
Prema jednadžbi reakcije N 2 + 3H 2 ⇄ 2NH 3 može se vidjeti da je količina početnih plinovitih tvari 4 mol (1 mol dušika i 3 mola vodonika), a količina plinovitih proizvoda 2 mol ( 2 mol amonijaka). Shodno tome, sa povećanjem pritiska, hemijska ravnoteža će se pomeriti udesno, prema manjoj količini gasovitih materija, a sa smanjenjem pritiska, ulevo, prema polaznim supstancama.
Konstanta ravnoteže- vrijednost koja za datu kemijsku reakciju određuje omjer između termodinamičkih aktivnosti (ili, ovisno o uvjetima reakcije, parcijalni pritisci, koncentracije) polaznih supstanci i proizvoda u stanju hemijske ravnoteže (u skladu sa zakonom o delovanju mase). Poznavajući konstantu ravnoteže reakcije, moguće je izračunati ravnotežni sastav reakcione smjese, granični prinos proizvoda i odrediti smjer reakcije.
Dato:\u003d 3 mol / l, \u003d 9 mol / l, \u003d 4 mol / l
Pronađite: K sa -?
Rješenje: 1) Napišimo jednačinu reakcije N 2 +3H 2 ⇄2NH 3
2) Konstanta ravnoteže za ovu reakciju ima izraz: K c \u003d 2 / * 3; 3) izračunajte konstantu ravnoteže K c = 4 2 / 3 * 9 3 = 0,0073
odgovor: K c \u003d 0,0073
8. Definirajte pojam "disperzni sistem". Dajte klasifikaciju dispergovanih sistema prema stanju agregacije dispergovane faze i dispergovanog medija. Ova saznanja sistematizirati i odrediti agregacijsko stanje dispergirane faze i disperzione sredine za predložene sisteme: ulje; prašnjavi vazduh. Predvidjeti i objasniti stabilnost ovih koloidnih sistema.
Disperzni sistem- to su formacije od dvije ili više faza (tijela) koje se uopće ili praktično ne miješaju i kemijski ne reagiraju jedna na drugu.
Većina opšta klasifikacija disperznih sistema zasniva se na razlici u agregacijskom stanju disperzione sredine i dispergirane faze. Kombinacije tri vrste stanje agregacije omogućavaju razlikovanje devet tipova dispergovanih sistema. Radi kratkoće, obično se označavaju razlomkom, čiji brojnik označava disperziranu fazu, a nazivnik označava disperzioni medij, na primjer, za sistem "gas u tekućini", usvojena je oznaka G/L.
| Oznaka | Disperzovana faza | Disperzioni medij | Ime i primjer |
| Y/Y | gasoviti | gasoviti | Disperzioni sistem nije formiran |
| F/G | Tečnost | gasoviti | Aerosoli: magle, oblaci |
| T/Y | solidan | gasoviti | Aerosoli (prašina, isparenja), praškovi |
| G/F | gasoviti | Tečnost | Plinske emulzije i pjene |
| Ž/Ž | Tečnost | Tečnost | Emulzije: ulje, kajmak, mleko |
| T/F | solidan | Tečnost | Suspenzije i soli: pulpa, mulj, suspenzija, pasta |
| G/T | gasoviti | solidan | porozna tijela |
| F/T | Tečnost | solidan | Kapilarni sistemi: tečnost u poroznim tijelima, tlo, tlo |
| T/T | solidan | solidan | Čvrsti heterogeni sistemi: legure, beton, kompozitni materijali |
Zauzvrat, ovi sistemi su klasifikovani prema stepenu disperzije.
Sistemi sa česticama dispergovane faze iste veličine nazivaju se monodisperzni, a sistemi sa česticama različitih veličina polidisperzni. Po pravilu, stvarni sistemi koji nas okružuju su polidisperzni.
Stabilnost dispergovanih sistema je mogućnost da budu u početnom stanju neograničeno dugo vremena.
Stabilnost dispergovanih sistema može biti:
1. Na padavine
disperzovana faza - karakteriše sposobnost dispergovanog sistema da održi ravnotežnu distribuciju faze po zapremini disperzione sredine ili njenu otpornost na razdvajanje faza. Ovo svojstvo se zove sedimentacija (kinetička) održivost .
2. U pravcu agregacije
njegove čestice. Agregatna stabilnost
je sposobnost dispergovanog sistema da zadrži stepen disperzije nepromenjen tokom vremena, tj. veličine čestica i njihove individualnosti.
To je zbog sposobnosti dispergovanih sistema da formiraju agregate (tj. da rastu). U pogledu agregacije, disperzovani sistemi mogu biti stabilni kinetički
i termodinamički
. Termodinamički stabilni sistemi nastaju kao rezultat spontane disperzije jedne od faza, tj. spontano formiranje heterogenog sistema.
Disperzioni sistem: prašnjavi vazduh se sastoji od gasovitog disperzionog medija i čvrste disperzione faze. Ovaj sistem je kinetički i agregatno nestabilan.
Disperzioni sistem: ulje se sastoji od tečnog disperzionog medija i tečne disperzione faze. A sistem je kinetički i agregatno stabilan.
9. Definirajte pojam "promjene hemijske ravnoteže". Komentirajte koji faktori utiču, a koji ne utiču na položaj hemijske ravnoteže? Formulirajte Le Chatelierov princip. Predvidite u kojem se smjeru pomiče ravnoteža s povećanjem tlaka, temperature, koncentracije početnih tvari za reakciju:
+CaCO3 + O(para)⇄Ca(HCO 3 +Q
Hemijska ravnoteža- dinamičko stanje hemijskog sistema u kojem se hemijska reakcija odvija reverzibilno, a brzine direktne i reverzne reakcije su jedna drugoj.
Položaj hemijske ravnoteže zavisi od sledećih parametara reakcije: temperature, pritiska i koncentracije. Promjena ovih parametara uzrokuje promjenu brzina strujanja hemijske reakcije i pomera hemijsku ravnotežu.
Faktori koji utiču na hemijsku ravnotežu: temperatura, pritisak, koncentracija.
1) temperatura: kada temperatura raste, hemijska ravnoteža se pomera ka endotermnoj (apsorpcionoj) reakciji, a kada se smanjuje, ka egzotermnoj (izolacionoj) reakciji.
2) pritisak: kada se pritisak povećava, hemijska ravnoteža se pomera ka manjoj zapremini supstanci, a kada se smanjuje, ka većoj zapremini. Ovaj princip se odnosi samo na gasove, tj. ako učestvuju u reakciji čvrste materije, oni se ne uzimaju u obzir.
3) koncentracija polaznih supstanci i produkta reakcije
Sa povećanjem koncentracije jedne od polaznih supstanci, hemijska ravnoteža se pomera prema produktima reakcije, a sa povećanjem koncentracije produkta reakcije prema polaznim supstancama.






