H hemijska veza. Karakteristike hemijske veze
Svaki atom ima određeni broj elektrona.
Ulazak u hemijske reakcije, atomi doniraju, stiču ili socijaliziraju elektrone, dostižući najstabilniju elektronsku konfiguraciju. Konfiguracija sa najnižom energijom je najstabilnija (kao kod atoma plemenitog gasa). Ovaj obrazac se naziva "pravilo okteta" (slika 1).
Rice. jedan.
Ovo pravilo važi za sve vrste veza. Elektronske komunikacije između atoma omogućavaju im da formiraju stabilne strukture, od najjednostavnijih kristala do složenih biomolekula koji na kraju formiraju žive sisteme. Od kristala se razlikuju po kontinuiranom metabolizmu. Međutim, mnoge kemijske reakcije se odvijaju prema mehanizmima elektronski transfer, koji igraju važnu ulogu u energetskim procesima u tijelu.
Hemijska veza je sila koja drži zajedno dva ili više atoma, jona, molekula ili bilo koju njihovu kombinaciju..
Priroda hemijska veza univerzalna: to je elektrostatička sila privlačenja između negativno nabijenih elektrona i pozitivno nabijenih jezgara, određena konfiguracijom elektrona u vanjskom omotaču atoma. Sposobnost atoma da formira hemijske veze naziva se valence, ili oksidacijskom stanju. Koncept od valentnih elektrona - elektroni koji formiraju hemijske veze, odnosno one koji se nalaze u najvisokoenergetskim orbitalama. Prema tome, vanjski omotač atoma koji sadrži ove orbitale naziva se valentna ljuska. Trenutno nije dovoljno ukazati na prisustvo hemijske veze, već je potrebno razjasniti njen tip: jonska, kovalentna, dipol-dipolna, metalna.
Prva vrsta veze jejonski veza
Prema Lewisovoj i Kosselovoj elektronskoj teoriji valencije, atomi mogu postići stabilnu elektronsku konfiguraciju na dva načina: prvo, gubljenjem elektrona, postajući katjoni, drugo, njihovo sticanje, pretvaranje u anjoni. Kao rezultat prijenosa elektrona, zbog elektrostatičke sile privlačenja između jona s nabojima suprotnog predznaka, formira se kemijska veza, nazvana Kossel " elektrovalentan(sada se zove jonski).
U ovom slučaju, anioni i kationi formiraju stabilnu elektronsku konfiguraciju s ispunjenom vanjskom elektronskom ljuskom. Tipične ionske veze formiraju se od katjona T i II grupa periodnog sistema i anjona nemetalnih elemenata grupa VI i VII (16 i 17 podgrupa - respektivno, halkogeni i halogeni). Veze u jonskim jedinjenjima su nezasićene i neusmjerene, pa zadržavaju mogućnost elektrostatičke interakcije s drugim ionima. Na sl. 2 i 3 prikazuju primjere jonskih veza koje odgovaraju Kosselovom modelu prijenosa elektrona.
Rice. 2.
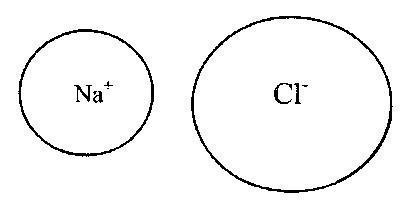
Rice. 3. Jonska veza u molekulu natrijum hlorida (NaCl).
Ovdje je prikladno podsjetiti se nekih svojstava koja objašnjavaju ponašanje tvari u prirodi, posebno razmotriti koncept kiseline i osnove.
Vodene otopine svih ovih tvari su elektroliti. Mijenjaju boju na različite načine. indikatori. Mehanizam djelovanja indikatora otkrio je F.V. Ostwald. Pokazao je da su indikatori slabe kiseline ili baze, čija je boja u nedisocijacijskom i disociranom stanju različita.
Baze mogu neutralizirati kiseline. Nisu sve baze rastvorljive u vodi (na primer, neka organska jedinjenja koja ne sadrže -OH grupe su nerastvorljiva, posebno, trietilamin N (C 2 H 5) 3); rastvorljive baze se nazivaju alkalije.
Vodene otopine kiselina ulaze u karakteristične reakcije:
a) sa oksidima metala - sa stvaranjem soli i vode;
b) sa metalima - sa stvaranjem soli i vodonika;
c) sa karbonatima - sa stvaranjem soli, CO 2 i H 2 O.
Svojstva kiselina i baza opisuje nekoliko teorija. U skladu sa teorijom S.A. Arrhenius, kiselina je supstanca koja se disocira i formira jone H+ , dok baza formira jone HE- . Ova teorija ne uzima u obzir postojanje organskih baza koje nemaju hidroksilne grupe.
U skladu sa proton Bronstedova i Lowryjeva teorija, kiselina je supstanca koja sadrži molekule ili ione koji doniraju protone ( donatori protoni), a baza je supstanca koja se sastoji od molekula ili jona koji prihvataju protone ( akceptori protoni). Imajte na umu da u vodenim otopinama ioni vodika postoje u hidratiziranom obliku, odnosno u obliku hidronijevih iona H3O+ . Ova teorija opisuje reakcije ne samo s vodom i hidroksidnim ionima, već se također odvijaju u odsustvu rastvarača ili s nevodenim otapalom.
Na primjer, u reakciji između amonijaka NH 3 (slaba baza) i hlorovodonika u gasnoj fazi nastaje čvrst amonijum hlorid, a u ravnotežnoj smeši dve supstance uvek se nalaze 4 čestice od kojih su dve kiseline, a druge dve baze:
Ova ravnotežna smjesa se sastoji od dva konjugirana para kiselina i baza:
1)NH 4+ i NH 3
2) HCl i Cl ‑
Ovdje se u svakom konjugiranom paru kiselina i baza razlikuju za jedan proton. Svaka kiselina ima konjugovanu bazu. Jaka kiselina ima slabu konjugiranu bazu, a slaba kiselina ima jaku konjugiranu bazu.
Teorija Bronsted-Lowryja omogućava objašnjenje jedinstvene uloge vode za život biosfere. Voda, ovisno o tvari koja s njom stupa u interakciju, može pokazati svojstva kiseline ili baze. Na primjer, u reakcijama s vodenim otopinama octene kiseline, voda je baza, a s vodenim otopinama amonijaka kiselina.
1) CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 SOO- . Ovdje molekul sirćetne kiseline donira proton molekuli vode;
2) NH3 + H 2 O ↔ NH4 + + HE- . Ovdje molekul amonijaka prihvata proton iz molekule vode.
Dakle, voda može formirati dva konjugirana para:
1) H 2 O(kiselina) i HE- (konjugirana osnova)
2) H 3 O+ (kiselina) i H 2 O(konjugirana baza).
U prvom slučaju voda donira proton, au drugom ga prihvata.
Takvo svojstvo se zove amfiprotonitet. Supstance koje mogu reagovati i kao kiseline i baze nazivaju se amfoterično. Takve tvari se često nalaze u prirodi. Na primjer, aminokiseline mogu formirati soli i sa kiselinama i sa bazama. Stoga, peptidi lako formiraju koordinaciona jedinjenja sa prisutnim metalnim jonima.
Dakle, karakteristično svojstvo ionske veze je potpuno pomicanje gomile vezanih elektrona na jedno od jezgara. To znači da postoji oblast između jona u kojoj je gustina elektrona skoro nula.
Druga vrsta veze jekovalentna veza
Atomi se mogu formirati stabilno elektronske konfiguracije dijeljenjem elektrona.
Takva veza nastaje kada se par elektrona dijeli jedan po jedan. od svake atom. U ovom slučaju, socijalizirani vezni elektroni su ravnomjerno raspoređeni među atomima. Primjer kovalentne veze je homonuklearni dijatomski H molekuli 2 , N 2 , F 2. Alotropi imaju isti tip veze. O 2 i ozon O 3 i za poliatomsku molekulu S 8 i takođe heteronuklearne molekule hlorovodonik HCl, ugljen-dioksid CO 2, metan CH 4, etanol OD 2 H 5 HE, sumpor heksafluorid SF 6, acetilen OD 2 H 2. Svi ovi molekuli imaju iste zajedničke elektrone, a njihove veze su zasićene i usmjerene na isti način (slika 4).
Za biologe je važno da su kovalentni radijusi atoma u dvostrukim i trostrukim vezama smanjeni u odnosu na jednostruku vezu.
![]()
Rice. četiri. Kovalentna veza u Cl 2 molekulu.
Jonski i kovalentni tipovi veza su dva granična slučaja skupa postojeće vrste hemijske veze, au praksi je većina veza međusrednja.
Jedinjenja dva elementa koja se nalaze na suprotnim krajevima istog ili različitog perioda Mendeljejevskog sistema pretežno formiraju jonske veze. Kako se elementi približavaju jedan drugom u određenom periodu, jonska priroda njihovih spojeva se smanjuje, dok se kovalentni karakter povećava. Na primjer, halogenidi i oksidi elemenata na lijevoj strani periodnog sistema formiraju pretežno ionske veze ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH), a ista jedinjenja elemenata na desnoj strani tabele su kovalentna ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glukoza C 6 H 12 O 6, etanol C 2 H 5 OH).
Kovalentna veza, zauzvrat, ima još jednu modifikaciju.
U poliatomskim ionima i u složenim biološkim molekulima oba elektrona mogu doći samo iz jedan atom. To se zove donator elektronski par. Atom koji povezuje ovaj par elektrona sa donorom naziva se akceptor elektronski par. Ova vrsta kovalentne veze naziva se koordinacija (donator-akceptor, ilidativ) komunikacija(Sl. 5). Ova vrsta veze je najvažnija za biologiju i medicinu, budući da je hemija najvažnijih d-elemenata za metabolizam u velikoj mjeri opisana koordinacijskim vezama.
![]()
Slika. 5.
U pravilu, u kompleksnom spoju, atom metala djeluje kao akceptor elektronskog para; naprotiv, u jonskim i kovalentnim vezama, atom metala je donor elektrona.
Suština kovalentne veze i njena raznolikost - koordinaciona veza - može se razjasniti uz pomoć druge teorije kiselina i baza, koju je predložio GN. Lewis. On je donekle proširio semantički koncept pojmova "kiselina" i "baza" prema teoriji Bronsted-Lowryja. Lewisova teorija objašnjava prirodu stvaranja kompleksnih jona i učešće supstanci u reakcijama nukleofilne supstitucije, odnosno u stvaranju CS.
Prema Lewisu, kiselina je supstanca sposobna da formira kovalentnu vezu prihvatanjem elektronskog para iz baze. Lewisova baza je supstanca koja ima usamljeni par elektrona, koji doniranjem elektrona formira kovalentnu vezu sa Lewisovom kiselinom.
Odnosno, Lewisova teorija proširuje raspon kiselinsko-baznih reakcija i na reakcije u kojima protoni uopće ne učestvuju. Štaviše, sam proton je, prema ovoj teoriji, također kiselina, jer je u stanju prihvatiti elektronski par.
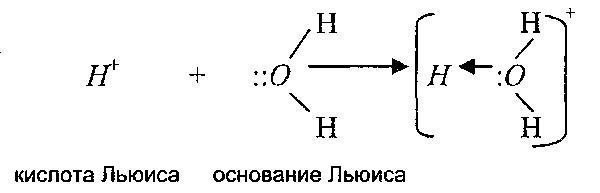
Prema tome, prema ovoj teoriji, kationi su Lewisove kiseline, a anioni su Lewisove baze. Sljedeće reakcije su primjeri:
Gore je napomenuto da je podjela tvari na ionske i kovalentne relativna, jer ne postoji potpuni prijelaz elektrona s atoma metala na atome akceptora u kovalentnim molekulima. U spojevima s ionskom vezom svaki ion je u električnom polju jona suprotnog predznaka, pa su međusobno polarizirani, a njihove školjke su deformirane.
Polarizabilnost odlučan elektronska struktura, naboj i veličina jona; veća je za anjone nego za katjone. Najveća polarizabilnost među kationima je za katione većeg naboja i manje veličine, na primjer, for Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Ima snažan polarizirajući efekat H+ . Pošto je efekat polarizacije jona dvostrani, značajno menja svojstva jedinjenja koja formiraju.
Treća vrsta veze -dipol-dipol veza
Pored navedenih vrsta komunikacije, postoje i dipol-dipol intermolekularni interakcije, takođe poznate kao van der Waals .
Snaga ovih interakcija ovisi o prirodi molekula.
Postoje tri vrste interakcija: permanentni dipol - permanentni dipol ( dipol-dipol atrakcija); permanentni dipol - inducirani dipol ( indukcija atrakcija); trenutni dipol - inducirani dipol ( disperzija privlačnost, ili londonske sile; pirinač. 6).

Rice. 6.
Samo molekuli s polarnim kovalentnim vezama imaju dipol-dipolni moment ( HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl), a snaga veze je 1-2 debye(1D \u003d 3,338 × 10 -30 kulona - C × m).
U biohemiji se razlikuje još jedna vrsta veze - vodonik vezu, što je ograničavajući slučaj dipol-dipol atrakcija. Ova veza nastaje privlačenjem između atoma vodika i malog elektronegativnog atoma, najčešće kisika, fluora i dušika. Kod velikih atoma koji imaju sličnu elektronegativnost (na primjer, s klorom i sumporom), vodikova veza je mnogo slabija. Atom vodika se razlikuje po jednoj bitnoj osobini: kada se vezani elektroni povuku, njegovo jezgro - proton - je izloženo i prestaje da bude zaštićeno elektronima.
Stoga se atom pretvara u veliki dipol.
Vodikova veza, za razliku od van der Waalsove, nastaje ne samo tokom međumolekularnih interakcija, već i unutar jedne molekule - intramolekularno vodoničnu vezu. Vodikove veze igraju važnu ulogu u biohemiji, na primjer, za stabilizaciju strukture proteina u obliku α-heliksa, ili za formiranje dvostruke spirale DNK (slika 7).
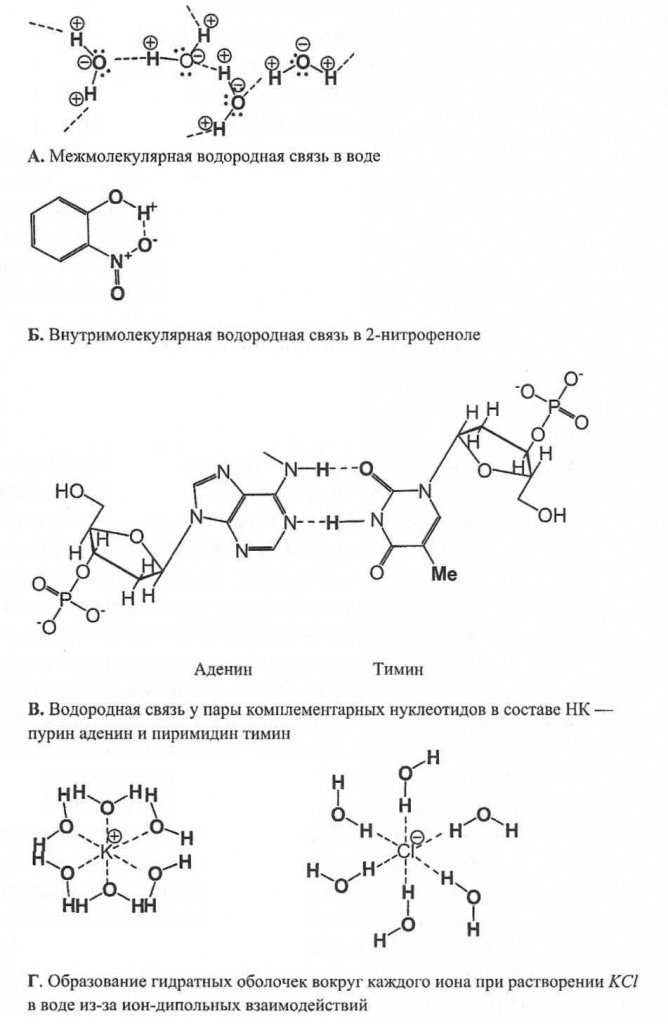
Fig.7.
Vodikove i van der Waalsove veze su mnogo slabije od ionskih, kovalentnih i koordinacionih veza. Energija međumolekulskih veza je prikazana u tabeli. jedan.
Tabela 1. Energija međumolekularnih sila
Bilješka: Stepen međumolekularnih interakcija odražava entalpiju topljenja i isparavanja (ključanja). Jonska jedinjenja zahtijevaju mnogo više energije za razdvajanje jona nego za razdvajanje molekula. Entalpije topljenja jonskih jedinjenja su mnogo veće od onih molekularnih jedinjenja.
Četvrta vrsta veze -metalna veza
Konačno, postoji još jedna vrsta međumolekulskih veza - metal: veza pozitivni joni rešetke metala sa slobodnim elektronima. Ova vrsta veze se ne javlja u biološkim objektima.
Od pregled vrstama veza, jedan detalj je pojašnjen: važan parametar atoma ili jona metala - donor elektrona, kao i atom - akceptor elektrona je njegov veličina.
Ne ulazeći u detalje, napominjemo da se kovalentni radijusi atoma, ionski radijusi metala i van der Waalsovi radijusi molekula u interakciji povećavaju kako raste njihov atomski broj u grupama periodnog sistema. U ovom slučaju, vrijednosti radijusa jona su najmanje, a van der Waalsovi polumjeri najveći. Po pravilu, pri kretanju niz grupu, radijusi svih elemenata se povećavaju, kako kovalentnih tako i van der Waalsovih.
Najvažnije za biologe i ljekare su koordinacija(donor-akceptor) veze koje razmatra koordinaciona hemija.
Medicinska bioanorganika. G.K. Barashkov
Hemijske čestice nastale od dva ili više atoma nazivaju se molekule(stvarno ili uslovno jedinice formule poliatomske supstance). Atomi u molekulima su hemijski vezani.
Pod hemijskom vezom se misli električne sile privlačnost koja drži čestice zajedno. Svaka hemijska veza u strukturne formule izgleda valentna linija, na primjer:
H - H (veza između dva atoma vodonika);
H 3 N - H + (veza između atoma dušika molekule amonijaka i vodonikovog kationa);
(K +) - (I -) (veza između kalijum katjona i jodidnog jona).
Hemijsku vezu formira par elektrona ( ), koji se u elektronskim formulama složenih čestica (molekula, kompleksnih jona) obično zamjenjuje valentnom linijom, za razliku od njihovih vlastitih, nepodijeljenih elektronskih parova atoma, na primjer:
Hemijska veza se naziva kovalentno, ako nastane socijalizacijom para elektrona od strane oba atoma.
U molekuli F 2 oba atoma fluora imaju istu elektronegativnost, pa im je posedovanje elektronskog para isto. Takva hemijska veza se naziva nepolarna, jer ima svaki atom fluora elektronska gustina isto u elektronska formula molekule se mogu uslovno podijeliti između njih podjednako:
U molekulu HCl, hemijska veza već postoji polarni, budući da je elektronska gustina na atomu hlora (element sa većom elektronegativnošću) mnogo veća nego na atomu vodika:
Kovalentna veza, na primjer H - H, može se formirati dijeljenjem elektrona dva neutralna atoma:
H + H > H – H
Ovaj mehanizam vezivanja se zove razmjena ili ekvivalentno.
Prema drugom mehanizmu, ista kovalentna veza H - H nastaje kada je elektronski par hidridnog jona H socijalizovan od strane vodikovog katjona H +:
H + + (:H) - > H - H
H + kation u ovom slučaju se zove akceptor i anjon H - donator elektronski par. Mehanizam formiranja kovalentne veze u ovom slučaju će biti donor-akceptor, ili koordiniranje.
Jednostruke veze (H - H, F - F, H - CI, H - N) nazivaju se a-linkovi, oni određuju geometrijski oblik molekula.
Dvostruke i trostruke veze () sadrže jednu?-komponentu i jednu ili dvije?-komponente; ?-komponenta, koja je glavna i uslovno formirana prva, uvijek je jača od?-komponente.
Fizičke (zapravo mjerljive) karakteristike hemijske veze su njena energija, dužina i polaritet.
Energija hemijske veze (E cv) je toplota koja se oslobađa tokom formiranja ove veze i troši se na njeno raskidanje. Za iste atome, jednostruka veza je uvijek slabiji nego višestruka (dvostruka, trostruka).
Dužina hemijske veze (l s) - međunuklearna udaljenost. Za iste atome, jednostruka veza je uvijek duže nego višestruka.
Polaritet komunikacija se mjeri električni dipolni moment str- proizvod stvarnog električnog naboja (na atomima date veze) dužine dipola (tj. dužine veze). Što je veći dipolni moment, veći je polaritet veze. Real električnih naboja na atomima u kovalentnoj vezi je uvijek manje vrijednosti od oksidacijskih stanja elemenata, ali se poklapaju u predznaku; na primjer, za H + I -Cl -I vezu, pravi naboji su H +0 "17 -Cl -0" 17 (bipolarna čestica ili dipol).
Polaritet molekula određena njihovim sastavom i geometrijskim oblikom.
Nepolarni (p = O) bice:
a) molekule jednostavno tvari, jer sadrže samo nepolarne kovalentne veze;
b) poliatomski molekule teško tvari, ako je njihov geometrijski oblik simetrično.
Na primjer, molekule CO 2, BF 3 i CH 4 imaju sljedeće smjerove vektora jednakih (dužnih) veza:
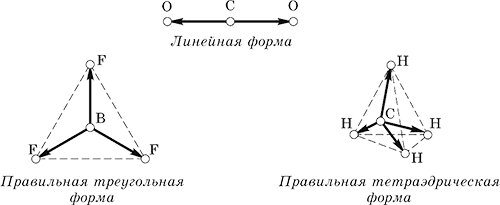
Kada se dodaju vektori veze, njihov zbir uvijek nestaje, a molekuli kao cjelina su nepolarni, iako sadrže polarne veze.
Polar (str> O) bit će:
a) dijatomski molekule teško tvari, jer sadrže samo polarne veze;
b) poliatomski molekule teško tvari, ako je njihova struktura asimetrično, odnosno njihov geometrijski oblik je ili nepotpun ili izobličen, što dovodi do pojave totalnog električnog dipola, na primjer, u molekulima NH 3, H 2 O, HNO 3 i HCN.
Kompleksni joni, kao što su NH 4 + , SO 4 2- i NO 3 - , u principu ne mogu biti dipoli, oni nose samo jedno (pozitivno ili negativno) naelektrisanje.
Jonska veza nastaje tokom elektrostatičkog privlačenja kationa i anjona bez gotovo socijalizacije para elektrona, na primjer, između K + i I -. Atom kalija ima nedostatak elektronske gustine, atom joda ima višak. Ova veza se razmatra ograničavajući slučaju kovalentne veze, pošto je par elektrona praktično u posedu anjona. Takva veza je najtipičnija za spojeve tipičnih metala i nemetala (CsF, NaBr, CaO, K 2 S, Li 3 N) i tvari klase soli (NaNO 3, K 2 SO 4, CaCO 3). Sva ova jedinjenja u sobnim uslovima su kristalne supstance koji se ujedinjuju uobičajeno imejonski kristali(kristali izgrađeni od kationa i aniona).
Postoji još jedna vrsta veze koja se zove metalna veza, u kojoj su valentni elektroni toliko labavo držani atomima metala da zapravo ne pripadaju određenim atomima.
Atomi metala, koji su ostali bez vanjskih elektrona koji im jasno pripadaju, postaju, takoreći, pozitivni ioni. Oni se formiraju metalna kristalna rešetka. Skup socijaliziranih valentnih elektrona ( elektronski gas) drži pozitivne ione metala zajedno i na određenim mjestima rešetke.
Pored jonskih i metalnih kristala, postoje i kristali atomski i molekularni kristalne tvari, u čijim se mjestima rešetke nalaze atomi, odnosno molekuli. Primjeri: dijamant i grafit - kristali s atomskom rešetkom, jod I 2 i ugljični dioksid CO 2 (suhi led) - kristali s molekularnom rešetkom.
Hemijske veze postoje ne samo unutar molekula tvari, već se mogu formirati i između molekula, na primjer, za tekući HF, vodu H 2 O i mješavinu H 2 O + NH 3:
vodoničnu vezu nastaje zbog sila elektrostatičkog privlačenja polarnih molekula koje sadrže atome najelektronegativnijih elemenata - F, O, N. Na primjer, vodikove veze su prisutne u HF, H 2 O i NH 3, ali ih nema u HCl, H 2 S i PH 3.
Vodikove veze su nestabilne i prilično lako pucaju, na primjer, kada se led otopi i voda proključa. Međutim, na razbijanje ovih veza troši se nešto dodatne energije, a samim tim i tačke topljenja (tabela 5) i tačke ključanja supstanci sa vodikovim vezama

(na primjer, HF i H 2 O) su znatno veće nego za slične tvari, ali bez vodikovih veza (na primjer, HCl i H 2 S).
Mnoga organska jedinjenja takođe formiraju vodonične veze; Vodikova veza igra važnu ulogu u biološkim procesima.
Primjeri zadataka dijela A1. Supstance sa samo kovalentnim vezama su
1) SiH 4, Cl 2 O, CaBr 2
2) NF 3, NH 4 Cl, P 2 O 5
3) CH 4 , HNO 3 , Na(CH 3 O)
4) CCl 2 O, I 2, N 2 O
2–4. kovalentna veza
2. samac
3. duplo
4. trostruko
prisutan u materiji
5. Višestruke veze su prisutne u molekulima
6. Čestice koje se nazivaju radikali su
7. Jednu od veza formira mehanizam donor-akceptor u setu jona
1) SO 4 2-, NH 4 +
2) H 3 O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 + , SO 3 2-
8. Najizdržljiviji i kratko veza - u molekulu
9. Supstance samo sa jonskim vezama - u kompletu
2) NH 4 Cl, SiCl 4
10–13. Kristalna rešetka materije
13. Va (OH) 2
1) metal
3) nuklearni
Najvažnije karakteristike veze uključuju: dužinu, polaritet, dipolni moment, zasićenost, usmjerenost, snagu i višestrukost veza.
Dužina komunikacije je udaljenost između jezgara atoma u molekulu. Dužina veze je određena veličinom jezgara i stepenom preklapanja elektronskih oblaka.
Dužina veze u HF je 0,92∙10 -10, u HCl - 1,28∙10 -10 m. Što je hemijska veza jača to je njena dužina kraća.
Ugao veze (valentni ugao) naziva se ugao između zamišljenih linija koje prolaze kroz jezgra hemijski vezanih atoma. ∟HOH=104 0,5; ∟H 2 S \u003d 92,2 0; ∟H 2 S e \u003d 91 0,0.
Najvažnija karakteristika hemijske veze je energije, definišući ga snagu.
Kvantitativno, snagu veze karakterizira energija utrošena na njeno raskidanje, a mjeri se u kJ po 1 molu supstance.
Stoga, snaga veze kvantitativno karakterizira energiju sublimacije E subl. tvari i energija disocijacije molekula na atome E diss. . Energija sublimacije se podrazumijeva kao energija koja se troši za prijelaz tvari iz čvrsto stanje u gasovito. Za dvoatomske molekule, energija vezivanja jednaka je energiji disocijacije molekula na dva atoma.
Na primjer, E diss. (a samim tim i E St.) u molekulu H 2 je 435 kJ/mol. U molekulu F 2 = 159 kJ / mol, u molekulu N 2 = 940 kJ / mol.
Za ne dvoatomske, već poliatomske molekule tipa AB, n je prosječna energija vezivanja
zbog AB n \u003d A + nB.
Na primjer, energija apsorbirana u procesu
je jednako 924 kJ/mol.
Energija veze
E OH = = = = 462 kJ/mol.
Zaključak o strukturi molekula i strukturi tvari donosi se prema rezultatima dobivenim različitim metodama. U ovom slučaju, dobivene informacije se koriste ne samo o dužinama i energijama veza, uglovima veze, već i drugim svojstvima tvari, kao što su, na primjer, magnetska, optička, električna, toplinska i druga.
Skup eksperimentalno dobijenih podataka o strukturi supstance dopunjuje i generalizuje rezultate kvantno-hemijskih proračunskih metoda koje koriste koncept kvantno-mehaničke teorije hemijskog vezivanja. Vjeruje se da kemijsku vezu uglavnom izvode valentni elektroni. Za s- i p-elemente, valentni elektroni su orbitale vanjskog sloja, a za d-elemente, elektroni s-orbitale vanjskog sloja i d-orbitale pred-vanjskog sloja.
Priroda hemijske veze.
Hemijska veza nastaje samo ako se atomi približe jedan drugom ukupna energija sistem (E kin. + E pot.) se smanjuje.
Razmotrite prirodu kemijske veze na primjeru molekularnog vodikovog jona H 2 + . (Dobija se zračenjem molekula vodonika H 2 elektronima; u plinskom pražnjenju). Za tako jednostavan molekularni sistem, Schrödingerova jednačina je najpreciznije riješena.
U vodonikovom jonu H 2 + jedan elektron se kreće u polju dva jezgra - protona. Udaljenost između jezgara je 0,106 nm, energija vezivanja (disocijacija na H atome i H+ jon) je 255,7 kJ/mol. To jest, čestica je jaka.
AT molekularni ion H 2 + djeluju elektrostatičke sile dvije vrste - sile privlačenja elektrona na oba jezgra i sile odbijanja između jezgara. Odbojna sila se manifestuje između pozitivno naelektrisanih jezgara H A + i H A +, što se može predstaviti na sledećoj slici. 3. Odbojna sila teži da odvoji jezgra jedno od drugog.

Rice. 3. Sila odbijanja (a) i privlačenja (b) između dva jezgra, koja nastaje kada se međusobno približavaju na udaljenostima reda veličine atoma.
Privlačne sile djeluju između negativno nabijenog elektrona e - i pozitivno nabijenih jezgri H + i H +. Molekul nastaje ako je rezultanta sila privlačenja i odbijanja nula, odnosno uzajamno odbijanje jezgara mora biti nadoknađeno privlačenjem elektrona prema jezgri. Takva kompenzacija zavisi od položaja elektrona e - u odnosu na jezgra (sl. 3 b i c). Ovdje ne mislimo na položaj elektrona u prostoru (koji se ne može odrediti), već na vjerovatnoću pronalaženja elektrona u prostoru. Položaj elektronske gustine u prostoru, koji odgovara sl. 3.b) doprinosi konvergenciji jezgara, a odgovarajuća sl. 3.c) - odbijanje jezgara, jer su u ovom slučaju sile privlačenja usmjerene u jednom smjeru i odbijanje jezgara nije kompenzirano. Dakle, postoji regija vezanja kada je gustina elektrona raspoređena između jezgara i regija koja labavi ili ne vezuje kada je gustina elektrona raspoređena iza jezgara.
Ako elektron uđe u područje veze, tada se formira hemijska veza. Ako elektron uđe u područje labavljenja, tada se ne formira kemijska veza.
U zavisnosti od prirode distribucije elektronske gustine u oblasti vezivanja, postoje tri glavna tipa hemijske veze: kovalentna, jonska i metalna. Ove veze se ne javljaju u svom čistom obliku, i obično je kombinacija ovih vrsta veza prisutna u spojevima.
Vrste veza.
U hemiji se razlikuju sljedeće vrste veza: kovalentne, jonske, metalne, vodikove veze, van der Waalsove veze, donor-akceptorske veze i dativne veze.
kovalentna veza
Kada se formira kovalentna veza, atomi dijele elektrone jedni s drugima. Primjer kovalentne veze je kemijska veza u molekulu Cl2. Lewis (1916) prvi je predložio da u takvoj vezi svaki od dva atoma hlora dijeli jedan od svojih vanjskih elektrona s drugim atomom hlora. Za preklapanje atomske orbitale dva atoma treba da priđu što bliže jedan drugom. Zajednički par elektrona formira kovalentnu vezu. Ovi elektroni zauzimaju istu orbitalu, a njihovi spinovi su usmjereni u suprotnim smjerovima.
Dakle, kovalentna veza se izvodi socijalizacijom elektrona iz različitih atoma kao rezultat uparivanja elektrona sa suprotnim spinovima.
Kovalentna veza je široko korištena vrsta veze. Kovalentna veza se može pojaviti ne samo u molekulima, već iu kristalima. Javlja se između identičnih atoma (u H 2, Cl 2, molekula dijamanata) i između različitih atoma (u H 2 O, NH 3 ...)
Mehanizam nastanka kovalentne veze
Razmotrimo mehanizam na primjeru formiranja H 2 molekula.
H + H \u003d H 2, ∆H \u003d -436 kJ / mol
Jezgro slobodnog atoma vodika okruženo je sferno simetričnim elektronskim oblakom formiranim od 1s elektrona. Kada se atomi približavaju jedan drugom na određenu udaljenost, njihovi elektronski oblaci (orbitale) se djelimično preklapaju (slika 4).
Rice. 4. Mehanizam stvaranja veze u molekulu vodonika.
Ako je razmak između jezgara atoma vodika koji se približavaju prije dodira 0,106 nm, tada je nakon preklapanja elektronskih oblaka ta udaljenost 0,074 nm.
Kao rezultat, između centara jezgara pojavljuje se molekularni oblak od dva elektrona, koji ima maksimalnu gustoću elektrona u prostoru između jezgara. Povećanje gustine negativni naboj između jezgara pogoduje snažnom povećanju sila privlačenja između jezgara, što dovodi do oslobađanja energije. Što je hemijska veza jača, to je veće preklapanje elektronskih orbitala. Kao rezultat pojave kemijske veze između dva atoma vodika, svaki od njih dostiže elektronsku konfiguraciju atoma plemenitog plina - helijuma.
Postoje dve metode koje objašnjavaju sa kvantnomehaničke tačke gledišta formiranje preklapanja oblasti elektronskih oblaka, odnosno formiranje kovalentne veze. Jedna od njih se zove metoda BC (valentne veze), a druga MO (molekularne orbitale).
U metodi valentnih veza razmatra se preklapanje atomskih orbitala odabranog para atoma. U MO metodi, molekul se posmatra kao cjelina i raspodjela elektronske gustine (od jednog elektrona) je raspoređena po cijelom molekulu. Sa položaja MO 2H u H 2 su povezani zbog privlačenja jezgara na oblak elektrona koji se nalazi između ovih jezgara.
Prikaz kovalentne veze
Linkovi su prikazani na različite načine:
jedan). Korištenje elektrona kao tačaka
U ovom slučaju, formiranje molekule vodika prikazano je dijagramom
H∙ + H∙ → H: H
2). Uz pomoć kvadratnih ćelija (orbitala), kao smještanje dva elektrona sa suprotnim spinovima u jednu molekulu kvantna ćelija

Ova šema pokazuje da je nivo molekularne energije niži od početnih atomskih nivoa, što znači da je molekularno stanje supstance stabilnije od atomskog stanja.
3). Kovalentna veza je predstavljena šipkom
Na primjer, N - N. ova karakteristika simbolizira par elektrona.
Ako je jedna kovalentna veza nastala između atoma (jedan zajednički elektronski par), onda se zove single, ako više, onda višestruko duplo(dva zajednička elektronska para), trostruko(tri zajednička elektronska para). Jednostruka veza je predstavljena jednom linijom, dvostruka sa dva, a trostruka sa tri.
Crtica između atoma pokazuje da oni imaju generalizirani par elektrona.
Klasifikacija kovalentnih veza
U zavisnosti od smera preklapanja elektronskih oblaka, razlikuju se σ-, π-, δ-veze. σ-veza nastaje kada se oblaci elektrona preklapaju duž ose koja povezuje jezgra atoma u interakciji.
Primjeri σ-veze:

Rice. 5. Formiranje σ-veze između s-, p-, d- elektrona.
Primjer formiranja σ-veze kada se s-s oblaci preklapaju uočen je u molekulu vodika.
π-veza se vrši preklapanjem elektronskih oblaka sa obe strane ose, povezujući jezgra atoma.

Rice. 6. Formiranje π-veze između p-, d- elektrona.
δ-veza nastaje kada se dva oblaka d-elektrona koja se nalaze u paralelnim ravnima preklapaju. δ veza je manje jaka od π veze, a π veza je manje jaka od σ veze.
Svojstva kovalentne veze
a). Polaritet.
Postoje dvije vrste kovalentnih veza: nepolarne i polarne.
U slučaju nepolarne kovalentne veze, elektronski oblak formiran od zajedničkog para elektrona je raspoređen u prostoru simetrično u odnosu na jezgra atoma. Primjer su dvoatomne molekule koje se sastoje od atoma jednog elementa: H 2 , Cl 2 , O 2 , N 2 , F 2 . Njihov elektronski par podjednako pripada oba atoma.
U slučaju polarne veze, elektronski oblak koji formira vezu pomiče se prema atomu s višom relativnom elektronegativnošću.
Primjeri su molekule: HCl, H 2 O, H 2 S, N 2 S, NH 3, itd. Razmotrite formiranje molekule HCl, što se može predstaviti sljedećom shemom
![]()
Elektronski par se pomera na atom hlora, jer relativna elektronegativnost atoma hlora (2.83) veća je od elektronegativnosti atoma vodonika (2.1).
b). Zasićenost.
Sposobnost atoma da učestvuju u formiranju ograničenog broja kovalentnih veza naziva se zasićenje kovalentne veze. Zasićenje kovalentnih veza je zbog činjenice da u hemijska interakcija učestvuju samo spoljni elektroni nivoi energije, odnosno ograničen broj elektrona.
u) . Orijentacija i hibridizacija kovalentne veze.
Kovalentnu vezu karakteriše orijentacija u prostoru. To se objašnjava činjenicom da oblaci elektrona imaju određeni oblik i njihovo maksimalno preklapanje je moguće uz određenu prostornu orijentaciju.
Smjer kovalentne veze određuje geometrijsku strukturu molekula.
Na primjer, za vodu, ima trokutasti oblik.
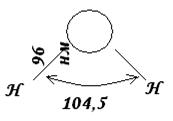
Rice. 7. Prostorna struktura molekula vode.
Eksperimentalno je utvrđeno da je u molekuli vode H 2 O udaljenost između jezgara vodika i kisika 0,096 nm (96 pm). Ugao između linija koje prolaze kroz jezgra je 104,5 0 . Dakle, molekula vode ima ugaoni oblik i njena struktura se može izraziti u obliku prikazane figure.
Hibridizacija
Kao eksperimentalni i teorijske studije(Slater, Pauling) tokom formiranja nekih jedinjenja, kao što su BeCl 2 , BeF 2 , BeBr 2 , stanje valentnih elektrona atoma u molekuli nije opisano čistim s-, p-, d-talasnim funkcijama , već njihovim linearnim kombinacijama. Takve mješovite strukture nazivaju se hibridne orbitale, a proces miješanja naziva se hibridizacija.
Kao što pokazuju kvantno-hemijske kalkulacije, miješanje s- i p-orbitala atoma je povoljan proces za formiranje molekula. U ovom slučaju se oslobađa više energije nego pri formiranju veza koje uključuju čiste s- i p-orbitale. Dakle, hibridizacija elektronskih orbitala atoma dovodi do velikog smanjenja energije sistema i, shodno tome, do povećanja stabilnosti molekula. Hibridizovana orbitala je više izdužena na jednoj strani jezgra nego na drugoj. Stoga će gustina elektrona u preklapajućem području hibridnog oblaka biti veća od gustine elektrona u području preklapanja s- i p-orbitale odvojeno, zbog čega je veza koju formiraju elektroni hibridne orbitale odlikuje se većom snagom.
Postoji nekoliko tipova hibridnih stanja. Kada se s- i p-orbitale hibridiziraju (nazvana sp hibridizacija), nastaju dvije hibridne orbitale, smještene pod uglom od 180 0 jedna u odnosu na drugu. U ovom slučaju se formira linearna struktura. Ova konfiguracija (struktura) je poznata za većinu halogenida zemnoalkalnih metala (na primjer, BeX 2 gdje je X=Cl, F, Br), tj. spojni ugao je 180 0 S.

Rice. 8. sp hibridizacija
Druga vrsta hibridizacije, nazvana sp 2 hibridizacija (formirana od jedne s i dvije p orbitale), dovodi do formiranja tri hibridne orbitale, koje se nalaze pod uglom od 120 0 jedna prema drugoj. U ovom slučaju u prostoru se formira trigonalna struktura molekula (ili pravilnog trokuta). Takve strukture su poznate za jedinjenja BX 3 (X=Cl, F, Br).



Rice. 9. sp 2 hibridizacija.
Ništa manje uobičajena je sp 3 hibridizacija, koja se formira od jedne s i tri p orbitale. U ovom slučaju formiraju se četiri hibridne orbitale, orijentisane u prostoru simetrično na četiri vrha tetraedra, odnosno nalaze se pod uglom od 109 0 28". Ovaj prostorni položaj naziva se tetraedar. Takva struktura je poznata po NH 3, H 2 O molekule i općenito za elemente perioda II Šematski se njegov prikaz u prostoru može prikazati na sljedećoj slici

Rice. 10. Prostorni raspored veza u molekuli amonijaka,
projektovan na ravan.
Formiranje tetraedarskih veza usled sp 3 hibridizacije može se predstaviti na sledeći način (slika 11):
Rice. 11. Formiranje tetraedarskih veza tokom sp 3 hibridizacije.
Formiranje tetraedarskih veza tokom sp 3 hibridizacije prikazano je na sl. 12.

Fig.12. Formiranje tetraedarskih veza tokom sp 3 - hibridizacije u CCl 4 molekule
Hibridizacija se ne odnosi samo na s- i p-orbitale. Da bi se objasnili stereohemijski elementi III i narednih perioda, postaje neophodno konstruisati hibridne orbitale istovremeno uključujući s-, p-, d-orbitale.
Supstance sa kovalentnom vezom uključuju:
1. organska jedinjenja;
2. čvrsta i tečne supstance, u kojem se formiraju veze između parova atoma halogena, kao i između parova atoma vodika, dušika i kisika, na primjer, H 2;
3. elementi grupe VI (npr. spiralni lanci telura), elementi grupe V (npr. arsen), elementi grupe IV (dijamant, silicijum, germanijum);
4. jedinjenja koja poštuju 8-N pravilo (kao što su InSb, CdS, GaAs, CdTe), kada se elementi koji ih formiraju nalaze u periodnom sistemu Mendeljejeva u grupama II-VI, III-V.
AT čvrste materije sa kovalentnom vezom može se formirati za istu supstancu različito kristalne strukture, čija je energija vezivanja skoro ista. Na primjer, struktura ZnS može biti kubna (cink blende) ili heksagonalna (wurtzit). Raspored najbližih susjeda kod cink blende i wurtzita je isti, a jedina i mala razlika u energijama ove dvije strukture određena je rasporedom atoma koji slijede najbliže. Ova sposobnost nekih supstanci naziva se alotropija ili polimorfizam. Drugi primjer alotropije je silicijum karbid, koji ima niz politita različitih struktura od čisto kubnih do heksagonalnih. Ove brojne kristalne modifikacije ZnS, SiC postoje na sobnoj temperaturi.
Jonska veza
Jonska veza je elektrostatička sila privlačenja između jona suprotnih naboja (tj. + i -).
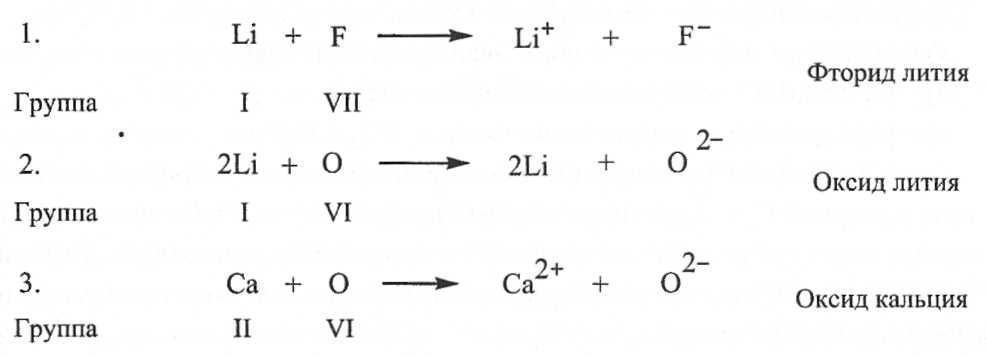
Ideja o jonskoj vezi nastala je na osnovu ideja V. Kossela. On je predložio (1916) da kada dva atoma interaguju, jedan od njih odustaje, a drugi prihvata elektrone. Dakle, ionska veza nastaje kao rezultat prijenosa jednog ili više elektrona s jednog atoma na drugi. Na primjer, u natrijevom kloridu, ionska veza nastaje kao rezultat prijenosa elektrona s atoma natrija na atom klora. Kao rezultat ovog prijenosa formiraju se jon natrija sa nabojem od +1 i jon hlora sa nabojem od -1. Oni se međusobno privlače elektrostatičkim silama, formirajući stabilnu molekulu. Model prijenosa elektrona koji je predložio Kossel omogućava objašnjenje nastanka takvih spojeva kao što su litijum fluorid, kalcijum oksid i litijum oksid.
Najtipičnija jonska jedinjenja sastoje se od katjona metala koji pripadaju grupama I i II periodnog sistema i anjona nemetalnih elemenata koji pripadaju grupama VI i VII.
Lakoća formiranja jonskog spoja ovisi o lakoći formiranja kationa i anjona koji su u njemu sastavni. Lakoća formiranja je veća, što je niža energija jonizacije atom koji donira elektrone (donator elektrona), a atom koji prima elektrone (akceptor elektrona) ima veći afinitet prema elektronu. afinitet prema elektronu je mjera sposobnosti atoma da prihvati elektron. Kvantitativno se definira kao promjena energije koja se javlja kada se jedan mol jednostruko nabijenih anjona formira iz jednog mola atoma. Ovo je takozvani koncept "prvog afiniteta prema elektronu". Drugi afinitet prema elektronu je promjena energije koja se javlja kada se jedan mol dvostruko nabijenih anjona formira iz jednog mola jednostruko nabijenih aniona. Ovi koncepti, odnosno energija ionizacije i afinitet elektrona, odnose se na plinovite tvari i karakteristike su atoma i jona u gasovitom stanju. Ali treba imati na umu da je većina jonskih spojeva najstabilnija u čvrstom stanju. Ova okolnost se objašnjava postojanjem kristalne rešetke u njihovom čvrstom stanju. Postavlja se pitanje. Zašto su, na kraju krajeva, jonska jedinjenja stabilnija u obliku kristalnih rešetki, a ne u gasovitom stanju? Odgovor na ovo pitanje je proračun energije kristalne rešetke na osnovu elektrostatičkog modela. Pored ovoga, ovaj proračun je i test teorije jonske veze.
Da bi se izračunala energija kristalne rešetke, potrebno je odrediti rad koji se mora potrošiti na uništavanje kristalne rešetke sa stvaranjem plinovitih iona. Za proračun se koristi koncept sila privlačenja i odbijanja. Izraz za potencijalnu energiju interakcije jednostruko nabijenih jona dobija se zbrajanjem energije privlačenja i energije odbijanja
E \u003d E inc + E out (1).
Kao E prit, uzeta je energija Kulonovog privlačenja jona suprotnih predznaka, na primjer, Na + i Cl - za jedinjenje NaCl
E int \u003d -e 2 / 4πε 0 r (2),
budući da je raspodjela elektronskog naboja u ispunjenoj elektronskoj ljusci sferno simetrična. Zbog odbijanja do kojeg dolazi zbog Paulijevog principa kada se ispunjene ljuske anjona i kationa preklapaju, udaljenost na kojoj se ioni mogu približiti je ograničena. Energija odbijanja se brzo mijenja s međunuklearnom udaljenosti i može se napisati kao sljedeća dva približna izraza:
E otm \u003d A / r n (n≈12) (3)
E otm \u003d B ∙ exp (-r / ρ) (4),
gdje su A i B konstante, r je udaljenost između jona, ρ je parametar (karakteristična dužina).
Treba napomenuti da nijedan od ovih izraza ne odgovara složenom kvantnomehaničkom procesu koji dovodi do odbijanja.
Unatoč aproksimaciji ovih formula, one omogućavaju precizno izračunavanje i, shodno tome, opisivanje kemijske veze u molekulima takvih ionskih spojeva kao što su NaCl, KCl, CaO.
Budući da električno polje jona ima sfernu simetriju (slika 13), ionska veza, za razliku od kovalentne, nema usmjerenost. Interakcija dvaju suprotno nabijenih jona kompenzira se odbojnim silama samo u smjeru koji povezuje centre jezgara jona; u drugim smjerovima električna polja iona nisu kompenzirana. Zbog toga su u stanju da komuniciraju sa drugim jonima. Dakle, ionska veza nema zasićenje.
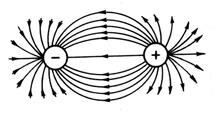
Rice. 13. Sferna simetrija elektrostatičko polje
suprotno naelektrisane naboje.
Zbog neusmjerenosti i nezasićenosti jonske veze, energetski je najpovoljnije kada je svaki ion okružen maksimalan broj jona suprotnog predznaka. Zbog toga je najpoželjniji oblik postojanja jonskog jedinjenja kristal. Na primjer, u kristalu NaCl, svaki kation ima šest anjona kao najbližih susjeda.
Samo kada visoke temperature u gasovitom stanju, jonska jedinjenja postoje u obliku nevezanih molekula.
U ionskim jedinjenjima koordinacijski broj ne ovisi o specifičnostima elektronske strukture atoma, kao u kovalentnim jedinjenjima, već je određen omjerom veličina iona. Sa odnosom jonskih radijusa u rasponu od 0,41 - 0,73, uočava se oktaedarska koordinacija jona, sa omjerom od 0,73-1,37 - kubična koordinacija itd.
Dakle, u normalnim uslovima, jonska jedinjenja su kristalne supstance. Koncept dvojonskih molekula, na primjer, NaCL, CsCl nije primjenjiv na njih. Svaki kristal se sastoji od velikog broja jona.
Jonska veza se može predstaviti kao ograničavajuća polarna veza, za koju je efektivni naboj atoma blizu jedinice. Za čisto kovalentnu nepolarnu vezu, efektivni naboj atoma je nula. U stvarnim supstancama, čisto jonske i čisto kovalentne veze su rijetke. Većina spojeva ima srednju prirodu veze između nepolarnih kovalentnih i polarnih jonskih. To jest, u ovim jedinjenjima kovalentna veza ima djelomično jonski karakter. Priroda jonskih i kovalentnih veza u stvarnim supstancama prikazana je na slici 14.

Rice. 14. Jonska i kovalentna priroda veze.
Proporcija jonske prirode veze naziva se stepenom jonske. Karakteriziraju ga efektivni naboji atoma u molekulu. Stepen ionnosti raste sa povećanjem razlike u elektronegativnosti njegovih sastavnih atoma.
metalni spoj
U atomima metala, vanjski valentni elektroni se drže mnogo slabije nego u atomima nemetala. To uzrokuje gubitak veze elektrona sa pojedinim atomima na dovoljno dug vremenski period i njihovu socijalizaciju. Formira se socijalizirani ansambl vanjskih elektrona. Postojanje ovakvog elektronskog sistema dovodi do pojave sila koje drže pozitivne ione metala u bliskom stanju, uprkos njihovom sličnom naelektrisanju. Takva veza se naziva metalna veza. Takva veza je karakteristična samo za metal i postoji u čvrstom i tečno stanje supstance. Metalna veza je vrsta hemijske veze. Zasnovan je na socijalizaciji vanjskih elektrona, koji gube vezu s atomom i stoga se nazivaju slobodnim elektronima (slika 15).
Rice. 15. Metalni priključak.
Sljedeće činjenice potvrđuju postojanje metalne veze. Svi metali imaju visoku toplotnu provodljivost i visoku električnu provodljivost, što je obezbeđeno prisustvom slobodnih elektrona. Osim toga, ista okolnost određuje i dobru refleksivnost metala na svjetlosno zračenje, njihov sjaj i neprozirnost, visoku plastičnost i pozitivan temperaturni koeficijent električnog otpora.
Stabilnost kristalne rešetke metala ne može se objasniti takvim vrstama veza kao što su ionske i kovalentne. Jonska veza između atoma metala koji se nalaze na čvorovima kristalne rešetke je nemoguća, jer imaju isti naboj. Kovalentna veza između atoma metala je također malo vjerojatna, jer svaki atom ima od 8 do 12 najbližih susjeda, a formiranje kovalentnih veza sa toliko zajedničkih elektronskih parova nije poznato.
Metalne strukture karakteriše činjenica da imaju prilično rijedak raspored atoma (međunuklearne udaljenosti su velike) i veliki broj najbliži susjedi svakog atoma u kristalnoj rešetki. U tabeli 1 navedene su tri tipične metalne strukture.
Tabela 1
Karakteristike struktura tri najčešća metala
Vidimo da svaki atom sudjeluje u formiranju velikog broja veza (na primjer, sa 8 atoma). Tako veliki broj veza (sa 8 ili 12 atoma) ne može se istovremeno lokalizirati u prostoru. Komunikacija se mora odvijati zbog rezonancije oscilatorno kretanje vanjskih elektrona svakog atoma, što rezultira kolektivizacijom svih vanjskih elektrona kristala sa formiranjem elektronskog plina. U mnogim metalima, dovoljno je uzeti jedan elektron iz svakog atoma da bi se formirala metalna veza. To je upravo ono što je uočeno za litijum, koji ima samo jedan elektron u vanjskom omotaču. Kristal litijuma je rešetka Li + jona (kuglice poluprečnika 0,068 nm) okružene elektronskim gasom.

Rice. 16. Različite vrste kristalnog pakovanja: a-heksagonalno zatvoreno pakovanje; b - čelno-centrirano kubično pakovanje; B-kubično pakovanje.
Postoje sličnosti između metalnih i kovalentnih veza. Ona leži u činjenici da se oba tipa veze zasnivaju na socijalizaciji valentnih elektrona. Međutim, kovalentna veza povezuje samo dva susjedna atoma, a zajednički elektroni su u neposrednoj blizini povezanih atoma. U metalnoj vezi nekoliko atoma učestvuje u socijalizaciji valentnih elektrona.
Dakle, koncept metalne veze je neraskidivo povezan sa konceptom metala kao skupa pozitivno naelektrisanih jonskih jezgara sa velikim prazninama između jona ispunjenih elektronskim gasom, dok na makroskopskom nivou sistem ostaje električno neutralan.
Pored tipova hemijskih veza o kojima smo gore govorili, postoje i druge vrste veza koje su intermolekularne: vodonična veza, van der Waalsova interakcija, interakcija donor-akceptor.
Donorsko-akceptorska interakcija molekula
Mehanizam stvaranja kovalentne veze zbog oblaka od dva elektrona jednog atoma i slobodne orbitale drugog naziva se donor-akceptor. Atom ili čestica koja daje oblak od dva elektrona za komunikaciju naziva se donor. Atom ili čestica sa slobodnom orbitalom koja prihvata ovaj elektronski par naziva se akceptor.
Glavne vrste međumolekularne interakcije. vodoničnu vezu
Između valentno zasićenih molekula, na udaljenostima većim od veličine čestica, mogu se pojaviti elektrostatičke sile međumolekulskog privlačenja. Zovu se van der Waalsove sile. Van der Waalsova interakcija uvijek postoji između blisko raspoređenih atoma, ali igra važnu ulogu samo u odsustvu jačih mehanizama vezivanja. Ova slaba interakcija s karakterističnom energijom od 0,2 eV/atomu odvija se između neutralnih atoma i između molekula. Naziv interakcije povezan je s imenom van der Waalsa, jer je on prvi predložio da jednačina stanja, uzimajući u obzir slabu interakciju između molekula plina, mnogo bolje opisuje svojstva stvarnih plinova od jednačine stanje idealan gas. Međutim, prirodu ove privlačne sile objasnio je tek 1930. godine London. Trenutno se Van der Waalsovoj privlačnosti pripisuju sljedeće tri vrste interakcija: orijentacijska, indukcija, disperzija (londonski efekat). Van der Waalsova energija privlačenja određena je zbrojem interakcija orijentacije, indukcije i disperzije.
E int = E op + E ind + E disp (5).
Orijentacijska interakcija (ili dipol-dipol interakcija) manifestira se između polarnih molekula, koje se, kada im se približe, okreću (orijentiraju) jedna prema drugoj sa suprotnim polovima tako da potencijalna energija sistem molekula postao je minimalan. Energija orijentacijske interakcije je utoliko značajnija što je veći dipolni moment molekula μ i što je udaljenost l između njih manja:
E op \u003d - (μ 1 μ 2) 2 / (8π 2 ∙ε 0 ∙l 6) (6),
gdje je ε 0 električna konstanta.
Induktivna interakcija je povezana s procesima polarizacije molekula okolnim dipolima. To je značajnije, što je veća polarizabilnost α nepolarne molekule i što je veći dipolni moment μ polarne molekule
E ind \u003d - (αμ 2) / (8π 2 ∙ε 0 ∙l 6) (7).
Polarizabilnost α nepolarne molekule naziva se deformaciona polarizacija, jer je povezana sa deformacijom čestice, dok μ karakteriše pomeranje elektronskog oblaka i jezgara u odnosu na njihove prethodne pozicije.
Interakcija disperzije (londonski efekat) se javlja u bilo kojoj molekuli, bez obzira na njihovu strukturu i polaritet. Zbog trenutnog nepodudaranja centara gravitacije naelektrisanja elektronskog oblaka i jezgara, nastaje trenutni dipol, koji indukuje trenutne dipole u drugim česticama. Kretanje trenutnih dipola postaje koordinisano. Kao rezultat toga, susjedne čestice doživljavaju međusobnu privlačnost. Energija interakcije disperzije zavisi od energije jonizacije E I i polarizabilnosti molekula α
E disp \u003d - (E I 1 ∙ E I 2) ∙ α 1 α 2 / (E I 1 + E I 2) l 6 (8).
Vodikova veza ima srednji karakter između valentne i međumolekularne interakcije. Energija vodonične veze je niska, 8-80 kJ/mol, ali je veća od energije van der Waalsove interakcije. Vodikova veza je karakteristična za tečnosti kao što su voda, alkoholi, kiseline i posledica je pozitivno polarizovanog atoma vodika. Mala veličina i odsustvo unutrašnjih elektrona omogućavaju atomu vodika koji je prisutan u tekućini u bilo kojem spoju da uđe u dodatnu interakciju s negativno polariziranim atomom drugog ili istog molekula koji nije kovalentno vezan za njega.
A δ- - H δ+ .... A δ- - H δ+ .
Odnosno, postoji asocijacija molekula. Povezivanje molekula dovodi do smanjenja isparljivosti, povećanja tačke ključanja i toplote isparavanja, povećanja viskoznosti i permitivnost tečnosti.
Voda je posebno pogodna supstanca za stvaranje vodikovih veza, jer njena molekula ima dva atoma vodika i dva usamljena para na atomu kiseonika. To uzrokuje visok dipolni moment molekule (μ D = 1,86 D) i sposobnost formiranja četiri vodikove veze: dvije kao donor protona i dvije kao akceptor protona
(H 2 O .... N - O ... H 2 O) 2 puta.
Iz eksperimenata je poznato da s promjenom molekularne težine u seriji jedinjenja vodonika elemenata trećeg i narednih perioda, tačka ključanja raste. Ako se ovaj obrazac primeni na vodu, tada njena tačka ključanja ne bi trebalo da bude 100 0 C, već 280 0 C. Ova kontradikcija potvrđuje postojanje vodonične veze u vodi.
Eksperimenti su pokazali da se molekularni saradnici formiraju u tečnoj, a posebno u čvrstoj vodi. Led ima tetraedarsku kristalnu rešetku. U središtu tetraedra nalazi se atom kisika jedne molekule vode, na četiri vrha nalaze se atomi kisika susjednih molekula, koji su povezani vodikovim vezama sa svojim najbližim susjedima. U tekućoj vodi vodonične veze su djelomično prekinute, u njenoj strukturi se uočava dinamička ravnoteža između saradnika molekula i slobodnih molekula.
Metoda valentne veze
Teorija valentnih veza, ili lokaliziranih elektronskih parova, pretpostavlja da svaki par atoma u molekulu drži zajedno jedan ili više zajedničkih elektronskih parova. U prikazu teorije valentnih veza, hemijska veza je lokalizovana između dva atoma, odnosno dvocentrična je i dvoelektronska.
Metoda valentnih veza zasniva se na sljedećim glavnim odredbama:
Svaki par atoma u molekulu drži zajedno jedan ili više zajedničkih elektronskih parova;
Jednu kovalentnu vezu formiraju dva elektrona sa antiparalelnim spinovima koji se nalaze u valentnim orbitalama veznih atoma;
Kada se formira veza, valne funkcije elektrona se preklapaju, što dovodi do povećanja gustine elektrona između atoma i smanjenja ukupna energija sistemi;
Svaki atom ima određeni broj elektrona.
Ulazeći u hemijske reakcije, atomi doniraju, dobijaju ili socijalizuju elektrone, dostižući najstabilniju elektronsku konfiguraciju. Konfiguracija sa najnižom energijom je najstabilnija (kao kod atoma plemenitog gasa). Ovaj obrazac se naziva "pravilo okteta" (slika 1).
Rice. jedan.
Ovo pravilo važi za sve vrste veza. Elektronske veze između atoma omogućavaju im da formiraju stabilne strukture, od najjednostavnijih kristala do složenih biomolekula koje na kraju formiraju žive sisteme. Od kristala se razlikuju po kontinuiranom metabolizmu. Međutim, mnoge kemijske reakcije se odvijaju prema mehanizmima elektronski transfer, koji igraju važnu ulogu u energetskim procesima u tijelu.
Hemijska veza je sila koja drži zajedno dva ili više atoma, jona, molekula ili bilo koju njihovu kombinaciju..
Priroda kemijske veze je univerzalna: to je elektrostatička sila privlačenja između negativno nabijenih elektrona i pozitivno nabijenih jezgara, određena konfiguracijom elektrona u vanjskoj ljusci atoma. Sposobnost atoma da formira hemijske veze naziva se valence, ili oksidacijskom stanju. Koncept od valentnih elektrona- elektroni koji formiraju hemijske veze, odnosno one koji se nalaze u najvisokoenergetskim orbitalama. Prema tome, vanjski omotač atoma koji sadrži ove orbitale naziva se valentna ljuska. Trenutno nije dovoljno ukazati na prisustvo hemijske veze, već je potrebno razjasniti njen tip: jonska, kovalentna, dipol-dipolna, metalna.
Prva vrsta veze jejonski veza
Prema Lewisovoj i Kosselovoj elektronskoj teoriji valencije, atomi mogu postići stabilnu elektronsku konfiguraciju na dva načina: prvo, gubljenjem elektrona, postajući katjoni, drugo, njihovo sticanje, pretvaranje u anjoni. Kao rezultat prijenosa elektrona, zbog elektrostatičke sile privlačenja između jona s nabojima suprotnog predznaka, formira se kemijska veza, nazvana Kossel " elektrovalentan(sada se zove jonski).
U ovom slučaju, anioni i kationi formiraju stabilnu elektronsku konfiguraciju s ispunjenom vanjskom elektronskom ljuskom. Tipične ionske veze formiraju se od katjona T i II grupa periodnog sistema i anjona nemetalnih elemenata grupa VI i VII (16 i 17 podgrupa - respektivno, halkogeni i halogeni). Veze u jonskim jedinjenjima su nezasićene i neusmjerene, pa zadržavaju mogućnost elektrostatičke interakcije s drugim ionima. Na sl. 2 i 3 prikazuju primjere jonskih veza koje odgovaraju Kosselovom modelu prijenosa elektrona.

Rice. 2.

Rice. 3. Jonska veza u molekulu natrijum hlorida (NaCl).
Ovdje je prikladno podsjetiti se nekih svojstava koja objašnjavaju ponašanje tvari u prirodi, posebno razmotriti koncept kiseline i osnove.
Vodene otopine svih ovih tvari su elektroliti. Mijenjaju boju na različite načine. indikatori. Mehanizam djelovanja indikatora otkrio je F.V. Ostwald. Pokazao je da su indikatori slabe kiseline ili baze, čija je boja u nedisocijacijskom i disociranom stanju različita.
Baze mogu neutralizirati kiseline. Nisu sve baze rastvorljive u vodi (na primer, neka organska jedinjenja koja ne sadrže -OH grupe su nerastvorljiva, posebno, trietilamin N (C 2 H 5) 3); rastvorljive baze se nazivaju alkalije.
Vodene otopine kiselina ulaze u karakteristične reakcije:
a) sa oksidima metala - sa stvaranjem soli i vode;
b) sa metalima - sa stvaranjem soli i vodonika;
c) sa karbonatima - sa stvaranjem soli, CO 2 i H 2 O.
Svojstva kiselina i baza opisuje nekoliko teorija. U skladu sa teorijom S.A. Arrhenius, kiselina je supstanca koja se disocira i formira jone H+ , dok baza formira jone HE- . Ova teorija ne uzima u obzir postojanje organskih baza koje nemaju hidroksilne grupe.
U skladu sa proton Bronstedova i Lowryjeva teorija, kiselina je supstanca koja sadrži molekule ili ione koji doniraju protone ( donatori protoni), a baza je supstanca koja se sastoji od molekula ili jona koji prihvataju protone ( akceptori protoni). Imajte na umu da u vodenim otopinama ioni vodika postoje u hidratiziranom obliku, odnosno u obliku hidronijevih iona H3O+ . Ova teorija opisuje reakcije ne samo s vodom i hidroksidnim ionima, već se također odvijaju u odsustvu rastvarača ili s nevodenim otapalom.
Na primjer, u reakciji između amonijaka NH 3 (slaba baza) i hlorovodonika u gasnoj fazi nastaje čvrst amonijum hlorid, a u ravnotežnoj smeši dve supstance uvek se nalaze 4 čestice od kojih su dve kiseline, a druge dve baze:
Ova ravnotežna smjesa se sastoji od dva konjugirana para kiselina i baza:
1)NH 4+ i NH 3
2) HCl i Cl ‑
Ovdje se u svakom konjugiranom paru kiselina i baza razlikuju za jedan proton. Svaka kiselina ima konjugovanu bazu. Jaka kiselina ima slabu konjugiranu bazu, a slaba kiselina ima jaku konjugiranu bazu.
Teorija Bronsted-Lowryja omogućava objašnjenje jedinstvene uloge vode za život biosfere. Voda, ovisno o tvari koja s njom stupa u interakciju, može pokazati svojstva kiseline ili baze. Na primjer, u reakcijama s vodenim otopinama octene kiseline, voda je baza, a s vodenim otopinama amonijaka kiselina.
1) CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 SOO- . Ovdje molekul sirćetne kiseline donira proton molekuli vode;
2) NH3 + H 2 O ↔ NH4 + + HE- . Ovdje molekul amonijaka prihvata proton iz molekule vode.
Dakle, voda može formirati dva konjugirana para:
1) H 2 O(kiselina) i HE- (konjugirana osnova)
2) H 3 O+ (kiselina) i H 2 O(konjugirana baza).
U prvom slučaju voda donira proton, au drugom ga prihvata.
Takvo svojstvo se zove amfiprotonitet. Supstance koje mogu reagovati i kao kiseline i baze nazivaju se amfoterično. Takve tvari se često nalaze u prirodi. Na primjer, aminokiseline mogu formirati soli i sa kiselinama i sa bazama. Stoga, peptidi lako formiraju koordinaciona jedinjenja sa prisutnim metalnim jonima.
Dakle, karakteristično svojstvo ionske veze je potpuno pomicanje gomile vezanih elektrona na jedno od jezgara. To znači da postoji oblast između jona u kojoj je gustina elektrona skoro nula.
Druga vrsta veze jekovalentna veza
Atomi mogu formirati stabilne elektronske konfiguracije dijeljenjem elektrona.
Takva veza nastaje kada se par elektrona dijeli jedan po jedan. od svake atom. U ovom slučaju, socijalizirani vezni elektroni su ravnomjerno raspoređeni među atomima. Primjer kovalentne veze je homonuklearni dijatomski H molekuli 2 , N 2 , F 2. Alotropi imaju isti tip veze. O 2 i ozon O 3 i za poliatomsku molekulu S 8 i takođe heteronuklearne molekule hlorovodonik HCl, ugljen-dioksid CO 2, metan CH 4, etanol OD 2 H 5 HE, sumpor heksafluorid SF 6, acetilen OD 2 H 2. Svi ovi molekuli imaju iste zajedničke elektrone, a njihove veze su zasićene i usmjerene na isti način (slika 4).
Za biologe je važno da su kovalentni radijusi atoma u dvostrukim i trostrukim vezama smanjeni u odnosu na jednostruku vezu.
![]()
Rice. četiri. Kovalentna veza u Cl 2 molekulu.
Jonski i kovalentni tipovi veza su dva ograničavajuća slučaja mnogih postojećih tipova hemijskih veza, a u praksi je većina veza međusrednja.
Jedinjenja dva elementa koja se nalaze na suprotnim krajevima istog ili različitog perioda Mendeljejevskog sistema pretežno formiraju jonske veze. Kako se elementi približavaju jedan drugom u određenom periodu, jonska priroda njihovih spojeva se smanjuje, dok se kovalentni karakter povećava. Na primjer, halogenidi i oksidi elemenata na lijevoj strani periodnog sistema formiraju pretežno ionske veze ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH), a ista jedinjenja elemenata na desnoj strani tabele su kovalentna ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glukoza C 6 H 12 O 6, etanol C 2 H 5 OH).
Kovalentna veza, zauzvrat, ima još jednu modifikaciju.
U poliatomskim ionima i u složenim biološkim molekulima oba elektrona mogu doći samo iz jedan atom. To se zove donator elektronski par. Atom koji povezuje ovaj par elektrona sa donorom naziva se akceptor elektronski par. Ova vrsta kovalentne veze naziva se koordinacija (donator-akceptor, ilidativ) komunikacija(Sl. 5). Ova vrsta veze je najvažnija za biologiju i medicinu, budući da je hemija najvažnijih d-elemenata za metabolizam u velikoj mjeri opisana koordinacijskim vezama.
![]()
Slika. 5.
U pravilu, u kompleksnom spoju, atom metala djeluje kao akceptor elektronskog para; naprotiv, u jonskim i kovalentnim vezama, atom metala je donor elektrona.
Suština kovalentne veze i njena raznolikost - koordinaciona veza - može se razjasniti uz pomoć druge teorije kiselina i baza, koju je predložio GN. Lewis. On je donekle proširio semantički koncept pojmova "kiselina" i "baza" prema teoriji Bronsted-Lowryja. Lewisova teorija objašnjava prirodu stvaranja kompleksnih jona i učešće supstanci u reakcijama nukleofilne supstitucije, odnosno u stvaranju CS.
Prema Lewisu, kiselina je supstanca sposobna da formira kovalentnu vezu prihvatanjem elektronskog para iz baze. Lewisova baza je supstanca koja ima usamljeni par elektrona, koji doniranjem elektrona formira kovalentnu vezu sa Lewisovom kiselinom.
Odnosno, Lewisova teorija proširuje raspon kiselinsko-baznih reakcija i na reakcije u kojima protoni uopće ne učestvuju. Štaviše, sam proton je, prema ovoj teoriji, također kiselina, jer je u stanju prihvatiti elektronski par.

Prema tome, prema ovoj teoriji, kationi su Lewisove kiseline, a anioni su Lewisove baze. Sljedeće reakcije su primjeri:
Gore je napomenuto da je podjela tvari na ionske i kovalentne relativna, jer ne postoji potpuni prijelaz elektrona s atoma metala na atome akceptora u kovalentnim molekulima. U spojevima s ionskom vezom svaki ion je u električnom polju jona suprotnog predznaka, pa su međusobno polarizirani, a njihove školjke su deformirane.
Polarizabilnost određena elektronskom strukturom, nabojem i veličinom jona; veća je za anjone nego za katjone. Najveća polarizabilnost među kationima je za katione većeg naboja i manje veličine, na primjer, for Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Ima snažan polarizirajući efekat H+ . Pošto je efekat polarizacije jona dvostrani, značajno menja svojstva jedinjenja koja formiraju.
Treća vrsta veze -dipol-dipol veza
Pored navedenih vrsta komunikacije, postoje i dipol-dipol intermolekularni interakcije, takođe poznate kao van der Waals .
Snaga ovih interakcija ovisi o prirodi molekula.
Postoje tri vrste interakcija: permanentni dipol - permanentni dipol ( dipol-dipol atrakcija); permanentni dipol - inducirani dipol ( indukcija atrakcija); trenutni dipol - inducirani dipol ( disperzija privlačnost, ili londonske sile; pirinač. 6).

Rice. 6.
Samo molekuli s polarnim kovalentnim vezama imaju dipol-dipolni moment ( HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl), a snaga veze je 1-2 debye(1D \u003d 3,338 × 10 -30 kulona - C × m).
U biohemiji se razlikuje još jedna vrsta veze - vodonik vezu, što je ograničavajući slučaj dipol-dipol atrakcija. Ova veza nastaje privlačenjem između atoma vodika i malog elektronegativnog atoma, najčešće kisika, fluora i dušika. Kod velikih atoma koji imaju sličnu elektronegativnost (na primjer, s klorom i sumporom), vodikova veza je mnogo slabija. Atom vodika se razlikuje po jednoj bitnoj osobini: kada se vezani elektroni povuku, njegovo jezgro - proton - je izloženo i prestaje da bude zaštićeno elektronima.
Stoga se atom pretvara u veliki dipol.
Vodikova veza, za razliku od van der Waalsove, nastaje ne samo tokom međumolekularnih interakcija, već i unutar jedne molekule - intramolekularno vodoničnu vezu. Vodikove veze igraju važnu ulogu u biohemiji, na primjer, za stabilizaciju strukture proteina u obliku α-heliksa, ili za formiranje dvostruke spirale DNK (slika 7).

Fig.7.
Vodikove i van der Waalsove veze su mnogo slabije od ionskih, kovalentnih i koordinacionih veza. Energija međumolekulskih veza je prikazana u tabeli. jedan.
Tabela 1. Energija međumolekularnih sila
Bilješka: Stepen međumolekularnih interakcija odražava entalpiju topljenja i isparavanja (ključanja). Jonska jedinjenja zahtijevaju mnogo više energije za razdvajanje jona nego za razdvajanje molekula. Entalpije topljenja jonskih jedinjenja su mnogo veće od onih molekularnih jedinjenja.
Četvrta vrsta veze -metalna veza
Konačno, postoji još jedna vrsta međumolekulskih veza - metal: veza pozitivnih jona rešetke metala sa slobodnim elektronima. Ova vrsta veze se ne javlja u biološkim objektima.
Iz kratkog pregleda tipova veza proizlazi jedan detalj: važan parametar atoma ili jona metala - donor elektrona, kao i atom - akceptor elektrona je njegov veličina.
Ne ulazeći u detalje, napominjemo da se kovalentni radijusi atoma, ionski radijusi metala i van der Waalsovi radijusi molekula u interakciji povećavaju kako raste njihov atomski broj u grupama periodnog sistema. U ovom slučaju, vrijednosti radijusa jona su najmanje, a van der Waalsovi polumjeri najveći. Po pravilu, pri kretanju niz grupu, radijusi svih elemenata se povećavaju, kako kovalentnih tako i van der Waalsovih.
Najvažnije za biologe i ljekare su koordinacija(donor-akceptor) veze koje razmatra koordinaciona hemija.
Medicinska bioanorganika. G.K. Barashkov