Gibbsova energija jednostavnih supstanci. gibbs energy
Holandski fizikalni hemičar van't Hoff predložio je novu teoriju hemijskog afiniteta, koja je, bez objašnjenja prirode hemijskog afiniteta, ograničena na navođenje metode njegovog merenja, tj. kvantifikacija hemijski afinitet.
van't Hoff koristi kao meru hemijskog afiniteta maksimalni rad Ayax-a ili za reakcije koje se dešavaju na ili respektivno.
Maksimalni rad jednak je energiji koja se mora primijeniti na sistem da bi se zaustavila reakcija, odnosno da bi se savladale sile kemijskog afiniteta. Budući da se reakcija odvija u smjeru obavljanja pozitivnog maksimalnog rada, znak ili određuje smjer spontanog toka hemijska interakcija.
Maksimalni rad na konstantan volumen je jednako
Razlika se zove Helmholtzova energija sistema i označava se slovom Dakle,
Maksimalni rad na konstantan pritisak je jednako
Razlika se naziva Gibbsova energija sistema i označava se slovom Dakle,
![]()
Gibbsova energija hemijske reakcije.
Gibbsova energija termodinamička funkcija stanja sistema Promjena Gibbsove energije u sistemu tokom protoka hemijska reakcija naziva se Gibbsova energija hemijske reakcije. Prema jednačinama (IV.20) i (IV.21),
![]()
Na osnovu (IV.21), Gibbsova energija hemijske reakcije karakteriše pravac i granicu spontanog toka reakcije u uslovima konstantne temperature i pritiska.
Helmholtzova energija hemijske reakcije.
Helmholcova energija je takođe termodinamička funkcija stanja sistema.Promena Helmholcove energije u sistemu tokom reakcije naziva se Helmholcova energija hemijske reakcije. Prema (IV.18) i (IV.19),
gdje su i promjena odgovarajućih termodinamičkih funkcija tijekom reakcije koja se odvija na i temperaturi T.
Vrijednost [vidi jednačina (IV. 19)] karakteriše pravac i granicu spontanog toka reakcija u izohorno-izotermnim uslovima.
Na sl. IV.3 pokazuje odnos između glavnih termodinamičkih funkcija stanja sistema.
Gibbsova energija formiranja hemijskih jedinjenja.
Gibbsova energija hemijske reakcije, kao promena termodinamičke funkcije stanja sistema, može se izračunati iz razlike
![]()
(indeksi "2" i "1" odnose se na konačno i početno stanje sistema, respektivno). Prilikom izračunavanja Gibbsove energije hemijske reakcije prema jednačini (IV.24), treba imati na umu da - zbir Gibbsovih energija nastanka svih reakcijskih proizvoda, - zbir Gibbsovih energija nastanka svih početnih supstanci. Standardna Gibbsova energija hemijske reakcije izračunava se iz razlike između zbira standardnih Gibbsovih energija formiranja produkta reakcije i polaznih materijala.
Standard Gibbs Energy Education hemijsko jedinjenje nazovite Gibbsovom energijom reakcije stvaranja jednog mola ovog spoja, koji je u standardnom stanju, iz odgovarajućeg
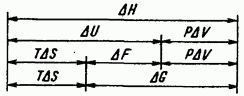
Rice. IV.3. Omjer najvažnijih termodinamičkih funkcija
jednostavne supstance, koje se takođe nalaze u standardna stanja i faze i modifikacije koje su termodinamički stabilne na datoj temperaturi (Tabela IV.3).
Standardne Gibbsove energije formiranja jednostavnih supstanci uzimaju se jednakim nuli ako su njihove agregatna stanja i modifikacije su stabilne u standardnim uslovima i 298,16 K.
Pravac i granice spontanog toka hemijskih reakcija.
U skladu sa (IV. 19) i (IV.21), pozitivan maksimalni rad A ili odgovara negativnim vrijednostima Helmholtzove energije i Gibbsove energije kemijskih reakcija. Drugim riječima, kada konstantna temperatura i pritiska, reakcija teče spontano u pravcu koji odgovara smanjenju Gibbsove energije sistema.Stoga, uslov za spontani tok hemijske reakcije pri datim i T je nejednakost
Granica spontanog toka reakcije kod, odnosno uslova ravnoteže, je postizanje minimalne vrijednosti za podatke i T funkcije
Pri konstantnoj temperaturi i zapremini, reakcija teče spontano u pravcu koji odgovara smanjenju Helmholcove energije sistema, pa je uslov za spontani
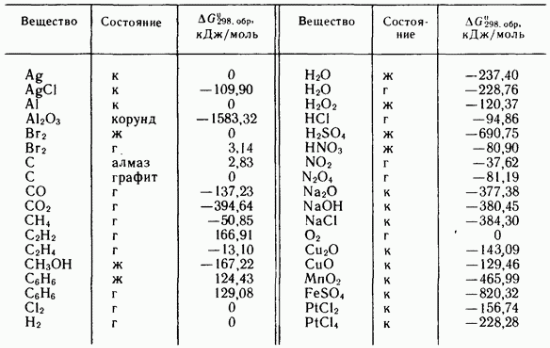
Tabela IV.3, Standardne Gibbsove energije formiranja nekih jednostavnih supstanci i jedinjenja na 298,16 K
proizvoljan tok hemijske reakcije za date V i T je nejednakost
Granica spontanog toka reakcije kod, odnosno uslova ravnoteže, je postizanje minimalne vrijednosti za date V i T vrijednosti funkcije
Ako prilikom mijenjanja hemijski sastav Sistem odgovara povećanju Gibbsove energije, što znači da ne dolazi do spontane reakcije. Nejednakost
znači da se reakcija može odvijati spontano samo u suprotnom smjeru, što odgovara smanjenju Gibbsove energije sistema. Lako je izračunati standardnu Gibbsovu energiju kemijske reakcije na 298,16 K i tako saznati predznak promjene funkcije.
Tako, na primjer, koristeći podatke date u tabeli. IV.3, može se izračunati standardna Gibbsova energija reakcije na 298,16 K (za 1 mol
Rezultirajuća vrijednost Gibbsove energije reakcije zadovoljava nejednakost (IV.25). To znači da se pri 101 kPa i 298 K proces interakcije natrijum oksida sa vodom može spontano odvijati u pravcu proizvodnje (k).
kako god standardne energije Gibbs hemijske reakcije ne može biti kriterijum za pravac ili granica spontane pojave hemijske interakcije u uslovima drugačijim od standardnih. Količinu je također nemoguće zamijeniti kvantitetom.Sve ovo donekle otežava korištenje Gibbsove energije za procjenu procesa koji se odvijaju u realnim uslovima.
Iz jednadžbe (IV.22) proizlazi da kada je Gibbsova energija hemijske reakcije manja, to je manja i veća.Najveći hemijski afinitet supstanci jedne prema drugoj se manifestuje u reakcijama koje se odvijaju oslobađanjem toplote i koje su praćeno povećanjem entropije sistema Iz jednačine (IV.22) takođe proizilazi da endotermni procesi koji se javljaju sa smanjenjem entropije ne mogu spontano da nastanu, jer je vrednost u ovom slučaju uvek pozitivna. Endotermne interakcije mogu se spontano odvijati samo ako su takve interakcije olakšane povećanjem temperature, jer se time povećava vrijednost faktora entropije procesa
Ovdje ćete pronaći primjere zadataka za izračunavanje termodinamičkih parametara kao što su entalpija, entropija, . Utvrđivanje mogućnosti spontanog toka procesa, kao i sastavljanje termohemijskih jednačina.
Zadaci za dio Osnove termodinamike sa rješenjima
Zadatak 1. Izračunajte standardnu entalpiju i standardnu entropiju hemijske reakcije. Odredite u kojem smjeru na 298 °K (naprijed ili nazad) će se reakcija odvijati. Izračunajte temperaturu pri kojoj su oba smjera reakcije podjednako vjerovatna.
Fe 2 O 3 (c) + 3H 2 \u003d 2Fe (c) + 3H 2 O (g)
Δ Hokrug = ΣH 0 con– ΣH 0 ref kJ/mol
Korištenje referentnih podataka standardne entalpije supstance, nalazimo:
Δ Hokrug= 2 Δ H 0 Fe +3 Δ H 0 H2 O - Δ H 0 Fe2 O3 - 3 Δ H 0 H2 \u003d 2 0 + 3 (- 241,82) - (-822,16) - 3 0 = 96,7 kJ / mol
Δ Sokrug=Σ S 0 con– Σ S 0 ref J/(mol K)
Korištenje referentnih podataka standardne entropije supstance, nalazimo:
Δ Sokrug= 2 Δ S 0 Fe + 3 Δ S 0 H2 O - Δ S 0 Fe2 O3 - 3 Δ S 0 H2 = 2 27,15 + 3 188,7 – 89,96 – 3 131 = 137,44 J/(mol K)
ΔG = Δ H – TΔS\u003d 96,7 - 298 137,44 / 1000 \u003d 55,75 kJ / mol
Na T=298°K, ΔG> 0 - reakcija se ne odvija spontano, tj. reakcija će se odvijati u suprotnom smjeru.
ΔG = Δ H – TΔS= 0, onda
T= — (ΔG – Δ H) / ∆S= — (0-96,7)/0,137 = 705,83 hiljada
Na T = 705,83 K, reakcija će se odvijati s jednakom vjerovatnoćom i u naprijed i u obrnutom smjeru.
Zadatak 2. Izračunajte Gibbsovu energiju i odredite mogućnost da se reakcija odvija na temperaturama od 1000 i 3000 K.
Jednačina reakcije za sagorijevanje tekućeg ugljičnog disulfida je sljedeća:
CS 2 (l) + 3O 2 \u003d CO 2 + 2SO 2
Izračunavamo toplotni učinak reakcije zamjenom referentnih podataka standardnih entalpija tvari u izraz:
Δ Hokrug = ΣH 0 con– ΣH 0 ref kJ/mol
Δ Hokrug= 2 Δ H 0 SO2+ Δ H 0 CO2- Δ H 0 CS2 - 3 Δ H 0 O2 = 2 (-296,9) + 3 (- 393,5) - 87 - 3 0 \u003d -1075,1 kJ / mol
One. tokom sagorevanja 1 mol oslobađa se ugljični disulfid 1075,1 kJ toplota
i kada gori x madeži oslobađa se ugljični disulfid 700 kJ toplota
Hajde da nađemo X:
x\u003d 700 1 / 1075,1 \u003d 0,65 mol
Dakle, ako se kao rezultat reakcije oslobodi 700 kJ topline, tada će u reakciju ući 0,65 mola CS 2
Zadatak 4. Izračunajte termički efekat reakcije redukcije željeznog oksida (II) sa vodonikom, na osnovu sljedećih termohemijskih jednačina:
1. FeO (c) + CO (g) \u003d Fe (c) + CO 2 (g); ΔH 1 = -18,20 kJ;
2. CO (g) + 1 / 2O 2 (g) \u003d CO 2 (g) ΔH 2 = -283,0 kJ;
3. H 2 (g) + ½ O 2 (g) \u003d H 2 O (g) ΔH 3 = -241,83 kJ.
Reakcija redukcije željeznog oksida (II) sa vodikom ima sljedeći oblik:
4. FeO (c) + H 2 (g) = Fe (c) + H 2 O (g)
Za izračunavanje toplotnog efekta reakcije potrebno je primijeniti , tj. reakcija 4. može se dobiti dodavanjem reakcija 1. i 2. i oduzimanjem reakcije 1.:
Δ Hokrug= Δ H 1 + Δ H 3 – Δ H 2 \u003d -18,2 - 241,3 + 283 \u003d 23 kJ
Na ovaj način, termički efekat reakcije redukcija željeznog oksida (II) vodonikom je jednaka
Δ Hokrug= 23 kJ
Zadatak 5. Reakcija sagorevanja benzena izražena je termohemijskom jednačinom:
C 6 H 6 (g) + 7½ O 2 (g) \u003d 6CO 2 (g) + 3H 2 O (g) - 3135,6 kJ.
Izračunajte toplinu stvaranja tekućeg benzena. Odredite kaloričnu vrijednost tečnog benzena, pod uvjetom da su standardni uvjeti isti kao i normalni.
Toplotni efekat reakcije je:
Δ Hokrug = ΣH 0 con– ΣH 0 ref kJ/mol
U našem slučaju Δ Hokrug= - 3135,6 kJ, nalazimo toplotu stvaranja tečnog benzena:
Δ Hokrug= 6 Δ H 0 Sa O2 + 3 Δ H 0 H2 O - Δ H 0 C6 H6 - 7.5 Δ H 0 O2
-Δ H 0 C6 H6= Δ Hokrug- 3 (-241,84) + 6 (- 393,51) - 7,5 0 \u003d - 3135,6 - 3 (-241,84) + 6 (- 393,51) - 7, 5 0 \u003d - 49,02 kJ / mol
Δ H 0 C6 H6 = 49,02 kJ/mol
Kalorična vrijednost tečni benzen se izračunava po formuli:
QT= Δ Hokrug 1000 / M
M(benzen) = 78 g/mol
QT= - 3135,6 1000 / 78 = - 4,02 10 4 kJ / kg
Kalorična vrijednost tečni benzen Q T = - 4,02 10 4 kJ / kg
Zadatak 6. Reakcija oksidacije etil alkohola izražena je jednadžbom:
C 2 H 5 OH (g) + 3,0 O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g).
Odredite toplotu stvaranja C 2 H 5 OH (l), znajući ΔH x.r. = - 1366,87 kJ. Napišite termohemijsku jednačinu. Odrediti molarnu toplotu isparavanja C 2 H 5 OH (g) → C 2 H 5 OH (g), ako je poznata toplota stvaranja C 2 H 5 OH (g), jednaka –235,31 kJ mol -1.
Na osnovu datih podataka pišemo termohemijska jednačina:
C 2 H 5 OH (g) + 3O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g) + 1366,87 kJ
termalni efekat reakcije jednako:
Δ Hokrug = ΣH 0 con– ΣH 0 ref kJ/mol
U našem slučaju Δ Hokrug= - 1366,87 kJ.
Korištenje referentnih podataka toplote stvaranja supstanci, nalazimo toplotu formiranja C 2 H 5 OH (l):
Δ Hokrug= 2 Δ H 0 Sa O2 + 3 Δ H 0 H2 O - Δ H 0 C2 H5 OH(l) – 3 Δ H 0 O2
- 1366,87 = 2 (-393,51) + 3 (-285,84)— Δ H 0 C2 H5 OH - 3 0
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
Δ H 0 C2 H5 OH(g) = Δ H 0 C2 H5 OH(l) + Δ H 0 isparavanje
Δ H 0 isparavanje = Δ H 0 C2 H5 OH(g) — Δ H 0 C2 H5 OH(l)
Δ H 0 isparavanje\u003d - 235,31 + 277,36 \u003d 42,36 kJ / mol
Utvrdili smo da je toplina stvaranja C 2 H 5 OH (l) jednaka
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
a molarna toplota isparavanja C 2 H 5 OH (l) → C 2 H 5 OH (g) je
Δ H 0 isparavanje= 42,36 kJ/mol
Zadatak 7. Kako objasniti da je u standardnim uslovima egzotermna reakcija nemoguća:
CO 2 (g) + H 2 (g) ↔ CO (g) + H 2 O (g)?
Izračunajte ΔG ove reakcije. Na kojim temperaturama ovu reakciju postaje spontano?
Izračunati ΔG ova reakcija:
ΔG = Δ H – TΔS
Da bismo to učinili, prvo definiramo Δ Hi ∆S reakcije:
Δ Hokrug = ΣH 0 con– ΣH 0 ref kJ/mol
Korištenje referentnih podataka standardne entalpije supstance, nalazimo:
Δ Hokrug= Δ H 0 H2 O(l) + Δ H 0 CO- Δ H 0 CO2 - Δ H 0 H2 \u003d -110,5 + (-285,8) - (393,5) - 0 = -2,8 kJ / mol
Δ Sokrug=Σ S 0 con– Σ S 0 ref J/(mol K)
Slično, koristeći referentne podatke standardne entropije supstance, nalazimo:
Δ Sokrug= Δ S 0 H2 O(l) + Δ S 0 CO- Δ S 0 CO2 - Δ S 0 H2 = 197,5 + 70,1 - 213,7 - 130,52 \u003d -76,6 J / (mol K)
Hajde da nađemo Gibbsova energija pod standardnim uslovima
ΔGokrug= Δ H – TΔS\u003d -2,8 + 298 76,6 / 1000 \u003d 20 kJ / mol> 0,
pa je reakcija spontana ne ide.
Pronađi na kojoj temperaturi nastaje ova reakcija spontano.
U stanju ravnoteže ΔGokrug = 0 , onda
T = Δ H/ ∆S = -2,8 / (-76,6 1000) \u003d 36,6 K
Zadatak 8. Izračunavajući na osnovu tabelarnih podataka ΔG i ΔS, odrediti toplotni efekat reakcije:
2 NO (g) + Cl 2 (g) ↔ 2 NOCl (g).
Pri konstantnoj temperaturi i pritisku, promjena Gibbsova energija
ΔG = Δ H – TΔS
Na osnovu tabelarnih podataka izračunavamo ∆G i ∆S
ΔG 0 okrug= Σ ΔG 0 prod — Σ ΔG 0 ref
ΔGokrug= 2 ΔG 0 NOCl(G) — 2 ΔG 0 NO(G) — ΔG 0 Cl2(d)
ΔGokrug= 2 66,37 — 2 89,69 – 0 = — 40,64 kJ/mol
ΔGokrug < 0 , pa je reakcija spontana.
Δ Sokrug=Σ S 0 con– Σ S 0 ref J/(mol K)
Δ Sokrug = 2 ∆S 0 NOCl(G) — 2 ∆S 0 NO(G) — ∆S 0 Cl2(d)
Δ Sokrug = 2 261,6 — 2 210,62 – 223,0 = -121,04 J/(mol K)
Hajde da nađemo Δ H :
Δ H = ΔG + TΔS
Δ H = - 40,64 + 298 (-121,04 / 1000) \u003d - 76,7 kJ / mol
Toplotni efekat reakcije Δ H = - 76,7 kJ / mol
Problem 9. Sa čime će gasoviti hlorovodonik intenzivnije interagovati (po 1 mol): sa aluminijumom ili sa kalajem? Dajte odgovor tako što ćete izračunati ΔG 0 za obje reakcije. Reakcioni proizvodi su čvrsta so i gasoviti vodonik.
Izračunati ∆G0 za reakciju interakcije gasovitog hlorovodonika (po 1 molu) sa aluminijumom
2Al (t) + 6HCl (g) \u003d 2AlCl 3 (t) + 3H 2
ΔG 0 okrug= Σ ΔG 0 prod — Σ ΔG 0 ref kJ/mol
ΔG 0 okruzi1= 2 ΔG 0 AlCl 3 (t) + 3 ΔG 0 H2 — 2 ΔG 0 Al(t) — 6ΔG 0 HCl(G)
ΔG 0 okruzi1= 2 (-636,8) + 3 0 — dvadeset — 6(-95,27) = -701,98 kJ/mol
Tada u reakciji učestvuje 2 mola Al(t). ΔGokruzi1 1 mol Al(t) je jednak
ΔG 0 okrug 1 \u003d -701,98 / 2 \u003d -350,99 kJ / mol
Izračunati ∆G0 za reakciju interakcije plinovitog klorovodika (po 1 molu) s kositrom:
Sn (t) + 2HCl (g) \u003d SnCl 2 (t) + H 2
ΔG 0 okruzi2 =ΔG 0 SnCl 2 (t) + ΔG 0 H2 — ΔG 0 Sn(t) — 2ΔG 0 HCl(G)
ΔG 0 okrug 2 \u003d -288,4 + 0- 0- 2 (-95,27) \u003d -97,86 kJ / mol
Obe reakcije imaju ΔG 0 <0 , stoga spontano teku u smjeru naprijed, ali će plinoviti hlorovodonik intenzivnije komunicirati sa aluminijumom, jer
ΔG 0 okrug 1˂ ΔG 0 okrug 2
Problem 10. Bez pribjegavanja proračunima, odredite koji znaci (>0,<0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 HBr (g) + O 2 (g) ↔ 2 H 2 O (g) + 2 Br 2 (g)
Kako će povećanje temperature utjecati na smjer kemijske reakcije?
Pri konstantnoj temperaturi i pritisku Gibbsova energetska promjena povezan sa entalpijom i entropijom izrazom:
ΔG = Δ H – TΔS
je mjera poremećaja sistema. Vrijednost entropije je veća što je veći poremećaj u sistemu (što je više plinovitih tvari). U ovoj reakciji, broj molova gasova na desnoj strani je 5, a na levoj strani je 4, što znači da se entropija sistema smanjuje ∆S˂0.
Prema stanju problema, reakcija se, dakle, odvija u smjeru naprijed ΔG˂0.
U normalnim uslovima TΔS ˂˂ ΔH, tako i u ovom slučaju ∆H˂0 je egzotermna reakcija.
Kada temperatura poraste može doći vrijeme kada vrijednosti TΔS i Δ H postane isti, tada će sistem doći u ravnotežu ΔG=0. Ako se temperatura značajno poveća, tada će prevladati faktor entropije TΔS, tada se reakcija više neće odvijati spontano ΔG>0.
Da bi se rešio jedan od glavnih problema hemijske termodinamike – da bi se ustanovila fundamentalna mogućnost spontanih procesa – neophodno je imati objektivan kvantitativni kriterijum. Gore je pokazano da su sile koje djeluju u različitim procesima (uključujući i hemijske) dvije konkurentske tendencije ili dva suprotna faktora:
1. Energija, ili entalpija, zbog želje sistema da pređe u stanje sa najnižom energijom, na primjer, pri p = const, smanjite entalpiju (𝛥H< 0);
2. Strukturna, odnosno entropijska, zbog želje sistema da pređe u stanje sa maksimalnim stepenom neuređenosti, tj. povećati entropiju (𝛥S>0).
Ako se stepen poremećenosti ne promijeni u toku reakcije (𝛥S=0), tada je smjer procesa određen promjenom entalpije i proces se odvija spontano u smjeru smanjenja entalpije (𝛥H< 0).
Ako se proces odvija bez promjene entalpije (𝛥H=0), onda je entropija faktor koji određuje smjer reakcije i proces će se spontano povećavati u smjeru njenog povećanja (𝛥S > 0).
Ako se i entalpija i entropija mijenjaju istovremeno, tada je smjer spontanog toka procesa određen ukupnim pokretačka snaga reakcije. Spontana reakcija se odvija u smjeru u kojem je total pokretačka snaga sistemi će se smanjiti.
S obzirom na istovremeno djelovanje ova dva suprotna faktora, takva pokretačka sila (funkcija stanja) za reakcije koje se odvijaju pri konstantnoj temperaturi i pritisku je Gibbsova energija (G), koja se također naziva izobarično-izotermalni potencijal, ili slobodna energija.
Kao kriterijum za određivanje pravca spontanog toka hemijskih procesa (kada je p=const, promena Gibbsove energije 𝛥G ili
𝛥G=G 2 - G 1 (1.27)
U zavisnosti od znaka njegove promene moguća su tri slučaja.
1. 𝛥G< 0, реакция термодинамически возможна.
Pri konstantnoj temperaturi i pritisku, hemijske reakcije se odvijaju spontano samo u pravcu smanjenja Gibbsove energije u sistemu (𝛥G< 0).
Ova odredba je povezana sa principom minimalne energije, koji je u osnovi drugog zakona termodinamike, čija jedna od formulacija glasi:
"Toplota ne može samostalno preći sa manje zagrejanog tela na više zagrejano, samo je spontano moguć obrnuti proces."
2. 𝛥G > 0, reakcija je termodinamički nemoguća;
3. 𝛥G = 0, termodinamički su moguće i direktne i reverzne reakcije.
Odsustvo promene Gibsove energije je termodinamički uslov za uspostavljanje hemijske ravnoteže u reakcionom sistemu.
Gibbsova energija je povezana s entalpijom, entropijom i temperaturom na sljedeći način:
Promjena Gibbsove energije (𝛥G) se tada zapisuje kao:
𝛥G = 𝛥N – T𝛥S (1.28)
Iz jednadžbe 1.28 proizlazi da mogućnost spontanih kemijskih reakcija ovisi o odnosu vrijednosti 𝛥N i T𝛥S. U ovom slučaju moguća su četiri glavna slučaja:
1. Ako je 𝛥N< 0, а 𝛥S >0, tada će Gibbsova energija uvijek biti negativna (𝛥G< 0). Такие реакции термодинамически возможны при любой температуре.
2. Ako je 𝛥N > 0 i 𝛥S< 0, то всегда 𝛥G >0. Takve reakcije su termodinamički nemoguće na bilo kojoj temperaturi.
3. Ako je 𝛥N > 0 i 𝛥S > 0, tada je reakcija moguća samo na visokim temperaturama, kada | 𝛥N |< | Т𝛥S |.
4. Ako je 𝛥N<0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | >| T𝛥S |.
Za izvođenje različitih termodinamičkih proračuna, kao i u slučaju drugih termodinamičkih funkcija, uvodi se poseban koncept: standardna Gibbsova energija stvaranja tvari (𝛥G° uzorak 298). Ovo je promjena Gibbsove energije u reakciji formiranja jednog mola spoja iz odgovarajućih jednostavnih supstanci, kada su sve sudionice u standardnom stanju, a reakcija se odvija pod standardnim uvjetima (obično se mjeri u kJ / mol). pri čemu:
Standardna Gibbsova energija formiranja jednostavnih supstanci uslovno se uzima jednakom nuli.
Priručnici obično daju vrijednosti standardnih Gibbsovih energija formiranja supstance na 298 K. Poznavajući vrijednosti 𝛥H i 𝛥S, može se izračunati vrijednost 𝛥G na drugim temperaturama i, shodno tome, predvidjeti mogućnost ili nemogućnost spontane reakcije.
Gibbsova energija je funkcija stanja sistema. Dakle, njegova promjena u toku određene hemijske reakcije zavisi samo od prirode, fizičkog ili agregatnog stanja početnih supstanci i produkta reakcije, njihove količine i ne zavisi od međufaza reakcije ili od načina na koji je dati sistem reakcije. dostigla konačno stanje, tj.
Prilikom zbrajanja, broj molova (v) svih supstanci koje sudjeluju nužno se uzima u obzir.
Primjer 1. Izračunati  reakcija, zasnovana na standardnim toplotama formiranja.
reakcija, zasnovana na standardnim toplotama formiranja.






