Topljenje vode. Postoje taline prema vrsti hemijskih jedinjenja. Koliko košta pisanje vašeg rada
ESSAY
"Tijela koja se tope"
Izvedeno:
Prisyazhnyuk Olga 9-A
Provjereno:
Nevzorova Tatyana Igorevna
Uvod
Proračun količine topline
Topljenje
Specifična toplota fuzije
Topljenje metala
Tačka topljenja i ključanja vode
topi se
Zanimljivo o topljenju
Zaključak (zaključci)
Spisak korišćene literature
Uvod
Agregatno stanje - stanje materije koje karakteriziraju određena kvalitativne osobine: sposobnost ili nemogućnost održavanja volumena i oblika, prisustvo ili odsustvo reda dugog i kratkog dometa i dr. Promjena agregacijskog stanja može biti praćena skokovitom promjenom slobodne energije, entropije, gustoće i drugih osnovnih fizičkih svojstava.
Postoje tri glavna agregatna stanja: čvrsto, tečno i gasovito. Ponekad nije sasvim ispravno klasifikovati plazmu kao stanje agregacije. Postoje i druga stanja agregacije, na primjer, tekući kristali ili Bose-Einstein kondenzat.
Promjene u agregacijskom stanju su termodinamički procesi koji se nazivaju fazni prijelazi. Razlikuju se sljedeće varijante: od čvrstog do tekućeg - topljenje; iz tečnog u gasovito - isparavanje i ključanje; od čvrstog do gasovitog - sublimacija; iz gasovitog u tečno ili čvrsto - kondenzacija. Posebnost je odsustvo oštre granice prijelaza u stanje plazme.
Za opisivanje različitih stanja u fizici koristi se širi koncept termodinamičke faze. Pojave koje opisuju prelaze iz jedne faze u drugu nazivaju se kritične pojave.
Čvrsto: Stanje koje karakteriše sposobnost održavanja volumena i oblika. Atomi čvrstog tijela prave samo male vibracije oko stanja ravnoteže. Postoji i poredak dugog i kratkog dometa.
Tečnost: Stanje tvari u kojem ima nisku stišljivost, odnosno dobro zadržava volumen, ali nije u stanju zadržati svoj oblik. Tečnost lako poprima oblik posude u koju se nalazi. Atomi ili molekuli tečnosti vibriraju blizu ravnotežnog stanja, zaključani drugim atomima, i često skaču na druga slobodna mjesta. Postoji samo poredak kratkog dometa.
Gas: Stanje koje karakteriše dobra kompresibilnost, bez mogućnosti zadržavanja volumena i oblika. Plin ima tendenciju da zauzme cjelokupni volumen koji mu se daje. Atomi ili molekuli plina ponašaju se relativno slobodno, udaljenosti između njih su mnogo veće od njihove veličine.
Ostala stanja: Nakon dubokog hlađenja, neke (daleko ne sve) supstance prelaze u supravodljivo ili superfluidno stanje. Ova stanja su, naravno, odvojene termodinamičke faze, ali teško da zaslužuju da se nazivaju novim agregatnim stanjima materije zbog svoje neuniverzalnosti. Nehomogene supstance kao što su paste, gelovi, suspenzije, aerosoli itd., koje pod određenim uslovima ispoljavaju svojstva i čvrstih i tečnih, pa čak i gasova, obično se klasifikuju kao dispergovani materijali, a ne u neka specifična agregatna stanja materije.
Topljenje
Rice. 1. Stanje čiste materije (dijagram)

Rice. 2. Temperatura topljenja kristalnog tijela

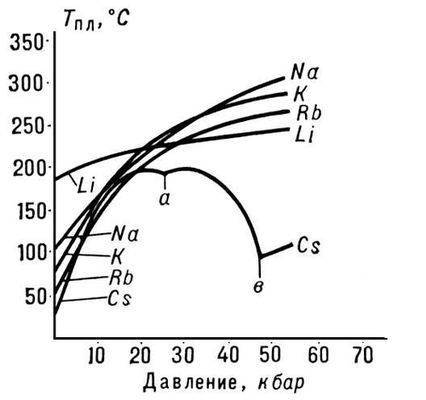
Rice. 3. Tačka topljenja alkalnih metala
Topljenje - prijelaz tvari iz kristalnog (čvrstog) stanja u tekućinu; nastaje sa apsorpcijom toplote (fazni prijelaz prvog reda). Glavne karakteristike P. čistih supstanci su tačka topljenja (Tmelt) i toplota koja je neophodna za sprovođenje procesa P. (toplota topljenja Qmelt).
Temperatura P. zavisi od spoljašnjeg pritiska p; na dijagramu stanja čiste supstance ova zavisnost je prikazana krivuljom topljenja (kriva koegzistencije čvrste i tečne faze, AD ili AD" na slici 1). Topljenje legura i čvrstih rastvora se dešava, kao pravilo, u temperaturnom opsegu (sa izuzetkom eutektika sa konstantnim Tmelt) Ovisnost temperature početka i kraja P. legure od njenog sastava pri datom pritisku prikazana je na dijagramima stanja posebnim linijama ( krivulje likvidusa i solidusa, vidi Binarni sistemi) od čvrstog kristalnog stanja do izotropne tečnosti odvija se u fazama (u određenom temperaturnom opsegu), svaka faza karakteriše određeni stupanj u razaranju kristalne strukture.
Prisustvo određene temperature P. važan je znak ispravne kristalne strukture čvrstih materija. Na osnovu toga ih je lako razlikovati od amorfnih čvrstih materija koje nemaju fiksni Tm. Amorfne čvrste materije postepeno prelaze u tečno stanje, omekšavajući sa povećanjem temperature (vidi Amorfno stanje). Volfram ima najvišu temperaturu među čistim metalima (3410°C), a živa najnižu (-38,9°C). Posebno vatrostalna jedinjenja uključuju: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), itd. Po pravilu, za supstance sa visokim Tm karakteriziraju veće vrijednosti Qm. Nečistoće prisutne u kristalnim supstancama smanjuju njihov Tm. Ovo se u praksi koristi za dobijanje legura sa niskim Tmelt (vidi, na primer, Wood-ova legura sa Tmelt = 68 °C) i smeša za hlađenje.
P. počinje kada kristalna supstanca dostigne Tpl. Od početka P. do njegovog završetka, temperatura supstance ostaje konstantna i jednaka Tmelt, uprkos prenosu toplote na supstancu (slika 2). U normalnim uslovima nije moguće zagrijati kristal na T > Tmelt (vidi Pregrijavanje), dok se tokom kristalizacije relativno lako postiže značajno prehlađenje taline.
Priroda zavisnosti Tm od pritiska p određena je smerom zapreminskih promena (DVm) na P. (vidi Clapeyron-Clausiusovu jednačinu). U većini slučajeva, P. supstance je praćen povećanjem njihovog volumena (obično za nekoliko posto). Ako je to slučaj, onda povećanje pritiska dovodi do povećanja Tm (slika 3). Međutim, u nekim supstancama (voda, brojni metali i metalidi, vidi sliku 1), tokom P. dolazi do smanjenja volumena. Temperatura P. ovih supstanci opada sa povećanjem pritiska.
P. je praćen promjenom fizičkih svojstava tvari: povećanje entropije, što odražava poremećaj kristalne strukture tvari; povećanje toplotnog kapaciteta, električnog otpora [sa izuzetkom nekih polumetala (Bi, Sb) i poluprovodnika (Ge), koji imaju veću električnu provodljivost u tečnom stanju]. Tokom P., otpor na smicanje pada na gotovo nulu (poprečni elastični valovi se ne mogu širiti u talini, vidi tekućina), smanjuje se brzina širenja zvuka (longitudinalni valovi) itd.
Prema molekularnim i kinetičkim prikazima, P. se izvodi na sljedeći način. Kada se toplota primeni na kristalno telo, povećava se energija vibracija (amplituda oscilovanja) njegovih atoma, što dovodi do povećanja telesne temperature i doprinosi stvaranju raznih vrsta defekata u kristalu (neispunjeni čvorovi kristalne rešetke - slobodna mjesta; kršenje periodičnosti rešetke atomima ugrađenim između njenih čvorova, itd., vidi Defekti u kristalima). U molekularnim kristalima može doći do djelomičnog poremećaja međusobne orijentacije osi molekula ako molekuli nemaju sferni oblik. Postepeni porast broja defekata i njihova povezanost karakterizira fazu pre topljenja. Kada se Tmelt postigne, u kristalu se stvara kritična koncentracija defekata i počinje kristalizacija; kristalna rešetka se raspada na lako pokretne submikroskopske regije. Toplota dovedena tokom P. ne koristi se za zagrijavanje tijela, već za razbijanje međuatomskih veza i uništavanje dugog dometa u kristalima (vidi Redosled dugog dometa i poredak kratkog dometa). U samim submikroskopskim područjima, s druge strane, poredak kratkog dometa u rasporedu atoma se ne mijenja značajno na tački topljenja (koordinacijski broj taline na Tmelt u većini slučajeva ostaje isti kao i kristala). Ovo objašnjava niže vrijednosti topline fuzije Qm u odnosu na topline isparavanja i relativno malu promjenu niza fizičkih svojstava tvari tokom njihovog P.
Proces pirolize igra važnu ulogu u prirodi (piroliza snijega i leda na površini zemlje, mineralizacija minerala u njenim dubinama, itd.) i u tehnologiji (proizvodnja metala i legura, livenje u kalupe, itd.) .
Specifična toplota fuzije
Specifična toplota fuzije (također: entalpija fuzije; postoji i ekvivalentan koncept specifične toplote kristalizacije) - količina toplote koja se mora preneti jednoj jedinici mase kristalne supstance u ravnotežnom izobarično-izotermnom procesu kako bi se da ga prevede iz čvrstog (kristalnog) stanja u tečno (ista količina toplote koja se oslobađa tokom kristalizacije supstance). Toplina fuzije je poseban slučaj topline faznog prijelaza prvog reda. Razlikovati specifičnu toplinu fuzije (J/kg) i molarnu (J/mol).
Specifična toplota fuzije označena je slovom (grčko slovo lambda) Izračunska formula specifična toplota tačka topljenja:
gdje je specifična toplina fuzije, količina topline koju je primila supstanca tokom topljenja (ili oslobođena tokom kristalizacije), je masa tvari koja se topi (kristalizira).
Topljenje metala
Prilikom topljenja metala moraju se poštovati određena pravila. Pretpostavimo da će otopiti olovo i cink. Olovo će se brzo otopiti, imajući tačku topljenja od 327°; cink će, s druge strane, dugo ostati čvrst, jer je njegova tačka topljenja iznad 419 °. Šta će dovesti do takvog pregrijavanja? Počet će biti prekriven filmom prelijepe boje, a zatim će njegova površina biti skrivena ispod sloja praha koji se ne topi. Olovo je izgorjelo od pregrijavanja, oksidiralo se spajanjem s kisikom u zraku. Ovaj proces, kao što znate, odvija se na običnoj temperaturi, ali kada se zagrije, ide mnogo brže. Dakle, dok se cink počne topiti, ostat će vrlo malo metalnog olova. Ispostavit će se da je legura potpuno drugačijeg sastava, kako se i očekivalo, a velika količina olova će se izgubiti u obliku otpada. Jasno je da prvo moramo rastopiti vatrostalniji cink, a zatim u njega staviti olovo. Ista stvar će se dogoditi ako se cink legira sa bakrom ili mesingom, prvo zagrijavanjem cinka. Cink će izgorjeti do trenutka kada se bakar otopi. To znači da uvijek prvo morate rastopiti metal s višom tačkom topljenja.
Ali ovaj ne može izbjeći ludnicu. Ako se pravilno zagrijana legura dugo vremena drži na vatri, na površini tekućeg metala se ponovo stvara film kao rezultat isparenja. Jasno je da će se topljiviji metal ponovo pretvoriti u oksid i sastav čepa će se promijeniti; To znači da se metal ne može pregrijati duže vrijeme bez potrebe. Stoga pokušavaju na sve moguće načine smanjiti otpad metala, polažući ga u kompaktnu masu; sitni komadići, piljevina, strugotine se prvo „pakuju“, tope se komadi manje-više iste veličine, zagrijavaju na dovoljnoj temperaturi, a metalna površina se štiti od kontakta sa zrakom. U tu svrhu majstor može uzeti boraks ili jednostavno pokriti površinu metala slojem pepela, koji će uvijek plutati na vrhu (zbog manje specifične težine) i neće ometati pri izlivanju metala. Kada se metal stvrdne, javlja se još jedan fenomen, vjerovatno poznat i mladim majstorima. Metal se, skrućivanjem, smanjuje u volumenu, a to smanjenje nastaje zbog unutrašnjih, još ne očvrsnutih metalnih čestica. Na površini odljevka ili unutar njega formira se manje ili više značajno udubljenje u obliku lijevka, takozvana šupljina skupljanja. Obično se kalup izrađuje na način da se na tim mjestima odljevka formiraju rupe za skupljanje, koje se naknadno uklanjaju, pokušavajući zaštititi sam proizvod što je više moguće. Jasno je da rupe za skupljanje kvare odljevak i ponekad ga mogu učiniti neupotrebljivim. Nakon topljenja, metal se lagano pregrijava tako da je tanji i topliji i samim tim bolje ispunjava detalje kalupa i ne smrzava se prerano od kontakta sa hladnijim kalupom.
Budući da je tačka topljenja legura obično niža od tačke topljenja najvatrostalnijih metala koji čine leguru, ponekad je korisno učiniti suprotno: prvo rastopiti topljiviji, a zatim vatrostalniji metal. Međutim, to je dopušteno samo za metale koji nisu jako oksidirani ili pod uvjetom da su ti metali zaštićeni od pretjerane oksidacije. Potrebno je uzeti više metala nego što je potrebno za samu stvar, kako bi ispunio ne samo kalup, već i kanal za ulijevanje. Jasno je da prvo morate izračunati potrebnu količinu metala.
Tačka topljenja i ključanja vode
Najviše iznenađujuće i najblaženije svojstvo vode za živu prirodu je njena sposobnost da bude tečnost u "normalnim" uslovima. Molekuli jedinjenja veoma sličnih vodi (na primer, molekuli H2S ili H2Se) su mnogo teži, ali pod istim uslovima formiraju gas. Stoga se čini da je voda u suprotnosti sa zakonima periodnog sistema, koji, kao što znate, predviđa kada, gdje i koja svojstva supstanci će biti bliska. U našem slučaju iz tabele proizilazi da bi se svojstva vodikovih spojeva elemenata (nazvanih hidridi) koji se nalaze u istim vertikalnim stupovima trebalo monotono mijenjati sa povećanjem mase atoma. Kiseonik je element šeste grupe ove tabele. U istoj grupi su sumpor S (atomske mase 32), selen Se (atomske mase 79), telur Te (atomske mase 128) i polonijum Po (atomske mase 209). Slijedom toga, svojstva hidrida ovih elemenata bi se trebala monotono mijenjati pri prelasku sa teških elemenata na lakše, tj. u nizu H2Po → H2Te → H2Se → H2S → H2O. Što se i događa, ali samo sa prva četiri hidrida. Na primjer, tačke ključanja i topljenja rastu kako se povećava atomska težina elemenata. Na slici, križići označavaju tačke ključanja ovih hidrida, a krugovi označavaju tačke topljenja.

Kao što se može vidjeti, kako se atomska težina smanjuje, temperature opadaju prilično linearno. Područje postojanja tekuće faze hidrida postaje sve "hladnije", a kada bi kisikov hidrid H2O bio normalno jedinjenje, slično njegovim susjedima u šestoj grupi, tada bi tekuća voda postojala u rasponu od - 80 °C do -95 °C. Na više Na visokim temperaturama, H2O bi uvijek bio plin. Na našu sreću i svu sreću na Zemlji, voda je anomalna, ne prepoznaje periodični obrazac, već slijedi svoje zakone.
To se objašnjava jednostavno - većina molekula vode povezana je vodikovim vezama. Upravo te veze razlikuju vodu od tečnih hidrida H2S, H2Se i H2Te. Da nisu, tada bi voda ključala već na minus 95°C. Energija vodoničnih veza je prilično visoka i one se mogu prekinuti samo na mnogo višoj temperaturi. Čak iu gasovitom stanju, veliki broj molekula H2O zadržava svoje vodonične veze, spajajući se u (H2O)2 dimere. Potpuno vodonične veze nestaju samo pri temperaturi vodene pare od 600 °C.
Podsjetimo da se ključanje sastoji u činjenici da se unutar kipuće tekućine formiraju mjehurići pare. Pri normalnom pritisku, čista voda ključa na 100 "C. Ako se toplota dovodi kroz slobodnu površinu, proces površinskog isparavanja će se ubrzati, ali ne dolazi do volumetrijskog isparavanja karakterističnog za ključanje. Vrenje se može izvesti i spuštanjem spoljašnjeg pritisak, pošto se u ovom slučaju pritisak para jednak spoljašnjem pritisku postiže na nižoj temperaturi. Na vrhu veoma visoke planine pritisak i, shodno tome, tačka ključanja su toliko niski da voda postaje nepodesna za kuvanje - nije postignuta potrebna temperatura vode. Uz dovoljno visok pritisak, voda se može zagrijati toliko da se u njoj može otopiti olovo (327°C), a opet neće ključati.
Pored super velikih tačaka ključanja (a ovaj drugi proces zahteva previše toplote fuzije za tako jednostavnu tečnost), sam opseg postojanja vode je anomalan - sto stepeni po kojima se te temperature razlikuju - prilično veliki raspon za tako nisku molekularnu tečnost kao što je voda. Granice dopuštenih vrijednosti hipotermije i pregrijavanja vode su neobično velike - uz pažljivo zagrijavanje ili hlađenje, voda ostaje tečna od -40 ° C do +200 ° C. Ovo proširuje temperaturni raspon u kojem voda može ostati tečna na 240 °C.
Kada se led zagrije, njegova temperatura prvo raste, ali od trenutka formiranja mješavine vode i leda, temperatura će ostati nepromijenjena sve dok se sav led ne otopi. To se objašnjava činjenicom da se toplina koja se dovodi do topljenog leda prvenstveno troši samo na uništavanje kristala. Temperatura topljenja leda ostaje nepromijenjena sve dok se svi kristali ne unište (vidi latentnu toplinu fuzije).
topi se
Taline su tečno rastopljeno stanje tvari na temperaturama u određenim granicama udaljenim od kritične točke topljenja i koje se nalaze bliže tački topljenja. Priroda taline je inherentno određena vrstom kemijskih veza elemenata u rastopljenoj tvari.
Taline se široko koriste u metalurgiji, staklarstvu i drugim oblastima tehnologije. Taline obično imaju složen sastav i sadrže različite komponente koje međusobno djeluju (vidi fazni dijagram).
Otopi se
1. Metalik (Metali (naziv dolazi od latinskog metallum - rudnik, rudnik) - grupa elemenata sa karakterističnim metalnim svojstvima, kao što su visoka toplotna i električna provodljivost, pozitivni temperaturni koeficijent otpora, visoka duktilnost i metalni sjaj);
2. Jonski (Ion (starogrčki ἰόν - ide) - jednoatomna ili poliatomska električno nabijena čestica nastala kao rezultat gubitka ili dodavanja jednog ili više elektrona atomu ili molekuli. Ionizacija (proces stvaranja jona) može nastaju na visokim temperaturama, pod uticajem električnog polja);
3. Poluprovodnici sa kovalentnim vezama između atoma (Poluprovodnici - materijali koji po svojoj provodljivosti zauzimaju srednje mesto između provodnika i dielektrika i razlikuju se od provodnika po jakoj zavisnosti provodljivosti od koncentracije nečistoća, temperature i raznih vrsta zračenja. glavno svojstvo ovih materijala je povećanje električne provodljivosti sa povećanjem temperature);
4. Organske taline sa van der Waalsovim vezama;
5. Visoki polimeri (Polimeri (grč. πολύ- - mnogo; μέρος - deo) - anorganske i organske, amorfne i kristalne supstance dobijene uzastopnim ponavljanjem različitih grupa atoma, nazvane "monomerne jedinice", povezane u dugačke makromolekule hemijskim ili koordinacionim obveznice)
Taline prema vrsti hemijskih jedinjenja su:
1. Sol;
2.Oxide;
3. Oksidno-silikatna (šljaka) itd.
Topi sa posebnim svojstvima:
1.Eutektički
Zanimljivo o topljenju
Zrnca leda i zvijezde.
Odnesite komad čistog leda u toplu prostoriju i gledajte kako se topi. Brzo će postati jasno da se led, koji je izgledao monolitan i homogen, raspada na mnoga mala zrna - pojedinačne kristale. U zapremini leda, nalaze se nasumično. Jednako zanimljiva slika može se vidjeti kada se led otopi sa površine.
Donesite glatki komad leda na lampu i sačekajte dok se ne počne topiti. Kada topljenje dodirne unutrašnja zrna, tamo će se početi pojavljivati vrlo fini uzorci. Uz jaku lupu možete vidjeti da imaju oblik heksagonalnih pahuljica. U stvari, to su rastopljene udubine ispunjene vodom. Oblik i smjer njihovih zraka odgovaraju orijentaciji monokristala leda. Ovi obrasci se zovu "Tyndallove zvijezde" po engleskom fizičaru koji ih je otkrio i opisao 1855. godine. "Tyndallove zvijezde", slične pahuljama, zapravo su udubljenja na površini otopljenog leda, veličine oko 1,5 mm, ispunjena vodom. U njihovom središtu vidljivi su mjehurići zraka, koji su nastali zbog razlike u zapremini otopljenog leda i otopljene vode.
DA LI STE ZNALI?
Postoji metal, takozvana Vudova legura, koja se lako rastopi čak iu toploj vodi (+68 stepeni Celzijusa). Dakle, prilikom miješanja šećera u čaši, metalna kašika napravljena od ove legure će se otopiti brže od šećera!
Najvatrostalnija supstanca, tantal karbid TaCO-88, topi se na temperaturi od 3990°C.
1987. godine, njemački istraživači su uspjeli superohladiti vodu na -700C dok su je održavali u tečnom stanju.
Ponekad se, da bi se snijeg na trotoarima brže otopio, posipaju solju. Do topljenja leda dolazi jer nastaje rastvor soli u vodi, čija je tačka smrzavanja niža od temperature vazduha. Rješenje samo poteče s trotoara.
Zanimljivo je da stopala postaju hladnija na mokrom kolovozu, jer je temperatura rastvora slane vode niža od one u čistom snegu.
Ako čaj iz čajnika sipate u dve šolje: sa šećerom i bez šećera, onda će čaj u šolji sa šećerom biti hladniji, jer. otapanje šećera (uništenje njegove kristalne rešetke) također troši energiju.
U teškim mrazima, da bi se povratila glatkoća leda, klizalište se zalijeva toplom vodom.Topla voda topi tanak gornji sloj leda, ne smrzava se tako brzo, ima vremena da se raširi, a površina leda je vrlo glatka.
Zaključak (zaključci)
Topljenje je prijelaz tvari iz čvrstog u tekuće stanje.
Kada se zagrije, temperatura tvari raste, a brzina toplinskog kretanja čestica raste, dok se unutarnja energija tijela povećava.
Kada temperatura čvrste supstance dostigne tačku topljenja, kristalna rešetka čvrste supstance počinje da se raspada. Dakle, glavni dio energije grijača, provedenog na čvrsto tijelo, troši se na smanjenje veza između čestica tvari, odnosno na uništavanje kristalne rešetke. U tom slučaju se povećava energija interakcije između čestica.
Rastopljena supstanca ima veće skladište unutrašnje energije nego u čvrstom stanju. Preostali dio topline fuzije troši se na rad na promjeni volumena tijela tokom njegovog topljenja.
Tokom topljenja, volumen većine kristalnih tijela se povećava (za 3-6%), a smanjuje se tokom skrućivanja. Ali, postoje tvari u kojima se, kada se otape, volumen smanjuje, a kada se stvrdne, povećava. To uključuje, na primjer, vodu i lijevano željezo, silicij i neke druge. . Zato led pliva na površini vode, a čvrsto liveno gvožđe - u sopstvenom topljenju.
Čvrste tvari koje se nazivaju amorfne (ćilibar, smola, staklo) nemaju određenu tačku topljenja.
Količina topline potrebna za otapanje tvari jednaka je proizvodu specifične topline fuzije pomnoženoj s masom tvari.
Specifična toplina fuzije pokazuje koliko je topline potrebno za potpuno prevođenje 1 kg tvari iz čvrstog u tekuće stanje, uzeto pri brzini topljenja.
Jedinica specifične topline fuzije u SI je 1J/kg.
Tokom procesa topljenja, temperatura kristala ostaje konstantna. Ova temperatura se naziva tačka topljenja. Svaka supstanca ima svoju tačku topljenja.
Tačka topljenja za datu supstancu zavisi od atmosferskog pritiska.
Spisak korišćene literature
Podaci iz elektronske slobodne enciklopedije "Wikipedia"
en./wiki/Main_page
Sajt "Čas! Fizika za radoznale" class-fizika.narod/8_11.htm
Web stranica "Fizička svojstva vode"
sve-o-voda/temperatura ključanja.php
Sajt "Metali i konstrukcije"
metaloconstruction/osnovy-plavleniya-metallov/
Slični sažetci:
Glavno svojstvo tečnosti je promjena oblika pod utjecajem mehaničkog djelovanja. Idealne i prave tečnosti. Koncept Njutnovskih fluida. Metoda za određivanje svojstava tečnosti. Slobodno formiranje površine i površinski napon.
Kamčatka Državna akademija ribarska flota SAŽETAK Na temu: „Fazna ravnoteža i fazne transformacije"Napisao: Primio: IEF student Isakov A.Ya.
1. SVOJSTVA I STRUKTURA VODE
1.1. Anomalija svojstava vode
Tek krajem 18. i početkom 19. vijeka. postao svjestan šta čini supstanca koja se zove voda. Eksperimenti G. Cavendisha, A. Lavoisier-a, A. Humboldta, J.L. Gay-Lussac je dokazao da voda nastaje iz dvije zapremine vodonika i jedne zapremine kiseonika, tj. ima hemijsku formulu H 2 O i molekulska težina 18. Međutim, postepeno je postalo jasno da je u gotovo svim fizičko-hemijskim parametrima ova supstanca jedinstvena, oštro se razlikuje od ostalih prirodnih spojeva.
Tačke topljenja i ključanja vode
Zasnovani su na prihvaćenim referentnim sistemima temperature.
Odabir vode za kreiranje temperaturnih skala.
Celzijus(1701-44). Celzijusova skala -1741 Tačke ključanja i topljenja vode at atmosferski pritisak jednaka 100 o C odnosno 0 o C,
Réaumur(1683-1757). Reaumurova skala od 1730. Tačka ključanja vode uzima se kao 80 o (1 o C \u003d 5/4 o R).
Fahrenheit(1686-1736). Tačka topljenja leda uzima se kao 32 o F, tačka ključanja vode je 180 o F (t o C = 5/9 t o F - 32).
Otkriće periodičnog zakonaD.I. Mendeljejev (1869). Nesklad između fizičkih parametara vode i periodičnog zakona.
Neslaganje sa periodičnim zakonom može se uočiti iz poređenja tačaka ključanja i topljenja vodonikovih jedinjenja elemenata grupe kiseonika. Podaci za H 2 Se uzeti su iz grafikona. Za vodu se vidi da bi u skladu sa periodičnim zakonom, tačka topljenja vode bila oko minus 90o, a tačka ključanja oko -70o. Voda bi u "normalnim" uslovima bila otrovan gas neprijatnog mirisa. Život na Zemlji bi bio nemoguć.
Zahvaljujući ovim „anomalnim“ svojstvima, voda štiti život i reguliše toplotni i gasni režim naše planete.
Toplotni kapacitet vode
Specifični toplotni kapacitet vode je najveći od svih tečnosti. I ovdje se voda uzima kao standard: da bi se 1 g vode zagrijao za 1 o C potrošiti 1 kaloriju toplinske energije (calor - toplina, lat.). Za poređenje: gips - 0,27, suha glina 0,22 kal. (1 kal = 4,187 J.). Specifični toplotni kapacitet leda i pare je upola manji - 0,5 cal/g. deg. Latentne toplote topljenja i isparavanja vode su takođe neobično velike - 79 i 539 kal. Dakle, da biste pretvorili 1 g leda s temperaturom od 0 ° C u paru, trebate potrošiti 79 + 100 + 539 = 718 kalorija topline. Zbog tako izuzetno velikog toplotnog kapaciteta, voda je glavni regulator toplotnog režima na našoj planeti. Utjecaj Svjetskog okeana utiče na skoro sve tačke Zemlje, čak i najudaljenije od morske obale, koje karakteriše tzv. kontinentalna klima. Velika vodena tijela, a prije svega Svjetski okean, regulatori su termičkog režima Zemlje. Za sloj tla, godišnji promet topline je 1,5-3 kcal / cm 2, za, na primjer, Baltičko i Crno more 48-52. U nedostatku rezervoara temperatura bi ljeti porasla, a zimi bi opala za nekoliko stotina stepeni i život na zemlji bi bionemoguće; naprotiv, da je Zemlja potpuno prekrivena okeanom, godišnja amplituda vazduha bi se promenila od 0 na ekvatoru do 5-6 o C na polovima. Utjecaj okeana proteže se na cijelu planetu, uključujući hladne polove na Antarktiku.
Visok toplinski kapacitet vode povezan je s takvim pokazateljima kao što su latentna toplota fuzije, komponenta 333,7 10 3 J/kg, i latentna toplota isparavanje, komponenta 2258,10 3 J/kg, tj. Potrebna je ogromna količina energije da se 1 kg leda pretvori u tečnost i 1 kg tekuće vode u paru. To svedoči o visokom energetskom intenzitetu vode, što predodređuje njenu isključivu ulogu akumulatora energije u toku prirodnih procesa.
Dielektrična konstanta vode ( )
Vrijednost dielektrična konstanta jer je voda najviša od svih tečnosti i jednaka je 80,1 na temperaturi od 20°C. na temperaturi od oko 0°C je oko 82. To znači da kada se soli rastvore u vodi, jačina električne interakcije između suprotno nabijene čestice se smanjuju za 80 puta, uzrokujući da se soli disociraju u ione. Većina rastvarača nema više od 50, nepolarnih tečnosti (benzin, kerozin) ne više od 3. Ovo svojstvo vode predodređuje pojavu elektrolitička disocijacija, tj. sposobnost soli, kiselina, alkalija da se razlažu u vodenim rastvorima na suprotno nabijene ione. Voda je inertna kao rastvarač. Donosi hranjive tvari živim organizmima i izbacuje toksine i ne postoji ništa što bi ga zamijenilo. To. i bez ovog svojstva vode život na zemlji bi bionemoguće.
Voda rastvara minerale, ali se oni ponovo rađaju ako voda ispari. Ova karakteristika je od kolosalnog geološkog i biološkog značaja, predodređuje cikluse vode različitih redova, koji se odvijaju u nekoliko sati (u živim organizmima) i traju milionima godina u utrobi Zemlje (geološki). Očigledno je pojava života na Zemlji u velikoj mjeri posljedica ovog nevjerovatnog svojstva vode.
Gustina vode .
Sve supstance imaju maksimalnu gustinu na tački topljenja, osim vode. Maksimalna gustina vode(1,0 g / cm 3) odgovara t-re 3,98 o; gustina leda 0,918 g/cm 3 ; samo voda ne tone u vlastitom topljenju; Tales iz Mileta je skrenuo pažnju na to. Kada se voda zamrzne, formira se tanka zaštitna ledena kora, koja osigurava očuvanje vodnih tijela, prvenstveno Svjetskog okeana, glavnog regulatora vazdušnog režima planete. I bez ovog svojstva vode život bi poprimio potpuno drugačiji oblik.
1.2. Ideje o skrivenoj strukturi vode
Struktura vode. Tridesete godine dvadesetog veka donele su novo veliko otkriće vezano za proučavanje vode: engleski fizičari J. Bernal i R. Fowler su na osnovu rendgenskih i spektroskopskih studija ustanovili da su molekuli vode uređeni na određeni način. , svaki molekul vode je okružen sa četiri druga u tetraedru. Time je potvrđena izjava iznesena krajem 18. vijeka. V. Roentgen je razmišljao o složenoj strukturi tekuće vode i postojanju dodatnih veza između pojedinačnih molekula. Naučnici ovu pojavu nazivaju struktura vode, iako je jasno da ju je nemoguće u potpunosti poistovjetiti s kristalnom rešetkom čvrstih tvari, budući da je tekuća voda mješavina monomernih i polimernih molekula, veze između pojedinačnih monomera su dinamičke: one se neprestano pojavljuju, razgrađuju, jačaju, slabe.
Glavni razlog postojanja strukture vode je posebna vrsta veze između pojedinačnih atoma - vodonik. Ova veza je po prirodi elektrostatička, ali je slabija od normalne. valentna veza između atoma vodika i kisika formirajući odvojene monomere. U svakom H 2 O monomeru, razmak između atoma vodika i kiseonika je 0,1 nm, a ugao formiran između valentnih veza je oko 105º. U vodikovoj vezi, razmak između atoma se povećava na 0,176 nm i nije striktno konstantan.
Postoji nekoliko modela strukture vode zasnovanih na ideji povezivanja pojedinačnih monomera vodoničnim vezom. J. Bernal i R. Fowler su predložili postojanje tri tipa molekularnog rasporeda: a) strukture koje se približavaju kristalnoj rešetki leda postoje na temperaturama od 0 do 4ºS; b) strukture poput kvarca, preovlađuju na temperaturi od 4-200ºS; c) zbijene strukture tipične za normalne tečnosti (gotovo bez vodoničnih veza) pojavljuju se na temperaturama iznad 200 ºS [Blokh A.M. Struktura vode i geološki procesi.L., 1969, str.216].
Zanimljiv pristup tumačenju strukturnih karakteristika vode predložio je italijanski fizičar M. Angeno (1967). Prema njegovim idejama, svaka molekula vode može sudjelovati u najviše dvije, već takozvane kolektivne vodikove veze, zbog kojih kombinacija valentne i vodikove veze formira veze. različite vrste(Sl. 1).
Rice. 1. Molekularni agregati u tekućoj vodi (prema M. Ajendo).
Ove karike mogu formirati lance, prstenove i složenije sisteme koji se kontinuirano formiraju, uništavaju i razmjenjuju molekule. Gde ukupan broj vodonični mostovi u sistemu ostaju konstantni i mogući tipovi agregata su prisutni u vodi u različitim proporcijama u statičkoj ravnoteži određenoj temperaturom. Čini se da se prstenovi od šest molekula približavaju strukturi leda.
Sa stanovišta strukturne strukture tekuće vode, objašnjene su sve njene anomalne osobine. Potreba za uništavanjem vodikovih veza predodređuje visok energetski intenzitet vode, zbog čega tačke topljenja i ključanja, toplinski kapacitet i latentne topline topljenja i isparavanja postaju abnormalno visoke. Kada se voda ohladi u temperaturnom rasponu od 4 do 0ºS, struktura se restrukturira od gušćeg tetragonalnog do heksagonalnog pakovanja leda. Jaka veza između molekula vode čini ga inertnim prema otopljenim tvarima. Kako strukturu vode čine elektrostatičke veze, na nju utiču različita polja (temperaturna, geodinamička, magnetska, električna).
Kako temperatura raste, struktura vode počinje da se ruši. Procjene različitih autora, koji izračunavaju postotak molekula sa očuvanim vodikovim vezama, su bliske: oko polovina molekula je strukturirana u hladnoj vodi, a pri dostizanju temperature od 100°C strukturne veze se zadržavaju u oko 30% molekula. , a kada se približi kritičnoj temperaturi (374°C) strukturirani molekuli nestaju.
Kada se primeni pritisak, molekuli tečnosti se približavaju jedni drugima i njihov viskozitet se povećava. Voda se ponaša sasvim drugačije. Prve faze opterećenja dovode do restrukturiranja strukture vode, popunjavanja međumolekularnih praznina, praćeno smanjenjem njene viskoznosti, a tek počevši od pritisaka od oko 100 MPa (dovoljno visokih za prirodne uvjete) počinje postupno povećanje viskoznosti.
1.3. Sorte vode
Strukturna svojstva vode i postojanje nekoliko izotopa kiseonika i vodonika razlog su zašto voda može formirati mnoge fizičko-hemijske vrste. Evo nekih od njih.
Ideje o aktiviranoj vodi
Eksperimenti novosibirskih naučnika (F.A. Letnikov i drugi) na tretmanu vode u autoklavima na temperaturama od 300-400 ºS i pritiscima do 100 MPa pokazali su da se time povećava sposobnost rastvaranja vode za mnoge minerale (do sulfida, gipsa, kvarca), pH se smanjuje, električna provodljivost se povećava. Utjecaj temperature i pritiska na promjenu vodenih struktura doveo je stručnjake do ideje o mogućnosti simulacije svojstava vode koja se nalazi na velikim dubinama (tj. na visokim temperaturama i pritiscima), te doveo do otkrića tzv. pozvao aktiviranu vodu . Nakon tretmana vode u autoklavima Otkrivanje aktiviranog stanja u vodi termomineralnih izvora sugerira da se ljekovitost nekih vrsta mineralnih voda može povezati ne samo s njihovim hemijskim sastavom, već i s povećanjem biološke aktivnosti vode. kada se aktivira. Otkriće fenomena aktivacije ne samo da omogućava da se objasne neka svojstva hidrotermalnih otopina, već otvara i mogućnost za umjetnu pripremu mineralnih voda.
Utjecaj električnog polja
Kada se stavi voda električno polje mogu doći do određenih promjena u njegovoj strukturi. Dakle, električna struja slabi strukturne veze, a nakon tretmana vode naizmjeničnom električnom strujom, brzina isparavanja se povećava, prema malobrojnim dostupnim podacima, za 11-18%. Uočen je uticaj električnih polja na intenzitet apsorpcije svetlosnih zraka vodom.
Utjecaj magnetnog polja
Pozitivan uticaj na ljudsko tijelo vode koja je u magnetsko polje, primijećeno je u srednjem vijeku. Belgijski inženjer T. Vermayern je 1945. godine patentirao jednostavan način za smanjenje intenziteta stvaranja kamenca u parnim kotlovima korištenjem preliminarne magnetne obrade vode. Trenutno je ova metoda postupanja sa skalom veoma široko rasprostranjena. Dovoljno je osvrnuti se na iskustva mnogih termoelektrana (Rostovskaya, Astrakhanskaya, itd.), Državnih okružnih elektrana (Simferopolskaya, Saratovskaya), fabrika, rudnika i drugih preduzeća.
Prilikom namakanja sjemena mnogih poljoprivrednih kultura, cvijeća i voća magnetiziranom vodom, njihova klijavost se dramatično povećava. Trenutno domaća industrija čak proizvodi posebne uređaje za magnetizaciju vode, preporučene za poljoprivredna preduzeća i vrtlare.
voda- II . Početkom 60-ih godina XX veka. N.N. Fedyakin je otkrio izuzetno zanimljiv fenomen: kada se vodena para kondenzira u tankim kvarcnim kapilarama (5-20 mikrona u promjeru), nastaje tekućina koja se po svojstvima značajno razlikuje od obične vode. Kasnije su ovu tečnost, nazvanu voda-II, proučavali veliki ruski i strani istraživači, posebno veliki tim naučnika na čelu sa B.V. Deryagin. Utvrđeno je da je voda-II viskozna tečnost sa gustinom od oko 1 g/cm 3 i indeksom prelamanja od 1,49 (nasuprot 1,33 za običnu vodu). Ova tečnost prelazi u čvrsto stanje nakon hlađenja na minus 35÷40 ºS bez skoka zapremine. Tačka ključanja vode-II pri atmosferskom pritisku je približno 250 ºS. Voda-II ima jedinstveni infracrveni apsorpcijski spektar koji ne odgovara nijednom od njih poznate supstance. Modifikovano stanje dobijene supstance je stabilno i očuvano je tokom destilacije (ovaj postupak je korišćen za grubljenje porcija vode-II). Dokazano je da novodobljena supstanca striktno odgovara formuli H 2 O; kvarc, očigledno, igra ulogu katalizatora u sintezi vode-II.
Studiju vode-II vodio je B.V. Deryagin i njegovi saradnici su zaključili da može postojati poseban tip jake molekularne veze između vodika i kiseonika, koji formira polimere koji se sastoje od 6-10 H2O monomernih molekula.Još je teško odrediti ulogu vode-II u prirodnim sistemima, ali jasno je da njegovo proučavanje obećava određene perspektive u proučavanju dubokih geoloških procesa.
Teška voda. Trenutno su poznata tri izotopa vodonika (1 H-procijum, 2 H-deuterijum D, 3 H-tricijum T) i tri izotopa kiseonika (16 O, 17 O, 18 O). To znači da može postojati značajan broj varijanti vode sa različitim kombinacijama izotopa. Najstabilnija od njih je takozvana teška voda D 2 O, sadržana kao nečistoća u običnoj vodi u stotim dijelovima procenta. Teška voda se po svojim svojstvima značajno razlikuje od obične vode: maksimalna gustina je zabeležena pri t=11,2 ºS i iznosi 1,056 g/cm 3 ; viskozitet je 20% veći; dielektrična konstanta je 0,3-0,5% niža. Tačka topljenja teške vode je 3,8 ºS; tačka ključanja 101,4 ºS. Sudeći po datim podacima i nizu drugih podataka, deuterijumska veza je čak jača od vodonične veze.Teška voda se koristi kao moderator neutrona u nuklearnim reaktorima. Teška voda je otrovna, u njoj umiru živa bića i biljke. Neki znanstvenici povezuju evoluciju života na našoj planeti s promjenama u koncentraciji deuterija u vodi: posebno, niža koncentracija deuterija u vodi u usporedbi sa modernom koncentracijom deuterijuma u vodi objašnjava postojanje divovskih biljojeda u mezozoiku. Međutim, ove odredbe su kontroverzne.
Ovdje navedeni primjeri različitih vrsta vode, predodređenih njenom složenom strukturom i izotopijom, pokazuju koliko su neiscrpni izgledi za pojavu novih otkrića u proučavanju tako nevjerovatne tvari kao što je voda.
Ovo se ponekad naziva latentna toplota (latentna toplota se naziva jer se proces topljenja (i skrućivanja) dešava na konstantna temperatura, grijanje (hlađenje) izgleda da izostaje, iako se apsorpcija (oslobađanje) topline nastavlja). Specifična latentna toplota fuzije —je količina topline potrebna za promjenu jedinice mase čvrste tvari u tekućinu bez promjene temperature. To je takođe količina toplotne energije koja se daje kada se jedinica mase tečnosti pretvori u solidan bez promjene temperature.
Studija. Odredite specifičnu latentnu toplinu topljenja leda
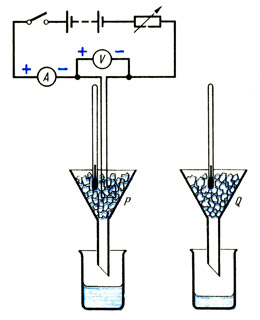 Stavite jednake količine slomljeni led u dva identična lijevka P i Q (vidi sliku). Ako je led uzet iz zamrzivača, onda treba pričekati da dostigne temperaturu od 0 o C i počne se topiti. Potopni grijač spojen na ampermetar, voltmetar i reostat stavite u lijevak P tako da bude potpuno prekriven ledom.
Stavite jednake količine slomljeni led u dva identična lijevka P i Q (vidi sliku). Ako je led uzet iz zamrzivača, onda treba pričekati da dostigne temperaturu od 0 o C i počne se topiti. Potopni grijač spojen na ampermetar, voltmetar i reostat stavite u lijevak P tako da bude potpuno prekriven ledom.
Odmah nakon uključivanja grijača, stavite suhe čaše poznate težine ispod lijevka P i Q. Zabilježite očitanja ampermetra i voltmetra i, ako je potrebno, koristite reostat kako biste ih održavali konstantnim tijekom eksperimenta. Nakon nekoliko minuta, kada se malo vode skupi u čaši ispod lijevka P, označite vrijeme, izvadite čaše i isključite grijač. Odredite mase čaša sa njihovim sadržajem.
U specifičnoj latentnoj toplini l ima jedinicu J x kg -1. Ako iz njega prođe supstanca mase m čvrsto stanje u tečnost, tada je stjecanje količine topline ΔQ određeno formulom ΔQ = mƖ.
Pretpostavimo da dobijemo sljedeće rezultate:
masa stakla pod P prije eksperimenta = m 1 kg
masa stakla pod P nakon eksperimenta = m 2 kg
masa leda otopljenog u P tokom eksperimenta = (m 2 -m 1) kg
masa stakla ispod Q prije eksperimenta = m 3 kg
masa stakla ispod Q nakon eksperimenta = m 4 kg
masa leda otopljenog u Q tokom eksperimenta = (m 4 - m 3) kg
očitavanje ampermetra = I, A
Očitavanje voltmetra = V, V
Vrijeme tokom kojeg je grijač bio uključen = t min = 60t s
Kontrola Q lijevka. Omogućava vam da odredite masu leda koja se otopila na sobnoj temperaturi tokom eksperimenta. Logično bi bilo pretpostaviti da će se led iste mase otopiti u P. Dakle, dodatna masa leda koju je rastopio grijač je:
(m 2 - m 1) - (m 4 - m 3) \u003d m.
Ako Ɩ — specifična latentna toplota fuzije led, onda toplotnu energiju, potrebno da se led otopi, bit će ml J. Trebalo bi biti jednako električna energija prenosi grijač, koji je VI x 60t. Dakle ml = VI x 60t Ɩ = Vl x 60t / m J x kg -1
Vrijednost specifične topline topljenja leda je 336.000 J x kg -1, odnosno 336.000 J toplotne energije potrebne za otapanje 1 kg leda na 0 °C. Ista količina toplote se oslobađa kada se 1 kg vode smrzne na 0°C.
Ako a početni led ispod 0°C, biće potrebna dodatna toplota da se temperatura podigne na 0°C pre nego što se led počne topiti.
Mnoge kuće imaju podrume, au njima se često sprema povrće za zimu. Zbog izolacijskog svojstva zemlje, podrum ostaje relativno hladan ljeti i relativno topao zimi. Kada se očekuje oštra zima, u podrum se stavlja bure vode. Kada se smrzne, oslobođena latentna toplinska energija pomaže u održavanju temperature u podrumu blizu 0°C, što štiti povrće od smrzavanja.






