Gibbsova energetska tablica standardnih vrijednosti. Standardne entalpije formiranja supstanci, standardne entropije i standardne Gibbsove energije stvaranja supstanci
Standardna molarna entalpija stvaranja supstance ΔH o6p, m (298 K) je promena entalpije tokom formiranja jednog mola date supstance iz njenih sastavnih elemenata u njihovim standardnim stanjima na temperaturi od 298 K i pritisku od jedna atmosfera.
Uporedimo ovu definiciju sa gore navedenim primjerima. Uverili smo se
da se oksidacija vodika može predstaviti sa najmanje tri različita stehiometrijske jednačine. Dakle, znamo najmanje tri različite standardne molarne entalpije:
a) ΔH°t (298 K, 2H20(l.)) = - 571,6 kJ/mol
b) ΔH°t (298 K, H20(l.)) = - 285,8 kJ/mol
c) ΔH°t (298 K, H2O(T.)) = - 241,8 kJ/mol
Koja od ovih vrijednosti odgovara standardnoj molarnoj entalpiji stvaranja vode? Vrijednost (c) ne može joj odgovarati, jer standardno stanje vode na 298 K nije parno (gasovito) stanje, što odgovara oznaci H20(g). Standardna molarna entalpija formiranja vode može imati jednu od dvije preostale vrijednosti, među kojima je razlika određena načinom na koji je napisana jednačina reakcije. Međutim, budući da gornja definicija standardne molarne entalpije formiranja pokazuje da ona odgovara promjeni entalpije po molu formirane tvari, treba odabrati opciju (b). Na ovaj način, standardna molarna entalpija stvaranja vode\u003d - 285,8 kJ / mol.
U tabeli. Tabela 5.1 navodi standardne molarne entalpije formiranja nekih uobičajenih supstanci u njihovim standardnim stanjima. Imajte na umu da tabela uključuje ne samo tvari, već i neke ione. Joni i mnoga jedinjenja ne mogu se dobiti direktnom sintezom iz elemenata koji ih formiraju. Međutim, njihove standardne entalpije formiranja mogu se izračunati korištenjem Hessovog zakona (o čemu ćemo učiti u odjeljku 5.3).
Većinu spojeva karakteriziraju negativne entalpije formiranja. Stoga se nazivaju egzotermnim jedinjenjima. Samo nekoliko spojeva ima pozitivnu entalpiju formiranja. Zovu se endotermna jedinjenja. Primjer endotermnog spoja je benzen.
Treba obratiti pažnju na činjenicu da entalpije stvaranja čvrstih spojeva u pravilu imaju veće (u apsolutnoj vrijednosti) negativne vrijednosti od entalpije stvaranja plinova. Standardna molarna entalpija formiranja supstance ili jona je mera njegove stabilnosti u poređenju sa elementima koji formiraju dato jedinjenje. Što je veća (u apsolutnoj vrijednosti) negativna vrijednost entalpije formiranja jedinjenja, to je jedinjenje stabilnije.
Po definiciji, standardna molarna entalpija formiranja bilo kojeg elementa u njegovom standardnom stanju na 298 K je nula. Na primjer, ΔH (298 K, 02(g)) = 0.
Tabela 5.1. Standardne molarne entalpije formiranja
Supstanca |
ΔN(298 K), kJ/mol |
Supstanca |
D298 K), kJ/mol |
Grupirajte komponente za izračunavanje svojstava idealnog gasa prema Bensonu
Cikloalkani
Acetilenski ugljovodonici
aromatični ugljovodonici
Entalpija formiranja
Predviđanje entalpije formiranja
Predviđanje organskih jedinjenja Bensonovom metodom za atome sa njihovim prvim okruženjem
Neke multivalentne grupe Bensonove metode za stanje idealnog gasa
UVOD
Najbolje rješenje za razvoj hemijsko-tehnoloških procesa i opreme za njihovu implementaciju moguće je samo uz pouzdane informacije o fizičko-hemijskim i termodinamičkim svojstvima hemijskih jedinjenja. Takve informacije često čine 50 do 90% ulaznih podataka dizajna.
Za praksu, eksperimentalni podaci su poželjniji. Tokom godina prikupljena je i obrađena ogromna količina takvih podataka. Ove informacije su dostupne u brojnim kompilacijama i referentnim knjigama. U nekima od njih date su sve trenutno poznate vrijednosti termodinamičkih i fizičko-hemijskih karakteristika i data je njihova kritička analiza. Drugi sadrže samo vrijednosti koje preporučuju autori, a često su ili prosječne vrijednosti ili rezultat statističke obrade čitavog niza akumuliranih informacija. Međutim, brz napredak tehnologije i uvođenje sve više i više novih supstanci i materijala na terenu uzrokuju značajan jaz između potrebe za podacima i njihove dostupnosti. Određivanje eksperimentalnih vrijednosti u širokim parametrima stanja i sastava često je teško, a ponekad jednostavno nemoguće.
Iz tog razloga, inženjer je često primoran da se oslanja na različite metode za izračunavanje i predviđanje svojstava supstanci. Treba imati na umu da se pojmovi "kalkulacija" i "prognoza" često koriste naizmjenično, iako drugi od njih nosi iskreno priznanje činjenice da rezultat može biti samo djelimično tačan. Proračuni se mogu zasnivati na teoriji, na korelaciji eksperimentalnih vrijednosti ili na kombinaciji oboje.
Entalpija formiranja
Entalpija formiranja je glavno svojstvo koje se koristi u rješavanju mnogih teorijskih i praktičnih problema. Poznavanje entalpija formiranja reaktanata omogućava izračunavanje toplotnih efekata reakcija od interesa, što je neophodno pri proceni adijabatske temperaturne razlike u reakcionoj zoni, formiranju zahteva za dizajn reaktora i tehnološke karakteristike hemijskog procesa. Entalpije nastajanja supstanci su neophodne pri izvođenju kvantitativne termodinamičke analize procesa, određivanju teoretskog stepena konverzije reagensa, odabiru uslova za provođenje hemijska transformacija itd. Kvalitet izvršene termodinamičke analize umnogome zavisi od pouzdanosti informacija o entalpijama stvaranja supstanci.
Jedinice entalpije su kJ/mol i J/mol. U referentnoj literaturi prethodnih godina, entalpije formiranja se često prikazuju u kcal/mol (1 cal = 4,184 J, 1 kcal = 4,184 kJ).
Entalpija formiranja () veze u užem smislu je standard promjena entalpije u reakciji stvaranja date supstance iz elemenata ili jednostavne supstance. Jednostavne supstance su hemijski elementi koji su na razmatranoj temperaturi u svojoj prirodnoj fazi i hemijskim stanjima.
Kao standardno stanje supstance bira se takvo stanje u kojem je ova supstanca stabilna pri standardnom pritisku od 1 atm (101325 Pa). Kondenzirano stanje supstance je standardno do onih temperatura na kojima je njen pritisak zasićena para dostiže 1 atm. Iznad ovih temperatura, idealno plinsko stanje se bira kao standard.
Za jednostavne supstance koje učestvuju u formiranju molekula većine organskih jedinjenja, standardno stanje na 298,15 K je:
za ugljik, grafit;
za vodonik, kiseonik, azot, fluor i hlor - idealan dvoatomski gas;
za brom, dvoatomska tečnost;
za jod i sumpor - kristalno stanje, dvoatomno i jednoatomno.
Apsolutne vrijednosti entalpije se ne mogu odrediti jer uključuju apsolutne vrijednosti unutrašnja energija. Potreba za određivanjem entalpije formiranja spojeva zahtijevala je postizanje međunarodnog sporazuma, prema kojem su vrijednosti elemenata i jednostavnih supstanci u standardnom stanju uzete jednake nuli.
Veličina i znak tvari sa složenom molekularnom strukturom mogu biti različiti. Ovo se objašnjava na sljedeći način. Formiranje materije iz slobodnih atoma uvijek je praćeno oslobađanjem energije, rezultirajuće tvari su negativne. Međutim, kada se tvar formira od jednostavnih tvari koje se sastoje od dvoatomskih molekula (H 2, O 2, N 2, Cl 2 itd.) ili u kondenziranom stanju (ugljik, brom, itd.), određena količina energije je potrebne za razbijanje veza u molekulima ovih jednostavnih supstanci ili za njihovo prevođenje u plinovito stanje. Kao rezultat toga, entalpija formiranja može biti i pozitivna i negativna, i jednaka nuli.
U opštem slučaju, vrednost i predznak ne daju osnova za bilo kakve tvrdnje o termodinamičkoj stabilnosti supstance, jer ona ne zavisi samo od entalpije, već i od entropijske komponente promene slobodne energije tokom formiranja ove supstance. supstance. Ipak, za poređenje termodinamičke stabilnosti predstavnika iste homologne grupe ili spojeva sa sličnom molekularnom strukturom, može biti prilično informativno, u prvoj aproksimaciji, analizirati njihove entalpije formiranja. U ovom slučaju, tvar s nižom entalpijom formiranja ima veću termodinamičku stabilnost.
Za većinu spojeva, reakcije njihovog stvaranja iz jednostavnih supstanci ne mogu se provesti u praksi. Glavni izvor činjeničnih informacija o entalpijama formiranja organskih spojeva su eksperimentalni podaci o entalpijama njihovog sagorijevanja (), dobiveni kalorimetrijskom metodom. Akumulirane do danas i preporučene vrijednosti i sadržane su u kompilacijama. Do sada su se referentne informacije o pružale isključivo kalorimetrijskim podacima. Moderne metode empirijskog predviđanja također se temelje samo na kalorimetrijskim podacima. Istovremeno, treba napomenuti da su informacije koje su jedinstvene u pogledu spektra uključenih supstanci, obima sprovedenih studija i tačnosti dobijenih termodinamičkih karakteristika sadržane u rezultatima istraživanja hemijske ravnoteže. Po našem mišljenju, efektivna upotreba ovih informacija značajno će proširiti prognostičke mogućnosti metoda za masovne proračune organskih supstanci.
PROGNOŽIVANJE ENTALPIJA FORMACIJE
Odnose se glavne metode za predviđanje entalpija formiranja organskih spojeva, odnosno karakteriziraju svojstvo tvari u stanju idealnog plina pri pritisku od 1 atm. i temperaturu od 298,15 K, koja se često naziva standardom. Među metodama proračuna mase posebnu pažnju treba obratiti na metode molekularne mehanike i aditivne metode (lat. additio- dodatak). Većina polu-empirijskih metoda ne daje potrebnu kvalitetu prognoze. Neempirijske metode ne daju direktan pristup entalpijama stvaranja tvari i, štoviše, još uvijek su nedostupne za izračunavanje svojstava organskih tvari sa složenom molekularnom strukturom.
U grupi metoda molekularne mehanike stekli smo značajno iskustvo u korišćenju MMX metode (zasnovano na polje sile Ellinger). Metoda se dobro pokazala u primjeni na alkane. Međutim, već za aromatične spojeve preporučljivo je koristiti ga ne za izračunavanje entalpije formiranja, već za procjenu efekata interakcije supstituenata u molekuli, tj. za razlike u entalpijama stvaranja izomera. Za većinu organohalogenih, kisikovih, dušičnih i sumpornih spojeva, metoda daje pristrasne procjene. Međutim, ovu metodu treba koristiti u svim slučajevima za ekspresnu procjenu imovine. Kao i svaka druga metoda, ona zahtijeva da rezultati budu potkrijepljeni informacijama dobivenim drugom metodom predviđanja. Metoda molekularne mehanike ima odličan interfejs i izuzetno je efikasna kao izvor informacija o strukturi molekula i njihovim geometrijskim parametrima.
U nedostatku referentnih podataka za prognoziranje, trenutno se široko koriste različite aditivne metode. Od stvaranja glavnih aditivnih metoda za predviđanje svojstava organskih supstanci u stanju idealnog gasa, proteklo je značajno vremensko razdoblje, ali one su zadržale svoju važnost, uprkos sve dostupnijim metodama molekularnog modeliranja. Ove metode su efikasne u onim slučajevima kada se svojstvo linearno mijenja s promjenom broja fragmenata istog tipa u molekulu. Strogo aditiv je, na primjer, molekulska težina neke supstance. Za entalpije formiranja organskih jedinjenja, aditivni pristup je u mnogim slučajevima samo neka aproksimacija u proračunu. Činjenica je da se čak iu homolognoj grupi mijenja nelinearno s promjenom broja ugljikovih atoma u molekuli (slika 1.1).
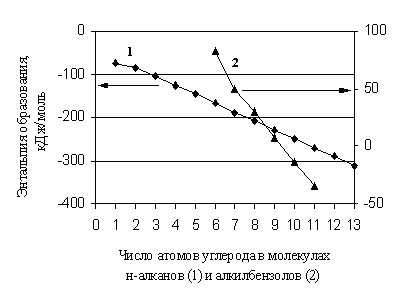
Rice. 1.1. Ovisnost entalpije stvaranja n-alkana i alkil benzena o broju atoma ugljika u njihovim molekulima
Dakle, homologna razlika nije konstantna vrijednost, posebno za prve članove homolognih grupa. Na isti način, sa povećanjem broja supstituenata istog tipa u molekulima organskih supstanci, često se mora govoriti o odstupanju od aditivnosti u . Međutim, kada se uvedu korekcije za neaditivnost, metode ove grupe funkcionišu sasvim zadovoljavajuće ako su stepen i dubina njihove detaljnosti dovoljni i odgovaraju točnosti savremenog eksperimenta.
U zavisnosti od usvojene ideologije, strukturni i kvantitativni nosioci informacija u aditivnim metodama mogu biti atomi, grupe atoma ili veze koje čine molekul. Većina metoda predviđanja je konstruirana na način da je, kako se baza podataka o entalpijama formiranja širi, relativno lako precizirati vrijednosti parcijalnih doprinosa ili uvesti nove korekcije.
Opšti pristup predviđanju entalpija stvaranja supstanci uključuje proračun sa naknadnim, ako je potrebno, prelaskom na entalpije formiranja idealnog gasa na drugim temperaturama ili k , tj. na svojstvo materije u stvarnom stanju.
Od različitih metoda izračunavanja aditiva, razmatramo dvije; Bensonova grupna metoda za atome sa njihovim prvim okruženjem i metoda Tatevskog za veze.
Predviđanje organskih jedinjenja Bensonovom metodom za atome sa njihovim prvim okruženjem
Treba priznati da se od svih raznovrsnih šema aditiva za predviđanje entalpije formiranja organskih supstanci Bensonova metoda najšire koristi u dužem periodu. To se vjerovatno objašnjava činjenicom da ova metoda pokriva najširi spektar spojeva. Za brzu procjenu velike većine spojeva bez uključivanja bilo kakvih tehničkih sredstava, metoda, možda, nema premca. Sasvim je očigledno da je cijena njegove univerzalnosti tačnost prognoze. Stoga je prilikom korištenja metode potrebno biti svjestan njenih neizbježnih ograničenja. Pokušat ćemo skrenuti pažnju potencijalnih korisnika na glavne, koje su rezultat našeg opsežnog testiranja metode.
Bensonova metoda se obično naziva grupna metoda atom sa svojom prvom pratnjom. Metodu je autor razvio za izračunavanje sljedećih svojstava idealnog plina tvari: toplinski kapacitet na temperaturama koje su višestruke od 100 stepeni, entalpija formiranja i entropija.
Entalpija sistema. standardni uslovi. Entalpija stvaranja supstance. Entalpija reakcije. Endotermne i egzotermne reakcije.
Entalpija sistema (od grčkog enthalpo I toplota) je ϶ᴛᴏ jednoznačna funkcija H stanja termodinamičkog sistema sa nezavisnim entropijskim parametrima S i pritiskom P, koja je povezana sa unutrašnjom energijom U relacijom H =U+PV, gde je V zapremina sistema. U hemiji se najčešće smatra izobarnim procesima (P = const), a toplotni efekat se u ovom slučaju naziva promena entalpije sistema ili entalpija procesa: Qp = ∆H; ∆H=∆U+P∆V. Entalpija ima dimenziju energije (kJ). Njegova vrijednost je proporcionalna količini tvari; entalpija jedinične količine supstance (mol) meri se u kJ∙mol–1. U termodinamičkom sistemu, oslobođena toplota hemijskog procesa se smatra negativnom (egzotermni proces, ΔH< 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH >0. Jednačine hemijskih reakcija koje pokazuju entalpiju procesa nazivaju se termohemijske. Numeričke vrijednosti entalpije ΔH označene su zarezom u kJ i odnose se na cijelu reakciju, uzimajući u obzir stehiometrijske koeficijente svih reaktanata. Pošto reaktanti mogu biti različiti agregatna stanja, tada se označava donjim desnim indeksom u zagradama: (t) - čvrsta, (k) - kristalna, (g) - tečna, (d) - gasovita, (p) - rastvorena. Na primjer, interakcija plinovitih H2 i Cl2 proizvodi dva mola plinovitog HCl. Termohemijska jednadžba je napisana na sljedeći način: Kada su plinoviti H2 i O2 u interakciji, formirani H2O može biti u tri agregatna stanja, što će uticati na promjenu entalpije: 298K. standardno stanje termodinamička funkcija, na primjer, entalpija, označena je indeksima i superskriptima: indeks se obično izostavlja: Δ.
Entalpija formiranja (toplina formiranja), entalpija reakcije formiranja date supstance (ili rastvora) iz datih početnih supstanci. Entalpija nastanka hemijskog jedinjenja naziva se entalpija reakcije stvaranja datog jedinjenja iz jednostavnih supstanci. Kao jednostavne supstance birajte hemijski elementi u njihovoj prirodnoj fazi i hemijskom stanju na datoj temperaturi. Dakle, na 298 K, za hlor, gasoviti hlor, koji se sastoji od molekula C12, je jednostavna supstanca, a za kalijum metalni kalijum. Entalpija stvaranja čvrstog KCl na 298 K je entalpija reakcije: K(čvrsto) + 1/2Cl2= KCl(čvrsto) Entalpija formiranja KCl(čvrstog) na 500 K odgovara reakciji: K( tečnost) + 1/2Cl2 = KCl (čvrsto), budući da prirodno fazno stanje (jednostavna supstanca) za kalijum više nije kristal, već tečnost (temperatura topljenja K 336,66 K).
Entalpija formiranja mora se odrediti na bilo kojoj temperaturi. Standardne entalpije formiranja odgovaraju reakcijama formiranja u kojima su i jednostavne supstance i rezultirajuće jedinjenje pod pritiskom od 1 atm (1,01 x 105 Pa). Po definiciji, za sve jednostavne supstance na bilo kojoj temperaturi = 0. Za većinu hemijskih. conn. entalpija formiranja - negativna. količine.
Mjerne jedinice entalpije nastajanja su J/g, J/mol.U termodinamici otopina (talina) entalpija nastajanja se podrazumijeva kao promjena entalpije tokom izotermno-izobarične formacije 1 mol (1 g ) rastvora (taline) date kompozicije od čistih komponenti. Dakle, u dvokomponentnom sistemu KF-A1F3, entalpija formiranja taline 50% molarnog sastava odgovara procesu: 1/2KF (tečnost) + 1/2A1F3 (tečnost) = KF-A1F3 (talina, 50 mol.%).
Endotermne reakcije (od drugih grčkih ἔνδον - unutra i θέρμη - toplota) - hemijske reakcije praćene apsorpcijom toplote. Za endotermne reakcije, promjena entalpije i unutrašnje energije ima pozitivne vrijednosti (ΔH > 0, ΔU > 0), tako da produkti reakcije sadrže više energije od originalnih komponenti. Endotermne reakcije uključuju: reakcije redukcije metala iz oksida , elektroliza (apsorbuje se električna energija), elektrolitička disocijacija (npr. rastvaranje soli u vodi), jonizacija, fotosinteza Endotermne reakcije su suprotne od egzotermnih reakcija.
Egzotermna reakcija je hemijska reakcija praćena oslobađanjem toplote. Suprotno od endotermne reakcije.Ukupnu količinu energije u hemijskom sistemu je izuzetno teško izmeriti ili izračunati. S druge strane, promjena entalpije ΔH in hemijska reakcija mnogo lakše izmeriti ili prebrojati. U te svrhe koriste se kalorimetri. Izmjerena vrijednost ΔH povezana je sa energijom vezivanja molekula na sljedeći način: ΔH = energija utrošena na kidanje veza - energija koja se oslobađa kada se veze produkata reakcije formiraju.Za egzotermne reakcije, ova formula daje negativnu vrijednost za ΔH, budući da se veća vrijednost oduzima od manje vrijednosti. Tokom sagorevanja vodonika, na primer: 2H2 + O2 → 2 H2O, promena entalpije je ΔH = −483,6 kJ po jednom molu O2.
Sagorevanje goriva u atmosferskom kiseoniku.
Sagorevanje baruta.
Dodavanje koncentrovane sumporne kiseline u vodu.
Oksidacija masti i ugljikohidrata u živim organizmima.
Adijabatsko sagorevanje
Entalpija sistema. standardni uslovi. Entalpija stvaranja supstance. Entalpija reakcije. Endotermne i egzotermne reakcije. - koncept i vrste. Klasifikacija i karakteristike kategorije "Eentalpija sistema. Standardni uslovi. Entalpija stvaranja supstance. Entalpija reakcije. Endotermne i egzotermne reakcije." 2014, 2015.
Osnovne jednadžbe hemijske termodinamike i hemijske ravnoteže
1.Q=DE+W-jednadžba prvog zakona termodinamike
2.W=PDV
3. Q v = DE v -toplota izohornog procesa
4. Q p = DH p -toplota izobarnog procesa
5. DH p = DE + PDV -jednadžba prvog zakona termodinamike za izobarne procese
6. DH = å n DH 0 298 dol. prod. reagovati. - å n DH 0 298 dol. ref. supstance - P Prva posledica Hesovog zakona
7. DH = å n DH 0 298 sagorijevanje. Exodus. in. - å n DH 0 298 izgorjelo prod. reakcije - indruga posledica Hesovog zakona
8.Q=W-jednadžba prvog zakona termodinamike za biosisteme
9.DS = ¾¾ -entropija kao funkcija stanja sistema
10.DS ³ 0 -jednadžba drugog zakona termodinamike
11 S = å n S 0 298 nast. R. - å n S 0 298 ref. in. -izračunavanje entropije reakcije
12. DG 0 = DH 0 - TDS 0 -jednadžbe za izračunavanje Gibbsove energije
13. DG 0 = å n DG 0 298 prod. R. - å n DG 0 298 ref. in.(x)
14. DG 0 \u003d - 2,3RT LG Ks - jednadžba izoterme hemijske reakcije pod standardnim uslovima
15. - jednadžba izoterme kemijske reakcije
16. - konstanta hemijske ravnoteže izražena kao ravnotežne koncentracije supstance
17. - konstanta hemijske ravnoteže izražena u terminima ravnoteže parcijalni pritisci supstance
18. - izobarna jednadžba
19. - izračunavanje toplotnog efekta iz vrednosti konstanti
Tabela 1
| Supstanca | Standardna entalpija formiranja kJ/mol | Standardna entropija J/mol×K | Standardna Gibbsova energija formiranja kJ/mol |
| Neorganske supstance | |||
| C (grafit) | +6 | ||
| CO (g) | -110 | +198 | -137 |
| CO 2 (g) | -393,5 | +214 | -394 |
| Cl 2 (g) | +223 | ||
| Cl 2 O (g) | +76 | +266 | +94 |
| FeSO 3 (tv) | -753 | +96 | -680 |
| H 2 (g) | +131 | ||
| HCl (g) | -92 | +187 | -95 |
| HI (g) | +24 | +206 | -1 |
| HNO 2 (rešenje) | -119 | +153 | -56 |
| HNO 3 (l) | -174 | +156 | -81 |
| H 2 O (l) | -286 | +70 | -237 |
| H 2 O 2 (l) | -187 | +110 | -120 |
| H 2 S (g) | -21 | +206 | -34 |
| H 2 SO 4 (l) | -814 | +157 | -690 |
| KNO 3 (TV) | -495 | +133 | -395 |
| KOH (rastvor) | -477 | +92 | -441 |
| N 2 (g) | +192 | ||
| NH 3 (g) | -46 | +192 | -16 |
| H 2 O (g) | +82 | +220 | +104 |
| NE (g) | +91 | +211 | +87 |
| NE 2 (g) | +33 | +240 | +51 |
| N 2 O 3 (g) | +11 | +356 | +115 |
| Na 2 O 2 (TV) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (TV) | -1117 | +225 | -1043 |
| O 2 (g) | +205 | ||
| SO 2 (g) | -297 | +248 | -300 |
| SO 3 (g) | -396 | +257 | -371 |
| organska materija | |||
| metan (g) | -75 | +186 | -51 |
| etan (g) | -85 | +229 | -33 |
| etilen (g) | +52 | +219 | +68 |
| acetilen (g) | +227 | +201 | +209 |
| benzen (w) | +49 | +173 | +125 |
| cikloheksan (l) | -156 | +204 | +27 |
| klorometan (g) | -86 | +234 | -63 |
| diklormetan (g) | -95 | +270 | -69 |
| triklorometan (g) | -101 | +296 | -69 |
| Tetrahlorid ugljenika (g) | -100 | +310 | -58 |
| metanol (w) | -239 | +127 | -166 |
| etanol (w) | -277 | +161 | -174 |
| dietil etar (l) | -279 | +253 | -123 |
| acetaldehid (g) | -166 | +264 | -133 |
| aceton (w) | -247 | +199 | -154 |
| Piruvat jon (rastvor) | + | -559 | |
| L-mliječna kiselina (rastvor) | -686 | +222 | -539 |
| saharoza (TV) | -2222 | +360 | -1545 |
| D-glukoza (rastvor) | -1264 | +269 | -917 |
| nitrobenzen (w) | +16 | +224 | +146 |
| anilin (w) | +31 | +191 | +149 |
| L-leucin (rastvor) | -643 | +208 | -362 |
| glicin (rastvor) | -523 | +159 | -380 |
| D,L-leucilglicin (rastvor) | + | -464 | |
| Glicilglicin (rastvor) | -734 | +231 | -492 |
Standardne entalpije sagorevanja organskih materija, kJ/mol
Specifična toplota potpuna oksidacija supstanci u organizmu, kJ/g.
Zadaci učenja:
Zadatak 1 U ljudskom tijelu, reakcija oksidacije etil alkohola odvija se u dvije faze. Prvi je oksidacija etil alkohola u acetaldehid uz sudjelovanje enzima alkohol dehidrogenaze prema jednadžbi: C 2 H 5 OH + ½ O 2 \u003d CH 3 COH + H 2 O.
Izračunajte DH 0 reakcije koristeći prvu posljedicu Hessovog zakona if
DN 0 dol. (C 2 H 5 OH) \u003d - 278 kJ / mol;
DN 0 dol. (CH 3 COH) \u003d - 166 kJ / mol;
DN 0 dol. (H 2 O) \u003d - 286 kJ / mol.
Rješenje: DH 0 = å n DH 0 - å n DN 0 inverzni ref.in.in; DH = (-166+ (-286)-(-278)) = - 174 kJ/mol
Odgovori: termički efekat reakcije DH = -174 kJ/mol, tj. egzotermni proces.
Zadatak 2. Toplota sagorevanja glukoze je -2810 kJ/mol, toplota sagorevanja etil alkohola je -1366 kJ/mol. Na osnovu ovih podataka izračunajte termički efekat biohemijskog procesa fermentacije glukoze:
C 6 H 12 O 6 \u003d 2C 2 H 5 OH + 2CO 2
Rješenje: Toplotni efekat ove reakcije može se izračunati primjenom druge posljedice iz Hessovog zakona:
DH = ån DH 0 spaljivanje. Exodus. supstance - å n DH 0 sagorevanje. prod. reakcije
DH \u003d -2810 - 2 ∙ (-1366) = - 78 kJ / mol
odgovor: termički efekat procesa fermentacije je - 78 kJ/mol.
Zadatak 3. Izračunajte standardnu entropiju reakcije:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
glicin glicin glicilglicin
Ako je S 0 (glicilglicin) = 231 J/mol × K;
S 0 (glicin) \u003d 159 J / mol × K;
S 0 (H 2 O) \u003d 70 J / mol × K;
Rješenje:
DS \u003d S 0 298 (hl-hl) + S 0 298 (H 2 O) - 2 S 0 298 (glicin) \u003d (231 + 70) - (159 + 159) = -17 J / mol × K
odgovor: DS 0 298 \u003d - 17 J / mol × K, tj. entropija će se smanjiti.
Zadatak 4. Toplota sagorevanja ugljenih hidrata, proteina i masti je 17, 17 i 39 kJ
respektivno. Prosječna dnevna potreba za proteinima, mastima i ugljikohidratima za studente je 113, 106 i 451 g. Kolika je dnevna potreba učenika za energijom?
Rješenje: Izračunajte koliko se energije oslobađa prilikom oksidacije ugljikohidrata, proteina i masti
DH = (451×17) + (113×17) + (106×39) = 13722 kJ.
odgovor: Dnevna potreba za energijom je 13722 kJ.
Zadatak 5. Zašto je proces denaturacije proteina na 40 0 C spontan ako je reakcija endotermna, a termički efekat iznosi 2830 J/mol? DS vrijednost za ovu reakciju je 288 J/mol∙K
Rješenje: Za određivanje smjera procesa potrebno je znati veličinu promjene Gibbsove energije, izračunatu po jednačini: DG 0 = DH 0 - TDS 0 . Proračun pokazuje da je DG< 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Odgovor: Zato što DG< 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Zadatak 6. Izračunajte Gibbsovu energiju, koja je kriterijum spontanosti procesa, za reakciju glikolize pod standardnim uslovima: C 6 H 12 O 6 (rastvor) ® 2C 3 H 6 O 3 (rastvor) (mlečna kiselina).
Rješenje:
Iz tabele termodinamičkih vrednosti zapisujemo standardnu Gibbsovu energiju za učesnike u hemijskom procesu: ∆G 0 (C 6 H 12 O 6) = -917 kJ / mol; ∆G 0 (C 3 H 6 O 3) = -539 kJ / mol. Koristeći 1 zaključak iz Hessovog zakona, izračunavamo Gibbsovu energiju:
ΔG 0 = 2×ΔG 0 (C 3 H 6 O 3) - ΔG 0 (C 6 H 12 O 6)
ΔG 0 = 2 (-539) - (-917) \u003d -161 kJ / mol
odgovor: jer ∆G0< 0, то реакция протекает самопроизвольно в smjer naprijed.
Zadatak 7. Izračunajte promjenu Gibbsove energije na 25 0 C koristeći standardne vrijednosti entalpije formiranja i apsolutne entropije za ovu reakciju: CO + 2H 2 = CH 3 OH
DN 0 arr CH 3 OH \u003d -293 kJ / mol S 0 (CH 3 OH) = 127 J / mol × K
DH 0 arr CO \u003d - 110 kJ / mol. S 0 (CO) \u003d 198 J / mol × K
S 0 (H 2) \u003d 131 J / mol × K
Rješenje: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 arr. pr.reak. - ånDH 0 dol. ref. supstance
DH 0 = - 293 - (-110) \u003d - 183 kJ / mol
DS 0 = å n S 0 nast. p - å n S 0 ishod. supstance
DS 0 \u003d 127 - (198 + 2 (131) = - 333 J / mol × K
DG 0 = - 183,5 kJ / mol - (298K × 0,333 kJ / mol × K) \u003d - 83,8 kJ / mol
odgovor: DG 0 \u003d - 83,8 kJ / mol
Zadatak 8. Izračunajte konstantu ravnoteže na 310 K za reakciju ATP + AMP ↔ 2ADP ako slobodna energija Gibbsova reakcija ΔG°=-2.10kJ/mol.
Rješenje: u ravnoteži DG 0 = - 2,3RT log Ks
K c = 10 0,354 = 2,26
odgovor: Kc = 2,26
Zadatak 9. Konstanta ravnoteže reakcije: PCl 5 (g) “PCl 3 (g) + Cl 2 (g) na 250 0 C je 2. U kojem smjeru se reakcija odvija pri sljedećim koncentracijama: C (PCl 5) \u003d C (PCl 3) \u003d 2 mol/l; C (Cl 2) \u003d 4 mol / l?
Rješenje: Za određivanje smjera reakcije koristimo jednačinu izoterme
Izračunaj Ps
Jer P s > K s, zatim DG > 0
zaključak: reakcija se ne može spontano odvijati u smjeru naprijed, jer DG>0.
Zadatak 10. Konstanta ravnoteže reakcije 2SO 2 (g) + O 2 (g) Û 2SO 3 (g) na temperaturi od 627 0 C je 2,3 ∙ 10 -7, DH 0 = 376,5 kJ / mol. Izračunajte konstantu ravnoteže na 727 0 S.
Rješenje: koristimo jednadžbu izobare hemijske reakcije:
T 1 = 273 + 627 = 900 K
T2 = 273 + 727 = 1000K
odgovor: Konstanta ravnoteže na 727 0 C je 3,56 × 10 -5.
Zadatak 11. Za reakciju H 2 O (g) + CO (g) ® CO 2 (g) + H 2 (g), konstante hemijske ravnoteže su jednake: na 800 0 C Kp = 2,87, na 1000 0 C Kp = 1,39. Izračunajte toplotni efekat ove reakcije.
Rješenje: Primjenjujući jednadžbu izobare kemijske reakcije, izračunavamo DH
Uzmimo T 1 = 800 + 273 = 1073 K
T 2 = 1000 + 273 = 1273 K
odgovor: DH = -39,16 kJ/mol.
Zadaci za samostalno rješavanje:
Zadatak 1. Za isparavanje 1 mola vode potrebno je 40 kJ. Koliko će se toplote dnevno izgubiti kada se 720 g vode oslobodi kroz kožu?
odgovor: 1600 kJ
Zadatak 2. Vodonik peroksid (H 2 O 2) u obliku rastvora sa masenim udelom od 3%. koristi se u medicini za liječenje rana. Dokažite da je proces razgradnje vodikovog peroksida u prisustvu enzima katalaze spontan, koristeći vrijednosti standardne entropije formiranja početnih tvari i produkta reakcije za izračunavanje:
S 0 298 (H 2 O 2) =110 J/mol×K; S 0 298 (H 2 O) \u003d 70 J / mol × K; S 0 298 (O 2) = 205 J / mol × K.
Odgovor: Δ S = 62,5 J/mol × K
Zadatak 3. Prilikom sagorijevanja metana zapremine 2 m 3 oslobađa se 79600 kJ topline. Izračunajte standardnu toplotu sagorevanja metana.
odgovor: 891,52 kJ/mol
Zadatak 4. Izračunajte standardnu Gibbsovu energiju za proces oksidacije glukoze prema sljedećim podacima: DH 0 arr (C 6 H 12 O 6) \u003d - 1264,4 kJ / mol; DH 0 arr (CO 2) \u003d - 393 kJ / mol;
DH 0 arr (H 2 O) \u003d - 286 kJ / mol. Promjena entropije cjelokupnog reakcionog sistema je 0,259 kJ/mol×K
odgovor: DG \u003d - 2886,8 kJ / mol.
Zadatak5. Izračunajte standardnu entalpiju stvaranja etanola koristeći tražene standardne entalpije sagorijevanja.
odgovor: DN 0 dol. = -273 kJ/mol
Zadatak 6. Konstanta ravnoteže reakcije N 2 0 4 (g) ↔ 2N0 2 (g) na 25°C je 0,1. U kojem smjeru će se reakcija odvijati pri sljedećim koncentracijama tvari:
a) C (N0 2) = C (N 2 0 4) = 0,1 mol / l;
b) C (N0 2) \u003d 0,01 mol / l; C (N 2 0 4) \u003d 0,02 mol / l?
Zadatak 7. Za reakciju H 2 + I 2 ® 2HI na 444 0 C, konstanta ravnoteže je 50. Odredite smjer procesa ako početna smjesa ima sljedeći sastav: C (H 2) = 2 mol / l, C ( HI) \u003d 10 mol / l.
odgovor: Stanje ravnoteže, jer je ∆G=0.
Zadatak 8. Izračunajte konstantu ravnoteže ako je DG 0 298 za ovu reakciju 4,478 kJ/mol.
odgovor: 6,1
Zadatak 9. Konstanta ravnoteže razgradnje medicinske supstance u autoklavu na 413K je 0,396∙10 5 Pa, a na 443K iznosi 1,286∙10 5 Pa. Izračunajte toplotni efekat reakcije.
odgovor: 59,6 kJ/mol.
Zadatak 10. Koristeći vrijednost ΔG°, utvrdite postoji li opasnost od trovanja pacijenta kada se koristi kao a lijek dušikov oksid (I), Toksični dušikov oksid (II) može nastati reakcijom: 2N 2 O + O 2 = 4NO. Sve supstance su unutra gasovitom stanju. Pogledajte tabelu za referentne podatke.






