Guruh - elementlarning vertikal qatori
Xususiyatlari ketma-ket o'zgarib turadigan elementlar qatori, masalan, litiydan neongacha yoki natriydan argongacha bo'lgan sakkiz elementdan iborat qator, Mendeleev davrlar deb atagan. Agar natriy litiy ostida, argon esa neon ostida bo'lishi uchun bu ikki davrni bir-birining ostiga yozsak, elementlarning quyidagi tartibini olamiz:
Ushbu tartibga solish bilan o'z xususiyatlariga o'xshash va bir xil valentlikka ega bo'lgan elementlar, masalan, litiy va natriy, berilliy va magniy va boshqalar vertikal ustunlarga tushadi.
Barcha elementlarni davrlarga bo'lib, bir davrni ikkinchi davr ostida joylashtirgan holda xossalari va hosil bo'lgan birikmalar turi bo'yicha bir-biriga o'xshash elementlar bir-birining ostiga tushishi uchun Mendeleyev jadval tuzib, uni elementlarning davriy sistemasini guruhlar va qatorlar bo'yicha deb atagan. Ushbu jadvalda zamonaviy shakl, Mendeleevdan keyin kashf etilgan elementlar bilan to'ldirilgan, kitob boshida berilgan.
U o'nta gorizontal qator va sakkizta vertikal ustun yoki guruhlardan iborat bo'lib, ularda bir-biriga o'xshash elementlar bir-birining ostiga joylashtiriladi.
Keling, birinchi navbatda elementlarning gorizontal qatorlarda joylashishiga e'tibor qarataylik. Birinchi qatorda faqat ikkita element mavjud - vodorod va geliy. Bu ikki element birinchi davrni tashkil qiladi. Ikkinchi va uchinchi qatorlar biz ko'rib chiqqan elementlardan iborat bo'lib, har biri sakkiz elementdan iborat ikkita davrni tashkil qiladi. Ikkala davr ham gidroksidi metall bilan boshlanadi va noiloj gaz bilan tugaydi. Har uch davr ham kichik davrlar deb ataladi.
To'rtinchi qator ham gidroksidi metall - kaliy bilan boshlanadi. Oldingi ikki qatorda xususiyatlar qanday o'zgarganiga qarab, bu erda ular bir xil ketma-ketlikda o'zgarishini kutish mumkin va ketma-ket ettinchi element yana halogen, sakkizinchisi esa asil gaz bo'ladi. Biroq, bu kuzatilmaydi. Halojen o'rniga ettinchi o'rinda marganets, ham asosiy, ham kislotali oksidlarni hosil qiluvchi metall, faqat eng yuqori qismi mos keladigan xlor oksidiga o'xshaydi. Marganetsdan keyin bir qatorda yana uchta metall bor - temir, kobalt va nikel, ular bir-biriga juda o'xshash. Va faqat keyingi, beshinchi qator, misdan boshlab, olijanob gaz kriptoni bilan tugaydi. Oltinchi qator yana ishqoriy metall rubidiydan boshlanadi va hokazo.Shunday qilib, argondan keyingi elementlarda xossalarning ozmi-koʻpmi toʻliq takrorlanishi ikkinchi elementda boʻlgani kabi sakkizdan keyin emas, faqat oʻn sakkiz elementdan keyin kuzatiladi. va uchinchi qatorlar. Bu o'n sakkiz element to'rtinchi - ikki qatordan iborat buyuk davr deb ataladigan davrni tashkil qiladi.
Beshinchi asosiy davr keyingi ikki qator, oltinchi va ettinchi qatorlardan iborat. Bu davr boshlanadi gidroksidi metall rubidium va asil gaz ksenon bilan tugaydi.
Sakkizinchi qatorda, lantandan keyin, lantanidlar (yoki lantanidlar) deb ataladigan o'n to'rtta element mavjud bo'lib, ular lantanga va bir-biriga juda o'xshash. Ushbu o'xshashlikni hisobga olgan holda, ularning atomlari tuzilishining o'ziga xosligi tufayli (32-bandga qarang), lantanidlar odatda umumiy jadvaldan tashqarida joylashtiriladi, faqat lantan uchun qutida ularning tizimdagi o'rnini qayd qiladi.
Ksenondan keyingi asil gaz radoni faqat to'qqizinchi qatorning oxirida joylashganligi sababli, sakkizinchi va to'qqizinchi qatorlar ham bitta katta davrni tashkil qiladi - o'ttiz ikkita elementni o'z ichiga olgan oltinchi.
Katta davrlarda elementlarning barcha xossalari ikkinchi va uchinchi davrlardagi kabi izchil o'zgarmaydi. Bu erda, davrlarning o'zlari ichida xususiyatlarning o'zgarishida hali ham ba'zi davriylik mavjud.
Shunday qilib, kislorodning eng yuqori valentligi dastlab bir elementdan ikkinchisiga o'tganda bir xilda ortadi, ammo keyin davr o'rtalarida maksimal darajaga etib, ikkiga tushadi, shundan so'ng davr oxiriga kelib yana ettitaga ko'tariladi. Shu munosabat bilan katta davrlarning har biri ikki qismga (ikki qatorga) bo'linadi.
Ettinchi - hali tugallanmagan davrni tashkil etuvchi o'ninchi qator o'n to'qqiz elementni o'z ichiga oladi, ulardan birinchi va oxirgi o'n uchtasi nisbatan yaqinda sun'iy yo'l bilan olingan. Aktiniydan keyingi o'n to'rt element atomlarining tuzilishiga ko'ra aktiniyga o'xshaydi; shuning uchun aktinidlar (yoki aktinidlar) nomi ostida ular lantanidlar kabi umumiy jadvaldan tashqarida joylashtiriladi.
Jadvalning vertikal ustunlarida yoki guruhlarda o'xshash xususiyatlarga ega bo'lgan elementlar mavjud. Shuning uchun, har bir vertikal guruh, xuddi elementlarning tabiiy oilasi. Jadvalda sakkizta shunday guruh mavjud. Guruh raqamlari yuqori qismida rim raqami bilan belgilanadi.
Birinchi guruhdagi elementlar bilan oksidlar hosil qiladi umumiy formula, ikkinchisida - RO, uchinchisida - va hokazo. Shunday qilib, kislorod bo'yicha har bir guruh elementlarining eng yuqori valentligi, bir nechta istisnolardan tashqari, guruh raqamiga to'g'ri keladi.
Xuddi shu guruhga kiruvchi elementlarni solishtirsak, shuni ko'rish mumkinki, beshinchi qatordan (to'rtinchi davr) boshlab, har bir element to'g'ridan-to'g'ri uning ostida yoki tepasida joylashgan element bilan emas, balki undan ajratilgan elementlar bilan eng katta o'xshashlikni ko'rsatadi. bitta hujayra. Masalan, yettinchi guruhda brom bevosita xlor va yodga qo‘shilmaydi, balki xlordan marganets, yoddan texnetiy bilan ajratiladi; oltinchi guruhdagi o'xshash elementlar - selen va tellur molibden bilan ajralib turadi, bu ulardan juda farq qiladi; birinchi guruhga kiruvchi rubidiy sakkizinchi qatorda joylashgan seziyga juda o'xshaydi, lekin to'g'ridan-to'g'ri uning ostida joylashgan kumushga deyarli o'xshamaydi va hokazo.
Bu to'rtinchi qatordan boshlab har biri bir-birining ustiga joylashgan ikkita qatordan iborat katta davrlar boshlanishi bilan izohlanadi. Davr ichida metall xususiyatlar chapdan o'ngga zaiflashganligi sababli, har bir katta davrda yuqori (juft) qatorning elementlari pastki (g'oq) elementlarga qaraganda aniqroq bo'lishi aniq. Qatorlar orasidagi farqni belgilash uchun katta davrlarning birinchi qatorlari elementlari jadvalda chapga, ikkinchi qatorlar elementlari esa o‘ngga siljiydi.
Shunday qilib, to'rtinchi davrdan boshlab, davriy tizimning har bir guruhini ikkita kichik guruhga bo'lish mumkin: yuqori qatorlar elementlaridan tashkil topgan "juft" va pastki qatorlar elementlaridan tashkil topgan "gq". Mendeleyev tipik deb atagan kichik davrlar elementlariga kelsak, birinchi va ikkinchi guruhlarda ular o‘z xossalariga ko‘ra juft qatorlar elementlariga yaqinroq bo‘lib, chapga, boshqalarida esa toq qatorlar elementlariga siljiydilar. O'ngga.
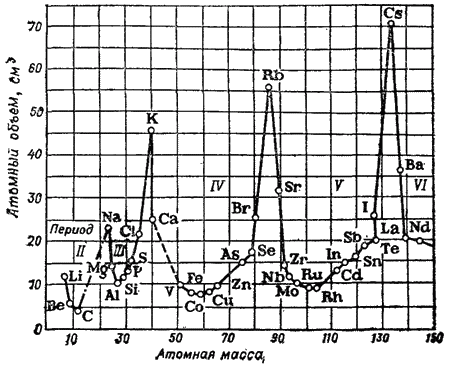
Guruch. 1. Element atom hajmining atom massasiga bog'liqligi.
Shuning uchun tipik elementlar odatda bitta asosiy kichik guruhga juft yoki toq qatorlarning o'xshash elementlari bilan birlashtiriladi va boshqa kichik guruh ikkinchi darajali deb ataladi.
Davriy tizimni qurishda Mendeleev elementlarni atom massalarining ortib borishiga qarab joylashtirish tamoyiliga amal qilgan. Biroq, jadvaldan ko'rinib turibdiki, uchta holatda bu tamoyil buzilgan. Ha, argon atom massasi 39,948) kaliydan (39,098), kobalt (58,9332) nikeldan (58,70) oldin va tellurdan (127,60) yoddan (126,9045) oldin. Bu erda Mendeleev o'zi qabul qilgan tartibdan chetga chiqdi, bu elementlarning xususiyatlaridan kelib chiqib, ularni joylashtirishning aynan shunday ketma-ketligini talab qildi. Shunday qilib, u atom massasiga alohida ahamiyat bermadi va jadvaldagi elementning o'rnini belgilab, uning xususiyatlarining umumiyligiga asoslandi. Keyingi tadqiqotlar Mendeleyev tomonidan tuzilgan davriy sistemada elementlarning joylashishi mutlaqo to‘g‘ri va atomlarning tuzilishiga mos kelishini ko‘rsatdi (batafsilroq III bobga qarang).
Demak, davriy sistemada elementlarning xossalari, ularning atom massasi, valentligi va kimyoviy xarakteri gorizontal va vertikal yo’nalishda ma’lum ketma-ketlikda o’zgaradi. Jadvaldagi elementning o'rni, shuning uchun uning xususiyatlari bilan belgilanadi va aksincha, har bir joy ma'lum xususiyatlar to'plamiga ega bo'lgan elementga mos keladi.
Shuning uchun, jadvaldagi elementning o'rnini bilib, uning xususiyatlarini juda aniq belgilashingiz mumkin.
Elementlarning nafaqat kimyoviy xossalari, balki juda ko'p fizik xususiyatlari ham oddiy moddalar davriy ravishda o'zgarib turadi, agar ularni atom massasining funktsiyalari deb hisoblasak.
O'zgarishlarning davriyligi jismoniy xususiyatlar oddiy moddalar, masalan, ularning atom hajmlarini solishtirganda aniq namoyon bo'ladi.
Shaklda ko'rsatilgan. 1 egri chiziq atom massasining ortishi bilan elementlarning atom hajmi qanday o'zgarishini ko'rsatadi: gidroksidi metallar eng katta atom hajmlariga ega.
Oddiy moddalarning boshqa ko'plab fizik konstantalari ham davriy ravishda o'zgarib turadi.
Dmitriy Ivanovich Mendeleev 1834 yil 27 yanvarda (8 fevral) Tobolsk shahrida mahalliy gimnaziya direktori oilasida tug'ilgan. Tobolsk gimnaziyasini tugatgach, Peterburg pedagogika institutiga oʻqishga kiradi va uni 1855 yilda oltin medal bilan tugatadi. 1859 yilda "O'n." mavzusida nomzodlik dissertatsiyasini himoya qildi aniq hajmlar”, Mendeleev ikki yillik ilmiy sayohat bilan chet elga ketdi. Rossiyaga qaytgach, dastlab Sankt-Peterburg texnologiya institutida, ikki yildan so‘ng esa Sankt-Peterburg universitetida professor etib saylandi va u yerda 33 yil davomida ilmiy-pedagogik ish olib bordi. 1892 yilda Mendeleev 1893 yilda uning tashabbusi bilan Bosh og'irlik va o'lchovlar palatasiga (hozirgi D. I. Mendeleev nomidagi Butunittifoq Metrologiya ilmiy tadqiqot instituti) aylantirilgan Namunaviy o'lchovlar va o'lchovlar omborining ilmiy xodimi etib tayinlandi.
Mendeleyev ijodiy faoliyatining eng katta natijasi 1869 yilda, ya’ni 35 yoshida davriy qonunni kashf etishi va elementlarning davriy tizimini yaratishi bo‘ldi. Mendeleevning boshqa asarlaridan eng muhimi "Suvli eritmalarni o'rganish solishtirma og'irlik”, doktorlik dissertatsiyasi “Spirtning suv bilan birikmasi to‘g‘risida” va “Eritmalarni assotsiatsiya sifatida tushunish”. Mendeleyev tomonidan ishlab chiqilgan eritmalarning kimyoviy yoki gidrat nazariyasining asosiy tushunchalari hozirgi eritmalar nazariyasining muhim qismini tashkil qiladi.
Mendeleevning ajoyib ishi uning "Kimyo asoslari" kitobidir, unda birinchi marta barcha noorganik kimyo davriy qonun nuqtai nazaridan taqdim etilgan.
Nazariyani amaliyot bilan uzviy bog‘lagan holda, Mendeleyev butun umri davomida mahalliy sanoatni rivojlantirishga katta e’tibor berdi.
1984 yilda ilmiy hamjamiyat Sovet Ittifoqi davriy qonunni kashf etgan va elementlarning davriy tizimini yaratgan atoqli olim D.I.Mendeleyev tavalludining yuz ellik yilligini dunyoning koʻpgina mamlakatlarida tantanali ravishda nishonladi.
Davriy tizim kimyoviy elementlar
Hozirgi vaqtda 109 ta kimyoviy element ma'lum. Oxirgi elementlar faqat bir necha atom miqdorida olingan va amaliy ahamiyatga ega emas. Biroq, davriy tizim yanada kengaytirilishi mumkin.
Shakllar grafik tasvir davriy tizim (davriy jadval) boshqacha bo'lishi mumkin; ularning asosiy ikkitasi: uzun va qisqa.
Jadvalning uzun shaklida har bir davr bir qatorda yoziladi. O'quv maqsadlarida odatda jadvalning qisqa shakli qo'llaniladi, unda uzun davrlar ikki qatorga yoziladi.
Davriy tizimdan iborat etti davrdan, jadvalda gorizontal ravishda joylashtirilgan, va sakkizta guruh vertikal ravishda joylashtirilgan.
Davr - ishqoriy metalldan boshlanib, inert (olijanob) gaz bilan tugaydigan (1-davrdan tashqari) elementlarning gorizontal qatori.
1-davr 2 ta elementdan, 2 va 3-davrlarda har biri 8 ta elementdan iborat. Birinchi, ikkinchi va uchinchi davrlar deyiladi kichik (qisqa) davrlar. 4-va 5-davrlarda har biri 18 ta elementdan, 6-davrda 32 ta elementdan, 7-davrda 87 va undan keyingi elementlardan, hozirda maʼlum boʻlgan oxirgi elementlardan 109-gacha boʻlgan elementlar mavjud. To'rtinchi, beshinchi, oltinchi va ettinchi davrlar deyiladi katta (uzoq) davrlar.
Har biri Guruh Davriy tizim ikkita kichik guruhdan iborat: asosiy kichik guruh (A) va ikkilamchi kichik guruh (B). Asosiy kichik guruh kichik va katta davrlarning elementlarini o'z ichiga oladi (metalllar va metall bo'lmaganlar). yon kichik guruh faqat katta davrlarning elementlarini o'z ichiga oladi (faqat metallar).
Masalan, I guruhning asosiy kichik guruhi litiy, natriy, kaliy, rubidiy, seziy va fransiy elementlaridan, I guruhning ikkinchi darajali kichik guruhi esa mis, kumush va oltin elementlardan iborat. VIII guruhning asosiy kichik guruhini inert gazlar, ikkilamchi kichik guruhini temir, kobalt, nikel, ruteniy, rodiy, palladiy, osmiy, iridiy, platina, hassiy va meitneriy metallari tashkil qiladi. .
Oddiy moddalar va elementlarning birikmalarining xossalari o'zgaradi monoton tarzda har bir davrda va spazmodik tarzda davrlar chegarasida. Xususiyatlarning o'zgarishining bu tabiati davriy bog'liqlikning ma'nosidir.
DA davrlar chapdan o'ngga elementlarning metall bo'lmagan xossalari monoton ravishda oshadi, metall xususiyatlari esa zaiflashadi. Masalan, ikkinchi davrda litiy juda faol metall, berilliy amfoter oksid hosil qiluvchi metall va shunga mos ravishda amfoter gidroksid, B, C, N, O tipik nometallar, ftor eng faol hisoblanadi. metall bo'lmagan, neon inert gazdir. Shunday qilib, davr chegaralarida xususiyatlar keskin o'zgaradi: davr gidroksidi metalldan boshlanadi va inert gaz bilan tugaydi.
DA davrlar chapdan o'ngga qarab element oksidlari va ularning gidratlarining kislotali xossalari ortadi, asosiy xossalari esa zaiflashadi. Masalan, uchinchi davrda natriy oksidi asosli oksid, magniy oksidi asosli, alyuminiy oksidi amfoter, kremniy, fosfor, oltingugurt va xlor oksidlari esa kislotali oksid hisoblanadi. Natriy gidroksid - kuchli asos (ishqor), magniy gidroksid - zaif erimaydigan asos, A1 (OH) 3 - erimaydigan amfoter gidroksid, kremniy kislotasi - juda kuchsiz kislota, H 3 PO 4 - o'rtacha kuchli kislota, sulfat kuchli kislota, HClO 4 (perklorik) bu seriyadagi eng kuchli kislotadir.
DA asosiy kichik guruhlar yuqoridan pastgacha elementlarning metall xossalari kuchayadi, metall bo'lmagan xususiyatlar esa zaiflashadi. Masalan, 4A kichik guruhida: uglerod va kremniy nometallar, germaniy, qalay, qo'rg'oshin metallar va qalay, qo'rg'oshin germaniyga qaraganda ko'proq tipik metallardir. 1A kichik guruhida barcha elementlar metallardir, ammo shunga ko'ra kimyoviy xossalari Shuningdek, litiydan seziy va fransiygacha bo'lgan metall xususiyatlarining kuchayishini kuzatish mumkin.
Natijada, metall xususiyatlari eng seziy va fransiyda, metall bo'lmagan - ftorda ifodalangan.
DA asosiy kichik guruhlar yuqoridan pastga qarab oksidlar va ularning gidratlarining asosiy xossalari ortadi, kislota xossalari esa zaiflashadi. Masalan, 3A kichik guruhida: B 2 O 3 - kislota oksidi, va T1 2 O 3 - asosiy. Ularning gidratlari: H 3 BO 3 kislota, T1 (OH) 3 esa asosdir.
1. Davriy qonunning D.I. tomonidan kashf etilishi. Mendeleev.
2.
Davriy qonunning D.I. tomonidan kashf etilishi. Mendeleev
Davriy qonunni kashf etgan kuni D.I. Mendeleev 1869 yil 1 mart sanaladi, garchi bu kashfiyotga yo'l ko'p yillar o'tib ketgan bo'lsa ham. Endi Mendeleev nomi dunyoning eng buyuk olimlari nomlari ro'yxatiga abadiy kirdi va uning kashfiyoti zamonaviy kimyoning asosiga aylandi.
Kimyoviy elementlar tasnifining asosi D.I. Mendeleev o'sha davrda ma'lum bo'lgan ikkita asosiy xususiyatni qo'ydi: 1) atom massasi; 2) kimyoviy xossalari. Ma'lum elementlarning sistematikasi bo'yicha ish (o'sha paytda ulardan 63 tasi ma'lum edi) D.I. Mendeleyev elementlarni asosiy xossalarini hisobga olgan holda atom massalarining ortishiga qarab joylashtirgan. U kimyoviy jihatdan o'xshash elementlarning muntazam ravishda paydo bo'lishini va shuning uchun ularning ko'pgina xossalari davriy ravishda bir qator elementlarda takrorlanishini aniqladi. Elementlar xossalarining atom massalariga bog'liqligi aniqlandi.
Ushbu naqsh davriy qonunda ifodalangan: oddiy jismlarning xossalari, shuningdek, elementlar birikmalarining shakllari va xossalari elementlarning atom og'irliklarining (massalarining) kattaligiga davriy bog'liqlikda bo'ladi.
Qonun elementlarni o'rganishda kuchli yangi vositadir. U elementlarning hali kashf etilmagan xususiyatlarini oldindan belgilash imkonini berdi. Shunday qilib, u 21, 31, 32-sonlar ostida o'sha paytda noma'lum elementlarning xususiyatlarini tasvirlab berdi (u bo'sh kataklarni qoldirdi). D.I.ning hayoti davomida. Mendeleev tomonidan ushbu uchta element kashf etilgan: 1875 yilda. 31 Ga (Lecoq de Boisbaudran), 1879 - 21 Sc (Nilson va Kliv), 1886 - 32 Ge (Vinkler) ni kashf etdi va davriy tizimga joylashtirildi. D.I.ning ushbu uchta elementi. Mendeleyev davriy qonunni «mustahkamlovchilar» deb atagan. U shunday deb yozgan edi: "Kelajak davriy qonunni halokat bilan tahdid qilmaydi, faqat keyingi ustki tuzilma va rivojlanish va'da qilinadi". Atom massasini oshirish orqali elementlarni tartibga solish, D.I. Mendeleev bu tamoyildan uch marta voz kechgan. Demak, 18 Ar(A=39,948) 19 K(A=39,098) gacha turadi; 27 Co(A=58,933) 28 Ni(A=58,70) gacha; 52 Te(127,60) dan 53 I(A=126,904) gacha. Shunday qilib, u atom massasiga alohida ahamiyat bermadi, balki elementlarning xususiyatlarining umumiyligini hisobga olgan holda jadvaldagi elementning o'rnini belgiladi. Atom tuzilishi nazariyasining rivojlanishi shuni ko'rsatdiki, elementlarning joylashishi D.I. Mendeleyev davriy sistemada mutlaqo to'g'ri va atomlarning tuzilishiga mos keladi.
Hozirda 114 ta ob'ekt ochiq. Davriy tizimda cheklovlar bormi? Fan javob beradi: keskin belgilangan chegaralar bo'lishi mumkin emas - davriy tizimning boshi ham, oxiri ham. Shunday qilib, 1953 yilda massasi vodorod atomidan deyarli 1000 baravar kam bo'lgan pozitroniy (Ps) topildi. Mendeleyev elementlar sistemasini ochadi.
Pozitroniy elektron va pozitron sifatida ifodalanishi mumkin. Pozitron - massasi elektronga o'xshash, ammo musbat zaryadga ega bo'lgan zarracha. Pozitroniy (Ps) umumiy tortishish markazi atrofida harakatlanadigan elektron va pozitrondir. Pozitroniy elektron-pozitron qobig'idan iborat bo'lib, yadroga ega emas, lekin qisqa umrga ega: taxminan 10 -7 - 10 -10 sek. va fotonlar emissiyasi bilan yo'qoladi. Pozitroniy elementlarning davriy sistemasini ochadi, u kuchli qaytaruvchidir va qaytaruvchi sifatida kimyoviy reaksiyalarda qatnasha oladi. Masalan, u ionlarni tiklaydi: Fe 3+ dan Fe 2+ gacha
Pozitroniyning kashf etilishi anti-atomlardan qurilgan butunlay boshqacha moddiy dunyo mavjudligi haqidagi savolni ko'tardi. Haqiqatan ham, pozitroniy atomlar orasidagi chegarada joylashgan - musbat zaryadlangan yadro va manfiy zaryadlangan elektronlardan iborat va atomlarga qarshi - manfiy zaryadlangan yadrolar va musbat zaryadlangan pozitronlar tizimlari:
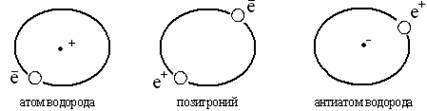
Antiatomlar mavjud, ularning ba'zilari (vodorod, geliyning antiatomlari) eksperimental ravishda o'rganilgan. Shuning uchun, davriy tizimning boshlanishi haqida gapirish mumkin emas, chunki pozitroniyga oid jadval antiatomlar dunyosida D.I. davriy jadvalining tuzilishini takrorlashi mumkin. Mendeleev.
Og'ir elementlar sohasida kimyoviy elementlar tizimining rivojlanishi mavjud: 114-element allaqachon kashf etilgan. D.I. qonunini to'ldiradigan (lekin buzilmaydigan) yangi naqshlar paydo bo'lishi mumkin. Mendeleev.
Davriy tizimning tabiiy oxiri o'rtacha ishlash muddati bo'lgan elementning atom raqami bilan belgilanadi atom yadrosi 1 * 10 -15 sekdan kamroq bo'ladi. 108-114 seriya raqamlari bo'lgan elementlar uchun bu vaqt taxminan 1 * 10 -12 sek. Atom yadrolari nazariyasining rivojlanishi katta seriya raqamlarida "barqarorlik orollari" mavjud bo'lishi mumkinligini hisobga olishga imkon berdi, ya'ni. uzoq umrga ega bo'lgan alohida atomlar.
boshiga
Davriy tizimning qurilishi (davr, guruh, kichik guruh).
Davriy qonunning ifodasi kimyoviy elementlarning davriy tizimidir. Davriy tizim davriy qonunning grafik tasviridir. 1869 yilda Mendeleev jadvalning eskizini - uzun shaklni berdi va 1870 yilda u qisqa shaklni taklif qildi. Qisqa shaklning zamonaviy versiyasiga ba'zi muhim o'zgarishlar kiritildi (noble gazlar nol guruhidan sakkizinchi guruhga ko'chirildi). Hozirgi vaqtda elementlarning davriy tizimining bir necha yuz variantlari (400 dan ortiq) ma'lum va ularning barchasi asosan Mendeleev tomonidan taklif qilingan qurilish tamoyilini o'z ichiga oladi.
Davriy sistema 7 davr va 8 guruhdan iborat.
Davr - tipik metalldan (ishqoriy) boshlanib, amfoter elementdan o'tib, metall bo'lmagan (olijanob gazlar) bilan tugaydigan atomlarning yadro zaryadini oshirish tartibida joylashgan gorizontal elementlar qatori. Davr raqami energiya darajalari sonini ko'rsatadi. Davrlar kichik va katta.
Malyugin 3. Davriy sistemaning tuzilishi. Davrlar.
Davriy jadvalning qisqa davr versiyasi quyidagilardan iborat davrlar, seriyalar, guruhlar va kichik guruhlar.
Uzoq muddatli versiyada seriyalar ko'rsatilmagan.
Davr - gidroksidi metalldan boshlanadigan atom yadrosi zaryadining o'sish tartibida joylashgan kimyoviy elementlar davriy tizimining gorizontal qatori ( Li, Na, K.Rb, Cs, Fr) va inert gaz bilan tugaydi (U, Yo'q, Ar, kr, Xe, Rn).
Istisnolar: vodorod (metall bo'lmagan) bilan boshlanadigan birinchi davr.
Davriy tizim mavjud etti davr va 10 seriya.
Davrlar kichik va katta bo'linadi.
Birinchi davr, 2 ta elementdan iborat va shuningdek ikkinchi va uchinchi, har biri 8 ta element bilan, kichik deyiladi. Ular bitta gorizontal qatordan iborat.
Har birida ikkita gorizontal qatorga ega qolgan davrlar, katta deyiladi.
To'rtinchi va beshinchi davrlar har birida 18 ta kimyoviy element mavjud. Beshinchi va oltinchi davrlar - har birida 32 ta kimyoviy element. Ettinchi davr, so'nggi ma'lumotlarga ko'ra, 32 ta elementni o'z ichiga oladi, ularning ko'pchiligi sun'iy ravishda yadroviy sintez reaktsiyasini o'tkazish orqali olingan.
Har bir asosiy davr bor ikki qator.
Katta davrlarning yuqori qatorlari deyiladi hatto, pastki qatorlar g'alati. Katta davrlarning hatto qatorlarida faqat metallar mavjud.
Lantandan keyingi oltinchi davrda La (seriya raqami Z=57) 14 ta element mavjud (seriya raqamlari Z=5, ular xossalari boʻyicha lantanga oʻxshash va shunday deyiladi). lantanidlar, ular davriy jadvalning pastki qismida joylashgan.
Aktiniy Ac dan keyingi to'liq bo'lmagan yettinchi davrda (seriya raqami Z=89) 14 ta element mavjud (seriya raqamlari Z =, ular aktiniyga xossalariga o'xshash va deyiladi. aktinidlar. Lantanidlar singari, ular davriy jadvalning pastki qismida joylashgan (1-rasm).
1-rasm. Davrlar va seriyalarning joylashishi
davriy tizimda
Jadval 1. Davrlardagi elementlar soni:
Davr raqami | Qatorlar soni | Davr nomi | Elementlar soni | Kichik guruhlar bo'yicha elementlar soni |
||
tomoni | Lantanidlar/ aktinidlar |
|||||
2 qator + lantanidlar | ||||||
2 qator + aktinidlar |
Davrlarda kuzatilgan naqshlar.
Har bir davr (birinchisidan tashqari) tipik metall (Li, Na, K, Rb, Cs, Fr) bilan boshlanadi va nobel gaz (He, Ne, Ar, Kr, Xe, Rn) bilan tugaydi, oldidan tipik bo'lmagan. -metall (F, Cl, Br, I, At).
Har bir davrda, chapdan o'ngga qarab, atom yadrosining zaryadi ortadi, atom radiusi kamayadi, metallning zaiflashishi va metall bo'lmagan xususiyatlarining kuchayishi, oksidlovchi xususiyatlarining pasayishi va kuchayishi kuzatiladi. elementlar va ular hosil qiladigan oddiy va murakkab moddalar.
O'z-o'zini tekshirish uchun savollar
1. Kimyoviy elementlarning davriy tizimi qanday tuzilish elementlaridan iborat?
2. Davr deb nimaga aytiladi?
3. Davriy sistemada nechta davr va qator bor?
4. Har bir davrda nechta element bor?
5. Qanday davrlar kichik deb ataladi va nima uchun?
6. Qancha qator kichik davrlarga ega?
7. Qanday davrlar katta deb ataladi? Qancha qator uzun davrlarga ega?
8. VI, VII davrlar tuzilishida qanday xususiyatlar mavjud?
9. Har bir davr qaysi elementlardan boshlanadi?
10. Har bir davr qaysi elementlar bilan tugaydi?
11. Qaysi elementlar asil (inert) gazlardan oldin turadi?
12. Chapdan o'ngga davrlarda elementlarning xossalari qanday o'zgaradi?
Javobni ko'rish
1. Davrlar, qatorlar, guruhlar va kichik guruhlardan.
2. Davr - atom yadrosi zaryadining o'sish tartibida joylashgan kimyoviy elementlar davriy tizimining gorizontal qatori, ishqoriy metall (Li, Na, K. Rb, Cs, Fr) bilan boshlanib, bir qator bilan tugaydi. inert gaz (He, Ne, Ar, Kr, Xe, Rn).
3. 7 ta nuqta va 10 qator.
4. 1-jadvalga qarang.
5. I, II va III davrlar kichik deyiladi, ular mos ravishda 2, 8, 8 kimyoviy elementlarni o'z ichiga oladi.
6. Kichik davrlarning har birida bir qator bor. 1-rasmga qarang.
7. IV, V, VI, VII davrlar katta deyiladi. Har bir asosiy davr 2 qatorga ega. 1-rasmga qarang.
8. VIda 14 ta element - lantanidlar, VII davrda 14 ta aktinidlar elementi mavjud. Qulaylik uchun ular stolning pastki qismida joylashgan.
13. Har bir davr (birinchisidan tashqari) tipik ishqoriy metall (Li, Na, K, Rb, Cs, Fr) bilan boshlanadi.
14. Har bir davr nobel gaz (He, Ne, Ar, Kr, Xe, Rn) bilan tugaydi.
15. Ulardan oldin tipik metall bo'lmaganlar - galogenlar (F, Cl, Br, I, At) joylashgan.
16. Har bir davrda, chapdan o'ngga qarab, metallning zaiflashishi va metall bo'lmagan xususiyatlarining kuchayishi, elementlarning va ular hosil qiladigan oddiy va murakkab moddalarning oksidlovchi xususiyatlarining pasayishi va kuchayishi kuzatiladi.
Mustaqil hal qilish uchun vazifalar
1. Tartib raqamlari 14, 48, 52, 56, 78 bo‘lgan elementlar qaysi davr va qatorlarda joylashgan? Ularning belgisini, ruscha nomini, nisbiy atom massasini ko'rsating.
2. IV davr toq qator elementlarining belgilarini, nomlarini va nisbiy atom massalarini yozing.
3. Qaysi elementning metall xossalari aniqroq - kalsiy yoki kaliy? Nega?
4. Qaysi elementning metall bo'lmagan xossalari aniqroq: fosfor yoki xlor? Nega?
5. To'rtinchi davrning qaysi elementi eng faol nometall hisoblanadi? Nega?
6. Beshinchi davrning qaysi elementi eng faol metall hisoblanadi? Nega?
Javobni ko'rish:
Tartib raqam | ||||||
Element belgisi | ||||||
Nisbiy atom massasi |
toq - PSHE ning 5-qatori, u elementlarni o'z ichiga oladi |
|||||||||
Element belgisi | |||||||||
Tartib raqam | |||||||||
Ruscha nomi | germaniy | ||||||||
Nisbiy atom massasi |
3. Kaliy. PSCEdagi elementlarning holatiga qarashingiz kerak. Kaliy (K) va kaltsiy (Ca) bir xil (to'rtinchi) davrda. Bir davr ichida metall xususiyatlar chapdan o'ngga zaiflashadi.
4. Xlor. PSCEdagi elementlarning holatiga qarashingiz kerak. Fosfor (P) va xlor (Cl) bir xil (uchinchi) davrda. Bir davrda, chapdan o'ngga, metall bo'lmagan xususiyatlar ortadi.
5. Bu davrning eng faol nometali bromdir. Bir davrda, chapdan o'ngga, metall bo'lmagan xususiyatlar ortadi. Kripton inert elementi kimyoviy faollikni ko'rsatmaydi, undan oldin eng faol metall bo'lmagan.
6. Bu davrning eng faol metalli rubidiydir. Davr faol ishqoriy metall (Li, Na, K. Rb, Cs, Fr) bilan boshlanadi, davrda chapdan o'ngga siljishda metall xossalari zaiflashadi. .






