Oddiy moddalarning Gibbs energiyasi. gibs energiyasi
Gollandiyalik fizik kimyogari Van't Xoff kimyoviy yaqinlikning yangi nazariyasini taklif qildi, u kimyoviy yaqinlikning mohiyatini tushuntirmasdan, uni o'lchash usulini ko'rsatish bilan cheklanadi, ya'ni. miqdoriy aniqlash kimyoviy yaqinlik.
van't Hoff kimyoviy yaqinlik o'lchovi sifatida maksimal ish Ayax yoki da yoki mos ravishda sodir bo'ladigan reaktsiyalar uchun foydalanadi.
Maksimal ish reaktsiyani to'xtatish, ya'ni kimyoviy yaqinlik kuchlarini engish uchun tizimga qo'llanilishi kerak bo'lgan energiyaga teng. Reaksiya ijobiy maksimal ishni bajarish yo'nalishida davom etganligi sababli, belgi yoki o'z-o'zidan oqim yo'nalishini aniqlaydi. kimyoviy o'zaro ta'sir.
Maksimal ish vaqti doimiy hajm ga teng
Farq tizimning Helmgolts energiyasi deb ataladi va harf bilan belgilanadi Shunday qilib,
Maksimal ish vaqti doimiy bosim ga teng
Farq tizimning Gibbs energiyasi deb ataladi va harf bilan belgilanadi.
![]()
Kimyoviy reaksiyaning Gibbs energiyasi.
Gibbs energiyasi sistema holatining termodinamik funktsiyasi. Oqim paytida tizimdagi Gibbs energiyasining o'zgarishi kimyoviy reaksiya kimyoviy reaksiyaning Gibbs energiyasi deyiladi. (IV.20) va (IV.21) tenglamalarga muvofiq,
![]()
(IV.21) ga asoslanib, kimyoviy reaksiyaning Gibbs energiyasi o'zgarmas harorat va bosim sharoitida reaksiyaning o'z-o'zidan borishi yo'nalishi va chegarasini tavsiflaydi.
Kimyoviy reaksiyaning Gelmgolts energiyasi.
Gelmgolts energiyasi sistema holatining termodinamik funksiyasi hamdir.Reaksiya jarayonida sistemada Gelmgolts energiyasining o’zgarishi kimyoviy reaksiyaning Gelmgolts energiyasi deyiladi. (IV.18) va (IV.19) ga muvofiq,
T va haroratda davom etayotgan reaksiya davomida tegishli termodinamik funktsiyalarning o'zgarishi bu erda va.
Qiymat [qarang tenglama (IV. 19)] izoxorik-izotermik sharoitda reaksiyalarning o‘z-o‘zidan ketishining yo‘nalishi va chegarasini tavsiflaydi.
Shaklda. IV.3 tizim holatining asosiy termodinamik funktsiyalari o'rtasidagi bog'liqlikni ko'rsatadi.
Kimyoviy birikmalar hosil bo'lishning Gibbs energiyasi.
Kimyoviy reaksiyaning Gibbs energiyasi tizim holatining termodinamik funktsiyasining o'zgarishi bo'lib, farqdan hisoblanishi mumkin.
![]()
("2" va "1" indekslari mos ravishda tizimning yakuniy va boshlang'ich holatini bildiradi). (IV.24) tenglama bo'yicha kimyoviy reaksiyaning Gibbs energiyasini hisoblashda shuni yodda tutish kerakki - barcha reaksiya mahsulotlarining hosil bo'lishining Gibbs energiyalari yig'indisi, - hosil bo'lishning Gibbs energiyalari yig'indisi. barcha boshlang'ich moddalardan. Kimyoviy reaksiyaning standart Gibbs energiyasi reaktsiya mahsulotlari va boshlang'ich materiallarning hosil bo'lishining standart Gibbs energiyalari yig'indisi o'rtasidagi farqdan hisoblanadi.
Standart Gibbs energiya ta'limi kimyoviy birikma standart holatda bo'lgan ushbu birikmaning bir molining hosil bo'lish reaktsiyasining Gibbs energiyasini mos keladiganidan chaqiring.
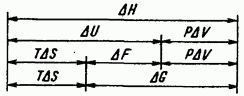
Guruch. IV.3. Eng muhim termodinamik funksiyalarning nisbati
oddiy moddalar ham mavjud standart holatlar va ma'lum haroratda termodinamik barqaror bo'lgan fazalar va modifikatsiyalar (IV.3-jadval).
Oddiy moddalarning hosil bo'lishining standart Gibbs energiyalari, agar ular bo'lsa, nolga teng qabul qilinadi jamlangan holatlar va modifikatsiyalar standart sharoitlarda barqaror va 298,16 K.
Kimyoviy reaksiyalarning o'z-o'zidan ketishining yo'nalishi va chegaralari.
(IV. 19) va (IV.21) ga muvofiq, ijobiy maksimal ish A yoki kimyoviy reaktsiyalarning Helmgolts energiyasi va Gibbs energiyasining salbiy qiymatlariga mos keladi. Boshqacha aytganda, qachon doimiy harorat va bosim bo‘lsa, reaksiya sistemaning Gibbs energiyasining kamayishiga to‘g‘ri keladigan yo‘nalishda o‘z-o‘zidan boradi.Shuning uchun berilgan va T da kimyoviy reaksiyaning o‘z-o‘zidan o‘tish sharti tengsizlikdir.
Reaksiyaning o'z-o'zidan oqimining chegarasi, ya'ni muvozanat sharti, funktsiyaning ma'lumotlari va T uchun minimal qiymatga erishishdir.
Doimiy harorat va hajmda reaksiya sistemaning Gelmgolts energiyasining kamayishiga mos keladigan yo'nalishda o'z-o'zidan boradi.Shuning uchun o'z-o'zidan sodir bo'lish sharti.
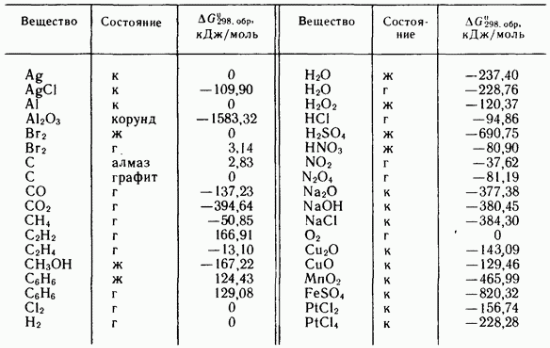
IV.3-jadval, 298,16 K da ba'zi oddiy moddalar va birikmalarning hosil bo'lishning standart Gibbs energiyalari
Berilgan V va T uchun kimyoviy reaksiyaning ixtiyoriy borishi tengsizlikdir
Reaksiyaning o'z-o'zidan oqimining chegarasi, ya'ni muvozanat holati, funktsiyaning berilgan V va T qiymatlari uchun minimal qiymatga erishishdir.
Agar o'zgartirilganda kimyoviy tarkibi Tizim Gibbs energiyasining ortishiga mos keladi, ya'ni o'z-o'zidan reaktsiya sodir bo'lmaydi. Tengsizlik
reaksiya o'z-o'zidan faqat teskari yo'nalishda borishi mumkinligini bildiradi, bu tizimning Gibbs energiyasining pasayishiga to'g'ri keladi. Kimyoviy reaksiyaning standart Gibbs energiyasini 298,16 K da hisoblash va shu tariqa funktsiyaning o'zgarishi belgisini topish qiyin emas.
Masalan, jadvalda keltirilgan ma'lumotlardan foydalanish. IV.3, reaksiyaning standart Gibbs energiyasini 298,16 K da (1 mol uchun) hisoblash mumkin.
Reaksiyaning Gibbs energiyasining natijaviy qiymati tengsizlikni qanoatlantiradi (IV.25). Bu 101 kPa va 298 K da natriy oksidining suv bilan o'zaro ta'sir qilish jarayoni ishlab chiqarish (k) yo'nalishi bo'yicha o'z-o'zidan borishi mumkinligini anglatadi.
Biroq standart energiya Kimyoviy reaksiyaning Gibbsi standartdan boshqa sharoitlarda kimyoviy oʻzaro taʼsirning oʻz-oʻzidan paydo boʻlish yoʻnalishi yoki chegarasi uchun mezon boʻla olmaydi. Miqdorni miqdor bilan almashtirish ham mumkin emas.Bularning barchasi real sharoitda sodir bo'layotgan jarayonlarni baholash uchun Gibbs energiyasidan foydalanishni biroz qiyinlashtiradi.
(IV.22) tenglamadan kelib chiqadiki, kimyoviy reaksiyaning Gibbs energiyasi qancha kichik bo'lsa, shuncha kichik va kattaroq bo'lsa, moddalarning bir-biriga nisbatan eng katta kimyoviy yaqinligi issiqlik ajralib chiqishi bilan davom etuvchi reaktsiyalarda namoyon bo'ladi. sistema entropiyasining ortishi bilan birga (IV.22) tenglamadan, shuningdek, entropiyaning pasayishi bilan sodir bo'ladigan endotermik jarayonlar o'z-o'zidan sodir bo'lolmaydi, chunki bu holda qiymat har doim ijobiy bo'ladi. Endotermik o'zaro ta'sirlar, agar bunday o'zaro ta'sirlar haroratning oshishi bilan osonlashtirilsa, o'z-o'zidan davom etishi mumkin, chunki bu jarayonning entropiya omili qiymatini oshiradi.
Bu yerda siz entalpiya, entropiya, kabi termodinamik parametrlarni hisoblash uchun topshiriqlar misollarini topasiz. Jarayonning o'z-o'zidan o'tish imkoniyatini aniqlash, shuningdek, termokimyoviy tenglamalarni tuzish.
Eritmalar bilan termodinamika asoslari bo'limi uchun topshiriqlar
Topshiriq 1. Kimyoviy reaksiyaning standart entalpiyasi va standart entropiyasini hisoblang. 298 °K da (oldinga yoki teskari) reaksiya qaysi yo'nalishda borishini aniqlang. Reaksiyaning har ikki yo‘nalishi ham teng bo‘lgan haroratni hisoblang.
Fe 2 O 3 (c) + 3H 2 \u003d 2Fe (c) + 3H 2 O (g)
Δ Htuman = SH 0 con– SH 0 ref kJ/mol
Malumot ma'lumotlaridan foydalanish standart entalpiyalar moddalarni topamiz:
Δ Htuman= 2 Δ H 0 Fe +3 Δ H 0 H2 O - Δ H 0 Fe2 O3 - 3 Δ H 0 H2 \u003d 2 0 + 3 (- 241,82) - (-822,16) - 3 0 \u003d 96,7 kJ / mol
Δ Stuman=Σ S 0 con– Σ S 0 ref J/(mol K)
Malumot ma'lumotlaridan foydalanish standart entropiyalar moddalarni topamiz:
Δ Stuman= 2 Δ S 0 Fe + 3 Δ S 0 H2 O - Δ S 0 Fe2 O3 - 3 Δ S 0 H2 = 2 27,15 + 3 188,7 – 89,96 – 3 131 = 137,44 J/(mol K)
DG = Δ H – TDS\u003d 96,7 - 298 137,44 / 1000 \u003d 55,75 kJ / mol
T=298°K da, DG> 0 - reaktsiya o'z-o'zidan ketmaydi, ya'ni. reaktsiya teskari yo'nalishda davom etadi.
DG = Δ H – TDS= 0, keyin
T= — (DG – Δ H) / ∆S= — (0-96,7)/0,137 = 705,83K
T = 705,83 K da reaktsiya teng ehtimollik bilan oldinga va teskari yo'nalishda davom etadi.
2-topshiriq. Gibbs energiyasini hisoblang va reaksiyaning 1000 va 3000 K haroratlarda borish imkoniyatini aniqlang.
Suyuq uglerod disulfidining yonishi uchun reaktsiya tenglamasi quyidagicha:
CS 2 (l) + 3O 2 \u003d CO 2 + 2SO 2
Reaksiyaning issiqlik effektini moddalarning standart entalpiyalarining mos yozuvlar ma'lumotlarini ifodaga almashtirish orqali hisoblaymiz:
Δ Htuman = SH 0 con– SH 0 ref kJ/mol
Δ Htuman= 2 Δ H 0 SO2+ Δ H 0 CO2- Δ H 0 CS2 - 3 Δ H 0 O2 \u003d 2 (-296,9) + 3 (- 393,5) - 87 - 3 0 \u003d -1075,1 kJ / mol
Bular. yonish paytida 1 mol uglerod disulfidi ajralib chiqadi 1075,1 kJ issiqlik
va yonayotganda x mollar uglerod disulfidi ajralib chiqadi 700 kJ issiqlik
Keling, topamiz X:
x\u003d 700 1 / 1075,1 \u003d 0,65 mol
Demak, reaksiya natijasida 700 kJ issiqlik ajralib chiqsa, reaksiyaga 0,65 mol CS 2 kiradi.
4-topshiriq. Quyidagi termokimyoviy tenglamalar asosida temir oksidi (II) ning vodorod bilan qaytarilish reaksiyasining issiqlik effektini hisoblang:
1. FeO (c) + CO (g) \u003d Fe (c) + CO 2 (g); DH 1 = -18,20 kJ;
2. CO (g) + 1 / 2O 2 (g) \u003d CO 2 (g) DH 2 \u003d -283,0 kJ;
3. H 2 (g) + ½ O 2 (g) \u003d H 2 O (g) DH 3 \u003d -241,83 kJ.
Temir oksidi (II) ning vodorod bilan qaytarilish reaktsiyasi quyidagi shaklga ega:
4. FeO (c) + H 2 (g) = Fe (c) + H 2 O (g)
Reaksiyaning termal ta'sirini hisoblash uchun uni qo'llash kerak , ya'ni. 4. reaksiyani 1. va 2. reaksiyalarni qoʻshib, 1. reaksiyani ayirib olish mumkin:
Δ Htuman= Δ H 1 + Δ H 3 – Δ H 2 \u003d -18,2 - 241,3 + 283 \u003d 23 kJ
Shunday qilib, reaksiyaning termal effekti temir oksidi (II) ning vodorod bilan qaytarilishi teng
Δ Htuman= 23 kJ
Topshiriq 5. Benzolning yonish reaksiyasi termokimyoviy tenglama bilan ifodalanadi:
C 6 H 6 (g) + 7½ O 2 (g) \u003d 6CO 2 (g) + 3H 2 O (g) - 3135,6 kJ.
Suyuq benzolning hosil bo'lish issiqligini hisoblang. Suyuq benzolning issiqlik qiymatini, standart shartlar odatdagidek bo'lishi sharti bilan aniqlang.
Reaksiyaning issiqlik effekti:
Δ Htuman = SH 0 con– SH 0 ref kJ/mol
Bizning holatda Δ Htuman= - 3135,6 kJ, suyuq benzolning hosil bo'lish issiqligini topamiz:
Δ Htuman= 6 Δ H 0 O2 + 3 bilan Δ H 0 H2 O - Δ H 0 C6 H6 - 7,5 Δ H 0 O2
-Δ H 0 C6 H6= Δ Htuman- 3 (-241,84) + 6 (- 393,51) - 7,5 0 \u003d - 3135,6 - 3 (-241,84) + 6 (- 393,51) - 7, 5 0 \u003d - 49,02 kJ / mol
Δ H 0 C6 H6 = 49,02 kJ/mol
Kaloriya qiymati suyuq benzol quyidagi formula bo'yicha hisoblanadi:
QT= Δ Htuman 1000 / M
M(benzol) = 78 g/mol
QT= - 3135,6 1000 / 78 = - 4,02 10 4 kJ / kg
Kaloriya qiymati suyuq benzol Q T = - 4,02 10 4 kJ / kg
Topshiriq 6. Etil spirtining oksidlanish reaksiyasi tenglama bilan ifodalanadi:
C 2 H 5 OH (g) + 3,0 O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g).
DH x.r ni bilgan holda C 2 H 5 OH (l) hosil bo lish issiqligini aniqlang. = - 1366,87 kJ. Termokimyoviy tenglamani yozing. Bug'lanishning molyar issiqligini C 2 H 5 OH (g) → C 2 H 5 OH (g) aniqlang, agar hosil bo'lish issiqligi C 2 H 5 OH (g) ma'lum bo'lsa, -235,31 kJ mol -1 ga teng.
Berilgan ma'lumotlarga asoslanib, biz yozamiz termokimyoviy tenglama:
C 2 H 5 OH (g) + 3O 2 (g) \u003d 2CO 2 (g) + 3H 2 O (g) + 1366,87 kJ
termal effekt reaktsiyalar teng:
Δ Htuman = SH 0 con– SH 0 ref kJ/mol
Bizning holatda Δ Htuman= - 1366,87 kJ.
Malumot ma'lumotlaridan foydalanish moddalarning hosil bo'lish issiqliklari, C 2 H 5 OH (l) hosil bo'lish issiqligini topamiz:
Δ Htuman= 2 Δ H 0 O2 + 3 bilan Δ H 0 H2 O - Δ H 0 C2 H5 OH(l) – 3 Δ H 0 O2
- 1366,87 \u003d 2 (-393,51) + 3 (-285,84)— Δ H 0 C2 H5 OH - 3 0
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
Δ H 0 C2 H5 OH(g) = Δ H 0 C2 H5 OH(l) + Δ H 0 bug'lanish
Δ H 0 bug'lanish = Δ H 0 C2 H5 OH(g) - Δ H 0 C2 H5 OH(l)
Δ H 0 bug'lanish\u003d - 235,31 + 277,36 \u003d 42,36 kJ / mol
C 2 H 5 OH (l) ning hosil bo'lish issiqligi teng ekanligini aniqladik
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
va bug'lanishning molyar issiqligi C 2 H 5 OH (l) → C 2 H 5 OH (g) bo'ladi.
Δ H 0 bug'lanish= 42,36 kJ/mol
7-topshiriq. Standart sharoitda ekzotermik reaksiya mumkin emasligini qanday tushuntirish mumkin?
CO 2 (g) + H 2 (g) ↔ CO (g) + H 2 O (g)?
Ushbu reaksiyaning DG ni hisoblang. Qanday haroratlarda bu reaktsiya o'z-o'zidan paydo bo'ladi?
Hisoblash DG bu reaktsiya:
DG = Δ H – TDS
Buning uchun biz birinchi navbatda aniqlaymiz Δ Hva ∆S reaktsiyalar:
Δ Htuman = SH 0 con– SH 0 ref kJ/mol
Malumot ma'lumotlaridan foydalanish standart entalpiyalar moddalarni topamiz:
Δ Htuman= Δ H 0 H2 O(l) + Δ H 0 CO- Δ H 0 CO2 - Δ H 0 H2 \u003d -110,5 + (-285,8) - (393,5) - 0 \u003d -2,8 kJ / mol
Δ Stuman=Σ S 0 con– Σ S 0 ref J/(mol K)
Xuddi shunday, mos yozuvlar ma'lumotlaridan foydalanish standart entropiyalar moddalarni topamiz:
Δ Stuman= Δ S 0 H2 O(l) + Δ S 0 CO- Δ S 0 CO2 - Δ S 0 H2 \u003d 197,5 + 70,1 - 213,7 - 130,52 \u003d -76,6 J / (mol K)
Keling, topamiz Gibbs energiyasi standart sharoitlarda
DGtuman= Δ H – TDS\u003d -2,8 + 298 76,6 / 1000 \u003d 20 kJ / mol> 0,
shuning uchun reaktsiya o'z-o'zidan bo'ladi ketmaydi.
Bu reaksiya qanday haroratda bo'lishini toping o'z-o'zidan.
Muvozanat holatida DGtuman = 0 , keyin
T = Δ H/ ∆S = -2,8 / (-76,6 1000) \u003d 36,6 K
Vazifa 8. DG va DS jadval ma’lumotlari asosida hisoblab, reaksiyaning issiqlik effektini aniqlang:
2 NO (g) + Cl 2 (g) ↔ 2 NOCl (g).
Doimiy harorat va bosimda o'zgarish Gibbs energiyasi
DG = Δ H – TDS
Jadval ma'lumotlariga asoslanib, biz hisoblaymiz ∆G va ∆S
DG 0 tuman= Σ DG 0 ishlab chiqarish — Σ DG 0 ref
DGtuman= 2 DG 0 NOCl(G) — 2 DG 0 YO'Q(G) — DG 0 Cl2(d)
DGtuman= 2 66,37 — 2 89,69 – 0 = — 40,64 kJ/mol
DGtuman < 0 , shuning uchun reaktsiya o'z-o'zidan bo'ladi.
Δ Stuman=Σ S 0 con– Σ S 0 ref J/(mol K)
Δ Stuman = 2 ∆S 0 NOCl(G) — 2 ∆S 0 YO'Q(G) — ∆S 0 Cl2(d)
Δ Stuman = 2 261,6 — 2 210,62 – 223,0 = -121,04 J/(mol K)
Keling, topamiz Δ H :
Δ H = DG + TDS
Δ H = - 40,64 + 298 (-121,04 / 1000) \u003d - 76,7 kJ / mol
Reaksiyaning issiqlik effekti Δ H = - 76,7 kJ / mol
Masala 9. Gazsimon vodorod xlorid nima bilan ko'proq (1 mol uchun) o'zaro ta'sir qiladi: alyuminiy bilan yoki qalay bilan? Javobingizni ikkala reaksiya uchun DG 0 ni hisoblab bering. Reaktsiya mahsulotlari qattiq tuz va gazsimon vodoroddir.
Hisoblash ∆G0 gazsimon vodorod xloridning (1 mol uchun) alyuminiy bilan o'zaro ta'siri reaktsiyasi uchun
2Al (t) + 6HCl (g) \u003d 2AlCl 3 (t) + 3H 2
DG 0 tuman= Σ DG 0 ishlab chiqarish — Σ DG 0 ref kJ/mol
DG 0 tumanlar 1= 2 DG 0 AlCl 3 (t) + 3 DG 0 H2 — 2 DG 0 Al(t) — 6DG 0 HCl(G)
DG 0 tumanlar 1= 2 (-636,8) + 3 0 — yigirma — 6(-95,27) = -701,98 kJ/mol
Reaksiyada 2 mol Al(t) qatnashadi DGtumanlar 1 1 mol Al(t) ga teng
DG 0 tuman 1 \u003d -701,98 / 2 \u003d -350,99 kJ / mol
Hisoblash ∆G0 gazsimon vodorod xloridning (1 mol uchun) qalay bilan o'zaro ta'siri reaktsiyasi uchun:
Sn (t) + 2HCl (g) \u003d SnCl 2 (t) + H 2
DG 0 tumanlar 2 =DG 0 SnCl 2 (t) + DG 0 H2 — DG 0 Sn(t) — 2DG 0 HCl(G)
DG 0 tuman 2 \u003d -288,4 + 0- 0- 2 (-95,27) \u003d -97,86 kJ / mol
Ikkala reaktsiya ham bor DG 0 <0 , shuning uchun ular o'z-o'zidan oldinga yo'nalishda harakat qiladilar, ammo gazsimon vodorod xlorid alyuminiy bilan yanada intensiv o'zaro ta'sir qiladi, chunki
DG 0 tuman 1˂ DG 0 tuman 2
Muammo 10. Hisob-kitoblarga murojaat qilmasdan, qaysi belgilarni aniqlang (>0,<0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 HBr (g) + O 2 (g) ↔ 2 H 2 O (g) + 2 Br 2 (g)
Haroratning oshishi kimyoviy reaktsiyaning yo'nalishiga qanday ta'sir qiladi?
Doimiy harorat va bosim ostida Gibbs energiyasining o'zgarishi entalpiya va entropiya bilan quyidagi ifoda bilan bog'liq:
DG = Δ H – TDS
tizimning buzilishining o'lchovidir. Entropiya qiymati qanchalik katta bo'lsa, tizimdagi tartibsizlik shunchalik katta bo'ladi (gazsimon moddalar shunchalik ko'p). Bu reaksiyada gazlarning o'ng tomonidagi mollar soni 5 taga, chap tomonida esa 4 taga teng, ya'ni sistemaning entropiyasi kamayadi. ∆S˂0.
Muammoning shartiga ko'ra, reaktsiya oldinga yo'nalishda davom etadi, shuning uchun DG˂0.
Oddiy sharoitlarda TDS ˂˂ DH, shuning uchun bu holatda ∆H˂0 ekzotermik reaksiya hisoblanadi.
Harorat ko'tarilganda qadriyatlarga ega bo'ladigan vaqt kelishi mumkin TDS va Δ H bir xil bo'ladi, keyin tizim muvozanatga keladi DG=0. Agar harorat sezilarli darajada oshirilsa, u holda entropiya omili ustunlik qiladi TDS, keyin reaktsiya endi o'z-o'zidan davom etmaydi DG>0.
Kimyoviy termodinamikaning asosiy muammolaridan birini hal qilish uchun - o'z-o'zidan sodir bo'ladigan jarayonlarning fundamental imkoniyatini o'rnatish uchun - ob'ektiv miqdoriy mezonga ega bo'lish kerak. Yuqorida ko'rsatilgandek, turli jarayonlarda (shu jumladan kimyoviy) ta'sir qiluvchi kuchlar ikkita raqobatlashuvchi tendentsiya yoki ikkita qarama-qarshi omil:
1. Entalpiya yoki entalpiya, tizimning eng kam energiyaga ega bo'lgan holatga o'tish istagi tufayli, masalan, p = const da, entalpiyani (𝛥H) pasaytiring.< 0);
2. Tizimning maksimal darajadagi tartibsizlik holatiga o'tish istagi tufayli strukturaviy yoki entropiya, ya'ni. entropiyani oshirish (𝛥S>0).
Agar reaksiya jarayonida buzilish darajasi o'zgarmasa (𝛥S=0), u holda jarayonning yo'nalishi entalpiyaning o'zgarishi bilan aniqlanadi va jarayon o'z-o'zidan entalpiyaning kamayishi (𝛥H) yo'nalishi bo'yicha boradi.< 0).
Agar jarayon entalpiyani o'zgartirmasdan sodir bo'lsa (𝛥H=0), u holda entropiya reaksiya yo'nalishini belgilovchi omil bo'lib, jarayon o'z-o'zidan uning ortishi yo'nalishi bo'yicha ortadi (𝛥S > 0).
Agar entalpiya ham, entropiya ham bir vaqtning o'zida o'zgarsa, jarayonning o'z-o'zidan oqimining yo'nalishi jami bilan aniqlanadi. harakatlantiruvchi kuch reaktsiyalar. O'z-o'zidan reaktsiya jami bo'lgan yo'nalishda davom etadi harakatlantiruvchi kuch tizimlari kamayadi.
Ushbu ikki qarama-qarshi omilning bir vaqtda ta'sirini hisobga olsak, doimiy harorat va bosimda sodir bo'ladigan reaktsiyalar uchun bunday harakatlantiruvchi kuch (holat funktsiyasi) Gibbs energiyasi (G) bo'lib, uni izobarik-izotermik potensial yoki erkin energiya deb ham ataladi.
Kimyoviy jarayonlarning spontan oqimining yo'nalishini aniqlash mezoni sifatida (p = const bo'lganda, Gibbs energiyasining o'zgarishi 𝛥G yoki
𝛥G=G 2 - G 1 (1.27)
Uning o'zgarishi belgisiga qarab, uchta holat mumkin.
1. 𝛥G< 0, реакция термодинамически возможна.
Doimiy harorat va bosimda kimyoviy reaksiyalar faqat tizimdagi Gibbs energiyasini kamaytirish yo'nalishida o'z-o'zidan boradi (𝛥G)< 0).
Ushbu qoida termodinamikaning ikkinchi qonunining asosini tashkil etuvchi minimal energiya printsipi bilan bog'liq bo'lib, uning formulalaridan biri quyidagicha:
"Issiqlik kamroq isitiladigan jismdan ko'proq isitiladigan jismga mustaqil ravishda o'tishi mumkin emas, faqat teskari jarayon o'z-o'zidan mumkin."
2. 𝛥G > 0, reaksiya termodinamik jihatdan mumkin emas;
3. 𝛥G = 0, ham toʻgʻridan-toʻgʻri, ham teskari reaksiyalar termodinamik jihatdan mumkin.
Gibbs energiyasida o'zgarishning yo'qligi reaktsiya tizimida kimyoviy muvozanatni o'rnatish uchun termodinamik shartdir.
Gibbs energiyasi entalpiya, entropiya va harorat bilan quyidagicha bog'liq:
Keyin Gibbs energiyasining o'zgarishi (𝛥G) quyidagicha yoziladi:
𝛥G = 𝛥N – T𝛥S (1,28)
1.28 tenglamadan kelib chiqadiki, o'z-o'zidan sodir bo'ladigan kimyoviy reaktsiyalar ehtimoli 𝛥N va T𝛥S qiymatlarining nisbatiga bog'liq. Bunday holda, to'rtta asosiy holat mumkin:
1. Agar 𝛥N< 0, а 𝛥S >0 bo'lsa, Gibbs energiyasi har doim salbiy bo'ladi (𝛥G< 0). Такие реакции термодинамически возможны при любой температуре.
2. Agar 𝛥N > 0 va 𝛥S bo‘lsa< 0, то всегда 𝛥G >0. Bunday reaksiyalar har qanday haroratda termodinamik jihatdan mumkin emas.
3. Agar 𝛥N > 0 va 𝛥S > 0 bo‘lsa, reaksiya faqat yuqori haroratda sodir bo‘ladi, qachonki | 𝛥N |< | Т𝛥S |.
4. Agar 𝛥N<0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | >| T𝛥S |.
Har xil termodinamik hisob-kitoblarni amalga oshirish uchun, shuningdek, boshqa termodinamik funktsiyalar uchun maxsus tushuncha kiritiladi: moddaning hosil bo'lishining standart Gibbs energiyasi (𝛥G° namunasi 298). Bu barcha ishtirok etuvchi moddalar standart holatda bo'lganda va reaksiya standart sharoitda (odatda kJ bilan o'lchanadi) sodir bo'lganda, mos keladigan oddiy moddalardan bir mol birikma hosil bo'lish reaksiyasida Gibbs energiyasining o'zgarishi. / mol). Bunda:
Oddiy moddalarni hosil qilishning standart Gibbs energiyasi shartli ravishda nolga teng qabul qilinadi.
Ma'lumotnomalar odatda moddaning hosil bo'lish energiyalarining standart Gibbs qiymatlarini 298 K da beradi. spontan reaktsiyaning mumkin emasligi.
Gibbs energiyasi tizim holatining funktsiyasidir. Shuning uchun uning ma'lum bir kimyoviy reaktsiya jarayonida o'zgarishi faqat boshlang'ich moddalar va reaktsiya mahsulotlarining tabiati, fizik yoki agregat holatiga, ularning miqdoriga bog'liq va reaktsiyaning oraliq bosqichlariga yoki berilgan reaktsiya tizimiga bog'liq emas. yakuniy holatga yetdi, ya'ni.
Yig'ishda barcha ishtirok etuvchi moddalarning mol soni (v) albatta hisobga olinadi.
1-misol. Hisoblash  reaktsiya, hosil bo'lishning standart issiqliklariga asoslangan.
reaktsiya, hosil bo'lishning standart issiqliklariga asoslangan.






