Darajalardagi orbitallarning maksimal soni. Atomlar tuzilishi asoslari bo'limi uchun topshiriqlar
Ushbu bo'limda siz atomning tuzilishi mavzusidagi asosiy vazifalar turlarini topishingiz mumkin: vakillik elektron konfiguratsiya, kvant sonlarining ta'rifi va boshqalar.
Masala 1. Neytronning massasi 1,67*10 -27 kg, tezligi 4*10 2 m/s. De Broyl to'lqin uzunligini aniqlang.
Vazifa 2. Elektron formulalar tuzing va elektronlarning bo'ylab taqsimlanishini grafik tarzda ifodalang kvant hujayralari Belgilangan elementlar uchun. ning hosil bo'lishi bilan atomlarning qo'zg'alishi paytida juft elektronlarning ajralish imkoniyatlarini tahlil qiling. valent elektronlar spin-valentlik nazariyasiga muvofiq. Uglerod, xlor.
Vazifa 3. Elektron formulalar tuzing va ko'rsatilgan elementlar uchun kvant hujayralardagi elektronlarning taqsimlanishini grafik tarzda tasvirlang. Spin-valentlik nazariyasiga muvofiq valentlik elektronlarini hosil qilish bilan atomlarni qo'zg'atish jarayonida juft elektronlarning ajralish imkoniyatlarini tahlil qiling.
xlor, berilliy argon
Vazifa 4. Nima kvant soni atomning ma'lum pastki sathidagi orbitallar sonini aniqlaydi? s-, p- ustidagi orbitallar soni qancha, d- vaf- pastki darajalar?
11 va 25.
Yechim:
Yechim: Bosh kvant soni n orbitalning energiyasi va hajmini tavsiflaydi va faqat 1 dan ∞ gacha bo'lgan butun sonlarning qiymatlarini oladi.
Yon kvant soni (orbital) l orbitalning geometrik shaklini tavsiflaydi va har bir energiya darajasi uchun 0 dan (n-1) gacha bo'lgan butun sonlar qiymatlarini oladi.
Ko'p elektronli atomlarda elektron energiyasi ham qiymatga bog'liq l. Shuning uchun elektronning holati turli qiymatlar bilan tavsiflanadi l energiya quyi darajalari deyiladi:
l=0, s-orbitallar sharsimon
l=1, p-orbitallar gantel shaklida
l=2, d-orbitallar murakkabroq shaklga ega
l=3, f-orbitallar murakkabroq shaklga ega
Magnit kvant soni m l orbitalning kosmosdagi yo'nalishini tavsiflaydi va -dan qiymat oladi. l … 0 … +l .
s-kichik daraja l=0, m l = 0 qiymat bilan tavsiflanadi
p-pastki daraja l=1, m l = -1 qiymat bilan tavsiflanadi; 0; +1 (3 orbital)
d-pastki daraja l=2, m l = -2 qiymat bilan tavsiflanadi; - bitta; 0; +1; +2 (5 orbital)
f-kichik daraja l=3, m l = -3 qiymat bilan tavsiflanadi; -2; - bitta; 0; +1; +2; +3 (7 orbital)
m l atomning berilgan energiya quyi darajasidagi orbitallar sonini aniqlaydi.
Spin kvant soni m s elektronning o'z o'qi atrofida aylanishini tavsiflaydi va + ½ va - ½ qiymatlarini oladi.
4-darajada atomning tashqi qatlami uchun 4s, 4p, 4d energiya holatlari mumkin.
Keling, ular uchun kvant raqamlari to'plamini yozamiz:
4s: n =4, l = 0, m l = (2l+1)=1 (1 orbital), m s = ±½
4p: n =4, l = 1, m l = (2l+1)=3 (3 orbital -1,0,+1), m s = ±3½
4d: n =4, l = 2, m l = (2l+1)=5 (5 orbital -2,-1,0,+1,+2), m s = ±5½
Xonim elektronlarning maksimal soni uchun ko'rsatilgan.
ga muvofiq p-kichik darajadagi elektronlarning maksimal soni 6 ga teng.
Bu sohada P2 maksimal.
Guruch. 2.3. Elektronning vodorod atomida bo'lish ehtimolini taqsimlash.
O'zgaruvchanligini aytish mumkin elektronning o'zi emas, balki uni topish ehtimoli atomning istalgan joyida.
Shunday qilib, elektronning to'lqin tabiati tufayli atom
aniq geometrik o'lchamlarga va o'zgarmas shaklga ega emas.
Atomdagi elektron to'lqin ob'ektidir. Biroq, elektronning atom tomonidan yo'qolishi (atomning ionlanishi) har doim bitta shaklda sodir bo'ladi
parchalanuvchi elektron zarracha sifatida.
2.7. Atomlarning elektron qavatlarining tuzilishi. kvant raqamlari
Shredinger tenglamasini integrallash orqali r=f(x,y,z) to‘lqin funksiyasi topiladi. r ni aniqlagandan so'ng, r 2 dV qiymatini taxmin qilish mumkin - ehtimollik
atom yadrosini o'rab turgan dV fazo hajmida elektronni topish ehtimoli.
Shredinger tenglamasini yechish natijasi atomdagi elektronning harakatini tavsiflovchi uchta kvant sonidir.
2.7.1. Bosh kvant soni (n)
Bosh kvant soni xarakterlaydi (birinchi taxminda) elektronning umumiy energiyasi yoki uning energiya darajasi.
U belgilaydi o'lchamlari atom orbitali . Qanchalik "n" bo'lsa, shuncha ko'p kattaroq o'lcham atom orbitali, ya'ni elektron yadrodan uzoqroq, shuning uchun uning energiyasi yuqoriroq.
n=1 uchun Shredinger tenglamasining bitta yechimi mumkin.
n=2 bo‘lsa, to‘rtta, n=3 bo‘lsa, Shredinger tenglamasining to‘qqizta yechimi va hokazo. Umuman olganda, "n" ning har bir qiymati uchun "n2" echimlar mavjud.
Bu yechimlar orbital to'lqin funksiyalari yoki elektronning orbitallaridir.
"Orbital" tushunchasini Bor nazariyasida qo'llaniladigan "orbita" tushunchasi bilan birlashtirmaslik kerak. Bor nazariyasidagi orbita deganda elektronning yadro atrofidagi traektoriyasi (yoʻli) tushuniladi.
Orbitallarni yadro atrofidagi elektronlar kirishi mumkin bo'lgan ba'zi joylar deb hisoblash mumkin. (lekin har doim ham ularni to'ldirmaydi)
yut). Bu hayajonlangan holatda elektronlarni topish ehtimoli maksimal (~ 95%) bo'lgan nuqtalarning joylashuvidir.
Chunki elektron bor manfiy zaryad, uning orbitalini ba'zilari deb hisoblash mumkin zaryad taqsimoti. Bu tarqatish ham deyiladi elektron bulut.
"n" qiymati bir xil bo'lgan elektronlar to'plami energiya darajasi (yoki qobiq yoki elektron qatlam) deb ataladi.
yemoq ). Qo'zg'atmagan atomlarda "n" ning maksimal qiymati D.I. jadvalidagi ushbu element davrining soniga to'g'ri keladi. Mendeleev.
Energiya darajalari ba'zan katta harflar bilan ko'rsatilgan.
(Raqamlar eng ko'p ishlatiladi.)
2.7.2. Orbital kvant soni (l)
Orbital kvant soni elektron bulutning shaklini aniqlaydi (ammo bu faqat bitta elektronli vodorod atomi uchun aniq).
Ko'p elektronli atomlarda l energiyani ham xarakterlaydi. Bu atomlarda ma'lum energiya darajasidagi elektronlar turli energiyaga ega bo'lgan pastki darajalarga guruhlangan.
l ning har bir qiymati ma'lum energiyaga mos keladi
osmon pastki darajasi. Bir xil "n" va "l" ga ega bo'lgan elektronlar to'plami pastki daraja deb ataladi (yoki pastki qavat).
Orbital kvant soni 0 dan (n-1) gacha bo'lgan qiymatlarni oladi: 0,1,2,3,…….(n-1).
Ko'pincha "l" qiymati raqamlar o'rniga lotin alifbosining kichik harflari bilan ifodalanadi.
l = 0 1 2 3 ... | ||
belgilash s p d f .... |
||
(Qo'zg'atmagan atomlarda to'rtdan ortiq pastki darajalar to'ldirilmaydi, chunki l \u003d 0,1,2,3 qiymatlari hozirda ma'lum bo'lgan barcha elementlarning elektronlarini tavsiflaydi).
2.1-jadval |
|||
Bosh va orbital kvant sonlari o'rtasidagi bog'liqlik |
|||
Kvant soni (n) | Orbital qiymat |
||
kvant soni | |||
la(l) | |||
0,1,2(s-, p-, d-) | |||
0,1,2,3 (s-, p-, d-, f-) | |||
l = 0 bo'lgan orbitallar, | |||||||
to'pning shakli (shar) | chaqirdi | ||||||
orbitallar (shartli ravishda tasvirlangan | |||||||
doiralar). | |||||||
l = 0 bo'lgan elektronlar s-elektronlar deyiladi. |
|||||||
2.1-jadvaldan ko'rinib turibdiki, s-orbital |
|||||||
barcha energiya darajalarida. Birinchisida |
|||||||
energiya darajasi faqat s bor - |
|||||||
orbitallar. | |||||||
l =1 bo'lgan orbitallar |
|||||||
dumbbell shakli (sakkizinchi jild) va on- |
|||||||
p-orbitallar deyiladi (elektronlar -p- |
|||||||
elektronlar). p-orbitallar hammasida joylashgan |
|||||||
birinchi darajalardan boshqa darajalar. | |||||||
l =2 bo'lgan orbitallarga ega | murakkabroq |
||||||
shakli (hajmli "yonca bargi") va ustiga- |
|||||||
d-orbitallar deyiladi. | |||||||
d-orbitallar birinchisidan tashqari barcha darajalarda |
|||||||
birinchi (n=1) va ikkinchi (n=2). | |||||||
l =3 bo'lgan orbitallar (f-orbitallar) |
|||||||
d-orbitallarga qaraganda ancha murakkab. Ular, |
|||||||
to'rtinchi darajadan boshlanadi. | |||||||
Orbital energiya | (pastki darajalar), | ||||||
bir xil energiya darajasida bo'lganlar bir xil emas va ketma-ketlikda ortadi:
Es Quyi darajalarni energiya bo'yicha taqsimlash grafikda ko'rsatilgan Energiya pastki darajasi quyidagicha belgilanadi: asosiy kvant raqam arab raqamlari bilan yoziladi; orbital - mos keladi karam sho'rva lotin harflarida. Pastki darajalar Guruch. 2.4. Energiya darajalarini kichik darajalarga bo'lish sxemasi. Masalan: 4d - to'rtinchi energiya darajasining d-pastki darajasi (n=4,l=2). Har bir daraja uchun l qiymatlari soni asosiy kvant sonining qiymatlari soniga teng (2.1-jadvalga qarang), shuning uchun darajadagi pastki darajalar soni ham asosiy kvant soni "n" ga teng. 2.7.3. Magnit kvant soni (ml) Magnit kvant soni kosmosdagi elektron bulutining magnit maydonga nisbatan yo'nalishini tavsiflaydi. U elektron bulutning o'qlar bo'ylab cho'zilishini aniqlaydi, ya'ni. uning magnit maydon yo'nalishiga to'g'ri keladigan eksa bo'ylab fazoda siljishi. "ml" -l dan +l gacha bo'lgan har qanday musbat va manfiy butun qiymatlarni, shu jumladan nolni qabul qilishi mumkin. "ml" qiymatlari soni ma'lum bir pastki darajadagi orbitallar sonini aniqlaydi. Masalan: s-pastki daraja: l =0 → ml = 0 → 1 orbital p-pastki daraja: l =1 → ml = –1, 0, +1 → 3 orbital d-pastki daraja: l =2 → ml = –2, – 1, 0, +1, +2 → 5 orbital f-pastki daraja: l =3 → ml = –3, –2, –1, 0, +1, +2, +3 → 7 orbital. Umuman olganda, pastki darajadagi orbitallar soni ml =2l +1 (2.10) ga teng. Grafik jihatdan har qanday orbital hujayra sifatida tasvirlangan (kvant hujayra) □ va undagi elektron o'q shaklida bo'ladi. s-sublayer: p-pastki qatlam: d-sublayer: f-sublayer: Energiya darajasidagi orbitallarning umumiy soni: Shunday qilib, har bir orbital va bu orbitalda joylashgan elektron uchta kvant soni bilan tavsiflanadi - asosiy (n), orbital (l) va magnit (m l). 2.2-jadval Energiya sathidagi orbitallar soni tayinlash ml qiymati puflamoq- orbitallar 2, -1, 0, +1, +2 2, -1, 0, +1, +2 3,-2,-1,0,+1,+2,+3 Elektron yana bitta xususiyatga ega - spin kvant soni. 2.7.4. Spin kvant soni (ms) "m s" elektronning ichki harakatini xarakterlaydi - spin. U o'z o'qi atrofida harakati tufayli elektronning magnit momenti bilan bog'liq. Oddiy qilib aytganda, "ms" o'z o'qi atrofida elektronning aylanish yo'nalishini ifodalaydi. Bu kvant soni faqat ikkita qiymatni oladi: 1 2 va −1 2 Agar elektronning yadro atrofida va uning o'qi atrofida aylanish yo'nalishlari bir xil bo'lsa (masalan, soat yo'nalishi bo'yicha), u holda "ms" +1/2 qiymatini oladi, agar ular mos kelmasa, -1/2. N, l va ml qiymatlari bir xil bo'lgan, lekin qarama-qarshi yo'naltirilgan spinli (antiparallel) ikkita elektron juftlashgan yoki bo'linmagan elektronlar juftligi deb ataladi. To'yinmagan spinli elektronlar juftlashtirilmagan (yoki "bo'sh") deyiladi. Elektronlari bo'lmagan orbital bo'sh orbital deyiladi. 2.8. Ko'p elektronli atomlarning tuzilishi Atomdagi elektronlarning (yoki elementning elektron konfiguratsiyasi) darajalar, pastki sathlar va orbitallar bo'yicha taqsimlanishi haqidagi yozuv atomning asosiy (qo'zg'atilmagan) holati uchun berilgan. Agar bir yoki bir nechta atom qo'zg'aluvchan holatda bo'lsa, elektron konfiguratsiya atomning qo'zg'aluvchan holatini ham tavsiflaydi. Elektron konfiguratsiyani yozishda asosiy kvant soni (n) raqamlar bilan ko'rsatilgan, pastki darajalar (s, p, d, f) harflar bilan ko'rsatilgan va harflar darajasi - berilgan pastki darajadagi elektronlar soni. Masalan, 4d3 - to'rtinchi energiya darajasining d-pastki sathida 3 ta elektron mavjud. Vodorod - 1s1 Litiy - 1s2 2s1 Magniy - 1s2 2s2 2p6 3s2 va boshqalar. Atomlardagi orbitallardagi elektronlarning taqsimlanishi uchta asosiy qoida bilan belgilanadi: Pauli printsipi; -
eng kam energiya printsipi; Gund qoidasi. 2.8.1. Pauli printsipi (1925) Elementlar spektrlari va ularning davriy sistemadagi o'rnini tahlil qilish asosida Pauli eng muhim printsipni oldi: Atomda barcha to'rtta kvant sonining qiymatlari bir xil bo'lgan ikkita elektron bo'lishi mumkin emas, ya'ni. atomdagi har qanday ikkita elektron kamida bitta kvant soni bilan farq qilishi kerak. Yoki: orbitalda ikkitadan ko'p bo'lmagan elektronlar bo'lishi mumkin, ular qarama-qarshi spinlarga ega bo'lishi kerak. Pauli printsipining oqibatlari: 1. Yuqorida aytib o'tilganidek, bir darajadagi orbitallar soni asosiy kvant sonining kvadratiga teng, ya'ni: Norb \u003d n2 va orbitalda ikkitadan ortiq elektron bo'lishi mumkin emasligi sababli: Bir darajadagi elektronlarning maksimal soni asosiy kvant sonining kvadratidan ikki baravar ko'pdir. n=1: (Nel =2 12 =2 elektron) n=2: (Nel =2 22 = 8 elektron) n=3: (Nel =2 32 = 18 elektron) n=4: (Nel =2 42 \u003d 32 elektron) 2. Shuningdek, yuqorida qayd etilgan ediki, berilgan quyi darajadagi orbitallar soni ushbu pastki sath uchun magnit kvant sonining qiymatlari soniga teng (ml = 2l + 1) va ikkitadan ko'p bo'lmasligi mumkin. orbitalga elektronlar, keyin: Pastki darajadagi elektronlarning maksimal soni ushbu pastki daraja uchun magnit kvant sonining ikki barobariga teng: s-kichik darajadagi: Nel = 2 (2 0 + 1) = 2 elektron (s-elektron); p-kichik darajadagi: Nel =2·(2·1+1) =6 elektron (p-elektron); d-pastki sathida: Nel = 2 (2 2 + 1) = 10 elektron (d-elektron); f-kichik darajadagi: Nel = 2 (2 3 + 1) = 14 elektron (f-elektron). 2.8.2. Eng kam energiya printsipi Yuqorida ta'kidlanganidek, atomdagi elektronning eng barqaror holati uning energiyasining minimal qiymatiga to'g'ri keladi va yadroga eng yaqin orbitadagi elektron minimal energiyaga ega. Har qanday boshqa holat qo'zg'aluvchan, beqaror - undan elektron o'z-o'zidan kamroq energiyaga ega bo'lgan holatga o'tadi. Atomdagi elektronlarni joylashtirish ketma-ketligi ularning yadro bilan eng katta aloqasiga mos kelishi kerak, ya'ni. elektron eng kam energiyaga ega bo'lishi kerak. Shuning uchun, elektron eng past energiyaga ega bo'lgan tagida joylashgan bo'sh joylar mavjud ekan, elektron yuqori energiya pastki darajasini egallamaydi. to'g'ri emas to'g'ri Klechkovskiy qoidalari: 1. Elektron energiyasi asosan asosiy va orbital kvant sonlarining qiymatlari bilan aniqlanganligi sababli, birinchi navbatda n + l yig'indisi kichik bo'lgan pastki daraja to'ldiriladi. Masalan, ikkita 3d va 4s pastki sathlaridan 4s pastki sathlari birinchi navbatda elektronlar bilan to'ldiriladi: 3d: (n+l =3+2=5)4s→3d 4s: (n+l =4+0=4) 2. Agar turli pastki darajalar uchun n + l yig'indilari bir xil bo'lsa, u holda birinchi navbatda kichikroq "n" bilan pastki daraja to'ldiriladi. , chunki "n" da elektronning energiyasiga qo'shgan hissasi " dan kattaroqdir. l ". Masalan, 5s, 4p va 3d pastki darajalarida n+ summalari l bir xil: 5s: (5+0=5), 4p: (4+1=5), 3d: (3+2=5). Keyingisi- Shunday qilib, to'ldirish sxema bo'yicha ketadi: 3d→4p→5s. 2.8.3. Gund qoidasi Berilgan pastki darajadagi orbitallar birinchi navbatda bitta elektron bilan to'ldiriladi , ya'ni. har bir elektron juftlashtirilmagan elektron shaklida alohida hujayrada joylashgan. Bu naqsh elektronlar bir-birini kuchliroq itarishi bilan bog'liq, ular bir xil orbitalni egallaganlarida. Shuning uchun ular turli orbitallarni egallashga moyil bo'ladi, keyin itarilish kamroq bo'ladi (ya'ni, va kamroq energiya). Spinlarning bir xil yo'nalishi ham energiyaning pasayishiga yordam beradi; bu bir xil spinli elektronlar harakatlanayotganda bir-biridan qochishi va shuning uchun kamroq qaytarilishi bilan bog'liq. Bu izchillik deyiladi elektron korrelyatsiya. Boshqacha qilib aytganda, berilgan qiymat uchun l» atomdagi elektronlar shunday joylashtirilganki, ularning umumiy spin soni (Sm s ) maksimal edi. Masalan, p-kichik darajadagi uchta elektronning qaysi joylashuvi atomning barqaror holatiga mos kelishini ko'rib chiqing: Sms = − 1
Sms = Sms = − 1
Sms = − 1
− 1
Misol. Atomdagi elektronlarning holatini to'rtta kvant soni bilan tavsiflang: elektron Spektroskopik, kimyoviy va rentgen nurlari asosida tashkil etilgan Noskopik ma'lumotlar, orbitallarni elektronlar bilan to'ldirish tartibi quyidagicha: 1s2 | 2s2 2p6 | 3s2 3p6 | 4s2 3d10 4p6 | 5s2 4d10 5p6 | 6s2 5d1 4f14 5d2÷10 6p6 | 7s2 6d1 5f14 6d2÷10 …7p6 | Masalan, yuqoridagi formula bo'yicha biz to'ldirish sxemasini tuzamiz elektron orbitallar: Zirkoniya 40 Zr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 100 Fm:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14 5d9 6p6 7s2 6d1 5f11. Qaysi pastki daraja oxirgi elektronlar bilan to'ldirilganligiga qarab, ular farqlanadi: s-elementlar - ularning atomlarida tashqi darajadagi s-pastki darajasi elektronlar bilan to'ldirilgan oxirgi hisoblanadi (jadvallarda ular ko'pincha qizil rangga bo'yalgan); p-elementlar - ularning atomlarida tashqi darajadagi p-pastki darajasi (to'q sariq rang) elektronlar bilan to'ldirilgan oxirgi (1 dan 6 gacha); d-elementlar - ularning atomlarida oldingi tashqi darajadagi d-pastki darajasi oxirgi marta elektronlar bilan to'ldiriladi (1 dan 10 gacha), tashqi darajada esa ularning ko'pchiligi ikkita elektronga (s2) ega. Keyinchalik, nozik spektral tadqiqotlar asosida, barcha 32 d-elementning tashqi sathida (ns) ikkita elektronga ega emasligi aniqlandi. 9 ta element uchun: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au - har biri bittadan (ns1 ), palladiyda (Pd) esa ikkala elektron (5s0) yo'q. Bu elektronlarning tashqi s-pastki sathidan oldingi tashqi d-pastki darajaga (bir elektron toʻqqizta elementga, ikkitasi palladiyga "tushadi") "yurishi" (yoki "qobiliyatsizligi") bilan bogʻliq. "Breakthrough" yoki "muvaffaqiyatsizlik" ekzotermik ta'sir bilan tavsiflanadi va yanada barqaror konfiguratsiyaga olib keladi (d-elementlar - ko'k). f-elementlar - ularning atomlarida uchinchi darajadagi f-pastki darajasi tashqi tomondan (odatda qora) elektronlar bilan to'ldirilgan oxirgi hisoblanadi. 3-BOB. D.I.MENDELEEV DAVRIY TIZIMI orbital shakli Magnit kvant sonim l elektronning magnit momentini xarakterlaydi. Kosmosdagi kvant pastki sathining yo'nalishini aniqlaydi. Pastki sathning magnit maydon chiziqlari yo'nalishi bo'yicha proyeksiyalari soni kvantlangan va u ma'lum bir pastki sathdagi orbitallar soniga teng. Aytish mumkinki, magnit kvant soni pastki darajadagi orbitallar sonini aniqlaydi. m l -l dan nolga +l gacha bo'lgan qiymatlarni oladi. m l = –l,…,+1, 0, –1,…, +l. s pastki darajasini ko'rib chiqing. Uning uchun: l=0, m l =0 Da R ostki darajasi l=1, m l = –1, 0, +1 ga ega Bunday holda, kvantlash qoidalariga ko'ra, allaqachon uchta proektsiya mavjud. Demak, p-pastki sathida uchta p-orbital mavjud. 2.2-rasm. d-kichik daraja uchun: l=2, m l = –2, –1, 0, +1, +2. Bu shuni anglatadiki, kvant nazariyasiga ko'ra, d-kichik daraja beshta d-orbitaldan iborat. F pastki sathida l=3, m l = –3, –2, –1, 0, +1, +2, +3 mavjud. Shuning uchun f-kichik daraja ettita f-orbitaldan iborat. Pastki sathdagi orbitallar sonini m l =2l+1 ifodadan aniqlash mumkin: l qiymati: 0, 1, 2, 3, ……. pastki daraja: s, p, d, f, ……. orbitallar soni: 1, 3, 5, 7, ……. Spin kvant sonim s elektronning o'z o'qi atrofida "aylanishi" tufayli paydo bo'ladigan impulsning to'g'ri momentini tavsiflaydi. Ikkita qiymatni oladi: +1/2 va –1/2, bu elektron aylanishning ikkita mumkin bo'lgan yo'nalishiga mos keladi. m s = +1/2; -1/2. U Stern va Gerlax tajribalaridan olingan. Ko'rib chiqilgan kvant raqamlari elektronning energiyasini, uning doiraviy hajmda qolish ehtimoli bo'lgan fazoning hajmini va shaklini aniqlaydi, ya'ni. orbitalning kosmosdagi o'lchami, shakli va yo'nalishi. To'lqin funktsiyasi kvant sonlarining barcha mumkin bo'lgan qiymatlari uchun Shredinger tenglamasining yechimi bo'lganligi sababli, to'lqin funktsiyasi, o'z navbatida, ko'rib chiqilgan n, l va m l kvant parametrlarining funktsiyasi ekanligini aytishimiz mumkin, bu erda: n= 1, 2, 3, 4,…, l= 0, 1, 2, 3,…,n–1 m l =–l,…, –1, 0, +1,…, +l atom orbitallari. Yadrodan uzoq bo'shliqda elektronni topish ehtimoli juda kichik bo'lganligi sababli, ular orbitallar haqida gapirganda, ular atom yadrosi atrofida elektron zaryadning 90-95% i to'plangan shunday maydonni anglatadi. Kvant mexanikasi nuqtai nazaridan atom orbitallari (n, l, m l) toʻlqin funksiyasining geometrik koʻrinishidir. Z Y elektronning uch o'lchamli fazodagi o'rnini aniqladi va Ular o'sha joyda, so'ngra bunday ta'riflar to'plami orqali nuqta qo'yishadi X fazoviy bulut ko'rinishidagi rasmni oladi Chetlari xiralashgan nogo nuqtalar /2.3-rasm.) T Z s-orbital. U l=0 uchun mavjud. m l qiymati ham Y nol. Bizda faqat bitta qiymat bor m l =0. Binobarin, s-orbital maksimal simmetriyaga ega. Unda .. Bor X sharsimon shakl (2.4-rasm). Bunday holda, ehtimollik elektronning aylana yadro bo'shlig'idagi harakati quyidagicha aniqlanadi: 2.4-rasm. faqat radius vektoridir va koordinatalar burchagiga bog'liq emas. elektron maksimalga ega bo'lgan egri chiziqqa mos keladi (2.5-rasm). Maksimal tarqalish ehtimoli - da 0 r 1 r, A 0 radiusga mos keladigan yadrodan r 1 masofasi 2.5-rasm. birinchi Bor orbitasi. p-orbital. l=1 uchun mavjud. m l = -1, 0, +1. Z p-orbital ikkinchi va undan keyingi barchada paydo bo'ladi Y har bir darajada uchta p-orbital bo'lishi mumkin emas. p-orbital X koordinata yo'nalishi bo'yicha fazoda yotadi Px o'qlari. Ular mos ravishda p x, p y, p z -orbitallar deb ataladi Py (2.6-rasm). R dz 2 dx 2 y 2 dxy dxz dyz d-orbital. Uchinchi kvant darajasida l=2 da paydo bo'ladi. d-kichik darajadagi elektronlarning besh xil holati allaqachon mavjud bo'lishi mumkin, shuning uchun har bir kvant darajasining d-kichik darajasi beshta d-orbitalni o'z ichiga oladi. Bunda m l beshta qiymatni qabul qiladi: m l = -2, -1, 0, +1, +2, d-orbitallar p-orbitallarga qaraganda murakkabroq shaklga ega, ular to'rt gulbarg shaklida yoki to'rt gulbarg shaklida bo'ladi. halqali dumbbell shakli (2.7-rasm). f-orbital. l=3 bo'lganda paydo bo'ladi. f-orbitallar faqat to'rtinchi va undan uzoqroq darajalarda bo'lishi mumkin. l=3 m da l 7 ta /–3, –2, –1, 0, +1, +2, +3/ qiymatga ega bo‘lganligi sababli, f-kichik sathida yettita orbital bo‘lishi mumkin. F-orbitallarning shakli d-orbitallarnikidan ham murakkabroq. f-orbitallar murakkab olti lobli figuralar sifatida tasvirlangan. Kimyoviy bog'lanishlar hosil bo'lishida orbitallarning shakli va uning yo'nalishi katta rol o'ynaydi, chunki bu ikki omil birlashtiruvchi atomlarning elektron bulutlarining bir-birining ustiga chiqish xususiyati va darajasini belgilaydi. 2.1.5. Atomlarning elektron qavatlarining tuzilishi. Atomlarning to'liq elektron-energiya tuzilishi ko'rib chiqilgan kvant sonlari to'plami bilan oldindan belgilanadi. Asosiy kvant soni n nafaqat kvant darajasining sonini aniqlaydi, balki ushbu darajadagi kichik darajalar sonini ham ko'rsatadi. Misol uchun, n=3 bo'lganda, bizda uchinchi kvant darajasi mavjud bo'lib, u uchta pastki sathdan iborat: s-, p-, d-kichik daraja. Kvant sathi yadrodan qanchalik uzoqda bo'lsa, u qanchalik sig'imli bo'lsa, u shunchalik ko'p pastki darajalardan iborat. Bir darajadagi orbitallar sonini k n =n 2 formulasi, quyi sathdagi orbitallar sonini esa yuqorida aytib o'tilganidek, k l =2l+1 formulasi bilan aniqlash mumkin. Keling, kvant darajalari va pastki darajalarni o'zaro tartibga solishning nazariy sxemasini ko'rib chiqaylik. /Birinchi to'rt daraja uchun fragment/. To'rtta vertikal chiziqda biz n, l, m l va m s kvant sonlarining qiymatlarini chizamiz. 2.8-rasm). Biz allaqachon bilamizki, n ning raqamli qiymati qanchalik katta bo'lsa, kvant darajasi shunchalik katta bo'ladi. Shuning uchun, rasmda u balandlikda uzunroq qilingan. Kvant soni l bilan bog'liq ikkinchi vertikal chiziq kvant darajalarining pastki darajalarga bo'linishini ko'rsatadi. Birinchi kvant darajasi faqat bitta pastki sathdan iborat /s-kichik daraja sifatida belgilangan/. Ikkinchi kvant darajasi allaqachon ikkita pastki darajaga bo'lingan: s-pastki daraja va p-pastki daraja. Uchinchi daraja uchta pastki darajaga bo'linadi /s, p va d/, to'rtinchisi esa to'rtta pastki darajaga bo'linadi /s, p, d va f/. orbital elektronlarning kvant pastki darajalari orbitallarda yuqori daraja vena 2.8-rasm. Uchinchi vertikal chiziq m l kvant soniga to'g'ri keladi. Bu kvant pastki sathining orbitallarga bo'linishini ko'rsatadi. Har bir kichik darajadagi orbitallar soni magnit kvant soni oladigan qiymatlar sonidir. s-kichik daraja faqat bitta orbitaldan iborat, shuning uchun birinchi kvant darajasida faqat bitta orbital mavjud. p pastki darajasi uchta orbitaldan iborat. m l = -2, -1, 0, +1, +2 f-sublevel quvvatini etti orbitalgacha oshirdi f-pastki daraja m l = -3, -2, -1, 0, +1, +2 +3 To'rtinchi vertikal chiziq spin kvant soniga tayinlangan m s . Oldinga qarab, ushbu kvant soni orbitaldagi elektronlarning mumkin bo'lgan sonini oldindan belgilashini ta'kidlaymiz. Tegishli postulatga ko'ra, orbitalda ikkita elektron bo'lishi mumkin, ammo ular turli spinlarga ega bo'lishi kerak, ya'ni. m s ning turli qiymatlari: +1/2 va –1/2. Shu munosabat bilan, to'rtinchi vertikal chiziq kvant pastki darajasi va darajasining elektronlar bilan maksimal bandligini ko'rsatadi. s-kichik darajadagi - 2 elektron p-kichik darajadagi - 6 elektron d-kichik darajadagi - 10 elektron f-kichik darajadagi - 14 elektron Bir kichik darajadagi elektronlarning maksimal sonini quyidagi formula bilan aniqlash mumkin: Kvant darajalari va pastki darajalarni tartibga solishning nazariy ketma-ketligi quyidagicha ko'rinadi: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f6s6p6d6f7s7f… Biroq, kvant darajalari pastki darajalarga bo'linganda, berilgan nazariy ketma-ketlik buziladi. Pastki darajalarning haqiqiy joylashuvi aniqlanadi Klechkovskiy hukmronligi, unga ko'ra pastki darajalar ketma-ketligi ikkita n va l kvant sonlarining umumiy qiymati bilan belgilanadi. Ikki yoki undan ortiq pastki darajalar uchun n + l bir xil qiymatga ega bo'lsa, n qiymatidan kichikroq pastki daraja birinchi o'ringa chiqadi. 1s - 2s - 2p - 3s - 3p - 3d - 4s - 4p - 4d - 4f - 5s -5p - 5d - 5f (n+l) 1 2 3 3 4 5 4 5 6 7 5 6 7 8 Klechkovskiy qoidasiga ko'ra, pastki darajalarning haqiqiy ketma-ketligi quyidagicha: 1s2s2p3s3p4s3d4p5s4d5p6s5d4f5d 2–5 6p7s6d 1 5f 6d 2–5 7p. Atomlarning elektron qavatlarining tuzilishi quyidagi diagrammada ko'rsatilgan (2.9-rasm): 2.1.6. Elektronlarni atomda taqsimlashning asosiy tamoyillari. Atomning ko'rib chiqilgan elektron qobig'i uchta printsipga muvofiq elektronlar bilan to'ldiriladi: eng kam energiya printsipi, Pauli printsipi / qoidasi / Hund. eng kam printsipi atomdagi elektron minimal energiya qiymatiga ega bo'lgan erkin pastki sathni egallashini bildiradi. Boshqacha qilib aytganda, elektron yadro bilan eng kuchli bog'lanish ta'minlangan pastki darajada qoladi. Pastki sathlarni to'ldirish ketma-ketligi yuqorida keltirilgan atomning elektron qobig'i tuzilishidagi pastki darajalarning haqiqiy joylashuviga mos keladi: 1s2s2p3s3p4s3d –… va hokazo. /sm. yuqorida/. Pauli printsipi/Pauli taqiqi/ atomda to'rtta kvant sonining bir xil qiymatlari bo'lgan ikkita elektron ham bo'lishi mumkin emasligini aytadi. Natija. Orbital turli spinli ikkita elektronni o'z ichiga olishi mumkin (ya'ni, spin kvant sonining turli qiymatlari bilan: m s = +1/2 va m s = -1/2). Uchinchi tamoyil Hund printsipi yoki qoidasi/Hunda/. Bu elektronlarning kvant pastki darajasini to'ldirish tartibini tushuntiradi. Pastki sath ichida elektronlar shunday taqsimlanadiki, ularning umumiy kvant soni maksimal qiymatga ega bo'ladi /birorbitalda birinchi navbatda bitta elektron, keyin esa juftlash/. To'g'ri taqsimot, masalan, uchta p-elektron bo'ladi: Qaysi pastki daraja oxirgi elektronlar bilan to'ldirilganligiga qarab, s-, p-, d-, f-elementlar farqlanadi. s-elementlar atomlarida oxirgi elektronlar tashqi kvant sathining s-kichik darajasini egallagan elementlardir. /Masalan, natriy, magniy, kaliy, kaltsiy va boshqalar/. p-elementlar atomlarida oxirgi elektronlar tashqi kvant sathining p-kichik darajasini egallagan elementlardir. /Masalan, uglerod, kislorod, xlor va boshqalar/. Oxirgi elektronlar bilan to'ldirilgan d-pastki daraja elementlarni d-elementlar sifatida tasniflaydi. /Masalan, d-elementlar titan, xrom, temir, mis, chunki bu elementlarda oxirgi elektronlar oxirgidan oldingi darajadagi d-pastki darajasini egallaydi/. f-elementlar - atomlarida oxirgi elektronlar kvant sathidan tashqaridan ikkinchisining f-kichik darajasini egallagan elementlardir. /Masalan, prazeodimiy, evropiy, erbiy va boshqalar/. 2.1.7. Elektron formulalar va kvant hujayralari yordamida atomlarning elektron tuzilishi tasviri. Har qanday atomning elektron tuzilishi elektron formulalar bilan ifodalanadi. Elektron formulalarda kvant elektron sathi n asosiy kvant sonining raqamli qiymati bilan, pastki sath tegishli pastki sathning harf belgisi bilan yoziladi va pastki sathdagi elektronlar soni pastki daraja darajasi bilan belgilanadi. belgilash. Masalan, 3d 5 3-kvant darajasining d-kichik darajasida beshta elektron borligini bildiradi. Har qanday elementning elektron formulasi misolda ko'rsatilganidek, bunday bo'laklarning to'liq to'plamidan iborat. Shunday qilib, titan atomining elektron formulasi /№22/: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 . Barcha quvvatlarning yig'indisi 22 ga teng, ya'ni yadro zaryadi +22 bo'lgan titan atomi elektron qobig'ida 22 ta elektronni o'z ichiga oladi, ular umumiy manfiy zaryad (-22) bilan musbat zaryadni qoplaydi. atom yadrosi, atomni murakkab elektr neytral tizimga aylantiradi. D.I.Mendeleyev elementlar davriy sistemasi tuzilishini ko‘rib chiqib, elektron formulalar tuzish qulayroqdir. Oldinga qarab va o'rta maktabda olingan bilimlarga asoslanib, biz elementlarning davriy tizimini elektron formulalar shaklida taqdim etamiz. (2.10-rasm.) Biz davriy tizimdagi muayyan elementning elektron formulalarini yozishga keyinroq qaytamiz va har qanday elementning elektron formulasini yozishni o'rganish oson bo'lgan algoritmni ko'rib chiqamiz. Ikkinchidan, atomning elektron qobig'ining tuzilishi kvant hujayralari yordamida tasvirlangan. IV 4s 2 3d 10 4p 6 V 5s 2 4d 10 5p 6 VI 6s 2 5d 1 4f 14 5d 9 6p 6 VII 7s 2 6d 1 5f 14 6d 9 7p 6 Biz allaqachon kvant hujayralaridan foydalanganmiz, garchi biz "kvant hujayra" tushunchasini kiritmagan bo'lsak ham. Kvant hujayra orbitalning grafik tasviridan boshqa narsa emas. U hujayra tomonidan ko'rsatilgan va orbitaldagi elektronlar hujayrada turgan o'q bilan tasvirlangan. s-kichik daraja uchun bitta hujayra tayinlangan, chunki s-kichik daraja faqat bitta orbitalga ega. P-pastki daraja uchun uchta hujayra ajratilgan, chunki p-pastki sathda uchta p-orbital mavjud. d-pastki daraja beshta katakcha, f-pastki daraja esa yetti katak bilan ifodalanadi. Biz allaqachon kvant xujayralari yordamida tasvirlangan elektron formulani yozgan titan atomining elektron tuzilishi quyidagicha ko'rinadi: 2.1.8. Har bir kimyoviy elementning individualligi haqida. Kimyoviy elementning "identifikatsiya kartasi" ni uning elektron formulasi deb atash mumkin. Unga qarab, kimyogar bu "kimyoviy belgi" ning o'ziga xosligi haqida ko'p gapiradi. Biz allaqachon bilamizki, elementning universal xarakteristikasi atom yadrosining musbat zaryadidir va agar siz chuqurroq qarasangiz, musbat zaryadlangan elementar zarrachalar - protonlar soni. Ularning sonining ko'payishi xususiyatlarning keskin o'zgarishiga olib keladi. Tabiatning umumbashariy qonuni - miqdorning sifatga o'tish qonuni amal qila boshlaydi. Biroq, element sifatining o'zgarishiga faqat protonlar soni emas, balki yadrodagi neytronlar soni ham ta'sir qiladi. Yuqorida aytib o'tilganidek, yadroda protonlar soni bir xil, ammo neytronlari soni boshqacha bo'lgan elementlarga izotoplar deyiladi. Har bir elementning o'z izotoplari soni bor: birida ko'proq, ikkinchisida kamroq. Jadvalda D.I. Mendeleev elementning atom massasini kasr son sifatida ko'rsatadi, bu yadroda elementar zarrachalarning kasr soni borligini anglatmaydi, bu holda ushbu elementning barcha izotoplarining o'rtacha atom massasi hisobga olinadi. ularning tabiatdagi miqdoriy mazmuni. Ammo agar aniq tajribalarda biz bunday "o'rtacha" atom massasidan foydalansak, bu mutlaqo to'g'ri bo'lmaydi, chunki "o'rtacha" dan keyin bu izotop o'zining individualligini yo'qotadi, ayniqsa izotop radioaktiv bo'lsa. Amalda, ular atom massasini emas, balki "A" massa raqamini ishlatganda haqiqiy qiymatdan ko'proq chetga chiqadilar, ya'ni. atom massasiga eng yaqin butun son. Ehtimol, elementning individual xususiyatlarini hisobga olgan holda, agar biz radioaktiv haqida gapiradigan bo'lsak, izotopning atom massasini foizda tabiatda kattaroq yoki eng barqaror / yoki beqaror / bo'lganini olish yaxshiroqdir. elementlar. Ko'rib turganingizdek, kimyoviy elementlar uchun miqdorning sifatga o'tish qonuni ikki yo'nalishda amalga oshiriladi: proton va neytron. Protonga ko'ra: yadroda keyingi protonning paydo bo'lishi keskin ravishda yangi elementga olib keladi va neytronga ko'ra: bu elementning sifatini radioaktivlik paydo bo'lishigacha kengaytiradi. Buni vodorod misolida ko'rish mumkin. Agar vodorod yadrosiga proton qo'shilsa, bu element sifatida vodorodning barcha xususiyatlarini inkor etadi /berilgan individual/ va uni yangi elementga - geliyga /ya'ni. yangi shaxsga aylanadi. Neytron qo‘shilishi vodorod elementining o‘zini inkor etmaydi, balki uning sifat chegaralarini kengaytirib, vodorod izotopi 2 1 H / deyteriy 2 1 D / deb ataladi, keyin esa 3 1 H / tritiy 3 1 T / izotopini hosil qiladi. . Neytronlar sonining ko'payishi bilan element qo'shimcha xususiyatlarga ega bo'ladi, bu holda radioaktivlik. Radioaktiv xususiyatlarning alohida izotoplar tomonidan namoyon bo'lishi bunday elementlarga alohida individuallik beradi, agar elementlarni ekologik nuqtai nazardan ko'rib chiqsak, xavfli individuallik deyish mumkin. DA Shunga o'xshash tezislar: Vant-Xoff qoidasi. Arrenius tenglamasi va uning qo'llanilishi. Reaksiyalanuvchi molekulalarning faol to'qnashuvi nazariyasi. O'tish holati nazariyasi asoslari. Geterogen reaksiyalarning kinetikasi. Geterogen jarayonlarning xususiyatlari. Gomogen va geterogen kataliz. Massalar ta'siri qonunining yuzalardagi reaktsiyalar uchun qo'llanilishi. Grafik nazariyasi usullari asosida chiziqli mexanizmlar uchun kinetik tenglamalarni chiqarish algoritmlari. Grafiklar nazariyasining kimyoviy kinetikada qo'llanilishi. Yo'naltirilgan yoylar ketma-ketligi. Kimyoviy reaksiyaning issiqlik effekti yoki kimyoviy reaksiya natijasida tizim entalpiyasining o'zgarishi. Kimyoviy muvozanatga tashqi sharoitlarning ta'siri. Bosim, konsentratsiya va haroratning muvozanat holatiga ta'siri. Kimyoviy bog'lanish turlari. Kompleks reaksiyalar tushunchasi va turlari. Har xil tartibli teskari reaktsiyalar. Ikki parallel qaytarilmas birinchi tartibli reaksiyalarning eng oddiy holati. Ketma-ket reaksiyalarning mexanizmi va bosqichlari. Zanjirli va bog'langan reaksiyalarning xususiyatlari va tezligi. Kimyoviy kinetika masalalari, kimyoviy jarayonning bosqichlari. Ochiq va yopiq tizimlar, massa va energiyaning saqlanish qonuni. Gess qonuni va uning natijasi, reaksiyalar tezligi. Kataliz hodisasi, bir jinsli, geterogen, oksidlanish-qaytarilish reaksiyalari. Geterogen katalizda katalizator va reaksiyaga kirishuvchi moddalar turli fazalarda bo‘ladi, ko‘pincha katalizator qattiq moddadir, reaksiyaga kirishuvchi moddalar esa suyuq yoki gazsimon holatda bo‘ladi va reaksiya ikki faza orasidagi chegarada, ya’ni sirtda boradi. katalizator. Poeto... Kimyoviy kinetika tushunchasi va o'rganish predmeti. Kimyoviy reaksiya tezligi va unga ta'sir etuvchi omillar, o'lchash usullari va turli sanoat tarmoqlari uchun ahamiyati. Katalizatorlar va ingibitorlar, ularning kimyoviy reaksiyalarga ta'siridagi farqi, qo'llanilishi. Katalizatorlarning tasnifi ma'lum xususiyatlar yoki xususiyatlar to'plamiga asoslanadi. Elektron strukturaning o'ziga xos xususiyatlariga ko'ra moddalarning turiga, diskretlik darajasiga va harakatning kollektivligiga ko'ra tasniflash. Kimyoviy reaksiyalarda foydalanish. Nazariy qism. Kimyoning fizik va kimyoviy jarayonlar tezligi va mexanizmini o'rganadigan bo'limi kimyoviy kinetika deb ataladi. Kinetika jarayonlarning haqiqiy mexanizmlarini aniqlash imkonini beradi. Kimyoviy kinetikada bir jinsli va geterogen jarayonlar farqlanadi. Trautz bo'yicha trimolekulyar reaksiyalarning talqini. Yorug'lik reaktsiyasi tezligining yakuniy tenglamasi. Samarali faollashtirish energiyasi haqida tushuncha. Erkin valentliklarning kvazstatsionar konsentrasiyalari uchun formulalar. Tarmoqlanmagan zanjirli jarayonlarning o'ziga xos xususiyatlari. Kimyoviy reaksiyaning o'zgarmas haroratda reaksiyaga kirishuvchi moddalar konsentratsiyasiga bog'liqligi. Geterogen sistemalarda kimyoviy reaksiyalar tezligi. Bir jinsli sistemadagi kimyoviy muvozanatga dastlabki moddalar va reaksiya mahsulotlari konsentratsiyasining ta'siri. Kataliz, katalizator va katalitik jarayon tushunchalari, ularning turli ta'riflari. Katalizatorlar tomonidan reaksiyalarni tezlashtirish mexanizmlari. Kimyoviy (biologik bo'lmagan) kataliz. Sulfat kislota ishtirokida spirtdan dietil efir sintezi. Kataliz nazariyalari. Kimyoviy kinetika va uning kimyoviy jarayonlarni boshqarishdagi ahamiyati. Oqim muhitiga ko'ra reaksiyalarning tasnifi, ularning o'ziga xos xususiyatlari. Kimyoviy reaksiyalarning tezligi, uning atrof-muhit haroratiga va yorug'lik mavjudligiga bog'liqligi. Katalizatorlarning ishlash printsipi. Zanjirning tarmoqlanish jarayoni. Fotokimyoviy boshlanishi. Samarali faollashtirish energiyasi. Faol markazlar, ularning hosil bo'lish va so'nish usullari. qisman bosim. Zanjirni yoqish chegaralarini talqin qilish. Yadro portlashining amaliyoti va nazariyasi. Statsionar rejimda sirtdagi kimyoviy o'zgarish tezligi. Diffuziya va kinetik rejim. sirt adsorbsiyasi. Yuzaki heterojen katalitik jarayon. Tarmoqlangan zanjirli reaksiyaning cheklovchi rejimlari. Tarmoqlanish va sindirish. Katalizning ta'rifi va uning sanoatdagi o'rni. Selektivlik va “kimyoviy reaksiya mexanizmi” tushunchasi haqida umumiy tushunchalar. Fazalar va reaksiyalar turlari bo'yicha katalitik tizimlarning tasnifi. Sanoat katalizatorlariga adsorbsiya va asosiy talablar.



2 va 5 holatlar xarakterlanadi.Shuning uchun ular atomning barqaror holatiga mos keladi.
Kimyo asoslari
 Sferik pastki sathning faqat bitta proyeksiyasi bo'lishi mumkin. (2.1-rasm), "nol" qiymatiga ega. Shuning uchun s-kichik sathida faqat bitta s-orbital mavjud.
Sferik pastki sathning faqat bitta proyeksiyasi bo'lishi mumkin. (2.1-rasm), "nol" qiymatiga ega. Shuning uchun s-kichik sathida faqat bitta s-orbital mavjud. elektron bulut. Agar har daqiqada
elektron bulut. Agar har daqiqada qaysi zaryadli bulut elektron bulut deb ataladi. Uning zichligi 2 ga proporsional bo'lib, elektronni topish ehtimolining bevosita o'lchovidir. 90-95% elektron zaryadini o'z ichiga olgan bulutning chegara yuzasi orbital shaklini beradi.
qaysi zaryadli bulut elektron bulut deb ataladi. Uning zichligi 2 ga proporsional bo'lib, elektronni topish ehtimolining bevosita o'lchovidir. 90-95% elektron zaryadini o'z ichiga olgan bulutning chegara yuzasi orbital shaklini beradi.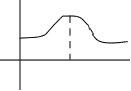 1s uchun radial elektron zichligi taqsimoti
1s uchun radial elektron zichligi taqsimoti Pz darajalari. m l uchta qiymatga ega bo'lgani uchun, keyin p-kichik darajalarda
Pz darajalari. m l uchta qiymatga ega bo'lgani uchun, keyin p-kichik darajalarda qadah shakliga ega. Barcha uchta p-orbital joylashgan
qadah shakliga ega. Barcha uchta p-orbital joylashgan 2.6-rasm. Z Y Y Z Z
2.6-rasm. Z Y Y Z Z

f
4f
d
4d
p
4p
s
4s
d
3d
p
3p
s
3s
n=2
––
p
2p
s
2s
n=1
–
s
1s
6p
6s
4d
5s
3d
4s
3s
2s
1s
2.9-rasm.
I
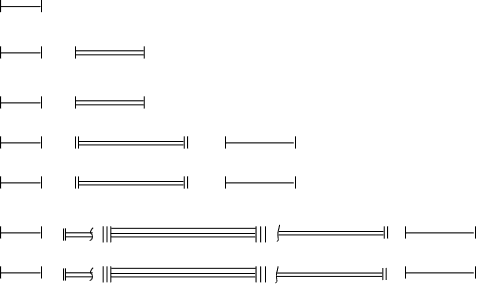
 1s2
1s2II 2s 2 2p 6
4p
3d
3p
2p






