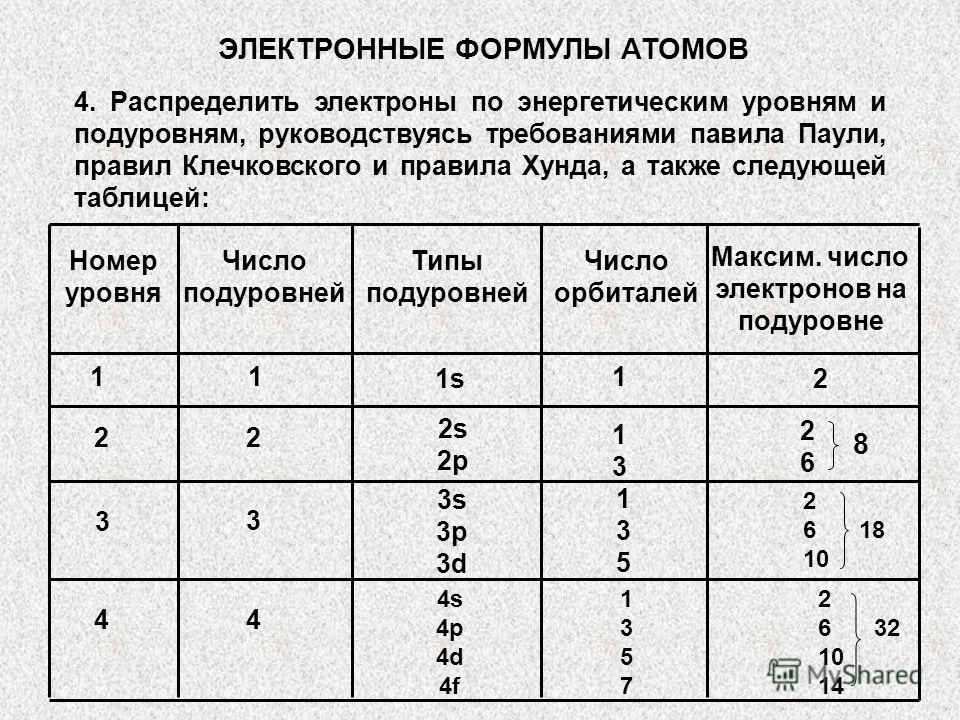
Kvant hujayralari orasida silikon elektronlarini taqsimlang. Vanadiy elektronlarining kvant hujayralarga taqsimlanishi
1-bo'lim uchun vazifalar
Namuna ijrosi Uy ishi
Atomning tuzilishi
1-topshiriq. a) Ushbu kichik darajalarning asosiy va orbital kvant sonlarining raqamli qiymatlarini ko'rsating, ularni to'ldirish ketma-ketligini hisoblang: 5 p, 7p, 7s.
Yechim. 5p 7p 7s
Ma'nosi n 5 7 7
Ma'nosi l 1 1 0
yig'indisi ( n +l ) 6 8 7
To'ldirish ketma-ketligi (Klechkovskiy qoidalari asosida):
1 – 5p; 2 – 7s; 3 – 7p.
b) Kvant hujayralari bo'ylab tarqaling valent elektronlar 2s 2 2p 4, kimyoviy elementni va uning D.I.dagi o'rnini aniqlang. Mendeleyev (davr raqami, guruh, kichik guruh).
Yechim. Kvant hujayralardagi valent elektronlar quyidagicha taqsimlanadi: 2 s 2 2p 4
Tavsiya etilgan kislorod elementi ikkinchi davrda, oltinchi guruhda, D.I. davriy jadvalining asosiy kichik guruhida joylashgan. Mendeleev.
ichida) Atomlar va ionlarning elektron formulalarini yozing, ularning D.I.dagi o'rnini ko'rsating. Mendeleyev (davr raqami, guruh, kichik guruh): K, Zn 2+ .
Yechim. Kaliy kimyoviy elementining elektron formulasi quyidagicha: 1 s 2 2s 2 2p 6 3s 2 3p 6 4s bitta. U toʻrtinchi davr, birinchi guruh, D.I. davriy sistemasining asosiy kichik guruhida joylashgan. Mendeleev. Zn 2+ kationining elektron formulasi: 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 . Kimyoviy element sink to'rtinchi davrda, ikkinchi guruhda, yon kichik guruhda joylashgan.
Barcha topshiriqlar uchun xuddi shunday qiling.
ATOMNING TUZILISHI
D. I. Mendeleyevning davriy tizimida (4-jadval) hammasi ma'lum elementlar. U etti davr (1-3 - kichik, 4-7 - katta), 8 guruhdan iborat. Har bir guruh asosiy va ikkinchi darajali kichik guruhlarga bo'linadi. Asosiy kichik guruh kichik va katta davrlarning elementlarini o'z ichiga oladi, yon guruh esa faqat kattalarni o'z ichiga oladi.
1-misol Davriy tizimda belgilang D.I. Yadro zaryadi 85 ga teng element atomining Mendeleyev pozitsiyasi (davr raqami, guruh raqami, asosiy yoki ikkilamchi kichik guruh).
Yechim. Element (85 At) 6-davr, 7-guruh, asosiy kichik guruh.
Elementlarning atomlari musbat zaryadlangan yadro (proton va neytron) va elektronlardan iborat. Elektronlar soni elementning atom raqamiga teng. Atomdagi elektronning holati kvant sonlari bilan tavsiflanadi n, l, m l va m s, ular mos ravishda nomlanadi eng muhimi, orbital, magnit va spin.
Orbitallarni elektronlar bilan to'ldirish tartibi V. Klechkovskiyning quyidagi qoidalari bilan belgilanadi:
to'ldirish miqdorning o'sish tartibida sodir bo'ladi ( n + l);
Ushbu yig'indining bir xil qiymatlarida, birinchi navbatda, asosiy qiymatning pastki qiymatiga ega bo'lgan pastki daraja to'ldiriladi kvant soni n.
Elektronlarni to'ldirish ketma-ketligi energiya darajalari va ko'p elektronli atomlarda pastki darajalar shaklga ega
1s<2s<2p<3s<3p<4s<3d <4p<5s<4d <5p<6s<5d 4f<6p <7s<6d 5f<7p.
Misol 2. Klechkovskiy qoidalaridan foydalanib, qaysi pastki sath elektronlar bilan to'ldirilganligini hisoblang 4 R yoki 5 s.
Yechim. 4 uchun R- pastki daraja sn + l= 4 + 1 = 5; 5 uchun s- pastki daraja Sn+l= 5 + 0 = 5. Yig'indi bir xil bo'lgani uchun, birinchi navbatda pastroq qiymatga ega bo'lgan pastki daraja to'ldiriladi. n, ya'ni 4 R.
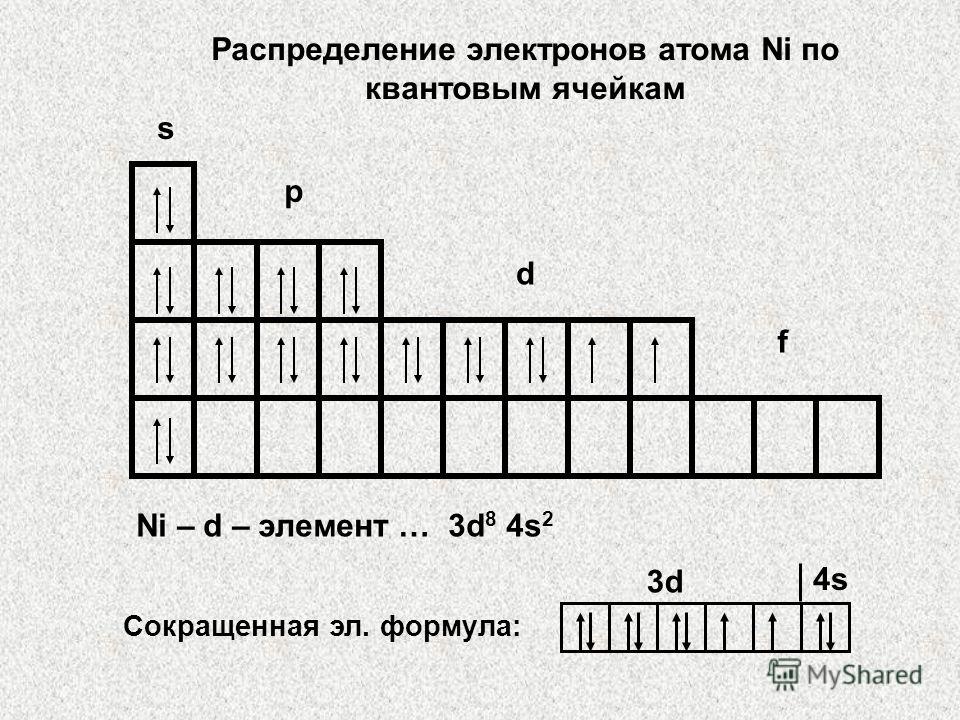
3-misol Valentlik elektronlarning taqsimlanishiga ko'ra - 3d 5 4s 2 Qaysi element ekanligini aniqlang, belgisini ko'rsating va to'liq elektron formulani yozing.
Yechim. Oxirgi energiya darajasining asosiy kvant sonining qiymati mos keladi xona davr, shuning uchun element ichida 4-davr. Valentlik elektronlar yig'indisi ko'rsatadi xona element joylashgan guruh, bu holda raqam guruhlar 7. Valentlik elektronlari yoqilganligi uchun d-pastki daraja, keyin bu element yon kichik guruh: 25 Mn 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
4-misol. Yadro zaryadi 22 bo‘lgan element atomining to‘liq elektron formulasini yozing.
Yechim. 22 Ti 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
5-misol. Fq, Sn 2+ ionlarining to‘liq elektron formulalarini yozing.
Yechim. Manfiy zaryadlangan ion hosil bo'lganda, elementning neytral atomi elektronlarni qabul qiladi: F 0 + 1 ē = Fq;9 Fq1 ionining elektron formulasi s 2 2s 2 2p 6. Elementning neytral atomi elektronlardan voz kechganda musbat zaryadlangan ion olinadi: Sn 0 - 2 ē = Sn 2+ ; 50 Sn 2+ ionining elektron formulasi 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 0 .
1-bo'lim uchun vazifalar
Har bir vazifa o'z ichiga oladi uchta savol(a B C).
| Ish raqami | a) Ushbu kichik darajalarning asosiy va orbital kvant sonlarining raqamli qiymatlarini ko'rsating, ularni to'ldirish ketma-ketligini hisoblang | b) Valentlik elektronlarini kvant hujayralar orasida taqsimlash, kimyoviy elementni va uning D.I.Mendeleyev sistemasidagi o‘rnini aniqlash (davr nomeri, guruh, kichik guruh). | v) Taklif etilayotgan atom va ionlarning elektron formulalarini yozing, ularning D.I.Mendeleyev sistemasidagi o‘rnini ko‘rsating (davr nomeri, guruh, kichik guruh). |
| 3p; 4s; 2p | 3d 1 4s 2 | Fe, Na+ | |
| 3d; 4p; 3p | 3d 2 4s 2 | Co, Cl- | |
| 5d; 4p; 4d | 3d 3 4s 2 | Ni, Ba2+ | |
| 3d; 4f; 5s | 3d 5 4s 1 | Zn, Ca2+ | |
| 4d; 4s; 5s | 4d 5 5s 2 | Sn, S 2- | |
| 6s; 4p; 4f | 3d 6 4s 2 | Vt, 3+ ichida | |
| 3d; 5s; 7p | 3d 7 4s 2 | S, La 3+ | |
| 4d; 6s; 5d | 3d 8 4s 2 | F, Tl 3+ | |
| 4p; 5p; 4f | 3d 10 4s 1 | Br, Zr 4+ | |
| 3d; 3p; 2s | 3d 10 4s 2 | Al, Hg2+ | |
| 5d; 3s; 6s | 4s 2 4p 1 | Pb, Au 3+ | |
| 6d; 4f; 5p | 4s 2 4p 2 | Ge, Ag+ | |
| 5d; 3p; 4d | 4 s 2 4p 3 | Ga, Sb 3+ | |
| 7s; 6p; 4d | 4s 2 4p 4 | N, Bi 3+ | |
| 5d; 4p; 3d | 4s 2 4p 5 | Cl, Pb 2+ | |
| 5s; 6s; 4p | 4s 2 4p 6 | Y, Hf 4+ | |
| 6p; 5f; 6d | 5d 7 6 s 2 | Zr, At- | |
| 5d; 5s; 4f | 5d 10 6 s 2 | Ta, Ga 3+ | |
| 3s; 4d; 3p | 5d 3 6 s 2 | Cr, Se 2- | |
| 5f; 4d; 4s | 5d 5 6 s 2 | Mo, Cu 2+ |
5-ma'ruza. ASOSIY KVANT SONI (n) soni (n) atomdagi elektronning umumiy energiyasini xarakterlaydi. U butun sonlarning qiymatlarini olishi mumkin: 1, 2, 3 ... n n kvant sonining har bir qiymati o'z energiya darajasiga ega. Elektronlar bilan to'ldirilgan atomdagi energiya darajalari soni element davriy jadvalda joylashgan davr soniga teng.

ASOSIY KVANT SONI (n) Masalan, uchinchi davrga tegishli har qanday element atomidagi elektronlar uchta energiya sathida joylashgan. Seriyaga eng yaqin energiya darajasida joylashgan elektronlar (n=1) eng kam energiyaga ega. Kvant energiyasini yutishda (E=hn) elektron yuqori energiya darajasiga o'tadi. Pastroq darajaga o'tganda, elektron energiyaning kvantini chiqaradi. (davomi)

ORBITAL KVANT SONI (ɭ) ɭ raqami orbitalning shaklini va shuning uchun elektron bulutni belgilaydi. U noldan n-1 gacha qiymat olishi mumkin: ɭ = 0, 1, 2, 3 … n-1 Masalan, agar asosiy kvant soni to'rt bo'lsa (n=4), u holda ɭ 0 qiymatlarini oladi, 1, 2, 3.

n sonining qiymatlari bir xil, lekin har xil (ɭ) bo'lgan elektronlar energiya jihatidan biroz farq qiladi. Shuning uchun ma'lum energiya darajasidagi elektronlar energiya quyi darajalariga guruhlangan deyiladi. ORBITAL KVANT SONI (ɭ) Bu quyi darajalar quyidagi harf belgilari bilan belgilanadi: Orbital kvant soni (l) Energiyaning pastki sath belgisi s p d f (davomi)

Har bir energiya darajasidagi pastki darajalar soni uning kvant soniga teng, ya'ni. bu darajadagi raqam. Birinchi energiya darajasi (n=1) bir s - pastki sathdan iborat; ikkinchisi (n=2) - ikkita (s; p) pastki darajadan; uchinchi (n=3) - uchta (s; p; d) pastki sathdan; to‘rtinchi (n=4) – to‘rttadan (s; p; d; f) pastki sathdan: Bosh kvant soni (n) (daraja raqami) Pastki darajalar turlari s s, p s, p, d s, p, d, f ORBITAL KVANT SONI ( ɭ ) (davomi)

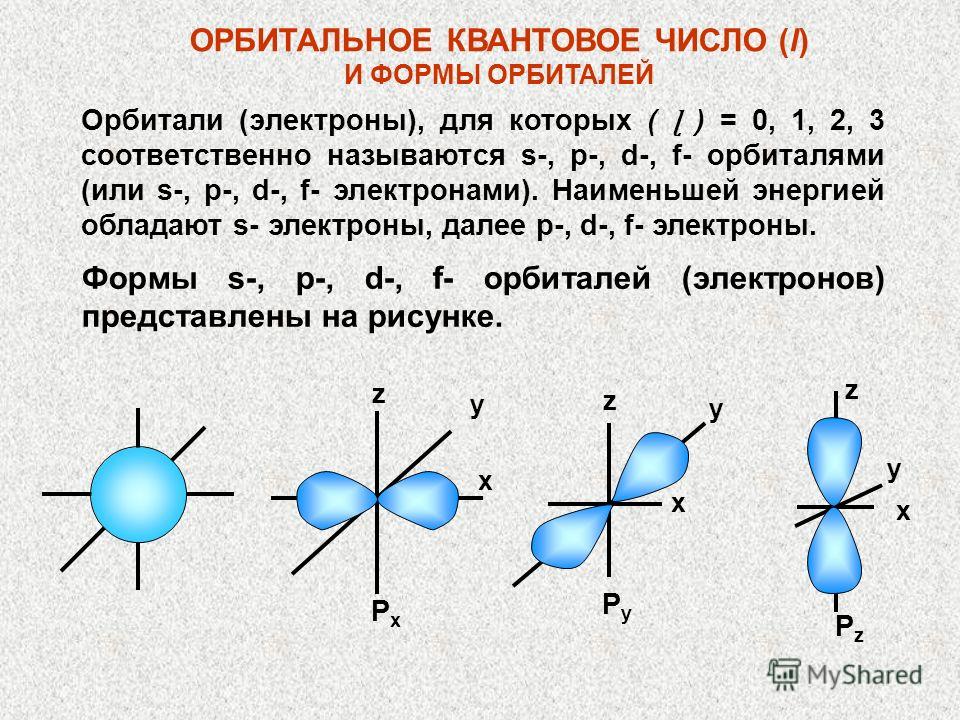
ORBITAL KVANT SONI (l) VA ORBITAL SHAKLLARI (ɭ) = 0, 1, 2, 3 bo'lgan orbitallar (elektronlar) s-, p-, d-, f-orbitallar (yoki -, f- elektronlar) deb ataladi. S-elektronlar eng kam energiyaga ega, keyin p-, d-, f-elektronlar. s-, p-, d-, f-orbitallarning (elektronlarning) shakllari rasmda ko'rsatilgan. x x x z PyPy PzPz y y y z z PxPx
M soni orbitallarning (bulutlarning) fazoviy joylashishini tavsiflaydi. U – ɭ dan + ɭ gacha bo'lgan barcha butun qiymatlarni qabul qilishi mumkin, shu jumladan nol: m = – l … 0 … + l Masalan: ɭ = 2 bilan bizda m = – 2, – 1, 0, + 1, + 2 m orbital kvant soniga bog'liq va ma'lum bir pastki darajadagi elektron bo'lishi mumkin bo'lgan energiya holatlari (orbitallar) sonini ko'rsatadi (ma'lum qiymat ɭ bilan). Berilgan qiymatga ega orbitallar soni (ɭ) 2 ɭ + 1 MAGNET KVANT SONI (m)

MAGNET VA ORBITAL Kvant SONLARNING ALOQASI Orbital kvant soni (ɭ) Magnit kvant soni (m) Orbitallar soni (bulutlar) – 1, 0, + 1 – 2, – 1, 0, + 1, + 2 –3, – 2 , – 1, 0, +1, +2,

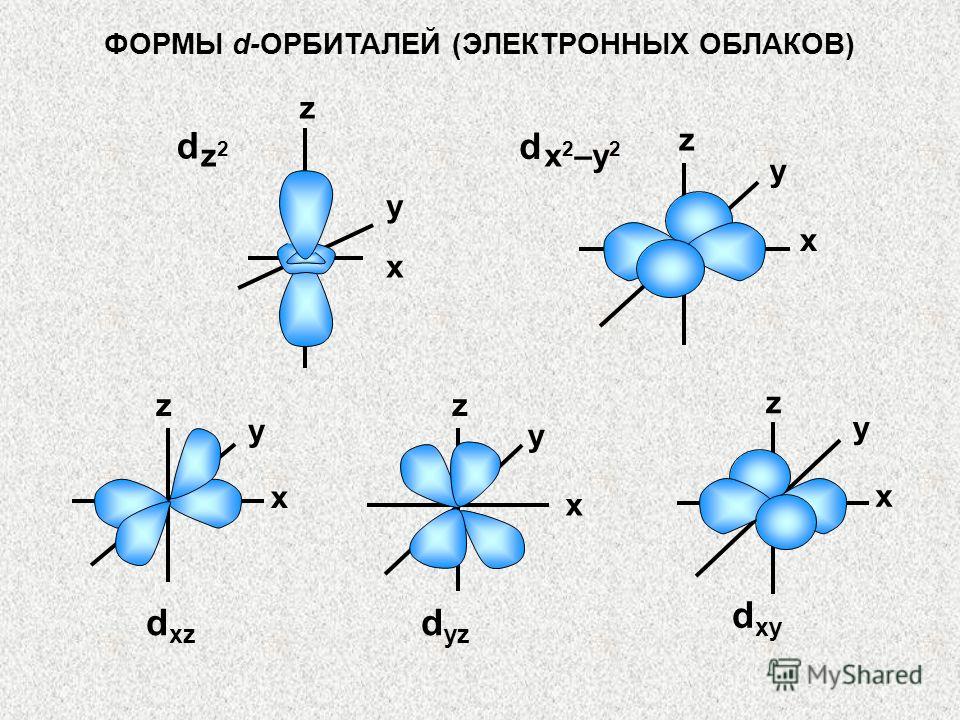
KVANT HUYATALARI (ORBITALAR) Har bir orbital odatda to'rtburchak bilan ifodalanadi, uni kvant hujayra deb ham ataladi.s - pastki daraja 1 hujayradan iborat p - pastki daraja 3 hujayradan iborat d - pastki daraja 5 hujayradan iborat f - pastki daraja 7 hujayradan iborat. s p d f

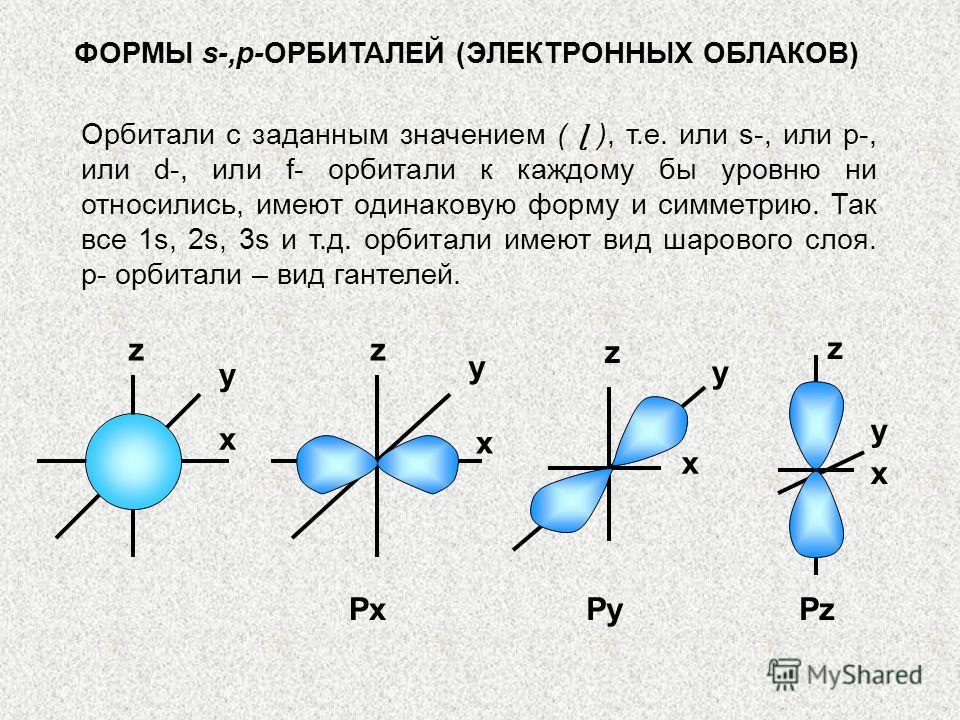
s-,p-ORBITALAR SHAKLLARI (ELEKTRON BULUTLAR) Berilgan qiymatga ega (ɭ), ya'ni. yoki s-, yoki p-, yoki d- yoki f-orbitallar har bir sathda bir xil shakl va simmetriyaga ega. Shunday qilib, hamma narsa 1s, 2s, 3s va hokazo. orbitallar sharsimondir. p-orbitallar dumbbellning bir turi. x x x x y z PxPyPz y y y z z z
SPIN KVANT SONI (S) Berilgan m qiymati uchun s soni faqat ikkita ma'noga ega bo'lishi mumkin: Elektron spin deb ataladigan gipoteza 1925 yilda ilgari surilgan (dastlab - aniqlik uchun - bu shunday deb ishonilgan edi. hodisa Yerning Quyosh atrofida orbita bo'ylab harakatlanayotganda o'z o'qi atrofida aylanishiga o'xshaydi). + ½ va – ½ Aslida, spin elektronning klassik analoglari bo'lmagan sof kvant xususiyatidir. To'g'ri aytganda, spin elektronning kosmosdagi harakati bilan bog'liq bo'lmagan to'g'ri burchak momentumidir. Barcha elektronlar uchun spinning mutlaq qiymati har doim s = 1/2 bo'ladi. Spinning Z o'qiga proyeksiyasi (magnit spin raqami) faqat ikkita qiymatga ega bo'lishi mumkin: m S = +1/2 yoki m S = -1/2.

"Atomda barcha to'rtta kvant sonining qiymatlari bir xil bo'lgan ikkita elektron bo'lishi mumkin emas." AO n, l, m uchta kvant soni bilan tavsiflanganligi sababli, u qarama-qarshi spinli ikkitadan ko'p bo'lmagan elektronni o'z ichiga olishi mumkin: PAULI PRINCIPLE X e = 2 (2l + 1); s–2; p–6; d - 10; f – 14 Elektronlarning maksimal soni: Pastki sathda: Darajada: N = 2n2

"Darajalar va pastki sathlarni elektronlar bilan to'ldirishda, atomdagi elektronlarni joylashtirish ketma-ketligi ularning yadro bilan eng katta aloqasiga mos kelishi kerak, ya'ni. elektron eng past energiyaga ega bo'lishi kerak." ENG KAM ENERGIYA PRINSIBI Bu tamoyil tizimlarning barqarorligi uchun umumiy termodinamik talablarni ifodalaydi: maksimal barqarorlik minimal energiyaga mos keladi. Amalda "eng kam energiya printsipi" Klechkovskiy qoidalari shaklida qo'llaniladi:

Keling, quyi darajalarda energiya zaxirasini taqqoslaylik: 4s 
3d, 4p va 5s pastki darajalarida yig'indisi (n+l) 5 ga teng: SUBLEVEL (n + l) 3+2=5 4+1=5 5+0=5 3d 4p 5s 1s2s2p3s4s3d4p5s4d5p6s4f5d Klech. 2-misol: Bu holda, n asosiy kvant sonining pastki qiymatiga ega bo'lgan pastki daraja birinchi navbatda to'ldiriladi, ya'ni. quyidagi ketma-ketlikda: 3d 3p 5s Umuman olganda, darajalar va pastki darajalarni to'ldirish quyidagi ketma-ketlikda boradi: 6p7s5f6d6p7s5f6d


Elektron formulalarda s, p, d, f harflari energiya elektronlarini bildiradi. Harflar oldidagi raqamlar berilgan elektron joylashgan energiya darajasini ko'rsatadi va yuqori o'ngdagi indeks bu pastki darajadagi elektronlar soni 5p 3 yozuvi elektronning p-kichik darajasida uchta elektron mavjudligini bildiradi. beshinchi energiya darajasi. ATOMLARNING ELEKTRON FORMULAI

Har qanday element atomining elektron formulasini tuzishda quyidagi ketma-ketlikka amal qilish kerak: 1. Elementning tartib raqamini (demak, atomdagi elektronlar sonini) aniqlang; 2. Elektronlar joylashgan energiya sathlari sonini aniqlang /davr soni bo'yicha/; 3. Elektronlarni asosiy qoidalar talablaridan kelib chiqib, pastki darajalar va darajalarga taqsimlang. ATOMLARNING ELEKTRON FORMULAI

4. Pauli qoidasi, Klechkovskiy qoidalari va Xund qoidalari, shuningdek, quyidagi jadval talablari asosida energiya sathlari va pastki sathlar bo'yicha elektronlarni taqsimlang: ATOMLARNING ELEKTRON FORMULA Daraja raqami Pastki darajalar soni Pastki sathlar turlari Orbitallar soni Maks. pastki sathdagi elektronlar soni 11 1s s 2p s 3p 3d s 4p 4d 4f
1. Oltingugurt atomining elektron formulasini tuzing: 1. Oltingugurtning tartib raqami 16: atomda atigi 16 ta elektron bor 2. Oltingugurt uchinchi davrda: 16 ta elektron uchta energiya sathida joylashgan: 1s 2s2p 3s3p3d. 3. Eng kam energiya printsipi va Pauli printsipiga muvofiq 16 ta elektronni energiya ostki darajalari bo'yicha taqsimlaymiz: 16 S - 1s 2 2s 2 2p 6 3s 2 3p 4 - oltingugurt atomining formulasi. ATOMLARNING ELEKTRON FORMULALARINI YAPISH

2. Kaltsiy atomi (Ca) formulasini tuzing: 1. Seriya raqami Ca \u003d 20: atomda 20 ta elektron bor 2. Ca toʻrtinchi davrda: 20 ta elektron toʻrt darajada joylashgan: 1s 2s 2p. 3s 3p 3d 4s 4p 4d 4f 3. 20 ta elektron taqsimlang: 20 Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 0 4s 2 yoki 1s 2 2s 2 2p 6 3s 2 4 3s2

3. Titan atomi / Ti / formulasini tuzing: 1. Seriya raqami Ti = 22: atomda 22 ta elektron bor 2. Ti 4-davrda: elektronlar 4 sathda joylashgan: 1s 2s 2p 3s 3p 3d. 4s 4p 4d 4f 3. 22 elektronni Pauli printsipi talablarini va eng kam energiya tamoyilini bajargan holda quyi darajalarga taqsimlang: 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 yoki 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 ATOMLARNING ELEKTRON FORMULALARINI YAPISH.

4. Seriy atomi (Ce) formulasini tuzing: 1. Seriya raqami Ce \u003d 58: atomda 58 ta elektron bor 2. Ce oltinchi davrda: 58 ta elektron oltita darajada joylashgan: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p … 3. 58 ta elektronni quyi sathlar oʻrtasida taqsimlang 58 Ce – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4s 6s 5s 4s 2 4s 6s 52p 4f (n + l = = 7) 5p (n + l == 6) 5s (n + l == 5) 6s (n + l == 6) 5s 5p 6s 4f

Qaysi pastki sath elektronlar bilan to'ldirilganligiga qarab barcha elementlar to'rt turga (oilaga) bo'linadi: 1) S-elementlar: tashqi sathning S-kichik darajasi to'ldiriladi. Ularning umumiy formulasi: … nS 2 n – davr raqami s-elementlar har bir davrning dastlabki ikkita elementini o'z ichiga oladi. 2) P-elementlar: tashqi sathning P-kichik darajasi to'ldiriladi. Ularning umumiy formulasi: ... nS 2 n P 1–6 p-elementlar har bir davrning oxirgi olti elementini o'z ichiga oladi (1 va 7-dan tashqari). TO'RT TUR Elementlar

3) d - elementlar: ular ikkinchi darajali d-pastki darajasini tashqi tomondan to'ldiradi. Ularning umumiy formulasi: ... (n-1) d 1-10 nS 2 Tashqi sathda ular 2 ta ba'zan 1 ta elektronga (s 1-2) ega. d-elementlarga s- va p-elementlar orasida joylashgan katta davrlarning 10 ta elementi kiradi. TO'RT TUR Elementlar yoki (n-2) f 1-14 (n-1) d 1 nS 2 4) f - elementlar: ular ikkinchi darajali d-pastki sathini tashqaridan to'ldiradi. Ularning umumiy formulasi: ... (n-2) f 1-14 nS 2 f-elementlarga lantanidlar va aktinidlar kiradi.

Davriy sistema yordamisiz atomlarning elektron konfiguratsiyasini tuzish Buning uchun quyidagilarni bilish kerak: 1. Davrda nechta element bor: davr Davrdagi elementlar soni = 18 3 = 36 4 = 54 5 = 86 6 tugallanmagan

2. Davrdagi dastlabki ikki element S-elementlar ekanligi. 3. Har bir davrning oxirgi olti elementi (1 va 7-dan tashqari) yirik davrlarning elementlarining p-elementlari (3-dan boshlab) - bular d-elementlardir. 5. Lantan (57 La) dan keyin 4f elementlari keladi. 6. Aktiniydan (89 Ac) keyin 5f elementlari Davriy jadval yordamisiz atomlarning elektron konfiguratsiyasini tuzish.

3. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l. L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bitta" title="(!LANG: Yechim 3. Yo'q, chunki d-kichik daraja uchun l = 2 , bu faqat n > 3 qiymatlari uchun mumkin. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bitta mavjud" class="link_thumb"> 34 !} Yechim 3. Yo'q, chunki d-kichik daraja uchun l = 2, bu faqat n > 3 qiymatlari uchun mumkin. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l. L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 da bitta qiymat m l = 0 (bitta AO) va l = 1 da uchta qiymat mavjud m l = 1 , 0, + 1 (jami uchta AO), shuning uchun L darajasidagi AOlarning umumiy soni to'rtta. MISOLLAR VA MUAMMOLAR 3. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l. L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bitta "> 3. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l. , m l. L darajasi ( n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 da bitta qiymat m l = 0 (bitta AO) va l = 1 da uchta qiymat mavjud. m l = 1, 0, + 1 (jami uchta AO), shuning uchun L-darajali AO ning umumiy soni to'rtta. MISOLLAR va MAMULLAR "> 3. Yechim 4. Har bir AO uchta qiymat bilan tavsiflanadi. kvant sonlari: n, l, m l. L darajasi (n = 2) ikkita kichik darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bitta" title="(!LANG: Yechim 3. Yo'q, chunki d-kichik daraja uchun l = 2 , bu faqat n > 3 qiymatlari uchun mumkin. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bitta mavjud"> title="Yechim 3. Yo'q, chunki d-kichik daraja uchun l = 2, bu faqat n > 3 qiymatlari uchun mumkin. Yechim 4. Har bir AO kvant sonlarining uchta qiymati bilan tavsiflanadi: n, l, m l. L darajasi (n = 2) ikkita pastki darajaga ega: l = 0 va l = 1. l = 0 uchun faqat bittasi mavjud."> !}
Atomning ko'rib chiqilgan elektron qobig'i uchta printsipga muvofiq elektronlar bilan to'ldiriladi: eng kam energiya printsipi, Pauli printsipi / qoidasi / Hund.
Eng kam printsipi shuni ko'rsatadiki, atomdagi elektron minimal energiya qiymatiga ega bo'lgan erkin pastki darajani egallaydi. Boshqacha qilib aytganda, elektron yadro bilan eng kuchli bog'lanish ta'minlangan pastki darajada qoladi.
Pastki darajalarni to'ldirish ketma-ketligi atomning elektron qobig'i tuzilishidagi pastki darajalarning yuqoridagi haqiqiy joylashuviga mos keladi:
1sà2sà2pà3sà3pà4sà3d –… va hokazo. /sm. yuqorida/.
Pauli printsipi /Pauli taqiqi/ atomda to'rtta kvant sonining bir xil qiymatlari bo'lgan ikkita elektron ham bo'lishi mumkin emasligini aytadi.
Natija. Orbitalda turli spinli ikkita elektron bo'lishi mumkin (ya'ni spin kvant sonining turli qiymatlari: ms = +1/2 va ms = -1/2).
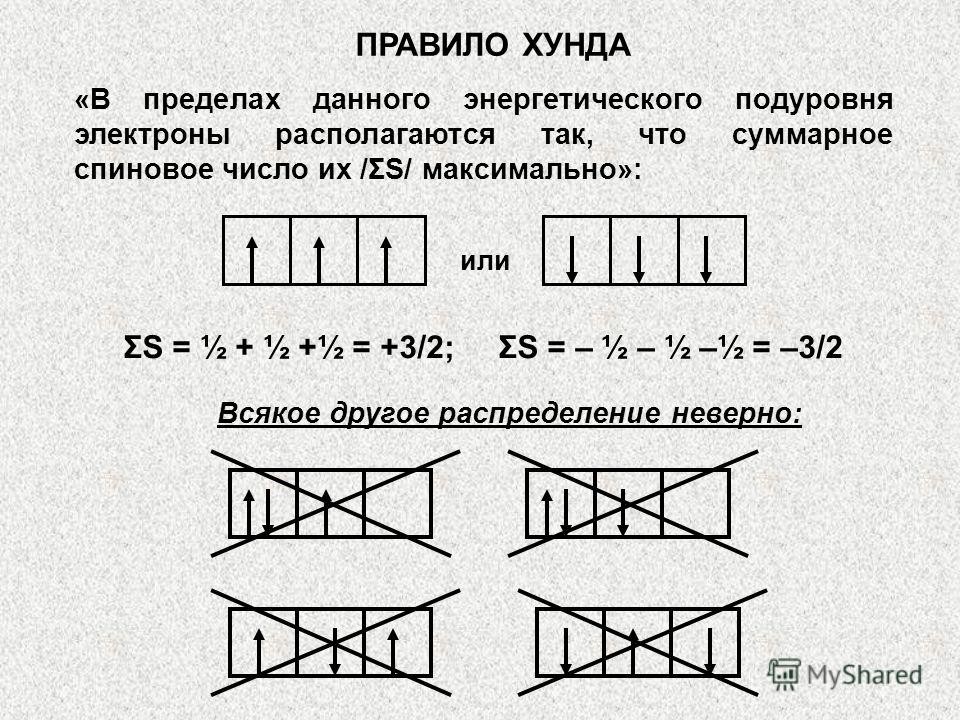
Uchinchi tamoyil - Gunda /Hunda/ tamoyili yoki qoidasi. Bu elektronlarning kvant pastki darajasini to'ldirish tartibini tushuntiradi. Pastki sath ichida elektronlar shunday taqsimlanadiki, ularning umumiy kvant soni maksimal qiymatga ega bo'ladi /birinchi navbatda har bir orbitalga bitta elektron, keyin esa juftlash/. To'g'ri taqsimot, masalan, uchta p-elektron bo'ladi:
Qaysi pastki daraja oxirgi elektronlar bilan to'ldirilganligiga qarab, s-, p-, d-, f-elementlar farqlanadi.
s-elementlar atomlarida oxirgi elektronlar tashqi kvant sathining s-kichik darajasini egallagan elementlardir. /Masalan, natriy, magniy, kaliy, kaltsiy va boshqalar/.
p-elementlar atomlarida oxirgi elektronlar tashqi kvant sathining p-kichik darajasini egallagan elementlardir. /Masalan, uglerod, kislorod, xlor va boshqalar/.
Oxirgi elektronlar bilan to'ldirilgan d-pastki daraja elementlarni d-elementlar sifatida tasniflaydi. /Masalan, d-elementlar titan, xrom, temir, mis, chunki bu elementlarda oxirgi elektronlar oxirgidan oldingi darajadagi d-pastki darajasini egallaydi/.
f-elementlar - atomlarida oxirgi elektronlar kvant sathidan tashqaridan ikkinchisining f-kichik darajasini egallagan elementlardir. /Masalan, prazeodimiy, evropiy, erbiy va boshqalar/.
2.1.7. Elektron formulalar va kvant hujayralari yordamida atomlarning elektron tuzilishi tasviri.
Har qanday atomning elektron tuzilishi elektron formulalar bilan ifodalanadi. Elektron formulalarda kvant elektron sathi n asosiy kvant sonining raqamli qiymati bilan, pastki sath tegishli pastki sathning harf belgisi bilan yoziladi va pastki sathdagi elektronlar soni pastki daraja darajasi bilan belgilanadi. belgilash. Masalan, 3d5 3-kvant darajasining d-kichik darajasida beshta elektron borligini bildiradi. Har qanday elementning elektron formulasi misolda ko'rsatilganidek, bunday bo'laklarning to'liq to'plamidan iborat. Shunday qilib, titan atomining elektron formulasi /№22/: 1s22s22p63s23p64s23d2. Barcha quvvatlarning yig'indisi 22 ga teng, ya'ni yadro zaryadi +22 bo'lgan titan atomi elektron qobig'ida 22 ta elektronni o'z ichiga oladi, ular umumiy manfiy zaryad (-22) bilan musbat zaryadni qoplaydi. atom yadrosi, atomni murakkab elektr neytral tizimga aylantiradi.
D.I.Mendeleyev elementlar davriy sistemasi tuzilishini ko‘rib chiqib, elektron formulalar tuzish qulayroqdir. Oldinga qarab va o'rta maktabda olingan bilimlarga asoslanib, biz elementlarning davriy tizimini elektron formulalar shaklida taqdim etamiz. (2.10-rasm.) Biz davriy tizimdagi muayyan elementning elektron formulalarini yozishga keyinroq qaytamiz va har qanday elementning elektron formulasini yozishni o'rganish oson bo'lgan algoritmni ko'rib chiqamiz. Ikkinchidan, atomning elektron qobig'ining tuzilishi kvant hujayralari yordamida tasvirlangan.

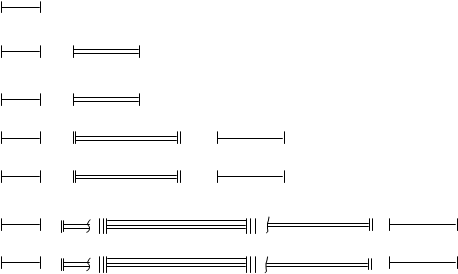 Men 1s2
Men 1s2
II 2s2 2p6
VI 6s2 5d1 4f14 5d9 6p6
VII 7s2 6d1 5f14 6d9 7p6
Biz allaqachon kvant hujayralaridan foydalanganmiz, garchi biz "kvant hujayra" tushunchasini kiritmagan bo'lsak ham. Kvant hujayra orbitalning grafik tasviridan boshqa narsa emas. U hujayra tomonidan ko'rsatilgan va orbitaldagi elektronlar hujayrada turgan o'q bilan tasvirlangan. s-kichik daraja uchun bitta hujayra tayinlangan, chunki s-kichik daraja faqat bitta orbitalga ega. P-pastki daraja uchun uchta hujayra ajratilgan, chunki p-pastki sathda uchta p-orbital mavjud. d-pastki daraja beshta katakcha, f-pastki daraja esa yetti katak bilan ifodalanadi.
Biz allaqachon kvant xujayralari yordamida tasvirlangan elektron formulani yozgan titan atomining elektron tuzilishi quyidagicha ko'rinadi:
Rossiya Federatsiyasi Qishloq xo'jaligi vazirligi
FGOU VPO "Ulyanovsk davlat qishloq xo'jaligi akademiyasi"
Fan bo'yicha test va imtihon savollari uchun topshiriqlar
Ulyanovsk - 2010 yil
A.L. Ignatov. "Kimyo" fanidan testlar va imtihon savollari uchun topshiriqlar / Ed. prof. IN VA. Kostina. - Ulyanovsk davlat qishloq xo'jaligi akademiyasi, 2009 yil, 58s.
Taqrizchi: Kafiyatullina A.G., t.f.n., Ulyanovsk davlat pedagogika universiteti kimyo kafedrasi katta o‘qituvchisi I.N. Ulyanova»
Ushbu qo'llanmada kimyo kursining asosiy bo'limlari bo'yicha nazorat topshiriqlari, tipik masalalarni yechish misollari va imtihon savollari ro'yxati mavjud.
Muhandislik fakultetining sirtqi bo‘lim talabalari uchun: 110301 “Qishloq xo‘jaligini mexanizatsiyalash”, 110304 “Agrosanoat majmuasida mashinalarga texnik xizmat ko‘rsatish va ta’mirlash texnologiyasi”, 190601 “Avtomobil va avtomobilsozlik” mutaxassisliklari.
© A.L.Ignatov, 2010.
© FGOU VPO "Ulyanovsk davlat qishloq xo'jaligi akademiyasi", 2010 yil.
NAZORAT VAZIFALARI
MADDANING TUZILISHI
Oddiy masalalarni yechishga misollar
1-topshiriq. Atomning qaysi energiya quyi sathi elektronlar bilan avvalroq to'ldiriladi: a) 4s yoki 3d; b) 5p yoki
4d; c) 6p yoki 4f?
Yechim. Energiya pastki sathlarini elektronlar bilan to'ldirish tartibi Klechkovskiy qoidasi bilan belgilanadi, unga ko'ra pastki sathlar asosiy va orbital kvant sonlari (n + l) yig'indisining ketma-ket ortib borishi tartibida elektronlar bilan to'ldiriladi. bu summaning bir xil qiymatlari, asosiy kvant soni n ni oshirish tartibida. Masalaning shartida sanab o‘tilgan energiya ostki darajalari yig‘indisini (n+l) topamiz.
Yig'indi n+l 4+0=4 |
Binobarin, (a) xolatda 4s pastki sath birinchi navbatda elektronlar bilan, keyin esa 3d pastki sath; (b) holatida birinchi navbatda 4d, keyin 5p; (c) holatda birinchi 4f, keyin 6p.
Vazifa 2. Elektronlarni darajalar bo'yicha taqsimlang, yerdagi va qo'zg'atilgan holatda Fe atomining elektron formulasini yozing, uning valentlik elektronlarining kvant holatlarini ko'rsating va ularni kvant hujayralar orasida taqsimlang.
Yechim. Bu masalani hal qilish qo'zg'atmagan temir atomida elektronlar egallaydigan darajalar sonini aniqlashdan boshlanishi kerak. Ularning soni element joylashgan davrning soni bilan belgilanadi. Temir uchun u 4 ga teng. Birinchi ikki darajadagi elektronlarning maksimal soni mos ravishda 2 va 8 ga teng (asosiy kvant soni 2n2 ning ikki barobar kvadrati bilan aniqlanadi). Valentlik elektronlarining maksimal soni element (VIII) joylashgan guruh soni bilan aniqlanadi. Temir yon kichik guruhda joylashganligi sababli, uning valentlik elektronlari s - tashqi energiya darajasining pastki darajasi va d - tashqi darajaning pastki darajasi o'rtasida taqsimlanadi. Demak, 4s holatida 2 ta, 3d holatida 6 ta elektron mavjud (guruh raqami minus 2). Temir atomining oxirgi energiya darajasidagi elektronlarning umumiy soni 14 tani tashkil qiladi.
Shunday qilib, qo'zg'atmagan temir atomidagi elektronlar darajalar bo'yicha quyidagicha taqsimlanadi:
Har bir n-daraja n ta kichik darajaga bo'lingan. Atomning elektron formulasini yozishda pastki darajalar asosiy va orbital kvant sonlari yig'indisining o'sish tartibida joylashtiriladi:
Valentlik elektronlari - 3d 6 4s2.
Pastki darajadagi kvant katakchalarini elektronlar bilan to'ldirish tartibi Xund qoidasi bilan umumiy spinning eng katta mutlaq qiymati printsipiga muvofiq belgilanadi:
Qo'zg'atilgan temir atomida bitta s - elektron 4p - pastki darajaga o'tadi. Qo'zg'alish holatida elektronlar kvant hujayralariga quyidagicha taqsimlanadi:
3-topshiriq. Mn2+, S2-, Br- ionlarining elektron formulalarini yozing.
Yechim. Mn atomida (d-element) elektronlar taqsimlanadi
energiya darajalari quyidagicha: 1s2 2s2 2p6 3s2 3p6 3d 5 4s 2
d - elementlarda musbat ionlar hosil bo'lganda, har doim birinchi navbatda tashqi qatlamning s-elektronlari chiqariladi, ya'ni Mn + 2 uchun elektron formula to'g'ri keladi:
1s2 2s2 2p6 3s2 3p6 3d 5 4s 0
keyin S2- ioni uchun 3p pastki sathining "tugallanishi" sodir bo'ladi
S2– :1s2 2s2 2p6 3s 2 3p 6
Pastki darajaning xuddi shunday "tugallanishi" Br-ion shakllanishi paytida sodir bo'ladi:
Br:1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 5
Br– :1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 6 |
|||||||
Topshiriq 4. Elementning davriy sistemadagi (davr, guruh, kichik guruh) o rnini ko rsating, agar uning atomidagi oxirgi elektron holatga tushib qolgan bo lsa: a) 3d6; b) 4p2.
Javobni asoslang.
Yechim. a) Agar oxirgi elektron d-holatdagi atomga urilsa, bu yon kichik guruhning elementidir. Ikkilamchi kichik guruhlar elementlarining atomlarida oxirgi valentlik elektron d - oxirgi energiya darajasining pastki darajasiga to'g'ri keladi. Bundan kelib chiqadiki, n-1=3 va n=4. Asosiy kvant sonining qiymati - 4 - davr sonini aniqlaydi - 4. 4s holati 3d dan ertaroq elektronlar bilan to'ldirilganligi sababli, valentlik bo'lishi mumkin bo'lgan elektronlarning umumiy soni 4 ga teng: 3d2 4s2. Bu shuni anglatadiki, bu yon kichik guruhning IV guruhining 4-davrining elementi - titanium (Ti).
b) Agar oxirgi elektron atomga p-holatda kirsa, u holda bu asosiy kichik guruhning elementi hisoblanadi.
Asosiy kichik guruhlar elementlarining atomlarida valent elektronlar tashqi energiya darajasida joylashgan. Demak, asosiy kvant sonining qiymati - 4 - davr sonini aniqlaydi. Tashqi darajadagi p-holat s-holatdan keyin elektronlar bilan to'ldirilganligi sababli, valentlik elektronlarining umumiy soni 4 ga teng, guruh sonini aniqlaydi. Shuning uchun bu IV guruhning 4-davrining elementi va asosiy kichik guruh - germaniy.
5-topshiriq. BCl3 molekulasida qaysi elektron bulutlari ustma-ust qoplanishini, molekulaning qanday bog`lanish burchagi borligini, BCl3 molekulasi qutbli yoki qutbli emasligini aniqlang. Javobingizni asoslang, BCl3 molekulasining tuzilishini VS usuli (valentlik bog'lari) nuqtai nazaridan ko'rib chiqing.
Yechim. Elementning davriy sistemadagi o‘rniga ko‘ra, bog‘lar hosil qiluvchi atomlardagi valent elektronlarning kvant holatlarini ko‘rsating va ularni quyidagicha taqsimlang.
kvant hujayralari: B…2s 2 2p1, lekin bor atomi uchta kimyoviy bog'lanish hosil qilganligi sababli u qo'zg'aluvchan holatda bo'ladi va sp2 elektron orbitallarining gibridlanishi sodir bo'ladi; uchta gibrid elektron bulutlar hosil bo'ladi.
22p1 | ||||||||
B* ….2s1 2p2 | ||||||||
23p5 | ||||||||
p-elektron xlorda bog' hosil bo'lishida ishtirok etadi.
B-Cl aloqalari V atomining gibrid elektron bulutlari va Cl atomining p-elektron bulutlarining bir-birining ustiga chiqishi natijasida hosil bo'ladi.
Uch valentli atom B gibrid elektron bulutlarining yo'nalishi bog'lanish yo'nalishini va BCl3 molekulasining shaklini aniqlaydi. B-Cl bog'lari 1200 burchakka yo'naltirilgan va BCl3 molekulasi tekis uchburchak shakliga ega. Molekulada bog'lanishning hosil bo'lish sxemasi 1-rasmda ko'rsatilgan.
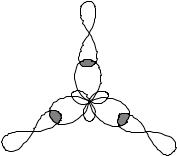
Bog'lanish dipol momenti vektorlari mkb >0 elektromanfiyligi yuqori bo'lgan atom tomon yo'naltiriladi. PM molekulasining umumiy dipol momenti 0 ga teng, ya'ni. molekula qutbsiz, ammo barcha B-Cl aloqalari qutbli.
Topshiriq 6. Quyidagi moddalarning kristallaridagi zarrachalar o'rtasida qanday bog'liqlik mavjud: CH4, Ne, Rb, RbF, Si, ZnSe? Bu moddalar zarrachalarning tabiati va ular orasidagi bog'lanish turlariga ko'ra qanday turdagi kristall panjaraga ega
siqilgan holat?
Yechim. Metan va neon kristallari molekulyar panjara bilan tavsiflanadi. Birinchi kristall panjaraning joylari qutbsiz CH4 molekulalarini o'z ichiga oladi, ular orasida van der Waals kuchlarining dispersiya komponenti harakat qiladi. Dispersiyaning o'zaro ta'siri monotomik neon molekulalari orasidagi kristallarda ham namoyon bo'ladi.
Rubidiy - bu metall; kristalli rubidiy metall panjara bilan tavsiflanadi; panjara joylarida joylashgan rubidiy kationlari orasidagi bog'lanish metalldir.
RbF birikmasida odatiy ion bog'lanish ishlaydi, chunki atomlarning elektronegativligidagi farq
ikkitadan ortiq birlik: DX RbF \u003d XF - XRb \u003d 4,0 - 0,8 \u003d 3,2 (I-ilova), RbF kristallari ionli panjara bilan tavsiflanadi, ularning tugunlarida ijobiy va manfiy ionlar Rb + va F - , ular orasida ion aloqasi mavjud.
Kristalli kremniy (kremniy metall bo'lmagan) olmosga o'xshash kovalent kristall panjaraga ega bo'lib, unda har bir kremniy atomi to'rtta qo'shni atom bilan qutbsiz kovalent aloqa bilan bog'langan. Rux selenid kristallari kovalent panjaraga ega.
Kristal panjaraning tugunlarida joylashgan rux va selen atomlari o'rtasida qutbli kovalent bog'lanish ta'sir qiladi, chunki ∆XZnSe = 2,4 - 1,6 = 0,8 bo'ladi.
1-mashq
Vazifalar 1-jadvalda berilgan. Variantning raqami qatorga, topshiriq raqami ustunga mos keladi.
1. Elektronlarni energiya darajalari bo'yicha taqsimlang, topshiriqda taklif qilingan atomning elektron formulasini yozing, valent elektronlarning kvant holatlarini ko'rsating, ularni qo'zg'atilgan va qo'zg'atilgan holatlardagi kvant hujayralar o'rtasida taqsimlang, bu element qaysi elektron oilaga tegishli ekanligini ko'rsating?
2. Taklif etilgan ionlarning elektron formulalarini yozing, valentlik elektronlarining kvant holatlarini ko'rsating va ularni kvant hujayralar o'rtasida taqsimlang.
3. Topshiriqda taklif qilingan pastki darajalar qanday ketma-ketlikda elektronlar bilan to'ldiriladi? Tushuntirish bering.
4. Oxirgi elektronning kvant holatiga ko'ra elementning davriy sistemadagi o'rnini ko'rsating (davr, guruh, kichik guruh).
5. Valentli bog'lanish usuli nuqtai nazaridan vazifada taklif qilingan molekulalarning tuzilishini ko'rib chiqing, ko'rsating






