Kimyada yarıçap. Genel kimya ders notları
Atom yarıçaplarının belirlenmesi de bazı problemler içerir. İlk olarak, bir atom kesin olarak tanımlanmış bir yüzeye ve yarıçapa sahip bir küre değildir. Bir atomun bir elektron bulutu ile çevrili bir çekirdek olduğunu hatırlayın. Çekirdekten uzakta bir elektronu tespit etme olasılığı, kademeli olarak belirli bir maksimuma yükselir ve daha sonra kademeli olarak azalır, ancak yalnızca sonsuza kadar sıfıra eşit olur. uzun mesafe. İkinci olarak, yarıçapı belirlemek için hala bir koşul seçersek, böyle bir yarıçap deneysel olarak hala ölçülemez.
Deney, yalnızca çekirdekler arası mesafeleri, başka bir deyişle bağ uzunluklarını belirlemeyi mümkün kılar (ve o zaman bile, Şekil 2.21'in başlığında verilen belirli çekincelerle). Bunları belirlemek için X-ışını kırınım analizi veya elektron kırınımı yöntemi (elektron kırınımına dayalı) kullanılır. Bir atomun yarıçapının, aynı atomlar arasındaki en küçük çekirdekler arası mesafenin yarısına eşit olduğu varsayılır.
Van der Waals yarıçapı. Bağlanmamış atomlar için en küçük çekirdekler arası mesafenin yarısına van der Waals yarıçapı denir. Bu tanım Şekil 2'de gösterilmektedir. 2.22.
Pirinç. 2.21. Bağlantı uzunluğu. Moleküller sürekli titreştiğinden, çekirdekler arası mesafe veya bağ uzunluğu sabit bir değere sahip değildir. Bu şekil, basit bir iki atomlu molekülün doğrusal titreşimini şematik olarak göstermektedir. Titreşimler, bağ uzunluğunu sadece bağlı iki atomun merkezleri arasındaki mesafe olarak tanımlamayı imkansız hale getirir. Daha kesin bir tanım şöyle görünür: bağ uzunluğu, iki atomun kütle merkezleri arasında ölçülen ve minimum bağ enerjisine karşılık gelen, bağlı atomlar arasındaki mesafedir. Minimum enerji Mors eğrisinde gösterilir (bkz. Şekil 2.1).
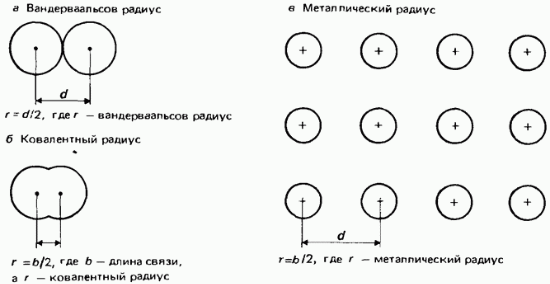
Pirinç. 2.22. Atom yarıçapı, a - van der Waals yarıçapı; b - kovalent yarıçap; c - metal yarıçapı.
kovalent yarıçaplar. Kovalent yarıçap, iki özdeş atom arasındaki çekirdekler arası mesafenin (bağ uzunluğu) yarısı olarak tanımlanır, bağlı arkadaş başka bir kovalent bağ ile (Şekil 2.22, b). Örnek olarak bağ uzunluğu 0,1988 nm olan bir klor molekülünü ele alalım. Klorun kovalent yarıçapının 0.0944 nm olduğu varsayılır.
Bir elementin atomunun kovalent yarıçapını bilerek, başka bir elementin atomunun kovalent yarıçapını hesaplayabiliriz. Örneğin, bağ uzunluğunun deneysel olarak belirlenmiş değeri 0,1767 nm'dir. Bu değerden klorun kovalent yarıçapını (0.0994 nm) çıkardığımızda, karbonun kovalent yarıçapının 0.0773 nm olduğunu buluruz. Bu hesaplama yöntemi, atom yarıçaplarının basit bir toplama yasasına uyduğu toplamsallık ilkesine dayanmaktadır. Böylece bağ uzunluğu, karbon ve klorun kovalent yarıçaplarının toplamıdır. Toplama ilkesi sadece basit kovalent bağlar için geçerlidir. Çift ve üçlü kovalent bağlar daha kısadır (Tablo 2.7).
Basit bir kovalent bağın uzunluğu, molekül içindeki ortamına da bağlıdır. Örneğin, bağ uzunluğu, üç ikameli bir karbon atomunda 0.1070 nm'den bileşikte 0.115 nm'ye kadar değişir.
metal yarıçaplar. Metal yarıçapının, metal kristal kafesteki komşu iyonlar arasındaki çekirdekler arası mesafenin yarısına eşit olduğu varsayılır (Şekil 2.22, c). Atom yarıçapı terimi genellikle metalik olmayan elementlerin atomlarının kovalent yarıçapını ifade ederken, metalik yarıçap terimi metalik elementlerin atomlarını ifade eder.
İyonik yarıçaplar. İyonik yarıçap, kristalli bir iyonik bileşikte (tuz) bitişik monatomik (basit) iyonlar arasındaki çekirdekler arası mesafenin iki bölümünden biridir. İyonik yarıçapın belirlenmesi de önemli problemlerle ilişkilidir, çünkü interiyonik mesafeler iyonik yarıçapların kendileri değil deneysel olarak ölçülmektedir. İnteriyonik mesafeler, kristal kafes içindeki iyonların paketlenmesine bağlıdır. Şek. 2.23, bir kristal kafes içinde iyonları paketlemenin üç olası yolunu gösterir. Ne yazık ki, deneysel olarak ölçülen interiyonik mesafeler
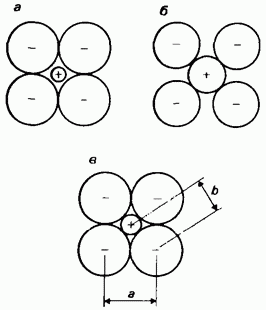
Pirinç. 2.23. İyonik yarıçaplar, a - anyonlar birbirleriyle temas halindedir, ancak katyonlar anyonlarla temas halinde değildir; b - katyonlar anyonlarla temas halindedir, ancak anyonlar birbirleriyle temas halinde değildir; c - katyonların anyonlarla temas halinde olduğu ve anyonların birbirleriyle temas halinde olduğu koşullu olarak kabul edilen iyon düzenlemesi. a mesafesi deneysel olarak belirlenir. Anyonun yarıçapının iki katı olarak alınır. Bu, anyon ve katyon yarıçaplarının toplamı olan b interion mesafesinin hesaplanmasını mümkün kılar. Ara mesafe b'yi bilerek, katyonun yarıçapı hesaplanabilir.
her durumda bu üç paketleme yönteminden hangisinin gerçekten gerçekleştirildiğini yargılamamıza izin vermeyin. Problem, interiyonik mesafenin, iki iyonun yarıçaplarına karşılık gelen iki parçaya bölünmesi gereken oranı bulmak, başka bir deyişle, bir iyonun fiilen nerede bitip diğerinin nerede başladığına karar vermektir. Örneğin, Şekil 2'de gösterildiği gibi. 2.12, tuzların elektron yoğunluğu haritaları da bu sorunun çözülmesine izin vermemektedir. Bu zorluğun üstesinden gelmek için genellikle: 1) interiyonik mesafenin iki iyon yarıçapının toplamı olduğu, 2) iyonların küresel olduğu ve 3) komşu kürelerin birbiriyle temas halinde olduğu varsayılır. Son varsayım, Şekil 2'de gösterilen iyon paketleme yöntemine karşılık gelir. 2.23, c. Bir iyon yarıçapı biliniyorsa, toplamsallık ilkesine göre diğer iyonik yarıçaplar hesaplanabilir.
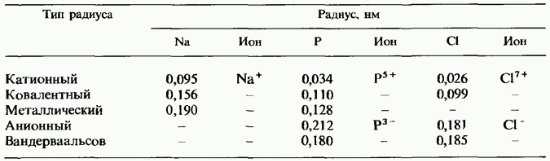
Farklı yarıçap türlerinin karşılaştırılması. Masada. 2.8, 3. periyodun üç elementi için çeşitli tiplerdeki yarıçapların değerlerini gösterir. En büyük değerlerin anyon ve van der Waals yarıçaplarına ait olduğunu görmek kolaydır. Şek. 11.9, argon hariç, 3. periyodun tüm elementleri için iyonların ve atomların boyutlarını karşılaştırır. Atomların boyutları kovalent yarıçaplarıyla belirlenir. Katyonların atomlardan daha küçük olduğu ve anyonların büyük bedenler aynı elementlerin atomlarından daha fazladır. Tüm yarıçap türlerinin her elemanı için en küçük değer her zaman katyonik yarıçapa aittir.
Tablo 2.8. Çeşitli tiplerdeki atom yarıçaplarının karşılaştırılması
Atomların ve iyonların yarıçaplarının belirlenmesi. X-ışınlarının kristallerin çalışmasına uygulanması, yalnızca iç yapı ikincisi, aynı zamanda parçacık boyutunu belirlemek için,bir kristal oluşturan - atomlar veya iyonlar.
Şekil 46. Bir kristalde temas eden parçacıklar
Bu tür hesaplamaların nasıl yapıldığını anlamak için kristali oluşturan parçacıkların küresel ve birbirleriyle temas halinde olduğunu hayal edin. Bu durumda, iki komşu parçacığın merkezleri arasındaki mesafenin yarıçaplarının toplamına eşit olduğunu varsayabiliriz (Şekil 46). Parçacıklar basit atomlarsa ve aralarındaki mesafe ölçülürse, o zaman atomun yarıçapı da belirlenir, açıkçası bulunan mesafenin yarısına eşittir. Örneğin, metalik sodyum kristalleri için kafes sabitinin d 3.84 angstroma eşit olduğunda, yarıçapın r sodyum atomu eşittir.
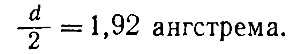
Çeşitli iyonların yarıçaplarını belirlemek biraz daha zordur. Burada iyonların boyutları aynı olmadığı için iyonlar arasındaki mesafeyi basitçe ikiye bölmek artık mümkün değildir. Ancak iyonlardan birinin yarıçapı r 1 biliniyor, diğerinin yarıçapı r 2 basit çıkarma ile kolayca bulunur:
r2 = d - r1
Bu nedenle, kristal kafeslerin sabitlerinden çeşitli iyonların yarıçaplarını hesaplamak için, en az bir iyonun yarıçapını bilmek gerekir. O zaman diğer tüm iyonların yarıçaplarını bulmak artık zorluk yaratmayacaktır.
Optik yöntemlerin yardımıyla, flor iyonlarının yarıçaplarını oldukça doğru bir şekilde belirlemek mümkün oldu F - (1.33 A) ve oksijen O - (1.32 A); bu yarıçaplar, diğer iyonların yarıçaplarının hesaplanmasında başlangıç değerleri olarak hizmet eder. Örneğin, magnezyum oksit MgO'nun kafes sabitinin belirlenmesi, bunun 2,1 angstroma eşit olduğunu gösterdi. Bundan oksijen iyonunun yarıçapını çıkararak, magnezyum iyonunun yarıçapını buluruz:
2,1 - 1,32 = 0,78 Å
Sodyum florürün kafes sabiti 2.31 A'dır; Flor iyonunun yarıçapı 1.33 angstrom olduğundan, sodyum iyonunun yarıçapı şöyle olmalıdır:
2,31 -1,33 = 0,98 Å
Sodyum iyonunun yarıçapını ve sodyum klorürün kafes sabitini bilerek, klor iyonunun yarıçapını vb. hesaplamak kolaydır.
Bu şekilde hemen hemen tüm atom ve iyonların yarıçapları belirlenir.
Bu miktarların büyüklüğü hakkında genel bir fikir, tabloda verilen verilerle verilmektedir. 7.
Masa 7
Bazı elementlerin atomlarının ve iyonlarının yarıçapları
| eleman | atom yarıçapı | iyon yarıçapı | iyon sembolü |
| 1,92 | 0,98 | Na+ | |
| 2,38 | 1,33 | B+ | |
| 2,51 | 1,49 | Rb+ | |
| 2,70 | 1,65 | Cs+ | |
| 1,60 | 0,78 | mg++ | |
| 1,97 | 1,06 | Ca++ | |
| 2,24 | 1,43 | Ba++ | |
| 0,67 | 1,33 | F- | |
| 1,07 | 1,81 | Cl- | |
| 1,19 | 1,96 | Br- | |
| 1,36 | 2,20 | J- | |
| 1,04 | 1,74 | S- |
Bu verilerin gösterdiği gibi, metallerde atomların yarıçapları iyonların yarıçaplarından daha büyüktür, metaloidlerde ise tam tersine iyonların yarıçapları atomların yarıçaplarından daha büyüktür.
Bir kristali oluşturan iyonların göreli boyutları, uzaysal kafesin yapısı üzerinde büyük bir etkiye sahiptir. Bu nedenle, örneğin, kimyasal yapılarında çok benzer iki - CsCl ve NaCl yine de çeşitli tiplerde kafesler oluşturur ve ilk durumda her bir pozitif iyon sekiz negatif iyonla ve ikincisinde - sadece altı ile çevrilidir. Bu fark, sezyum iyonlarının boyutlarının
ve sodyum aynı değildir. Bir dizi düşünce bizi iyonların kristalin içine yerleştirilmesi gerektiğini kabul etmeye zorlar, böylece her küçük iyon mümkünse onu çevreleyen büyük iyonlar arasındaki boşluğu tamamen doldurur ve bunun tersi de geçerlidir; diğer bir deyişle, pozitif iyonlardan neredeyse her zaman daha büyük olan negatif iyonlar, pozitif iyonları olabildiğince yakın çevrelemelidir, aksi takdirde sistem kararsız olacaktır. Cs + iyonunun yarıçapı 1,65 Å ve Na + iyonu sadece 0,98 Å olduğundan, birincinin çevresine ikinciden daha fazla Cl - iyonunun yerleştirilebileceği açıktır.
Bir kristaldeki her bir pozitif iyonu çevreleyen negatif iyonların sayısına, verilen kafesin koordinasyon sayısı denir. Çeşitli kristallerin yapısının incelenmesi, aşağıdaki koordinasyon numaralarının en yaygın olduğunu gösterir: 2, 3, 4, 6, 8 ve 12.
Koordinasyon sayısı yarıçap oranına bağlıdır pozitif iyon negatif iyonun yarıçapına: bu oran birliğe ne kadar yakınsa, koordinasyon sayısı o kadar büyük olur. İyonları en yakın paketleme yöntemine göre kristalde bulunan toplar olarak ele alarak, pozitif ve negatif iyonların yarıçapları arasında hangi oranda bir veya başka bir koordinasyon numarası elde edilmesi gerektiğini hesaplamak mümkündür.
Aşağıda, belirli bir yarıçap oranı için hesaplanan teorik olarak en büyük koordinasyon sayıları verilmiştir.
Bu tablodan bulunan NaCl ve CsCl için koordinasyon numaralarının, bu maddelerin kristallerindeki iyonların gerçek düzenine tekabül ettiğini doğrulamak kolaydır.
Örneğin, NaCl durumunda, sodyum iyonunun (0.98 Å) yarıçapının klor iyonunun (1.81 Å) yarıçapına oranı 0.98:1.81 = 0.54'tür. Bu oran 0.41-0.73 aralığında; bu nedenle, NaCl kafesinde koordinasyon sayısı altı olmalıdır.
Atomların ve iyonların yarıçaplarını belirleme konulu bir makale okuyorsunuz
ATOM YARIÇAPI- bir atomun, moleküller ve kristallerdeki atomlar arası (nükleer) mesafeleri yaklaşık olarak tahmin etmeyi mümkün kılan bir özelliği. Atomların net sınırları olmadığından, "A.R." kavramını tanıtırken. %90-98 demek elektron atomu bu yarıçapta bir küre içine alınır. A.r. 0.1 HM sırasına sahiptir, ancak değerlerindeki küçük farklılıklar bile onlardan inşa edilen kristallerin yapısını belirleyebilir, moleküllerin denge geometrisini etkileyebilir, vb. Diğerleri için. problemlerde, moleküllerdeki ve yoğun ortamdaki atomlar arasındaki en kısa mesafeler, A.R.'lerinin toplamı olarak kabul edilebilir, ancak bu tür toplamlık çok yaklaşıktır ve her durumda tatmin edici değildir. Atomlar arasında hangi kuvvetlerin hareket ettiğine bağlı olarak (bkz. Atomlar arası etkileşim), metalik, iyonik, kovalent ve van der Waals A. p.
metalik yarıçaplar, bir kristaldeki atomlar arasındaki en kısa mesafenin yarısına eşit kabul edilir. metal elemanın yapısı, koordinatlara bağlıdır. sayılar İle. Eğer A. p. birim başına K=12'de, daha sonra K=8, 6 ve 4 A. s. aynı eleman 0.98'e eşit; 0.96; 0.88. A. p. değerlerinin yakınlığı. farklı metaller - karşılıklı çözünürlük için gerekli (yeterli olmasa da) bir koşul metaller ikame türü. Bu nedenle, sıvı K ve Li genellikle karışmaz ve iki sıvı katman oluşturmaz ve Rb ve Cs ile K sürekli bir katı çözelti serisi oluşturur (A.R. Li, K, Pb ve Cs eşittir 0.155; 0.236; 0.248; 0.268 HM) . Katkı A. r. kristalin parametrelerini yaklaşık olarak tahmin etmenizi sağlar. intermetalik ızgaralar. bağlantılar.
İyonik yarıçaplar, iyonik kristallerdeki çekirdekler arası mesafelerin yaklaşık tahminleri için kullanılır. En yakın katyon ve anyon arasındaki mesafenin iyon yarıçaplarının toplamına eşit olduğu varsayılır. A.R.'nin belirtilen eklenebilirliğinin doğruluğu.
Fark A. r. KF ve NaF'deki çekirdekler arası mesafelerin karşılaştırılmasıyla elde edilen iyonlar 0.035 nm'dir (NaF'deki KF kristallerindeki A.R. iyonlarının aynı olduğu varsayılır) ve KCl ve NaCl bileşikleri için 0.033 HM'dir, KBr ve NaBr bileşiklerinden - 0.031 HM ve KI ve NaI bileşiklerinden - 0.030 HM. T. o., iyonik kristallerdeki çekirdekler arası mesafeleri A. R. ile belirlemedeki tipik hata ~ 0.001 nm.
Bir kaç tane var A. p. değerlerinde farklılık gösteren iyonik A. p. sistemleri. bireysel iyonlar, ancak yaklaşık olarak aynı çekirdekler arası mesafelere yol açar. İlk kez, iyonik A. p.'nin belirlenmesi üzerinde çalışın. 20'li yıllarda yapıldı. 20. yüzyıl V. M. Goldschmidt (V. M. Goldschmidt), bir yandan, X-ışını yöntemleriyle ölçülen kristallerdeki çekirdekler arası mesafelere dayanır. yapısal Analiz, ve diğer yandan, A. p. ve , yöntemle belirlenir refraktometri(sırasıyla 0.133 ve 0.132 HM). Diğer çoğu sistem de belirli . kristallerde ve belirli bir "referans" değerinde A. p. tanım ve o. Naib'de. Pauling'in sistemi tarafından yaygın olarak bilinen bu referans değeri A. p. (0.140HM). En büyüklerinden biri olarak kabul edilen Belov ve Bokiya sisteminde. güvenilir, A. r. 0 2- 0.136 HM'ye eşit olarak alınır. Aşağıda belirli iyonların yarıçaplarının değerleri verilmiştir:
|
Goldschmidt sisteminde |
Pauling sisteminde |
Goldschmidt sisteminde |
Pauling sisteminde |
||
Aynı koordinatlara sahip iyonik kristaller için. sayılar, bkz. İyonik kristallerdeki en kısa çekirdekler arası mesafelerin deneysel değerlerinden yukarıda verilen A.R.'den hesaplanan A.R. toplamının sapması 0.001-0.002 NM'dir.
70-80'lerde. A. p.'yi doğrudan belirlemek için girişimlerde bulunuldu. yöntemlerle elektron yoğunluğunu ölçerek iyonlar röntgen yapısal analiziçekirdekleri birleştiren hat üzerindeki minimum elektron yoğunluğunun iyonların sınırı olarak alınması şartıyla. Kırınım alkali metallerin halojenür kristalleri için ölçümler A. r. Li + , Na + , K + , Rb + ve Cs + katyonları sırasıyla eşittir. 0.094; 0.117; 0.149; 0.163; 0.186 nm ve A. r. anyonlar F - , Cl - , Br - , I - - eşit cevap. 0.116; 0.164; 0.180; 0,205HM. İle. kırınım ölçümler, aşırı tahmin edilen (yukarıda verilen geleneksel ile karşılaştırıldığında) A. p. katyonlar ve hafife alınan değerlere Ve. anyonlar. Bir kristaldeki elektron yoğunluğunun dağılımının ölçülmesiyle bulunan A.R. bir bileşikten diğerine aktarılamaz ve bunların toplamsallıklarından sapmalar çok büyüktür, bu nedenle böyle bir A.R. nükleer mesafeleri tahmin etmek için kullanılamaz.
Kovalent yarıçap, tek bir kimyasalın uzunluğunun yarısı olarak tanımlanır. X - X bağları (burada X, metal olmayan bir elementtir). Halojenler için, kovalent A.R., X2 molekülündeki X - X çekirdekler arası mesafenin yarısı, S ve Se için - X 8'deki X - X mesafesinin yarısı, karbon için - bir elmas kristalindeki en kısa C - C mesafesinin yarısıdır. Kovalent A. r. F, Cl, Br, I, S, Se ve C karşılık. 0.064'e eşit; 0.099; 0.114; 0.133; 0.104; 0.117 ve 0.077 nm. H atomu için A. r. 0.030 HM'ye eşit alınır (her ne kadar H2 molekülündeki H - H bağının uzunluğunun yarısı 0.037 HM olsa da). Kovalent arr katkılılığı. çok atomlu moleküllerde en kısa çekirdekler arası mesafelerin (bağ uzunlukları) tahmin edilmesini sağlar. Dolayısıyla bu kurala göre C-Cl bağ uzunluğu 0.176 HM'ye eşit olmalıdır ve CCl 4 molekülünde bu değer için deneysel olarak elde edilen değer 0.177 HM'dir. Aşağıda kovalent A. r. tekli bağların uzunlukları temelinde hesaplanan belirli elementlerin atomları için:

Çift veya üçlü kimyasal içeren moleküllerde. bağlar, kovalent A. p.'nin indirgenmiş değerlerini kullanın, çünkü çoklu bağlar tekli olanlardan daha kısadır. Aşağıda, çoklu bağların oluşumunda atomların kovalent yarıçapları verilmiştir:
Van der Waals yarıçapları efekti belirler. soy gaz atomlarının boyutları. Ayrıca, van der Waals A.p. kimyasal olarak birbirine bağlı olmayan aynı adı taşıyan en yakın atomlar arasındaki çekirdekler arası mesafenin yarısını düşünün. bağ ve farklı moleküllere ait (örneğin, moleküler kristallerde). Atomlar birbirlerine van der Waals yarıçaplarının toplamından daha az bir mesafede yaklaştıklarında, güçlü bir atomlar arası itme meydana gelir. Bu nedenle, van der Waals A.p. farklı moleküllere ait atomların izin verilen minimum temaslarını karakterize eder. Aşağıda bazı atomlar için van der Waals atom yarıçaplarının değerleri verilmiştir:

Van der Waals A. r. Çarşamba günü. 0.08 nm daha fazla kovalent A. p. İyonik A. r. negatif yüklü bir iyon için (örneğin, Cl -), nötr durumdaki bir atomun van der Waals yarıçapı ile pratik olarak çakışır.
Van der Waals A. p. moleküllerin şeklini, moleküllerin konformasyonlarını ve moleküler kristallerdeki paketlenmelerini belirlemenizi sağlar. Yoğun paketleme ilkesine göre, bir kristal oluşturan moleküller, bir molekülün "çıkıntıları" diğerinin "boşluklarına" girecek şekilde düzenlenir. Bu prensibi kullanarak, mevcut kristalografik veriler yorumlanabilir ve bazı durumlarda moleküler kristallerin yapısı tahmin edilebilir.
Aydınlatılmış.: Boky G.B., Crystal chemistry, 3. baskı, M., 1971; Pauling L., Genel kimya, çev. İngilizce'den, M., 1974; Campbell J., Modern General Chemistry, çev. İngilizce'den, cilt 1, M., 1975; E. Cartmell, G. V. A. Fowles, Değerlik ve moleküllerin yapısı, çev. İngilizceden, M., 1979. V.G. Dashevsky.
Atom yarıçapı, en yakın komşu atomların sayısına bağlıdır.
Atom yarıçapları, metal atomlarının yarıçaplarına, metalik olmayan elementlerin kovalent yarıçaplarına ve soy gaz atomlarının yarıçaplarına bölünür.
Kristallerde hareket eden etkileşimlerin toplamı tarafından belirlenen atom yarıçapı, bir dereceye kadar veya bağın tipine ve cn'ye bağlıdır.
Bu grubun - samaryum, tülyum ve plütonyum - geçiş metallerinin atomik yarıçapları / - çok daha büyüktür, bu nedenle bunlara karşılık gelen eğri, d - geçiş metalleri için eğrilerin solunda bulunur ve karakteristik kırılmalar sergiler. İnert gazlar, atomlarını katı halde bağlayan çok zayıf moleküler kuvvetler nedeniyle çok büyük atom yarıçaplarına sahiptir. Karşılık gelen eğrinin konumu, ağırlıklı olarak güçlü bir metalik bağa sahip grup VIII'in d - ve / - geçiş metalleri için eğrilerle ilgili değildir.
Atom yarıçapı, kullanılan bu en yüksek değerin temel kuantum sayısındaki n artışla artar. enerji seviyesi. Bununla birlikte, her bir enerji seviyesi için ortalama elektron dağılım yarıçapı çeşitli atomlar aynı değildir, çünkü çekirdeğin etkin yüküne bağlıdır. Etkili nükleer yük Z3d (j), ele alınan elektrona etki eden görünen yüktür. 2eff değeri, Z çekirdeğinin gerçek yükünden daha azdır, çünkü her bir dış elektron, iç elektronlar tarafından çekirdeğin hareketinden kısmen korunur. En dıştaki elektronlar için, gerçek nükleer yükün aynı atom veya iyondaki diğer elektronlar tarafından korunma derecesi, gerçek ve etkili nükleer yükler arasındaki fark olarak tanımlanan koruma sabiti S ile karakterize edilebilir.
Atom yarıçapları, iyonik olanlar gibi, koordinasyon sayısının büyüklüğüne bağlı olarak aynı element için değişir. Bu bağlamda, belirttiğimiz gibi, genellikle belirli bir yarıçap değerinin ait olduğu koordinasyon numarasının ait olduğu bir indeks, örneğin rv ile gösterilir.
Atom yarıçapı 156 A, Ca2'nin iyon yarıçapı 103 A'dır.
Atom yarıçapı 2 65 A, Cs'nin iyon yarıçapı 165 A'dır. Havada tutuşma ile anında oksitlenerek peroksit ve süperperoksit oluşturur.
Atom yarıçapı (metal) 0 280 nm, iyonik yarıçap Fr 0 186 nm.
Atom yarıçapları S C1 Ar dizisinde azalır, çünkü S'den C1'e ve C1'den Ar'a giderken çekirdeğin yükü bir artar. Bir dönem içinde değerlik elektronları artmasıyla çekirdeğe daha güçlü bir şekilde çekilirler. pozitif yük, böylece atom yarıçapları buna göre azalır. İzoelektronik (aynı sayıda elektrona sahip) atomik ve iyonik parçacıklar için, çekirdeğin yükü (elementin seri numarası) arttıkça etkili yarıçaplar azalır, çünkü bu durumda da çekimde kademeli bir artış vardır. çekirdeğe elektronlar.
Atom yarıçapları, artan grup sayısı ile benzer şekilde I'den VI'ya ve çinko grubuna doğru değişir. Atomlar arası bağların uzunluğu ve atom çapları azaldıkça, atomlar arası bağların enerjisi artar ve bu nedenle termal genleşme katsayısı a ve metallerin sıkıştırılabilirliği k azalır.
B alt gruplarının elementlerinin atom yarıçapları ve sıkıştırılabilirliği, IB - - VIIB yönünde önemli ölçüde artar ve inert gazların atom yarıçapları, karşılık gelen dönemlerde alkali metallerin atom yarıçaplarına çok yakındır.
Metallerin atom yarıçapları. Atom yarıçapları, metal atomlarının yarıçaplarına, metalik olmayan elementlerin kovalent yarıçaplarına ve soy gaz atomlarının yarıçaplarına bölünür.
Denklemde ikame edilecek atom yarıçapı r d ve Hz genellikle Pauling tarafından kullanılan yarıçaplardan farklıdır; Tabloda verilmiştir. 4.2 parantez içinde. Bu yarıçaplar kullanılarak hesaplanan atomlar arası mesafeler Tablonun ikinci sütununda verilmiştir. 4.1 parantez içinde. Genellikle deneysel değerlerle Pauling yarıçaplarından elde edilen değerlerden biraz daha iyi anlaşırlar, ancak fark nadiren büyüktür. Schoemaker ve Stevenson şeması, ikili ve üçlü bağlara genişletilememesi dezavantajından muzdariptir ve bu nedenle, aşağıdaki tartışmada faydalı olmak için yeterince geniş uygulanabilirliğe sahip değildir.
Atom yarıçapları, metal atomlarının yarıçaplarına, metalik olmayan elementlerin kovalent yarıçaplarına ve soy gaz atomlarının yarıçaplarına bölünür.
Atom yarıçapları, atom numarasına veya nükleer yüke periyodik olarak bağımlıdır. Genel olarak, periyodik element sistemi en tanıdık - tablo biçiminde sunulursa, aynı sayıda kuantum katmanına sahip atomik yarıçaplar soldan sağa azalır, elektron kabuğu olduğu gibi küçülür. Yukarıdan aşağıya, aksine, kuantum katmanlarının sayısındaki artışla atom yarıçapları artar.
Atom yarıçapları, metal atomlarının yarıçapları, kovalent yarıçaplar ve soy gaz atomlarının yarıçaplarını içeren moleküller arası (van der Waals) yarıçaplarına bölünmüştür.
Tipik olarak, gruplardaki atom yarıçapları yukarıdan aşağıya doğru artar.
Tungstenin atom yarıçapı 1 37 A, molibden 1 36 A, vanadyum - 1 32 A ve krom-1 25 A'dır. Deneyimler, konjuge birikimin daha belirgin olduğunu göstermektedir, elementin atom yarıçapı atom yarıçapına ne kadar yakınsa tungsten.
F c C1 Br I serisinde halojenlerin atom yarıçapları artar. Aynı sırayla kaynama ve erime noktaları artar ve halojenlerin rengi derinleşir.
Şema kristali - Bu işlemi birkaç kez tekrarlamak. Silisyumun atom yarıçapı (koordinasyon sayısı 4 ve kovalent bağ ile) 1175 A'dır. Silikon atomunun nispeten büyük yarıçapı nedeniyle, silikon karbondan daha büyük bir metalliğe sahiptir. Bileşiklerde, silikon ağırlıklı olarak dört değerlidir.
Borun atom yarıçapı 0 97'dir ve B3 iyonunun yarıçapı 0 20 A olarak tahmin edilmektedir.
Borun atom yarıçapı 0 97'dir ve B3 iyonunun yarıçapı 0 20 A olarak tahmin edilmektedir.
Demir Durum Şeması.| Demirin ısı kapasitesinin sıcaklıkla değişimi [kcalKz - atom deg. Fe'nin atom yarıçapı 1 26 A'dır ve metalden bir elektronun iş fonksiyonu 4 7 ey'dir. Şekilde gösterildiği gibi. XIV-15, demirin normal basınçta dört allotropik formu vardır. Demirin termal genleşme katsayısı 500 C'ye kadar yükselir, ardından 769 C'ye düşer ve daha sonra tekrar 911 C'ye yükselir. Yaklaşık 133 bin atm basınç altında normal sıcaklıkta oluşturulan, demirin e-formu, rf (FeFe) 2 40 A, yüksek yoğunluklu (91 g / cm3) ve arttırılmış (yaklaşık olarak) altıgen sıkı paketlenmiş bir yapı ile karakterize edilir. 25 kez) elektrik direnci.
Co ve Ni'nin standart atom yarıçapları 125 ve 124 A'dır ve metallerin karakteristik elektron çalışma fonksiyonları sırasıyla 42 ve 50 eV'dir. Bu elementlerin allotropisi, demirden çok daha az çalışılmıştır. Kobalt için, ısıtıldığında (yaklaşık 450 C), altıgen yakın yerleşim, yüzleri ortalanmış bir küp olarak değişirken, nikel için (yaklaşık 358 C), bunun tersi doğrudur. Her iki metalin de böyle zıt bir davranışına neden olan şey açık değildir.
Fe'nin atom yarıçapı 1 26 A'dır ve metalden bir elektronun iş fonksiyonu 4 7 eV'dir. Şekilde gösterildiği gibi. X1V - 15, normal basınçta demirin dört allotropik formu vardır. Bunlardan a, (5 ve b) merkezli bir küp olarak kristalleşirken y, ortalanmış yüzleri olan bir küp olarak kristalleşir Demirin termal genleşme katsayısı 500 C'ye yükselir, ardından 769 C'ye düşer ve sonra tekrar yükselir 911 C'ye kadar
Co ve Ni'nin standart atom yarıçapları 125 ve 124 A'dır ve metallerin karakteristik elektron çalışma fonksiyonları sırasıyla 42 ve 50 ea'dır. Bu elementlerin allotropisi, demirden çok daha az çalışılmıştır. Kobalt için, ısıtıldığında (yaklaşık 450 C), altıgen yakın yerleşim, yüzleri ortalanmış bir küp olarak değişirken, nikel için (yaklaşık 358 C), bunun tersi doğrudur. Her iki metalin de böyle zıt bir davranışına neden olan şey açık değildir. Kobalt için bir polimorfik dönüşüm daha kaydedildi - 1125 C'de.
Li'nin atom yarıçapı, elektronik karşılıklarının atom yarıçaplarından önemli ölçüde farklıdır, bu nedenle Li, onlarla ötektik alaşımlar oluşturur.
Vanadyumun atom yarıçapı, niyobyumunkinden belirgin şekilde daha küçüktür ve niyobyumdan tantaluma giderken, tantalın yeni bir elektron katmanına sahip olmasına rağmen, atom yarıçapı pratik olarak değişmez. Tantalın atom yarıçapının anormal derecede küçük değeri, hafniyum durumunda olduğu gibi, lantanit büzülmesinin etkisine bağlıdır. 5 oksidasyon durumundaki niyobyum ve tantal da aynı iyon yarıçapına sahiptir, bu da büyük bir benzerliğe neden olur. kimyasal özellikler bu unsurlar.
Niyobyum ve tantalın atom yarıçapları neredeyse çakışır (Tablo 33), aynı oksidasyon durumunun iyonik yarıçapları da birbirine çok yakındır, bu nedenle bileşikleri özelliklerde çok benzerdir. VB alt grubunun metalleri refrakterdir, iyi mekanik özelliklere sahiptir ve hidrojen, karbon, oksijen ve nitrojen safsızlıklarının içeriğine büyük ölçüde bağlıdır. Bu safsızlıklar sertliği arttırır, metalleri kırılgan ve daha az sünek hale getirir. Vakum elektron ışını erimiş, niyobyum ve tantal çok sünektir ve soğukken iyi çalışır.
Molekülün yapısı - köken olarak. Daha sonra halka ortak S8'de tasvir edilmiştir. Kükürtün atom yarıçapı 0 104 nm'ye eşit olarak kabul edilir.
Atomlar arası mesafelerden hesaplanan atom yarıçapları basit maddeler ah, nm. Metal olmayanların atom yarıçapları, basit maddelerin molekülleri veya kristallerindeki atomlar arası mesafenin yarısı ile aynı şekilde hesaplanır.
Niyobyum ve tantalın atom yarıçapları neredeyse çakışır (bkz. Tablo 33), aynı oksidasyon durumunun iyonik yarıçapları da birbirine çok yakındır, bu nedenle bileşikleri özelliklerde çok benzerdir. VB alt grubunun metalleri refrakterdir, iyi mekanik özelliklere sahiptir ve hidrojen, karbon, oksijen ve nitrojen safsızlıklarının içeriğine büyük ölçüde bağlıdır. Bu safsızlıklar sertliği arttırır, metalleri kırılgan ve daha az sünek hale getirir. Vakum elektron ışını erimiş, niyobyum ve tantal çok sünektir ve soğukken iyi çalışır. Olağan koşullar altında, bu metaller, kararlı bir koruyucu oksit film ile kaplandıkları için pasiftir. saat Yüksek sıcaklık oksijen, halojenler, nitrojen, karbon, hidrojen, karbon dioksit ve su buharı ile etkileşime girer. 600 C ve üzerindeki tantal, hidrojende indirgenemeyen güçlü, ateşe dayanıklı, zayıf iletken Ta20b oksit ile kaplanmıştır.
Vanadyumun atom yarıçapı, niyobyumunkinden belirgin şekilde daha küçüktür ve niyobyumdan tantaluma giderken, tantalın yeni bir elektron katmanına sahip olmasına rağmen, atom yarıçapı pratik olarak değişmez. 5 oksidasyon durumundaki niyobyum ve tantal da aynı iyonik yarıçaplara sahiptir, bu da bu elementlerin kimyasal özelliklerinde büyük bir benzerliğe neden olur.
Aşırı doymuş bir katı çözeltiden çökelti türleri. Alüminyumun atom yarıçapı 0 143 nm, bakır - 0 128 nm, çinko - 0 138 nm'dir.
Buna uygun olarak, atom yarıçapı lityum durumunda 155 A'dan karbon durumunda 077 A'ya düşer. Erime noktaları ve kaynama noktaları giderek artar; sertlik ve benzeri diğer özellikler gibi bu göstergeler, belirli bir maddenin atomları arasındaki bağın gücünü yansıtır; erime noktası lityum için 186'dan karbon için 3500'e yükselir ve kaynama noktası lityum için 1336'dan karbon için 4200'e yükselir.
Elektron yoğunluğunun kristallerdeki atomlar arasındaki iletişim hattı üzerindeki dağılımı. a - novalent-nan bağı (elmas C, noktalı çizgi - değerlik elektron çiftinin elektron yoğunluğu. b - iyonik bağ (NaCl, noktalı çizgi - dış elektron yörüngelerinin bölgesi. c - metalik bağ (A1, noktalı çizgi - elektron yoğunluğu) atomlar arası uzayda Aynı tip bağa sahip bileşiklerin yapılarında metalik atomlar arası mesafelere sahip basit maddelerin (elementlerin) yapılarındaki gat'ın atom yarıçapları, silisyum karbürde atom yarıçaplarının toplamı ile iyi tanımlanmıştır. (0 189 nm), gat (Si) 0 117 nm, rJT (C) 0 077 nm, 0 194 nm'ye eşit belirtilen yarıçapların toplamı ile pratik olarak çakışır.
Uranyumun atom yarıçapı büyüktür, 1 54 A'ya eşittir, iyon yarıçapı - 1 03 A, U4 - 0 93 A, U5 - 0 87 A ve U6 - 0 83 A.
Sezyumun atom yarıçapı 262 A'dır.
Bor, nitrojen ve silisyumun atom yarıçapları sırasıyla 0 80'dir; 0 74 ve 1 17 A - Aşağıdaki durumlarda atomların katı toplar olduğunu varsayarak bu elementlerin davranışlarını tahmin edin ve tahmin ettiğiniz sonuçları deneysel verilerle karşılaştırın.
Vanadyum, niyobyum ve tantalın atom yarıçapları sırasıyla 1 34'tür; 1 46 ve 1 46 A - Niyobyum ve tantalın atom yarıçapları neden çakışıyor?
Geçiş elementlerinin atom yarıçapları, geçiş elementi metallerindeki daha büyük bağ kuvvetini yansıtan, geçiş olmayan elementlerin atom yarıçaplarından daha küçüktür.
Metal katalizörlerin atom yarıçapları belirli sınırlar içinde olmalıdır, çünkü aksi takdirde ya sikloheksandaki hidrojen atomları onları çeken katalizör atomundan çok uzakta olacak ya da karbon atomlarının halkası kafes üzerinde uzanmayacaktır. Sikloheksan dehidrojenasyon katalizörleri, 1236-1397 A atom yarıçapına sahiptir.
Bakır alt grubunun elementlerinin atom yarıçapları küçüktür: gs 128 pm; / - d g Ai 1 44 rm.
Oluşumunda yer alan kimyasal elementlerin en önemli özelliklerinden biri Kimyasal bağ, bir atomun (iyon) boyutudur: artmasıyla atomlar arası bağların gücü azalır. Bir atomun (iyon) boyutu genellikle yarıçapı veya çapının değeri ile belirlenir. Bir atomun (iyon) net sınırları olmadığından, "atomik (iyonik) yarıçap" kavramı, bir atomun (iyon) elektron yoğunluğunun %90-98'inin bu yarıçapın küresinde bulunduğu anlamına gelir. Atomik (iyonik) yarıçapların değerlerini bilmek, kristallerdeki (yani, bu kristallerin yapısı) çekirdekler arası mesafeleri tahmin etmeyi mümkün kılar, çünkü birçok problem için atom çekirdekleri (iyonlar) arasındaki en kısa mesafeler olarak kabul edilebilir. atomik (iyonik) yarıçaplarının toplamıdır, ancak bu tür bir toplamlık yaklaşıktır ve her durumda geçerli değildir.
Altında atom yarıçapıkimyasal element(iyonik yarıçap hakkında, aşağıya bakınız), bir kimyasal bağın oluşumunda yer alan genel durumda, bir elementin kristal kafesindeki en yakın atomlar arasındaki denge nükleer mesafenin yarısını anlamaya karar verdiler. Atomları (iyonları) katı küreler olarak düşünürsek oldukça basit olan bu kavram aslında karmaşık ve çoğu zaman belirsizdir. Bir kimyasal elementin atomik (iyonik) yarıçapı sabit bir değer değildir, ancak en önemlileri kimyasal bağın türü olan bir dizi faktöre bağlı olarak değişir.
ve koordinasyon numarası
Farklı kristallerde aynı atom (iyon) oluşursa farklı şekiller kimyasal bağ, o zaman bir kristalde kovalent bağ ile birkaç yarıçap - kovalent olacaktır; iyonik bağı olan bir kristalde iyonik; metalde metalik; bir moleküler kristalde van der Waals. Kimyasal bağ türünün etkisi aşağıdaki örnekte görülebilir. Elmasta dört kimyasal bağın tümü kovalenttir ve sp 3-melezler, yani belirli bir atomun dört komşusu da aynı ve
ondan aynı mesafe d= 1.54 A˚) ve elmastaki karbonun kovalent yarıçapı
0,77 A˚'ye eşittir. Bir arsenik kristalinde, kovalent bağlarla bağlı atomlar arasındaki mesafe ( d 1 = 2.52 A˚), van der Waals kuvvetleriyle bağlı atomlar arasındakinden çok daha az ( d 2 = 3.12 A˚), bu nedenle As'ın kovalent yarıçapı 1.26 A˚ ve van der Waals'ı 1.56 A˚ olacaktır.
Atomik (iyonik) yarıçap da koordinasyon sayısındaki bir değişiklikle çok keskin bir şekilde değişir (bu, elementlerin polimorfik dönüşümleri sırasında gözlemlenebilir). Koordinasyon sayısı ne kadar küçükse, atomlar (iyonlar) ile boşluk doldurma derecesi o kadar düşük ve çekirdekler arası mesafeler o kadar küçük olur. Koordinasyon sayısındaki artışa her zaman çekirdekler arası mesafelerde bir artış eşlik eder.
Yukarıdakilerden, bir kimyasal bağın oluşumunda rol oynayan farklı elementlerin atomik (iyonik) yarıçaplarının, ancak aynı tip kimyasal bağın gerçekleştiği kristaller oluşturduklarında karşılaştırılabileceği ve oluşturulan kristallerdeki bu elementlerin aynı koordinasyon numaraları.
Atomik ve iyonik yarıçapların temel özelliklerini daha ayrıntılı olarak ele alalım.
Altında elementlerin kovalent yarıçapları Bir kovalent bağ ile birbirine bağlanan en yakın atomlar arasındaki denge çekirdekler arası mesafenin yarısını anlamak gelenekseldir.
Kovalent yarıçapların bir özelliği, aynı koordinasyon numarasına sahip farklı "kovalent yapılarda" sabit olmalarıdır. Z j. Ek olarak, kovalent yarıçaplar genellikle birbirine ek olarak bağlanır, yani A–B mesafesi, kovalent bağların varlığında A–A ve B–B mesafelerinin toplamının yarısıdır ve hepsinde aynı koordinasyon sayıları vardır. üç yapı.
Normal, tetrahedral, oktahedral, kuadratik ve lineer kovalent yarıçaplar vardır.
Bir atomun normal kovalent yarıçapı, bir atomun periyodik tablodaki yerine karşılık gelen sayıda kovalent bağ oluşturduğu duruma karşılık gelir: karbon için - 2, nitrojen için - 3, vb. Bu, farklı değerlerle sonuçlanır. çoklu (sıralı) bağlara bağlı olarak normal yarıçaplar (tek bağ, çift, üçlü). Hibrit elektron bulutları üst üste bindiğinde bağ oluşursa, tetrahedralden bahsederler.
(Z k = 4, sp 3-hibrit orbitaller), oktahedral ( Z k = 6, d 2sp 3-hibrit orbitaller), ikinci dereceden ( Z k = 4, dsp 2-hibrit orbital), doğrusal ( Z k = 2, sp-hibrit orbitaller) kovalent yarıçaplar.
Kovalent yarıçaplar hakkında aşağıdakileri bilmek yararlıdır (bir dizi element için kovalent yarıçap değerleri verilmiştir).
1. Kovalent yarıçaplar, iyonik olanlardan farklı olarak, küresel bir şekle sahip atomların yarıçapları olarak yorumlanamaz. Kovalent yarıçaplar, yalnızca kovalent bağlarla birleştirilmiş atomlar arasındaki çekirdekler arası mesafeleri hesaplamak için kullanılır ve aynı türden kovalent olarak bağlı olmayan atomlar arasındaki mesafeler hakkında hiçbir şey söylemez.
2. Kovalent yarıçapın değeri, kovalent bağın çokluğu ile belirlenir. Üçlü bağ, ikili bağdan daha kısadır, bu da tekli bağdan daha kısadır, bu nedenle üçlü bağın kovalent yarıçapı, daha küçük olan bir çift bağın kovalent yarıçapından daha küçüktür.
bekar. İlişkinin çokluk sırasının bir tamsayı olması gerekmediği akılda tutulmalıdır. Bağ rezonant ise (benzen molekülü, Mg2 Sn bileşiği, aşağıya bakınız) kesirli de olabilir. Bu durumda kovalent yarıçap, bağ çokluğunun tamsayı sıralarına karşılık gelen değerler arasında bir ara değere sahiptir.
3. Bağ karışık bir kovalent-iyonik yapıya sahipse, ancak bağın yüksek derecede kovalent bileşenine sahipse, o zaman kovalent yarıçap kavramı getirilebilir, ancak bağın iyonik bileşeninin etkisi üzerindeki etkisi değer ihmal edilemez. Bazı durumlarda, bu etki kovalent yarıçapta bazen 0,1 A˚'ye kadar önemli bir azalmaya yol açabilir. Ne yazık ki, bu etkinin büyüklüğünü çeşitli şekillerde tahmin etmeye çalışır.
davalar henüz sonuçlanmadı.
4. Kovalent yarıçapın değeri, kovalent bağ oluşumunda yer alan hibrit orbitallerin tipine bağlıdır.
iyon yarıçapı, elbette, en yakın iyonların çekirdekleri arasındaki mesafelerin toplamının yarısı olarak tanımlanamaz, çünkü kural olarak, katyonların ve anyonların boyutları keskin bir şekilde farklıdır. Ayrıca iyonların simetrisi küreselden biraz farklı olabilir. Bununla birlikte, gerçek iyonik kristaller için iyon yarıçapıİyona yaklaşan topun yarıçapını anlamak gelenekseldir.
İyonik yarıçaplar, iyonik kristallerdeki çekirdekler arası mesafelerin yaklaşık tahminleri için kullanılır. En yakın katyon ve anyon arasındaki mesafenin iyon yarıçaplarının toplamına eşit olduğu varsayılır. Bu tür kristallerde iyonik yarıçaplar açısından çekirdekler arası mesafelerin belirlenmesindeki tipik hata ≈0.01 A˚'dir.
Bireysel iyonların iyonik yarıçaplarının değerlerinde farklılık gösteren, ancak yaklaşık olarak aynı çekirdekler arası mesafelere yol açan birkaç iyonik yarıçap sistemi vardır. İyonik yarıçapların belirlenmesi ile ilgili ilk çalışma 1920'lerde V. M. Goldshmit tarafından yapılmıştır. İçinde yazar, bir yandan, X-ışını yapısal analizi ile ölçülen iyonik kristallerdeki çekirdekler arası mesafeleri ve diğer yandan, tarafından belirlenen iyonik yarıçap F- ve O2- değerlerini kullandı.
refraktometri yöntemi. Diğer sistemlerin çoğu ayrıca, kırınım yöntemleriyle belirlenen kristallerdeki çekirdekler arası mesafelere ve belirli bir iyonun iyonik yarıçapının bazı "referans" değerlerine dayanır. En çok bilinen sistemde
Pauling'e göre, bu referans değeri, O2− peroksit iyonunun iyonik yarıçapıdır, şuna eşittir:
1.40A˚. O2– için bu değer teorik hesaplamalarla uyumludur. En güvenilirlerinden biri olarak kabul edilen G. B. Bokiya ve N. V. Belov sisteminde, iyonik yarıçap O2– 1.36 A˚'ye eşit olarak alınır.
1970'lerde ve 1980'lerde, çekirdekleri bağlayan hat üzerindeki elektron yoğunluğunun minimumunun iyonların sınırı olarak alınması şartıyla, X-ışını yapısal analizi kullanılarak elektron yoğunluğunu ölçerek iyonların yarıçaplarını doğrudan belirleme girişimleri yapıldı. . Bu doğrudan yöntemin, katyonların iyonik yarıçaplarının aşırı tahmin edilen değerlerine ve anyonların iyonik yarıçaplarının hafife alınan değerlerine yol açtığı ortaya çıktı. Ek olarak, doğrudan bir yöntemle belirlenen iyonik yarıçap değerlerinin bir bileşikten diğerine aktarılamadığı ve toplamdan sapmaların çok büyük olduğu ortaya çıktı. Bu nedenle, bu tür iyonik yarıçaplar, çekirdekler arası mesafeleri tahmin etmek için kullanılmaz.
İyonik yarıçaplar hakkında aşağıdakileri bilmek yararlıdır (aşağıdaki tablolarda Bokiy ve Belov'a göre iyonik yarıçap değerleri verilmiştir).
1. Aynı elementin iyonlarının iyon yarıçapı, yüküne bağlı olarak değişir ve aynı iyon için koordinasyon sayısına bağlıdır. Koordinasyon sayısına bağlı olarak, tetrahedral ve oktahedral iyon yarıçapları ayırt edilir.
2. Birinin içinde dikey sıra, daha doğrusu, bir grup içinde, periyodik
sistem iyon yarıçapları aynı ücret elektronlar tarafından işgal edilen kabukların sayısı ve dolayısıyla iyonun boyutu arttığından, elementin atom numarasındaki bir artışla artar.
|
Yarıçap, A˚ |
3. Aynı periyottaki pozitif yüklü atom iyonları için iyonik yarıçaplar artan yük ile hızla azalır. Hızlı düşüş, iki ana faktörün bir yöndeki etkisiyle açıklanır: yükü artan atom numarası ile artan katyon tarafından “kendi” elektronlarının güçlü çekimi; katyonun yükündeki bir artışla, katyon ve onu çevreleyen anyonlar arasındaki etkileşimin kuvvetinde bir artış.
|
Yarıçap, A˚ |
4. Aynı periyottaki atomların negatif yüklü iyonları için, iyonik yarıçaplar arttıkça artar. negatif yük. Bu durumda önceki paragrafta tartışılan iki faktör zıt yönlerde hareket eder ve birinci faktör hakimdir (anyonun negatif yükündeki bir artışa iyonik yarıçapında bir artış eşlik eder), bu nedenle iyonik yarıçapta bir artış ile negatif yükteki bir artış, önceki durumdaki bir azalmadan çok daha yavaş gerçekleşir.
|
Yarıçap, A˚ |
5. Aynı eleman için, yani aynı başlangıç ile elektronik konfigürasyon, katyonun yarıçapı anyonunkinden daha küçüktür. Bunun nedeni, harici "ilave" elektronların anyon çekirdeğine çekiciliğinin azalması ve iç elektronlar nedeniyle tarama etkisinin artmasıdır (katyonun elektron eksikliği vardır ve anyonun fazlalığı vardır).
|
Yarıçap, A˚ |
6. Aynı yüklü iyonların boyutları periyodik tablonun periyodikliğini takip eder. Bununla birlikte, iyonik yarıçapın değeri, çekirdeğin yüküyle orantılı değildir. Z elektronların çekirdek tarafından güçlü bir şekilde çekilmesinden kaynaklanır. Ayrıca, aynı yüke sahip atom ve iyonların yarıçaplarının artmadığı, ancak artan atom numarası ile azaldığı serideki lantanitler ve aktinitler (sözde lantanit büzülmesi ve aktinit büzülmesi) bir istisnadır. periyodik bağımlılık.11
11 Lantanit büzülmesi ve aktinit büzülmesi, lantanitlerde ve aktinitlerde atom numarası dolgusunda bir artışla eklenen elektronların olmasından kaynaklanır. iç d ve f- ana ile kabuklar kuantum sayısı verilen periyodun ana kuantum sayısından daha az. Aynı zamanda kuantum mekaniksel hesaplamalara göre d ve özellikle f durumda elektron çekirdeğe olduğundan çok daha yakındır. s ve p büyük bir kuantum sayısına sahip belirli bir periyodun durumları, bu nedenle d ve f-elektronlar atomun iç bölgelerinde bulunur, ancak bu durumların elektronlarla doldurulması ( Konuşuyoruz enerji alanındaki elektronik seviyeler hakkında) farklı bir şekilde gerçekleşir.
metal yarıçapı bir metal elementin kristalleşen yapısında atom çekirdekleri arasındaki en kısa mesafenin yarısına eşit kabul edilir. Koordinasyon numarasına bağlıdırlar. Herhangi bir elementin metalik yarıçapını alırsak Z k \u003d birim başına 12, o zaman ne zaman Z k = 8, 6 ve 4 aynı elementin metalik yarıçapları sırasıyla 0.98 olacaktır; 0.96; 0.88. Metalik yarıçaplar toplamsallık özelliğine sahiptir. Değerlerini bilmek, intermetalik bileşiklerin kristal kafeslerinin parametrelerini yaklaşık olarak tahmin etmeyi mümkün kılar.
Metallerin atom yarıçapları aşağıdaki özelliklerle karakterize edilir (metallerin atom yarıçaplarının değerlerine ilişkin veriler bulunabilir).
1. Geçiş metallerinin metalik atom yarıçapları, geçiş metallerindeki daha büyük bağ kuvvetini yansıtan, geçiş olmayan metallerin metalik atom yarıçaplarından genellikle daha küçüktür. Bu özellik, periyodik sistemde geçiş gruplarının metalleri ve bunlara en yakın metallerin elektronik yapıya sahip olmasından kaynaklanmaktadır. d- kabuklar ve elektronlar d-Devletler kimyasal bağ oluşumunda görev alabilirler. Bağın güçlendirilmesi, kısmen bağın kovalent bileşeninin görünümünden ve kısmen de iyonik çekirdeklerin van der Waals etkileşiminden kaynaklanabilir. Demir ve tungsten kristallerinde, örneğin elektronlar d-durumlar bağlanma enerjisine önemli katkı sağlar.
2. Birinde dikey grup Yukarıdan aşağıya doğru hareket ettikçe, elektron sayısındaki art arda artışa bağlı olarak metallerin atom yarıçapları artar (elektronların kapladığı kabuk sayısı artar).
3. Aynı dönem içinde, daha doğrusu alkali metal geçiş metal grubunun ortasına, soldan sağa doğru atomik metal yarıçapları azalır. Aynı sırayla artan elektrik şarjı atom çekirdeği ve değerlik kabuğundaki elektron sayısında bir artış var. Atom başına bağlanan elektronların sayısındaki artışla, metalik bağ güçlendirilir ve aynı zamanda çekirdeğin yükündeki bir artış nedeniyle, çekirdek (iç) elektronların çekirdek tarafından çekimi artar, böylece metalik atom yarıçapının değeri azalır.
4. İlk yaklaşımdaki aynı periyottaki VII ve VIII gruplarının geçiş metalleri hemen hemen aynı metal yarıçaplarına sahiptir. Görünüşe göre, 5 ve 5'e sahip öğeler söz konusu olduğunda daha fazla d- elektronlar, nükleer yükte bir artış ve atom metalik yarıçapında bir azalmaya yol açan çekirdek elektronların çekiciliğinin ilişkili etkileri, atomda (iyonda) artan elektron sayısının neden olduğu etkilerle telafi edilir. metalik bir bağ oluşumuna katılır ve metalik yarıçapta bir artışa yol açar (elektronlar tarafından işgal edilen durumların sayısını arttırır).
5. Dördüncü periyottan beşinci periyoda geçiş sırasında meydana gelen geçiş elemanları için yarıçaplardaki artış (bakınız paragraf 2), geçiş elemanları için şu anda gözlenmez.
beşinci periyottan altıncı periyoda geçiş; bu son iki periyotta karşılık gelen (karşılaştırma dikey olarak gider) elementlerin metalik atom yarıçapları hemen hemen aynıdır. Görünüşe göre, bu, aralarında bulunan elemanların nispeten derin bir şekilde tamamlanması gerçeğinden kaynaklanmaktadır. f-kabuk, bu nedenle çekirdeğin yükündeki artış ve buna bağlı çekim etkileri, artan sayıda elektronla ilişkili etkilerden (lantanit kasılması) daha önemli hale gelir.
|
4 periyottan eleman |
Yarıçap, A˚ |
5. periyottaki eleman |
Yarıçap, A˚ |
6. periyottaki eleman |
Yarıçap, A˚ |
6. Genellikle, metalik yarıçaplar iyonik yarıçaplardan çok daha büyüktür, ancak istisnasız hepsi kovalent olanlardan daha büyük olmasına rağmen, aynı elementlerin kovalent yarıçaplarından çok önemli ölçüde farklı değildirler. Aynı elementlerin metalik atomik ve iyonik yarıçaplarının değerlerindeki büyük fark, kökenini neredeyse serbest iletim elektronlarına borçlu olan bağın güçlü olmadığı gerçeğiyle açıklanır (dolayısıyla gözlenen nispeten büyük atomlar arası mesafeler metal kafes). Metalik bağı bazı özel "rezonans" olarak düşünürsek, aynı elementlerin metalik ve kovalent yarıçaplarının değerlerinde önemli ölçüde daha küçük bir fark açıklanabilir. kovalent bağ.
Altında van der Waals yarıçapı Bir van der Waals bağı ile birbirine bağlanan en yakın atomlar arasındaki denge nükleer mesafesinin yarısını anlamak gelenekseldir. Van der Waals yarıçapları, soy gaz atomlarının etkin boyutlarını belirler. Ek olarak, tanımdan da anlaşılacağı gibi, van der Waals atom yarıçapı, aynı adı taşıyan, bir van der Waals bağı ile birbirine bağlanan ve farklı moleküllere ait olan en yakın atomlar arasındaki çekirdekler arası mesafenin yarısı olarak kabul edilebilir (örneğin, moleküler kristaller). Atomlar birbirlerine van der Waals yarıçaplarının toplamından daha az bir mesafede yaklaştıklarında, güçlü bir atomlar arası itme meydana gelir. Bu nedenle, van der Waals atom yarıçapları, farklı moleküllere ait atomların izin verilen minimum temaslarını karakterize eder. Bazı atomlar için van der Waals atom yarıçaplarının değerlerine ilişkin veriler bulunabilir).
Van der Waals atom yarıçaplarını bilmek, moleküllerin şeklini ve moleküler kristallerdeki paketlenmelerini belirlemeyi mümkün kılar. Van der Waals yarıçapları, van der Waals kuvvetlerinin zayıflığı ile açıklanan, yukarıda listelenen aynı elemanların tüm yarıçaplarından çok daha büyüktür.






