Hidrojenin spektral çizgilerinin dalga boyları. Mutlak minimum. Kuantum teorisi dünyamızı nasıl açıklar?
Bohr tarafından öne sürülen varsayımlar, hidrojen atomunun spektrumunu hesaplamayı mümkün kıldı ve hidrojen benzeri sistemler- şarjlı bir çekirdekten oluşan sistemler Z ve bir elektron (örneğin, He +, Li 2+ iyonları) ile teorik olarak Rydberg sabitini hesaplayın.
Bohr'u izleyerek, hidrojen benzeri bir sistemdeki elektronun hareketini, kendimizi dairesel durağan yörüngelerle sınırlayalım. Rutherford tarafından önerilen (208.1) m e v 2 /r=Zе 2 /(4 0 r 2) denklemini ve (210.1) denklemini birlikte çözerek, n'inci durağan yörüngenin yarıçapı için bir ifade elde ederiz:
burada n=1, 2, 3, ... . (22.1) ifadesinden, yörüngelerin yarıçaplarının tam sayıların kareleriyle orantılı olarak büyüdüğü sonucu çıkar.
Bir hidrojen atomu (Z=1) için, n=1'deki ilk elektron yörüngesinin yarıçapı denir. ilk Bohr yarıçapı(a), eşittir

gazların kinetik teorisine dayalı hesaplamalara karşılık gelir. Durağan yörüngelerin yarıçapları ölçülemediğinden, teoriyi test etmek için deneysel olarak ölçülebilen niceliklere yönelmek gerekir. Bu miktar, hidrojen atomları tarafından yayılan ve emilen enerjidir.
Hidrojen benzeri bir sistemdeki bir elektronun toplam enerjisi, kinetik enerjisinin (m e v 2/2) toplamıdır ve potansiyel enerjiçekirdeğin elektrostatik alanında (-Ze 2 / (4 0 r)):

(m e v 2/2 = 1 / 2 Ze2(4 0 r) olduğunu hesaba kattık (bkz.
(208.1)). n'inci sabit yörüngenin yarıçapı için nicelenmiş değerleri (22.1) dikkate alarak, elektron enerjisinin yalnızca aşağıdaki izin verilen ayrık değerleri alabileceğini elde ederiz:

eksi işareti, elektronun bağlı durumda olduğu anlamına gelir.
(22.3) formülünden, bir atomun enerji durumlarının, değere bağlı olarak değişen bir dizi enerji seviyesi oluşturduğu sonucu çıkar. P. tamsayı n Bir atomun enerji seviyelerini belirleyen ifadede (212.3) denir. Ana kuantum sayısı. n=1 olan enerji durumu temel (normal) durum; /r > 1 olan durumlar heyecanlı. Bir atomun temel durumuna karşılık gelen enerji düzeyine denir. temel (normal) seviye; diğer tüm seviyeler heyecanlı.
vermek n farklı tamsayı değerleri, hidrojen atomu için elde ederiz

(Z=1), formül (212.3)'e göre, olası enerji seviyeleri, Şek. 294. Artan hidrojen atomunun enerjisi n artar (negatif değeri azalır) ve enerji seviyeleri değere karşılık gelen sınıra yaklaşır n= . Hidrojen atomu böylece en düşük enerjiye sahiptir. (E 1 = - 13.55 eV) n= 1 ve maksimum (E 1 \u003d 0) n \u003d 'de (bir elektron bir atomdan çıkarıldığında). Bu nedenle, E =0 değeri şuna karşılık gelir: iyonlaşma atom (bir elektron koparın).
Bohr'un ikinci varsayımına göre (bkz. (210.2)), hidrojen atomunun (Z=1) durağan durumdan geçişi sırasında nİle birlikte daha yüksek enerji durağan duruma m daha düşük enerjili bir kuantum yayılır
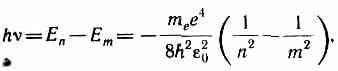
radyasyon frekansı nereden

R=m e e 4 /(8s 3 2 0 ).
Hesaplamada kullanma R evrensel sabitlerin modern değerleri, hidrojen atomu için ampirik formüllerde Rydberg sabitinin deneysel değeri ile çakışan bir değer elde ederiz (bkz. §209). Bu tesadüf, Bohr'un elde ettiği formülün doğruluğunu ikna edici bir şekilde kanıtlıyor.
(22.3) hidrojen benzeri bir sistemin enerji seviyeleri için.
Örneğin, formülde yerine koyma
(212) m=1 ve n=2, 3, 4, ..., Lyman serisini oluşturan ve uyarılmış seviyelerden elektron geçişlerine (n=2, 3, 4, .. .) ana (m=1) üzerindedir. Benzer şekilde, m=2, 3, 4, 5 yerine koyarken,
6 ve bunlara karşılık gelen değerler n § 209'da açıklanan Balmer, Paschen, Bracket, Pfund ve Humphrey serilerini (bazıları şematik olarak Şekil 294'te gösterilmiştir) elde ederiz. Bu nedenle, hidrojen atomunun spektrumunu nicel olarak açıklayan Bohr'un teorisine göre, spektral seriler, atomun verilenin üzerinde bulunan uyarılmış durumlardan belirli bir duruma geçişinden kaynaklanan radyasyona karşılık gelir.
Hidrojen atomunun absorpsiyon spektrumu çizgiye benzer, ancak sadece Lyman serisini içerir. Bohr'un teorisiyle de açıklanır. Serbest hidrojen atomları genellikle temel durumda olduğundan (en düşük enerjili durağan durum) n= 1), atomlara dışarıdan belli bir enerji verildiğinde, sadece geçişler gözlemlenebilir.
temel halden uyarılmış olanlara atomlar (Lyman serisi ortaya çıkar).
Bohr'un teorisi, atom fiziğinin gelişiminde önemli bir adımdı ve kuantum mekaniğinin yaratılmasında önemli bir adımdı. Bununla birlikte, bu teorinin iç çelişkileri vardır (bir yandan klasik fizik yasalarını uygularken, diğer yandan kuantum postülalarına dayanmaktadır). Hidrojen atomunun ve hidrojen benzeri sistemlerin spektrumlarını inceledi ve frekansları hesapladı. spektral çizgiler ancak yoğunluklarını açıklayamadı ve şu soruyu cevaplayamadı: neden belirli geçişler meydana geliyor? Bohr'un teorisinin ciddi bir eksikliği, onu hidrojen atomunu hemen takip eden en basit atomlardan biri olan helyum atomunun spektrumunu tanımlamak için kullanmanın imkansızlığıydı.
sınav soruları
Atomun nükleer modeli neden başarısız oldu?
Hidrojen atomunun çeşitli spektral çizgileri arasında Balmer serisi neden ilk incelenecekti?
m ve m sayılarının anlamı nedir? n genelleştirilmiş Balmer formülünde?
Bracket serisinin kısa dalga boyu sınırına karşılık gelen hidrojen atomunun radyasyon frekansı nedir?
Bohr'un postülalarının anlamını açıklayın. nasıl açıklıyorlar çizgi spektrumu atom? Şekil 1'deki eğrinin hangi kısımlarında. 293 elastiktir ve hangi elektronların atomlarla esnek olmayan çarpışmaları gözlemlenir?
Frank ve Hertz'in deneylerinden elde edilebilecek ana girdiler nelerdir? Bohr modelini kullanarak, bir hidrojen atomu n=3 ve n=4 olan durumlara girdiğinde görünebilecek spektral çizgileri belirtin.
Hidrojen atomunun ilk iki spektral serisinin her birinin dalga boyu ölçeğinde üç satırını çizin.
Hidrojen atomunun absorpsiyon spektrumu neden sadece Lyman serisini içeriyor? (22.3) formülünün E n =-13.55/n2 olarak yazılabileceğini gösterin, burada E elektron volt olarak ifade edilir.
Görevler
27.1. Hidrojen atomunun spektrumunun (Lyman serisi) ultraviyole serisindeki maksimum ve minimum foton enerjilerini belirleyin.
27.2. Balmer serisinin sınırına karşılık gelen dalga boyunu belirleyin.
27.3. Bohr teorisini kullanarak, bir hidrojen atomunun ikinci yörüngesi boyunca hareket eden bir elektronun yörüngesel manyetik momentini belirleyin.
27.4. Bohr teorisini kullanarak, dalga boyu =1.212 10 -7 m olan bir fotonun emisyonu ile uyarılmış bir durumdan (n=2) temel duruma geçişi sırasında bir elektronun yörüngesel mekanik momentumundaki değişimi belirleyin. L = h=1.05 10 -3 4 J s]
27.5. Hidrojen atomunun iyonlaşma potansiyelini belirleyin.
27.6. Hidrojen atomunun iyonlaşma enerjisinin E i \u003d 13.6 eV, bu atomun ikinci uyarma potansiyelini belirleyin.
27.7 . Hidrojen atomunun iyonlaşma enerjisinin £" = 13.6 eV olduğu gerçeğine dayanarak, Lyman serisinin en uzun dalga boyu çizgisine karşılık gelen foton enerjisini elektron volt cinsinden belirleyin.
* I. Rydberg (1854-1919) - İsveçli bilim adamı, spektroskopi alanında uzman.
Seyrekleştirilmiş gazların emisyon spektrumları (yani, tek tek atomların emisyon spektrumları) üzerine yapılan çalışmalar, her bir gazın, tek tek spektral çizgilerden veya yakın aralıklı çizgi gruplarından oluşan iyi tanımlanmış bir çizgi spektrumuna sahip olduğunu göstermiştir. En çok çalışılan, en basit atomun - hidrojen atomunun spektrumudur.
İsviçreli bilim adamı I. Balmer (1825-1898), o zamanlar bilinen hidrojen atomunun tüm spektral çizgilerini tanımlayan ampirik bir formül aldı. spektrumun görünür bölgesi:
nerede R "= 1.10 10 7 m -1 - devamlıRydberg . v = c/ olduğundan, formül
(209.1) frekanslar için yeniden yazılabilir:

burada R \u003d R "c \u003d 3.29 10 15 s -1 ayrıca Rydberg sabitidir.
(209.1) ve (209.2) ifadelerinden, farklı değerlerde farklılık gösteren spektral çizgilerin n, adı verilen bir grup veya dizi oluşturur. Balmer serisi. artış ile n dizinin çizgileri yaklaşıyor; anlam n= tanımlar dizi kenarlığı, sürekli spektrumun yüksek frekansların yanından bitişik olduğu.
Daha sonra (20. yüzyılın başında), hidrojen atomunun spektrumunda birkaç seri daha keşfedildi. AT spektrumun ultraviyole bölgesi bulunan Lyman serisi:

AT Kızılötesi spektrum ayrıca bulundu: Paschen serisi
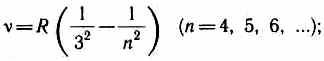
Braket serisi
Pfund serisi

Humphrey serisi

Hidrojen atomunun spektrumundaki yukarıdaki tüm seriler, adı verilen tek bir formülle tanımlanabilir. genelleştirilmiş Balmer formülü ile:

burada m verilen her seride sabit bir değere sahiptir, m= 1, 2, 3, 4, 5, 6 (seriyi tanımlar), n m+1'den başlayarak tamsayı değerleri alır (bu serinin tek tek satırlarını tanımlar).
Daha karmaşık spektrumların incelenmesi - alkali metallerin buharlarının spektrumları (örneğin, Li, Na, K) - bunların bir dizi düzensiz düzenlenmiş çizgi ile temsil edildiğini gösterdi. Rydberg, onları her biri Balmer serisinin çizgileri gibi yer alan üç seriye ayırmayı başardı.
Yukarıdaki seri formüller ampirik olarak seçilmiştir ve deneysel olarak çok yüksek doğrulukla doğrulanmış olmalarına rağmen, uzun süre teorik olarak doğrulanmamıştır. Yukarıdaki seri formüller, içlerinde tam sayıların şaşırtıcı tekrarı, Rydberg sabitinin evrenselliği, derin bir ifadeye tanıklık eder. fiziksel duyu klasik fizik çerçevesinde ortaya çıkarılması imkansız olan düzenlilikler buldu.
§210. Bohr'un varsayımları
Nitel olarak yeni bir atom teorisi - kuantum - inşa etmeye yönelik ilk girişim, 1913'te Danimarkalı fizikçi Niels Bohr (1885-1962) tarafından yapıldı. Çizgi tayfının ampirik yasalarını, Rutherford'un atomun nükleer modelini ve ışığın emisyonunun ve soğurulmasının kuantum doğasını tek bir bütünde birleştirme hedefini belirledi. Bohr teorisini iki varsayıma dayandırdı.
Bohr'un ilk varsayımı (durağan durum varsayımı): bir atomda, enerji yaymadığı durağan (zamanla değişmeyen) durumlar vardır. Bir atomun durağan durumları, elektronların hareket ettiği sabit yörüngelere karşılık gelir. Elektronların sabit yörüngelerdeki hareketine elektromanyetik dalgaların emisyonu eşlik etmez.
Bir atomun durağan durumunda, dairesel bir yörünge boyunca hareket eden bir elektron, koşulu sağlayan açısal momentumun ayrık nicelenmiş değerlerine sahip olmalıdır.
m e sanal gerçeklik n = h(n= 1, 2, 3, ...), (210.1)
nerede e elektronun kütlesi, v- r n , h=h/(2) yarıçapının n'inci yörüngesindeki hızı. Bohr'un ikinci varsayımı (frekans kuralı): bir elektron sabit bir yörüngeden diğerine hareket ettiğinde, bir foton enerji ile yayılır (absorbe edilir)
h =E n -E m , (210.2)
karşılık gelen durağan durumların enerji farkına eşittir ( E n ve E m - sırasıyla, atomun radyasyondan önceki ve sonraki durağan durumlarının enerjileri (absorpsiyon)). saat E m < E n E m > E n- absorpsiyonu (bir atomun daha yüksek enerjili bir duruma geçişi, yani bir elektronun çekirdekten daha uzak bir yörüngeye geçişi). Olası ayrık frekanslar kümesi v = = (E n -E m )/h kuantum geçişleri ve atomun çizgi spektrumunu belirler.
Spektral serileri en iyi çalışılan serilerdir. Rydberg'in formülüne iyi uyuyorlar:
1 λ = R (1 n ′ 2 − 1 n 2) (\displaystyle (\frac (1)(\lambda ))=R\left((\frac (1)((n")^(2))) -(\frac (1)(n^(2)))\sağ)),nerede R= 109 677 cm -1 hidrojen için Rydberg sabitidir, n'- serinin ana seviyesi.
Ana enerji seviyesine geçişler sırasında ortaya çıkan spektral çizgilere denir. rezonans, başka - ast.
Spektral Serilerin Fiziği
Hidrojen atomu, çekirdeğin etrafında dönen bir elektrondan oluşur. Elektron ile çekirdeğin protonu arasındaki elektromanyetik kuvvet, bir kümenin varlığına neden olur. kuantum durumları her biri kendi enerjisine sahip elektron. Bu durumlar Bohr modelinde ayrı elektron yörüngeleri olarak gösterilir. Her yörünge veya durum bir n tamsayısına karşılık gelir.
Spektral emisyon, bir elektron daha yüksek bir enerji durumundan daha düşük bir enerji durumuna geçtiğinde meydana gelir. Düşük enerji durumu n' ve yüksek enerji durumu n ile gösterilir. Yayılan fotonun enerjisi, iki durum arasındaki farka karşılık gelir. Her bir durumun enerjisi her zaman aynı olduğu için aralarındaki fark da her zaman aynıdır ve geçiş her zaman sabit enerjili bir foton yayacaktır.
Spektral çizgiler seri olarak n' ile gruplandırılmıştır. Çizgiler, Yunanca harflerdeki en düşük frekanstan sırayla adlandırılır. Örneğin, 2 → 1 satırı Lyman-alpha (Ly-α) satırı ve 7 → 3 Paschen-delta (Pa-δ) olarak adlandırılır.
Hidrojen 21 santimetrelik çizgi gibi bu serilere girmeyen çizgilere sahiptir. Bu çizgiler, atomdaki aşırı ince geçişler gibi daha nadir süreçlere karşılık gelir. İnce yapı, göreli etkilerden dolayı iki veya daha fazla yakın kümelenmiş ince çizgiler olarak görünen tek biçimli spektral çizgileri de gerektirir.
Lyman serisi
açık T. Lyman 1906'da. Serinin tüm hatları ultraviyole aralığındadır. Seri, Rydberg formülüne karşılık gelir. n' = 1 ve n = 2, 3, 4, … ; L a = 1216 Å çizgisi, hidrojenin rezonans çizgisidir. Seri sınırı 911.8 Å'dir.
Balmer serisi
1885 yılında I. Ya. Balmer tarafından keşfedilmiştir. Serinin ilk dört satırı görünür aralıktadır ve dalga boyları için ampirik bir formül öneren ve buna dayanarak bu serinin ultraviyole bölgesinde diğer çizgilerin varlığını öngören Balmer'den çok önce biliniyordu. Seri, Rydberg formülüne karşılık gelir. n' = 2 ve n = 3, 4, 5, … ; satır H α = 6565 Å , seri sınırı - 3647 Å .
Paschen Serisi
Brackett Serisi
1922'de F.S. Bracket tarafından keşfedildi. Serinin tüm hatları yakın kızılötesi aralığındadır. Seri, Rydberg formülüne karşılık gelir. n' = 4 ve n = 5, 6, 7, … ; çizgi B a = 40 522 A. Seri sınırı 14.588 Å'dir.
Pfund serisi
A. G. Pfund tarafından 1924 yılında keşfedilmiştir. Serinin çizgileri yakın (ortanın bir kısmı) kızılötesi aralığındadır. Seri, Rydberg formülüne karşılık gelir. n' = 5 ve n = 6, 7, 8, … ; çizgi Pf α = 74 598 Â. Seri sınırı 22.794 Å'dir.
Hidrojenin spektral çizgileri
Görünür aralıktaki hidrojenin çizgi spektrumunu açıklamaya yönelik ilk girişim, 1885 yılında öğretmen ve matematikçi Johann Balmer (1825-1898) tarafından yapılmıştır. Balmer, frekansların f Spektrumun görünür kısmındaki bu çizgiler formülle tanımlanabilir.
f ~(1/2 2)-(1/n 2).
~ sembolü orantılı anlamına gelir, yani aşağıda tartışılan sabit bir faktörün varlığını gösterir. Bu denklemde n - 2'den büyük bir tam sayı, yani 3, 4, 5 vb.
Spektrumun görünen kısmındaki bu çizgilere Balmer serisi denir. Daha sonra, spektrumun ultraviyole ve kızılötesi kısımlarında çizgiler keşfedildi. Keşiflerinden sonra sırasıyla Lyman ve Paschen serileri olarak adlandırıldılar - Amerikalı fizikçi ve spektroskopist Theodor Lyman (1874–1954) ve Alman fizikçi Louis Carl Heinrich Friedrich Paschen (1865–1947). 1888'de İsveçli fizikçi ve spektroskopist Johannes Rydberg (1854–1919), bir hidrojen ark lambasının emisyonunda ve güneş ve yıldız ışığının absorpsiyon spektrumunda görülebilen tüm tayf çizgilerini tanımlayan bir formül yayınladı. Hidrojenin spektral çizgilerinin frekansı için Rydberg formülü şu şekildedir:
f =R H [(1/ n 1 2)-(1/n 2 2)],
nerede n 1, 1'den başlayan tam sayılardır ve n 2 - daha büyük olması gereken diğer tam sayılar n bir . Anlam n 1 =1 Lyman serisini verir, n 1 \u003d 2 - Balyalayıcı, n 1 \u003d 3 - Pashen'in serisi.
Devamlı R H, hidrojen atomu için Rydberg sabiti olarak adlandırılır. onun değeri R H=109677.6 santimetre-1 ve dalga sayısı ile ifade edilir ( santimetre-bir). Rydberg formülünde bu değeri kullanırken, tamsayılarla belirlenen spektral çizgilerin frekansları n 1 ve n 2 dalga sayıları ile ifade edilir. Sonucu hertz'e çevirmek için, ortaya çıkan değeri ışık hızıyla, yani 3 10 10 ile çarpmanız gerekir. santimetre/saniye. Bir spektral çizginin dalga boyunu bulmak için, dalga sayısında ifade edilen frekansın tersini almak, yani birini dalga sayısında ifade edilen frekansa bölmek gerekir. örneğin, eğer n 1 =2 ve n 2 =3, o zaman
f =R H[(1/2 2)-(1/3 2)] = R H[(1/4)-(1/9)] = 1.52 10 4 santimetre -1
dalga sayısı olarak ifade edilen frekanstır. Bu sayının karşılığı 6.56 10 -5 santimetre = 656 10 -9 m = = 656 nm. Yani dalga boyu 656 nmŞekil 2'de gösterilen Balmer serisindeki kırmızı çizgidir. 9.2.
Şekil tartışırken 8.7 Kutudaki bir parçacık için kuantum enerji seviyeleri arasındaki optik geçişlerin ayrıklığını zaten tartışmıştık. Şek. 8.7, bir kutudaki bir parçacığın durumları arasındaki geçişleri gösterir. n =1 dönüşür n =2 ve n =1 dönüşür n =3. Bu bağlamda, hidrojen atomundaki optik geçişlerin, tam sayılara bağlı ayrı bir frekans kümesine karşılık gelebilmesi büyük bir sürpriz olmamalıdır. Ancak 1888'de Rydberg formülü elde edildiğinde, Rydberg formülüne göre tamsayılar aracılığıyla birbirine bağlanan enerji seviyelerini nicelleştirme fikrine daha 12 yıl vardı. hidrojen atomu ile ilişkili enerji seviyeleri.
Pirinç. 9.3. Lyman ve Balmer serisi hidrojen emisyon çizgilerini oluşturan bazı enerji seviyelerinin diyagramları. Aşağıya doğru oklar, örneğin bir ark lambasında olduğu gibi, ışığın hidrojen tarafından nasıl yayıldığını gösterir. Şekil l'de koyu çizgiler veren absorpsiyon üzerine. 9.2, oklar yukarıyı gösteriyordu. Seviyeler arasındaki aralıklar, ölçeklendirilmek üzere geleneksel olarak gösterilir.
Lyman ve Balmer serilerine yol açan bazı enerji seviyeleri Şekil 2'de gösterilmektedir. 9.3. Burada aşağıyı gösteren oklar, bir hidrojen ark lambasında gözlenen emisyon çizgilerine karşılık gelir. Başlangıçta daha yüksek bir enerji seviyesinde olan hidrojen atomu, sonunda daha düşük bir seviyeye geçer. Enerji, bir foton emisyonu yoluyla korunur. Enerjiyi korumak için, bir fotonun orijinal, daha yüksek, daha yüksek arasındaki farka eşit bir enerji taşıması gerekir. enerji seviyesi ve daha düşük bir enerji son seviyesi. Mümkün olan en küçük değer n Rydberg formülünde 1, 1'e eşittir ve n 2 daha fazla olmalı n bir . 2–1 olarak etiketlenen ok, seviyeden gelen emisyona karşılık gelir. n =2 seviye başına n =1.
Lyman serisindeki bir sonraki en büyük radyasyon enerjisi, seviyeden gidilerek elde edilir. n =3 seviye başına n =1. Rydberg formülünde, bir sonraki olası değer için n 1 eşittir 2 ve n 2 daha fazla olmalı n bir . Bu nedenle, Balmer serisindeki emisyon hattının en düşük enerjisi 3–2 olarak işaretlenmiştir. Bir hidrojen atomu seviyesinde olduğunda n =3, seviyeye gider n =2, enerji korunumu 656 dalga boyuna sahip bir fotonun emisyonu ile sağlanır. nm. Işık hidrojen atomlarına düştüğünde, aynı diyagramda yukarıyı gösteren oklarla gösterilebilecek olan absorpsiyon meydana gelir.






