Proceset e transferimit të masës: nxjerrja, nxjerrja
Klasifikimi i proceseve të transferimit të masës.
Proceset e transferimit masiv, në të cilat produktet fillestare dhe përfundimtare shkëmbejnë lëndën, organizohen për të marrë produkte në një formë të kontrolluar, të cilat përmbahen në lëndët e para në përqendrime të vogla. Këto procese kryhen në aparatet e transferimit masiv.
Proceset e transferimit të masës klasifikohen sipas tre karakteristikave kryesore: gjendja e grumbullimit të substancës, mënyra e kontaktit fazor dhe natyra e ndërveprimit të tyre.
Klasifikimi i proceseve të transferimit të masës sipas gjendjes së grumbullimit të fazave kontaktuese në figurën (1).
Ju mund të imagjinoni gjashtë kombinime të ndryshme të tre fazave të mundshme në dy: gaz - lëng, gaz - i ngurtë, lëng - lëng, lëng - i ngurtë, gaz - gaz, i ngurtë - i ngurtë. Dy kombinimet e fundit praktikisht nuk përdoren në pajisjet e transferimit masiv.
Kur dy përbërës të ndashëm përmbahen njëkohësisht në gaz dhe
fazat e lëngëta, ndarja e tyre është e mundur në proceset e distilimit (distilimit) dhe korrigjimit.
Distilimi (distilimi) - ndarja e përzierjeve të lëngshme në fraksione të ndryshme në përbërje.
Korrigjimi është një metodë për ndarjen e përzierjeve të lëngshme që përbëhen nga disa përbërës. Korrigjimi bazohet në avullimin e përsëritur të një lëngu dhe kondensimin e avujve të tij ose në një avullim të vetëm të një përzierjeje të ndjekur nga kondensimi në shumë faza të përbërësve. Përdoret korrigjimi p.sh. , në industrinë e alkoolit për të marrë alkool të korrigjuar. Pra, nëse një tretësirë e alkoolit etilik në ujë avullohet pjesërisht, atëherë përqendrimi i alkoolit në fazën e avullit do të jetë më i madh se në lëngun e mbetur dhe sesa në tretësirën origjinale. Nëse pas kësaj avulli kondensohet, atëherë do të përftohen dy lëngje me përqendrime të ndryshme të alkoolit në to. Përsëritja e këtij procesi mund të sigurojë përqendrime gjithnjë e më të larta të alkoolit, d.m.th. shkallë gjithnjë e më e lartë e ndarjes së komponentëve.
(Fig.1) Klasifikimi i proceseve të transferimit të masës sipas gjendjes së grumbullimit të trupave punues: G-gaz; Zh - lëng; TV.t - një trup i fortë.
Në rastin kur komponenti është i tretshëm në secilën nga fazat, të cilat janë vetë të pazgjidhshme në njëra-tjetrën, procesi i kalimit të komponentit nga faza e gaztë në atë të lëngët quhet thithje (thithje vëllimore), dhe proces i kundërt. quhet desorbim. Për shembull, nëse një përzierje e amoniakut dhe ajrit vihet në kontakt me ujin, një pjesë e amoniakut do të kalojë në ujë (uji thith amoniakun) dhe ajri do të pastrohet pjesërisht prej tij. Në procesin e kundërt, kur një zgjidhje ujore e amoniakut bie në kontakt me ajrin, një pjesë e amoniakut do të kalojë në këtë të fundit - do të ndodhë një proces desorbimi.
Nëse gjatë kalimit të njërit prej përbërësve nga faza në fazë në njërën prej tyre sasia e lëngut (tretësit) zvogëlohet (rritet), ky proces quhet tharje (lagështim).P.sh., kur qumështi bie në kontakt me ajrin e nxehtë. uji kalon në ajër. Në të njëjtën kohë, qumështi thahet dhe ajri lagështohet.
Kalimi nga një gjendje e ngurtë në një gjendje të gaztë pa kaluar nëpër fazën e lëngshme quhet sublimim. Në rastin e veçantë kur si gazi ashtu edhe lënda e ngurtë janë vetëm bartës të lëngut të vendosur në poret dhe në sipërfaqen e lëndës së ngurtë, kalimi i tij në avull kur furnizohet nxehtësia quhet tharje ose tharje në ngrirje. Në veçanti, te perimet, lagështia në gjendje të lëngshme ose të avullit bartet në sipërfaqe dhe më pas hiqet nga sipërfaqja, d.m.th. procesi tipik i tharjes. Procesi i kundërt - kalimi i përbërësve të përzierjes nga faza e gaztë në atë të ngurtë - quhet procesi i përthithjes (thithjes sipërfaqësore) ose procesi i shkëmbimit të joneve.Shembull i adsorbimit është depërtimi i grimcave të avullit të ujit. nga përzierja e tij me ajrin në kokrrizat e xhelit të silicës dhe mbajtja e tyre në poret e tij; ndërsa ajri është tharë.
Nëse faza e gazit është një përzierje e disa përbërësve që absorbohen në shkallë të ndryshme nga adsorbuesi, është e mundur të ndahet përzierja me adsorbim të pjesshëm.
Kur ndahen në një sistem lëng-lëng, dy lëngje të pazgjidhshëm në njëri-tjetrin vihen në kontakt, secila prej të cilave shpërndan përbërësin e ndarë në një masë të ndryshme. Shembull: ndarja e alkoolit etilik dhe izobutanolit duke kontaktuar përzierjen e tyre me ujë. Në këtë rast, izobutanoli kalon në mënyrë aktive në ujë. Nëse pas kësaj tretësira ujore e izobutanolit ndahet nga përzierja e tij me alkool etilik, në të cilën sasia e izobutanolit është reduktuar ndjeshëm, atëherë procesi mund të përsëritet me një kontakt të ri të përzierjes së ndarë të izobutanolit dhe alkoolit me ujë të freskët dhe izobutanol. prej tij mund të merret një përqendrim më i lartë. Ky proces quhet nxjerrje e lëngshme.
Substancat veçanërisht të pastra fitohen në proceset e kristalizimit të pjesshëm. Kristalet që kanë rënë nga tretësira dhe kanë një sasi më të vogël ndotësish se tretësira origjinale, treten në tretës i pastër dhe kristalizohet sërish nga tretësira. Në këtë rast, një pjesë e ndotësve ndahen sërish.
Nëse të dyja fazat në sistemin lëng-ngurtë janë substanca neutrale, dhe përbërësi i ndarë kalon nga e ngurtë në të lëngshme, procesi i ndarjes quhet ekstraktim në sistemin e ngurtë. lëngun e trupit. Një shembull i këtij procesi është kalimi i lëngut nga panxhari në ujë.
Procesi i kundërt i transferimit të një substance nga faza e lëngshme në sipërfaqen e lëndës së ngurtë ndodh në proceset e përthithjes dhe shkëmbimeve të tjera, dhe në vëllim - në proceset e nxjerrjes së kundërt.Shembull i adsorbimit është pastrimi i ujit nga papastërtitë. kur kalon nëpër një grykë të karbonit të aktivizuar që thith këto papastërti. Një shembull i nxjerrjes së shpinës do të ishte kriposja e mishit ose peshkut.
Sipas metodës së kontaktit fazor, proceset e transferimit të masës ndahen në procese me kontakt të drejtpërdrejtë fazor, kontakt përmes membranave dhe pa kufi fazor të dukshëm.Nëse ndërmjet fazave vendosen membrana, atëherë procesi i ndarjes i përket fushës së teknologjive të membranës.
Sipas natyrës së ndërveprimit të fazave, proceset dhe aparatet e transferimit të masës ndahen në periodike dhe të vazhdueshme. Përveç kësaj, në proceset e vazhdueshme, është e mundur të organizohen lëvizje të komponentëve me rrjedhje direkte, kundërrryme, tërthore dhe të kombinuar.Në varësi të organizimit specifik të procesit, një sërë ndryshimesh në përqendrimet e substancave të përfshira në procesi përgjatë gjatësisë së aparatit dhe në kohë janë të mundshme. Diversiteti i tyre rritet duke kombinuar proceset.
Llogaritjet e aparatit të transferimit të masës
Llogaritjet inxhinierike të aparateve të transferimit të masës përdorin varësi fenomenologjike. Ata përdorin gjerësisht koeficientët empirikë të lidhjes ndërmjet forca lëvizëse procesi dhe reaksionet ndaj tij pa depërtim të thellë në thelbin fizik ose kimik të dukurive. Forca lëvizëse e proceseve të transferimit të masës është ndryshimi në përqendrime.
Përqendrimi i tretësirës (përzierjes). Sasia relative e një përbërësi të caktuar në një tretësirë quhet përqendrimi i tij. Tretësirat me përqendrim të lartë të një lënde të tretur quhen të koncentruara dhe ato me përqendrim të ulët quhen të holluara.
Më së shpeshti përdoren mënyrat e mëposhtme të shprehjes së përqendrimeve:
Masa - numri i njësive të masës së një tretësie në 100 njësi të masës së një tretësire. Për shembull, një tretësirë 15% e klorurit të natriumit është një tretësirë, 100 g prej së cilës përmban 15 g klorur natriumi dhe 85 g ujë;
molari volumetrik - numri i moleve të një lënde të tretur për njësi vëllimi të tretësirës;
masë molare - numri i moleve të një lënde të tretur në 1000 g tretës;
mol relativ (fraksion mol) - raporti i numrit të moleve të substancës në fjalë me numrin e përgjithshëm të moleve të të gjitha substancave në tretësirë.
Procesi i transferimit të masës do të ndalet sapo të arrihet përqendrimi i ekuilibrit në sistem.
Bilanci fazor.Kushti kryesor për baraspeshën e proceseve në aparatin e bartjes së masës është baraspesha e fazave. Kur gjendja e substancave devijon nga ekuilibri, për shembull, si rezultat i një ndryshimi të parametrave termodinamikë, realizohet një proces kalimtar i rivendosjes së ekuilibrit (parimi i Le Chatelier).
Gjendja e ekuilibrit i bindet rregullit të fazës Gibbs, të diskutuar në hyrje, sipas të cilit numri i shkallëve të lirisë S të një sistemi termodinamik ekuilibër, mbi të cilin veprojnë vetëm temperatura dhe presioni nga faktorë të jashtëm, është i barabartë me numrin e komponentëve K. minus numrin e fazave Ф plus dy:
S=K-F +2.
Numri i shkallëve të lirisë, siç dihet, është numri i variablave të pavarur (temperatura, presioni, përqendrimi), për çdo vlerë të të cilave është i mundur ekuilibri termodinamik. Për shembull, në një sistem që përbëhet vetëm nga avujt e ujit (numri i përbërësve K = 1, numri Ф = 1), kemi S = 1-1 + 2 = 2. Dy parametra të këtij sistemi, për shembull, temperatura dhe presioni, mund të ndryshojë në një gamë të gjerë pa shkelur ekuilibrin, pra pa formimin e një faze të re. Nëse në të njëjtin sistem shfaqet një fazë e re - një lëng, atëherë numri i fazave do të bëhet i barabartë me Ф=2 dhe pastaj S=1-2+2=1. Në këtë sistem, në një gjendje ekuilibri, vetëm një parametër, për shembull, temperatura, mund të ndryshojë në mënyrë të pavarur. Më pas presioni do të vendoset në një nivel që korrespondon me temperaturën e caktuar. Kjo do të ndodhë ose për shkak të avullimit shtesë të avullit nga lëngu, ose si rezultat i kondensimit të një pjese të avullit.Një sistem i tillë quhet i lagësht. avull i ngopur. Nëse në të njëjtin sistem shfaqet një fazë e tretë - një trup i ngurtë (akulli), atëherë Ф=3, S=0. Në këtë rast, sistemit i hiqet çdo liri, d.m.th. mund të realizohet vetëm me një vlerë rreptësisht fikse prej presioni dhe temperatura - në parametrat kritikë që korrespondojnë pikë e trefishtë në diagramin e gjendjes së avullit të ujit.
Në sistemet me shumë komponentë, përveç temperaturës dhe presionit, përqendrimet e përbërësve ndryshojnë. Për përzierje binare të ujit – alkoolit kemi K=2, S=2-2=2, d.m.th. kushtet e ekuilibrit mund të realizohen me një ndryshim arbitrar në dy parametra. Në presionin atmosferik, këto parametra mund të jenë temperatura dhe përqendrimi i një ose dy komponentëve, ose presioni dhe përqendrimi i njërit prej përbërësve. Gjendjet e ekuilibrit të një sistemi binar paraqiten si një varësi e përqendrimit të një komponenti nga përqendrimi i një tjetri, kur presioni dhe temperatura e përzierjes janë parametra të varur, dhe gjithashtu si një varësi e përqendrimit të njërit dhe përqendrimit të komponenti tjetër i lidhur me të, në një temperaturë arbitrare.
Diagrami izobar, në koordinata, ka dy kthesa - kurba e vlimit dhe kurba e kondensimit. Izotermi në të korrespondon me përqendrimin e lëngut të vluar dhe përqendrimin e kondensatës nga avulli i përbërjes. Sasia e fazave të avullit dhe të lëngshme është në përpjesëtim të zhdrejtë me raportin e segmenteve. Pika në diagram korrespondon me avull i mbinxehur përbërjen e temperaturës.
Ekuacionet e bilancit material. Ekuacioni i linjës së punës.
Le të shqyrtojmë bilancin e materialit në aparatin e transferimit të masës duke përdorur shembullin e një aparati kundërrrymë me lartësi H, i cili është i instaluar vertikalisht dhe ku dy faza të përbërësve lëvizin drejt njëra-tjetrës.
Nga lart, m 2H kg / s lëng me një përqendrim fillestar të përbërësit të dytë C 2H hyn në aparat, dhe m 2H kg / s lëng me një përqendrim përfundimtar të C 2K hiqet nga poshtë. Nga poshtë, m 1H kg/s gaz me përqendrim fillestar të përbërësit të parë C 1H hyn dhe m 1K kg/s gaz me përqendrim përfundimtar C 1K hiqet nga lart.
Duke neglizhuar humbjet në kushte stacionare, mund të shkruajmë ekuacionet e bilanceve materiale:
m 2H + m 1H = m 2K + m 1K;
m 2H C 2H + m 1H C 1H = m 2K C 2K + m 1K C 1K .
m 2 C 2 + m 1H C 1H = m 2K C 2K + m 1 C 1.
Ekuacioni i fundit quhet ekuacioni i vijës së punës të procesit. Ai vendos një marrëdhënie midis përqendrimeve të komponentit të dëshiruar në të gjitha seksionet e aparatit. Ky është ekuacioni i një vije të drejtë me një pjerrësi
m 2 / m 1.
Ekuacioni i linjës së punës paraqitet si një vijë e drejtë AB, dhe vijat e ekuilibrit për proceset e kalimit nga faza e gaztë në lëng dhe nga lëngu në të gaztë janë përkatësisht 0 (E) G - F dhe 0 (E) F. - G. Sipas vendndodhjes relative të linjave të punës dhe ekuilibrit mund të gjykohet në drejtimin e kalimit të substancës. Nëse linja e punës është mbi vijën e ekuilibrit, atëherë përqendrimi i përbërësit të parë në gaz është më i lartë se ai i ekuilibrit, dhe në lëng është më i ulët se ai i ekuilibrit, d.m.th. C 11> (C 11 *) g - f; Nga 21< (С 21 *) г _ ж.
Në këtë rast, komponenti do të kalojë nga faza e gaztë në lëng.
Koeficienti i transferimit të masës. Forca lëvizëse në procesin e transferimit të masës është ndryshimi i përqendrimeve në thelbin e rrjedhës dhe në kufirin e fazës së AC, dhe reagimi i sistemit është rrjedha masive e substancës së transferuar. Marrëdhënia e tyre në varësinë fenomenologjike paraqitet si:
DM = ? C.
Ku? - konstante.
Kur llogaritni pajisjet nga një konstante? caktoni një faktor që karakterizon vetë pajisjen. Kjo është sipërfaqja e transferimit të masës F. Atëherë do të kemi:
DM=? C? F; ? F=?.
E perhershme? quhet koeficienti i transferimit të masës. Për aparatet e difuzionit të prodhimit të panxharit të sheqerit
? \u003d 1,5 - 10- 7 ... 8,5 10- 6 m / s.
Varësia e kritereve.
Kriteri Prandtl në proceset e difuzionit karakterizon ndryshimin në profilet e shpejtësisë dhe përqendrimit në to, i cili shfaqet për faktin se proceset e relaksimit të përqendrimit mungojnë në proceset e vendosjes së shpejtësive të rrjedhës në aparate. 5 vonesa mund të jetë mjaft domethënëse. Llojet specifike të kritereve të ekuacioneve të transferimit të masës (të dhëna si shembull):
Nu D \u003d 3,8- 10 -4 Re l, 38 Pr D
për të llogaritur koeficientin e transferimit të masës nga grimcat e materialeve bimore;
0,0066 Re Pr 0,5
për të llogaritur koeficientin e transferimit të masës në një kolonë të ujitur me film në Re W = 4...80.
NUMRI I NJËSIVE TË TRANSFERIMIT
Konsideroni procesin e transferimit të komponentit të ekstraktueshëm të fazës së parë në të dytën.Fazat tregohen me shifrën e parë të indeksit në përqendrimin C. Në hyrje të aparatit, që korrespondon me pikën A, përqendrimi i substancës në faza e parë është C 1n.
Në grafik, rreshti AB, i cili është ekuacioni C 1 =f(C 2), është vija e punës e procesit. Linja e punës e procesit vendos një marrëdhënie midis përqendrimeve të komponentit, i cili përdoret për llogaritjen e procesit, në çdo seksion të aparatit.
Kurba C 1 \u003d f (C 2) është një vijë ekuilibri, gjendja e ekuilibrit të çdo përqendrimi të çdo përbërësi në fazën e parë (për shembull, alkooli në fazën e gazit) korrespondon me një përqendrim të përcaktuar rreptësisht të të njëjtit përbërës në Faza e dytë (për shembull, alkooli në fazën e dytë të lëngshme). Çdo temperaturë dhe presion ka kurbën e vet të ekuilibrit.
Nëse supozojmë se faza e parë që hyn në aparat vjen në ekuilibër në fazën e parë me fazën e dytë që tërhiqet, atëherë përqendrimi i fazës së parë do të jetë i barabartë me C 12.
etj................
Proceset teknologjike, shpejtësia e rrjedhës së të cilave përcaktohet nga shpejtësia e transferimit të një substance nga një fazë në tjetrën, quhen transferim masiv. dhe aparatet në të cilat zhvillohen këto procese janë aparate të shkëmbimit të masës .
Proceset e transferimit të masës zënë një vend të veçantë midis proceseve kimike dhe teknologjike.
Në shumicën e impianteve të prodhimit të industrisë kimike, aparatet e transferimit të masës dhe të reagimit lidhen sipas skemës së mëposhtme
(Fig. 4.1).
Oriz. 4.1. Skema e procesit teknologjik me një aparat transferimi masiv
Lënda e parë hyn në reaktor, ku pjesërisht shndërrohet në produkte reaksioni, që nga viti reaksionet kimike për të marrë produktet e synuara mos vazhdoni deri në fund. Përzierja e produkteve të reaksionit dhe lëndëve të para që largohen nga reaktori, duke mos marrë pjesë në reaksion, dërgohet në pajisjen e ndarjes së transferimit të masës. Në pajisje, përzierja ndahet në produkte të reaksionit dhe lëndë të para të pa reaguara, të cilat kthehen në reaktor dhe produktet e reaksionit ushqehen për përpunim të mëtejshëm.
Nga kjo rezulton se ekziston një lidhje e ngushtë teknologjike midis aparateve reaksionale dhe ndarëse. Ligji i kësaj lidhjeje është: aq më e ulët është ngarkesa në aparatin e reaksionit, d.m.th. sa më i ulët të jetë shndërrimi i lëndës së parë në produkte të reaksionit, aq më e madhe është ngarkesa në aparatin e ndarjes dhe anasjelltas.
Kombinimi optimal i ngarkesave në aparatin reaksionar dhe ndarës siguron kosto minimale të prodhimit. Prandaj, baza e prodhimit kimik - reaktori - funksionon në mënyrë optimale vetëm në kombinim me një aparat ndarës që funksionon në mënyrë optimale. Në këtë drejtim, funksionimi i aparatit të shkëmbimit masiv në industrinë kimike nuk është më pak i rëndësishëm sesa funksionimi i vetë reaktorit.
Në aparatin ndarës mund të kryhen një sërë procesesh. Kryesorja dhe më e rëndësishmja prej tyre janë përthithja, korrigjimi, nxjerrja, kristalizimi, adsorbimi, tharja, proceset e shkëmbimit të joneve dhe ndarja e membranës.
Absorbimiështë një proces ndarjeje i bazuar në thithjen selektive të gazeve ose avujve nga absorbuesit e lëngshëm - adsorbentët. Ky proces përdoret në shumë industri në të cilat është e nevojshme të nxirret çdo substancë ose kompleks substancash nga një përzierje gazesh. Gjatë procesit të përthithjes kalimi i një lënde ose grupi substancash nga një fazë gazi (avulli) në një lëng desorbimi.
korrigjimi quhet procesi i ndarjes së një përzierjeje të lëngjeve që ka temperatura të ndryshme zierja në presionin e duhur, në përbërës të pastër ose të pasuruar si rezultat i lëvizjes së kundërt të rrjedhave të avullit dhe lëngjeve. Procesi ka rëndësi të madhe në ato industri që kërkojnë ndarje të pjesshme ose të plotë të përzierjeve homogjene të lëngshme në përbërës të pastër ose grupe të tyre. Gjatë procesit të korrigjimit, kalimi i një lënde ose grupi substancash nga një fazë e lëngshme në një fazë avulli dhe anasjelltas.
Nxjerrja quhet një proces ndarjeje i bazuar në nxjerrjen e një lënde ose grupi substancash të tretura në një lëng nga një lëng tjetër që nuk përzihet ose përzihet vetëm pjesërisht me të parin. Procesi përdoret kur një substancë e tretur ose një grup substancash duhet të nxirret nga një tretësirë. Në këtë proces ka kalimi i një lënde nga një fazë e lëngshme në një fazë tjetër të lëngshme.
Adsorbimiështë një proces ndarjeje i bazuar në thithjen selektive të gazeve, avujve ose substancave të tretura në lëngje nga një absorbues i ngurtë poroz - një adsorbent i aftë për të thithur një ose më shumë substanca nga përzierja e tyre . Procesi përdoret në ato industri ku është e nevojshme të nxirret një ose një substancë tjetër nga një përzierje e gazrave, avujve ose substancave të tretura. Në këtë proces substancat kalojnë nga faza e gaztë ose e lëngshme në të ngurtë. Procesi i kundërt quhet desorbimi.
Procesi i shkëmbimit të joneveështë një proces i nxjerrjes së një substance nga një tretësirë, bazuar në aftësinë e disave të ngurta(shkëmbyesit e joneve) për të shkëmbyer jonet e tyre të lëvizshme për jonet e substancës së nxjerrë. Procesi përdoret për nxjerrjen e substancave nga tretësirat. , me përqendrim të ulët. Në këtë proces substancat kalojnë nga faza e lëngët në të ngurtë.
tharje quhet procesi i largimit të lagështisë nga materialet e ngurta të lagështa duke e avulluar atë. Procesi është i nevojshëm për ato industri në të cilat substancat natyrore të lagështa duhet të dehidratohen përpara përpunimit të tyre ose substancat e gatshme në fazën e fundit të prodhimit. Në këtë proces ka kalimi i lagështisë nga një material i ngurtë i lagësht në fazën e avullit ose gazit.
Kristalizimi quhet procesi i ndarjes, i bazuar në ndarjen e një lënde në formën e një faze të ngurtë (kristale) nga faza e lëngët. Procesi zhvillohet në ato raste kur kërkohet të merren substanca me pastërti të lartë. Në këtë proces ka kalimi i një lënde nga një fazë e lëngshme në një fazë të ngurtë. Procesi i kundërt - shpërbërje.
Ndarja e membranës bazohet në aftësinë e disa filmave të hollë (membranave gjysmë të përshkueshme) për të kaluar disa substanca dhe për të mbajtur të tjera. Në këtë proces substancat kalojnë nëpër një membranë gjysmë të përshkueshme nga lëngu ose gazi origjinal në fazën e lëngshme ose të gazit pas membranës.
Proceset teknologjike, shpejtësia e rrjedhës së të cilave përcaktohet nga shpejtësia e kalimit të një lënde (mase) nga një fazë në tjetrën, quhen transferim masiv, dhe aparati për kryerjen e këtyre proceseve quhet aparat i transferimit të masës.
Klasifikimi i proceseve të transferimit të masës
Në teknologjinë ushqimore, përdoren kryesisht proceset e mëposhtme të transferimit të masës: midis gazit (avullit) dhe lëngut, gazit dhe të ngurtë, si dhe midis dy fazave të lëngshme.
Korrigjimi– ndarja e një përzierjeje të lëngshme, e përbërë nga përbërës me paqëndrueshmëri të ndryshme, në përbërës të pastër ose të pasuruar, si rezultat i ndërveprimit kundër rrymës së avullit dhe rrjedhave të lëngut. Rektifikimi përdoret në prodhimin e alkoolit etilik dhe ndarjen e vajrave esencialë. Gjatë distilimit dhe korrigjimit, disa substanca kalojnë nga lëngu në avull, të tjerët nga avulli në lëng.
Absorbimi- thithja selektive e gazeve ose avujve nga absorbuesit e lëngshëm - absorbuesit.
Procesi përdoret në prodhimin e ujërave të gazuara, birrës dhe disa llojeve të verës, sulfimit të mushtit dhe lëngut të rrushit për të parandaluar fermentimin, ngopjen e lëngut të panxharit me formimin e karbonatit të kalciumit të patretshëm.
Adsorbimi- thithja selektive e gazeve, avujve ose substancave të tretura në lëngje nga sipërfaqja e një absorbuesi të ngurtë - adsorbent.
Procesi përdoret për pastrimin e verës, pastrimin e solucioneve ujë-alkool nga ngjyrat dhe papastërtitë e tjera, për çngjyrosjen e lëngjeve dhe shurupeve në prodhimin e sheqerit.
Procesi i kundërt - desorbimi- kryhet pas adsorbimit dhe përdoret shpesh për të rigjeneruar substancën e përthithur nga absorbuesi.
Tharje- heqja e lagështisë nga materialet e lagura me avullim. Ky proces përdoret në të gjitha degët e industrisë ushqimore, ku substancat natyrore me lagështi duhet të dehidratohen para se të përpunohen, ose produkti i përfunduar duhet të dehidrohet. Gjatë procesit të tharjes, lagështia shndërrohet në avull ose gaz.
Kristalizimi- procesi i ndarjes së fazës së ngurtë në formë kristalesh nga tretësirat ose shkrirjet.
Procesi përdoret në prodhimin e sheqerit dhe glukozës kristalore, acidit citrik, glukanatit të natriumit. Në procesin e kristalizimit, substanca lëviz në sipërfaqen e kristalit dhe kalimi i tij nga gjendje e lëngët në kristalore. Procesi i kundërt - kalimi i një faze të ngurtë kristalore në një tretësirë quhet shpërbërje.
Konceptet bazë
Kalimi i një lënde (ose disa substancave) nga një fazë në tjetrën përmes kufirit të tyre në drejtim të arritjes së ekuilibrit quhet transferim masiv, ose transferim masiv.
Kalimi i një lënde nga një fazë në një kufi fazor ose në drejtim i kundërt, pra brenda një faze, quhet transferim masiv.
Në shumicën e rasteve, tre substanca përfshihen në transferimin në masë: një substancë (ose substanca) shpërndarëse që përbën fazën e parë; një agjent shpërndarës (ose agjentë) që përbëjnë fazën e dytë; substancë (ose substanca) e shpërndarjes që kalon nga një fazë në tjetrën.
Le ta quajmë fazën e parë G (faza e gazit) , e dyta L (faza e lëngshme) , dhe substancën e shpërndarë M. Meqenëse të gjitha proceset e konsideruara të transferimit të masës janë të kthyeshme, substanca e shpërndarë mund të kalojë nga faza G në L dhe anasjelltas, në varësi të përqendrimit të kësaj lënde në fazat e shpërndarjes.
Le të supozojmë se substanca që do të shpërndahet është fillimisht vetëm në fazë G dhe ka përqendrim. Në fazë L
në momentin fillestar nuk ka asnjë substancë të shpërndarë dhe rrjedhimisht përqendrimi i saj në këtë fazë 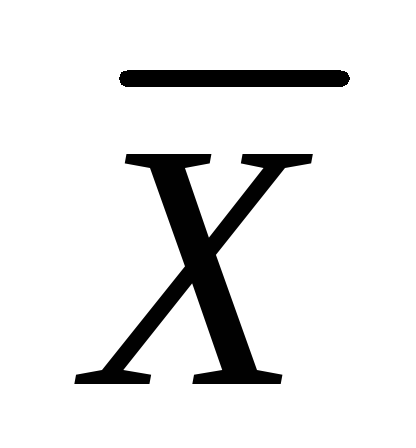 = 0.
= 0.
Nëse fazat e shpërndarjes vihen në kontakt, transferimi i substancës së shpërndarë nga faza G në fazë L, dhe në këtë të fundit do të gjendet një përqendrim i caktuar i substancës së shpërndarë 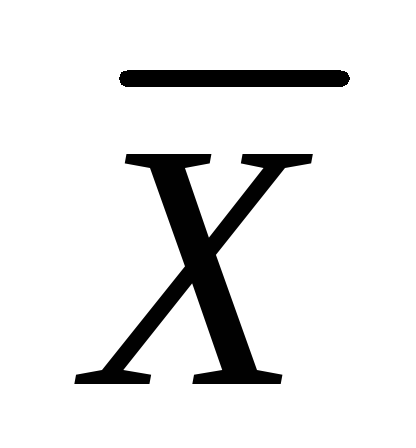 > 0. Që nga shfaqja e materies M në fazë L fillon dhe kalimi i tij i kundërt në fazë G, por deri në një moment të caktuar numri i grimcave M, duke kaluar për njësi të kohës përmes njësisë së sipërfaqes së kontaktit nga faza G në fazë L, më i madh se numri i grimcave që kalojnë nga faza L në G; rezultati përfundimtar i procesit është tranzicioni M jashtë fazës G në fazë L.
> 0. Që nga shfaqja e materies M në fazë L fillon dhe kalimi i tij i kundërt në fazë G, por deri në një moment të caktuar numri i grimcave M, duke kaluar për njësi të kohës përmes njësisë së sipërfaqes së kontaktit nga faza G në fazë L, më i madh se numri i grimcave që kalojnë nga faza L në G; rezultati përfundimtar i procesit është tranzicioni M jashtë fazës G në fazë L.
Pas një periudhe të caktuar kohe, shkalla e kalimit të substancës së shpërndarë nga faza G në fazë L dhe anasjelltas bëhen të njëjta. Një gjendje e tillë quhet ekuilibri . Në gjendjen e ekuilibrit, në çdo rast specifik, ekziston një marrëdhënie e përcaktuar rreptësisht midis përqendrimeve të substancës së shpërndarë, të cilat, në ekuilibrin e sistemit, quhen i balancuar . Përqendrimet e ekuilibrit janë shumë të rëndësishme për përcaktimin e shpejtësisë së rrjedhës së një procesi.
Faqe 1
Proceset e transferimit të masës karakterizohen nga një ndërfaqe e fazës së lirë, e cila ndryshon ndjeshëm nga ndërveprimi i rrjedhave - natyra stokastike e proceseve. Llogaritja e komponentit stokastik bën të mundur përcaktimin e shpërndarjes së përqendrimeve të përbërësve përgjatë gjatësisë së zonës së kontaktit, gjë që ndikon në parametrat gjeometrikë të aparatit.
Proceset e transferimit të masës në sistemet dyfazore gaz-lëng përdoren gjerësisht në industrinë e naftës dhe gazit. Procese të tilla janë ndarja dhe stabilizimi i naftës dhe kondensatës, trajtimi i gazit thithës dhe rigjenerimi i glikoleve. Modele të palëvizshme të këtyre proceseve janë ndërtuar sipas një diagrami të vetëm koncepti, një version i thjeshtuar i të cilit diskutohet në këtë paragraf.
Proceset e transferimit të masës (korrigjimi, thithja, nxjerrja, etj.) janë ndër më intensivet me energji dhe metale: më shumë se 50% e energjisë shpenzohet për zbatimin e tyre, rreth 15% e masës totale të pajisjeve të linjës teknologjike është aparate kolone.
Proceset e transferimit të masës, si rregull, kryhen jashtë këtyre pajisjeve në komunikimet e instalimeve dhe zhvillohen në mënyrë spontane, dhe efikasiteti i tyre përcaktohet nga parametra të rastësishëm të lëvizjes së emulsionit. Në këto kushte, një numër i konsiderueshëm pikash me predha brongttymum jo-thiottymtt hyjnë në aparatin e vendosjes, duke rritur efikasitetin e funksionimit të tij.
Proceset e transferimit të masës - shpërbërja, kristalizimi, tharja, distilimi, korrigjimi, përthithja, nxjerrja, desorbimi, të cilat janë transferimi i një lënde brenda një faze ose ndërmjet fazave, i shkaktuar nga një gradient i përqendrimeve të saj dhe vazhdon pa ndryshim. përbërje kimike. Për ta bërë këtë, shërbeni: kristalizues, tharëse, distilues, ndreqës, absorbues, ekstraktues, desorber.
Proceset e transferimit të masës të përdorura gjerësisht për pastrimin e substancave dhe ndarjen e përzierjeve janë shumë të ndryshme. Ato ndryshojnë gjendja e grumbullimit fazat ndërvepruese, natyra e lëvizjes së tyre në aparat, prania e proceseve paralele të transferimit të nxehtësisë. Kjo është arsyeja për shumëllojshmërinë e gjerë të pajisjeve të transferimit në masë të përdorura në praktikë. Në një farë mase, metodat e llogaritjes së tyre gjithashtu ndryshojnë. Ky kapitull diskuton proceset më të zakonshme të transferimit të masës: thithjen, desorbimin dhe nxjerrjen e lëngjeve në kolonat kundërrrymës, distilimin e vazhdueshëm të sistemeve binare dhe shumëkomponente, adsorbimin periodik dhe aparatet me një shtrat fiks sorbent.
Proceset e transferimit të masës shoqërohen me kalimin e një substance nga një fazë në tjetrën si rezultat i difuzionit.
Proceset e transferimit të masës shpesh kombinohen me procese mekanike dhe hidromekanike. Për shembull, shpërbërja e plotë ose e pjesshme e pjesshme e produkteve të ngurta kombinohet me shtypjen. Një kombinim i tillë përshpejton ndjeshëm procesin e shpërbërjes, dhe në rastin e shpërbërjes së pjesshme, bën të mundur rritjen e ndjeshme të shkallës së nxjerrjes së përbërësve të synuar nga lënda e parë.
Proceset e transferimit të masës, si rregull, kryhen jashtë këtyre pajisjeve në komunikimet e instalimeve dhe zhvillohen në mënyrë spontane, dhe efikasiteti i tyre përcaktohet nga parametra të rastësishëm të lëvizjes së emulsionit. Në këto kushte, një numër i konsiderueshëm pikash me predha të blinduara të pashkatërruara hyjnë në pajisjet e vendosjes, duke ulur efikasitetin e tyre. Seksioni i shkëmbimit të masës së drop-former është projektuar për të kryer transferimin efektiv të masës midis globulave të ujit të formimit dhe pikave të ujit që përmbajnë një agjent demulsifikues (me një probabilitet prej 0 999 ose më shumë) në kushte që sigurojnë ekzistencën e pikave të një të caktuar. madhësia në rrjedhë.
Ministria e Arsimit dhe Shkencës e Federatës Ruse
Shtetit institucion arsimor më të larta
Arsimi profesional
"Shteti i Volgogradit Universiteti Teknik»
TEST
sipas disiplinës: Proceset dhe pajisjet
Studenti Abramov Sergej Ivanovich
Grupi EZK-379k
Kontrolloi punën ________________________________
Volgograd 2012
Pyetja numër 1 Karakteristikat e përgjithshme dhe klasifikimi proceset e transferimit të masës
Pyetja nr. 30 Skema e përthithjes me riqarkullim të lëngut dhe gazit
Bibliografi
1.Karakteristikat e përgjithshme dhe klasifikimi i proceseve të transferimit të masës Proceset e transferimit masiv janë procese në të cilat rolin kryesor e luan transferimi i materies nga një fazë në tjetrën. Forca lëvizëse e këtyre proceseve është ndryshimi potencialet kimike. Si çdo proces tjetër, forca lëvizëse transferimi i masës karakterizon shkallën e devijimit të sistemit nga gjendja e ekuilibrit dinamik. Brenda kësaj faze, substanca transferohet nga një pikë me një përqendrim më të lartë në një pikë me një përqendrim më të ulët. Prandaj, në llogaritjet inxhinierike, forca lëvizëse zakonisht shprehet afërsisht në termat e diferencës së përqendrimit, gjë që thjeshton shumë llogaritjet e proceseve të transferimit të masës. Proceset e transferimit masiv përdoren gjerësisht në industri: për ndarjen e përzierjeve homogjene të lëngshme dhe të gazta, për t'i përqendruar ato për të mbrojtur mjedisin mjedisi natyror(kryesisht për pastrim Ujërat e zeza dhe gazrat jashtë). Klasifikimi dhe karakteristikat e përgjithshme. Më të përhapurit janë proceset e mëposhtme të transferimit masiv: Absorbimi Distilimi dhe korrigjimi Nxjerrja (i lëngët) Adsorbimi Shkëmbimi i joneve Shpërbërja dhe nxjerrja nga trupat e ngurtë Kristalizimi Proceset e membranës Në të gjitha proceset e listuara më sipër, gjëja e zakonshme është kalimi i një substance (ose substancash) nga një fazë në tjetrën. Procesi i kalimit të një substance (ose disa substancave) nga një fazë në tjetrën në drejtim të arritjes së ekuilibrit quhet transferim masiv. Transferimi i lëndës brenda fazës - nga faza në kufirin e fazës ose anasjelltas - nga ndërfaqja në fazë - quhet transferim masiv (për analogji me procesin e transferimit të nxehtësisë brenda fazës - transferimi i nxehtësisë). Proceset e transferimit të masës zakonisht janë të kthyeshme. Për më tepër, drejtimi i kalimit të një substance përcaktohet nga përqendrimet e substancës në faza dhe kushtet e ekuilibrit. Ekuacioni kryesor kinetik i proceseve të transferimit të masës është ekuacioni i transferimit të masës, i cili bazohet në ligjet e përgjithshme kinetike të proceseve kimike dhe teknologjike. Shpejtësia e procesit [në kg/(m2 c)] është e barabartë me forcën lëvizëse Δ, pjesëtuar me rezistencën R: dM/dF = Δ/ R, ku dM është sasia e një lënde që ka kaluar nga një fazë në tjetrën për njësi të kohës; dF - sipërfaqja e kontaktit fazor. Duke treguar 1/R = K, marrim ekuacionin bazë të transferimit të masës dM =K Δ dF Koeficienti K - koeficienti i transferimit të masës (për analogji me procesin e transferimit të nxehtësisë) karakterizon shkallën e procesit të transferimit të një substance nga një fazë në tjetrën. Dimensioni i koeficientit të transferimit të masës: [K]= = [kg/s Δ· m2] d.m.th., koeficienti i transferimit të masës K tregon se sa e substancës së shpërndarë kalon nga faza në fazë për njësi të kohës përmes një njësie të sipërfaqes së kontaktit të fazës me një forcë lëvizëse të barabartë me unitetin. Dimensioni i forcës lëvizëse Δ mund të jenë të ndryshme, dhe dimensioni i K varet prej tij. Zakonisht, ekuacioni i transferimit të masës përdoret për të përcaktuar sipërfaqen e kontaktit fazor F, dhe në bazë të kësaj sipërfaqeje, përmasat e aparatit të transferimit të masës. M / (K Δ)
Proceset e transferimit të masës ndahen në: transferim mase në sisteme me kufi fazor të lirë (gaz-lëng, avull-lëng, lëng-lëng); transferimi i masës në sisteme me një sipërfaqe kontakti fazore fikse (sistemet gaz - të ngurtë, avull - të ngurtë, të lëngët - të ngurtë); transferimi i masës përmes ndarjeve gjysmë të përshkueshme (membranave). Proceset që karakterizohen nga një kufi i fazës së lirë përfshijnë procese të tilla të përdorura gjerësisht në teknologji si thithja, desorbimi, distilimi dhe korrigjimi, dhe nxjerrja e lëngshme. Në këto procese, kufiri i kontaktit të fazës është zakonisht i lëvizshëm, madhësia e sipërfaqes së kontaktit të fazës varet nga situata hidrodinamike, e cila dallon ndjeshëm mekanizmin e transferimit të masës në sistemet me një kufi fazor të lirë nga mekanizmi i transferimit për sistemet me fazë të ngurtë. Proceset e transferimit të masës me një kufi fazor të lirë ndahen në dy grupe sipas parimit të pjesëmarrjes së fazave në transferimin masiv. Grupi I - procese në të cilat marrin pjesë të paktën 3 substanca: 1) një substancë shpërndarëse (ose substanca) që përbëjnë fazën e parë Fu (për shembull, kur amoniaku absorbohet nga uji nga një përzierje amoniak-ajër, ajri nuk merr pjesë drejtpërdrejt në transferimin masiv); 2) një agjent shpërndarës (ose substanca) që përbëjnë fazën e dytë Fx (uji në ky shembull); 3) substanca e shpërndarë M, e cila kalon nga një fazë në tjetrën (proceset e përthithjes, desorbimit, nxjerrjes). Grupi I i proceseve (distilimi dhe korrigjimi) janë procese në të cilat substancat që përbëjnë fazat marrin pjesë në proceset e transferimit të masës dhe nuk mund të konsiderohen si bartës të substancës së shpërndarë. Drejtimi i procesit, forca lëvizëse e tij varen nga raporti i përqendrimeve të punës dhe ekuilibrit. Përqendrimet e fazave që marrin pjesë në proceset e transferimit të masës mund të kenë dimensione të ndryshme (kg/kg, kmol/m3, etj.). Zakonisht, përbërja e fazave shprehet në fraksione masive ose mole, përqendrime relative ose vëllimore. Nr. Përqendrimi Përcaktimi i përqendrimit të komponentit А Në fazën e lëngshme në fazën e gazit (avullit) ), kg А/kg ВХУ5Përqendrimi molar vëllimor, kmol А/m3 (А+В)СхСу6Përqendrimi në masë në vëllim, kg А/m3 (А +В)СхСу Marrëdhënia midis përbërjes së fazave në ekuilibër: y* = f(x) ku y* është fraksioni mol relativ i ekuilibrit të komponentit të synuar në fazën e gazit (avullit) Grafiku i kësaj varësie është vija e ekuilibrit. y* = mr x, ku mr = y*/x është koeficienti i shpërndarjes Koeficienti i shpërndarjes është raporti i përbërjeve të fazave në ekuilibër. Koeficienti i shpërndarjes -tg α- pjerrësia e vijës së ekuilibrit taνα=m R Balancat materiale të proceseve të transferimit të masës varen nga mënyra se si ato kryhen. Të dallojë ndërveprimin e vetëm, të vazhdueshëm dhe hapësinor të fazave. Në aparatet e transferimit të vazhdueshëm të masës, procesi mund të ndodhë me kontakt të vazhdueshëm fazor (për shembull, në aparatet thithëse të tipit filmik, të cilat janë në thelb një shkëmbyes nxehtësie me guaskë dhe tub, përgjatë sipërfaqeve të brendshme të tubave të të cilëve rrjedh një film i lëngshëm , dhe gazi lëviz drejt këtij lëngu). Në këtë rast, përqendrimet e substancës së shpërndarë në faza ndryshojnë në mënyrë monotonike. Fig.1. Për përgatitjen e një bilanc materiali me kontakt të vazhdueshëm të fazave në kushtet e kundërrrjedhjes (a) dhe rrjedhës së përparme (b) Me një kundërrrymë të vazhdueshme, e cila përdoret më shpesh në teknologji (Fig. 1, a), balanca materiale për një seksion arbitrar të aparatit me një shteg pafundësisht të vogël shprehet nga relacionet e mëposhtme: un> uk - fraksion mol i komponentit në fazën e gazit хк> хн - fraksion mol i komponentit në fazën e lëngshme M g \u003d G (un-uk) - shkalla molare e rrjedhës së komponentit që ka kaluar nga faza e gazit M W = L(xk-xn) - shpejtësia molare e rrjedhjes së komponentit që ka kaluar në fazën e lëngshme. Meqenëse i njëjti përbërës kalon nga faza e gazit në lëng, atëherë M g \u003d M f (un-uk) = L(xk-xn) (7.8) Për një seksion arbitrar të aparatit, në të cilin përbërjet aktuale të komponentit të synuar janë X dhe Y, ekuacioni i bilancit të materialit për pjesën e sipërme të aparatit: (un-y) = L(xk-x) Me një ndryshim të vogël në vlerat e G dhe L përgjatë lartësisë së aparatit Raporti quhet ekuacioni i vijës së punës (ekuacioni i vijës së përqendrimeve të punës) i një procesi të vazhdueshëm të transferimit të masës kundërrrymës. Ai shpreh marrëdhënien midis përbërjeve të fazave ndërvepruese në një seksion arbitrar të aparatit. Me L/G = konst. vija e punës është e drejtë. Nëse L/G ≠ konst., atëherë vija e punës devijon nga një vijë e drejtë. Ekzistojnë dy lloje të transferimit të masës në rrjedhë - molekulare dhe konvektive. Difuzioni molekular është kalimi i një lënde të shpërndarë në një mjedis të palëvizshëm nga shtresat e brendshme e kësaj faze (të parë) në ndërfaqe dhe, pasi e ka kaluar atë, shpërndarja në të gjithë vëllimin e fazës tjetër, e cila është në kontakt me të parën. Është pasojë e lëvizjes termike të molekulave (joneve, atomeve), e cila rezistohet nga forcat e brendshme të fërkimit. Difuzioni molekular përshkruhet nga ligji i parë i Fick-ut: dM= -DdFd τ ds /dp Për të gjithë sipërfaqen e difuzionit F, ligji i parë i Fick-ut shprehet si M = -D Fτ ds /dp ku D është koeficienti i difuzionit molekular; F - sipërfaqja normale me drejtimin e difuzionit; ds/dp është gradienti i përqendrimit të substancës për njësi gjatësi të shtegut n të substancës difuzuese; shenja minus shoqërohet me një ulje të gradientit të përqendrimit ds/dp përgjatë gjatësisë së rrugës së difuzionit. Koeficienti i difuzionit molekular D varet nga natyra e substancës difuzuese. Prandaj, nuk lidhet me dinamikën e procesit dhe karakterizon aftësinë e një substance për të depërtuar në çdo medium. Le të gjejmë dimensionin e saj nga shprehja: [D]= [m2/s], prej nga rezulton se koeficienti i difuzionit molekular D tregon se sa substancë shpërndahet për njësi të kohës nëpër një sipërfaqe njësi në një gradient përqendrimi të barabartë me një. Koeficienti i difuzionit molekular D është analog me difuzivitetin termik α.
Vlerat D gjenden në librat e referencës ose llogariten. Koeficienti i difuzionit varet nga temperatura (rritet me rritjen e temperaturës) dhe për gazrat - nga presioni (me presion në rritje, D g zvogëlohet). Për një mjedis të gaztë D g ≈ 1 cm2/s, për një mjedis të kondensuar (të lëngshëm) h ≈ 1 s/ditë, nga ku rrjedh se difuzioni molekular në lëngje, dhe aq më tepër në të ngurta- procesi është shumë i ngadaltë. Transferimi konvektiv (difuzioni konvektiv) karakterizohet nga lëvizja (transferimi) i materies duke lëvizur grimcat e rrjedhës në kushte të lëvizjes së fazës turbulente. Transferimi konvektiv i materies nën veprimin e pulsimeve turbulente nganjëherë quhet difuzion turbulent. Transferimi konvektiv i masës është procesi i transferimit të një substance gjatë lëvizjes së një lëngu ose gazi. Ky proces ndodh sikur mekanikisht - grimcat makrovolumi të një lëngu ose gazi rrjedhin. Transferimi i masës, si dhe konvekcioni, ndahet në natyror dhe të detyruar ose të detyruar. Me transferimin natyror të masës, lëvizja e lëngut ndodh për shkak të ndryshimit në densitet në pika të ndryshme lëng, dhe kur detyrohet - për shkak të shpenzimit të energjisë për lëvizjen e rrjedhës nga jashtë, duke përdorur një pompë, trazues, etj. Është e qartë se transferimi natyror i masës është një proces i ngadaltë dhe është i rrallë në teknologji, por shpesh është një proces shoqërues i transferimit të detyruar të masës. Për analogji me ligjin empirik të ftohjes së Njutonit (ose ekuacionin e transferimit të nxehtësisë), ekuacioni i transferimit të masës ka formën e mëposhtme: M = β (хgr - x) dFdτ ku β është koeficienti i proporcionalitetit-koeficienti i transferimit të masës. Me një proces të qëndrueshëm për të gjithë sipërfaqen F të transferimit të masës në τ = 1 s, ekuacioni merr formën M = β F (хgr-х). Për fazën Fu, ekuacioni i transferimit të masës do të jetë i ngjashëm me ekuacionin M = β F (хgr-х), por me zëvendësimin përkatës të përqendrimeve. Dimensioni i koeficientit të transferimit të masës: [β] = [M / F (y-ugl)] = [m / s]. Koeficienti i transferimit të masës, ndryshe nga koeficienti i transferimit të masës, karakterizon shpejtësinë e transferimit të lëndës brenda fazës me konvekcion dhe difuzioni molekular njëkohësisht. 2. Skema e përthithjes me riqarkullim të lëngut dhe gazit THYSHTJA e gazeve (lat. Absorptio, nga absorbeo-absorb), thithja volumetrike e gazeve dhe e avujve.<#"30" src="doc_zip3.jpg" />
ku Р°2 - presioni<#"34" src="doc_zip4.jpg" />
ku KH është koeficienti Henry, i cili ndryshon me temperaturën. Nëse thithja kryhet nën presion, por x * 2 -> 0, tretshmëria e gazit mund të llogaritet duke përdorur ekuacionin Krichevsky - Kazarnovsky: ku Kf - koeficienti. tretshmëria fizike, e barabartë me KH në x2 -> 0 dhe P -> -> 0; f*2 - paqëndrueshmëria e gazit; -vëllimi molar i pjesshëm i gazit të tretur në fazën e lëngët në hollim të pafund; R është konstanta universale e gazit; Presioni Po1 avujt e ngopur <#"20" src="doc_zip7.jpg" />(0,05-0,1) fraksioni molar (tretësirat e holluara), pastaj në presione të ulëta Ekuacioni i Sechenov është i vlefshëm: ku koeficienti A1,2, i pavarur nga përbërja e tretësirës, përthithja Oriz. 1. Varësia e tretshmërisë x2* e disa gazeve<#"27" src="doc_zip10.jpg" />
ku është efekti termik i tretjes së thithjes së gazit. Nëse tretësira nxehet gjatë përthithjes,. Ndërsa temperatura ndryshon, zakonisht ose mbetet konstante ose ndryshon pak. Tretshmëria e një gazi në një tretës të përzier (që përmban përbërës me polaritet të ulët) mund të vlerësohet nga relacioni: ku KN.si, KN.N- Koeficienti Henry resp. për një gaz në një përzierje tretësish dhe për tretësirat e këtij gazi në përbërës të pastër tretës; - koeficienti i aktivitetit të përbërësve të tretësit (fraksionet molore i referohen një përzierje tretësish pa gaz të tretur). Disa të dhëna për tretshmërinë e gazeve<#"18" src="doc_zip17.jpg" />dhe potenciali i absorbimit Lennard-Jone Këta parametra mund të përdoren për të përafruar tretshmërinë e gazeve<#"32" src="doc_zip19.jpg" />
ku është tretshmëria në 1 m3 gaz, e reduktuar në kushte normale (20 °C, 0,1 MPa) për 1 m3 absorbues; kv - konstante Boltzmann; P0, T0 - respektivisht presion<#"31" src="doc_zip21.jpg" /> Më poshtë janë vlerat e parametrave të potencialit Lennard-Jones (në K) për gazet<#"24" src="doc_zip23.jpg" />dhe lëngje: Efekti termik i shpërbërjes së gazit AH ndryshon në mënyrë lineare me rritjen; respektivisht tretshmëria e gazeve pak të tretshëm<#"21" src="doc_zip27.jpg" />, kryesisht He, Ne, H2, N2, CO, Ar, O2 dhe NO, rritet me rritjen e temperaturës (me përjashtim të tretësirave ujore) dhe tretshmërinë e gazeve shumë të tretshëm<#"21" src="doc_zip28.jpg" />zvogëlohet. Shembuj tipikë për tretësirat e holluara pafundësisht janë paraqitur në fig. 2. Tretshmëria e gazeve si H2S, COS, SO2, HC1, NH3, C12 është zakonisht shumë më e lartë se ajo e llogaritur nga ekuacioni (1), për shkak të ndërveprimit specifik me molekulat e tretësit. Me thithjen kimike, kapaciteti absorbues i absorbuesit (kapaciteti që korrespondon me sasinë kufizuese të gazit që përthithet nga një njësi e vëllimit të absorbuesit) dhe më shumë se me thithjen fizike në një reaksion të pakthyeshëm (për shembull, kur CO2 absorbohet nga NaOH tretësirat me formimin e Na2CO3), presioni ekuilibër i gazit mbi tretësirë është zero përderisa në tretësirë ka absorbues pa reagim dhe kapaciteti absorbues përcaktohet nga stoikiometria e reaksionit. Me një reagim të kthyeshëm, presioni<#"30" src="doc_zip30.jpg" /> Gazi i lëngshëm i thithjes së procesit të transferimit të masës ku Kx = ASKfKP është konstanta e ekuilibrit të sistemit gaz-lëng; Kp është konstanta e ekuilibrit të reaksionit; - shkalla e ekuilibrit të shndërrimit të absorbuesit; x1 - përqendrimi fillestar i absorbuesit; h është numri i moleve të produkteve të reaksionit për 1 mol të gazit të reaguar; j është numri i moleve të absorbuesit që ndërveprojnë me 1 mol të gazit të tretur; A5-koeficienti në varësi të stoikiometrisë. Faktori i përshpejtimit të përthithjes mund të jetë mjaft i madh. Pra, në rastin e thithjes së CO2 në një kolonë të mbushur me të njëjtat ngarkesa për sa i përket fazave, temperaturës dhe presionit, duke përdorur 2 N. një zgjidhje ujore e KOH (15% K përmbahet në tretësirë në formën e karbonatit), mund të merrni krahasuar me fizike thithjen e CO2 nga uji. Një tretës hipotetik ideal pa rezistencë ndaj transferimit të lëngjeve dhe reaktivitet të pafund do të siguronte Rrit dhe (nganjëherë disa herë) mund të ndodhë nën ndikimin e konvekcionit sipërfaqësor të shkaktuar nga gradientët lokalë tensioni sipërfaqësor, të cilat lindin në disa raste si rezultat i transferimit masiv, veçanërisht me të njëkohshëm. rrjedha e reaksioneve (për shembull, gjatë përthithjes së CO2 nga solucionet ujore të monoetanolaminës). Kjo duhet të merret parasysh kur zgjidhni kimikate të reja. Kuptimi nëse reaksioni çon në shfaqjen e konvekcionit sipërfaqësor, ai duhet të përcaktohet në bazë të koeficientit të transferimit të masës gjatë përthithjes fizike, i gjetur në kushtet e ekspozimit ndaj procesit të mikroflukseve konvektive pranë kufirit fazor. Kur llogaritni shkallën e përthithjes, shpesh përdorni koeficientin e transferimit të masës, i përcaktuar nga hipoteza. kompozime sipërfaqësore dhe, për rrjedhojë, hipotetikisht. forcat lëvizëse. Zakonisht supozohet se koeficienti i transferimit të masës, referuar përqendrimit në gaz, Kg [kmol / (m2 * MPa * s)] është për shkak të forcës lëvizëse (y2-y*2), ku y*2 është fraksioni molar i përbërësit të zhytur në gaz, i cili korrespondon me ekuilibrin me një lëng që ka një përbërje mesatare vëllimore x2; y2 është përbërja mesatare vëllimore e gazit në një seksion të caktuar të aparatit absorbues. Pastaj marrim: Në mënyrë të ngjashme, mund të gjeni forcën lëvizëse (x * 2 - x2) dhe koeficientin e transferimit të masës Kzh. Nga shprehjet (2) dhe (3) rrjedh: ku m = (y2,gr - y*2)/(x2,gr - x2) është pjerrësia e vijës së ekuilibrit në diapazonin e përqendrimit nga x2, y2 në x2,gr, y2,gr. Shprehja (4) shkruhet për koeficientin lokal të transferimit të masës dhe tregon se ky koeficient varet nga pjerrësia e vijës së ekuilibrit. Është më e përshtatshme për të llogaritur koeficientin e transferimit të masës duke përdorur ekuacionin (4) në rastet kur pjerrësia e vijës së ekuilibrit mbetet pothuajse konstante në intervalin e përqendrimit të punës. Me një vijë ekuilibri të lakuar, është e nevojshme të merret parasysh varësia e m nga përqendrimi. Thithja kryhet në pajisjet e transferimit të masës, të quajtura absorbues, në formë pllake, të paketuara (pastrues me emër të vjetëruar), film, film rrotullues dhe spërkatës. Skema e rrjedhave të materialit në absorbues është paraqitur në fig. 3. Lidhja ndërmjet përqendrimeve të komponentit të përthithur në gazin y2 dhe në lëng në çdo seksion horizontal të aparatit gjendet nga ekuacioni i bilancit të materialit (i ashtuquajturi ekuacion i linjës së punës). Në përgjithësi, ky ekuacion ka formën: ku L dhe G janë shpejtësia e rrjedhjes së lëngjeve dhe thithja e gazit. Kur vëllimet fazore ndryshojnë pak gjatë përthithjes, vija e punës është një vijë e drejtë: Këtu, indeksi "n" tregon seksionin e poshtëm të absorbuesit të kundërthënës ose desorberabsorbimit. Efektet termike të përthithjes mund të kenë një ndikim të rëndësishëm në rrjedhën e linjave të punës dhe ekuilibrit [y* = f(x*2)]. Rrjedha e linjës së punës mund të varet fuqishëm nga intensiteti i avullimit të tretësit (veçanërisht gjatë desorbimit). Nëse thithja shoqërohet me një çlirim të konsiderueshëm të nxehtësisë dhe sasia e materialit të përthithur është mjaft e madhe, tretësi mund të nxehet shumë kur kalon nëpër kolonë. Shembuj - tharje me ajër me H2SO4 të koncentruar, tretje<#"416" src="doc_zip42.jpg" /> Oriz. 3. Skema e prurjeve të materialit në absorbues dhe të ftohtit të linjave të punës dhe ekuilibrit (a-me kundërrrjedhje, 6-me rrjedhje përpara): LV-linja e punës; Linja OS-ekuilibri; dhe - forca shtytëse respekt. në fazën e gazit deri në krye dhe në fund. prerjet tërthore të aosoroerit dhe në fazat e gazit dhe të lëngët në skenë. Në mungesë të furnizimit ose heqjes së nxehtësisë së jashtme, në të njëjtat temperatura të gazit dhe lëngut dhe pa marrë parasysh avullimin dhe kondensimin e absorbuesit dhe nxehtësinë e tretjes së gazrave të tjerë.<#"24" src="doc_zip45.jpg" />, ku Cp është kapaciteti termik i tretësirës, është ndryshimi në përqendrimin e gazit në seksionin e konsideruar. Zakonisht supozohet se temperatura e lëngut në ndërfaqe dhe në vëllim është e njëjtë. Meqenëse përqendrimi më i lartë i gazit të tretur dhe, në përputhje me rrethanat, lëshimi më i lartë i nxehtësisë vërehet pranë sipërfaqes së kontaktit të fazës, temperatura e sipërfaqes ndërfaqe, e cila përcakton ekuilibrin e vërtetë, shpesh ndryshon ndjeshëm nga temperatura e masës së lëngshme. Po zhvillohen metoda për llogaritjen e këtij fenomeni. Shkalla e transferimit të masës lokale mund të përdoret për të llogaritur sipërfaqen e transferimit të masës F të nevojshme për të arritur ndryshimin e dëshiruar në përbërjen e gazit në absorbues [shih ref. ekuacioni (3)1 së bashku me ekuacionin e bilancit material për komponentin e absorbuar. Me një koeficient konstant të transferimit të masës përgjatë lartësisë së aparatit: ku G është shpejtësia e masës molare të gazit, kmol/(m2*s); R-numri total Njësitë e transferimit në fazën e gazit: Ky parametër i rëndësishëm varet vetëm nga mënyra teknologjike e procesit, përcaktohet nga pozicioni i linjave të punës dhe ekuilibrit dhe tregon se si ndikon forca lëvizëse e përthithjes.<#"21" src="doc_zip50.jpg" />. Me një rritje, dimensionet e aparatit zvogëlohen, por konsumi i energjisë dhe shkalla e shpërbërjes së përbërësve të dobët të tretshëm të përzierjes së gazit rritet, gjë që çon ose në humbjen e tyre dhe ndotjen e gazit të nxjerrë, ose në kosto shtesë për ndarjen. të gazrave të tretur. Gjatë llogaritjes së absorbuesve, veçanërisht absorbuesve të diskut, shpesh përdoret koncepti i efikasitetit të fazës ose shkalla e afrimit me ekuilibrin. Kjo vlerë mund të përkufizohet si raporti i ndryshimit të realizuar realisht në përbërje me ndryshimin që do të kishte ndodhur kur të arrihet ekuilibri: ku indeksi "in" tregon majën. seksioni i absorbimit të aparatit të kundërrrymës Kjo është arritur në shumë lloje të pajisjeve të kontaktit me shkallë. Kjo do të thotë se në analizën materiale të pajisjeve të tilla është legjitime të përdoret koncepti i një faze ekuilibri. Duke llogaritur numrin e pllakave teorike dhe duke ditur efikasitetin e fazës, është e mundur të përcaktohet numri i fazave aktuale të nevojshme për të siguruar një shkallë të caktuar ndarjeje. Bazat e teknologjisë së proceseve të absorbimit. Përthithja kryhet shpesh në formën e një cikli përthithje-desorbimi (një proces ciklik), megjithatë, hapi i desorbimit<#"159" src="doc_zip56.jpg" /> Oriz. 4. Skema skematike e ciklit të absorbimit-desorbimit: 1 - absorbues; 2-pompë; 3-zorber; 4 - frigorifer; 5-shkëmbyes nxehtësie; 6-bojler; 7 - kondensator. Fiz. thithja zakonisht kryhet në një temperaturë mjedisi(20-40°C) ose në temperatura të ulëta, sepse tretshmëria e gazeve shumë të tretshme<#"38" src="doc_zip57.jpg" />
ku është shkalla e përafrimit me ekuilibrin në daljen e gazit nga absorbuesi, në varësi të shpejtësisë së procesit të përthithjes. Në përgjithësi: ku G2 është sasia e thithjes së gazit të nxjerrë Në një reaksion të pakthyeshëm, sasia minimale e absorbuesit qarkullues përcaktohet nga ekuacioni stekiometrik reagimet dhe gjeni. Raporti i shkallës së rrjedhës së lëngjeve dhe gazit përcaktohet nga ekuacioni: Me proceset e qarkut të hapur, zakonisht, me proceset e qarkullimit - x2, në x2, p (përqendrimi i gazit në tretësirën e rigjeneruar). Në rastin më të thjeshtë (për dhe) kemi: . Nëse tretshmëria përshkruhet nga ligji i Henrit, atëherë.Në këtë rast, sasia e absorbuesit qarkullues nuk varet nga sasia e gazit të nxjerrë.Absorbimi Kur arrihet ekuilibri në daljen e absorbuesit Një parametër i rëndësishëm i procesit është i ashtuquajturi. Faktori i përthithjes: i cili është 1 në nxjerrjen e plotë të gazit.Ky faktor është i barabartë me raportin e këndeve të pjerrësisë së linjave të punës dhe të ekuilibrit, të cilat shprehin varësinë e përqendrimeve reale dhe të ekuilibrit të përbërësit të nxjerrë në fazën e gazit nga përqendrimi i tij në lëng. , respektivisht. Parametri A karakterizon njëkohësisht tejkalimin e sasisë së absorbuesit qarkullues në krahasim me minimumin e kërkuar për nxjerrjen e plotë të thithjes së gazit të tretshëm. Mënyra e desorbimit<#"18" src="doc_zip71.jpg" />përcaktohet nga gjendja e ekuilibrit në daljen e absorbuesit (me kundërrrymë). Përqendrimi minimal i arritshëm i gazit në të njëjtën tretësirë gjatë desorbimit<#"30" src="doc_zip73.jpg" />,
ku Р dhe Рpar - presioni total<#"20" src="doc_zip74.jpg" />gjenden nga kushti i përputhshmërisë me ekuacionin (5) jo vetëm në daljen e tretësirës nga desorberi, por edhe në çdo seksion të tij. Seksioni i sipërm i aparatit të kundërrrymës, ku gazi del nga gjeneratori, shpesh është i kufizuar. Pastaj = G2Ф*, ku Ф* = р*avulli/p2*(t,x2,в) - raporti i presionit të avullit<#"28" src="doc_zip76.jpg" />,
ku është shuma e presioneve të gazrave të tretur. Mënyra e desorbimit<#"29" src="doc_zip78.jpg" />
Ndërtimi i një linje pune gjatë desorbimit<#"160" src="doc_zip79.jpg" /> Oriz. 5. Linjat ekuilibër (/) dhe punuese (2, 3) të e.sorbimit<#"64" src="doc_zip80.jpg" />
ku dhe janë efektet termike respekt. avullimi dhe desorbimi absorbues; - diferenca e temperaturës midis tretësirave të rigjeneruara dhe të ngopura në skajin e ftohtë të shkëmbyesit të nxehtësisë thithëse. Presioni i desorbimit<#"59" src="doc_zip84.jpg" />
atëherë Qrel rritet me rritjen e temperaturës. Përndryshe, Qotd zvogëlohet, dhe me një shpejtësi të caktuar të rrjedhës së nxehtësisë, me rritjen e presionit të desorbimit, rigjenerimi nuk përkeqësohet, por përmirësohet, megjithatë, deri në një kufi të caktuar të përcaktuar nga qëndrueshmëria termokimike e absorbuesit dhe një rritje në Qload. Kostot e energjisë për desorbimin e gazit Bibliografi 1. Kafarov V. V., Bazat e transferimit masiv, botimi i tretë, M., 1979 2. Rudobashta S. P., Transferimi masiv në sistemet me fazë solide, M., 1980. Sherwood T.K., Pigford R., Wilkie C., Transferim masiv, përkth. nga anglishtja, M., 1982 Planovsky A.N., Nikolaev P.I., Proceset dhe aparatet e teknologjisë kimike dhe petrokimike, botimi i 3-të, M., 1987 Brownshtein B. I., Shchegolev V. V., Hidrodinamika, transferimi i masës dhe nxehtësisë në aparatet e kolonës, L., 1988 Ramm V. M., Absorption of gases, 2nd ed., M., 1976 Purifikimi i gazeve të procesit, përthithja, redaktuar nga T.A. Semenova I. L. Laites, 2nd ed., M., 1977 Kafarov V.V. - Bazat e transferimit masiv, botimi i 3-të. M.: shkollë e diplomuar, 1979. 439s. Sherwood T., Pigford R., Wilkie C., Transferimi masiv, përkth. nga anglishtja., M., 1981. Kasatkin A.G. Proceset dhe aparatet bazë të teknologjisë kimike. - M: Kimi, 1971 - 832. Ioffe I.L. Projektimi i proceseve dhe aparateve të teknologjisë kimike: një tekst shkollor për shkollat teknike. - L: Kimi, 1991 - 352s. Aleksandrov I.A. Aparatet e korrigjimit dhe absorbimit - M.: Kimi, 1978 - 277s. Dytnersky Yu.I. Proceset dhe aparatet e teknologjisë kimike. - M.: Kimi 1995 - 368s. Për përgatitjen e kësaj pune janë përdorur materiale nga faqja http://www.xumuk.ru/.






