Legătura chimică H. Caracteristicile unei legături chimice
Fiecare atom are un anumit număr de electroni.
Intrând în reacții chimice, atomii donează, dobândesc sau socializează electroni, atingând cea mai stabilă configurație electronică. Configurația cu cea mai scăzută energie este cea mai stabilă (ca în atomii de gaz nobil). Acest model este numit „regula octetului” (Fig. 1).
Orez. unu.
Această regulă se aplică tuturor tipuri de conexiuni. Legăturile electronice dintre atomi le permit să formeze structuri stabile, de la cele mai simple cristale până la biomolecule complexe care în cele din urmă formează sisteme vii. Ele diferă de cristale prin metabolismul lor continuu. Cu toate acestea, multe reacții chimice au loc în funcție de mecanisme transfer electronic, care joacă un rol important în procesele energetice din organism.
O legătură chimică este o forță care ține împreună doi sau mai mulți atomi, ioni, molecule sau orice combinație a acestora..
Natură legătură chimică universal: este forța electrostatică de atracție dintre electronii încărcați negativ și nucleele încărcate pozitiv, determinată de configurația electronilor din învelișul exterior al atomilor. Capacitatea unui atom de a forma legături chimice se numește valenţă, sau starea de oxidare. Conceptul de electroni de valență - electroni care formează legături chimice, adică cei localizați în cei mai mari orbitali de energie. În consecință, învelișul exterior al unui atom care conține acești orbitali se numește coajă de valență. În prezent, nu este suficientă indicarea prezenței unei legături chimice, dar este necesară clarificarea tipului acesteia: ionic, covalent, dipol-dipol, metalic.
Primul tip de conexiune esteionic conexiune
Conform teoriei electronice a valenței a lui Lewis și Kossel, atomii pot obține o configurație electronică stabilă în două moduri: în primul rând, prin pierderea de electroni, devenind cationi, în al doilea rând, dobândirea lor, transformându-se în anionii. Ca urmare a transferului de electroni, datorită forței electrostatice de atracție dintre ionii cu sarcini de semn opus, se formează o legătură chimică, numită Kossel " electrovalent(acum numit ionic).
În acest caz, anionii și cationii formează o configurație electronică stabilă cu un exterior umplut învelișul de electroni. Legăturile ionice tipice sunt formate din cationii grupelor T și II ale sistemului periodic și anionii elementelor nemetalice din grupele VI și VII (16 și, respectiv, 17 subgrupe, calcogeniși halogeni). Legăturile din compușii ionici sunt nesaturate și nedirecționale, deci păstrează posibilitatea interacțiunii electrostatice cu alți ioni. Pe fig. 2 și 3 prezintă exemple de legături ionice corespunzătoare modelului de transfer de electroni Kossel.
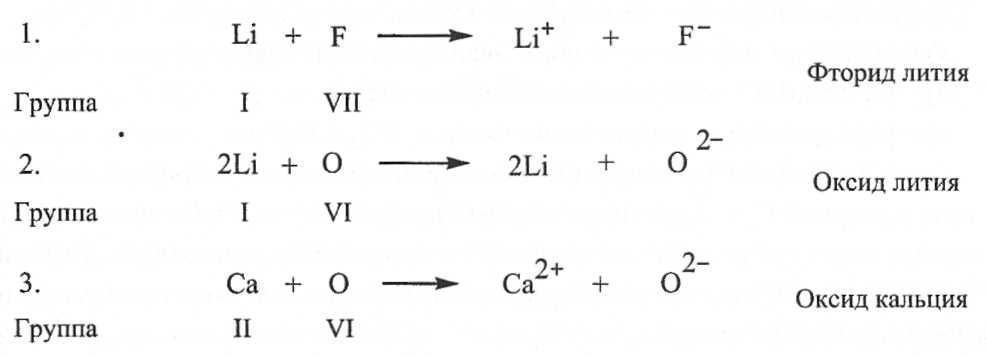
Orez. 2.
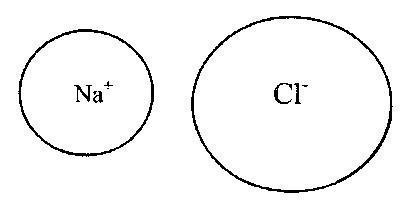
Orez. 3. Legătura ionică în molecula de clorură de sodiu (NaCl).
Aici este oportun să reamintim unele dintre proprietățile care explică comportamentul substanțelor în natură, în special să luăm în considerare conceptul de aciziși temeiuri.
Soluțiile apoase ale tuturor acestor substanțe sunt electroliți. Își schimbă culoarea în moduri diferite. indicatori. Mecanismul de acțiune al indicatorilor a fost descoperit de F.V. Ostwald. El a arătat că indicatorii sunt acizi sau baze slabe, a căror culoare în stările nedisociate și disociate este diferită.
Bazele pot neutraliza acizii. Nu toate bazele sunt solubile în apă (de exemplu, unii compuși organici care nu conțin grupări -OH sunt insolubili, în special, trietilamină N (C2H5)3); se numesc baze solubile alcalii.
Soluțiile apoase de acizi intră în reacții caracteristice:
a) cu oxizi metalici - cu formare de sare si apa;
b) cu metale - cu formarea de sare si hidrogen;
c) cu carbonați - cu formare de sare, CO 2 și H 2 O.
Proprietățile acizilor și bazelor sunt descrise de mai multe teorii. În conformitate cu teoria S.A. Arrhenius, un acid este o substanță care se disociază pentru a forma ioni H+ , în timp ce baza formează ioni EL- . Această teorie nu ține cont de existența bazelor organice care nu au grupări hidroxil.
In linie cu proton Teoria lui Bronsted și Lowry, un acid este o substanță care conține molecule sau ioni care donează protoni ( donatori protoni), iar baza este o substanță formată din molecule sau ioni care acceptă protoni ( acceptori protoni). Rețineți că în soluțiile apoase, ionii de hidrogen există într-o formă hidratată, adică sub formă de ioni de hidroniu H3O+ . Această teorie descrie reacții nu numai cu ioni de apă și hidroxid, ci și efectuate în absența unui solvent sau cu un solvent neapos.
De exemplu, în reacția dintre amoniac NH 3 (bază slabă) și clorură de hidrogen în faza gazoasă, se formează clorură de amoniu solidă, iar într-un amestec de echilibru de două substanțe există întotdeauna 4 particule, dintre care două sunt acizi, iar celelalte două sunt baze:
Acest amestec de echilibru constă din două perechi conjugate de acizi și baze:
1)NH 4+ și NH 3
2) acid clorhidricși Cl ‑
Aici, în fiecare pereche conjugată, acidul și baza diferă cu un proton. Fiecare acid are o bază conjugată. Un acid tare are o bază conjugată slabă, iar un acid slab are o bază conjugată puternică.
Teoria Bronsted-Lowry face posibilă explicarea rolului unic al apei pentru viața biosferei. Apa, în funcție de substanța care interacționează cu ea, poate prezenta proprietățile fie ale unui acid, fie ale unei baze. De exemplu, în reacțiile cu soluții apoase de acid acetic, apa este o bază, iar cu soluții apoase de amoniac, este un acid.
1) CH3COOH + H2O ↔ H3O + + CH 3 SOO- . Aici molecula de acid acetic donează un proton moleculei de apă;
2) NH3 + H2O ↔ NH4 + + EL- . Aici molecula de amoniac acceptă un proton din molecula de apă.
Astfel, apa poate forma două perechi conjugate:
1) H2O(acid) și EL- (bază conjugată)
2) H3O+ (acid) și H2O(bază conjugată).
În primul caz, apa donează un proton, iar în al doilea, îl acceptă.
O astfel de proprietate se numește amfiprotonitate. Sunt numite substanțe care pot reacționa atât ca acizi, cât și ca baze amfoter. Astfel de substanțe se găsesc adesea în natură. De exemplu, aminoacizii pot forma săruri atât cu acizi, cât și cu baze. Prin urmare, peptidele formează cu ușurință compuși de coordonare cu ionii metalici prezenți.
Astfel, proprietatea caracteristică a unei legături ionice este deplasarea completă a unui grup de electroni de legare la unul dintre nuclee. Aceasta înseamnă că există o regiune între ioni în care densitatea electronilor este aproape zero.
Al doilea tip de conexiune estecovalent conexiune
Atomii se pot forma stabil configuratii electronice prin împărțirea electronilor.
O astfel de legătură se formează atunci când o pereche de electroni este împărțită pe rând. de la fiecare atom. În acest caz, electronii de legătură socializați sunt distribuiți în mod egal între atomi. Un exemplu de legătură covalentă este homonuclear diatomic molecule H 2 , N 2 , F 2. Alotropii au același tip de legătură. O 2 și ozon O 3 și pentru o moleculă poliatomică S 8 și de asemenea molecule heteronucleare acid clorhidric acid clorhidric, dioxid de carbon CO 2, metan CH 4, etanol DIN 2 H 5 EL, hexafluorură de sulf SF 6, acetilena DIN 2 H 2. Toate aceste molecule au aceiași electroni comuni, iar legăturile lor sunt saturate și direcționate în același mod (Fig. 4).
Pentru biologi, este important ca razele covalente ale atomilor din legături duble și triple să fie reduse în comparație cu o singură legătură.
![]()
Orez. patru. Legătura covalentă în molecula de Cl2.
Tipurile ionice și covalente de legături sunt două cazuri limitative ale mulțimii tipurile existente legături chimice, iar în practică majoritatea legăturilor sunt intermediare.
Compușii a două elemente situate la capete opuse ale aceleiași perioade sau perioade diferite ale sistemului Mendeleev formează predominant legături ionice. Pe măsură ce elementele se apropie unele de altele într-o perioadă, natura ionică a compușilor lor scade, în timp ce caracterul covalent crește. De exemplu, halogenurile și oxizii elementelor din partea stângă a tabelului periodic formează predominant legături ionice ( NaCl, AgBr, BaS04, CaCO3, KNO3, CaO, NaOH), și aceiași compuși ai elementelor din partea dreaptă a tabelului sunt covalenti ( H20, CO2, NH3, NO2, CH4, fenol C6H5OH, glucoza C6H12O6, etanol C2H5OH).
Legătura covalentă, la rândul ei, are o altă modificare.
În ionii poliatomici și în moleculele biologice complexe, ambii electroni pot proveni doar din unu atom. Se numeste donator pereche de electroni. Se numește un atom care socializează această pereche de electroni cu un donor acceptor pereche de electroni. Acest tip de legătură covalentă se numește coordonare (donator-acceptator, saudativ) comunicare(Fig. 5). Acest tip de legătură este cel mai important pentru biologie și medicină, deoarece chimia celor mai importante elemente d pentru metabolism este în mare măsură descrisă de legăturile de coordonare.
![]()
Pic. 5.
De regulă, într-un compus complex, un atom de metal acționează ca un acceptor de pereche de electroni; dimpotrivă, în legăturile ionice și covalente, atomul de metal este donor de electroni.
Esența legăturii covalente și varietatea acesteia - legătura de coordonare - poate fi clarificată cu ajutorul unei alte teorii a acizilor și bazelor, propusă de GN. Lewis. El a extins oarecum conceptul semantic al termenilor „acid” și „bază” conform teoriei Bronsted-Lowry. Teoria Lewis explică natura formării ionilor complecși și participarea substanțelor la reacțiile de substituție nucleofilă, adică la formarea CS.
Potrivit lui Lewis, un acid este o substanță capabilă să formeze o legătură covalentă prin acceptarea unei perechi de electroni dintr-o bază. O bază Lewis este o substanță care are o pereche singură de electroni, care, donând electroni, formează o legătură covalentă cu acidul Lewis.
Adică, teoria Lewis extinde gama reacțiilor acido-bazice și la reacții în care protonii nu participă deloc. În plus, protonul însuși, conform acestei teorii, este și un acid, deoarece este capabil să accepte o pereche de electroni.
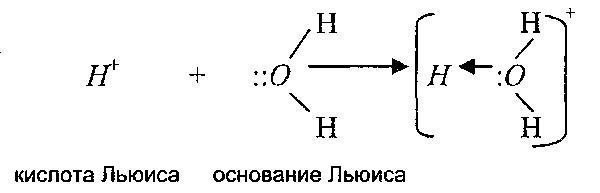
Prin urmare, conform acestei teorii, cationii sunt acizi Lewis și anionii sunt baze Lewis. Următoarele reacții sunt exemple:
S-a remarcat mai sus că subdiviziunea substanțelor în ionice și covalente este relativă, deoarece nu există un transfer complet al unui electron de la atomii de metal la atomii acceptori din moleculele covalente. În compușii cu o legătură ionică, fiecare ion se află în câmpul electric al ionilor de semn opus, deci sunt polarizați reciproc, iar învelișurile lor sunt deformate.
Polarizabilitate determinat structura electronica, sarcina și dimensiunea ionului; este mai mare pentru anioni decât pentru cationi. Cea mai mare polarizabilitate dintre cationi este pentru cationii cu sarcină mai mare și dimensiuni mai mici, de exemplu, pentru Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Are un puternic efect de polarizare H+ . Deoarece efectul polarizării ionilor este bifax, schimbă semnificativ proprietățile compușilor pe care îi formează.
Al treilea tip de conexiune -dipol-dipol conexiune
Pe lângă tipurile de comunicare enumerate, există și dipol-dipol intermolecular interacțiuni, cunoscute și ca van der Waals .
Puterea acestor interacțiuni depinde de natura moleculelor.
Există trei tipuri de interacțiuni: dipol permanent - dipol permanent ( dipol-dipol atracţie); dipol permanent - dipol indus ( inducţie atracţie); dipol instantaneu - dipol indus ( dispersie atracție sau forțe londoneze; orez. 6).

Orez. 6.
Numai moleculele cu polarități polare au un moment dipol-dipol. legaturi covalente (HCI, NH3, S02, H20, C6H5CI), iar puterea de legătură este 1-2 la revedere(1D \u003d 3,338 × 10 -30 metri coulomb - C × m).
În biochimie, se distinge un alt tip de legătură - hidrogen conexiune, care este un caz limitativ dipol-dipol atracţie. Această legătură se formează prin atracția dintre un atom de hidrogen și un mic atom electronegativ, cel mai adesea oxigen, fluor și azot. Cu atomi mari care au o electronegativitate similară (de exemplu, cu clor și sulf), legătura de hidrogen este mult mai slabă. Atomul de hidrogen se distinge printr-o caracteristică esențială: atunci când electronii de legare sunt îndepărtați, nucleul său - protonul - este expus și încetează să fie ecranat de electroni.
Prin urmare, atomul se transformă într-un dipol mare.
O legătură de hidrogen, spre deosebire de o legătură van der Waals, se formează nu numai în timpul interacțiunilor intermoleculare, ci și în cadrul unei molecule - intramolecular legătură de hidrogen. Legăturile de hidrogen joacă un rol important în biochimie, de exemplu, pentru stabilizarea structurii proteinelor sub formă de a-helix, sau pentru formarea unei duble helix ADN (Fig. 7).
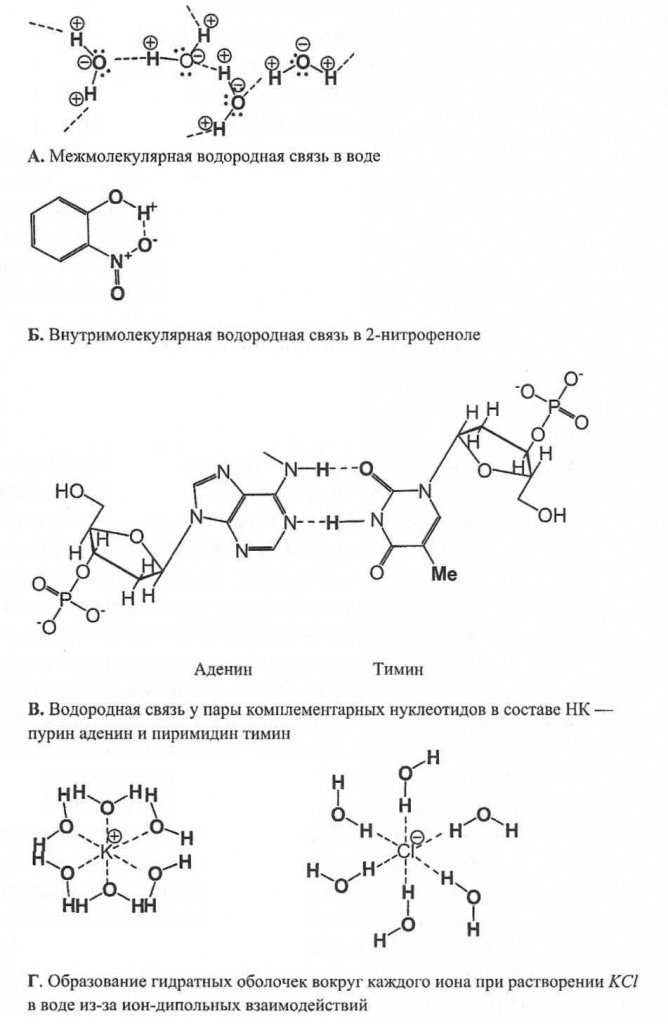
Fig.7.
Legăturile de hidrogen și van der Waals sunt mult mai slabe decât legăturile ionice, covalente și de coordonare. Energia legăturilor intermoleculare este indicată în tabel. unu.
Tabelul 1. Energia forțelor intermoleculare
Notă: Gradul de interacțiuni intermoleculare reflectă entalpia de topire și evaporare (fierbere). Compușii ionici necesită mult mai multă energie pentru a separa ionii decât pentru a separa molecule. Entalpiile de topire ale compuşilor ionici sunt mult mai mari decât cele ale compuşilor moleculari.
Al patrulea tip de conexiune -legatura metalica
În cele din urmă, există un alt tip de legături intermoleculare - metal: conexiune ionii pozitivi rețele de metale cu electroni liberi. Acest tip de conexiune nu apare la obiectele biologice.
Din Prezentare generală tipuri de legături, un detaliu este clarificat: un parametru important al unui atom sau ion al unui metal - un donor de electroni, precum și un atom - un acceptor de electroni este marimea.
Fără a intra în detalii, observăm că razele covalente ale atomilor, razele ionice ale metalelor și razele van der Waals ale moleculelor care interacționează cresc pe măsură ce numărul lor atomic în grupurile sistemului periodic crește. În acest caz, valorile razelor ionice sunt cele mai mici, iar razele van der Waals sunt cele mai mari. De regulă, la deplasarea în jos a grupului, razele tuturor elementelor cresc, atât covalente, cât și van der Waals.
Cele mai importante pentru biologi și medici sunt coordonare(donator-acceptator) legături considerate de chimia coordonării.
Bioanorganice medicale. G.K. Barașkov
Se numesc particule chimice formate din doi sau mai mulți atomi molecule(real sau condiționat unități de formulă substanțe poliatomice). Atomii din molecule sunt legați chimic.
Prin legătură chimică se înțelege forte electrice atracție care ține particulele împreună. Fiecare legătură chimică în formule structurale pare linia de valență, de exemplu:
H - H (legatura intre doi atomi de hidrogen);
H3N - H + (legatura dintre atomul de azot al moleculei de amoniac si cationul de hidrogen);
(K +) - (I -) (legatură între cationul de potasiu și ionul iodură).
O legătură chimică este formată dintr-o pereche de electroni ( ), care în formulele electronice ale particulelor complexe (molecule, ioni complecși) este de obicei înlocuită cu o linie de valență, spre deosebire de propriile perechi de atomi de electroni neîmpărțiți, de exemplu:
Legătura chimică se numește covalent, dacă se formează prin socializarea unei perechi de electroni de către ambii atomi.
În molecula F 2, ambii atomi de fluor au aceeași electronegativitate, prin urmare, posesia unei perechi de electroni este aceeași pentru ei. O astfel de legătură chimică se numește nepolară, deoarece fiecare atom de fluor are densitatea electronică la fel in formula electronica moleculele pot fi împărțite condiționat între ele în mod egal:
În molecula de HCl, legătura chimică este deja polar, deoarece densitatea electronilor pe atomul de clor (un element cu electronegativitate mai mare) este mult mai mare decât pe atomul de hidrogen:
O legătură covalentă, de exemplu H - H, poate fi formată prin împărțirea electronilor a doi atomi neutri:
H + H > H – H
Acest mecanism de legătură se numește schimb valutar sau echivalent.
Conform unui alt mecanism, aceeași legătură covalentă H - H apare atunci când perechea de electroni a ionului hidrură H este socializată de cationul de hidrogen H +:
H + + (:H) -> H - H
În acest caz se numește cationul H + acceptorși anionul H - donator pereche de electroni. Mecanismul de formare a unei legături covalente în acest caz va fi donator-acceptator, sau coordonarea.
Se numesc legături simple (H - H, F - F, H - CI, H - N). a-linkuri, ele determină forma geometrică a moleculelor.
Legăturile duble și triple () conțin o componentă p și una sau două componente p; componenta a, care este prima formată în mod condiționat, este întotdeauna mai puternică decât componentele a.
Caracteristicile fizice (de fapt măsurabile) ale unei legături chimice sunt energia, lungimea și polaritatea acesteia.
Energia de legătură chimică (E cv) este căldura care este eliberată în timpul formării acestei legături și este cheltuită pentru ruperea acesteia. Pentru aceiași atomi, este întotdeauna o singură legătură mai slab decât un multiplu (dublu, triplu).
Lungimea legăturii chimice (l s) - distanta internucleara. Pentru aceiași atomi, este întotdeauna o singură legătură mai lung decât un multiplu.
Polaritate comunicarea este măsurată moment dipol electric p- produsul unei sarcini electrice reale (pe atomii unei legături date) cu lungimea dipolului (adică lungimea legăturii). Cu cât momentul dipolului este mai mare, cu atât polaritatea legăturii este mai mare. Real sarcini electrice pe atomii dintr-o legătură covalentă are întotdeauna o valoare mai mică decât stările de oxidare ale elementelor, dar acestea coincid în semn; de exemplu, pentru legătura H + I -Cl -I, sarcinile reale sunt H +0 "17 -Cl -0" 17 (particulă bipolară sau dipol).
Polaritatea moleculelor determinate de compoziţia şi forma geometrică a acestora.
Nepolar (p = O) va fi:
a) molecule simplu substanțe, deoarece conțin numai legături covalente nepolare;
b) poliatomic molecule complex substanțe, dacă forma lor geometrică simetric.
De exemplu, moleculele CO2, BF3 și CH4 au următoarele direcții ale vectorilor de legătură egali (de-a lungul lungimii):
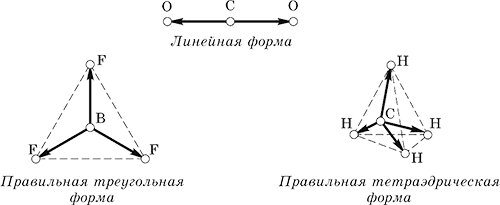
Când se adaugă vectori de legătură, suma lor dispare întotdeauna, iar moleculele în ansamblu sunt nepolare, deși conțin legături polare.
Polar (pag> O) va fi:
A) diatomic molecule complex substanțe, deoarece conțin doar legături polare;
b) poliatomic molecule complex substanțe, dacă structura lor asimetric, adică forma lor geometrică este fie incompletă, fie distorsionată, ceea ce duce la apariția unui dipol electric total, de exemplu, pentru moleculele de NH3, H2O, HNO3 și HCN.
Ionii complecși, precum NH 4 + , SO 4 2- și NO 3 - , nu pot fi în principiu dipoli, purtând o singură sarcină (pozitivă sau negativă).
Legătură ionică apare în timpul atracției electrostatice a cationilor și anionilor cu aproape nicio socializare a unei perechi de electroni, de exemplu, între K + și I -. Atomul de potasiu are o lipsă de densitate electronică, atomul de iod are un exces. Această conexiune este luată în considerare limitare cazul unei legături covalente, deoarece o pereche de electroni se află practic în posesia anionului. O astfel de conexiune este cea mai tipică pentru compușii de metale și nemetale tipice (CsF, NaBr, CaO, K 2 S, Li 3 N) și substanțe din clasa sărurilor (NaNO 3, K 2 SO 4, CaCO 3). Toți acești compuși în condiții de cameră sunt substanțe cristaline care se unesc denumirea comunăcristale ionice(cristale construite din cationi și anioni).
Există un alt tip de conexiune numit legatura metalica,în care electronii de valență sunt ținuți atât de slab de atomii de metal încât nu aparțin de fapt unor atomi specifici.
Atomii metalelor, rămași fără electroni externi care le aparțin în mod clar, devin, parcă, ioni pozitivi. Ele formează rețea cristalină metalică. Setul de electroni de valență socializați ( gaz de electroni)ține ionii metalici pozitivi împreună și în locuri specifice ale rețelei.
Pe lângă cristalele ionice și metalice, există și atomicși molecular substanțe cristaline, în locurile rețelei ale cărora se află atomi sau, respectiv, molecule. Exemple: diamant și grafit - cristale cu rețea atomică, iod I 2 și dioxid de carbon CO 2 (gheață carbonică) - cristale cu rețea moleculară.
Legăturile chimice există nu numai în interiorul moleculelor de substanțe, ci se pot forma și între molecule, de exemplu, pentru HF lichid, apă H 2 O și un amestec de H 2 O + NH 3:
legătură de hidrogen formate din cauza forțelor de atracție electrostatică a moleculelor polare care conțin atomi ai celor mai electronegative elemente - F, O, N. De exemplu, legăturile de hidrogen sunt prezente în HF, H 2 O și NH 3, dar nu sunt în HCl, H 2 S și PH 3.
Legăturile de hidrogen sunt instabile și se rup destul de ușor, de exemplu, când gheața se topește și apa fierbe. Cu toate acestea, se cheltuiește ceva energie suplimentară pentru ruperea acestor legături și, prin urmare, punctele de topire (Tabelul 5) și punctele de fierbere ale substanțelor cu legături de hidrogen.

(de exemplu, HF și H2O) sunt semnificativ mai mari decât pentru substanțe similare, dar fără legături de hidrogen (de exemplu, HCl și respectiv H2S).
Mulți compuși organici formează, de asemenea, legături de hidrogen; Legătura de hidrogen joacă un rol important în procesele biologice.
Exemple de sarcini din partea A1. Substanțele cu numai legături covalente sunt
1) SiH4, CI20, CaBr2
2) NF3, NH4CI, P205
3) CH4, HNO3, Na(CH30)
4) CCl2O, I2, N2O
2–4. legătură covalentă
2. singur
3. dublu
4. triplu
prezent în materie
5. Legături multiple sunt prezente în molecule
6. Particulele numite radicali sunt
7. Una dintre legături este formată de mecanismul donor-acceptor din setul de ioni
1) S042-, NH4+
2) H30+, NH4+
3) PO 4 3-, NO 3 -
4) PH 4 + , SO 3 2-
8. Cel mai durabilși mic de statura legătură - într-o moleculă
9. Substanțe cu numai legături ionice - în set
2) NH4CI, SiCI4
10–13. Rețeaua cristalină a materiei
13. Va (OH) 2
1) metal
3) nucleare
Cele mai importante caracteristici ale unei legături includ: lungimea, polaritatea, momentul dipolului, saturația, direcția, rezistența și multiplicitatea legăturilor.
Lungimea comunicării este distanța dintre nucleele atomilor dintr-o moleculă. Lungimea legăturii este determinată de mărimea nucleelor și de gradul de suprapunere a norilor de electroni.
Lungimea legăturii în HF este de 0,92∙10 -10, în HCl - 1,28∙10 -10 m. Cu cât legătura chimică este mai puternică, cu atât lungimea sa este mai mică.
Unghiul de legătură (unghiul de valență) numit unghiul dintre liniile imaginare care trec prin nucleele atomilor legați chimic. ∟HOH=104 0,5; ∟H 2 S \u003d 92,2 0; ∟H 2 S e \u003d 91 0,0.
Cea mai importantă caracteristică a unei legături chimice este energie, definindu-l putere.
Cantitativ, rezistența unei legături este caracterizată de energia cheltuită pentru ruperea acesteia și se măsoară în kJ per 1 mol de substanță.
Prin urmare, puterea de legătură caracterizează cantitativ energia de sublimare E subl. substanțele și energia de disociere a unei molecule în atomi E diss. . Energia de sublimare este înțeleasă ca energia cheltuită pentru trecerea unei substanțe din stare solidăîn gazos. Pentru moleculele diatomice, energia de legare este egală cu energia de disociere a moleculei în doi atomi.
De exemplu, E diss. (și prin urmare E St.) în molecula de H2 este de 435 kJ/mol. În molecula F 2 \u003d 159 kJ / mol, în molecula N 2 \u003d 940 kJ / mol.
Pentru moleculele nu diatomice, ci poliatomice de tip AB, n este energia medie de legare
datorită AB n \u003d A + nB.
De exemplu, energia absorbită în proces
este egal cu 924 kJ/mol.
Energie legată
E OH = = = = 462 kJ/mol.
Concluzia despre structura moleculelor și structura unei substanțe se face în funcție de rezultatele obținute prin diferite metode. În acest caz, informațiile obținute sunt folosite nu numai despre lungimile și energiile legăturilor, unghiurile de legătură, ci și alte proprietăți ale substanței, cum ar fi, de exemplu, magnetice, optice, electrice, termice și altele.
Setul de date obținute experimental cu privire la structura unei substanțe completează și generalizează rezultatele metodelor de calcul cuantico-chimic care utilizează conceptul de teorie mecanic-cuantică a legăturii chimice. Se crede că legătura chimică este realizată în principal de electroni de valență. Pentru elementele s și p, electronii de valență sunt orbitalii stratului exterior, iar pentru elementele d, electronii orbitalului s al stratului exterior și orbitalul d al stratului pre-exterior.
Natura legăturii chimice.
O legătură chimică se formează numai dacă, atunci când atomii se apropie unul de celălalt energie totală sistem (E kin. + E pot.) scade.
Luați în considerare natura legăturii chimice folosind exemplul ionului de hidrogen molecular H 2 + . (Se obține prin iradierea cu electroni a moleculelor de hidrogen H 2; în descărcare gazoasă). Pentru un astfel de sistem molecular simplu, ecuația Schrödinger este rezolvată cel mai bine.
În ionul de hidrogen H 2 + un electron se mișcă în câmpul a două nuclee - protoni. Distanța dintre nuclee este de 0,106 nm, energia de legare (disocierea în atomi de H și ion H +) este de 255,7 kJ/mol. Adică, particula este puternică.
LA ion molecular Acționează H 2 + forțe electrostatice de două tipuri - forțele de atracție ale electronului către ambele nuclee și forțele de repulsie dintre nuclee. Forța de respingere se manifestă între nucleele încărcate pozitiv H A + și H A +, care pot fi reprezentate în fig. 3. Forța de respingere tinde să separe nucleele unul de celălalt.

Orez. 3. Forța de respingere (a) și de atracție (b) între două nuclee, care apar atunci când se apropie unul de celălalt la distanțe de ordinul mărimii atomilor.
Forțe atractive acționează între electronul e - încărcat negativ și nucleele încărcate pozitiv H + și H +. O moleculă se formează dacă rezultanta forțelor de atracție și repulsie este zero, adică respingerea reciprocă a nucleelor trebuie compensată prin atracția electronului către nuclee. O astfel de compensare depinde de locația electronului e - față de nuclee (Fig. 3 b și c). Aici ne referim nu la poziția unui electron în spațiu (care nu poate fi determinată), ci la probabilitatea de a găsi un electron în spațiu. Locația densității electronilor în spațiu, corespunzătoare Fig. 3.b) contribuie la convergenţa nucleelor, iar fig. 3.c) - respingerea nucleelor, întrucât în acest caz forțele de atracție sunt direcționate într-o singură direcție și respingerea nucleelor nu este compensată. Astfel, există o regiune de legare atunci când densitatea de electroni este distribuită între nuclee și o regiune de slăbire sau anti-legare când densitatea de electroni este distribuită în spatele nucleelor.
Dacă un electron intră în regiunea de legătură, atunci se formează o legătură chimică. Dacă electronul intră în regiunea de slăbire, atunci nu se formează nicio legătură chimică.
În funcție de natura distribuției densității electronilor în regiunea de legare, există trei tipuri principale de legături chimice: covalente, ionice și metalice. Aceste legături nu apar în forma lor pură și, de obicei, o combinație a acestor tipuri de legături este prezentă în compuși.
Tipuri de linkuri.
În chimie, se disting următoarele tipuri de legături: covalente, ionice, metalice, legături de hidrogen, legături van der Waals, legături donor-acceptor și legături dative.
legătură covalentă
Când se formează o legătură covalentă, atomii împart electroni între ei. Un exemplu de legătură covalentă este o legătură chimică într-o moleculă de Cl2. Lewis (1916) a sugerat pentru prima dată că, într-o astfel de legătură, fiecare dintre cei doi atomi de clor împarte unul dintre electronii exteriori cu celălalt atom de clor. Pentru suprapunere orbitali atomici doi atomi ar trebui să se apropie cât mai mult unul de celălalt. O pereche comună de electroni formează o legătură covalentă. Acești electroni ocupă același orbital, iar spinurile lor sunt direcționate în direcții opuse.
Astfel, o legătură covalentă este realizată prin socializarea electronilor din diferiți atomi ca urmare a împerecherii electronilor cu spini opuși.
O legătură covalentă este un tip de legătură larg utilizat. O legătură covalentă poate apărea nu numai în molecule, ci și în cristale. Are loc între atomi identici (în H 2, Cl 2, molecule de diamant) și între atomi diferiți (în H 2 O, NH 3 ...)
Mecanismul apariției unei legături covalente
Să luăm în considerare mecanismul folosind exemplul formării moleculei de H2.
H + H \u003d H 2, ∆H \u003d -436 kJ / mol
Nucleul unui atom de hidrogen liber este înconjurat de un nor de electroni simetric sferic format dintr-un electron 1s. Când atomii se apropie unul de altul până la o anumită distanță, norii lor de electroni (orbitalii) se suprapun parțial (Fig. 4).
Orez. 4. Mecanismul formării legăturilor în molecula de hidrogen.
Dacă distanța dintre nucleele atomilor de hidrogen care se apropie înainte de atingere este de 0,106 nm, atunci după suprapunerea norilor de electroni, această distanță este de 0,074 nm.
Ca urmare, între centrele nucleelor apare un nor molecular cu doi electroni, care are densitatea maximă de electroni în spațiul dintre nuclee. Creșterea densității sarcina negativaîntre nuclee favorizează o creștere puternică a forțelor de atracție dintre nuclee, ceea ce duce la eliberarea de energie. Cu cât legătura chimică este mai puternică, cu atât este mai mare suprapunerea orbitalilor electronilor. Ca urmare a apariției unei legături chimice între doi atomi de hidrogen, fiecare dintre aceștia ajunge la configurația electronică a unui atom de gaz nobil - heliu.
Există două metode care explică din punct de vedere mecanic cuantic formarea unei regiuni de suprapunere a norilor de electroni, respectiv formarea unei legături covalente. Una dintre ele se numește metoda BC (legături de valență), cealaltă este MO (orbitali moleculari).
În metoda legăturilor de valență se ia în considerare suprapunerea orbitalilor atomici ai unei perechi selectate de atomi. În metoda MO, molecula este considerată ca un întreg, iar distribuția densității electronilor (de la un electron) este răspândită pe întreaga moleculă. Din poziția MO 2H în H 2 sunt conectate datorită atracției nucleelor către norul de electroni situat între acești nuclee.
Reprezentarea unei legături covalente
Link-urile sunt descrise în diferite moduri:
unu). Folosind electronii ca puncte
În acest caz, formarea unei molecule de hidrogen este prezentată de diagramă
H∙ + H∙ → H: H
2). Cu ajutorul celulelor pătrate (orbitali), ca plasarea a doi electroni cu spini opuși într-o moleculară celulă cuantică

Această schemă arată că nivelul de energie moleculară este mai scăzut decât nivelurile atomice inițiale, ceea ce înseamnă că starea moleculară a unei substanțe este mai stabilă decât starea atomică.
3). O legătură covalentă este reprezentată de o bară
De exemplu, N - N. această caracteristică simbolizează o pereche de electroni.
Dacă între atomi a apărut o legătură covalentă (o pereche de electroni comună), atunci se numește singur, dacă mai mult, atunci un multiplu dubla(două perechi de electroni comuni), triplu(trei perechi de electroni în comun). O legătură simplă este reprezentată de o linie, o legătură dublă de două și o legătură triplă de trei.
O liniuță între atomi arată că aceștia au o pereche generalizată de electroni.
Clasificarea legăturilor covalente
În funcție de direcția suprapunerii norilor de electroni, se disting legăturile σ-, π-, δ. Legătura σ apare atunci când norii de electroni se suprapun de-a lungul axei care conectează nucleele atomilor care interacționează.
Exemple de legătură σ:

Orez. 5. Formarea unei legături σ între electronii s-, p-, d-.
Un exemplu de formare a unei legături σ atunci când norii s-s se suprapun este observat într-o moleculă de hidrogen.
Legătura π se realizează prin suprapunerea norilor de electroni de ambele părți ale axei, conectând nucleele atomilor.

Orez. 6. Formarea unei legături π între electronii p-, d-.
Legătura δ apare atunci când doi nori de electroni d situati în planuri paralele se suprapun. Legătura δ este mai puțin puternică decât legătura π, iar legătura π este mai puțin puternică decât legătura σ.
Proprietățile unei legături covalente
A). Polaritate.
Există două tipuri de legături covalente: nepolare și polare.
În cazul unei legături covalente nepolare, norul de electroni format dintr-o pereche comună de electroni este distribuit în spațiu simetric față de nucleele atomilor. Un exemplu sunt moleculele diatomice formate din atomi ai unui element: H 2 , Cl 2 , O 2 , N 2 , F 2 . Perechea lor de electroni aparține în mod egal ambilor atomi.
În cazul unei legături polare, norul de electroni care formează legătura este deplasat spre atomul cu o electronegativitate relativă mai mare.
Exemple sunt molecule: HCl, H 2 O, H 2 S, N 2 S, NH 3 etc. Luați în considerare formarea moleculei de HCl, care poate fi reprezentată prin următoarea schemă
![]()
Perechea de electroni este mutată la atomul de clor, deoarece electronegativitatea relativă a atomului de clor (2.83) este mai mare decât cea a atomului de hidrogen (2.1).
b). Saturabilitatea.
Capacitatea atomilor de a participa la formarea unui număr limitat de legături covalente se numește saturația unei legături covalente. Saturația legăturilor covalente se datorează faptului că doar electronii externi participă la interacțiunea chimică. niveluri de energie, adică un număr limitat de electroni.
în) . Orientareși hibridizarea legăturii covalente.
O legătură covalentă se caracterizează prin orientarea în spațiu. Acest lucru se explică prin faptul că norii de electroni au o anumită formă și suprapunerea lor maximă este posibilă cu o anumită orientare spațială.
Direcția legăturii covalente determină structura geometrică a moleculelor.
De exemplu, pentru apă, are o formă triunghiulară.
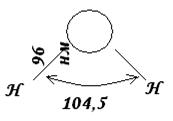
Orez. 7. Structura spațială a moleculei de apă.
S-a stabilit experimental că în molecula de apă H 2 O distanța dintre nucleele de hidrogen și oxigen este de 0,096 nm (96 pm). Unghiul dintre liniile care trec prin nuclee este 104,5 0 . Astfel, molecula de apă are o formă unghiulară și structura sa poate fi exprimată sub forma figurii prezentate.
Hibridizare
Ca experimental şi studii teoretice(Slater, Pauling) în timpul formării unor compuși, cum ar fi BeCl 2 , BeF 2 , BeBr 2 , starea electronilor de valență ai unui atom dintr-o moleculă nu este descrisă de funcțiile de undă s-, p-, d- pure. , ci prin combinațiile lor liniare. Astfel de structuri mixte se numesc orbitali hibrizi, iar procesul de amestecare se numește hibridizare.
După cum arată calculele chimice cuantice, amestecarea orbitalilor s și p ai unui atom este un proces favorabil pentru formarea unei molecule. În acest caz, se eliberează mai multă energie decât în formarea de legături care implică orbitali s și p puri. Prin urmare, hibridizarea orbitalilor electronici ai unui atom duce la o scădere mare a energiei sistemului și, în consecință, la o creștere a stabilității moleculei. Un orbital hibridizat este mai alungit pe o parte a nucleului decât pe cealaltă. Prin urmare, densitatea de electroni în regiunea de suprapunere a norului hibrid va fi mai mare decât densitatea de electroni în regiunea de suprapunere a orbitalilor s și p separat, drept urmare legătura formată de electronii orbitalului hibrid este caracterizat printr-o putere mai mare.
Există mai multe tipuri de stări hibride. Când orbitalii s și p se hibridizează (numit hibridizare sp), apar doi orbitali hibrizi, situați la un unghi de 180 0 unul față de celălalt. În acest caz, se formează o structură liniară. Această configurație (structură) este cunoscută pentru majoritatea halogenurilor de metal alcalino-pământos (de exemplu, BeX 2 unde X=Cl, F, Br), adică. unghiul de conectare este de 180 0 С.

Orez. 8. hibridizare sp
Un alt tip de hibridizare, numit hibridizare sp 2 (formată dintr-un orbital s și doi p), duce la formarea a trei orbitali hibrizi, care sunt situați la un unghi de 120 0 unul față de celălalt. În acest caz, în spațiu se formează o structură trigonală a unei molecule (sau un triunghi regulat). Astfel de structuri sunt cunoscute pentru compușii BX3 (X=Cl, F, Br).



Orez. 9. hibridizare sp 2.
Nu mai puțin frecventă este hibridizarea sp 3, care se formează din un orbital s și trei p. În acest caz, se formează patru orbitali hibrizi, orientați în spațiu simetric față de cele patru vârfuri ale tetraedrului, adică sunt situați la un unghi de 109 0 28". Această poziție spațială se numește tetraedrică. O astfel de structură este cunoscută pentru moleculele NH 3, H 2 O și, în general, pentru elementele perioadei II. Schematic imaginea sa în spațiu poate fi afișată în figura următoare

Orez. 10. Dispunerea spațială a legăturilor în molecula de amoniac,
proiectat pe un avion.
Formarea legăturilor tetraedrice datorită hibridizării sp 3 poate fi reprezentată după cum urmează (Fig. 11):
Orez. 11. Formarea de legături tetraedrice în timpul hibridizării sp 3.
Formarea legăturilor tetraedrice în timpul hibridizării sp 3 este prezentată în fig. 12.

Fig.12. Formarea de legături tetraedrice în timpul sp 3 - hibridizare în molecule CCl 4
Hibridizarea se referă nu numai la orbitalii s și p. Pentru a explica elementele stereochimice ale perioadelor III și ulterioare, devine necesar să se construiască simultan orbitali hibrizi incluzând orbitali s, p, d.
Substanțele cu o legătură covalentă includ:
1. compuși organici;
2. solidă şi substanțe lichide, în care se formează legături între perechi de atomi de halogen, precum și între perechi de atomi de hidrogen, azot și oxigen, de exemplu, H2;
3. elemente din grupa VI (de exemplu, lanțuri spiralate de telur), elemente din grupa V (de exemplu, arsen), elemente din grupa IV (diamant, siliciu, germaniu);
4. compuși care respectă regula 8-N (cum ar fi InSb, CdS, GaAs, CdTe), când elementele care le formează sunt situate în tabelul periodic al lui Mendeleev în grupele II-VI, III-V.
LA solide cu o legătură covalentă, se pot forma diferite structuri cristaline pentru aceeași substanță, a cărei energie de legare este practic aceeași. De exemplu, structura ZnS poate fi cubică (blendă de zinc) sau hexagonală (wurtzit). Dispunerea celor mai apropiati vecini din blenda de zinc si wurtzita este aceeasi, iar singura si usoara diferenta a energiilor acestor doua structuri este determinata de aranjarea atomilor care urmeaza celor mai apropiati. Această capacitate a unor substanțe se numește alotropie sau polimorfism. Un alt exemplu de alotropie este carbura de siliciu, care are un număr de politite de diferite structuri de la pur cubic la hexagonal. Aceste numeroase modificări cristaline ale ZnS, SiC există la temperatura camerei.
Legătură ionică
O legătură ionică este o forță electrostatică de atracție între ioni cu sarcini opuse (adică + și -).
Ideea legăturii ionice s-a format pe baza ideilor lui V. Kossel. El a sugerat (1916) că atunci când doi atomi interacționează, unul dintre ei renunță, iar celălalt acceptă electroni. Astfel, o legătură ionică se formează ca urmare a transferului unuia sau mai multor electroni de la un atom la altul. De exemplu, în clorura de sodiu, o legătură ionică se formează ca urmare a transferului unui electron de la un atom de sodiu la un atom de clor. Ca urmare a acestui transfer, se formează un ion de sodiu cu o sarcină de +1 și un ion de clor cu o sarcină de -1. Sunt atrași unul de celălalt de forțele electrostatice, formând o moleculă stabilă. Modelul de transfer de electroni propus de Kossel face posibilă explicarea formării unor compuși precum fluorură de litiu, oxid de calciu și oxid de litiu.
Cei mai tipici compuși ionici constau din cationi metalici aparținând grupelor I și II ale sistemului periodic și anioni ai elementelor nemetalice aparținând grupelor VI și VII.
Ușurința de formare a unui compus ionic depinde de ușurința de formare a cationilor și anionilor săi constituenți. Ușurința de formare este mai mare, cu atât energia de ionizare este mai mică atomul care donează electroni (donatorul de electroni), iar atomul care acceptă electroni (acceptorul de electroni) are o afinitate mai mare pentru electron. afinitate electronică este o măsură a capacității unui atom de a accepta un electron. Este definit cantitativ ca schimbarea energiei care are loc atunci când dintr-un mol de atomi se formează un mol de anioni încărcați individual. Acesta este așa-numitul concept de „prima afinitate electronică”. Cea de-a doua afinitate electronică este schimbarea energiei care are loc atunci când un mol de anioni încărcați dublu se formează dintr-un mol de anioni încărcați unic. Aceste concepte, adică energia de ionizare și afinitatea electronică, se referă la substanțele gazoase și sunt caracteristici ale atomilor și ionilor din stare gazoasă. Dar trebuie avut în vedere că majoritatea compușilor ionici sunt cei mai stabili în stare solidă. Această împrejurare se explică prin existența unei rețele cristaline în stare solidă. Se pune întrebarea. De ce, până la urmă, compușii ionici sunt mai stabili sub formă de rețele cristaline și nu în stare gazoasă? Răspunsul la această întrebare este calculul energiei rețelei cristaline, pe baza modelului electrostatic. În plus, acest calcul este și un test al teoriei legăturii ionice.
Pentru a calcula energia rețelei cristaline, este necesar să se determine munca care trebuie cheltuită pentru distrugerea rețelei cristaline cu formarea de ioni gazoși. Pentru calcul se folosește conceptul de forțe de atracție și repulsie. Expresia energiei potențiale de interacțiune a ionilor cu încărcare individuală se obține prin însumarea energiei de atracție și a energiei de repulsie.
E \u003d E inc + E out (1).
Ca E prit, energia atracției coulombiane a ionilor cu semne opuse este luată, de exemplu, Na + și Cl - pentru compusul NaCl
E int \u003d -e 2 / 4πε 0 r (2),
întrucât distribuția sarcinii electronice în învelișul de electroni umplut este simetrică sferic. Datorită respingerii care apare datorită principiului Pauli atunci când învelișurile umplute ale anionului și cationului se suprapun, distanța la care ionii se pot apropia este limitată. Energia respingătoare se schimbă rapid cu distanța internucleară și poate fi scrisă ca următoarele două expresii aproximative:
E otm \u003d A / r n (n≈12) (3)
E otm \u003d B ∙ exp (-r / ρ) (4),
unde A și B sunt constante, r este distanța dintre ioni, ρ este un parametru (lungimea caracteristică).
Trebuie remarcat faptul că niciuna dintre aceste expresii nu corespunde unui proces mecanic cuantic complex care duce la repulsie.
În ciuda aproximării acestor formule, ele permit să se calculeze cu exactitate și, în consecință, să descrie legătura chimică din moleculele unor astfel de compuși ionici precum NaCl, KCl, CaO.
Întrucât câmpul electric al ionului are simetrie sferică (Fig. 13), legătura ionică, spre deosebire de legătura covalentă, nu are direcționalitate. Interacțiunea a doi ioni încărcați opus este compensată de forțe de repulsie numai în direcția care leagă centrele nucleelor ionilor; în alte direcții, câmpurile electrice ale ionilor nu sunt compensate. Prin urmare, ei sunt capabili să interacționeze cu alți ioni. Astfel, o legătură ionică nu are saturație.
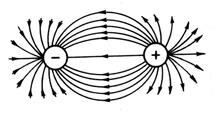
Orez. 13. Simetrie sferică câmp electrostatic
taxe cu taxe opuse.
Datorită nedirecționalității și nesaturației legăturii ionice, aceasta este cea mai favorabilă din punct de vedere energetic atunci când fiecare ion este înconjurat de număr maxim ioni de semn opus. Datorită acestui fapt, cea mai preferată formă de existență a unui compus ionic este un cristal. De exemplu, într-un cristal de NaCl, fiecare cation are șase anioni ca vecini cei mai apropiați.
Doar cand temperaturi mariîn stare gazoasă, compușii ionici există sub formă de molecule neasociate.
La compușii ionici, numărul de coordonare nu depinde de specificul structurii electronice a atomilor, ca în compușii covalenti, ci este determinat de raportul dintre dimensiunile ionilor. Cu un raport al razelor ionice în intervalul 0,41 - 0,73, se observă coordonarea octaedrică a ionilor, cu un raport de 0,73-1,37 - coordonare cubică etc.
Astfel, în condiții normale, compușii ionici sunt substanțe cristaline. Conceptul de molecule cu doi ioni, de exemplu, NaCL, CsCl nu este aplicabil acestora. Fiecare cristal este alcătuit dintr-un număr mare de ioni.
O legătură ionică poate fi reprezentată ca o legătură polară limitativă, pentru care sarcina efectivă a unui atom este aproape de unitate. Pentru o legătură nepolară pur covalentă, sarcina efectivă a atomilor este zero. În substanțele reale, legăturile pur ionice și pur covalente sunt rare. Majoritatea compușilor au o natură intermediară a legăturii dintre covalentul nepolar și ionic polar. Adică, în acești compuși, legătura covalentă are un caracter parțial ionic. Natura legăturilor ionice și covalente din substanțele reale este prezentată în Figura 14.

Orez. 14. Natura ionică și covalentă a legăturii.
Proporția naturii ionice a legăturii se numește grad de ionicitate. Se caracterizează prin sarcinile efective ale atomilor din moleculă. Gradul de ionicitate crește odată cu creșterea diferenței de electronegativitate a atomilor săi constitutivi.
conexiune metalica
În atomii metalici, electronii externi de valență sunt ținuți mult mai slab decât în atomii nemetalici. Aceasta determină pierderea conexiunii electronilor cu atomii individuali pentru o perioadă de timp suficient de lungă și socializarea acestora. Se formează un ansamblu socializat de electroni externi. Existența unui astfel de sistem electronic duce la apariția unor forțe care mențin ionii metalici pozitivi într-o stare apropiată, în ciuda încărcăturii lor similare. O astfel de legătură se numește legătură metalică. O astfel de legătură este caracteristică numai unui metal și există în solid și stare lichida substante. O legătură metalică este un tip de legătură chimică. Se bazează pe socializarea electronilor externi, care își pierd legătura cu atomul și de aceea se numesc electroni liberi (Fig. 15).
Orez. 15. Racord metalic.
Următoarele fapte confirmă existența unei legături metalice. Toate metalele au o conductivitate termică ridicată și o conductivitate electrică ridicată, care este asigurată de prezența electronilor liberi. În plus, aceeași circumstanță determină reflectivitate bună a metalelor la iradierea luminii, strălucirea și opacitatea lor, plasticitatea ridicată și un coeficient de temperatură pozitiv al rezistenței electrice.
Stabilitatea rețelei cristaline a metalelor nu poate fi explicată prin astfel de tipuri de legături precum ionice și covalente. Legătura ionică între atomii de metal situați la nodurile rețelei cristaline este imposibilă, deoarece au aceeași sarcină. O legătură covalentă între atomi de metal este, de asemenea, puțin probabilă, deoarece fiecare atom are 8 până la 12 vecini cei mai apropiați, iar formarea legăturilor covalente cu atât de multe perechi de electroni partajați este necunoscută.
Structurile metalice se caracterizează prin faptul că au un aranjament destul de rar al atomilor (distanțele internucleare sunt mari) și număr mare cei mai apropiați vecini ai fiecărui atom din rețeaua cristalină. Tabelul 1 enumeră trei structuri metalice tipice.
tabelul 1
Caracteristicile structurilor celor mai comune trei metale
Vedem că fiecare atom participă la formarea unui număr mare de legături (de exemplu, cu 8 atomi). Un număr atât de mare de legături (cu 8 sau 12 atomi) nu poate fi localizat simultan în spațiu. Comunicarea trebuie efectuată datorită rezonanței mișcare oscilatorie electronii externi ai fiecărui atom, ceea ce are ca rezultat colectivizarea tuturor electronilor externi ai cristalului cu formarea unui gaz de electroni. În multe metale, este suficient să luați un electron de la fiecare atom pentru a forma o legătură metalică. Este exact ceea ce se observă pentru litiu, care are un singur electron în învelișul exterior. Un cristal de litiu este o rețea de ioni Li + (bile cu o rază de 0,068 nm) înconjurată de un gaz de electroni.

Orez. 16. Diverse tipuri de ambalare cristalină: ambalare apropiată a-hexagonală; b - garnitură cubică centrată pe față; Ambalaj B-cubic.
Există asemănări între legăturile metalice și covalente. Constă în faptul că ambele tipuri de legături se bazează pe socializarea electronilor de valență. Cu toate acestea, o legătură covalentă conectează doar doi atomi învecinați, iar electronii împărtășiți sunt în imediata apropiere a atomilor conectați. Într-o legătură metalică, mai mulți atomi participă la socializarea electronilor de valență.
Astfel, conceptul unei legături metalice este indisolubil legat de ideea metalelor ca un set de nuclee ionice încărcate pozitiv, cu spații mari între ionii umpluți cu gaz de electroni, în timp ce la nivel macroscopic sistemul rămâne neutru din punct de vedere electric.
Pe lângă tipurile de legături chimice discutate mai sus, există și alte tipuri de legături care sunt intermoleculare: legătura de hidrogen, interacțiunea van der Waals, interacțiunea donor-acceptor.
Interacțiunea donor-acceptor a moleculelor
Mecanismul de formare a unei legături covalente datorită unui nor cu doi electroni al unui atom și unui orbital liber al altuia se numește donor-acceptor. Un atom sau o particulă care oferă un nor de doi electroni pentru comunicare se numește donator. Un atom sau o particulă cu un orbital liber care acceptă această pereche de electroni se numește acceptor.
Principalele tipuri de interacțiuni intermoleculare. legătură de hidrogen
Între moleculele saturate de valență, la distanțe care depășesc dimensiunea particulelor, pot apărea forțe electrostatice de atracție intermoleculară. Ele sunt numite forțe van der Waals. Interacțiunea van der Waals există întotdeauna între atomi distanțați, dar joacă un rol important doar în absența mecanismelor de legare mai puternice. Această interacțiune slabă cu o energie caracteristică de 0,2 eV/atom are loc între atomi neutri și între molecule. Numele interacțiunii este asociat cu numele lui van der Waals, deoarece el a fost primul care a sugerat că ecuația de stare, ținând cont de interacțiunea slabă dintre moleculele de gaz, descrie proprietățile gazelor reale mult mai bine decât ecuația de stat gaz ideal. Cu toate acestea, natura acestei forțe atractive a fost explicată abia în 1930 de Londra. În prezent, următoarele trei tipuri de interacțiuni sunt atribuite atracției Van der Waals: orientativă, de inducție, de dispersie (efectul Londra). Energia de atracție van der Waals este determinată de suma interacțiunilor de orientare, inducție și dispersie.
E int = E op + E ind + E disp (5).
Interacțiunea de orientare (sau interacțiunea dipol-dipol) se manifestă între moleculele polare, care, atunci când sunt abordate, se întorc (se orientează) unele către altele cu poli opuși astfel încât energie potențială sistemul de molecule a devenit minim. Energia interacțiunii de orientare este cu atât mai semnificativă, cu cât momentul dipol al moleculelor μ este mai mare și distanța l dintre ele este mai mică:
E op \u003d - (μ 1 μ 2) 2 / (8π 2 ∙ε 0 ∙l 6) (6),
unde ε 0 este o constantă electrică.
Interacțiunea inductivă este asociată cu procesele de polarizare a moleculelor de către dipolii din jur. Este cu cât este mai semnificativă, cu atât polarizabilitatea α a moleculei nepolare este mai mare și cu atât este mai mare momentul dipol μ al moleculei polare.
E ind \u003d - (αμ 2) / (8π 2 ∙ε 0 ∙l 6) (7).
Polarizabilitatea α a unei molecule nepolare se numește polarizabilitate la deformare, deoarece este asociată cu deformarea particulei, în timp ce μ caracterizează deplasarea norului de electroni și a nucleelor în raport cu pozițiile lor anterioare.
Interacțiunea de dispersie (efectul Londra) are loc în orice moleculă, indiferent de structura și polaritatea acestora. Datorită nepotrivirii instantanee a centrelor de greutate ale sarcinilor norului de electroni și nucleelor, se formează un dipol instantaneu, care induce dipoli instantanei în alte particule. Mișcarea dipolilor instantanei devine coordonată. Ca rezultat, particulele învecinate experimentează atracție reciprocă. Energia de interacțiune a dispersiei depinde de energia de ionizare E I și de polarizabilitatea moleculelor α
E disp \u003d - (E I 1 ∙ E I 2) ∙ α 1 α 2 / (E I 1 + E I 2) l 6 (8).
Legătura de hidrogen are un caracter intermediar între valentă și interacțiunile intermoleculare. Energia legăturii de hidrogen este scăzută, 8-80 kJ/mol, dar este mai mare decât energia de interacțiune van der Waals. Legătura de hidrogen este caracteristică lichidelor precum apa, alcoolii, acizii și se datorează unui atom de hidrogen polarizat pozitiv. Dimensiunea mică și absența electronilor interni permit atomului de hidrogen prezent într-un lichid în orice compus să intre în interacțiune suplimentară cu un atom polarizat negativ al altei sau aceleiași molecule care nu este legat covalent de acesta.
A δ- - H δ+ .... A 5--H 5+.
Adică există o asociere de molecule. Asocierea moleculelor duce la o scădere a volatilității, la creșterea punctului de fierbere și a căldurii de vaporizare, la creșterea vâscozității și permisivitatea lichide.
Apa este o substanță deosebit de potrivită pentru formarea legăturilor de hidrogen, deoarece molecula sa are doi atomi de hidrogen și două perechi singure la atomul de oxigen. Acest lucru determină un moment dipol ridicat al moleculei (μ D = 1,86 D) și capacitatea de a forma patru legături de hidrogen: două ca donor de protoni și două ca acceptor de protoni
(H 2 O .... N - O ... H 2 O) de 2 ori.
Din experimente se știe că cu o modificare a greutății moleculare în serie compuși cu hidrogen elemente ale perioadei a treia și următoare, punctul de fierbere crește. Dacă acest model este aplicat apei, atunci punctul său de fierbere nu ar trebui să fie 100 0 C, ci 280 0 C. Această contradicție confirmă existența unei legături de hidrogen în apă.
Experimentele au arătat că asociații moleculari se formează în apă lichidă și mai ales în apă solidă. Gheața are o rețea cristalină tetraedrică. În centrul tetraedrului se află un atom de oxigen al unei molecule de apă, la patru vârfuri sunt atomi de oxigen ai moleculelor învecinate, care sunt legați prin legături de hidrogen cu cei mai apropiați vecini ai lor. În apa lichidă, legăturile de hidrogen sunt parțial rupte; în structura sa, se observă un echilibru dinamic între asociații de molecule și moleculele libere.
Metoda legăturii de valență
Teoria legăturilor de valență, sau perechile de electroni localizate, presupune că fiecare pereche de atomi dintr-o moleculă este ținută împreună de una sau mai multe perechi de electroni partajate. În reprezentarea teoriei legăturilor de valență, o legătură chimică este localizată între doi atomi, adică este bicentrică și cu doi electroni.
Metoda legăturilor de valență se bazează pe următoarele prevederi principale:
Fiecare pereche de atomi dintr-o moleculă este ținută împreună de una sau mai multe perechi de electroni partajați;
O singură legătură covalentă este formată din doi electroni cu spini antiparaleli localizați în orbitalii de valență ai atomilor de legătură;
Când se formează o legătură, funcțiile de undă ale electronilor se suprapun, ceea ce duce la o creștere a densității electronilor între atomi și la o scădere a energie totală sisteme;
Fiecare atom are un anumit număr de electroni.
Intrând în reacții chimice, atomii donează, dobândesc sau socializează electroni, atingând cea mai stabilă configurație electronică. Configurația cu cea mai scăzută energie este cea mai stabilă (ca în atomii de gaz nobil). Acest model este numit „regula octetului” (Fig. 1).
Orez. unu.
Această regulă se aplică tuturor tipuri de conexiuni. Legăturile electronice dintre atomi le permit să formeze structuri stabile, de la cele mai simple cristale până la biomolecule complexe care în cele din urmă formează sisteme vii. Ele diferă de cristale prin metabolismul lor continuu. Cu toate acestea, multe reacții chimice au loc în funcție de mecanisme transfer electronic, care joacă un rol important în procesele energetice din organism.
O legătură chimică este o forță care ține împreună doi sau mai mulți atomi, ioni, molecule sau orice combinație a acestora..
Natura legăturii chimice este universală: este o forță electrostatică de atracție între electronii încărcați negativ și nucleele încărcate pozitiv, determinată de configurația electronilor din învelișul exterior al atomilor. Capacitatea unui atom de a forma legături chimice se numește valenţă, sau starea de oxidare. Conceptul de electroni de valență- electroni care formează legături chimice, adică cei localizați în cei mai mari orbitali de energie. În consecință, învelișul exterior al unui atom care conține acești orbitali se numește coajă de valență. În prezent, nu este suficientă indicarea prezenței unei legături chimice, dar este necesară clarificarea tipului acesteia: ionic, covalent, dipol-dipol, metalic.
Primul tip de conexiune esteionic conexiune
Conform teoriei electronice a valenței a lui Lewis și Kossel, atomii pot obține o configurație electronică stabilă în două moduri: în primul rând, prin pierderea de electroni, devenind cationi, în al doilea rând, dobândirea lor, transformându-se în anionii. Ca urmare a transferului de electroni, datorită forței electrostatice de atracție dintre ionii cu sarcini de semn opus, se formează o legătură chimică, numită Kossel " electrovalent(acum numit ionic).
În acest caz, anionii și cationii formează o configurație electronică stabilă cu o înveliș electron exterior umplut. Legăturile ionice tipice sunt formate din cationii grupelor T și II ale sistemului periodic și anionii elementelor nemetalice din grupele VI și VII (16 și, respectiv, 17 subgrupe, calcogeniși halogeni). Legăturile din compușii ionici sunt nesaturate și nedirecționale, deci păstrează posibilitatea interacțiunii electrostatice cu alți ioni. Pe fig. 2 și 3 prezintă exemple de legături ionice corespunzătoare modelului de transfer de electroni Kossel.

Orez. 2.

Orez. 3. Legătura ionică în molecula de clorură de sodiu (NaCl).
Aici este oportun să reamintim unele dintre proprietățile care explică comportamentul substanțelor în natură, în special să luăm în considerare conceptul de aciziși temeiuri.
Soluțiile apoase ale tuturor acestor substanțe sunt electroliți. Își schimbă culoarea în moduri diferite. indicatori. Mecanismul de acțiune al indicatorilor a fost descoperit de F.V. Ostwald. El a arătat că indicatorii sunt acizi sau baze slabe, a căror culoare în stările nedisociate și disociate este diferită.
Bazele pot neutraliza acizii. Nu toate bazele sunt solubile în apă (de exemplu, unii compuși organici care nu conțin grupări -OH sunt insolubili, în special, trietilamină N (C2H5)3); se numesc baze solubile alcalii.
Soluțiile apoase de acizi intră în reacții caracteristice:
a) cu oxizi metalici - cu formare de sare si apa;
b) cu metale - cu formarea de sare si hidrogen;
c) cu carbonați - cu formare de sare, CO 2 și H 2 O.
Proprietățile acizilor și bazelor sunt descrise de mai multe teorii. În conformitate cu teoria S.A. Arrhenius, un acid este o substanță care se disociază pentru a forma ioni H+ , în timp ce baza formează ioni EL- . Această teorie nu ține cont de existența bazelor organice care nu au grupări hidroxil.
In linie cu proton Teoria lui Bronsted și Lowry, un acid este o substanță care conține molecule sau ioni care donează protoni ( donatori protoni), iar baza este o substanță formată din molecule sau ioni care acceptă protoni ( acceptori protoni). Rețineți că în soluțiile apoase, ionii de hidrogen există într-o formă hidratată, adică sub formă de ioni de hidroniu H3O+ . Această teorie descrie reacții nu numai cu ioni de apă și hidroxid, ci și efectuate în absența unui solvent sau cu un solvent neapos.
De exemplu, în reacția dintre amoniac NH 3 (bază slabă) și clorură de hidrogen în faza gazoasă, se formează clorură de amoniu solidă, iar într-un amestec de echilibru de două substanțe există întotdeauna 4 particule, dintre care două sunt acizi, iar celelalte două sunt baze:
Acest amestec de echilibru constă din două perechi conjugate de acizi și baze:
1)NH 4+ și NH 3
2) acid clorhidricși Cl ‑
Aici, în fiecare pereche conjugată, acidul și baza diferă cu un proton. Fiecare acid are o bază conjugată. Un acid tare are o bază conjugată slabă, iar un acid slab are o bază conjugată puternică.
Teoria Bronsted-Lowry face posibilă explicarea rolului unic al apei pentru viața biosferei. Apa, în funcție de substanța care interacționează cu ea, poate prezenta proprietățile fie ale unui acid, fie ale unei baze. De exemplu, în reacțiile cu soluții apoase de acid acetic, apa este o bază, iar cu soluții apoase de amoniac, este un acid.
1) CH3COOH + H2O ↔ H3O + + CH 3 SOO- . Aici molecula de acid acetic donează un proton moleculei de apă;
2) NH3 + H2O ↔ NH4 + + EL- . Aici molecula de amoniac acceptă un proton din molecula de apă.
Astfel, apa poate forma două perechi conjugate:
1) H2O(acid) și EL- (bază conjugată)
2) H3O+ (acid) și H2O(bază conjugată).
În primul caz, apa donează un proton, iar în al doilea, îl acceptă.
O astfel de proprietate se numește amfiprotonitate. Sunt numite substanțe care pot reacționa atât ca acizi, cât și ca baze amfoter. Astfel de substanțe se găsesc adesea în natură. De exemplu, aminoacizii pot forma săruri atât cu acizi, cât și cu baze. Prin urmare, peptidele formează cu ușurință compuși de coordonare cu ionii metalici prezenți.
Astfel, proprietatea caracteristică a unei legături ionice este deplasarea completă a unui grup de electroni de legare la unul dintre nuclee. Aceasta înseamnă că există o regiune între ioni în care densitatea electronilor este aproape zero.
Al doilea tip de conexiune estecovalent conexiune
Atomii pot forma configurații electronice stabile prin împărțirea electronilor.
O astfel de legătură se formează atunci când o pereche de electroni este împărțită pe rând. de la fiecare atom. În acest caz, electronii de legătură socializați sunt distribuiți în mod egal între atomi. Un exemplu de legătură covalentă este homonuclear diatomic molecule H 2 , N 2 , F 2. Alotropii au același tip de legătură. O 2 și ozon O 3 și pentru o moleculă poliatomică S 8 și de asemenea molecule heteronucleare acid clorhidric acid clorhidric, dioxid de carbon CO 2, metan CH 4, etanol DIN 2 H 5 EL, hexafluorură de sulf SF 6, acetilena DIN 2 H 2. Toate aceste molecule au aceiași electroni comuni, iar legăturile lor sunt saturate și direcționate în același mod (Fig. 4).
Pentru biologi, este important ca razele covalente ale atomilor din legături duble și triple să fie reduse în comparație cu o singură legătură.
![]()
Orez. patru. Legătura covalentă în molecula de Cl2.
Tipurile ionice și covalente de legături sunt două cazuri limitative ale multor tipuri existente de legături chimice, iar în practică majoritatea legăturilor sunt intermediare.
Compușii a două elemente situate la capete opuse ale aceleiași perioade sau perioade diferite ale sistemului Mendeleev formează predominant legături ionice. Pe măsură ce elementele se apropie unele de altele într-o perioadă, natura ionică a compușilor lor scade, în timp ce caracterul covalent crește. De exemplu, halogenurile și oxizii elementelor din partea stângă a tabelului periodic formează predominant legături ionice ( NaCl, AgBr, BaS04, CaCO3, KNO3, CaO, NaOH), și aceiași compuși ai elementelor din partea dreaptă a tabelului sunt covalenti ( H20, CO2, NH3, NO2, CH4, fenol C6H5OH, glucoza C6H12O6, etanol C2H5OH).
Legătura covalentă, la rândul ei, are o altă modificare.
În ionii poliatomici și în moleculele biologice complexe, ambii electroni pot proveni doar din unu atom. Se numeste donator pereche de electroni. Se numește un atom care socializează această pereche de electroni cu un donor acceptor pereche de electroni. Acest tip de legătură covalentă se numește coordonare (donator-acceptator, saudativ) comunicare(Fig. 5). Acest tip de legătură este cel mai important pentru biologie și medicină, deoarece chimia celor mai importante elemente d pentru metabolism este în mare măsură descrisă de legăturile de coordonare.
![]()
Pic. 5.
De regulă, într-un compus complex, un atom de metal acționează ca un acceptor de pereche de electroni; dimpotrivă, în legăturile ionice și covalente, atomul de metal este donor de electroni.
Esența legăturii covalente și varietatea acesteia - legătura de coordonare - poate fi clarificată cu ajutorul unei alte teorii a acizilor și bazelor, propusă de GN. Lewis. El a extins oarecum conceptul semantic al termenilor „acid” și „bază” conform teoriei Bronsted-Lowry. Teoria Lewis explică natura formării ionilor complecși și participarea substanțelor la reacțiile de substituție nucleofilă, adică la formarea CS.
Potrivit lui Lewis, un acid este o substanță capabilă să formeze o legătură covalentă prin acceptarea unei perechi de electroni dintr-o bază. O bază Lewis este o substanță care are o pereche singură de electroni, care, donând electroni, formează o legătură covalentă cu acidul Lewis.
Adică, teoria Lewis extinde gama reacțiilor acido-bazice și la reacții în care protonii nu participă deloc. În plus, protonul însuși, conform acestei teorii, este și un acid, deoarece este capabil să accepte o pereche de electroni.

Prin urmare, conform acestei teorii, cationii sunt acizi Lewis și anionii sunt baze Lewis. Următoarele reacții sunt exemple:
S-a remarcat mai sus că subdiviziunea substanțelor în ionice și covalente este relativă, deoarece nu există un transfer complet al unui electron de la atomii de metal la atomii acceptori din moleculele covalente. În compușii cu o legătură ionică, fiecare ion se află în câmpul electric al ionilor de semn opus, deci sunt polarizați reciproc, iar învelișurile lor sunt deformate.
Polarizabilitate determinat de structura electronică, sarcina și dimensiunea ionului; este mai mare pentru anioni decât pentru cationi. Cea mai mare polarizabilitate dintre cationi este pentru cationii cu sarcină mai mare și dimensiuni mai mici, de exemplu, pentru Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Are un puternic efect de polarizare H+ . Deoarece efectul polarizării ionilor este bifax, schimbă semnificativ proprietățile compușilor pe care îi formează.
Al treilea tip de conexiune -dipol-dipol conexiune
Pe lângă tipurile de comunicare enumerate, există și dipol-dipol intermolecular interacțiuni, cunoscute și ca van der Waals .
Puterea acestor interacțiuni depinde de natura moleculelor.
Există trei tipuri de interacțiuni: dipol permanent - dipol permanent ( dipol-dipol atracţie); dipol permanent - dipol indus ( inducţie atracţie); dipol instantaneu - dipol indus ( dispersie atracție sau forțe londoneze; orez. 6).

Orez. 6.
Doar moleculele cu legături covalente polare au un moment dipol-dipol ( HCI, NH3, S02, H20, C6H5CI), iar puterea de legătură este 1-2 la revedere(1D \u003d 3,338 × 10 -30 metri coulomb - C × m).
În biochimie, se distinge un alt tip de legătură - hidrogen conexiune, care este un caz limitativ dipol-dipol atracţie. Această legătură se formează prin atracția dintre un atom de hidrogen și un mic atom electronegativ, cel mai adesea oxigen, fluor și azot. Cu atomi mari care au o electronegativitate similară (de exemplu, cu clor și sulf), legătura de hidrogen este mult mai slabă. Atomul de hidrogen se distinge printr-o caracteristică esențială: atunci când electronii de legare sunt îndepărtați, nucleul său - protonul - este expus și încetează să fie ecranat de electroni.
Prin urmare, atomul se transformă într-un dipol mare.
O legătură de hidrogen, spre deosebire de o legătură van der Waals, se formează nu numai în timpul interacțiunilor intermoleculare, ci și în cadrul unei molecule - intramolecular legătură de hidrogen. Legăturile de hidrogen joacă un rol important în biochimie, de exemplu, pentru stabilizarea structurii proteinelor sub formă de a-helix, sau pentru formarea unei duble helix ADN (Fig. 7).

Fig.7.
Legăturile de hidrogen și van der Waals sunt mult mai slabe decât legăturile ionice, covalente și de coordonare. Energia legăturilor intermoleculare este indicată în tabel. unu.
Tabelul 1. Energia forțelor intermoleculare
Notă: Gradul de interacțiuni intermoleculare reflectă entalpia de topire și evaporare (fierbere). Compușii ionici necesită mult mai multă energie pentru a separa ionii decât pentru a separa molecule. Entalpiile de topire ale compuşilor ionici sunt mult mai mari decât cele ale compuşilor moleculari.
Al patrulea tip de conexiune -legatura metalica
În cele din urmă, există un alt tip de legături intermoleculare - metal: conexiunea ionilor pozitivi ai rețelei de metale cu electronii liberi. Acest tip de conexiune nu apare la obiectele biologice.
Dintr-o scurtă trecere în revistă a tipurilor de legături, reiese un detaliu: un parametru important al unui atom sau ion al unui metal - un donor de electroni, precum și un atom - un acceptor de electroni este marimea.
Fără a intra în detalii, observăm că razele covalente ale atomilor, razele ionice ale metalelor și razele van der Waals ale moleculelor care interacționează cresc pe măsură ce numărul lor atomic în grupurile sistemului periodic crește. În acest caz, valorile razelor ionice sunt cele mai mici, iar razele van der Waals sunt cele mai mari. De regulă, la deplasarea în jos a grupului, razele tuturor elementelor cresc, atât covalente, cât și van der Waals.
Cele mai importante pentru biologi și medici sunt coordonare(donator-acceptator) legături considerate de chimia coordonării.
Bioanorganice medicale. G.K. Barașkov






