Configurația electronică a atomului tuturor elementelor. Învelișuri electronice ale atomului. Modele atomice Bohr
Cunoașterea stărilor posibile ale unui electron dintr-un atom, regula lui Klechkovsky, principiul lui Pauli și regula lui Hund fac posibilă luarea în considerare a configurației electronice a unui atom. Pentru aceasta se folosesc formule electronice.
Formula electronică denotă starea unui electron într-un atom, indicând principalul număr cuantic, care îi caracterizează starea, iar litera - numărul cuantic orbital. Un număr care indică câți electroni sunt într-o anumită stare este scris în dreapta vârfului literei care indică forma norului de electroni.
Pentru un atom de hidrogen (n \u003d 1, l \u003d 0, m \u003d 0), formula electronică va fi: 1s 1. Ambii electroni ai următorului element heliu He sunt caracterizați de aceleași valori ale lui n, l, m și diferă doar în spini. Formula electronică a atomului de heliu este ls 2 . Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil.
Pentru elementele perioadei a 2-a (n = 2, l = 0 sau l = 1), starea 2s este completată mai întâi, iar apoi subnivelul p al celui de-al doilea nivel energetic.
Formula electronică a atomului de litiu este: ls 2 2s 1. Electronul 2s 1 este mai puțin legat de nucleul atomic (Fig. 6), astfel încât atomul de litiu îl poate ceda cu ușurință (după cum vă amintiți evident, acest proces se numește oxidare), transformându-se în ion Li +.
Orez. 6.
Secțiuni transversale ale norilor de electroni 1s și 2s de către un plan care trece prin nucleu
În atomul de beriliu, al patrulea electron ocupă și starea 2s: ls 2 2s 2 . Cei doi electroni exteriori ai atomului de beriliu se desprind ușor - în acest caz, Be este oxidat la cationul Be 2+.
Atomul de bor are un electron în starea 2p: ls 2 2s 2 2p 1 . În continuare, la atomii de carbon, azot, oxigen și fluor (în conformitate cu regula lui Hund), se umple subnivelul 2p, care se termină la neonul gazului nobil: ls 2 2s 2 2p 6 .
Dacă vrem să subliniem că electronii de la un anumit subnivel ocupă celule cuantice unul câte unul, în formula electronică desemnarea subnivelului însoțește indicele. De exemplu, formula electronică a atomului de carbon
![]()
Pentru elementele perioadei a 3-a, se umple starea 3s (n = 3, l = 0) și, respectiv, subnivelul 3p (n = 3, l - 1). Subnivelul 3d (n = 3, l = 2) rămâne liber:
Uneori, în diagramele care prezintă distribuția electronilor în atomi, este indicat doar numărul de electroni la fiecare nivel de energie, adică ei notează formulele electronice abreviate ale atomilor elemente chimice, spre deosebire de formulele electronice complete de mai sus, de exemplu:
În elementele de perioade mari (a 4-a și a 5-a), în conformitate cu regula Klechkovsky, primii doi electroni ai stratului de electroni exterior ocupă, respectiv, stările 4s-(n = 4, l = 0) și 5s-stări (n = 5, l = 0):
Pornind de la al treilea element al fiecărei perioade mari, următorii zece electroni intră în subnivelurile anterioare 3d și respectiv 4d (pentru elementele subgrupurilor laterale):
De regulă, atunci când subnivelul d anterior este umplut, atunci subnivelul exterior (respectiv 4p- și 5p) p va începe să se umple:
Pentru elementele de perioade mari - al 6-lea și al 7-lea incomplet - nivelurile și subnivelurile de energie sunt umplute cu electroni, de regulă, după cum urmează: primii doi electroni intră în subnivelul s exterior, de exemplu:
următorul electron (pentru La și Ac) - la subnivelul d anterior:
Apoi următorii 14 electroni intră în al treilea nivel de energie din exterior către subnivelurile 4f și, respectiv, 5f pentru lantanide și actinide:
Apoi, al doilea nivel de energie exterior (subnivelul d) va începe să se acumuleze din nou pentru elementele subgrupurilor laterale:
Numai după ce subnivelul d este complet umplut cu zece electroni, subnivelul exterior p va fi umplut din nou:
În concluzie, vom lua în considerare din nou diferite moduri de afișare a configurațiilor electronice ale atomilor elementelor conform perioadelor din tabelul lui D. I. Mendeleev.
Luați în considerare elementele primei perioade - hidrogen și heliu.

Formulele electronice ale atomilor arată distribuția electronilor pe niveluri și subniveluri de energie.
Formulele electronice grafice ale atomilor arată distribuția electronilor nu numai pe niveluri și subniveluri, ci și după celule cuantice (orbitali atomici).

Într-un atom de heliu, primul strat de electroni este completat - are 2 electroni.
Hidrogenul și heliul sunt elemente s; subnivelul ls al acestor atomi este umplut cu electroni.
Pentru toate elementele perioadei a 2-a, primul strat de electroni este umplut, iar electronii umplu stările 2s și 2p în conformitate cu principiul energiei minime (întâi S-, apoi p) și cu regulile lui Pauli și Hund ( Masa 2).
În atomul de neon, al doilea strat de electroni este completat - are 8 electroni.
masa 2
Structura învelișurilor de electroni ale atomilor elementelor din perioada a 2-a

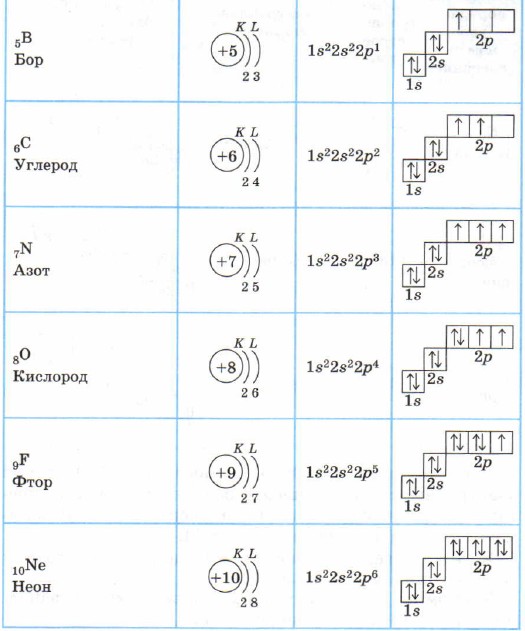
Litiu Li, beriliu Be - elemente s.
Borul B, carbonul C, azotul N, oxigenul O, fluorul F, neonul Ne sunt elemente p, subnivelul p al acestor atomi este umplut cu electroni.
Pentru atomii elementelor din perioada a 3-a, primul și al doilea strat de electroni sunt completați; prin urmare, al treilea strat de electroni este umplut, în care electronii pot ocupa stările 3s, 3p și 3d (Tabelul 3).
Tabelul 3
Structura învelișurilor de electroni ale atomilor elementelor din perioada a 3-a
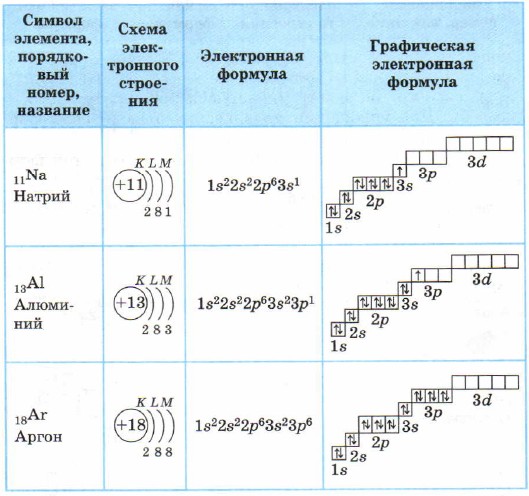
La atomul de magneziu, subnivelul 3s este finalizat. Sodiu Na și magneziu Mg sunt elemente s.
Pentru aluminiu și elementele care îl urmează, subnivelul 3p este umplut cu electroni.
Există 8 electroni în stratul exterior (al treilea strat de electroni) în atomul de argon. Ca strat exterior, este complet, dar în total, în al treilea strat de electroni, după cum știți deja, pot fi 18 electroni, ceea ce înseamnă că elementele din perioada a 3-a au o stare 3d goală.
Toate elementele de la aluminiu Al la argon Ar sunt elemente p.
Elementele s- și p formează principalele subgrupe din sistemul periodic.
Atomii elementelor din perioada a 4-a - potasiu și calciu - au un al patrulea nivel de energie, subnivelul 48 este umplut (Tabelul 4), deoarece, conform regulii Klechkovsky, are mai puțină energie decât subnivelul 3d.
Tabelul 4
Structura învelișurilor electronice ale atomilor elementelor din perioada a IV-a
![]()
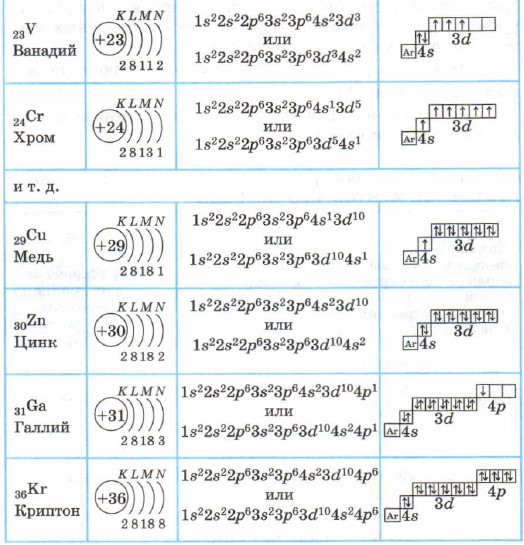
Pentru a simplifica formulele electronice grafice ale atomilor elementelor din perioada a 4-a:
Potasiul K și calciul Ca sunt elemente s incluse în principalele subgrupe. În atomii de la scandiu Sc la zinc Zn, subnivelul 3d este umplut cu electroni. Acestea sunt elemente 3D. Sunt incluse în subgrupele secundare, au un strat de electroni pre-extern umplut, sunt denumite elemente de tranziție.
Acordați atenție structurii învelișurilor de electroni ale atomilor de crom și cupru. În ele, are loc o „eșec” a unui electron de la nivelul 4s la subnivelul 3d, care se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate 3d 5 și 3d 10:
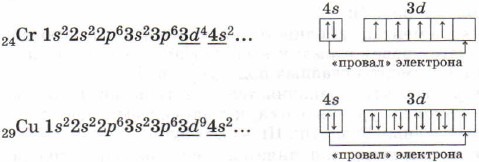
În atomul de zinc, al treilea nivel de energie este completat, toate subnivelurile sunt umplute în el - 3s, 3p și 3d, în total au 18 electroni.
În elementele care urmează zincului, al patrulea nivel de energie, subnivelul 4p, continuă să se umple.
Elementele de la galiu Ga la kripton Kr sunt elemente p.
Stratul exterior (al patrulea) al atomului de cripton Kr este complet și are 8 electroni. Dar doar în al patrulea strat de electroni, după cum știți, pot fi 32 de electroni; stările 4d și 4f ale atomului de cripton rămân încă neocupate.
Pentru elementele perioadei a 5-a, în conformitate cu regula Klechkovsky, subnivelurile sunt completate în următoarea ordine: 5s ⇒ 4d ⇒ 5p. Și există și excepții asociate cu „eșecul” electronilor în 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
În perioadele a 6-a și a 7-a, apar elementele f, adică elemente în care subnivelurile 4f și, respectiv, 5f ale celui de-al treilea nivel de energie din exterior sunt umplute.
Elementele 4f se numesc lantanide.
Elementele 5f se numesc actinide.
Ordinea de umplere a subnivelurilor electronice în atomii elementelor din perioada a 6-a: 55 Cs și 56 Ba - bs-elemente; 57 La ...6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - elemente 4f; 72 Hf - 80 Hg - 5d elemente; 81 Tl - 86 Rn - br elemente. Dar chiar și aici există elemente în care ordinea de umplere a subnivelurilor de energie este „încălcată”, ceea ce, de exemplu, este asociat cu o mai mare stabilitate energetică a subnivelurilor f pe jumătate și complet umplute, adică nf 7 și nf 14 .
În funcție de subnivelul atomului umplut cu electroni, toate elementele, așa cum ați înțeles deja, sunt împărțite în patru familie electronică sau bloc (Fig. 7):

Orez. 7.
Împărțirea sistemului periodic (tabel) în blocuri de elemente
- s-elemente; subnivelul s al nivelului exterior al atomului este umplut cu electroni; elementele s includ hidrogen, heliu și elemente din principalele subgrupe ale grupelor I și II;
- p-elemente; subnivelul p al nivelului exterior al atomului este umplut cu electroni; elementele p includ elemente ale principalelor subgrupuri ale grupelor III-VIII;
- d-elemente; subnivelul d al nivelului preextern al atomului este umplut cu electroni; Elementele d includ elemente ale subgrupurilor secundare ale grupelor I-VIII, adică elemente ale deceniilor intercalare de perioade mari situate între elementele s și p. Se mai numesc si elemente de tranzitie;
- elemente f; subnivelul f al celui de-al treilea nivel exterior al atomului este umplut cu electroni; acestea includ lantanide și actinide.
Întrebări și sarcini la § 3
- Realizați diagrame ale structurii electronice, formule electronice și formule electronice grafice ale atomilor următoarelor elemente chimice:
- a) calciu;
b) fier de călcat;
c) zirconiu;
d) niobiu;
e) hafniu;
e) aur. - Scrieți formula electronică pentru elementul #110 folosind simbolul pentru gazul nobil corespunzător.
- Care este „scăderea” electronului? Dați exemple de elemente în care se observă acest fenomen, notați-le formulele electronice.
- Cum se determină apartenența unui element chimic la o anumită familie electronică?
- Comparați formulele electronice și grafice electronice ale atomului de sulf. Ce Informații suplimentare conține ultima formulă?
În această lecție, veți afla despre învelișurile de electroni ale atomului, care sunt modelele atomice ale lui Bohr. Repetați structura nucleul atomic, apoi treceți la luarea în considerare a opiniilor moderne în studiul învelișurilor de electroni ale atomului, imagini condiționate ale nivelurilor și subnivelurilor electronice. Veți lua în considerare și modelele atomice ale lui Bohr.
Tema: Legea periodică și Sistemul periodic al elementelor chimice ale lui D. I. Mendeleev
Lecția: Învelișurile electronice ale unui atom. Modele atomice Bohr
1. Postulatele lui N. Bohr
Nucleul atomic este format din protoni - particule încărcate pozitiv și neutroni - particule care nu au sarcină. În această lecție, ne vom uita la structura învelișului de electroni a unui atom.
Orez. 1. Modelul planetar al atomului
În 1913, fizicianul danez Niels Bohr a sugerat că atomul este similar ca structură cu structura. sistem solar. În interiorul atomului, precum și în interiorul sistemului solar, Soarele este un nucleu masiv, în care este concentrată întreaga masă a atomului. Și în jurul acestui nucleu, la fel ca planetele din jurul Soarelui, electronii se învârt. Fig.1. Un electron are o masă de 1832 de ori mai mică decât un proton sau un neutron. Modelul lui Niels Bohr s-a bazat pe cel al profesorului său Ernest Rutherford.
Niels Bohr a sugerat că electronii dintr-un atom nu se mișcă aleatoriu, ci se mișcă pe anumite orbite. El a postulat, adică a acceptat fără dovezi, două propoziții.
Postulatele lui Niels Bohr.
1. În atom există orbite, fiind pe care, electronul nu radiază energie. Aceste orbite sunt numite staționare.
2. Radiația apare numai atunci când un electron sare de pe o orbită staționară pe alta.
2. Structura învelișului de electroni a atomului
Conform teoria cuantica structura unui atom, toți electronii dintr-un atom se mișcă de-a lungul nivelurilor de energie sau orbitelor. Aceste niveluri sunt formate din subniveluri. La rândul lor, subnivelurile constau din orbitali atomici. O astfel de structură este ușor de imaginat dacă presupunem că învelișul de electroni a unui atom este o casă care se află pe nucleu. Casa este formata din mai multe etaje - nivele. Fiecare nivel are subniveluri - acestea sunt apartamente. Apartamentele au orbitali atomici, adică camere. Nu putem determina locația specifică a unui electron în orbitali, ci probabilitatea ca acesta să fie în orbitalii atomici.
Niveluri.
Orbitele electronice în modelul Bohr sunt notate cu numere întregi: 1, 2, 3, 4, ... și așa mai departe până la n, sau cu litere latine în ordine alfabetică, începând cu litera K, L, M, N, O P, Q .Începând de la nivelul cel mai apropiat de nucleu . În cele ce urmează, vom numi astfel de orbite - niveluri.
Subniveluri.
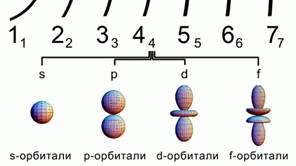
Orez. 2. Formele orbitalilor atomici
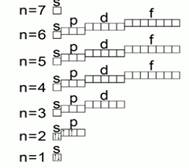
Nivelurile sunt la rândul lor formate din subniveluri. Numărul de subniveluri din fiecare nivel este egal cu numărul nivelului. Subnivelurile au nume.
Primul subnivel al fiecărui nivel se numește S,
Al 2-lea subnivel al fiecărui nivel se numește P,
Al treilea subnivel al fiecărui nivel se numește d,
Al 4-lea subnivel al fiecărui nivel se numește f
Orbitalii au forme diferite.
s - orbital sferic, orbital p are forma unui volum opt. orbitalii d și f sunt chiar mai mulți formă complexă. Fig 2.
Toate aceste cifre conturează zona cel mai probabil găsirea electronilor într-un atom.
Modelul ondulatoriu al unui atom nu este model fizic, și în curând abstract sau model matematic structura unui atom, aranjarea electronilor în el.
S - elemente.
Acestea sunt elemente care conțin doar electroni s la nivelul exterior.
Dacă aceștia sunt p - electroni, atunci acesta este p - element.
Cu cât nivelul de energie este situat mai departe de nucleu, cu atât poate găzdui mai mulți electroni, deoarece fiecare nivel de energie ulterior are un număr mai mare de subniveluri. Deci fiecare nivel N poate avea n2 subniveluri. Prin urmare, electronii pot găzdui 2n2. De ce am înmulțit n2 cu 2? Pentru că nu pot exista mai mult de 2 electroni în fiecare orbital atomic.
Cel mai mare număr de electroni la fiecare nivel este dat în Tabelul 1.
Orez. 3. Diagrama orbitală
Avem nevoie de toate aceste informații pentru a învăța cum să stabilim electronii în niveluri atomice, subnivele și orbitali.
3. Diagrama cuantică
Există o imagine condiționată a nivelurilor și subnivelurilor electronice. Aceasta este o diagramă orbitală sau cuantică. Într-o astfel de diagramă, orbitalii sunt reprezentați în mod convențional ca pătrate, iar electronii ca săgeți. Orez. 3. Dacă există două săgeți într-o celulă, atunci acestea vor fi indicate prin săgeți îndreptate în direcții diferite. Această proprietate a electronilor se numește spin.
După ce ați umplut toți orbitalii atomici cu electroni, trebuie să scrieți „pașaportul electronic” al elementului sau formula sa electronică. Pentru a face acest lucru, trebuie să desemnați fiecare nivel de energie cu numărul 1, 2, 3, ..., subnivelul cu litera s, p, d ...
Ca putere, scoateți numărul de electroni dintr-un anumit subnivel.
4. Structura electronică a atomului de azot
Exemplul #1.

Orez. 4. Formula electronică a azotului
Scrieți formula electronică a elementului chimic cu numărul atomic 7.
Un atom al unui astfel de element ar trebui să aibă 7 electroni. Să umplem orbitalii cu electroni, începând de la 1-urile de jos.
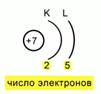
Orez. 5. Diagrama dispozitiei electronilor intr-un atom
Se va obţine următoarea configuraţie electronică: 1s22s22p3.Fig.4.
După aceea, trebuie să fixați locația electronilor în ceea ce privește nivelurile de energie. Pentru a face acest lucru, trebuie să descrieți schematic nucleul, să indicați sarcina acestuia și să determinați numărul niveluri de energie. Permiteți-mi să vă reamintesc că azotul are doar 2. Desenăm 2 arce, iar sub aceste arce scriem numărul de electroni care se află pe ele. Apoi obținem o astfel de schemă de aranjare electronică în atom. Fig.5.
5. Structura electronică a atomului de argon
Exemplul #2.
Scrieți formula electronică a elementului chimic cu numărul atomic 18.
Procedând la fel ca în primul caz, vom aranja electronii în orbitali atomici. 1s22s22p63s23p6. Acesta este elementul argon. Fig.6. Tradus din greacă „inactiv”. A primit acest nume deoarece nu interacționează cu niciun element chimic.
Elemente cu învelișul exterior de electroni completat.
Incluse în subgrupa gazelor nobile sau inerte. Inerția lor este cauzată de structura atomului lor. Aceste gaze au un înveliș energetic exterior complet - ns2np6. Gazele inerte formează o moleculă monoatomică. Toate celelalte gaze din natură au doar o moleculă diatomică. De exemplu, O2, H2 Motivul stabilității elementelor chimice cu o înveliș electronic complet nu este încă clar. Dar chimiștii o iau pur și simplu ca pe o lege a naturii. Toate celelalte elemente vor avea tendința de a-și completa învelișul exterior.
6. Etimologia denumirilor orbitalilor electronici
Va fi interesant de știut de ce subnivelurile anumitor niveluri sunt denumite prin anumite litere. alfabet englezesc. Fiecare atom emite energie. Această energie poate fi fixată în spectrele de emisie ale atomilor. Diferite spectre de emisie ale atomilor au alt fel. Liniile lor sunt diferite. Deci cele mai înguste linii ascuțite au fost numite litera s. Din cuvânt englezesc"minge".
s - subnivelul este numit după linia „ascuțită”.
p - subnivelul este denumit după linia „principal”.
d - subnivelul este numit după linia „difuză”, „neclară” (difuză).
f - subnivelul este denumit după linia „fundamentală”.
7. Câteva informații despre gazele inerte


Datorită inerției lor chimice, gazele nobile nu au fost cunoscute în chimie de mult timp. Abia în 1892 a fost obținut primul gaz inert de argon. A fost primit de D. Rayleigh. A obținut-o în timpul experimentelor cu azot. D. Rayleigh a observat că dacă se obține azot din aer, atunci acest gaz de azot va avea o masă mai mare decât dacă se obține azot în diferite experimente chimice. Dacă se obține 1 litru de azot din aer, atunci acesta va avea o masă de 1,2572 g, iar dacă se obține azot din descompunerea compușilor azotați, atunci masa va fi de 1,2505 g. De unde o astfel de diferență? Mulți oameni de știință au crezut că tocmai au efectuat un experiment și au încetat să cântărească aerul obținut în acest fel. D. Rayleigh cu prietenul său W. Ramsay. Ei au efectuat multe experimente și au confirmat că azotul gazos obținut din aer conține un alt gaz în compoziția sa, care era de 20 de ori mai greu decât hidrogenul. Așa a fost izolat argonul pentru prima dată. Până în anii 60 ai secolului XX nu s-a obținut un singur compus de gaze inerte. Acum au învățat cum să obțină artificial compuși ai gazelor inerte cu fluor și oxigen. Dacă dezasamblați un bec obișnuit cu incandescență, atunci veți întâlni gaz argon. Dar nu ar trebui să faci asta, pentru că te poți răni.
Rezumând lecția.
În această lecție, ați învățat despre învelișurile de electroni ale atomului, care sunt modelele atomice ale lui Bohr. Ați repetat structura nucleului atomic, considerate viziuni moderne în studiul învelișurilor de electroni ale atomului, imagini condiționate ale nivelurilor și subnivelurilor electronice. Considerate modelele atomice ale lui Bohr. Vom lua în considerare structura nucleului mai detaliat la lecțiile de chimie din clasa a 11-a.
1. Rudzitis G. E. Anorganic si Chimie organica. Clasa a 8-a: manual pentru institutii de invatamant: nivel de bază / G. E. Rudzitis, F. G. Feldman. M.: Iluminismul. 2011 176 p.: ill.
2. Popel P. P. Chimie: clasa a VIII-a: un manual pentru instituţiile de învăţământ general / P. P. Popel, L. S. Krivlya. - K .: Centrul de informare „Academia”, 2008.-240 p.: ill.
3. Gabrielyan O. S. Chimie. Clasa a 9-a Manual. Editura: Drofa.: 2001. 224s.
1. Chemport. ru.
1. Nr 4-6 (p. 138) Rudzitis G. E. Chimie anorganică şi organică. Clasa a VIII-a: manual pentru instituţiile de învăţământ: nivel de bază / G. E. Rudzitis, F. G. Feldman. M.: Iluminismul. 2011 176 p.: ill.
2. Pe baza structurii atomilor, explicați motivul periodicității proprietăților elementelor chimice.
3. Întocmește un scurt raport despre istoria descoperirii gazelor inerte.
Nucleul atomic este format din protoni - particule încărcate pozitiv și neutroni - particule care nu au sarcină. În această lecție, ne vom uita la structura învelișului de electroni a unui atom.
Orez. 1. Modelul planetar al atomului
În 1913, fizicianul danez Niels Bohr a sugerat că atomul este similar ca structură cu structura sistemului solar. În interiorul atomului, precum și în interiorul sistemului solar, Soarele este un nucleu masiv, în care este concentrată întreaga masă a atomului. Și în jurul acestui nucleu, la fel ca planetele din jurul Soarelui, electronii se învârt. Fig.1. Un electron are o masă de 1832 de ori mai mică decât un proton sau un neutron. Modelul lui Niels Bohr s-a bazat pe cel al profesorului său Ernest Rutherford.
Niels Bohr a sugerat că electronii dintr-un atom nu se mișcă aleatoriu, ci se mișcă pe anumite orbite. El a postulat, adică a acceptat fără dovezi, două propoziții.
Postulatele lui Niels Bohr.
1. În atom există orbite, fiind pe care, electronul nu radiază energie. Aceste orbite sunt numite staționare.
2. Radiația apare numai atunci când un electron sare de pe o orbită staționară pe alta.
Conform teoriei cuantice a structurii atomice, toți electronii dintr-un atom se mișcă de-a lungul nivelurilor de energie sau orbitelor. Aceste niveluri sunt formate din subniveluri. La rândul lor, subnivelurile constau din orbitali atomici. O astfel de structură este ușor de imaginat dacă presupunem că învelișul de electroni a unui atom este o casă care se află pe nucleu. Casa este formata din mai multe etaje - nivele. Fiecare nivel are subniveluri - acestea sunt apartamente. Apartamentele au orbitali atomici, i.e. camere. Nu putem determina locația specifică a unui electron în orbitali, ci probabilitatea ca acesta să fie în orbitalii atomici.
Niveluri.
Orbitele electronice în modelul Bohr sunt notate cu numere întregi: 1, 2, 3, 4, ... și așa mai departe până când n, sau cu litere latine alfabetic, începând cu litera K, L, M, N, O P, Q. Începând de la nivelul cel mai apropiat de nucleu. În cele ce urmează, vom numi astfel de orbite - niveluri.
Subniveluri.

Orez. 2. Formele orbitalilor atomici
Nivelurile sunt la rândul lor formate din subniveluri. Numărul de subniveluri din fiecare nivel este egal cu numărul nivelului. Subnivelurile au nume.
Primul subnivel al fiecărui nivel se numește S,
Al 2-lea subnivel al fiecărui nivel se numește P,
Al treilea subnivel al fiecărui nivel se numește d,
Al 4-lea subnivel al fiecărui nivel se numește f
Orbitalii au forme diferite.
Orbitalul s este sferic, orbitalul p are forma unui volum opt.d iar orbitalii f sunt chiar mai complexi. Fig 2.
Toate aceste cifre conturează regiunea cu cea mai mare probabilitate de a găsi electroni într-un atom.
Modelul ondulatoriu al unui atom nu este un model fizic, ci mai degrabă un model abstract sau matematic al structurii unui atom, a aranjamentului electronilor în el.
S - elemente.
Acestea sunt elemente care conțin doar electroni s la nivelul exterior.
Dacă aceștia sunt p - electroni, atunci acesta este p - element.
Cu cât nivelul de energie este situat mai departe de nucleu, cu atât poate găzdui mai mulți electroni, deoarece fiecare nivel de energie ulterior are un număr mai mare de subniveluri. Deci la fiecare n nivel pot exista n 2 orbitali. Prin urmare, electronii pot găzdui 2n 2 . De ce am înmulțit n 2 cu 2? Pentru că nu pot exista mai mult de 2 electroni în fiecare orbital atomic.
Cel mai mare număr de electroni la fiecare nivel este dat în Tabelul 1.

Orez. 3. Diagrama orbitală
Avem nevoie de toate aceste informații pentru a învăța cum să stabilim electronii în niveluri atomice, subnivele și orbitali.
Există o imagine condiționată a nivelurilor și subnivelurilor electronice. Aceasta este o diagramă orbitală sau cuantică. Într-o astfel de diagramă, orbitalii sunt reprezentați în mod convențional ca pătrate, iar electronii ca săgeți. Orez. 3. Dacă există două săgeți într-o celulă, atunci acestea vor fi indicate prin săgeți îndreptate în direcții diferite. Această proprietate a electronilor se numește a învârti.
După ce ați umplut toți orbitalii atomici cu electroni, trebuie să scrieți „pașaportul electronic” al elementului sau formula sa electronică. Pentru a face acest lucru, trebuie să desemnați fiecare nivel de energie cu numărul 1, 2, 3, ..., subnivelul cu litera s, p, d ...
Ca putere, scoateți numărul de electroni dintr-un anumit subnivel.
Exemplul #1.

Orez. 4. Formula electronică a azotului
Scrieți formula electronică a elementului chimic cu numărul atomic 7.
Un atom al unui astfel de element ar trebui să aibă 7 electroni. Să umplem orbitalii cu electroni, începând de la 1-urile de jos.

Orez. 5. Diagrama dispozitiei electronilor intr-un atom
Se va obţine următoarea configuraţie electronică: 1s 2 2s 2 2p 3. Fig.4.
După aceea, trebuie să fixați locația electronilor în ceea ce privește nivelurile de energie. Pentru a face acest lucru, trebuie să descrieți schematic nucleul, să indicați încărcarea acestuia și să determinați numărul de niveluri de energie. Permiteți-mi să vă reamintesc că azotul are doar 2. Desenăm 2 arce, iar sub aceste arce scriem numărul de electroni care se află pe ele. Apoi obținem o astfel de schemă de aranjare electronică în atom. Fig.5.
Exemplul #2.
Scrieți formula electronică a elementului chimic cu numărul atomic 18.
Procedând la fel ca în primul caz, vom aranja electronii în orbitali atomici. 1s 2 2s 2 2p 6 3s 2 3p 6 . Acesta este elementul argon. Fig.6. Tradus din greacă „inactiv”. A primit acest nume deoarece nu interacționează cu niciun element chimic.
Elemente cu învelișul exterior de electroni completat.
Incluse în subgrupa gazelor nobile sau inerte. Inerția lor este cauzată de structura atomului lor. Aceste gaze au un înveliș energetic exterior complet - ns 2np 6 . Gazele inerte formează o moleculă monoatomică. Toate celelalte gaze din natură au doar o moleculă diatomică. De exemplu, O 2 , H 2. Motivul stabilității elementelor chimice cu o înveliș de electroni complet nu este încă clar. Dar chimiștii o iau pur și simplu ca pe o lege a naturii. Toate celelalte elemente vor avea tendința de a-și completa învelișul exterior.
Va fi interesant de știut de ce subnivelurile anumitor niveluri sunt denumite prin anumite litere ale alfabetului englez. Fiecare atom emite energie. Această energie poate fi fixată în spectrele de emisie ale atomilor. Spectrele de emisie diferite ale atomilor au o formă diferită. Liniile lor sunt diferite. Deci cele mai înguste linii ascuțite au fost numite litera s. Din cuvântul englezesc „ball”.
s- subnivel numit după linia „ascuțită”.
p- subnivelul este numit după linia „principal”.
d- subnivelul este numit după linia „difuză”, „neclară” (difuză).
f- subnivelul este numit după linia „fundamentală”.


Datorită inerției lor chimice, gazele nobile nu au fost cunoscute în chimie de mult timp. Abia în 1892 a fost obținut primul gaz inert de argon. A fost primit de D. Rayleigh. A obținut-o în timpul experimentelor cu azot. D. Rayleigh a observat că dacă se obține azot din aer, atunci acest gaz de azot va avea o masă mai mare decât dacă se obține azot în diferite experimente chimice. Dacă se obține 1 litru de azot din aer, atunci acesta va avea o masă de 1,2572 g, iar dacă se obține azot din descompunerea compușilor azotați, atunci masa va fi de 1,2505 g. De unde o astfel de diferență? Mulți oameni de știință au crezut că tocmai au efectuat un experiment și au încetat să cântărească aerul obținut în acest fel. D. Rayleigh cu prietenul său W. Ramsay. Ei au efectuat multe experimente și au confirmat că azotul gazos obținut din aer conține un alt gaz în compoziția sa, care era de 20 de ori mai greu decât hidrogenul. Așa a fost izolat argonul pentru prima dată. Până în anii 60 ai secolului XX nu s-a obținut un singur compus de gaze inerte. Acum au învățat cum să obțină artificial compuși ai gazelor inerte cu fluor și oxigen. Dacă dezasamblați un bec obișnuit cu incandescență, atunci veți întâlni gaz argon. Dar nu ar trebui să faci asta, pentru că te poți răni.
Rezumând lecția.
În această lecție, ați învățat despre învelișurile de electroni ale atomului, care sunt modelele atomice ale lui Bohr. Ați repetat structura nucleului atomic, considerate viziuni moderne în studiul învelișurilor de electroni ale atomului, imagini condiționate ale nivelurilor și subnivelurilor electronice. Considerate modelele atomice ale lui Bohr. Vom privi mai detaliat lecțiile de chimie din clasa a 11-a.
1. Rudzitis G.E. Chimie anorganică și organică. Clasa a VIII-a: manual pentru instituţiile de învăţământ: nivel de bază / G. E. Rudzitis, F.G. Feldman. M.: Iluminismul. 2011 176 p.: ill.
2. Popel P.P.Chimie: clasa a VIII-a: un manual pentru instituţiile de învăţământ general / P.P. Popel, L.S. Krivlya. -K.: IC „Academia”, 2008.-240 p.: ill.
3. Gabrielyan O.S. Chimie. Clasa a 9-a Manual. Editura: Drofa.: 2001. 224s.
1. Nr 4-6 (p. 138) Rudzitis G.E. Chimie anorganică și organică. Clasa a VIII-a: manual pentru instituţiile de învăţământ: nivel de bază / G. E. Rudzitis, F.G. Feldman. M.: Iluminismul. 2011 176 p.: ill.
2. Pe baza structurii atomilor, explicați motivul periodicității proprietăților elementelor chimice.
3. Întocmește un scurt raport despre istoria descoperirii gazelor inerte.






