Distribuiți electronii de siliciu între celulele cuantice. Distribuția electronilor de vanadiu peste celulele cuantice
Sarcini pentru secțiunea 1
Exemplu de executare teme pentru acasă
Structura atomului
Sarcina 1. a) Indicați valorile numerice ale numerelor cuantice principale și orbitale ale acestor subniveluri, calculați succesiunea umplerii lor: 5 p, 7p, 7s.
Soluţie. 5p 7p 7s
Sens n 5 7 7
Sens l 1 1 0
Suma ( n +l ) 6 8 7
Secvență de umplere (pe baza regulilor lui Klechkovsky):
1 – 5p; 2 – 7s; 3 – 7p.
b) Distribuie peste celulele cuantice electroni de valență 2s 2 2p 4, determinați elementul chimic și poziția acestuia în D.I. Mendeleev (număr de perioadă, grup, subgrup).
Soluţie. Electronii de valență din celulele cuantice sunt distribuiți după cum urmează: 2 s 2 2p 4
Elementul oxigen propus este situat în a doua perioadă, a șasea grupă, principalul subgrup al Tabelului periodic al D.I. Mendeleev.
în) Scrieți formulele electronice ale atomilor și ionilor, indicați poziția lor în D.I. Mendeleev (număr de perioadă, grup, subgrup): K, Zn 2+ .
Soluţie. Formula electronică a elementului chimic potasiu este următoarea: 1 s 2 2s 2 2p 6 3s 2 3p 6 4s unu . Se află în perioada a patra, prima grupă, subgrupa principală a Tabelului periodic al lui D.I. Mendeleev. Formula electronică a cationului Zn 2+: 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 . Element chimic zincul este situat în a patra perioadă, al doilea grup, un subgrup lateral.
Faceți același lucru pentru toate sarcinile.
STRUCTURA ATOMULUI
În sistemul periodic al lui D. I. Mendeleev (Tabelul P.4) toate elemente cunoscute. Se compune din șapte perioade (1-3 - mici, 4-7 - mari), 8 grupe. Fiecare grup este împărțit în subgrupe principale și secundare. Subgrupul principal conține elemente de perioade mici și mari, iar grupul lateral conține doar cele mari.
Exemplul 1 Precizati in Sistemul periodic D.I. Poziția Mendeleev (numărul perioadei, numărul grupului, subgrupul principal sau secundar) a unui atom al unui element cu o sarcină nucleară de 85.
Soluţie. Elementul (85 At) se află în a 6-a perioadă, a 7-a grupă, subgrupa principală.
Atomii elementelor constau dintr-un nucleu încărcat pozitiv (protoni și neutroni) și electroni. Numărul de electroni este egal cu numărul atomic al elementului. Starea unui electron într-un atom este caracterizată de numere cuantice n,l, m l și m s, care sunt denumite respectiv cel mai important, orbital, magnetic și spin.
Ordinea de umplere a orbitalilor cu electroni este determinată de următoarele reguli ale lui V. Klechkovsky:
umplerea are loc în ordinea crescătoare a cantității ( n + l);
La aceleași valori ale acestei sume, se umple mai întâi subnivelul cu valoarea inferioară a valorii principale număr cuantic n.
Secvența de umplere cu electroni niveluri de energie iar subnivelurile din atomii multielectroni are forma
1s<2s<2p<3s<3p<4s<3d <4p<5s<4d <5p<6s<5d 4f<6p <7s<6d 5f<7p.
Exemplul 2. Folosind regulile Klechkovsky, calculați ce subnivel este umplut cu electroni primul 4 R sau 5 s.
Soluţie. Pentru 4 R-subnivel sn + l= 4 + 1 = 5; pentru 5 s-subnivel Sn+l= 5 + 0 = 5. Deoarece suma este aceeași, subnivelul cu valoarea inferioară este completat mai întâi n, adică 4 R.
Exemplul 3 După distribuţia electronilor de valenţă - 3d 5 4s 2 Stabiliți ce element este, indicați simbolul acestuia și scrieți formula electronică completă.
Soluţie. La care corespunde valoarea numărului cuantic principal al ultimului nivel de energie cameră perioadă, deci elementul este în a 4-a perioadă. Suma electronilor de valență arată cameră grupul în care se află elementul, în acest caz numărul grupuri 7. Deoarece electronii de valență sunt porniți d-subnivel, atunci acesta este un element subgrup lateral: 25 Mn 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
Exemplul 4. Scrieți formula electronică completă a unui atom al unui element cu o sarcină nucleară de 22.
Soluţie. 22 Ti 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
Exemplul 5. Scrieți formulele electronice complete ale ionilor Fq, Sn 2+.
Soluţie. Când se formează un ion încărcat negativ, atomul neutru al elementului acceptă electroni: F 0 + 1 ē = Fq; formula electronică a ionului 9 Fq1 s 2 2s 2 2p 6. Un ion încărcat pozitiv se obține atunci când un atom neutru al unui element cedează electroni: Sn 0 - 2 ē = Sn 2+ ; formula electronică a ionului 50 Sn 2+ 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 0 .
Sarcini pentru secțiunea 1
Fiecare sarcină conține trei întrebări(a B C).
| Numărul postului | a) Indicați valorile numerice ale numerelor cuantice principale și orbitale ale acestor subniveluri, calculați succesiunea umplerii lor | b) Distribuiți electronii de valență între celulele cuantice, determinați elementul chimic și poziția acestuia în sistemul D.I. Mendeleev (număr de perioadă, grup, subgrup) | c) Scrieți formulele electronice ale atomilor și ionilor propuși, indicați poziția acestora în sistemul lui D.I. Mendeleev (numărul perioadei, grupa, subgrupa) |
| 3p; 4s; 2p | 3d 1 4s 2 | Fe, Na+ | |
| 3d; 4p; 3p | 3d 2 4s 2 | Co, Cl- | |
| 5d; 4p; 4d | 3d 3 4s 2 | Ni, Ba2+ | |
| 3d; 4f; 5s | 3d 5 4s 1 | Zn, Ca2+ | |
| 4d; 4s; 5s | 4d 5 5s 2 | Sn, S 2- | |
| 6s; 4p; 4f | 3d 6 4s 2 | W, în 3+ | |
| 3d; 5s; 7p | 3d 7 4s 2 | S, La 3+ | |
| 4d; 6s; 5d | 3d 8 4s 2 | F, Tl 3+ | |
| 4p; 5p; 4f | 3d 10 4s 1 | Br, Zr 4+ | |
| 3d; 3p; 2s | 3d 10 4s 2 | Al, Hg2+ | |
| 5d; 3s; 6s | 4s 2 4p 1 | Pb, Au 3+ | |
| 6d; 4f; 5p | 4s 2 4p 2 | Ge, Ag+ | |
| 5d; 3p; 4d | 4 s 2 4p 3 | Ga, Sb 3+ | |
| 7s; 6p; 4d | 4s 2 4p 4 | N, Bi 3+ | |
| 5d; 4p; 3d | 4s 2 4p 5 | CI, Pb2+ | |
| 5s; 6s; 4p | 4s 2 4p 6 | Y, Hf 4+ | |
| 6p; 5f; 6d | 5d 7 6 s 2 | Zr, At- | |
| 5d; 5s; 4f | 5d 10 6 s 2 | Ta, Ga 3+ | |
| 3s; 4d; 3p | 5d 3 6 s 2 | Cr, Se 2- | |
| 5f; 4d; 4s | 5d 5 6 s 2 | Mo, Cu 2+ |
Cursul 5. NUMĂRUL CUANTICI PRINCIPAL (n) Numărul (n) caracterizează energia totală a unui electron dintr-un atom. Poate lua valorile numerelor întregi: 1, 2, 3 ... n Fiecare valoare a numărului cuantic n are propriul nivel de energie. Numărul de niveluri de energie dintr-un atom populat de electroni este egal cu numărul perioadei în care elementul se află în tabelul periodic.

NUMĂRUL CUANTICI PRINCIPAL (n) De exemplu, electronii dintr-un atom al oricărui element aparținând perioadei a treia sunt localizați pe trei niveluri de energie. Electronii situati la nivelul energetic cel mai apropiat de serie (n=1) au cea mai mica energie. La absorbția energiei cuantice (E=hν), electronul merge la un nivel de energie mai înalt. Când trece la un nivel inferior, un electron emite o cantitate de energie. (continuare)

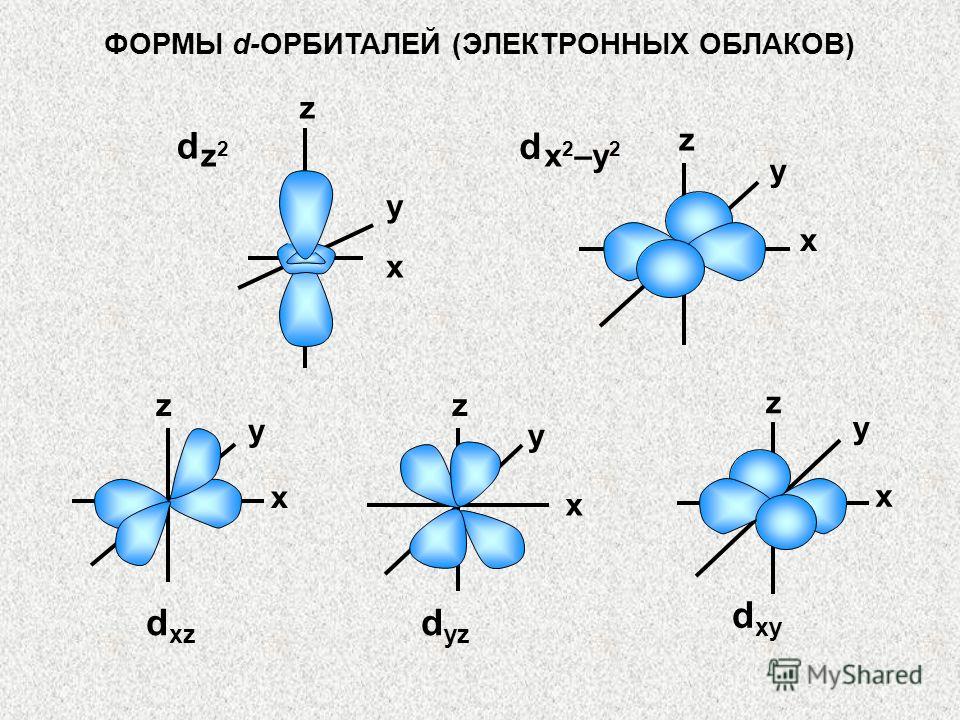
NUMĂRUL CUANTUM ORBITAL (ɭ) Numărul ɭ determină forma orbitalului și, prin urmare, a norii de electroni. Poate lua o valoare de la zero la n-1: ɭ = 0, 1, 2, 3 … n-1 De exemplu, dacă numărul cuantic principal este patru (n=4), atunci ɭ ia valorile 0, 1, 2, 3.

Electronii cu aceleași valori ale numărului n, dar diferiți (ɭ), diferă oarecum în energie. Prin urmare, se spune că electronii unui anumit nivel de energie se grupează în subniveluri de energie. NUMĂR CUANTUM ORBITAL (ɭ) Aceste subnivele li se atribuie următoarele denumiri de litere: Număr cuantic orbital (l) Denumirea subnivelului de energie s p d f (continuare)

Numărul de subniveluri din fiecare nivel de energie este egal cu numărul său cuantic, adică. numărul acestui nivel. Primul nivel de energie (n=1) este format dintr-un s - subnivel; al doilea (n=2) - de la două (s; p) subniveluri; al treilea (n=3) - din trei (s; p; d) subniveluri; al patrulea (n=4) – din patru (s; p; d; f) subnivele: Număr cuantic principal (n) (număr de nivel) Tipuri de subniveluri s s, p s, p, d s, p, d, f NUMĂR CANTIM ORBITAL ( ɭ ) (continuare)

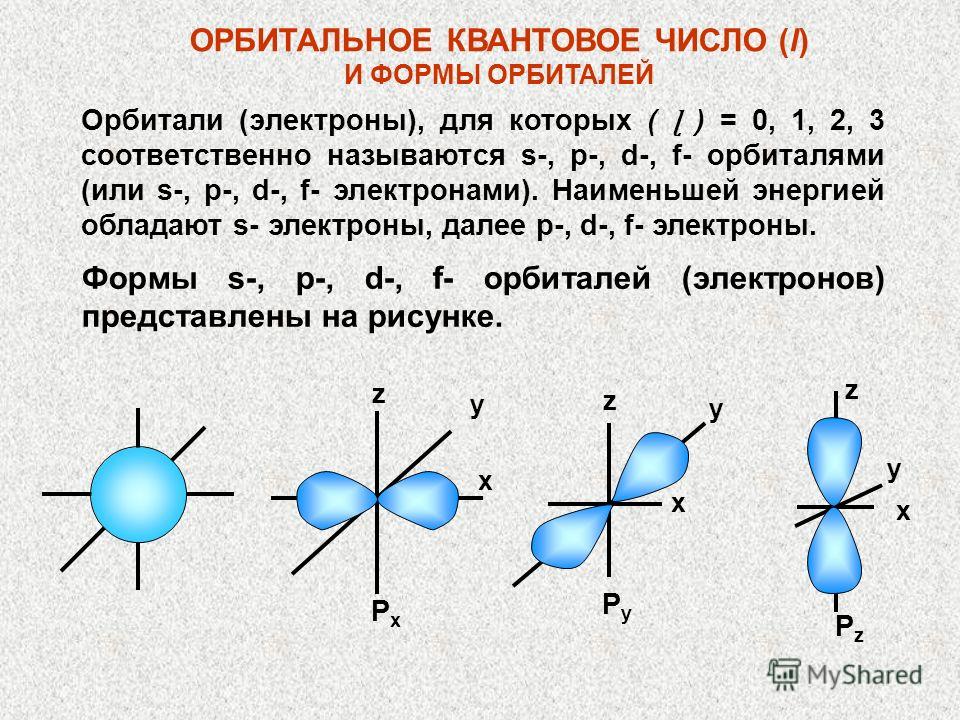
NUMĂRUL CANTICI ORBITAL (l) ȘI FORME ORBITALE Orbitalii (electronii) pentru care (ɭ) = 0, 1, 2, 3 respectiv se numesc orbitali s-, p-, d-, f (sau -, f- electroni). Electronii S au cea mai mică energie, apoi electronii p, d, f. Formele orbitalilor s-, p-, d-, f (electronii) sunt prezentate în figură. x x x z PyPy PzPz y y y z z PxPx
Numărul m caracterizează aranjarea spațială a orbitalilor (norilor). Poate lua toate valorile întregi de la – ɭ la + ɭ, inclusiv zero: m = – l … 0 … + l De exemplu: cu ɭ = 2 avem m = – 2, – 1, 0, + 1, + 2 m depinde de numărul cuantic orbital și indică numărul de stări de energie (orbitali) în care se poate afla un electron de un subnivel dat (cu o valoare dată de ɭ). Numărul de orbitali cu o valoare dată (ɭ) este 2 ɭ + 1 NUMĂR CANTIM MAGNETIC (m)

RELAȚIA NUMERELOR CANTICE MAGNETICE ȘI ORBITALE Numărul cuantic orbital (ɭ) Numărul cuantic magnetic (m) Numărul de orbitali (nori) – 1, 0, + 1 – 2, – 1, 0, + 1, + 2 –3, – 2 , – 1, 0, +1, +2,

CELULE CUANTICE (ORBITALE) Fiecare orbital este reprezentat de obicei printr-un dreptunghi, care se mai numește și celulă cuantică.s - subnivelul este format din 1 celulă p - subnivelul este format din 3 celule d - subnivelul este format din 5 celule f - subnivelul este format din 7 celule s p d f

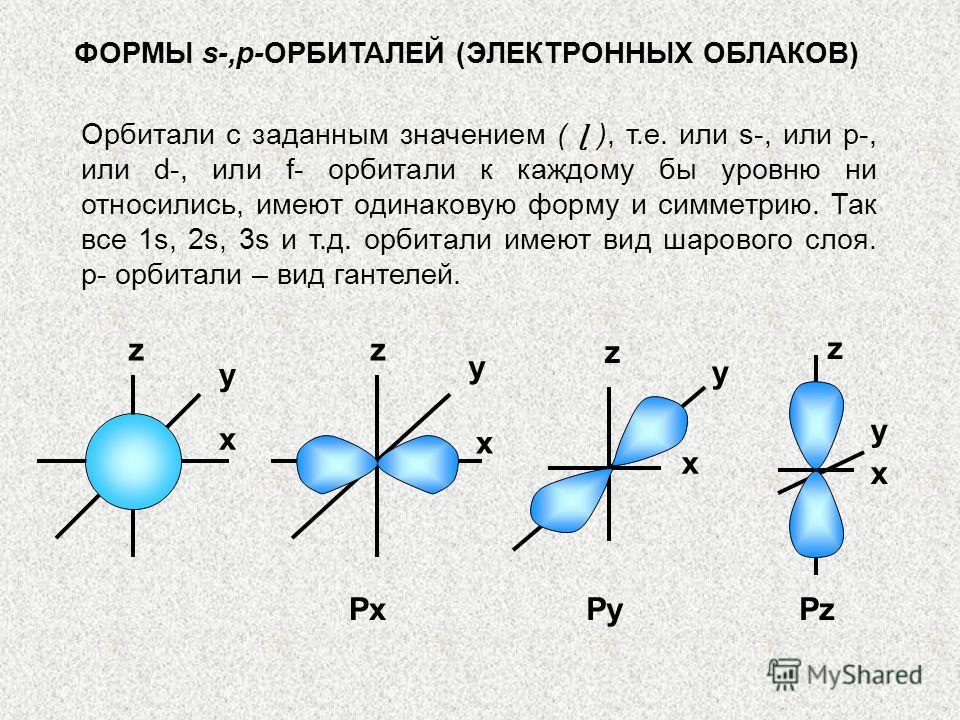
FORME de s-,p-ORBITALURI (NORI DE ELECTRONI) Orbitali cu o valoare dată (ɭ), adică. sau orbitale s-, sau p-, sau d-, sau f la fiecare nivel, au aceeași formă și simetrie. Deci totul este 1, 2, 3 etc. orbitalii sunt sferici. Orbitalii p sunt un tip de gantere. x x x x y z PxPyPz y y y z z z
SPIN NUMĂR CUANTUM (S) Pentru o valoare dată a lui m, numărul s poate avea doar două semnificații: Ipoteza că un electron are așa-numitul spin a fost înaintată în 1925 (la început - pentru claritate - s-a crezut că aceasta fenomenul este similar cu rotația Pământului în jurul axei sale pe măsură ce se mișcă pe orbită în jurul Soarelui). + ½ și – ½ De fapt, spinul este o proprietate pur cuantică a unui electron care nu are analogi clasici. Strict vorbind, spinul este momentul unghiular propriu al unui electron, care nu are legătură cu mișcarea în spațiu. Pentru toți electronii, valoarea absolută a spinului este întotdeauna s = 1/2. Proiecția spinului pe axa Z (numărul de spin magnetic) poate avea doar două valori: m S = +1/2 sau m S = -1/2.

„Nu pot exista doi electroni într-un atom cu aceleași valori ale tuturor celor patru numere cuantice.” Deoarece AO este caracterizat de trei numere cuantice n, l, m, atunci nu poate conține mai mult de doi electroni cu spini opuși: PRINCIPIU PAULI X e = 2 (2l + 1); s–2; p–6; d - 10; f – 14 Numărul maxim de electroni este: La subnivel: La nivel: N = 2n2

„La umplerea nivelurilor și subnivelurilor cu electroni, succesiunea de plasare a electronilor într-un atom ar trebui să corespundă celei mai mari conexiuni a acestora cu nucleul, adică. electronul trebuie să aibă cea mai mică energie”. PRINCIPIUL ENERGIEI MAI MAI MAI MULTE Acest principiu exprimă cerințele termodinamice generale pentru stabilitatea sistemelor: stabilitate maximă corespunde energiei minime. În practică, „principiul energiei minime” este aplicat sub forma regulilor lui Klechkovsky:

Să comparăm rezerva de energie la subnivelurile: 4s 
La subnivelurile 3d, 4p și 5s suma (n+l) este egală cu 5: SUBLEVEL (n + l) 3+2=5 4+1=5 5+0=5 3d 4p 5s 1s2s2p3s4s3d4p5s4d5p6s4f5d regulile lui Klechkovsky Exemplul 2: În acest caz, subnivelul cu valoarea inferioară a numărului cuantic principal n este completat mai întâi, adică. în următoarea secvență: 3d 3p 5s În general, umplerea nivelurilor și subnivelurilor merge în următoarea secvență: 6p7s5f6d6p7s5f6d


În formulele electronice, literele s, p, d, f reprezintă electroni de energie. Numerele din fața literelor indică nivelul de energie în care se află electronul dat, iar indicele din dreapta sus este numărul de electroni din acest subnivel. Înregistrarea 5p 3 înseamnă că există trei electroni în subnivelul p al al cincilea nivel de energie. FORMULA ELECTRONICĂ A ATOMILOR

La compilarea formulei electronice a unui atom al oricărui element, trebuie să ne ghidăm după următoarea succesiune: 1. Determinați numărul ordinal al elementului (și, în consecință, numărul de electroni din atom); 2. Determinați numărul de niveluri de energie pe care vor fi localizați electronii /după numărul perioadei/; 3. Distribuiți electronii pe subnivele și niveluri, ghidându-se după cerințele prevederilor principale. FORMULA ELECTRONICĂ A ATOMILOR

4. Distribuiți electronii pe niveluri și subniveluri de energie, ghidându-se după cerințele regulii lui Pauli, regulilor lui Klechkovsky și regulilor lui Hund, precum și următorul tabel: FORMULA ELECTRONICĂ A ATOMILOR Număr de nivel Număr de subnivele Tipuri de subnivele Număr de orbitali Max. numărul de electroni pe subnivel 11 1s s 2p s 3p 3d s 4p 4d 4f
1. Compuneți formula electronică a atomului de sulf: 1. Sulful are un număr de serie 16: există doar 16 electroni în atom 2. Sulful este în a treia perioadă: 16 electroni sunt situați pe trei niveluri energetice: 1s 2s2p 3s3p3d 3. Să distribuim 16 electroni pe subniveluri energetice în conformitate cu principiul energiei minime și cu principiul Pauli: 16 S - 1s 2 2s 2 2p 6 3s 2 3p 4 - formula atomului de sulf. COMPILAREA FORMULEI ELECTRONICE DE ATOMI

2. Compuneți formula atomului (Ca) de calciu: 1. Numărul de serie Ca \u003d 20: există 20 de electroni în atom 2. Ca este în a patra perioadă: 20 de electroni sunt localizați la patru niveluri: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. Distribuie 20 de electroni: 20 Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 0 4s 2 sau 1s 2 2s 2 2p 6 3s 2 3p 2

3. Compuneți formula atomului de titan / Ti /: 1. Numărul de serie Ti = 22: există 22 de electroni în atom 2. Ti este în perioada a 4-a: electronii sunt localizați la 4 niveluri: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. Distribuiți 22 de electroni în subniveluri, îndeplinind cerințele principiului Pauli și principiului energiei minime: 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 sau 22 Ti - 1s 2 2p 6 3s 2 3p 6 3d 2 4s 2 COMPILAREA FORMULEI ELECTRONICE DE ATOMI

4. Compuneți formula atomului de ceriu (Ce): 1. Număr de serie Ce \u003d 58: există 58 de electroni în atom 2. Ce este în a șasea perioadă: 58 de electroni sunt localizați în șase niveluri: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p … 3. Distribuiți 58 de electroni între subnivelurile 58 Ce – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4s 2 4s 2 4s 2 4s 4f (n + l = = 7) 5p (n + l == 6) 5s (n + l == 5) 6s (n + l == 6) 5s 5p 6s 4f

În funcție de ce subnivel este umplut cu electroni, toate elementele sunt împărțite în patru tipuri (familii): 1) Elemente S: este umplut subnivelul S al nivelului exterior. Formula lor generală este: … nS 2 n – numărul perioadei Elementele s includ primele două elemente ale fiecărei perioade. 2) Elemente P: se umple subnivelul P al nivelului extern. Formula lor generală este: … nS 2 n P 1–6 Elementele p includ ultimele șase elemente ale fiecărei perioade /cu excepția primei și a VII-a/. PATRU TIPURI DE ELEMENTE

3) d - elemente: umplu subnivelul d al celui de-al doilea nivel din exterior. Formula lor generală este: ... (n-1) d 1-10 nS 2 La nivelul exterior au 2 uneori 1 electron (s 1-2). Elementele d includ 10 elemente de perioade mari situate între elementele s și p. PATRU TIPURI DE ELEMENTE sau (n-2) f 1-14 (n-1) d 1 nS 2 4) f - elemente: umplu subnivelul d al celui de-al doilea nivel din exterior. Formula lor generală este: ... (n-2) f 1-14 nS 2 Elementele f includ lantanide și actinide

Întocmirea configurațiilor electronice ale atomilor fără ajutorul tabelului periodic Pentru a face acest lucru, trebuie să știți: 1. Câte elemente sunt conținute într-o perioadă: perioadă Numărul de elemente într-o perioadă = 18 3 = 36 4 = 54 5 = 86 6 neterminat

2. Că primele două elemente dintr-o perioadă sunt elemente S. 3. Ultimele șase elemente ale fiecărei perioade (cu excepția celei de a 1-a și a 7-a) sunt elemente p ale elementelor (începând cu a 3-a) ale perioadelor mari - acestea sunt elemente-d. 5. Lantanul (57 La) este urmat de elemente 4f. 6. După actiniu (89 Ac), urmează 5f elemente Compilarea configurațiilor electronice ale atomilor fără ajutorul tabelului periodic

3. Rezolvarea 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l. Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0, există doar unul" title="(!LANG: Soluția 3. Nu, deoarece pentru subnivelul d l = 2 , care este posibil numai pentru valorile n > 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0 există doar unul" class="link_thumb"> 34 !} Soluția 3. Nu, deoarece pentru subnivelul d l = 2, ceea ce este posibil numai pentru valorile n > 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l. Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. La l = 0 există o singură valoare m l = 0 (un AO), iar la l = 1 există trei valori m l = 1 , 0, + 1 (trei AO în total), prin urmare, numărul total de AO la nivelul L este de patru. EXEMPLE și PROVOCĂRI 3. Rezolvarea 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l. Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0 există doar un singur "> 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l , m l. Nivelul L ( n = 2) are două subniveluri: l = 0 și l = 1. La l = 0 există o singură valoare m l = 0 (un AO), iar la l = 1 există trei valori m l = 1, 0, + 1 (total trei AO), prin urmare, numărul total de AO la nivelul L este de patru. EXEMPLE și PROBLEME "> 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numere cuantice: n, l, m l. Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0, există doar unul" title="(!LANG: Soluția 3. Nu, deoarece pentru subnivelul d l = 2 , care este posibil numai pentru valorile n > 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0 există doar unul"> title="Soluția 3. Nu, deoarece pentru subnivelul d l = 2, ceea ce este posibil numai pentru valorile n > 3. Soluția 4. Fiecare AO este caracterizat de trei valori ale numerelor cuantice: n, l, m l. Nivelul L (n = 2) are două subniveluri: l = 0 și l = 1. Pentru l = 0 există doar unul"> !}
Învelișul de electroni considerat al unui atom este umplut cu electroni în conformitate cu trei principii: principiul energiei minime, principiul Pauli / regula / Hund.
Principiul minimului afirmă că un electron dintr-un atom ocupă subnivelul liber la care va avea valoarea minimă de energie. În alt mod, electronul rămâne la subnivelul la care este asigurată cea mai puternică legătură cu nucleul.
Secvența în care sunt umplute subnivelurile corespunde locației reale a subnivelurilor în structura învelișului de electroni a atomului dată mai sus:
1sà2sà2pà3sà3pà4sà3d –… etc. /cm. de mai sus/.
Principiul Pauli / interdicția Pauli / spune că un atom nu poate avea nici măcar doi electroni cu aceleași valori a patru numere cuantice.
Consecinţă. Un orbital poate conține doi electroni cu spini diferiți (adică cu valori diferite ale numărului cuantic de spin: ms = +1/2 și ms = –1/2).
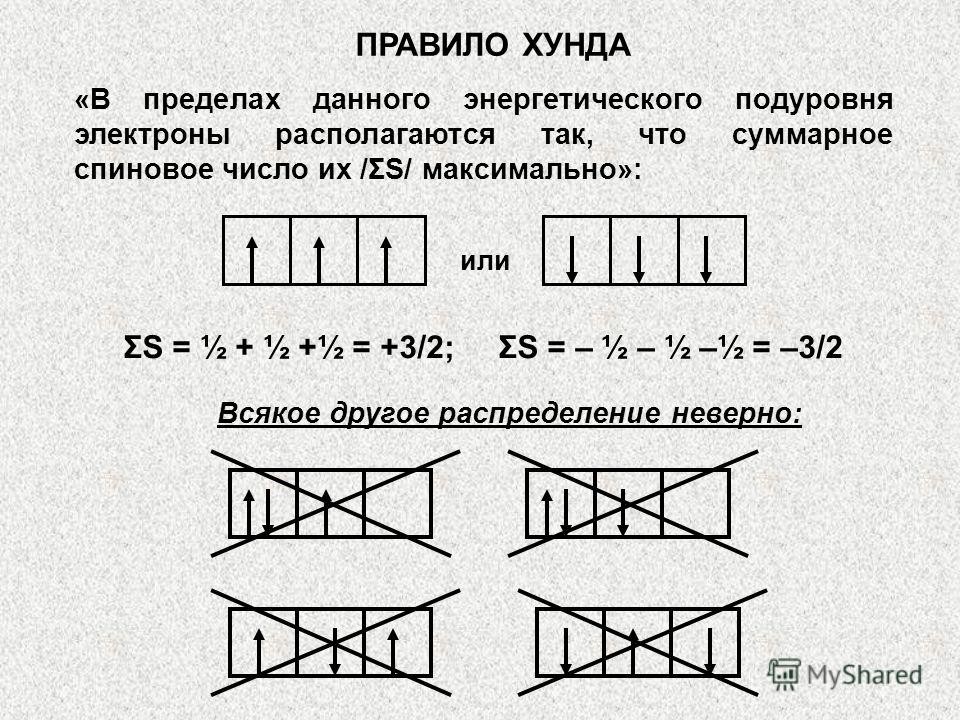
Al treilea principiu este principiul sau regula lui Gunda /Hunda/. Ea explică ordinea în care electronii umplu subnivelul cuantic. În cadrul subnivelului, electronii sunt distribuiți în așa fel încât numărul lor cuantic total să aibă o valoare maximă /primul un electron pe orbital, apoi împerechere/. Distribuția corectă va fi, de exemplu, trei electroni p în acest fel:
În funcție de ce subnivel este umplut cu ultimii electroni, se disting elementele s-, p-, d-, f-.
Elementele s sunt acele elemente în atomi cărora ultimii electroni ocupă subnivelul s al nivelului cuantic exterior. /De exemplu, sodiu, magneziu, potasiu, calciu etc./.
Elementele p sunt acele elemente în a căror atomi ultimii electroni ocupă subnivelul p al nivelului cuantic exterior. /De exemplu, carbon, oxigen, clor etc./.
Subnivelul d, umplut cu ultimii electroni, clasifică elementele drept elemente d. /De exemplu, elementele d sunt titan, crom, fier, cupru, deoarece în aceste elemente, ultimii electroni ocupă subnivelul d al penultimului nivel/.
Elementele f sunt acele elemente în ai căror atomi ultimii electroni ocupă subnivelul f al celui de-al doilea din afara nivelului cuantic. /De exemplu, praseodim, europiu, erbiu etc./.
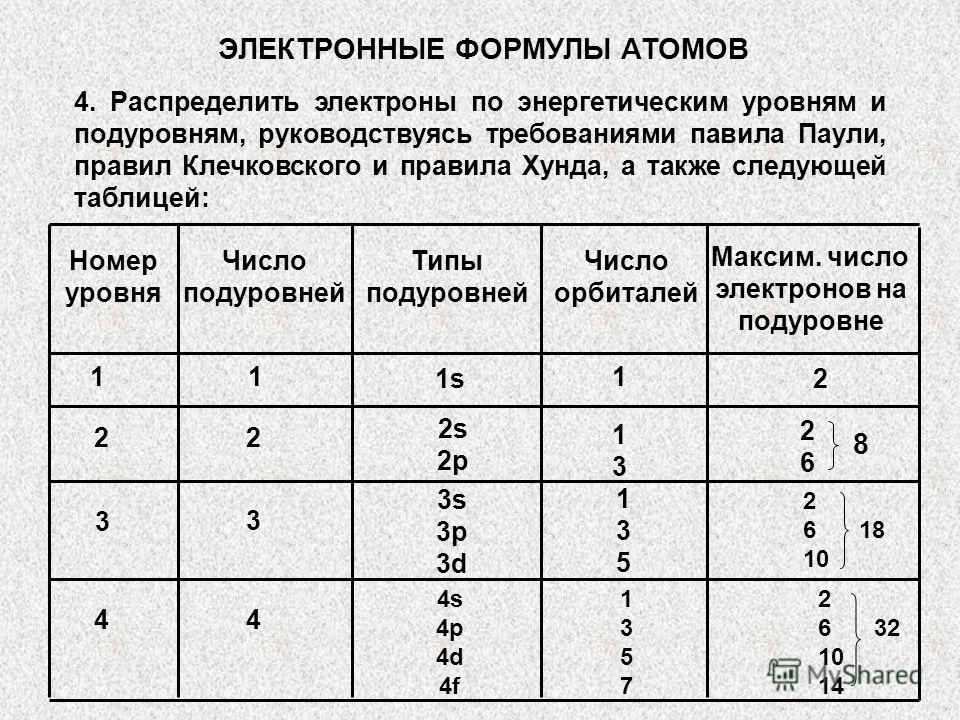
2.1.7. Imagine a structurii electronice a atomilor folosind formule electronice și celule cuantice.
Structura electronică a oricărui atom este reprezentată prin formule electronice. În formulele electronice, nivelul electronic cuantic este notat cu valoarea numerică a numărului cuantic principal n, subnivelul este scris prin desemnarea literei subnivelului corespunzător, iar numărul de electroni din subnivel este indicat de gradul subnivelului. desemnare. De exemplu, 3d5 înseamnă că există cinci electroni în subnivelul d al celui de-al treilea nivel cuantic. Formula electronică a oricărui element constă dintr-un set complet de astfel de fragmente, așa cum este indicat în exemplu. Astfel, formula electronică a atomului de titan /№22/ este: 1s22s22p63s23p64s23d2. Suma tuturor puterilor este 22, ceea ce înseamnă că atomul de titan, având o sarcină nucleară de +22, conține 22 de electroni pe învelișul de electroni, care, cu sarcina lor negativă totală (–22), compensează sarcina pozitivă a nucleul atomic, făcând atomul un sistem complex neutru din punct de vedere electric.
Este mai convenabil să compuneți formule electronice după luarea în considerare a structurii sistemului periodic de elemente al lui D.I. Mendeleev. Privind în perspectivă și pe baza cunoștințelor acumulate în liceu, vă prezentăm sistemul periodic de elemente sub formă de formule electronice. (Fig. 2.10.) Vom reveni mai târziu la scrierea formulelor electronice ale unui anumit element din sistemul periodic și vom lua în considerare un algoritm prin care este ușor de învățat cum să scrieți formula electronică a oricărui element. În al doilea rând, structura învelișului de electroni a unui atom este descrisă folosind celule cuantice.

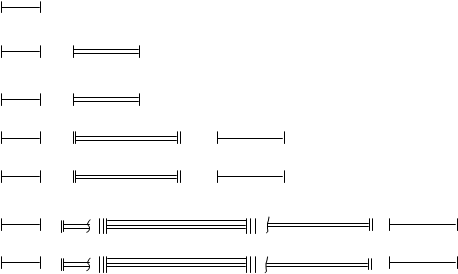 I 1s2
I 1s2
II 2s2 2p6
VI 6s2 5d1 4f14 5d9 6p6
VII 7s2 6d1 5f14 6d9 7p6
Am folosit deja celule cuantice, deși nu am introdus conceptul de „celulă cuantică”. O celulă cuantică nu este altceva decât o reprezentare grafică a unui orbital. Este indicat de o celulă, iar electronii din orbital sunt reprezentați de o săgeată care stă într-o celulă. O celulă este atribuită pentru subnivelul s, deoarece subnivelul s are un singur orbital. Trei celule sunt alocate pentru subnivelul p deoarece subnivelul p conține trei orbitali p. Subnivelul d este reprezentat de cinci celule, iar subnivelul f de șapte celule.
Structura electronică a atomului de titan, pentru care am scris deja formula electronică, descrisă folosind celule cuantice, arată astfel:
Ministerul Agriculturii al Federației Ruse
FGOU VPO „Academia Agricolă de Stat Ulyanovsk”
Sarcini pentru teste și întrebări de examen la disciplină
Ulyanovsk - 2010
A.L. Ignatov. Sarcini pentru teste și întrebări de examen la disciplina „Chimie” / Ed. prof. IN SI. Kostina. - Academia de Stat de Agricultură Ulyanovsk, 2009, 58s.
Referent: Kafiyatullina A.G., Candidat la Chimie, Lector principal al Departamentului de Chimie, Universitatea Pedagogică de Stat Ulyanovsk. I.N. Ulyanova»
Acest manual conține sarcini de control pentru secțiunile principale ale cursului de chimie, exemple de rezolvare a problemelor tipice și o listă de întrebări de examen.
Pentru studenții Facultății de Inginerie a cursurilor prin corespondență din specialitatea: 110301 „Mecanizarea agriculturii”, 110304 „Tehnologia întreținerii și reparației mașinilor în complexul agroindustrial”, 190601 „Automobile și industria auto”.
© A.L. Ignatov, 2010.
© FGOU VPO „Academia de Stat de Agricultură Ulyanovsk”, 2010.
SARCINI DE CONTROL
STRUCTURA SUBSTANȚEI
Exemple de rezolvare a unor probleme tipice
Sarcina 1. Ce subnivel energetic al unui atom este umplut cu electroni mai devreme: a) 4s sau 3d; b) 5p sau
4d; c) 6p sau 4f?
Soluţie. Ordinea de umplere a subnivelurilor de energie cu electroni este determinată de regula Klechkovsky, conform căreia subnivelurile sunt umplute cu electroni în ordinea creșterii succesive a sumei numerelor cuantice principale și orbitale (n + l), și pentru aceleași valori ale acestei sume, în ordinea creșterii numărului cuantic principal n. Să găsim suma (n+l) pentru subnivelurile de energie enumerate în starea problemei.
Suma n+l 4+0=4 |
În consecință, în cazul (a), subnivelul 4s este mai întâi umplut cu electroni, iar apoi subnivelul 3d; în cazul (b), mai întâi 4d, apoi 5p; în cazul (c), mai întâi 4f, apoi 6p.
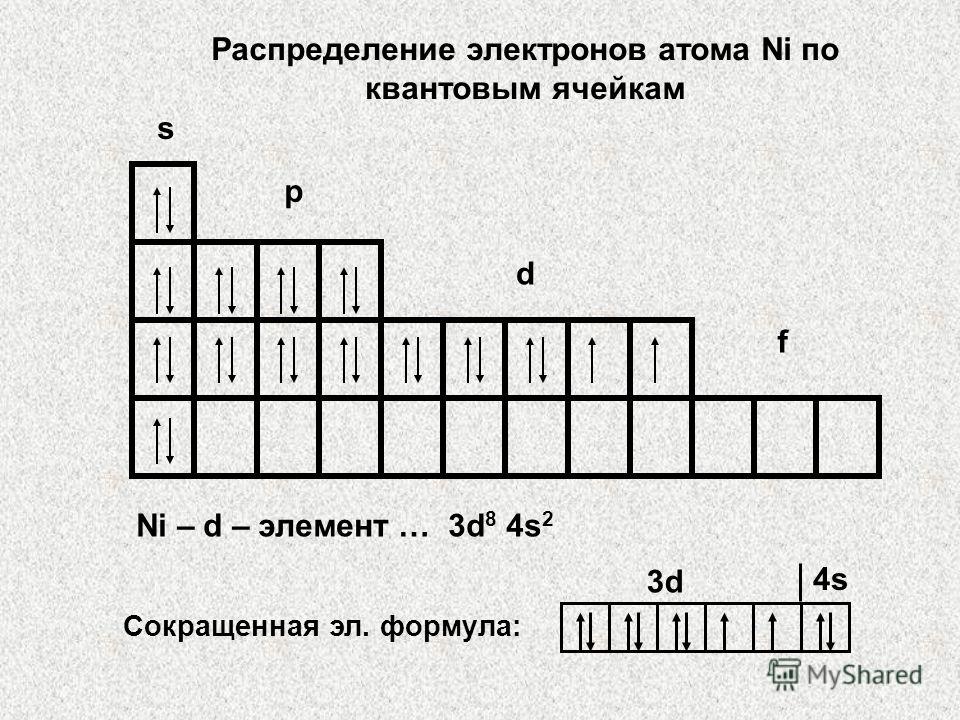
Sarcina 2. Distribuiți electronii pe niveluri, scrieți formula electronică a atomului de Fe în starea fundamentală și excitată, indicați stările cuantice ale electronilor săi de valență și distribuiți-le între celulele cuantice.
Soluţie. Soluția acestei probleme trebuie să înceapă cu determinarea numărului de niveluri care vor fi ocupate de electroni într-un atom de fier neexcitat. Numărul lor este determinat de numărul perioadei în care se află elementul. Pentru fier, este egal cu 4. La primele două niveluri, numărul maxim de electroni este 2, respectiv 8 (determinat de pătratul dublat al numărului cuantic principal 2n2 ). Numărul maxim de electroni de valență este determinat de numărul grupului în care se află elementul (VIII). Deoarece fierul este situat într-un subgrup lateral, electronii săi de valență sunt distribuiți între s - un subnivel al nivelului energetic extern și d - un subnivel al nivelului preextern. Deci, există 2 electroni în starea 4s și 6 în starea 3d (numărul grupului minus 2). Numărul total de electroni din penultimul nivel de energie al unui atom de fier este 14.
Deci, electronii dintr-un atom de fier neexcitat sunt distribuiți între niveluri după cum urmează:
Fiecare al n-lea nivel este împărțit în n subniveluri. Când scrieți formula electronică a unui atom, subnivelurile sunt aranjate în ordinea crescătoare a sumei numerelor cuantice principale și orbitale:
Electroni de valență - 3d 6 4s2.
Ordinea de umplere a celulelor cuantice ale subnivelului cu electroni este determinată de regula Hund conform principiului celei mai mari valori absolute a spinului total:
Într-un atom de fier excitat, un electron s merge la subnivelul 4p. Într-o stare excitată, electronii sunt distribuiți peste celulele cuantice după cum urmează:
Sarcina 3. Scrieți formulele electronice ale ionilor Mn2+, S2-, Br-.
Soluţie. La atomul de Mn (elementul d), electronii sunt distribuiți
niveluri de energie după cum urmează: 1s2 2s2 2p6 3s2 3p6 3d 5 4s 2
Când ionii pozitivi se formează în elemente d -, electronii s ai stratului exterior sunt întotdeauna eliminați primii, adică pentru Mn + 2, formula electronică este valabilă:
1s2 2s2 2p6 3s2 3p6 3d 5 4s 0
apoi pentru ionul S2– va avea loc „finalizarea” subnivelului 3p
S2– :1s2 2s2 2p6 3s 2 3p 6
O „finalizare” similară a subnivelului are loc în timpul formării ionului de Br-:
Br:1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 5
Br– :1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 6 |
|||||||
Sarcina 4. Indicați poziția elementului în sistemul periodic (perioadă, grupă, subgrupă), dacă ultimul electron din atomul său a căzut în starea: a) 3d6; b) 4p2 .
Justificați răspunsul.
Soluţie. a) Dacă ultimul electron a lovit atomul în starea d, atunci acesta este un element al subgrupului lateral. În atomii elementelor subgrupurilor secundare, ultimul electron de valență cade pe d - subnivelul penultimului nivel energetic. De aici rezultă că n-1=3 și n=4. Valoarea numărului cuantic principal - 4 - determină numărul perioadei - 4. Deoarece starea 4s este umplută cu electroni mai devreme de 3d, numărul total de electroni care pot fi de valență este 4: 3d2 4s2. Aceasta înseamnă că acesta este un element al perioadei a 4-a a grupului IV al subgrupului lateral - titan (Ti).
b) Dacă ultimul electron a intrat în atom în starea p, atunci acesta este un element al subgrupului principal.
În atomii elementelor principalelor subgrupe, electronii de valență sunt localizați la nivelul energetic exterior. Prin urmare, valoarea numărului cuantic principal - 4 - determină numărul perioadei. Deoarece starea p a nivelului exterior este umplută cu electroni după starea s, numărul total de electroni de valență, egal cu 4, determină numărul grupului. Prin urmare, acesta este un element al perioadei a 4-a a grupului IV și al subgrupului principal - germaniu.
Sarcina 5. Determinați ce nori de electroni se suprapun în molecula BCl3, ce unghi de legătură are molecula, dacă molecula BCl3 este polară sau nu. Justificați-vă răspunsul, luați în considerare structura moleculei BCl3 din punctul de vedere al metodei VS (legături de valență).
Soluţie. În funcție de poziția elementului în sistemul periodic, indicați stările cuantice ale electronilor de valență din atomii care formează legături și distribuiți-le conform
celule cuantice: B…2s 2 2p1 , dar din moment ce atomul de bor formează trei legături chimice, este într-o stare excitată și are loc hibridizarea orbitalilor de electroni sp2; se formează trei nori de electroni hibrizi.
22p1 | ||||||||
B* ….2s1 2p2 | ||||||||
23p5 | ||||||||
Electronul p este implicat în formarea unei legături în clor.
Legăturile B–Cl sunt formate prin suprapunerea norilor de electroni hibrizi ai atomului В și a norii de electroni p al atomului de Cl.
Direcția norilor de electroni hibrizi ai atomului trivalent B determină direcția legăturilor și forma moleculei de BCl3. Legăturile B–Cl sunt direcționate la un unghi de 1200 , iar molecula BCl3 are forma unui triunghi plat. Schema formării legăturilor într-o moleculă este prezentată în Fig.1.
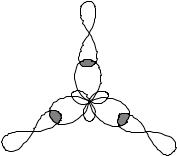
Vectorii momentului dipolar de legătură µb >0 sunt direcționați către atomul cu electronegativitate mai mare. Momentul dipol total al moleculei PM este 0, adică. molecula este nepolară, deși toate legăturile B-Cl sunt polare.
Sarcina 6. Care este relația dintre particulele din cristale ale următoarelor substanțe: CH4, Ne, Rb, RbF, Si, ZnSe? Ce tip de rețea cristalină, în funcție de natura particulelor și de tipurile de legături dintre ele, au aceste substanțe în
stare condensata?
Soluţie. Metanul și cristalele de neon sunt caracterizate de o rețea moleculară. Locurile primei rețele cristaline conțin molecule nepolare CH4, între care acționează componenta de dispersie a forțelor van der Waals. Interacțiunea de dispersie se manifestă și în cristale între moleculele de neon monoatomic.
Rubidiul este un metal; rubidiul cristalin se caracterizează printr-o rețea metalică; legătura dintre cationii de rubidiu localizați la locurile rețelei este metalică.
În compusul RbF, funcționează o legătură ionică tipică, deoarece diferența de electronegativitate a atomilor
mai mult de două unități: ΔX RbF \u003d XF - XRb \u003d 4,0 - 0,8 \u003d 3,2 (Anexa I), cristalele RbF sunt caracterizate de o rețea ionică, la nodurile căreia există ioni Rb + și F - pozitivi și negativi , între care legătura ionică.
Siliciul cristalin (siliciul este un nemetal) are o rețea cristalină covalentă, cum ar fi diamantul, în care fiecare atom de siliciu este conectat la patru atomi vecini printr-o legătură covalentă nepolară. Cristalele de seleniră de zinc au o rețea covalentă.
O legătură covalentă polară acționează între atomii de zinc și seleniu localizați la nodurile rețelei cristaline, deoarece ∆XZnSe = 2,4 - 1,6 = 0,8
Exercitiul 1
Sarcinile sunt date în tabelul 1. Numărul variantei corespunde rândului, numărul sarcinii corespunde coloanei.
1. Distribuiți electronii pe niveluri de energie, scrieți formula electronică a atomului propus în sarcină, indicați stările cuantice ale electronilor de valență, distribuiți-le între celulele cuantice în stările neexcitate și excitate, indicați cărei familii electronice aparține acest element?
2. Scrieți formulele electronice ale ionilor propuși, indicați stările cuantice ale electronilor de valență și distribuiți-le între celulele cuantice.
3. În ce secvență vor fi umplute cu electroni subnivelurile propuse în sarcină? Dă o explicație.
4. În funcție de starea cuantică a ultimului electron, indicați poziția elementului în sistemul periodic (perioadă, grupă, subgrupă).
5. Luați în considerare structura moleculelor propuse în sarcină din punctul de vedere al metodei legăturilor de valență, indicați






