Vodorod atomining emissiya spektri Balmer formulasi. Vodorod atomining spektrini o'rganish
Atomlarning eng oddiyi vodorod atomi Bor nazariyasi uchun o'ziga xos sinov ob'ekti edi. Nazariya yaratilgan vaqtga kelib, u eksperimental tarzda yaxshi o'rganilgan edi. Uning tarkibida bitta elektron borligi ma'lum edi. Atomning yadrosi proton - musbat zaryadlangan zarracha, uning zaryadi mutlaq qiymatida elektron zaryadiga teng, massasi esa elektron massasidan 1836 marta katta. Shuningdek, ichida XIX boshi asr diskret kashf etilgan spektral chiziqlar vodorod atomining nurlanishining ko'rinadigan hududida (deb nomlangan chiziqli spektr ). Keyinchalik, chiziq spektrining to'lqin uzunliklari (yoki chastotalari) bo'ysunadigan naqshlar miqdoriy jihatdan yaxshi o'rganildi (I. Balmer, 1885). Spektrning ko'rinadigan qismidagi vodorod atomining spektral chiziqlari to'plami deyiladi Balmer seriyasi . Keyinchalik spektrning ultrabinafsha va infraqizil qismlarida shunga o'xshash spektral chiziqlar topildi. 1890 yilda Yoxannes Rydberg spektral chiziqlar chastotalari uchun empirik formulani yaratdi:
Bu ikkita alyuminiy atomi va uchta kislorod atomidan hosil bo'lgan birikma hosil bo'lishiga olib kelishi mumkin. U ikkita kislorod atomi bilan birlashib, birikma hosil qiladi. Garchi davriy sistema o‘z vaqtida katta muvaffaqiyatga erishgan bo‘lsa-da, bu jadvalga to‘g‘ri kelmaydigan yangi elementlarning topilishi boshqa tasniflash tizimini izlashga olib keldi.
Bundan tashqari, Mendeleyev lantan, iterbiy, erbiy, terbiy, prazeodimiy va neodimiy kabi ba'zi noyob yer elementlarini bilar edi, ularning jadvalda o'z o'rni yo'q edi. Atom raqami elementlarning xossalari davriyligini bildiruvchi xarakteristikasi ekanligi aniqlanganda muammo hal qilindi. Bugungi kunda elementlar chapdan o'ngga va yuqoridan pastga ularning qiymatining ortib borishi tartibida tartiblangan. atom raqamlari, ya'ni. ularning atomlari yadrosidagi protonlar soni bo'yicha.
Balmer seriyasi uchun m = 2, n= 3, 4, 5, ... . Ultraviyole seriyali uchun (Lyman seriyasi) m = 1, n= 2, 3, 4, ... . Doimiy R bu formulada deyiladi Ridberg doimiysi . Uning raqamli qiymati R= 3,29 10 15 Gts. Bordan oldin chiziqli spektrlarning paydo bo'lish mexanizmi va vodorodning (va bir qator boshqa atomlarning) spektral chiziqlari formulalariga kiritilgan butun sonlarning ma'nosi tushunarsiz bo'lib qoldi.
Xuddi shu qatorda elektron qatlamlari soni bir xil bo'lgan va xossalari bosqichma-bosqich o'zgarib turadigan elementlar, oxirgi qatlamda bir xil miqdordagi elektronga ega bo'lgan va shuning uchun o'xshash xususiyatlarga ega bo'lgan elementlar bir xil ustunga joylashtiriladi. Birinchi davr, shuningdek, ikkinchi va uchinchi davrlar qisqa davrlar deb ataladi; sakkiz elementli to'rtinchi va beshinchisi uzun, oltinchi va ettinchisi esa 32 elementli juda uzun. Oxirgi ikkitasi, o'tish metallaridan tashqari, noyob tuproq elementlaridir.
Bor postulatlari yangi fan - atomning kvant fizikasining rivojlanish yo'nalishini belgilab berdi. Ammo ularda statsionar holatlar (orbitalar) parametrlarini va tegishli energiya qiymatlarini aniqlash retsepti mavjud emas edi. En.
Vodorod atomining statsionar holatlari energiyasining eksperimental izchil qiymatlariga olib keladigan kvantlash qoidasi Bor tomonidan taxmin qilingan. U yadro atrofida aylanadigan elektronning burchak impulsi faqat Plank doimiysiga karrali diskret qiymatlarni qabul qilishi mumkinligini aytdi. Dumaloq orbitalar uchun Bor kvantlash qoidasi quyidagicha yoziladi
Davriy sistema elementlarining xossalaridagi naqshlar. Elementlarni atom raqamining o'sish tartibida tasniflash yana ikkita mezondan foydalanishni o'z ichiga oladi: atom massasi va xossalarning o'xshashligi. Agar bu elementlar o'zlariga ko'ra eng kichikdan yuqoriga tartiblangan bo'lsa atom massasi, argine zamonaviy davriy jadvalda kaliyni egallagan holatda paydo bo'lishi kerak. Ammo argon olijanob gaz bo'lib, yuqori reaktiv metallar bo'lgan litiy va natriy guruhiga kirmaydi.
Agar ular atom raqami bo'yicha tartiblangan bo'lsa, argon 18 va kaliy 19 ga teng, shuning uchun ularning har biri o'z guruhiga kiradi. Elementlar xossalarining o'xshashligining sababi aynan ularning atomlaridagi elektronlarning soni va taqsimlanishidadir. Atomlari oxirgi qatlamda yoki energiya darajasida bir xil miqdordagi elektronga ega bo'lgan elementlar o'xshashdir Kimyoviy xossalari va shuning uchun davriy jadval bilan bir guruhda.
![]()
Bu yerda m e - elektron massasi, y - uning tezligi, rn statsionar aylana orbitasining radiusidir. Bor kvantlash qoidasi vodorod atomidagi elektronning statsionar orbitalarining radiuslarini hisoblash va energiya qiymatlarini aniqlash imkonini beradi. Ba'zi radiusli aylana orbita bo'ylab aylanadigan elektronning tezligi r yadroning Kulon maydonida, Nyutonning ikkinchi qonunidan kelib chiqqan holda, munosabat bilan aniqlanadi.
Dastlabki 10 ta elementning elektron taqsimoti quyidagicha. Iltimos, shuni yodda tutingki, elektron darajalar yoki darajalar siz yuqoriga o'tishingiz bilan yakunlanadi ma'lum davr. 1 va 2 davrlarning oxirgi elementlari bo'lgan geliy va neon o'zlarining to'liq elektron qatlamlariga ega.
Barcha ishqorlar oxirgi darajadagi bitta elektronga ega. Uning elektron konfiguratsiyasi. Bitta guruhdagi barcha elementlar oxirgi darajadagi bir xil konfiguratsiyaga ega. Hammasi o'xshash xususiyatlarga ega. Umuman olganda, materiyani tashkil etuvchi atomlar, bir xil yoki har xil bo'lishidan qat'i nazar, birlashadilar, garchi tabiatda alohida atomlardan hosil bo'lgan moddalar, masalan, guruh elementlari ham mavjud.

qayerda e - elementar zaryad, e 0 - elektr doimiysi. Elektron tezligi y va statsionar orbita radiusi rn Bor kvantlash qoidasi bilan bog'langan. Bundan kelib chiqadiki, statsionar aylana orbitalarining radiuslari ifoda bilan aniqlanadi
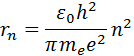
18-guruh elementlarining xususiyatlaridan biri shundaki, ularning barchasi tashqi qatlamida sakkizta elektronga ega, faqat ikkitasi bo'lgan geliy bundan mustasno. Ushbu struktura eng barqaror hisoblanadi, shuning uchun bu elementlarning atomlari odatda aralashmaydi kimyoviy reaksiyalar. Shuning uchun ular olijanob yoki inert gazlar laqabini olishadi. Qolgan elementlarning oxirgi qatlamida 8 ta elektronga ega bo'lishga harakat qilishlari ularning kimyoviy harakatlarini oqlaydi.
Shunday qilib, biz atomlar hosil bo'lish uchun birlashishga moyil degan xulosaga kelishimiz mumkin kimyoviy moddalar dastlabki atomlardan ko'ra ko'proq energiya beqaror bo'lgan ma'lum xususiyatlarga ega. Ushbu turdagi ulanish kimyoviy bog'lanish deb ataladi. Kimyoviy bog'lanish atomlarni turli atom klasterlarida ushlab turadigan jozibali kuchdir.
Yadroga eng yaqin orbita qiymatga mos keladi n= 1. Birinchi orbitaning radiusi, deyiladi Bor radiusi , ga teng

Keyingi orbitalarning radiusi mutanosib ravishda ortadi n 2 .
Bajarildi mexanik energiya E radiusli statsionar aylana orbitada aylanib yuruvchi atom yadrosi va elektron tizimi rn, ga teng
Geliy atomi oxirgi to'liq qatlamga ega, bu unga katta barqarorlikni beradi. Aksincha, oxirgi va yagona qatlamida elektronga ega bo'lgan vodorod atomi ancha barqaror emas. Biroq, agar ikkita vodorod atomi bir-biriga etarlicha yaqin bo'lsa, elektron qatlamlarini elektronlarini almashish orqali bog'lash uchun bu barqarorlik ortadi. Bunday bog'lanish mumkin, chunki atomning tashqi mintaqasining ko'p qismi bo'sh joydir. Diagramma shuni ko'rsatadiki, bu sharoitda bir qator elektrostatik kuchlar namoyon bo'ladi: ikkita yadro bir xil. elektr zaryadi va ikkita elektron kabi bir-birini qaytaradi; ammo yadrolar va elektronlar o'rtasida o'zaro tortishish mavjud bo'lib, to'rtta zarrachalar shunday joylashtirilganki, tortishish kuchlari itaruvchi kuchlarga to'liq qarshi turadi.

Shuni ta'kidlash kerak E p< 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ 2 и rn, biz olamiz:

Butun son n= 1, 2, 3, ... atomning kvant fizikasida deyiladi bosh kvant soni .
Bu sodir bo'lganda, a kimyoviy bog'lanish. Elektronlarni boshqa atomlar bilan almashish orqali barqarorlikka erishadigan atomlar kovalent bog' bilan bog'lanadi. Bir juft vodorod atomi normal haroratda vodorodning eng barqaror shaklidir.
Vodorod kabi ikkita atomdan iborat bo'lgan molekulalar diatomik molekulalar deyiladi. Agar ular ikkitadan ortiq atomni o'z ichiga olsa, ular ko'p atomli deb ataladi. Xuddi shu tarzda ikkita xlor atomi qo'shiladi. Individual atomning oxirgi qatlamida ettita elektron mavjud. Ikki xlor atomi bir-biriga yaqinlashganda va elektron qatlamlarini birlashtirganda, ular bir juft elektronga ega bo'ladi. Shunday qilib, har bir atom sakkizta elektron bilan o'ralgan deb hisoblanishi mumkin. Ikki xlor atomi molekula sifatida biriktirilgan holda qoladi.
Borning ikkinchi postulatiga ko'ra, elektronning energiya bilan bir statsionar orbitadan o'tishi paytida En energiya bilan boshqa statsionar orbitaga Em < En atom yorug'lik kvantini chiqaradi, chastotasi n nm qaysi D ga teng Enm / h:
![]()
Ushbu formula vodorod atomining spektral qatori uchun Rydberg empirik formulasiga to'liq mos keladi, agar biz doimiylikni o'rnatsak. R teng
Boshqa ko'plab gazlar mavjud kimyoviy elementlar, normal haroratda kislorod, azot, ftor kabi biatomik molekulalar shaklida sodir bo'ladi. Kovalent bog'lanishning ifodalanishi. Kovalent bog'lanish ikki yadroning ular orasidagi elektron juftlariga ta'sir etuvchi tortishish kuchidir: bitta bog'da bir juft, qo'sh bog'da ikkita juft va uch juft bog'da uch juft. Kovalent bog'lanish bir necha usulda ifodalanishi mumkin; masalan, ftorid molekulasidagi ikkita atom o'rtasidagi bog'lanish ikki yo'l bilan aniqlanishi mumkin.
Raqamli qiymatlarni almashtirish m e, e, e 0 va h bu formulada natija beradi
bu empirik qiymatga juda mos keladi R. Guruch. 6.3.1 elektronning yuqori statsionar orbitalardan pastki orbitalarga o'tishida vodorod atomining nurlanishida spektral qatorlar hosil bo'lishini ko'rsatadi.
Shaklda. 6.3.2. vodorod atomining energiya darajalarining diagrammasi ko'rsatilgan va turli spektral qatorlarga mos keladigan o'tishlar ko'rsatilgan.
Kovalent elementlarning xossalari. Uning erish va qaynash haroratlari past. Erkin elektronlar mavjud emas, lekin ular joylashganligi sababli, bu elementlar o'tkazmaydi elektr toki. Kovalent kristallarda atomlar faqat uch o'lchamli tarmoqni tashkil etuvchi kovalent bog'lanishlar bilan bog'lanadi.
Olmos tarkibida faqat uglerod atomlari mavjud va shuning uchun bu element mavjud bo'lgan shakllardan biridir. Uglerod atomida oxirgi qatlamda oxirgi to'rtta elektron bor va yana to'rttasi asil gaz tuzilishiga ega bo'lishi uchun etishmayapti va bu elektronlarning har birini boshqa to'rtta uglerod atomlari bilan bo'lishish orqali olish mumkin.
Borning vodorod atomi nazariyasi va eksperimenti o'rtasidagi ajoyib kelishuv uning haqiqiyligi foydasiga jiddiy dalil bo'lib xizmat qildi. Biroq, bu nazariyani murakkabroq atomlarga tatbiq etishga urinishlar muvaffaqiyatli bo'lmadi. Bor kvantlash qoidasining fizik talqinini bera olmadi. Bu o'n yil o'tgach, de Brogli tomonidan g'oyalarga asoslangan holda amalga oshirildi to'lqin xususiyatlari ah zarralar. De Broyl vodorod atomidagi har bir orbita atom yadrosi atrofida aylana bo'ylab tarqaladigan to'lqinga mos kelishini taklif qildi. To'lqin yadro atrofidagi har bir aylanishdan keyin doimiy ravishda takrorlanganda statsionar orbita paydo bo'ladi. Boshqacha qilib aytganda, statsionar orbita orbita uzunligi bo'ylab aylana shaklida turgan de-Broyl to'lqiniga mos keladi (6.3.3-rasm). Bu hodisa sobit uchlari bo'lgan ipda turgan to'lqinlarning statsionar rasmiga juda o'xshaydi.
Shunday qilib, u barqarorlikka ega bo'ladi elektron tuzilma, neon tuzilishiga o'xshash, oxirgi qatlamda to'rt juft elektron mavjud. Yod moddasi kristalli yoki uch o'lchamli tarmoqni tashkil etuvchi molekulalararo kuchlar bilan bog'langan yod molekulalari tomonidan hosil bo'ladi. Molekulalar orasidagi bu jozibador kuchlar zaif bo'lgani uchun, bu kristallar osongina yo'q qilinishi mumkin.
Uglerod strukturasi diagrammasida faqat markaziy element oxirgi qatlamga ega ekanligi kuzatiladi. Bu boshqa to'rt atomning har biriga, o'z navbatida, boshqa to'rtta atom bilan kovalent bog'lanish hosil qilishiga va shu tariqa ularning elektron qatlamlarini to'ldirishga imkon beradi. Har bir atom buni amalga oshirar ekan, ulkan tarmoq yaratiladi.
Statsionar holatda kvant holati vodorod atomining, de Broyl g'oyasiga ko'ra, to'lqin uzunliklarining butun soni l, ya'ni,
Bu munosabatni de Broyl to'lqin uzunligini o'rniga qo'yish l = h / p, qayerda p = m e y - elektron impulsi, biz olamiz:
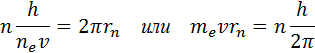
Olmosda uglerod atomlari barcha yo'nalishlarda juda barqaror bo'lgan uch o'lchovli tarmoq shaklida bo'ladi. Olmos eng ko'plaridan biridir qattiq moddalar, ma'lum va juda qattiq holatda qoladi yuqori haroratlar. Kovalent atom kristallarining xossalari.
Bularning barcha xususiyatlari qattiq kristallar ularni hosil qiluvchi zarralar orasida juda kuchli kuchlar o'rnatilganligini ko'rsating. Teorema shuni ko'rsatadiki, bu kuchlar ularning atomlari orasidagi kovalent bog'lanishlarga bog'liq. Olmos juda qattiq, uning erish va qaynash nuqtalari juda yuqori. kovalent aloqalar tarmoqni tashkil etuvchi uglerod atomlari o'rtasida shunchalik kuchliki, strukturani yo'q qilish uchun katta miqdorda energiya talab qilinadi. Bo'sh elektronlari bo'lmagani uchun u elektr tokini o'tkazmaydi.
Shunday qilib, Bor kvantlash qoidasi elektronlarning to'lqin xususiyatlari bilan bog'liq.
Vodorod atomini o'rganishda spektral naqshlarni tushuntirishda Bor nazariyasining muvaffaqiyati hayratlanarli edi. Atomlar kvant tizimlari ekanligi ayon bo'ldi va energiya darajalari atomlarning statsionar holatlari diskretdir. Bor nazariyasi yaratilishi bilan deyarli bir vaqtda atomning statsionar holatlari mavjudligi va energiyani kvantlash uchun bevosita eksperimental dalillar olindi. Atomning energiya holatlarining diskretligi 1913 yilda D.Frank va G.Gertsning simob atomlari bilan elektronlarning toʻqnashuvi oʻrganilgan tajribasida koʻrsatildi. Ma'lum bo'lishicha, agar elektronlarning energiyasi 4,9 eV dan kam bo'lsa, ularning simob atomlari bilan to'qnashuvi mutlaqo elastik ta'sir qonuniga muvofiq sodir bo'ladi. Agar elektron energiyasi 4,9 eV ga teng bo'lsa, u holda simob atomlari bilan to'qnashuv noelastik ta'sir xarakteriga ega bo'ladi, ya'ni harakatsiz simob atomlari bilan to'qnashuv natijasida elektronlar o'zlarining kinetik energiyasini butunlay yo'qotadilar. Bu shuni anglatadiki, simob atomlari elektronning energiyasini o'zlashtiradi va asosiy holatdan birinchi qo'zg'aluvchan holatga o'tadi,
Ikki atomni yaqinlashtirishda quyidagi holatlar yuzaga kelishi mumkin. Elektronlar va yadrolar o'rtasida itaruvchi kuchlar mavjud bo'lib, ular yaqinlashganda kuchayadi va hech qachon bog'lanish hosil bo'lmaydi, masalan, ikkita geliy atomini yaqinlashtirishga urinish. Bir atomning yadrosi va boshqa atomning elektronlari o'rtasida tortishish kuchlari paydo bo'ladi va aksincha. Bunday holda, tizimning energiyasi biroz masofaga kamayadi; keyin ikki atom o'rtasida bog'lanish hosil bo'ladi.
Bog'lanish jarayonida energiya doimo ajralib chiqadi. Demak, element yoki birikma hosil qiluvchi atomlarni ajratish uchun bog’ hosil bo’lish jarayonida ajralib chiqadigan energiyaga teng yoki undan katta energiya berish kerak. Grafit - tabiatda topilgan uglerodning yana bir shakli. Bunda uglerod atomlari olti a'zoli halqalarda joylashgan. Har bir uglerod atomi boshqa uchta atom bilan kovalent bog'langan. Shunday qilib, elektronlar harakat erkinligini qoldiradi, shuning uchun grafit elektr tokini o'tkazadi.
|
E 2 - E 1 = 4,9 eV. |
Bor kontseptsiyasiga ko'ra, atomning teskari o'z-o'zidan o'tishi paytida simob chastotali kvantlarni chiqarishi kerak.
![]()
Bunday chastotali spektral chiziq simob atomlarining emissiya spektrining ultrabinafsha qismida haqiqatda aniqlandi.
Bu qora rangli modda bo'lib, teginish uchun porloq, yumshoq va rangsiz, chunki u bir-biriga ozgina yopishgan va bir-birining ustiga siljiydigan sliplarda taqdim etilgan. U elektr tokini o'tkazish xususiyatiga ega elektrodlar, kompyuterlar uchun qalam vallari va printer lentalarini tayyorlash uchun ishlatiladi.
Metalllar boshqa moddalardan juda farq qiladigan xususiyatlarga ega, ular ma'lum bir turdagi bog'lanishning mavjudligini kuchaytiradi va ularga imkon beradi. Metall elementlarning tashqi qatlamida odatda 1, 2 yoki 3 elektrondan iborat atomlar mavjud. Bu elektronlar zaif bog'langan atom yadrosi shuning uchun ular osongina qayta ishlanishi mumkin.
Diskret holatlar tushunchasi klassik fizikaga ziddir. Shu sababli, kvant nazariyasi o'z qonunlarini rad etadimi degan savol tug'ildi.
Kvant fizikasi energiya, impuls, elektr razryad va boshqalarning saqlanishning asosiy klassik qonunlarini bekor qilmadi.N.Borning fikricha. muvofiqlik printsipi , kvant fizikasi klassik fizika qonunlarini o'z ichiga oladi va ma'lum sharoitlarda kvantdan klassik tushunchalarga silliq o'tishni aniqlash mumkin. Buni vodorod atomining energiya spektri misolida ko'rish mumkin (6.3.2-rasm). Katta kvant raqamlari uchun n>> 1 diskret darajalar asta-sekin bir-biriga yaqinlashadi va klassik fizikadan kelib chiqadigan uzluksiz spektr mintaqasiga silliq o'tish sodir bo'ladi.
Bir-biridan ajratilgan va iloji boricha bir-biriga yaqinlashadigan metall elementning atomlari to'plamini tasavvur qiling. Bunday sharoitda atomlarning tashqi elektron qatlamlari to'liq bir-biriga yopishadi va dastlab ma'lum elektron qatlamdan chiqadigan har qanday elektron endi biron bir alohida atom bilan bog'lanmaydi, balki to'plamdagi barcha atomlar tomonidan taqsimlanadi. Bu atomlar metall aloqa bilan bog'langan.
Metall kristall elektronlar dengiziga botirilgan musbat zaryadlangan statsionar atomlar tomonidan hosil bo'ladi, ular delokalizatsiyalanadi va shuning uchun biron bir alohida atomga tegishli emas. Ular juda ixcham bo'lganligi sababli, metallar juda qattiq, lekin ularni cho'zish orqali simlar hosil qilish mumkin, chunki atomlarning bir qatlami boshqasiga o'tishi mumkin.
Borning yarim klassik nazariyasi kvant kontseptsiyalarining rivojlanishidagi muhim bosqich bo'lib, uning fizikaga kiritilishi mexanika va elektrodinamikani tubdan qayta qurishni talab qildi. Bunday qayta qurish XX asrning 20-30-yillarida amalga oshirilgan.
Borning atomda elektronlar harakatlanadigan ma'lum orbitalar haqidagi g'oyasi juda shartli bo'lib chiqdi. Aslida, atomdagi elektronning harakati sayyoralar yoki sun'iy yo'ldoshlarning harakatiga juda oz o'xshaydi. Jismoniy ma'no faqat u yoki bu joyda elektronni topish ehtimoli bo'lib, to'lqin funksiyasi modulining kvadrati bilan tavsiflanadi |r| 2. To‘lqin funksiyasi r asosiy tenglamaning yechimidir kvant mexanikasi - Shredinger tenglamalari . Ma'lum bo'lishicha, atomdagi elektronning holati kvant sonlarining butun to'plami bilan tavsiflanadi. Bosh kvant soni n atom energiyasining kvantlanishini aniqlaydi. Burchak momentini kvantlash uchun, deyiladi orbital kvant soni l . Burchak momentining kosmosda ajralib turadigan har qanday yo'nalishga proyeksiyasi (masalan, vektor yo'nalishi magnit maydon) diskret qiymatlar qatorini ham oladi. Burchak momentining proyeksiyasini kvantlash uchun biz kiritamiz magnit kvant soni m . kvant raqamlari n, l, m ma'lum kvantlash qoidalari bilan bog'langan. Masalan, orbital kvant soni l 0 dan (gacha) butun son qiymatlarni qabul qilishi mumkin n- bitta). Magnit kvant soni m± oralig'ida har qanday butun qiymatlarni qabul qilishi mumkin l. Shunday qilib, bosh kvant sonining har bir qiymati n, atomning energiya holatini belgilaydigan, kvant sonlarining bir qator birikmalariga mos keladi l va m. Har bir bunday kombinatsiya ma'lum bir ehtimollik taqsimotiga |r| mos keladi 2 kosmosning turli nuqtalarida elektronni aniqlash ("elektron buluti").
Orbital kvant soni bo'lgan davlatlar l= 0 sferik simmetrik ehtimollik taqsimotlari bilan tavsiflanadi. Ular chaqiriladi s-davlatlar (1 s, 2s, ..., ns, ...). Qadriyatlar uchun l> 0 elektron bulutining sferik simmetriyasi buziladi. dan beri davlatlar l= 1 chaqiriladi p- davlatlar, bilan l = 2 - d-davlatlar va boshqalar.
Shaklda. 6.3.4 ehtimollik taqsimoti egri chiziqlarini ko'rsatadi r ( r) = 4p r 2 |r| 2 vodorod atomidagi elektronni yadrodan turli masofalarda 1-holatlarda aniqlash s va 2 s.
Shakldan ko'rinib turibdiki. 6.3.4, elektron 1-holatda s(vodorod atomining asosiy holati) yadrodan turli masofalarda aniqlanishi mumkin. FROM katta ehtimol bilan radiusga teng masofada aniqlanishi mumkin r Birinchi Bor orbitasining 1. 2-holatdagi elektronni topish ehtimoli s maksimal masofa r = 4r 1 yadrodan. Ikkala holatda ham vodorod atomini sferik simmetrik elektron bulut sifatida ko'rsatish mumkin, uning markazida yadro joylashgan.
Vodorod atomining spektral qatori.
Noyob gazlarning emissiya spektrlarini (ya'ni, alohida atomlarning emissiya spektrlarini) o'rganish shuni ko'rsatdiki, har bir gaz ma'lum xususiyatlarga ega. hukmronlik qilgan alohida spektral chiziqlar yoki bir-biriga yaqin joylashgan chiziqlar guruhidan iborat spektr. Bu, ayniqsa, eng oddiy vodorod atomi spektrida yaqqol namoyon bo'ladi.
Shveytsariyalik olim I. Balmer vodorod atomining o'sha davrda ma'lum bo'lgan barcha spektral chiziqlarini tavsiflovchi empirik formulani oldi. spektrning ko'rinadigan hududi:
qayerda n=3;4;5;6.
Balmer seriyasi bilan bir qatorda atom vodorod spektrida boshqa qatorlar topildi, ularning to'lqin raqamlari shunga o'xshash formulalar bilan ifodalanishi mumkin.
DA ultrabinafsha Lyman seriyasining hududlari:
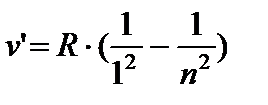 n = 2;3… (8,4)
n = 2;3… (8,4)
DA infraqizil hududlar:
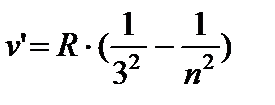 - Paschen seriyasi, n =4;5…
- Paschen seriyasi, n =4;5…
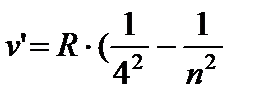 ) - Qavs qatori, n = 5;6… (8,5)
) - Qavs qatori, n = 5;6… (8,5)
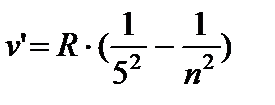 - Pfund seriyasi, n = 6;7…
- Pfund seriyasi, n = 6;7…
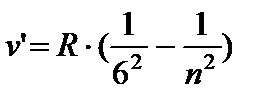 - Xamfri seriyasi, n = 7;8…
- Xamfri seriyasi, n = 7;8…
(8.3) - (8.5) munosabatlarini tahlil qilib, atom vodorodining barcha qatorlarini ifodalash mumkinligini aytishimiz mumkin. umumiy formula chaqirdi umumlashtirilgan Balmer formulasi bo'yicha:
 (8.6)
(8.6)
qayerda m har bir berilgan qatorda doimiy qiymatga ega, m=1;2;3;4;5;6 (ketmalarni belgilaydi); a n=m+1, m+2,… (ushbu qatorning alohida satrlarini belgilaydi).
Atomning statsionar holatining energiyasi:  (8.9)
(8.9)
"-" belgisi mavjud shartli qiymat, toza jismoniy ma'no– musbat yadro sohasidagi elektronning energiyasi manfiy. (8.9) dan ko'rinib turibdiki, statsionar holatlar energiyasi n=1;2;3... uchun diskret qator hosil qiladi.
Bor tomonidan ilgari surilgan postulatlar vodorod atomi va vodorodga o'xshash tizimlar (zaryadli yadrodan tashkil topgan tizimlar) spektrini hisoblash imkonini berdi. Ze va bitta elektron (masalan, ionlar Yo'q + , Li +) va nazariy jihatdan Ridberg doimiysini hisoblang.
Bordan so'ng, vodorodga o'xshash tizimdagi elektronning aylana statsionar orbitalari bilan chegaralangan harakatini ko'rib chiqaylik. Potensial energiya Elektronning yadro bilan o'zaro ta'siri:
 (9.1),
(9.1),
r- orbitaning radiusi. Kinetik energiya elektron yadro atrofida harakat qiladi: 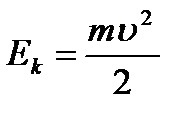 (9.2).
(9.2).
Keyin umumiy energiya atom:
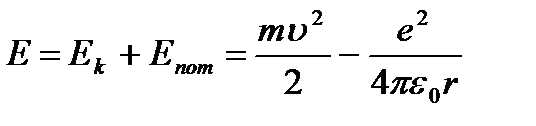 (9.3).
(9.3).
Yadro atrofidagi elektron tezlanish bilan harakat qiladi 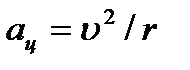 Kulon kuchi ta'sirida:
Kulon kuchi ta'sirida:  .
.
Nyutonning ikkinchi qonuniga ko'ra ( ma = F k) yozilishi mumkin:
 (9.4);
(9.4);
bu yerdan 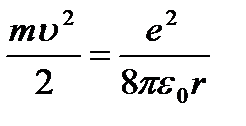 (9.5).
(9.5).
Biz (9.5) ni (9.3) qo'yamiz: 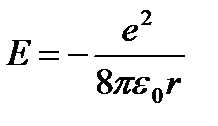 (9.6).
(9.6).
Bor tanlash qoidasini yoki kvantlash qoidasini taklif qildi (Borning uchinchi postulati): elektronning barcha mumkin bo'lgan orbitalaridan faqat elektronning burchak impulsi Plank doimiysiga karrali bo'lganlari amalga oshiriladi:
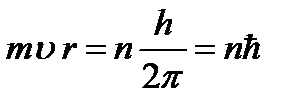 (9.7),
(9.7),
qayerda n=1,2,3,… - asosiy kvant soni. (9.4) va (9.7) munosabatlaridan foydalanib, biz statsionar elektron orbitasining radiusini aniqlaymiz:

 (9.8),
(9.8),
at (birinchi orbitaning radiusi).
(9.8) dan kelib chiqadi 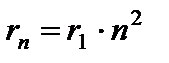 . (9.8) ni (9.10) ga almashtirib, uchun ifodani olamiz statsionar holat energiyalari:
. (9.8) ni (9.10) ga almashtirib, uchun ifodani olamiz statsionar holat energiyalari:
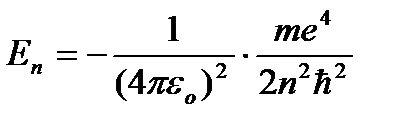 =
= 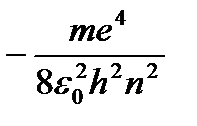 (9.9)
(9.9)
Da - birinchi statsionar holatning energiyasi.
Energiya holatida E 1 atom cheksiz qolishi mumkin. Vodorod atomini ionlash uchun, ya'ni. undan elektronni yirtib tashlash uchun unga 13,55 eV energiya berish kerak.
 eV;
eV;  ;
;
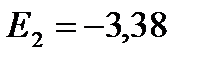 eV;
eV; 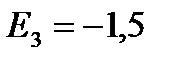 eV;
eV; ![]() eV va boshqalar.
eV va boshqalar.
, ,… holati hayajonlangan atomga mos keladi. Bu shtatlarda umr bo'yi tartibli  . Bu vaqt ichida elektron yadro atrofida taxminan 100 million aylanishni amalga oshirishga muvaffaq bo'ladi.
. Bu vaqt ichida elektron yadro atrofida taxminan 100 million aylanishni amalga oshirishga muvaffaq bo'ladi.
Berib n turli xil butun qiymatlar, biz vodorod atomi uchun formula (9.9) bo'yicha, mumkin bo'lgan energiya darajalarini olamiz. Vodorod atomining energiyasi ortib boradi P ortadi va energiya darajalari qiymatga mos keladigan chegaraga yaqinlashadi n=¥. Shunday qilib, vodorod atomi minimal energiyaga ega (E 1 \u003d -13,55 eV). n=1 va maksimal (E ¥ =0) da P=¥ . Shuning uchun E ¥ = 0 qiymati atomning ionlanishiga (undan elektronning ajralishi) mos keladi. Borning ikkinchi postulatiga ko'ra, vodorod atomining statsionar holatdan o'tish davrida n barqaror holatga t Kvant kamroq energiya bilan chiqariladi:

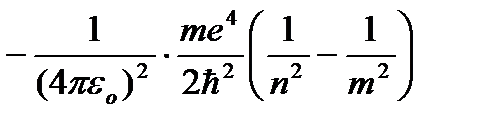 ,
,
radiatsiya chastotasi qaerdan:
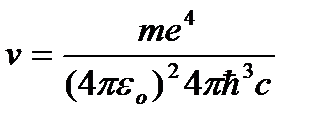
 =R
=R  , (9.10)
, (9.10)
qayerda  .
.
Hisoblashda foydalanish R zamonaviy qadriyatlar universal konstantalar, biz vodorod atomi uchun empirik formulalarda Ridberg doimiysining eksperimental qiymatiga to'g'ri keladigan qiymatni olamiz: ![]() .
.
Bu tasodif Bor tomonidan vodorodga o'xshash tizimning energiya darajalari uchun olingan formulaning to'g'riligini isbotlaydi.
Masalan, (9.10) formulaga almashtirish m=1 va n=2, 3, 4, ..., biz Liman qatorini tashkil etuvchi va qo'zg'aluvchan darajadan elektronlarning o'tishlariga mos keladigan chiziqlar guruhini olamiz. (n= 2, 3, 4, ...) asosiyda (t= 1). Xuddi shunday, almashtirishda t= 2, 3, 4, 5, 10 va ularning mos qiymatlari n biz Balmer, Paschen, Bracket, Pfund va Humphrey seriyalarini olamiz (ulardan ba'zilari sxematik tarzda 9.1-rasmda keltirilgan). Binobarin, vodorod atomining spektrini miqdoriy jihatdan tushuntirgan Bor nazariyasiga ko'ra, spektral qator atomning uning ustida joylashgan qo'zg'aluvchan holatlardan ma'lum holatga o'tishi natijasida hosil bo'lgan nurlanishga mos keladi.
 Bor nazariyasi klassik fizikaning atom ichidagi hodisalarga qoʻllanilmasligini va mikrokosmosda kvant qonunlarini qoʻllash zarurligini koʻrsatdi. Ammo geliy atomi uchun xuddi shunday nazariyani yaratishga urinish muvaffaqiyatsiz tugadi. Bor nazariyasi doimiy ravishda klassik ham, doimiy kvant nazariyasi ham emas edi. Bor nazariyasining kamchiliklarini yangisini yaratish orqali bartaraf etish mumkin edi kvant nazariyasi, bunda mikrozarrachalarning xatti-harakati va harakati o'z qonunlariga bo'ysunadi. Bu kvant mexanikasini yaratishda amalga oshirildi.
Bor nazariyasi klassik fizikaning atom ichidagi hodisalarga qoʻllanilmasligini va mikrokosmosda kvant qonunlarini qoʻllash zarurligini koʻrsatdi. Ammo geliy atomi uchun xuddi shunday nazariyani yaratishga urinish muvaffaqiyatsiz tugadi. Bor nazariyasi doimiy ravishda klassik ham, doimiy kvant nazariyasi ham emas edi. Bor nazariyasining kamchiliklarini yangisini yaratish orqali bartaraf etish mumkin edi kvant nazariyasi, bunda mikrozarrachalarning xatti-harakati va harakati o'z qonunlariga bo'ysunadi. Bu kvant mexanikasini yaratishda amalga oshirildi.
Atomdagi elektronning holati bir emas, balki bir nechta bilan tavsiflanadi kvant raqamlari.
Birinchidan ularning kvant raqamlari - bosh kvant soni: n=
bitta; 2;3,… Atomdagi elektronning energiya darajalarini aniqlaydi:  va statsionar orbitalarning radiuslari
va statsionar orbitalarning radiuslari  . Bu ifodalar Shredinger tenglamasining yechimidan kelib chiqadi va Bor tomonidan olingan mos formulalar bilan mos keladi.
. Bu ifodalar Shredinger tenglamasining yechimidan kelib chiqadi va Bor tomonidan olingan mos formulalar bilan mos keladi.
Ikkinchi kvant soni - orbital kvant soni, qaysi berilgan n 0, 1, 2, ... qiymatlarini qabul qilishi mumkin, n-bir. Bu raqam orbital burchak momentini aniqlaydi  yadroga nisbatan elektron. Atomdagi elektronning burchak momenti quyidagi formula bilan kvantlanadi:
yadroga nisbatan elektron. Atomdagi elektronning burchak momenti quyidagi formula bilan kvantlanadi: 
Uchinchi kvant soni - magnit kvant soni, berilganda 0 qiymatlarini oladi; ±1; ±2,…, ±; jami 2+1 qiymatlar. Bu raqam elektronning orbital burchak impulsining biron bir ixtiyoriy tanlangan Z yo'nalishiga proyeksiyalarini aniqlaydi. Faqat burchak momentum vektorining shunday yo'nalishlari mumkin, buning uchun vektorning tashqi magnit maydon yo'nalishiga (OZ o'qi) proyeksiyasi. qiymatlarni oladi: 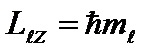
To'rtinchi kvant soni - aylanish(magnit spin) kvant soni Xonim
. U faqat ikkita qiymatni qabul qilishi mumkin 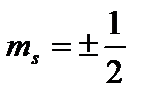 va elektronning spinining Z o'qiga proyeksiyaning mumkin bo'lgan qiymatlarini tavsiflaydi (ichki mexanik burchak momenti):
va elektronning spinining Z o'qiga proyeksiyaning mumkin bo'lgan qiymatlarini tavsiflaydi (ichki mexanik burchak momenti): 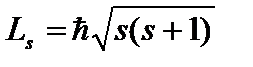 , qayerda
, qayerda ![]() spin kvant soni. Fazoviy spin kvantlash spin vektorining tashqi magnit maydon yo'nalishi bo'yicha proyeksiyasi quyidagi formula bo'yicha topilishini anglatadi:
spin kvant soni. Fazoviy spin kvantlash spin vektorining tashqi magnit maydon yo'nalishi bo'yicha proyeksiyasi quyidagi formula bo'yicha topilishini anglatadi:  .
.
1924 yilda shveytsariyalik fizik Pauli quyidagi printsipni ishlab chiqdi: har qanday atomda ikkita bir xil statsionar holatda bo'lgan ikkita elektron bo'lishi mumkin emas, ular to'rtta kvant sonlari to'plami bilan aniqlanadi - asosiy n; orbital; magnit m va spin m s. Pauli printsipi elektronlarga qo'shimcha ravishda yarim butun spinga ega bo'lgan boshqa zarralarga (birliklarda) bo'ysunadi.
Keling, ma'lum bir elektronlar sonini aniqlaylik.
=0 bo'lgan elektronlar chaqiriladi s 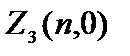 = 2(2×0+1)=2.
= 2(2×0+1)=2.
=1 bo'lgan elektronlar deyiladi R-elektronlar, ularning maksimal soni 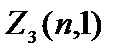 =2(2×1+1)=6.
=2(2×1+1)=6.
=2 bo'lgan elektronlar deyiladi d-elektronlar, ularning maksimal soni  =2(2 2+1)=10.
=2(2 2+1)=10.
=3 bo'lgan elektronlar deyiladi f-elektronlar, ularning maksimal soni  2(2×3+1)=14 va hokazo.
2(2×3+1)=14 va hokazo.
Maksimal raqam qiymat bilan belgilanadigan holatlardagi elektronlar n bosh kvant soni
= 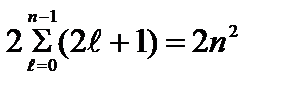
Bosh kvant sonining qiymati bir xil bo'lgan holatlar to'plamini egallagan elektronlar n elektron qobiq hosil qiladi. Quyidagi elektron qobiqlar mavjud (yoki qatlamlar): K-qatlam da n = 1; L- qatlam n = 2; M- qatlam n = 3; N- qatlam n=4 va boshqalar. Atomning har bir kvant qobig'ida elektronlar orbital kvant sonining ma'lum bir qiymatiga mos keladigan pastki qavatlar orasida taqsimlanadi; elektronga qarab, belgilar bilan kichik guruhda joylashgan s, p, d, f va hokazo.
| Bosh kvant soni | Elektron qobiq (qatlam) | Holatlardagi elektronlar soni | Elektronlarning maksimal soni | |||
| s ( =0) | p ( =1) | d ( =2) | f ( =3) | |||
| K | – | – | – | |||
| L | – | – | ||||
| M | – | |||||
| N |
Bosh kvant soni bilan aniqlangan holatda n= 1, faqat ikkita turli spin yo'nalishiga ega bo'lgan ikkita s-elektron bo'lishi mumkin (10.1-rasmga qarang).
Agar a n= 2, keyin sxema shaklda ko'rsatilgan shaklga ega. 10.2.
Kimyoviy elementlar atomlarida elektron holatlarni to'ldirish ketma-ketligi Pauli printsipi bilan izohlanadi.
Bu tamoyil D.I.Mendeleyev yaratgan davriy sistemada kimyoviy elementlar xossalarining davriyligini tushuntiradi.
Ikki tamoyilga bo'ysunadigan davriy tizimning qurilishini (yoki atom qatlamlarini elektronlar bilan to'ldirishni) kuzatamiz: a) to'ldirish eng past energiyadan (eng barqaror holat) boshlanadi; b) Pauli istisno tamoyili.
Davriy jadvaldagi birinchi element vodorod atomidir H, buning uchun Z = 1. U bitta elektronga ega, uning kvant raqamlari: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d +1/2 yoki -1/2, ya'ni elektron konfiguratsiya. vodorod atomi: 1S1.
Keyingi element geliydir Yo'q ikkita elektron mavjud, kvant raqamlari: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d ±1/2, ya'ni geliy atomining elektron konfiguratsiyasi: 1S 2. Elektronlar soni N = 2 bo'lgan K qavat to'liq to'ldirilgan.
Uchinchi element - lityum Li. Uning uchinchi elektronida kvant raqamlari mavjud: n \u003d 2, \u003d 0, m e \u003d 0, m s \u003d +1/2 yoki - 1/2, ya'ni 1S 2 2S 1 atomining elektron konfiguratsiyasi.
berilliy Ve: Z = 4 atomning elektron konfiguratsiyasi 1S 2 2S 2.
Keyingi oltita elementda 2p bilan to'ldirilgan qobiqlar mavjud. Natijada, Z = 10 bo'lgan neon Ne atomining elektron konfiguratsiyasiga ega 1S 2 2S 2 2P 6, ya'ni. L- qatlam to'liq to'ldiriladi va bu davriy jadvalning ikkinchi qatlamini tugatadi. He, Ne, shuningdek, s- yoki s- va p-kichik guruhlari elektronlar bilan toʻliq band boʻlgan boshqa atomlar kabi xossalari oʻxshash va kimyoviy jihatdan inertdir.
| Z | element belgisi | Element nomi | Elektron konfiguratsiya |
| H | vodorod | 1s 1 | |
| Yo'q | geliy | 1s2 | |
| Li | litiy | 1s1 2s1 | |
| Bo'l | berilliy | 1s2 2s2 | |
| B | bor | 1s 2 2s 2 2p 1 | |
| C | uglerod | 1s 2 2s 2 2p 2 | |
| N | azot | 1s 2 2s 2 2p 3 | |
| O | kislorod | 1s 2 2s 2 2p 4 | |
| F | ftor | 1s 2 2s 2 2p 5 | |
| Yo'q | neon | 1s 2 2s 2 2p 6 | |
| Na | natriy | 1s 2 2s 2 2p 6 3s 1 | |
| mg | magniy | 1s 2 2s 2 2p 6 3s 2 | |
| Al | alyuminiy | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| Si | kremniy | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| R | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| S | oltingugurt | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| Cl | xlor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 |
Qatlamlarni to'ldirishda buzilishlar Z=19 (kaliy K) bo'lgan elementda kuzatiladi, bu erda 4s qobig'ining to'ldirilishi to'ldirilmagan 3d bilan boshlanadi:
va hokazo 3d qobiq to'lguncha.
Bu buzilish elektronlar orasidagi o'zaro ta'sir bilan bog'liq bo'lib, ularning holati n=3, n=4 va hokazo asosiy kvant sonlari bilan tavsiflanadi. O'zaro ta'sir natijasida shunday vaziyat yuzaga keladiki, katta bo'lgan davlat n, lekin kichkinasi energetik jihatdan qulayroq bo'lishi mumkin.
Xuddi shunday holat 5s, 5p, 6s chig'anoqlari to'ldirilmagan 4 bilan to'ldirilgan noyob yer elementlari yoki lantanidlarda (58-71 raqamlari bo'lgan atomlarda) kuzatiladi. f qobiq. Ularning barchasi tashqi qobiqqa ega 6s 2 . Yana bir og'ish aktinidlar (90-103 raqamlari bo'lgan atomlar) uchun amal qiladi, ularda 5 ta f tashqi qobiqni to'ldirgandan keyin qobiq 7s 2 .
29-mavzu. Optik kvant generatorlari
Tanlash qoidalariga ko'ra, ko'pgina elementlarning atomlari energiya darajalariga ega bo'lib, elektron to'g'ridan-to'g'ri quyi darajaga o'ta olmaydi. Bu darajalar deyiladi metastabil davlatlar. Elektron boshqa elektron bilan to'qnashganda yoki undan yuqoriroqdan harakatlanayotganda shunday darajaga chiqishi mumkin yuqori daraja. Elektronning metastabil holatda qolish muddati 10-3 sekund, hayajonlangan holatda esa 10-8 s.
Atomning qo'zg'aluvchan holatdan asosiy holatga o'z-o'zidan o'tishi paytida chiqadigan nurlanish deyiladi. spontan emissiya. Spontan emissiya turli atomlar izchil yuzaga kelmaydi, chunki har bir atom nurlanishni boshqalardan mustaqil ravishda boshlaydi va tugatadi (15.1a-rasm).
Atom tomonidan energiya emissiyasi, unda o'tish metastabil holat asosiysi deyiladi elektromagnit nurlanish mos keladigan chastota deyiladi majburlangan yoki induktsiya qilingan, nurlanish (15.1b-rasm).
Chastota to'g'ri kelganda rag'batlantirilgan emissiya ehtimoli keskin ortadi elektromagnit maydon hayajonlangan atomning tabiiy nurlanish chastotasi bilan. Rag'batlantiruvchi nurlanish chastotasi, fazasi, polarizatsiyasi va tarqalish yo'nalishi bo'yicha ogohlantiruvchi nurlanish bilan bir xil. Binobarin, rag'batlantirilgan emissiya rag'batlantiruvchi nurlanish bilan qat'iy muvofiq, ya'ni chiqarilgan foton atomga tushgan fotonni ajratib bo'lmaydi. Chiqarilgan fotonlar bir yo'nalishda harakatlanib, boshqa hayajonlangan atomlar bilan uchrashib, keyingi induksiyalangan o'tishlarni rag'batlantiradi va fotonlar soni ko'chki kabi o'sadi.
Biroq, rag'batlantirilgan emissiya bilan bir qatorda, raqobat jarayoni, yutilish ham mumkin. Termodinamik muvozanatda bo'lgan atomlar tizimida tushayotgan nurlanishning yutilishi majburiy nurlanishdan ustun bo'ladi, ya'ni. Materiyadan o'tayotganda, hodisa nurlanishi zaiflashadi.
Muhitning radiatsiya hodisasini kuchaytirishi uchun uni yaratish kerak tizimning muvozanatsiz holati, bunda qo'zg'atilgan holatdagi atomlar soni asosiy holatdagi atomlar sonidan ko'p bo'ladi. Bunday davlatlar davlatlar deb ataladi. teskari populyatsiya bilan. Moddaning muvozanatsiz holatini yaratish jarayoni (tizimni populyatsiya inversiyasi holatiga o'tkazish) deyiladi. pompalanadi. Pompalash optik, elektr va boshqa usullar bilan amalga oshirilishi mumkin. Teskari holatlarga ega bo'lgan muhitlar faol deyiladi. Ularni salbiy assimilyatsiya koeffitsientiga ega bo'lgan ommaviy axborot vositalari deb hisoblash mumkin, chunki tushayotgan yorug'lik nurlari ushbu muhitdan o'tganda kuchayadi.
Birinchi marta rag'batlantirilgan emissiya tufayli yorug'lik kuchayishi mumkin bo'lgan muhitni olish imkoniyati 1939 yilda rus fizigi V.A.Fabrikant tomonidan ta'kidlangan. U eksperimental ravishda elektr razryad bilan qo'zg'atilgan simob bug'ining stimulyatsiyalangan emissiyasini topdi. Elektromagnit to'lqinlarning kuchayishi fenomeni va ularni kuchaytirishning ixtiro qilingan usuli (V.A.Fabrikant, M.M.Vudinskiy, F.A.Butaeva; 1951 yil) kashfiyoti kvant elektronikasining asosini tashkil etdi, uning qoidalari keyinchalik kvant amplifikatorlari va kvant amplifikatorlarini amalga oshirishga imkon berdi. yorug'lik generatorlari.
Muhitning deyarli teskari holati optik kvant generatorlarida yoki lazerlarda (inglizcha nomining birinchi harflaridan boshlab Light Amplification by Stimulated Emission of Radiation - stimulyatsiya qilingan emissiya orqali yorug'likni kuchaytirish) amalga oshiriladi. Lazerlar ko'rinadigan, infraqizil va ultrabinafsha yaqin hududlarda (optik diapazonda) hosil qiladi. Maserlarda (radio to'lqinlarning santimetr diapazonida ishlaydigan generator va kuchaytirgichlar) va lazerlarda qo'llaniladigan elektromagnit to'lqinlarni kuchaytirish va yaratishning sifat jihatidan yangi printsipi g'oyasi rus olimlari N.G. Basov va A.M.Proxorovga va amerikalik fizik C.ga tegishli. Mukofotlangan shaharlar Nobel mukofoti 1964 yil
Eng muhimi mavjud turlari lazerlar qattiq holat, gaz, yarim o'tkazgich va suyuqlikdir (bunday bo'linishning asosi faol muhitning turi). Aniqroq tasniflash nasos usullarini ham hisobga oladi - optik, termal, kimyoviy, elektroionizatsiya va boshqalar Bundan tashqari, ishlab chiqarish rejimini hisobga olish kerak - uzluksiz yoki impulsli.
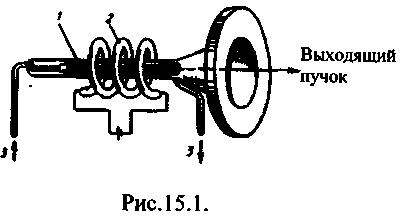 Lazer majburiy ravishda uchta asosiy komponentga ega: 1) faol muhit, aholi inversiyasi bo'lgan shtatlar yaratilgan; 2) nasos tizimi(faol muhitda inversiyalarni yaratish uchun qurilma); 3) optik rezonator(foton nurining selektiv yo'nalishini kosmosga ajratuvchi va chiquvchi yorug'lik nurini hosil qiluvchi qurilma).
Lazer majburiy ravishda uchta asosiy komponentga ega: 1) faol muhit, aholi inversiyasi bo'lgan shtatlar yaratilgan; 2) nasos tizimi(faol muhitda inversiyalarni yaratish uchun qurilma); 3) optik rezonator(foton nurining selektiv yo'nalishini kosmosga ajratuvchi va chiquvchi yorug'lik nurini hosil qiluvchi qurilma).
Spektrning ko'rinadigan hududida ishlaydigan birinchi qattiq holatdagi lazer (radiatsiya to'lqin uzunligi 0,6943 mkm) 1960 yilda yaratilgan yoqutli lazer (T.Maiman, AQSh). 16.1-rasmda yoqut lazerining sxemasi ko'rsatilgan. Unda darajalarning teskari populyatsiyasi 1955 yilda N. G. Basov va A. M. Proxorov tomonidan taklif qilingan uch darajali sxema bo'yicha amalga oshiriladi. Yaqut kristalli alyuminiy oksidi Al 2 Oz bo'lib, uning kristall panjarasida Al atomlarining bir qismi uch valentli Cr e + ionlari bilan almashtiriladi (xrom ionlarining 0,03 va 0,05% mos ravishda pushti va qizil yoqut). Optik nasos uchun ruby novda (1) atrofida spiral tarzda o'ralgan impulsli gaz deşarj lampasi (2) ishlatiladi. Yoqut kuchli chiroq nuri bilan qizg'in nurlantirilganda, xrom atomlari pastki sathdan keng tarmoqli darajalariga o'tadi. 3 (16.2-rasm). Xrom atomlarining qo'zg'aluvchan holatda ishlash muddati qisqa (10-7 s dan kam) bo'lganligi sababli, o'z-o'zidan 3®1 o'tishlari (ular ahamiyatsiz) yoki darajaga eng ko'p nurlanishsiz o'tishlar sodir bo'ladi. 2 (u metastabil deb ataladi) ortiqcha energiyani yoqut kristalli panjarasiga o'tkazish bilan. 2®1 o'tish tanlov qoidalari bilan taqiqlanadi, shuning uchun hayajonlangan holatning davomiyligi 2 10 -3 s tartibdagi xrom atomlari, ya'ni. shtatga qaraganda taxminan to'rt marta kattaroq 3. Bu 2-darajada xrom atomlarining "to'planishi" ga olib keladi . Etarli nasos quvvati bilan ularning 2-darajadagi konsentratsiyasi 1-darajaga qaraganda ancha yuqori bo'ladi , ya'ni 2-darajali teskari populyatsiyaga ega vosita paydo bo'ladi.
Ruby lazer tayog'i silindr bo'lib, uning uchlari ehtiyotkorlik bilan sayqallangan va kumush qatlami bilan qoplangan, shunda bir uchi yorug'likni to'liq aks ettiradi, ikkinchisi esa qisman aks ettiriladi va qisman o'tadi. Nasos chirog'i miltillaganda, turli xil chastotalardagi fotonlar yoqut novdasiga kiradi. Xrom atomlari ma'lum energiya fotonlarining bir qismini o'zlashtirib, hayajonlangan holatga o'tadi. Cheklangan o'z-o'zidan o'tishlar tufayli novdada stimulyatsiya qilingan nurlanish paydo bo'lishi mumkin, u o'z o'qi bo'ylab qat'iy ravishda tarqaladi va rol o'ynaydigan so'nggi nometalllarning ko'p aks etishi bilan kuchayadi. bo'shliq rezonatori. Natijada kuchli monoxromatik nurlanish paydo bo'ladi - yorug'lik zarbasi, uning bir qismi shaffof oynadan chiqadi. Bunday pulsning davomiyligi 10-3 s. Buning sababi shundaki, bu vaqt davomida barcha qo'zg'atilgan xrom ionlari qo'zg'almas holatga o'tadi. Lazer nuri qat'iy yo'naltirilgan va kichik farqlarga ega. Lazerning bo'shliq rezonatori ijobiy teskari aloqani yaratish va lazer chiqish nurining geometrik parametrlarini shakllantirish uchun xizmat qiladi.
Ruby novda tomonidan so'rilgan barcha energiya lazer nurlanishiga aylantirilmaydi. Uning bir qismi, juda muhim (50%) tayoqni isitish uchun sarflanadi, shuning uchun lazer dizayni sovutishni ta'minlaydi. 3. Taxminan 1000 K tayoq haroratida yoqut lazeri yo'q qilinadi.
Ko'p sonli lazer materiallari mavjud: neodimiy ionlari kiritilgan shisha, samariy ionlari bilan kaltsiy florit va boshqalar. Ular yorug'lik nurlanishini beradi. turli uzunliklar to'lqinlar: yoqut lazer - 0,694 mikron, neodimiy shisha lazer - 1,06 mikron (infraqizil nurlanish). Lazerlarda faol muhit sifatida gazlar yoki gazlar aralashmalari (Ne, Ar, Ne-He, CO 2 va boshqalar) ishlatilishi mumkin. Gaz lazerlarida faol muhitning atomlari ko'pincha yuqori chastotali razryad bilan qo'zg'atiladi. Qoida tariqasida, gaz lazerlarining emissiyasi doimiydir. Yarimo'tkazgichli, kimyoviy, gaz-dinamik va boshqa lazerlar yaratilgan.
Lazer nurlanishi quyidagi xususiyatlarga ega:
1) vaqt va fazoviy muvofiqlik;
2) qat'iy monoxromatiklik;
3) energiya oqimining yuqori zichligi;
4) nurda juda kichik burchak farqi.
G'ayrioddiy xususiyatlar lazer nurlanishi keng qo‘llanilishini topdi. Masalan, yorug'lik nurli mashinalarda lazer nurlari yordamida yoqut, olmosdan yasalgan soat toshlarida, o'tga chidamli qotishmalarda va kesish qiyin bo'lgan metallarda teshiklar ochiladi. Mikroelektronikada lazerlar mikrosxemalar, yotqizilgan yarimo'tkazgich qatlamlari va boshqalar uchun turli xil ulanishlarni payvandlash uchun ishlatiladi.
Mavzu 30. Kvant mexanikasi elementlari
Frantsuz olimi Lui de Broyl yorug'likning ikkilamchi korpuskulyar-to'lqinli tabiati haqidagi g'oyalarni ishlab chiqib, 1923 yilda korpuskulyar-to'lqinli dualizmning universalligi haqidagi gipotezani ilgari surdi. De Broyl yorug'lik xossalari bilan moddiy zarrachalarning xossalari o'rtasida chuqur o'xshashlik mavjudligini ta'kidladi; shuning uchun moddiy zarralar ham ikki tomonlama xususiyatga ega, ya'ni. muayyan sharoitlarda ularning to'lqin xossalari namoyon bo'ladi.
 De Broyl impulsi bo'lgan zarrani taxmin qildi
De Broyl impulsi bo'lgan zarrani taxmin qildi ![]() to'lqin uzunligiga mos keladi:
to'lqin uzunligiga mos keladi:  (1.2)
(1.2)
Bu munosabat (de-Broyl formulasi) impulsli har qanday zarra uchun amal qiladi R.
Tez orada de Broyl gipotezasi eksperimental tarzda tasdiqlandi. Amerikalik fiziklar K. Davisson va L. Germer 1927 yilda nikel monokristalidagi elektronlarning sochilishini rasmda ko'rsatilgan o'rnatish yordamida o'rgandilar. Elektron tabancadan 1 elektron nuri nikel kristaliga 2 yo'naltirildi, kristalldan sochilgan elektronlar 3 sezgir galvanometrga ulangan maxsus qabul qilgich 4 tomonidan ushlandi. Ko'zgu nurining intensivligi galvanometrdan o'tadigan oqim kuchidan aniqlandi. Tajribalar shuni ko'rsatdiki, ma'lum bir tushish burchagida elektronlar kristall sirtidan turli burchaklarda aks etadi va aks ettirilgan elektronlar sonining ba'zi yo'nalishlarda maksimallari, boshqalarida minimallari, ya'ni diffraktsiya naqshlari kuzatilgan. Bu hodisa de Broyl elektron to'lqin uzunligida kuzatilgan 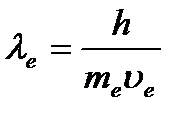 kristalldagi atomlararo masofa tartibida. Diffraktsiya maksimallari Vulf-Braggs formulasiga to'g'ri keldi
kristalldagi atomlararo masofa tartibida. Diffraktsiya maksimallari Vulf-Braggs formulasiga to'g'ri keldi ![]() , va Bragg to'lqin uzunligi aniq bo'lib chiqdi uzunligiga teng(1.2) formula bo'yicha hisoblangan to'lqin.
, va Bragg to'lqin uzunligi aniq bo'lib chiqdi uzunligiga teng(1.2) formula bo'yicha hisoblangan to'lqin.
Keyinchalik, P.S. Tartakovskiy va G. Tomson yupqa metall plyonkalar orqali tez elektronlarning o'tishini tekshirdilar. Shu bilan birga, ushbu plyonkalar orqasidagi fotografik plitalarda diffraktsiyadagi kabi difraksion naqsh olingan. rentgen nurlari polikristallarda.
1849-yilda V.A.Fabrikant, L.M.Biberman va N.G.Sushkinlar qurilmada juda kam tok boʻlgan elektron difraksiyasi boʻyicha tajribalar oʻtkazdilar, yaʼni har bir elektron tasodifiy joylarda fotoplastinka orqali qayd etilgan. Uzoq muddatli ta'sir qilish bilan, yuqori oqim kuchiga ega bo'lgan qisqa ta'sirda bo'lgani kabi, bir xil diffraktsiya namunasi olingan. Bu shuni anglatadiki, to'lqin xususiyatlari har bir elektronga alohida-alohida xosdir, lekin bitta elektronning diffraktsiyasi oqimdan diffraktsiya bilan olingan butun nuqtalar tizimini bermaydi. Bitta elektronning izi faqat bitta nuqtada bo'ladi, bu diffraktsiya sharti bilan ruxsat etiladi. Bu elektronlarning korpuskulyar tabiatini ko'rsatadi, chunki elektron tarqala olmaydi. Elektron qaysi joylarda tushishini aytish mumkin emas. Biz faqat kosmosdagi nuqtaga urish ehtimoli haqida gapirishimiz mumkin.
Shunday qilib, elektron ikki tomonlama tabiatga ega, ya'ni. u zarrachalar va to'lqinlarning xususiyatlarini birlashtiradi. Elektronlarning to'lqin tabiati ularning difraksiyasi bo'yicha tajribalar bilan tasdiqlangan. Elektronlarning korpuskulyar tabiati elektronning qismlarga bo'linmasdan, bir butun bo'lib harakat qilishida namoyon bo'ladi.
Keyinchalik neytronlar, protonlar, atom va molekulyar nurlar uchun diffraktsiya hodisalari ham kashf qilindi. Bu nihoyat mikrozarrachalarning toʻlqin xossalari mavjudligining isboti boʻlib xizmat qildi va mikrozarrachalarning harakatini de Broyl formulasi (1.2) bilan hisoblangan maʼlum toʻlqin uzunligi bilan tavsiflangan toʻlqin jarayoni koʻrinishida tasvirlash imkonini berdi.






