Vodorod atomining spektral chiziqlari. Laboratoriya ishlarini bajarish tartibi. Vodorodning izelektronik ketma-ketligi
Bor nazariyasi paydo bo'lgunga qadar vodorod atomi juda yaxshi o'rganilgan edi. Bu atomlarning eng oddiyidir. Yagona elektron o'z yadrosi atrofida aylanadi. Vodorodning chiziqli spektri ham oddiy. Shuning uchun uning tavsifi olingan tavsiflardan oldin boshqa atomlarning spektrlari.
Molekulyar spektrlar molekula yutilish yoki emissiyaga uchraganda kuzatiladi elektromagnit nurlanish energiyaning ko'payishi yoki kamayishi natijasida. Bug'larning energiya o'zgarishida ishtirok etishi va nurlanishning so'rilishi yoki chiqarilishi darajasida qonunlar tomonidan cheklovlar mavjud. Bu ikki hodisa mos ravishda induktsiyalangan yutilish va deb ataladi. Bundan tashqari, qo'zg'atilgan energiya holatidagi molekula o'z-o'zidan elektromagnit nurlanishni chiqarishi mumkin, bu esa induksion nurlanishsiz bir oz pastroq energiya darajasiga qaytadi.
Borning birinchi postulatiga ko'ra, atomda yadro atrofida elektronlar hech qanday emas, faqat ma'lum statsionar orbitalarda aylanishi mumkin, ular "ruxsat etilgan" deb ataladi. Bunday holda, energiya atom tomonidan chiqarilmaydi va so'rilmaydi. Har bir bunday orbita ma'lum biriga to'g'ri keladi energiya darajasi atom. Atom energiyasi faqat elektron boshqa orbitaga yoki boshqa energiya darajasiga o'tganda o'zgaradi. Bu sodir bo'lganda, energiya kvantining yutilishi yoki chiqarilishi.
Siz allaqachon atomning tuzilishi haqida bilib oldingiz. Atrofdagi elektronlar atom yadrosi, ortib borayotgan energiya darajalari qatorida joylashgan. Har bir element noyob konfiguratsiyadagi noyob elektron soniga ega, shuning uchun har bir element o'ziga xos energiya darajalariga ega. Energiya darajalarining bunday joylashishi atomning o'ziga xos izi bo'lib xizmat qiladi.
Biroq, xuddi shunday haroratgacha qizdirilgan gaz faqat ma'lum bir o'ziga xos to'lqin uzunliklarida yorug'lik chiqaradi. O'sha paytda bu kuzatuvning sababi tushunilmagan edi. Olimlar bu ta'sirni tushirish trubkasi yordamida o'rganishdi. Oqim trubkasi gaz bilan to'ldirilgan shisha nay bo'lib, ikkala uchida ham metall plastinka bor. Agar ikkita metall plastinka o'rtasida etarlicha katta kuchlanish farqi mavjud bo'lsa, trubka ichidagi gaz atomlari elektronlarining bir qismini olib tashlash uchun etarli energiyani o'zlashtiradi, ya'ni gaz atomlari ionlanadi.
Bor nazariyasida vodorod atomi
Bor bo'yicha vodorod atomi
Bor o'z nazariyasida atom yadrosi harakatsiz va elektron uning atrofida aylana orbita bo'ylab aylanadi, deb faraz qildi. Lekin zamonaviy fan ma'lumki, elektron harakatlanadigan ruxsat etilgan orbita umuman qo'zg'almas doira chizig'i emas. Aslida, bu kosmosning ma'lum bir hududi, to'p shaklidagi yupqa konsentrik qatlam bo'lib, uning markazi atom yadrosi bo'lib, unda elektron paydo bo'lishi mumkin. Bu hudud atomning elektron qobig'i yoki deyiladi orbital.
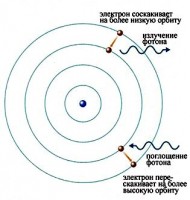
Bu elektronlar gaz bo'ylab harakatlana boshlaydi va boshqa atomlardagi elektronlarning bir qismini yuqori energiya darajasiga ko'taradigan oqim hosil qiladi. Keyin, atomlardagi elektronlar orqaga qaytganda, ular elektromagnit nurlanish chiqaradilar. Emissiya spektri deb ataladigan turli to'lqin uzunliklarida chiqarilgan yorug'lik miqdori quyida vodorod gazi bilan to'ldirilgan zaryadsizlangan naycha uchun ko'rsatilgan. Rasmdagi chiziqlar ko'rsatilgandek yorug'likning faqat ma'lum to'lqin uzunliklari kuzatiladi.
Oxir-oqibat, olimlar bu chiziqlar atomning o'ziga xos energiya darajalari o'rtasida o'tishni amalga oshiradigan elektronlar tomonidan chiqarilgan ma'lum energiyaning fotonlaridan kelib chiqqanligini tushunishdi. Rasmda bunga misol ko'rsatilgan. Atomdagi elektron yuqori energiya darajasidan pastroq energiya darajasiga tushganda, u qo'shimcha energiyani olib tashlash uchun foton chiqaradi.
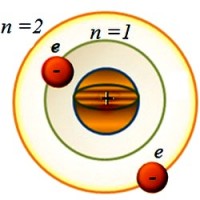
Atomda bir nechta elektron qobiq bo'lishi mumkin. Ularning har biri o'ziga xos xususiyatlarga ega bosh kvant soni n . U 1, 2, 3, ..., 7, ... butun son qiymatlarini oladi, energiya darajasining sonini bildiradi va berilgan orbitada joylashgan elektronlarning energiyasini aniqlaydi. Qiymat qanchalik katta n , elektron yadrodan qanchalik uzoqda bo'lsa va shunchalik ko'p energiyaga ega. Fizikada elektron qobiqlar ko'proq harflar bilan belgilanadi K, L, M, N, O, P, Q . Yadroga eng yaqin joylashgan Kimga -qobiq. Uning uchun n = 1. Unda joylashgan elektron eng kam energiya qiymatiga ega. Masalan, qobiq uchun L n = 2 va boshqalar.
Yuqorida aytib o'tganimizdek, fotonning chastotasi uning energiyasi bilan tenglama orqali bog'liq. Muayyan foton chastotasi bizga ma'lum bir rang berganligi sababli, har bir rang chizig'i o'ziga xos o'tish bilan qanday bog'liqligini ko'rishimiz mumkin. Ko'rinadigan yorug'lik emas yagona turdagi chiqarilgan elektromagnit nurlanish. Ko'proq baquvvat yoki kamroq energiyali o'tishlar ultrabinafsha yoki infraqizil nurlanishni keltirib chiqarishi mumkin. Biroq, har bir atom o'ziga xos energiya darajalariga ega bo'lganligi sababli, har bir atom o'z emissiya spektriga ega.
Atomlar nafaqat fotonlarni chiqaradi; ular fotonlarni ham yutadi. Agar foton atomga tegsa va fotonning energiyasi atomdagi elektronlarning ikkita energiya darajasi orasidagi bo'shliqqa to'g'ri kelsa, u holda quyi energiya darajasidagi elektron fotonni o'zlashtirishi va yuqori energiya darajasiga o'tishi mumkin. Agar fotonning energiyasi ikki energiya darajasi o'rtasidagi farqga to'g'ri kelmasa, u holda foton so'rilmaydi.
Ammo, Bor kabi, masalani soddalashtiramiz va elektron yadro atrofida aylana orbita bo'ylab aylanadi deb faraz qilaylik. Agar elektron birinchi orbitada bo'lsa ( n =1), keyin atomning bu holati deyiladi asosiy. Bu barqaror davlat. Va bu holda uning energiyasi minimal qiymatga ega.
Va elektron uzoqroq orbitaga o'tishi uchun nima kerak? Buning uchun u musbat zaryadlangan yadroning tortishishini engishi kerak. Va bu tashqaridan qo'shimcha energiya olganida mumkin. Va keyin u raqam bilan orbitada bo'ladi n ˃ 1 (n =2, 3, 4, …). Bunda atomning energiyasi ortadi. Va u chaqirilgan holatga kiradi hayajonlangan.
Ushbu effektdan foydalanib, agar bizda turli energiyadagi fotonlar manbai bo'lsa, biz turli materiallar uchun yutilish spektrlarini olishimiz mumkin. Yutish spektrini olish uchun siz qiziqqan materialning namunasiga oq yorug'likni yoriting. Oq yorug'lik har xil to'lqin uzunliklaridan iborat ko'rinadigan yorug'lik birga yig'ilgan. Absorbtsiya spektrida bo'shliqlar bo'ladi. Bo'shliqlar ma'lum bir element uchun energiya darajasida mos keladigan farq mavjud bo'lgan energiyalarga mos keladi.
Yutilgan fotonlar qora chiziqlar sifatida ko'rinadi, chunki bu to'lqin uzunliklarining fotonlari so'riladi va paydo bo'lmaydi. Shu sababli, yutilish spektri emissiya spektrining to'liq teskarisidir. Quyidagi ikkita rasmga qarang. Rasmda siz vodorod chizig'ining emissiya spektrini ko'rishingiz mumkin. Rasmda yutilish spektri ko'rsatilgan. Bu radiatsiya spektrining mutlaqo teskarisi! Atomning energiya darajalari haqida bir xil ma'lumotlarni olish uchun emissiya va yutilish usullaridan foydalanish mumkin.
Hatto Maks Plank ham atomlar energiyani qat'iy belgilangan qismlarda o'zlashtirishi yoki chiqarishini tushundi, uni u kvant. Va bu energiyaning kattaligi yorug'lik tebranishlarining chastotasiga proportsionaldir.
Ε = ħ· ѵ ,
Qorong'i chiziqlar gaz tomonidan so'rilgan yorug'lik chastotalariga mos keladi. Yorug'lik fotonlari elektronlar tomonidan so'rilsa, elektronlar yuqori energiya darajalariga o'tadi. Bu nurlanishning teskari jarayoni. Qorong'i chiziqlar, yutilish chiziqlari bir xil elementning emissiya spektrining chastotalariga mos keladi. Ko'proq harakat qilish uchun elektron tomonidan so'rilgan energiya miqdori yuqori daraja, boshlang'ich energiya darajasiga qaytganda chiqarilgan energiya miqdoriga to'g'ri keladi.
Menda shisha idishda noma'lum gaz bor. Gaz vodorod bo'lishi mumkin degan taxminim bor. Nima beriladi va nima qilish kerak? Bizda 642 nm da assimilyatsiya chizig'i bor. Bu shisha idishdagi moddaning to'lqin uzunligi 642 nm bo'lgan fotonlarni yutishini anglatadi. Ushbu o'tishga vodorodning qaysi 2 energiya darajasi mos kelishini hisoblashimiz kerak. Shuning uchun biz fotonlar qancha energiya yutishini bilishimiz kerak.
qayerda ѵ - chastota kvant nurlanishi,
ħ Plank doimiysi.
Va elektron uzoq orbitadan yadroga yaqinroq orbitaga o'tganda energiya kvanti chiqariladi.
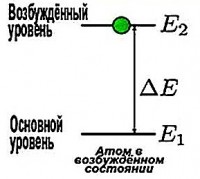
Vodorod atomi faqat bitta elektronga ega bo'lganligi sababli, u ko'pincha erning barqaror holatidadir ( n =1), unda u bir vaqtning o'zida hech narsa chiqarmasdan uzoq vaqt turishi mumkin. Ammo bu qo'shimcha energiya kvantini olguncha davom etadi. Va uni qabul qilib, elektron kattaroq radiusli boshqa ruxsat etilgan orbitaga o'tadi va atom hayajonlangan holatga o'tadi. Biroq, u bu holatda uzoq vaqt qololmaydi. Asosiy holatga qaytib, atom foton (yorug'lik kvanti) chiqaradi. Bu kvantning energiyasi hayajonlangan va asosiy holatlarning energiyalari orasidagi farqga teng.
Yutilgan fotonlarning energiyasini hisoblang. So'rilgan fotonlar 3,1 × 10 -19 J energiyaga ega edi. Ko'rinadigan to'lqin uzunliklarida nurlanishga olib keladigan o'tishlar energiyasini toping. Rasmda turli xil energiya darajasidagi o'tishlar ko'rsatilgan. Ko'rinadigan to'lqin uzunliklari bilan bog'liq o'tishlar energiya darajasida boshlangan yoki tugaydigan o'tishlar sifatida etiketlanadi. Keling, bu o'tishlarning energiyasini topamiz va uni hozirgina hisoblagan so'rilgan fotonlarning energiyasi bilan solishtiramiz.
2-energiya darajasidan 3-energiya darajasiga oʻtish energiyasi. 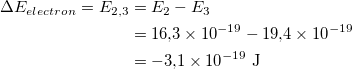
Demak, 2-energiya darajasidan 3-energiya darajasiga o'tish uchun elektron o'zlashtirishi kerak bo'lgan fotonning energiyasi 3,1 × 10 -19 J. Bu idishdagi gaz tomonidan yutilgan fotonlar bilan bir xil energiyadir! Shuning uchun, barcha elementlarning o'tishlari noyob bo'lganligi sababli, idishdagi gazni vodorod deb aytish mumkin. O'tish - bu energiya darajasi 2 va energiya darajasi o'rtasidagi fotonning yutilishi.
Nima uchun vodorod atomining spektri chiziqli
Vodorod atomining emissiya spektri
19-asrning boshlaridayoq vodorod atomining koʻrinadigan qismidagi spektri 4 ta alohida chiziqdan iboratligi aniqlangan: qizil, yashil, koʻk va binafsha. Buni qanday tushuntirish mumkin? Axir u faqat bitta elektronga ega.
Gap shundaki, nurlanish paytida elektron, masalan, to'rtinchi orbitadan nafaqat uchinchi orbitaga, balki ikkinchi va birinchi orbitaga, shuningdek uchinchidan ikkinchi orbitaga va hokazolarga sakrashi mumkin.
Emissiya va yutilish spektrlarini qo'llash
Fotonning energiyasi energiya darajasining energiyasiga mos kelmaydi, u ikki energiya darajasi o'rtasidagi energiya farqiga mos keladi. Astronomiyada yulduzlar va galaktikalar spektrlarini o'rganadigan fan spektroskop deb ataladi. Spektroskopiya astronomiyada astronomik ob'ektlar haqida turli xil narsalarni bilish uchun keng qo'llaniladigan vositadir.
Astronomik ob'ektlardagi elementlarni ularning spektrlari yordamida aniqlash
Yulduzdan keladigan yorug'lik spektrini o'lchash astronomlarga yulduz nimadan iboratligini aniqlashi mumkin. Har bir element faqat ma'lum to'lqin uzunliklarida yorug'lik chiqaradi yoki yutadi, chunki astronomlar qaysi elementlar yulduzlarda ekanligini spektrlaridagi chiziqlardan aniqlay oladilar. Ko'pgina yulduzlarning spektrlarini o'rganish natijasida biz ularning ko'pligini bilamiz turli xil turlari turli elementlarni o'z ichiga olgan va turli miqdorda yulduzlar.
Faraz qilaylik, elektron ikkinchi orbitada. Fotonni yutib, u uchinchi orbitaga o'tadi. Va yutilgan foton energiyasining qiymati bu darajalarning energiyalari orasidagi farqga teng.
Ε = E 3 – E 2
Spektroskopiya yordamida galaktika tezligini aniqlash
Doppler effekti va chastota qanday o'zgarishi haqida 9-bobda allaqachon bilib oldingiz. tovush to'lqinlari tovush chiqaradigan ob'ekt siz tomon yoki sizdan uzoqlashayotganiga qarab. Xuddi shu narsa elektromagnit nurlanish bilan sodir bo'ladi. Agar yorug'lik chiqaradigan jism biz tomon harakatlansa, yorug'likning to'lqin uzunligi qisqaroq bo'ladi. Agar ob'ekt bizdan uzoqlashsa, uning yorug'ligi to'lqin uzunligi cho'zilib ketadi.
Dopller effekti kosmosdagi jismlarning Yerdagi bizga nisbatan harakatiga qarab spektrlarga ta'sir qiladi. Masalan, bizdan ma'lum tezlikda uzoqlashgan uzoq galaktikadan keladigan yorug'lik qizil bo'ladi. Bu shuni anglatadiki, galaktika spektridagi emissiya va yutilish chiziqlari uzoqroq to'lqin uzunligiga siljiydi. Agar galaktika harakat qilmasa, spektrdagi har bir chiziq odatda qayerda bo'lishini bilish va uni qizil siljish holatiga solishtirish astronomlarga galaktikaning Yerga nisbatan tezligini aniq o'lchash imkonini beradi.
Ammo qo'shni energiya darajalari orasidagi energiya farqi unchalik emas doimiy qiymat. Elektron yadrodan qanchalik uzoqda bo'lsa, shunchalik kichikroq bo'ladi. Shunga ko'ra, chiqarilgan fotonlarning energiyasi va elektromagnit tebranishlarning nurlanish chastotasi har xil bo'ladi. Uning qiymati chastota qoidasi yoki Borning ikkinchi postulati yordamida aniqlanishi mumkin.
Global isish va issiqxona gazlari
Quyosh asosan spektrning ko'rinadigan qismida joylashgan to'lqin uzunliklari oralig'ida radiatsiya chiqaradi. Ushbu to'lqin uzunliklarida radiatsiya atmosfera gazlari orqali quyida joylashgan quruqlik va okeanlarni isitish uchun tarqaladi. Keyin issiq havo bu issiqlikni uzoq infraqizil to'lqin uzunliklarida chiqaradi. Atmosferadagi karbonat angidrid infraqizil to'lqin uzunliklariga mos keladigan energiya darajasiga ega bo'lib, u infraqizil nurlanishni yutish imkonini beradi. Keyin u barcha yo'nalishlarda infraqizil to'lqin uzunliklarida ham tarqaladi.
Elektron orbitadan harakat qilganda m orbitaga n Kvant energiya chiqariladi, uning qiymati quyidagi munosabat bilan hisoblanadi:
Ε = ħ· ѵ = E m – E n, m ˃ n ;
qayerda ѵ - kvant nurlanish chastotasi,
ħ Plank doimiysi.
Bu yerdan ѵ = (E m – E n)/ ħ
Ko'rib turganimizdek, nurlanish chastotasi o'tish sodir bo'lgan orbitalardagi energiya farqiga bog'liq. Va har bir chastota atomning emissiya spektridagi chiziqqa mos keladi. Bu vodorod atomi spektrida alohida chiziqlar mavjudligini tushuntiradi.
Bu ta'sir atmosfera va erning isishiga olib keladigan katta miqdordagi infraqizil nurlanishning atmosferadan chiqib ketishini to'xtatadi. Qaytgandan ko'ra ko'proq radiatsiya kiradi. Ridberg tenglamasi, kvant holatlari, elektron tuzilma. Yorug'lik uning rangi, to'lqin uzunligi yoki chastotasi bilan belgilanadi - bu uchta sifatning har biri yorug'lik to'lqinining asosiy tuzilishini belgilaydi. Yorug'lik to'lqinlari bizning atrofimizdan sakrab o'tib, millionlab yuzalarga o'tadi, natijada cheksiz ko'p ranglar paydo bo'ladi. yorug'lik sindiruvchi panjara, prizma yoki bulut bulutidan o'tadi, yorug'lik kamalakning barcha ranglariga bo'linadi.
Vodorod atomining to'liq spektri
Vodorod atomining spektral qatori
Aytish kerakki, har qanday gazning emissiya spektrida alohida spektral chiziqlar yoki bir-biriga yaqin joylashgan chiziqlar guruhlari kuzatiladi. Va bu chiziqlar tasodifiy emas, balki ma'lum bir tartibda joylashtirilgan.
Ammo atom ichidan keladigan yorug'lik aks ettirilgan yorug'likdan juda farq qiladi. Biz yorug'lik juda oz to'lqin uzunliklarini o'z ichiga olishini aniqlaymiz. Atomlar chiqaradigan yorug'lik va uning o'ziga xos xususiyatlari bizga atomning tuzilishi haqida tasavvur beradi.
Ushbu tajribada siz qo'zg'atilgan geliy va keyin vodorod atomlari tomonidan chiqarilgan yorug'likni tekshirish uchun spektrometrdan foydalanasiz. Bir element chiqaradigan yorug'lik atrofimizdagi tabiiy yorug'likdan va boshqa element chiqaradigan yorug'likdan qanday farq qilishini ko'rasiz. Siz spektrometringizni geliy gazi bilan kalibrlaysiz va keyin vodorod emissiyasini o'lchash uchun spektrometrdan foydalanasiz. Siz vodorod atomidagi mavjud energiya darajalarini hisoblab chiqasiz va keyin bu kvantlangan energiya darajalari orasidagi qaysi o'tishlar siz o'lchagan vodorod spektrlaridagi har bir chiziqqa, har bir to'lqin uzunligiga mos kelishini aniqlaysiz.
Joylashuvning matematik tavsifi spektral chiziqlar vodorod atomi shveytsariyalik olim tomonidan yaratilgan Iogann Jeykob Balmer 1855 yilda

Iogann Jeykob Balmer
Balmer matematik edi va butun sonlarning turli kombinatsiyalari ko'pchilikning bog'lanishini tushuntirishi mumkinligiga ishondi jismoniy hodisalar. Aytishlaricha, shveytsariyalik fizik Balmerning do'sti vodorod spektrining to'rtta ko'rinadigan chizig'ining har birining to'lqin uzunligini hisoblash imkonini beruvchi formulaning paydo bo'lishida ishtirok etgan. Eduard Xagenbax-Bishoff, kim uni vodorod spektrining qizil, yashil, ko'k va binafsha chiziqlarini tasvirlashga chaqirdi. Va Balmer empirik ravishda quyidagi formulani oldi:
![]()
qayerda λ - to'lqin uzunligi;
n = 3, 4, 5, 6 (asosiy kvant soni boshlang'ich energiya darajasi);
b = 3645,6 Å (angstrom).
O'sha paytdagi Balmer formulasining fizik ma'nosini hech kim tushuntirib bera olmadi. Va faqat 1913 yilda Niels Bor formuladagi butun sonlar ruxsat etilgan orbitalar ekanligini va spektral chiziqlar elektronlarning bir orbitadan ikkinchisiga o'tish natijasi ekanligini tushundi.
Ammo vodorod atomining radiatsiya spektridagi spektral qatorlar nafaqat ko'rinadigan qismida mavjudligi ma'lum bo'ldi. Keyinchalik ular ultrabinafsha va infraqizil zonalarda topilgan.
Vodorod atomining turli diapazonlarda chiqaradigan to'lqin uzunligini 1889 yilda shved fizigi tomonidan olingan formula bo'yicha hisoblash mumkin. Yoxannes Rydberg:
![]() ,
,
qayerda R ≈ 109737,3157 sm–1 (vodorod atomi uchun Ridberg doimiysi);
λ - to'lqin uzunligi;
n - butun son;
n" spektral qatorlar soni, va n" < n .

Yoxannes Rydberg
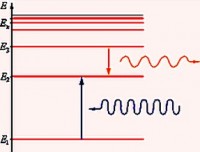
Emissiya spektrida Balmer seriyasi da qo'zg'aluvchan energiya sathidan elektronlarning o'tishi paytida kuzatiladi n ˃ 2 (n = 3, 4, 5,…) ikkinchi energiya darajasiga ( n" = 2). Yutish spektrida u elektronlarning ikkinchi darajadan yuqori energiya darajalariga o'tishida hosil bo'ladi.
Bu holda Rydberg formulasi quyidagi shaklni oladi:
![]()
Spektrning ultrabinafsha qismida topilgan qator deyiladi Lyman seriyasi. U 1906 yilda amerikalik fizik tomonidan kashf etilgan Teodor Lyman. Emissiya spektrida bu qator elektronlarning qo'zg'atilgan energiya sathidan birinchi darajaga o'tishida, yutilish spektrida esa birinchi darajadan eng yuqori darajaga o'tishda hosil bo'ladi.
Lyman seriyasi uchun Rydberg formulasi:
![]()
n" = 1;
n = 2, 3, 4…
Va infraqizil diapazonda 4 ta seriya aniqlandi: Paschen seriyasi, Qavs seriyasi, Pfund seriyasi va Humphrey seriyasi.
Paschen seriyasi 1908 yilda avstriyalik fizik tomonidan kashf etilgan Fridrix Paschen.
Paschen seriyasi uchun Rydberg formulasi:
![]()
qayerda n" = 3;
n = 4, 5, 6, …
Keyingi seriyani amerikalik fizik ochdi Frederik Samner Brakett uchun 1922. Ridberg formulasiga mos keladi n' = 4 va n = 5, 6, 7…
Pfund seriyasi amerikalik fizik tomonidan kashf etilgan Avgust Hermann Pfund 1924 yilda. Ushbu seriya uchun n' = 5 va n = 6, 7, 8, …
1953 yilda ochilgan Xamfri seriyasi uchun. Amerikalik fizik Kertis Xamfri, n' = 6 va n = 7, 8, 9, …:
Ridberg formulasiga mos qiymatlarni almashtirish n" va n , biz vodorod atomi spektrining barcha qatorlari uchun formulalarni olamiz.
Bor nazariyasi vodorod atomi spektrining chiziqli naqshini va vodorodga o'xshash atomlarning spektrlarini tushuntiradi, ular deyteriy va tritiyning og'ir izotoplarini, shuningdek, faqat bitta elektronga ega bo'lgan har qanday ionni, masalan, ionlangan geliyni o'z ichiga oladi. atom. Ammo, afsuski, uni murakkabroq atomlarga qo'llash mumkin emas.
Ishning maqsadi:
1. Vodorod atomi spektrining ko'rinadigan qismini o'rganing.
2. Ridberg konstantasini va vodorod atomining ionlanish energiyasini aniqlang.
Ishning asosiy nazariy qoidalari.
Klassik fizika qonunlari uzluksiz jarayonlarni tavsiflaydi. Musbat zaryadlangan yadro va uni o'rab turgan elektronlardan tashkil topgan atom, bu qonunlarga ko'ra, elektronlar yadro atrofida ma'lum orbitalarda doimiy ravishda harakatlansagina muvozanat holatida bo'ladi. Ammo klassik elektrodinamika nuqtai nazaridan, tezlanish bilan harakatlanadigan elektronlar elektromagnit to'lqinlarni chiqaradi, buning natijasida ular energiyani yo'qotadi va asta-sekin yadroga tushadi. Bunday sharoitda elektron aylanish chastotasi doimiy ravishda o'zgaradi va atomning emissiya spektri uzluksiz bo'lishi kerak. Elektron yadroga tushganda, atom mavjud bo'lishni to'xtatadi.
Oddiy hisob-kitoblar orqali elektronning yadroga tushishi uchun vaqt oralig'i 10 -11 s bo'lishiga ishonch hosil qilish mumkin. Tajriba shuni ko'rsatadiki, atom spektrlari alohida chiziqlar yoki chiziqlar guruhidan iborat. Bularning barchasi shuni ko'rsatadiki, mikro-ob'ektlar ishtirok etadigan jarayonlar uzluksizlik (diskretlik) bilan tavsiflanadi va klassik fizika usullari, umuman olganda, atom ichidagi harakatlarni tavsiflashda qo'llanilmaydi.
1913 yilda N. Bor vodorod atomining tuzilishini muvaffaqiyatli tushuntirib beradigan izchil nazariyani yaratishga muvaffaq bo'ldi. Bor M. Plankning (1900) osilatorlarning barqaror statsionar holatlari mavjudligi haqidagi postulatini kengaytirdi (bu hosila olish uchun zarur shartdir. to'g'ri formula qora tana nurlanishi) har qanday atom tizimiga. Bor nazariyasi ikkita postulatga asoslanadi:
1. Atom va atom tizimlari faqat ma'lum (statsionar) holatlarda uzoq vaqt turishi mumkin, ularda sodir bo'lgan zaryadlangan zarrachalarning harakatlariga qaramay, ular energiya chiqarmaydi yoki yutmaydi. Bu holatlarda atom tizimlari diskret qator hosil qiluvchi energiyaga ega: E 1, E 2, …, E n. Bu holatlar o'zlarining barqarorligi bilan ajralib turadi: elektromagnit nurlanishning yutilishi yoki tarqalishi natijasida yoki to'qnashuv natijasida energiyaning har qanday o'zgarishi faqat bir holatdan ikkinchi holatga to'liq o'tish (sakrash) bilan sodir bo'lishi mumkin.
2. Bir holatdan ikkinchi holatga o'tish jarayonida atomlar faqat qat'iy belgilangan chastotali nurlanishni chiqaradi (yoki yutadi). Energiyali E m holatdan E n holatga o‘tishda chiqariladigan (yoki yutilgan) nurlanish monoxromatik bo‘lib, uning chastotasi shart asosida aniqlanadi.
Ikkala postulat ham klassik elektrodinamika talablariga ziddir. Birinchi postulat atomlar nurlanmaydi, lekin uni hosil qiluvchi elektronlar tezlashtirilgan harakatni (yopiq orbitalarda aylanish) amalga oshirsa ham, deyiladi. Ikkinchi postulatga ko'ra, chiqarilgan chastotalar elektronlarning davriy harakatlari chastotalari bilan hech qanday aloqasi yo'q.
Moddaning emissiya spektri uning muhim xarakteristikasi bo'lib, uning tarkibini, tuzilishining ba'zi xususiyatlarini, atomlar va molekulalarning xususiyatlarini aniqlashga imkon beradi.
Gaz atomlari deb ataladigan individual spektral chiziqlar guruhlaridan iborat chiziqli spektrlarni chiqaradi spektral qator. Eng oddiy spektr vodorod atomining spektridir. 1885 yilda Balmer spektrning ko'rinadigan qismida joylashgan to'rtta chiziqning to'lqin uzunliklarini empirik formula bilan juda aniq ifodalash mumkinligini ko'rsatdi.
bu yerda n = 3, 4, 5, 6,…, V empirik doimiydir.
Ushbu formula bilan ifodalangan muntazamlik, ayniqsa, agar u hozirgi vaqtda odatda qo'llaniladigan shaklda taqdim etilsa, aniq bo'ladi:
![]() (3)
(3)
Miqdor ba'zan bilan belgilanadi va deyiladi spektroskopik to'lqinlar soni. Konstanta deyiladi Ridberg doimiysi. Shunday qilib, biz nihoyat erishamiz
![]() . (4)
. (4)
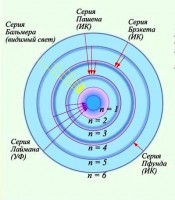
Chiziq raqami n ortishi bilan chiziq intensivligi kamayadi. Qo'shni chiziqlarning to'lqin raqamlari orasidagi farq ham kamayadi. n = ∞ uchun doimiy qiymat = olinadi. Agar (4) bilan aniqlangan spektral chiziqlarning joylashishini sxematik tarzda ifodalasak va ularning intensivligini chiziq uzunligi bo‘yicha shartli tasvirlasak, 1-rasmda ko‘rsatilgan rasmni olamiz.
Ularning ketma-ketligi va intensivlik taqsimotida 1-rasmda ko‘rsatilgan qonuniyatni ochib beruvchi spektral chiziqlar to‘plami deyiladi. spektral qator. Chiziqlar n → ∞ sifatida qalinlashadigan cheklovchi to'lqin uzunligi deyiladi qator chegarasi. Formula (4) bilan tavsiflangan qator Balmer seriyasi deb ataladi.
Balmer seriyasi bilan bir qatorda vodorod atomi spektrida butunlay o'xshash formulalar bilan ifodalangan bir qator boshqa qatorlar topildi.
Ultraviyole mintaqada Lyman seriyasi topildi:
![]() (5)
(5)
Spektrning infraqizil mintaqasida topilgan
Paschen seriyasi
![]() (6)
(6)
Braketlar seriyasi
![]() (7)
(7)
Pfund seriyasi
![]() (8)
(8)
Humphrey seriyasi
![]() (9)
(9)
Shunday qilib, atom vodorodining barcha ma'lum seriyalari deb ataladigan narsa bilan ifodalanishi mumkin Umumiy Balmer formulasi bo'yicha:
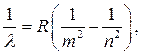 (10)
(10)
Bu erda har bir seriyadagi m doimiy qiymatga ega va n - m+1 dan boshlanadigan butun sonlar qatori.
Qidirmoq jismoniy hissiyot formulalar (10) yaratilishiga olib keldi kvant nazariyasi vodorod atomi. Buning uchun Shredinger tenglamasi quyidagicha yoziladi:
![]() (11)
(11)
Bu yerda r(r) - atomdagi elektronning holatini tavsiflovchi to'lqin funksiyasi, E - elektronning umumiy energiyasi.
Ushbu tenglamaning yechimi mumkin bo'lgan qiymatlar spektridir to'liq energiya vodorod atomi:
![]() (12)
(12)
(1) ga ko'ra, davlatlar orasidagi o'tish chastotasi bilan belgilanadi
Boshqa tomondan, taniqli formulaga ko'ra
(12), (13) va (14) ni birlashtirib, biz quyidagilarni olamiz:
![]() (15)
(15)
umumlashtirilgan Balmer formulasiga to'g'ri keladi.
Ridberg doimiysining (16) nazariy qiymati hali ham spektroskopik o'lchovlardan olingan eksperimental qiymatdan sezilarli darajada farq qiladi. Buning sababi shundaki, formula (16) olinganda ikkita faraz qilinadi: a) atom yadrosining massasi elektron massasiga nisbatan cheksiz katta (shuning uchun belgilanishida "∞" belgisi). a doimiy) va b) yadro harakatsiz. Haqiqatda, masalan, vodorod atomi uchun yadroning massasi elektron massasidan atigi 1836,1 marta ko'pdir. Ushbu holatni hisobga olish quyidagi formulaga olib keladi:
bu erda M - atom yadrosining massasi. Ushbu yaqinlashishda Ridberg doimiysi yadro massasiga bog'liq va shuning uchun turli xil vodorodga o'xshash atomlar uchun uning qiymatlari bir-biridan farq qiladi (2-rasm).
2-rasm 3-rasm
Atom haqidagi barcha ma'lumotlar to'plamini olish uchun energiya darajasi diagrammasidan foydalanish qulay (3-rasm). Gorizontal to'g'ri chiziqlar vodorod atomining turli energiya holatlariga mos keladi. Davlat raqami oshgani sayin, qo'shni darajalar orasidagi masofa kamayadi va chegarada yo'qoladi. Qo‘shilish nuqtasi tepasida kvantlanmagan musbat energiyalarning uzluksiz hududi joylashgan. Nol energiya darajasi n = ∞ bo'lgan darajaning energiyasi sifatida qabul qilinadi. Ushbu qiymatdan pastroq energiya darajalari diskretdir. Ular atomning umumiy energiyasining salbiy qiymatlariga mos keladi. Bu holat shuni ko'rsatadiki, bunday holatlardagi elektronning energiyasi, agar u atomdan ajralib, cheksiz holatda bo'lsa, uning energiyasidan kamroq bo'ladi. uzoq masofa, ya'ni elektron bog'langan holatda bo'ladi.
Bog'lanmagan elektronlarning mavjudligi uzluksiz energiya spektrining holatlari, shuningdek, diskret energiya spektrining bunday holatlari va holatlari o'rtasida kvant o'tishlarini amalga oshiradi. Bu shaklda namoyon bo'ladi doimiy spektr emissiya yoki yutilish ustiga qo'yilgan chiziqli spektr atom. Shuning uchun spektr ketma-ketlik chegarasida to'xtamaydi, balki undan tashqarida qisqaroq to'lqin uzunliklari tomon davom etadi va u erda uzluksiz bo'ladi. Uzluksiz spektrdagi holatlardan (atom ionlangan holatlar) diskret spektrdagi holatlarga o'tish elektron va elektronning rekombinatsiyasi bilan birga keladi. ijobiy ion. Olingan nurlanish deyiladi rekombinatsiya.
Atomning normal holatdan diskret spektrning yuqori energiya darajasiga o'tishi atomning qo'zg'alishi. Atomning diskret spektr sathlaridan biridan uzluksiz spektr mintaqasiga o'tishi atomni bog'lanmagan sistemaga aylantiradi. Bu jarayon atomning ionlanishi. Uzoq to'lqinlar tomonidan uzluksiz spektrning boshlanishining to'lqin raqamiga mos keladigan energiya (ketma-ket chegaraning to'lqin raqami) ga teng bo'lishi kerak. ionlanish energiyasi, ya'ni elektronni atomdan ajratish va uni cheksiz masofaga olib tashlash uchun zarur bo'lgan energiya. Shunday qilib, Liman seriyasining chegarasining to'lqin raqami yerdagi vodorod atomining ionlanish energiyasini, eng barqaror holatni beradi.
Ushbu maqolada biz Balmer seriyasining dastlabki to'rtta qatorini o'rganamiz, ular quyidagi belgilarga ega:
Qizil chiziq (n = 3),
Moviy - ko'k chiziq (n = 4),
Moviy chiziq (n=5),
Binafsha chiziq (n = 6).






