Ese për fizikën Dukuria e radioaktivitetit. Rëndësia e tij në shkencë, teknologji, mjekësi. Enciklopedia e madhe e naftës dhe gazit
Dërgoni punën tuaj të mirë në bazën e njohurive është e thjeshtë. Përdorni formularin e mëposhtëm
Studentët, studentët e diplomuar, shkencëtarët e rinj që përdorin bazën e njohurive në studimet dhe punën e tyre do t'ju jenë shumë mirënjohës.
Postuar ne http://www.allbest.ru/
Institucion arsimor autonom shtetëror
e mesme Arsimi profesional -
Kolegji Shtetëror i Shkencave Humane dhe Teknologjisë Novokuibyshev
abstrakte
sipas disiplinës:"kimia"
Tema: "Përdorimi i izotopeve radioaktive në teknologji"
Grazhdankina Daria Igorevna
Studentët e vitit të parë të grupit 16
specialiteti 230115
2013
1. Çfarë janë izotopet dhe si të merren ato
Bibliografi
izotopi radioaktiv zbulimi i të metave të atomit
1. Çfarë janë izotopet?
Izotopet janë varietete të çdo elementi kimik në D.I. Mendelejevi, me pesha të ndryshme atomike. Izotopet e ndryshme të çdo elementi kimik kanë të njëjtin numër protonesh në bërthamë dhe të njëjtin numër elektronesh në guaskat e atomit, kanë të njëjtin numër atomik dhe zënë vende të caktuara në tabelën D.I. Mendelejevi. Dallimi në peshën atomike midis izotopeve shpjegohet me faktin se bërthamat e atomeve të tyre përmbajnë një numër të ndryshëm neutronesh.
Izotopet radioaktive - izotopet e çdo elementi të sistemit periodik të D. I. Mendeleev, atomet e të cilit kanë bërthama të paqëndrueshme dhe kalojnë në një gjendje të qëndrueshme nga zbërthimi radioaktiv i shoqëruar nga rrezatimi. Për elementët me një numër atomik më të madh se 82, të gjithë izotopet janë radioaktive dhe kalbet nga zbërthimi alfa ose beta. Këto janë të ashtuquajturat izotope radioaktive natyrore, të cilat zakonisht gjenden në natyrë. Atomet e formuara gjatë zbërthimit të këtyre elementeve, nëse numri atomik i tyre është më i madh se 82, nga ana tjetër i nënshtrohen zbërthimit radioaktiv, produktet e të cilit mund të jenë edhe radioaktive. Rezulton, si të thuash, një zinxhir sekuencial, ose e ashtuquajtura familje e izotopeve radioaktive. Janë të njohura tre familje radioaktive natyrale, të emërtuara sipas elementit të parë të serisë si familje të uraniumit, toriumit dhe aktinouraniumit (ose aktiniumit). Familja e uraniumit përfshin radiumin dhe radonin. Elementi i fundit i secilës seri shndërrohet si rezultat i kalbjes në një nga izotopet e qëndrueshme të plumbit me numër serik 82. Përveç këtyre familjeve, njihen izotopet radioaktive individuale natyrore të elementeve me numër serik më të vogël se 82. Këto janë kaliumi. -40 dhe disa të tjerë. Nga këto, kalium-40 është i rëndësishëm, pasi gjendet në çdo organizëm të gjallë.
Të gjithë izotopet radioaktive elementet kimike mund të merret artificialisht.
Ka disa mënyra për t'i marrë ato. Izotopet radioaktive të elementeve si stronciumi, jodi, bromi e të tjerë, që zënë vendet e mesme në sistemin periodik, janë produkte të ndarjes së bërthamës së uraniumit. Nga një përzierje e produkteve të tilla të marra në një reaktor bërthamor, ato izolohen duke përdorur metoda radiokimike dhe metoda të tjera. Izotopet radioaktive të pothuajse të gjithë elementëve mund të prodhohen në një përshpejtues grimcash duke bombarduar atome të caktuara të qëndrueshme me protone ose deutone. Një metodë e zakonshme është marrja e izotopeve radioaktive nga izotopet e qëndrueshme të të njëjtit element duke i rrezatuar me neutrone në një reaktor bërthamor. Metoda bazohet në të ashtuquajturin reaksion të kapjes rrezatuese. Nëse një substancë rrezatohet me neutrone, këto të fundit, duke mos pasur ngarkesë, mund t'i afrohen lirisht bërthamës së një atomi dhe, si të thuash, "ngjiten" me të, duke formuar një bërthamë të re të të njëjtit element, por me një neutron shtesë. Në këtë rast, një sasi e caktuar energjie lëshohet në formë rrezatimi gama, kjo është arsyeja pse procesi quhet kapje rrezatuese. Bërthamat me një tepricë të neutroneve janë të paqëndrueshme, kështu që izotopi që rezulton është radioaktiv. Me përjashtime të rralla, izotopet radioaktive të çdo elementi mund të merren në këtë mënyrë.
Prishja e një izotopi mund të formojë një izotop, gjithashtu radioaktiv. Për shembull, stroncium-90 shndërrohet në ittrium-90, barium-140 në lantanum-140, etj.
Elementet transuranium të panjohur në natyrë me numër atomik më të madh se 92 (neptunium, plutonium, americium, curium etj.) janë marrë artificialisht, të gjithë izotopet e të cilëve janë radioaktive. Njëri prej tyre krijon një familje tjetër radioaktive, familjen neptunium.
Gjatë funksionimit të reaktorëve dhe përshpejtuesve, në materialet dhe pjesët e këtyre instalimeve dhe pajisjeve përreth formohen izotope radioaktive. Ky “aktivitet i nxitur”, i cili vazhdon pak a shumë gjatë pas ndërprerjes së funksionimit të instalimeve, përfaqëson një burim të padëshiruar rrezatimi. Aktiviteti i induktuar ndodh gjithashtu në një organizëm të gjallë të ekspozuar ndaj neutroneve, për shembull, gjatë një aksidenti ose një shpërthimi atomik.
Aktiviteti i izotopeve radioaktive matet në njësi Curie ose derivatet e tij - millicurie dhe microcurie.
Për kimike dhe fizike vetitë kimike izotopet radioaktive praktikisht nuk ndryshojnë nga elementët natyrorë; përzierja e tyre me asnjë substancë nuk e ndryshon sjelljen e saj në një organizëm të gjallë.
Është e mundur të zëvendësohen izotopet e qëndrueshme me atome të tilla të etiketuara në të ndryshme komponimet kimike. Vetitë e këtyre të fundit nuk do të ndryshojnë nga kjo, dhe nëse futen në trup, ato do të sillen si substanca të zakonshme, të paetiketuara. Megjithatë, për shkak të rrezatimit, është e lehtë të zbulohet prania e tyre në gjak, inde, qeliza etj. Izotopet radioaktive në këto substanca shërbejnë kështu si tregues, ose tregues të shpërndarjes dhe fatit të substancave të futura në trup. Prandaj quhen “gjurmues radioaktiv”. Shumë komponime inorganike dhe organike të etiketuara me izotopë të ndryshëm radioaktivë janë sintetizuar për diagnostikimin e radioizotopeve dhe studime të ndryshme eksperimentale.
2. Zbatimi i izotopeve radioaktive në inxhinieri
Një nga studimet më të spikatura të kryera me ndihmën e "atomeve të etiketuara" ishte studimi i metabolizmit në organizma. Është vërtetuar se në një kohë relativisht të shkurtër trupi i nënshtrohet një rinovimi pothuajse të plotë. Atomet përbërëse të tij zëvendësohen me të reja. Vetëm hekuri, siç kanë treguar eksperimentet në studimin izotopik të gjakut, është një përjashtim nga ky rregull. Hekuri është pjesë e hemoglobinës në qelizat e kuqe të gjakut. Kur atomet e hekurit radioaktiv u futën në ushqim, u zbulua se oksigjeni i lirë i çliruar gjatë fotosintezës fillimisht ishte pjesë e ujit dhe jo dioksidi i karbonit. Fusha e aplikimit të izotopeve radioaktive në industri është e gjerë. Një shembull i kësaj është metoda e mëposhtme për monitorimin e konsumit të unazës së pistonit në motorë djegia e brendshme. Duke rrezatuar unazën e pistonit me neutrone, ato shkaktojnë reaksione bërthamore në të dhe e bëjnë atë radioaktive. Kur motori është në punë, grimcat e materialit të unazës hyjnë në vajin lubrifikues. Duke ekzaminuar nivelin e radioaktivitetit të vajit pas një kohe të caktuar të funksionimit të motorit, përcaktohet veshja e unazës. Izotopet radioaktive bëjnë të mundur gjykimin e difuzionit të metaleve, proceseve në furrat e shpërthimit etj.
Rrezatimi i fuqishëm gama i preparateve radioaktive përdoret për të studiuar strukturën e brendshme të derdhjeve metalike për të zbuluar defektet në to.
Izotopet radioaktive që lëshojnë rreze gama mund të përdoren në vend të njësive të mëdha me rreze X për transndriçimin e produkteve, pasi vetitë e rrezeve gama janë të ngjashme me ato të rrezet x. Një burim i rrezeve gama vendoset në njërën anë të produktit që do të testohet dhe një film fotografik në anën tjetër. Kjo metodë e testimit quhet zbulimi i gabimeve gama. Në këtë mënyrë, aktualisht kontrollohen derdhjet e zeza dhe me ngjyra, produktet e gatshme (produktet e çelikut deri në 300 mm të trasha) dhe cilësia e saldimeve. Me ndihmën e izotopeve radioaktive, është e lehtë të matet trashësia e një shiriti metalik ose të fletëve metalike të mbështjellë në lëvizje dhe pa kontakt dhe automatikisht të ruhet trashësia konstante. Një burim i grimcave beta vendoset nën rripin lëvizës që del nga poshtë rrotullave të makinës. Një ndryshim në trashësinë e shiritit çon, pra, në një ndryshim në rrymën në njehsor. Kjo rrymë përforcohet dhe drejtohet ose në pajisje matëse, ose në një makinë automatike që bashkon menjëherë ose, anasjelltas, i shtyn rrotullat larg. Pajisjet e këtij lloji përdoren gjithashtu në industrinë e letrës, gomës dhe lëkurës. Krijohen burime radioizotopike energji elektrike. Ata përdorin nxehtësinë e krijuar në mostër që thith rrezatimin. Termoçiftet e shndërrojnë këtë nxehtësi në elektricitet. Një burim që peshon disa kilogramë siguron një fuqi prej disa dhjetëra vat për 10 vjet funksionim të pandërprerë. Burime të tilla përdoren për të fuqizuar fenerët automatikë dhe stacionet automatike të motit që funksionojnë në zona të vështira për t'u arritur. Burime më të fuqishme u instaluan në roverët hënorë sovjetikë të nisur në Hënë. Ata punuan me besueshmëri në temperatura nga -140 në +120.
Një nga studimet më të spikatura të kryera me ndihmën e "atomeve të etiketuara" ishte studimi i metabolizmit në organizma. Është vërtetuar se në një kohë relativisht të shkurtër trupi i nënshtrohet një rinovimi pothuajse të plotë. Atomet përbërëse të tij zëvendësohen me të reja. Vetëm hekuri, siç kanë treguar eksperimentet në studimin izotopik të gjakut, është një përjashtim nga ky rregull. Hekuri është pjesë e hemoglobinës në qelizat e kuqe të gjakut. Kur atomet e hekurit radioaktiv u futën në ushqim, u zbulua se oksigjeni i lirë i çliruar gjatë fotosintezës fillimisht ishte pjesë e ujit dhe jo dioksidi i karbonit. Izotopet radioaktive përdoren në mjekësi si për qëllime diagnostikuese ashtu edhe për qëllime terapeutike. Natriumi radioaktiv, i futur në sasi të vogla në gjak, përdoret për të studiuar qarkullimin e gjakut, jodi depozitohet intensivisht në gjëndrën tiroide, veçanërisht në sëmundjen e Graves. Duke monitoruar depozitimin e jodit radioaktiv me një numërues, diagnoza mund të bëhet shpejt. Doza të mëdha të jodit radioaktiv shkaktojnë shkatërrim të pjesshëm të indeve në zhvillim jonormal, dhe për këtë arsye jodi radioaktiv përdoret për trajtimin e sëmundjes së Graves. Rrezatimi intensiv gama i kobaltit përdoret në trajtimin e kancerit (pistoleta kobalt).
Lista e literaturës së përdorur
1. Gaisinsky M.N., Kimia bërthamore dhe aplikimet e saj, përkth. nga frëngjishtja, Moskë, 1961
2. Eksperimentale fizika bërthamore, ed. E. Segre, përkth. nga anglishtja, vëll.3, M., 1961; Mjetet e rrjetit INTERNET
Organizuar në Allbest.ru
Dokumente të ngjashme
Thelbi i fenomenit të radioaktivitetit, historia e zbulimit dhe studimit të tij, njohuritë moderne, rëndësia dhe zbatimi i tyre në fusha të ndryshme. Llojet e rrezatimit radioaktiv, karakteristikat e tyre dhe tipare dalluese. Rendi dhe fazat e kalbjes alfa, beta, gama.
punim afatshkurtër, shtuar 05/10/2009
Radioaktiviteti natyror është për shkak të izotopeve radioaktive natyrale të pranishme në të gjitha shtresat e tokës. Paraardhësit e izotopeve radioaktive që bëjnë pjesë në familjet radioaktive janë radiumi dhe toriumi.
punim afatshkurtër, shtuar 25.11.2008
Ligji i zbërthimit radioaktiv. Përcaktimi i joneve të elementeve kimike. Metoda e titrimit radiometrik, hollimi izotopik, analiza e aktivizimit, përcaktimi i përmbajtjes së elementeve kimike nga emetimi i izotopeve të tyre natyrore radioaktive.
prezantim, shtuar 05/07/2016
Përcaktimi i përmbajtjes relative të izotopeve të plutoniumit duke analizuar spektrat, raportin sasior të përmbajtjes së izotopeve sipas linjave të identifikuara. Vlerësimi i gjetjes së uljeve dhe seksioneve lineare të spektrit. Llogaritja e përmbajtjes së gabimit.
punim afatshkurtër, shtuar 23.08.2016
Seritë radioaktive natyrore dhe artificiale. Llojet e zbërthimit radioaktiv. Seria kryesore radioaktive e vërejtur në natyrë. Karakterizimi i serisë së toriumit, neptunit, radiumit, aktiniumit. Shndërrimet radioaktive të bërthamave. vargje të njëpasnjëshme të nuklideve.
prezantim, shtuar 30.05.2015
Karakterizimi i kimikateve dhe vetitë fizike hidrogjeni. Dallimet në masën e atomeve në izotopet e hidrogjenit. Konfigurimi i një shtrese të vetme elektronike të një atomi hidrogjeni të pangacmuar neutral. Historia e zbulimit, gjetja në natyrë, metodat e marrjes.
prezantim, shtuar më 14.01.2011
Karakterizimi i vetive kimike të aktinideve. Përcaktimi sasior i elementeve të transplutoniumit. Ndarja me precipitim me reagentë inorganikë dhe organikë. Metodat për izolimin dhe ndarjen e elementeve të transplutoniumit. Marrja e uraniumit metalik.
abstrakt, shtuar 03.10.2010
Parimet e përgjithshme për klasifikimin e substancave komplekse dhe të thjeshta inorganike. Madhësitë e atomeve dhe lidhja e tyre me pozicionin në sistemin periodik të elementeve. Koncepti i shpërbërjes elektrike dhe zgjidhjeve të elektroliteve. Sensorët e lidhjeve hidrogjenore dhe të membranës.
test, shtuar 02/01/2011
Metodat e jonizimit dhe shintilimit të rrezatimit radioaktiv. Përcaktimi i joneve të elementeve kimike në tretësirë duke përdorur reagjentë radioaktivë. Koha optimale e regjistrimit të rrezatimeve. Metoda e analizës së titrimit radiometrik dhe aktivizimit.
punim afatshkurtër, shtuar 05/07/2016
Vetitë fizike dhe kimike të acidit acetik. Karakterizimi i procesit të oksidimit të aldehidit. Metoda për prodhimin e acetaldehidit dhe etanalit. Parimet për llogaritjen e sasisë së nënprodukteve të formuara në procesin e përftimit të acidit acetik. Thelbi i metodës së Kolbes.
Puna e kursit
Prezantimi me temë: "Radioaktiviteti.
Përdorimi i izotopeve radioaktive në teknologji"
Prezantimi
1. Llojet e rrezatimit radioaktiv
2. Llojet e tjera të radioaktivitetit
3. Kalbja alfa
4.Zbërthimi beta
5. Kalbja e gamës
6. Ligji i zbërthimit radioaktiv
7. Rreshtat radioaktive
8. Efekti i rrezatimit radioaktiv te njerëzit
9. Zbatimi i izotopeve radioaktive
Lista e literaturës së përdorur
Prezantimi
Radioaktiviteti- shndërrimi i bërthamave atomike në bërthama të tjera, i shoqëruar nga emetimi i grimcave të ndryshme dhe rrezatimi elektromagnetik. Prandaj emri i fenomenit: në latinisht radio - rrezatoj, activus - efektiv. Kjo fjalë u prezantua nga Marie Curie. Gjatë kalbjes së një bërthame të paqëndrueshme - një radionuklid, ata fluturojnë me të shpejtësi e lartë një ose më shumë grimca me energji të lartë. Rrjedha e këtyre grimcave quhet rrezatim radioaktiv ose thjesht rrezatim.
rrezet X. Zbulimi i radioaktivitetit lidhej drejtpërdrejt me zbulimin e Roentgenit. Për më tepër, për disa kohë mendohej se ky është i njëjti lloj rrezatimi. Fundi i shekullit të 19-të në përgjithësi, ai ishte i pasur në zbulimin e llojeve të ndryshme të "rrezatimeve" të panjohura më parë. Në vitet 1880, fizikani anglez Joseph John Thomson filloi të studionte bartësit elementar. ngarkesë negative, në 1891 fizikani irlandez George Johnston Stoney (1826–1911) i quajti këto grimca elektrone. Më në fund, në dhjetor, Wilhelm Konrad Roentgen njoftoi zbulimin e një lloji të ri rrezesh, të cilat ai i quajti rreze X. Deri më tani, në shumicën e vendeve quhen kështu, por në Gjermani dhe Rusi pranohet propozimi i biologut gjerman Rudolf Albert von Kölliker (1817–1905) për të thirrur rrezet X. Këto rreze prodhohen kur elektronet (rrezet katodike) që udhëtojnë me shpejtësi në vakum përplasen me një pengesë. Dihej se kur rrezet katodike godasin xhamin, ai lëshon dritë e dukshme- lumineshencë e gjelbër. Roentgen zbuloi se në të njëjtën kohë disa rreze të tjera të padukshme burojnë nga pika e gjelbër në xhami. Kjo ndodhi rastësisht: në një dhomë të errët, një ekran aty pranë shkëlqente, i mbuluar me barium tetracianoplatinate Ba (më parë quhej cianid barium platinum). Kjo substancë jep një luminescencë të verdhë-jeshile të ndritshme nën veprimin e rrezeve ultravjollcë, si dhe rrezeve katodike. Por rrezet katodike nuk goditën ekranin dhe për më tepër, kur pajisja ishte e mbuluar me letër të zezë, ekrani vazhdonte të shkëlqente. Roentgen shpejt zbuloi se rrezatimi kalon nëpër shumë substanca të errëta, duke shkaktuar një nxirje të një pllake fotografike të mbështjellë me letër të zezë ose madje të vendosur në një kuti metalike. Rrezet kalonin nëpër një libër shumë të trashë, përmes një dërrase bredhi 3 cm të trashë, përmes një pllake alumini 1,5 cm të trashë ... Rrezet X kuptuan mundësitë e zbulimit të tij: “Nëse e mban dorën mes tubit të shkarkimit dhe ekranit. ", shkroi ai, "atëherë hijet e errëta janë kocka të dukshme në sfondin e skicave më të lehta të dorës. Ky ishte ekzaminimi i parë me rreze X në histori.
Zbulimi i Roentgen u përhap menjëherë në të gjithë botën dhe mahniti jo vetëm specialistët. Në prag të vitit 1896, një fotografi e një dore u ekspozua në një librari në një qytet gjerman. Mbi të ishin të dukshme kockat e një personi të gjallë, dhe në një nga gishtat - një unazë martese. Ishte një fotografi me rreze x e dorës së gruas së Roentgen. Mesazhi i parë i Roentgenit Rreth një lloji të ri rrezesh” u botua në "Raportet e Shoqërisë Fiziko-Mjekësore të Würzburgut" më 28 dhjetor, u përkthye dhe u botua menjëherë në vende të ndryshme, botuar në Londër, revista më e famshme shkencore "Nature" ("Nature") botoi një artikull nga Roentgen më 23 janar 1896.
Rrezet e reja filluan të hetohen në të gjithë botën, në vetëm një vit u botuan mbi një mijë punime mbi këtë temë. Të thjeshta në dizajn, makinat me rreze X u shfaqën edhe në spitale: aplikimi mjekësor i rrezeve të reja ishte i dukshëm.
Tani rrezet X përdoren gjerësisht (dhe jo vetëm për qëllime mjekësore) në të gjithë botën.
Rrezet e Bekerelit. Zbulimi i Roentgen shpejt çoi në një zbulim po aq të jashtëzakonshëm. Është bërë në vitin 1896 nga fizikani francez Antoine Henri Becquerel. Ai ishte më 20 janar 1896 në një takim të Akademisë, në të cilën fizikani dhe filozofi Henri Poincaré foli për zbulimin e Roentgen dhe demonstroi rrezet x të një dore njerëzore të bëra tashmë në Francë. Poincaré nuk e kufizoi veten në një histori për rrezet e reja. Ai sugjeroi që këto rreze janë të lidhura me luminescencën dhe, ndoshta, gjithmonë ndodhin njëkohësisht me këtë lloj lumineshence, kështu që rrezet katodike ndoshta mund të shpërndahen. Shkëlqimi i substancave nën veprimin e ultravjollcës - fluoreshencë ose fosforeshencë (në shekullin e 19-të nuk kishte asnjë dallim të rreptë midis këtyre koncepteve) ishte i njohur për Becquerel: babai i tij Alexander Edmond Becquerel (1820-1891) dhe gjyshi Antoine Cesar Becquerel (1788 - 1878) ishin të angazhuar në të - të dy fizikantë; djali i Antoine Henri Becquerel, Jacques, u bë fizikant, i cili "me trashëgimi" pranoi katedrën e fizikës në Muzeun e Parisit histori natyrore, Becquerelis e drejtoi këtë departament për 110 vjet, nga 1838 deri në 1948.
Becquerel vendosi të kontrollojë nëse rrezet X ishin të lidhura me fluoreshencën. Disa kripëra të uraniumit, për shembull, nitrat uranil UO 2 (NO 3) 2, kanë fluoreshencë të verdhë-jeshile të ndezur. Substanca të tilla ishin në laboratorin e Bekerelit, ku ai punonte. Me preparate uraniumi punonte edhe babai i tij, i cili tregoi se pas ndërprerjes së dritës së diellit, shkëlqimi i tyre zhduket shumë shpejt – në më pak se një të qindtën e sekondës. Megjithatë, askush nuk ka kontrolluar nëse kjo shkëlqim shoqërohet me emetim të disa rrezeve të tjera të afta të kalojnë nëpër materiale të errëta, siç ishte rasti me Roentgen. Pikërisht këtë, pas raportit të Poincaré, Becquerel vendosi ta testonte. Më 24 shkurt 1896, në mbledhjen javore të Akademisë, ai tha se duke marrë një pjatë fotografike të mbështjellë me dy shtresa letre të trashë të zezë, duke vendosur kristale të sulfatit të dyfishtë të uranil kaliumit K 2 UO 2 (SO 4) 2 2H2O dhe duke i ekspozuar të gjitha këto për disa orë në rrezet e diellit, pastaj pas zhvillimit të pllakës fotografike në të mund të shihni një kontur disi të paqartë të kristaleve. Nëse një monedhë ose një figurë e prerë nga kallaji vendoset midis pllakës dhe kristaleve, atëherë pas zhvillimit, një imazh i qartë i këtyre objekteve shfaqet në pjatë.
E gjithë kjo mund të tregojë një lidhje midis fluoreshencës dhe rrezeve X. Rrezet X të zbuluara së fundmi mund të merren shumë më lehtë - pa rreze katodike dhe tubin e nevojshëm vakum dhe tension të lartë për këtë, por ishte e nevojshme të kontrollohej nëse rezulton se kripa e uraniumit, e ngrohur në diell, lëshon një lloj gazi që depërton nën letrën e zezë dhe vepron në emulsionin fotografik Për të eliminuar këtë mundësi, Bekereli vendosi një fletë xhami midis kripës së uraniumit dhe pllakës fotografike - ajo ende ishte e ndezur. "Nga këtu," përfundoi ai mesazh i shkurter Bekereli, - mund të konkludojmë se kripa e ndritur lëshon rreze që depërtojnë përmes letrës së zezë që nuk është transparente ndaj dritës dhe rikthen kripërat e argjendit në pllakën fotografike. Sikur Poincaré të kishte të drejtë dhe rrezet X të Roentgenit mund të merren në një mënyrë krejtësisht të ndryshme.
Bekereli filloi të ndërtojë shumë eksperimente për të kuptuar më mirë kushtet në të cilat shfaqen rrezet që ndriçojnë një pllakë fotografike dhe për të hetuar vetitë e këtyre rrezeve. Ai vendosi substanca të ndryshme midis kristaleve dhe pllakës fotografike - letër, xhami, pllaka alumini, bakri, plumbi me trashësi të ndryshme. Rezultatet ishin të njëjta me ato të marra nga Roentgen, të cilat gjithashtu mund të shërbejnë si argument në favor të ngjashmërisë së të dy rrezatimeve. Përveç rrezeve të drejtpërdrejta të diellit, Bekereli ndriçoi kripën e uraniumit me dritën e reflektuar nga një pasqyrë ose e thyer nga një prizëm. Ai zbuloi se rezultatet e të gjitha eksperimenteve të mëparshme nuk kishin asnjë lidhje me diellin; ajo që kishte rëndësi ishte se sa kohë ishte kripa e uraniumit pranë pllakës fotografike. Të nesërmen, Becquerel e raportoi këtë në një takim të Akademisë, por, siç doli më vonë, ai bëri përfundimin e gabuar: ai vendosi që kripa e uraniumit, të paktën një herë "e ngarkuar" në dritë, atëherë ishte vetë e aftë të lëshonte rrezet depërtuese të padukshme për një kohë të gjatë.
Bekereli deri në fund të vitit botoi nëntë artikuj mbi këtë temë, në njërin prej tyre shkruante: “Kripëra të ndryshme uraniumi u vendosën në një kuti plumbi me mure të trasha... Të mbrojtura nga veprimi i çdo rrezatimi të njohur, këto substanca vazhdoi të lëshonte rreze që kalonin përmes xhamit dhe letrës së zezë..., në tetë muaj."
Këto rreze vinin nga çdo përbërje e uraniumit, madje edhe nga ato që nuk shkëlqejnë në diell. Akoma më i fortë (rreth 3.5 herë) ishte rrezatimi i uraniumit metalik. U bë e qartë se rrezatimi, megjithëse i ngjashëm në disa manifestime me rrezet X, ka një fuqi më të madhe depërtuese dhe është disi i lidhur me uraniumin, kështu që Bekereli filloi ta quante atë "rrezet e uraniumit".
Bekereli zbuloi gjithashtu se "rrezet e uraniumit" jonizojnë ajrin, duke e bërë atë një përcjellës të elektricitetit. Pothuajse njëkohësisht, në nëntor 1896, fizikantët anglezë J. J. Thomson dhe Ernest Rutherford (zbuluan jonizimin e ajrit nën veprimin e rrezeve X. Për të matur intensitetin e rrezatimit, Becquerel përdori një elektroskop në të cilin gjethet më të lehta të arta, të varura nga skajet dhe të ngarkuara elektrostatikisht, sprapsin dhe skajet e tyre të lira ndryshojnë. Nëse ajri përçon rrymë, ngarkesa kullon nga gjethet dhe ato bien - sa më shpejt, aq më e lartë është përçueshmëria elektrike e ajrit dhe, rrjedhimisht, aq më i madh është intensiteti i rrezatimit.
Mbeti pyetja se si substanca lëshon rrezatim të vazhdueshëm dhe të pandërprerë për shumë muaj pa furnizim me energji nga një burim i jashtëm. Vetë Becquerel shkroi se nuk ishte në gjendje të kuptonte se ku e merr uraniumi energjinë që lëshon vazhdimisht. Një sërë hipotezash, ndonjëherë mjaft fantastike, janë paraqitur me këtë rast. Për shembull, kimisti dhe fizikani anglez William Ramsay shkroi: “... fizikanët pyesnin veten se nga mund të vinte furnizimi i pashtershëm i energjisë në kripërat e uraniumit. Lord Kelvin ishte i prirur të sugjeronte se uraniumi është një lloj kurthi që kap energjinë rrezatuese të pazbulueshme që na arrin përmes hapësirës dhe e shndërron atë në një formë në të cilën është bërë e aftë të prodhojë efekte kimike.
Becquerel as nuk mund ta pranonte këtë hipotezë, as të dilte me diçka më të besueshme, as të braktiste parimin e ruajtjes së energjisë. Përfundoi se ai në përgjithësi e la punën me uranium për një kohë dhe filloi ndarjen vijat spektrale në një fushë magnetike. Ky efekt u zbulua pothuajse njëkohësisht me zbulimin e Bekerelit nga fizikani i ri holandez Peter Zeeman dhe u shpjegua nga një tjetër holandez, Hendrik Anton Lorentz.
Kjo përfundoi fazën e parë të studimit të radioaktivitetit. Albert Ajnshtajni e krahasoi zbulimin e radioaktivitetit me zbulimin e zjarrit, sepse ai besonte se zjarri dhe radioaktiviteti janë momente po aq të rëndësishme në historinë e qytetërimit.
1. Llojet e rrezatimit radioaktiv
Kur burimet e fuqishme të rrezatimit u shfaqën në duart e studiuesve, miliona herë më të forta se uraniumi (këto ishin preparate të radiumit, poloniumit, aktiniumit), ishte e mundur të njiheshim më shumë me vetitë e rrezatimit radioaktiv. Ernest Rutherford, bashkëshortët Maria dhe Pierre Curie, A. Becquerel dhe shumë të tjerë morën pjesë aktive në studimet e para mbi këtë temë. Para së gjithash u studiua fuqia depërtuese e rrezeve, si dhe efekti i fushës magnetike në rrezatim. Doli se rrezatimi është johomogjen, por është një përzierje e "rrezeve". Pierre Curie zbuloi se kur një fushë magnetike vepron mbi rrezatimin e radiumit, disa rreze devijohen ndërsa të tjerat jo. Dihej se fusha magnetike shmang vetëm grimcat fluturuese të ngarkuara, pozitive dhe negative në drejtime të ndryshme. Nga drejtimi i devijimit, ne u siguruam që rrezet β të devijuara të ishin të ngarkuara negativisht. Eksperimentet e mëtejshme treguan se nuk ka asnjë ndryshim thelbësor midis rrezeve katodë dhe β-rrezeve, nga e cila rezultoi se ato përfaqësojnë një rrymë elektronesh.
Rrezet devijuese kishin një aftësi më të fortë për të depërtuar në materiale të ndryshme, ndërsa ato që nuk devijonin thitheshin lehtësisht edhe nga fletë e hollë alumini - kështu sillej, për shembull, rrezatimi i elementit të ri polonium - rrezatimi i tij nuk depërtoi as përmes muret e kartonit të kutisë në të cilën ishte ruajtur droga.
Kur përdorni magnet më të fortë, doli që rrezet α devijojnë gjithashtu, vetëm shumë më të dobëta se rrezet β, dhe në drejtimin tjetër. Nga kjo rrjedh se ato janë të ngarkuara pozitivisht dhe kanë një masë shumë më të madhe (siç u zbulua më vonë, masa e grimcave α është 7740 herë më e madhe se masa e një elektroni). Ky fenomen u zbulua për herë të parë në 1899 nga A. Becquerel dhe F. Gisel. Më vonë doli se grimcat α janë bërthamat e atomeve të heliumit (nuklidi 4 He) me ngarkesë +2 dhe masë 4 cu. rreze β, ai zbuloi në rrezatimin e radiumit një lloj të tretë rrezesh që bëjnë të mos devijojnë në fushat magnetike më të forta, ky zbulim u konfirmua shpejt nga Becquerel. Ky lloj rrezatimi, për analogji me rrezet alfa dhe beta, u quajt rrezet gama, përcaktimi i rrezatimeve të ndryshme me shkronjat e para të alfabetit grek u propozua nga Rutherford. Rrezet gama rezultuan të jenë të ngjashme me rrezet X, d.m.th. ato përfaqësojnë rrezatimi elektromagnetik, por me gjatësi vale më të shkurtra dhe energji përkatësisht më të lartë. Të gjitha këto lloje të rrezatimit janë përshkruar nga M. Curie në monografinë e saj "Radium and Radioactivity". Në vend të një fushe magnetike, një fushë elektrike mund të përdoret për të "ndarë" rrezatimin, vetëm grimcat e ngarkuara në të do të devijojnë jo pingul. linjat e forcës, dhe përgjatë tyre - drejt pllakave devijuese.
Për një kohë të gjatë nuk ishte e qartë se nga vijnë të gjitha këto rreze. Për disa dekada, natyra e rrezatimit radioaktiv dhe vetitë e tij u sqaruan nga veprat e shumë fizikantëve, u zbuluan lloje të reja radioaktiviteti.γ
Rrezet alfa lëshojnë kryesisht bërthamat e atomeve më të rënda dhe për këtë arsye më pak të qëndrueshme (në tabelën periodike ato ndodhen pas plumbit). Këto janë grimca me energji të lartë. Zakonisht ekzistojnë disa grupe të grimcave α, secila prej të cilave ka një energji të përcaktuar rreptësisht. Pra, pothuajse të gjitha grimcat α të emetuara nga bërthamat 226 Ra kanë një energji prej 4,78 MeV (megaelektron-volt) dhe një pjesë të vogël të grimcave α me një energji prej 4,60 MeV. Një tjetër izotop i radiumit, 221 Ra, lëshon katër grupe grimcash α me energji 6.76, 6.67, 6.61 dhe 6.59 MeV. Kjo tregon praninë e disa niveleve të energjisë në bërthama, ndryshimi i tyre korrespondon me energjinë e α-kuanteve të emetuara nga bërthama. Emituesit "të pastër" alfa janë gjithashtu të njohur (për shembull, 222 Rn).
Sipas formulës E = mu 2 /2 mund të llogaritet shpejtësia e grimcave α me një energji të caktuar. Për shembull, 1 mol a-grimca me E= 4,78 MeV ka energji (në njësi SI) E\u003d 4,78 10 6 eV 96500 J / (eV mol) \u003d 4,61 10 11 J / mol dhe masa m= 0,004 kg/mol, prej nga uα 15200 km/s, që është dhjetëra mijëra herë më e madhe se shpejtësia e një plumbi pistolete. Grimcat alfa kanë efektin më të fortë jonizues: duke u përplasur me çdo atom tjetër në një gaz, të lëngët ose të ngurtë, ato "shkatërrojnë" elektronet prej tyre, duke krijuar grimca të ngarkuara. Në këtë rast, grimcat α humbasin energji shumë shpejt: ato mbahen edhe nga një fletë letre. Në ajër, rrezatimi α i radiumit kalon vetëm 3,3 cm, rrezatimi α i toriumit - 2,6 cm, etj. Në fund të fundit, grimca alfa, e cila ka humbur energjinë kinetike, kap dy elektrone dhe kthehet në një atom helium. Potenciali i parë jonizues i atomit të heliumit (He - e → He +) është 24.6 eV, i dyti (He + - e → He +2) është 54.4 eV, që është shumë më tepër se ai i çdo atomi tjetër. Kur elektronet kapen nga grimcat α, çlirohet energji e madhe (më shumë se 7600 kJ / mol), prandaj, asnjë atom i vetëm, përveç atomeve të vetë heliumit, nuk është në gjendje të mbajë elektronet e tij nëse një grimcë α është në lagjja.
Energjia shumë e lartë kinetike e grimcave α bën të mundur "të shihen" me sy të lirë (ose me një xham zmadhues të zakonshëm), kjo u demonstrua për herë të parë në vitin 1903 nga fizikani dhe kimisti anglez William Crookes (1832 - 1919. Ai mezi ngjitur të dukshme për syrin një kokërr kripë radiumi dhe fiksoi gjilpërën në një tub të gjerë qelqi. Në njërin skaj të këtij tubi, jo shumë larg majës së gjilpërës, vendosej një pjatë e veshur me një shtresë fosfori (sulfidi i zinkut shërbente si shtresë), dhe në skajin tjetër kishte një xham zmadhues. Nëse shikoni fosforin në errësirë, mund të shihni: e gjithë fusha e shikimit është e mbushur me shkëndija vezulluese dhe që vdesin menjëherë. Çdo shkëndijë është rezultat i ndikimit të një grimce α. Crookes e quajti këtë pajisje spinthariscope (nga greqishtja spintharis - një shkëndijë dhe skopeo - shikoj, vëzhgoj). Me ndihmën e kësaj metodë e thjeshtë duke numëruar grimcat α, u kryen një numër studimesh, për shembull, në këtë mënyrë u bë e mundur të përcaktohej mjaft saktë konstanta e Avogadro.
Në bërthamë, protonet dhe neutronet mbahen së bashku. forcat bërthamore Prandaj, nuk ishte e qartë se si një grimcë alfa, e përbërë nga dy protone dhe dy neutrone, mund të largohej nga bërthama. U përgjigj në vitin 1928 fizikan amerikan(i cili emigroi në 1933 nga BRSS) George (Georgy Antonovich) Gamov). Sipas ligjeve të mekanikës kuantike, grimcat α, si çdo grimcë me masë të vogël, kanë një natyrë valore dhe për këtë arsye ato kanë një probabilitet të vogël për të qenë jashtë bërthamës, në një të vogël (rreth 6 · 10–12 cm) largësi prej saj. Sapo të ndodhë kjo, zmbrapsja e Kulombit nga një bërthamë shumë afër e ngarkuar pozitivisht fillon të veprojë në grimcë.
Prishja alfa ndikohet kryesisht nga bërthama të rënda - më shumë se 200 prej tyre janë të njohura, grimcat α emetohen nga shumica e izotopeve të elementeve pas bismutit. Njihen emetues më të lehtë alfa, kryesisht atome të rralla të tokës. Por pse grimcat alfa emetohen nga bërthama, dhe jo protonet individuale? Në mënyrë cilësore, kjo shpjegohet me fitimin e energjisë në kalbjen α (grimcat α - bërthamat e heliumit janë të qëndrueshme). Teoria sasiore e kalbjes α u krijua vetëm në vitet 1980 dhe fizikanët vendas morën pjesë gjithashtu në zhvillimin e saj, duke përfshirë Lev Davidovich Landau, Arkady Beinusovich Migdal (1911-1991), Stanislav Georgievich Kadmensky, kreu i Departamentit të Fizikës Bërthamore në Universiteti Voronezh dhe kolegët.
Largimi i një grimce α nga bërthama çon në bërthamën e një elementi tjetër kimik, i cili zhvendoset në tabelën periodike nga dy qeliza në të majtë. Një shembull është transformimi i shtatë izotopeve të poloniumit (ngarkesa e bërthamës 84) në izotopë të ndryshëm të plumbit (ngarkesa bërthamore 82): 218 Po → 214 Pb, 214 Po → 210 Pb, 210 Po → 206 Pb, 211 Po → 2215 Pb, Po → 211Pb, 212Po → 208Pb, 216Po → 212Pb. Izotopet e plumbit 206 Pb 207 Pb dhe 208 Pb janë të qëndrueshme, pjesa tjetër janë radioaktive.
Zbërthimi beta vërehet si në bërthamat e rënda ashtu edhe në ato të lehta, siç është tritiumi. Këto grimca të lehta (elektrone të shpejta) kanë një fuqi më të lartë depërtuese. Pra, në ajër, grimcat β mund të fluturojnë disa dhjetëra centimetra, në lëng dhe të ngurta- nga fraksionet e një milimetri deri në rreth 1 cm Ndryshe nga grimcat α, spektri energjetik i rrezeve β nuk është diskret. Energjia e elektroneve që ikin nga bërthama mund të ndryshojë pothuajse nga zero në një vlerë maksimale karakteristike të një radionuklidi të caktuar. Zakonisht, energjia mesatare e grimcave β është shumë më e vogël se ajo e grimcave α; për shembull, energjia e rrezatimit β 228 Ra është 0.04 MeV. Por ka përjashtime; pra rrezatimi β i nuklidit jetëshkurtër 11 Be mbart një energji prej 11,5 MeV. Për një kohë të gjatë nuk ishte e qartë se si grimcat me shpejtësi të ndryshme fluturojnë nga atomet identike të të njëjtit element. Kur u bë e njohur struktura e atomit dhe bërthama atomike, është shfaqur një mister i ri: nga vijnë grimcat β të emetuara nga bërthama - në fund të fundit, nuk ka elektrone në bërthamë. Pasi fizikani anglez James Chadwick zbuloi neutronin në vitin 1932, fizikanët rusë Dmitry Dmitrievich Ivanenko (1904–1994) dhe Igor Evgenievich Tamm dhe, në mënyrë të pavarur, fizikani gjerman Werner Heisenberg sugjeruan që bërthamat atomike përbëhen nga protone dhe neut. Në këtë rast, grimcat β duhet të formohen si rezultat i procesit intranuklear të shndërrimit të një neutroni në një proton dhe një elektron: n → p + e. Masa e neutronit tejkalon pak masën totale të protonit dhe elektronit, masën e tepërt, në përputhje me formulën e Ajnshtajnit E = mc 2 jep energjinë kinetike të një elektroni që ikën nga bërthama; prandaj, β-zbërthimi vërehet kryesisht në bërthamat me një numër të tepërt neutronesh. Për shembull, nuklidi 226 Ra është një emetues α, dhe të gjithë izotopet më të rënda të radiumit (227 Ra, 228 Ra, 229 Ra dhe 230 Ra) janë β-emetues.
Mbeti për të gjetur pse grimcat β, në ndryshim nga grimcat α, kanë spektri i vazhdueshëm energji, që do të thoshte se disa prej tyre kishin shumë pak energji, ndërsa të tjerët kishin shumë energji (dhe në të njëjtën kohë ata lëviznin me një shpejtësi afër shpejtësisë së dritës). Për më tepër, energjia totale e të gjitha këtyre elektroneve (u matur me një kalorimetër) doli të ishte më pak se diferenca e energjisë midis bërthamës origjinale dhe produktit të saj të kalbjes. Përsëri, fizikanët u përballën me një "shkelje" të ligjit të ruajtjes së energjisë: një pjesë e energjisë së bërthamës origjinale u zhduk në një drejtim të panjohur. Ligji fizik i palëkundshëm u "shpëtua" në 1931 nga fizikani zviceran Wolfgang Pauli, i cili sugjeroi që gjatë zbërthimit β dy grimca fluturojnë nga bërthama: një elektron dhe një grimcë neutrale hipotetike - një neutrino me masë pothuajse zero, e cila largon. energji e tepërt. Spektri i vazhdueshëm i rrezatimit β shpjegohet me shpërndarjen e energjisë midis elektroneve dhe kësaj grimce. Neutrinoja (siç doli më vonë, e ashtuquajtura antineutrino elektronike formohet gjatë zbërthimit β) ndërvepron shumë dobët me materien (për shembull, shpon lehtësisht globin dhe madje edhe një yll të madh në diametër) dhe për këtë arsye nuk u zbulua për një kohë të gjatë. Neutrinot e lira për një kohë të gjatë - eksperimentalisht u regjistruan vetëm në 1956 Kështu, skema e rafinuar e zbërthimit beta është si më poshtë: n → p + . Teoria sasiore e zbërthimit β bazuar në idetë e Paulit për neutrinën u zhvillua në vitin 1933 nga fizikani italian Enrico Fermi, i cili propozoi gjithashtu emrin neutrino (në italisht, "neutron").
Shndërrimi i një neutroni në një proton gjatë zbërthimit β praktikisht nuk e ndryshon masën e nuklidit, por rrit ngarkesën bërthamore me një. Rrjedhimisht, formohet një element i ri, i zhvendosur në tabelën periodike me një qelizë në të djathtë, për shembull: →, →, →, etj. (njëkohësisht, një elektron dhe një antineutrino fluturojnë nga bërthama).
2. Llojet e tjera të radioaktivitetit
Përveç zbërthimit alfa dhe beta, njihen edhe lloje të tjera të transformimeve spontane radioaktive. Në vitin 1938, fizikani amerikan Luis Walter Alvarez zbuloi një lloj të tretë të transformimit radioaktiv, kapjen e elektroneve (K-capture). Në këtë rast, bërthama kap një elektron nga shtresa energjetike më e afërt me të (K-predha). Kur një elektron ndërvepron me një proton, formohet një neutron dhe një neutrino fluturon jashtë bërthamës, duke marrë energjinë e tepërt. Shndërrimi i një protoni në një neutron nuk e ndryshon masën e nuklidit, por zvogëlon ngarkesën bërthamore me një. Rrjedhimisht, formohet një element i ri, i cili është një qelizë në të majtë në tabelën periodike, për shembull, prej tij merret një nukleid i qëndrueshëm (ishte në këtë shembull që Alvarez zbuloi këtë lloj radioaktiviteti).
Me kapjen e K në shtresën elektronike të një atomi, një elektron nga një më i lartë niveli i energjisë, energjia e tepërt lirohet ose në formën e rrezeve X, ose shpenzohet për ikjen e një ose më shumë elektroneve të lidhur dobët nga atomi - të ashtuquajturat elektrone Auger, të quajtur sipas fizikantit francez Pierre Auger (1899–1993). ), i cili e zbuloi këtë efekt në 1923 (për të rrëzuar elektronet e brendshme, ai përdori rrezatim jonizues).
Në vitin 1940, Georgy Nikolaevich Flerov (1913-1990) dhe Konstantin Antonovich Petrzhak (1907-1998) zbuluan ndarje spontane duke përdorur shembullin e uraniumit, në të cilin një bërthamë e paqëndrueshme zbërthehet në dy bërthama më të lehta, masat e të cilave nuk ndryshojnë shumë. për shembull: → + + 2n. Ky lloj kalbjeje vërehet vetëm në uranium dhe elementë më të rëndë - më shumë se 50 nuklide në total. Në rastin e uraniumit, ndarja spontane ndodh shumë ngadalë: jetëgjatësia mesatare e një atomi 238 U është 6.5 miliardë vjet. Në vitin 1938, fizikani dhe kimisti gjerman Otto Hahn, radiokimisti dhe fizikanti austriak Lise Meitner (elementi Mt - meitnerium është emëruar pas saj) dhe fizikokimisti gjerman Fritz Strassmann (1902–1980) zbuluan se kur bombardohen nga bërthamat neutronike. të ndarë në fragmente, për më tepër, që fluturojnë nga neutronet janë në gjendje të shkaktojnë ndarjen e bërthamave fqinje të uraniumit, gjë që çon në reaksion zinxhir). Ky proces shoqërohet me çlirimin e energjisë së madhe (në krahasim me reaksionet kimike), e cila çoi në krijimin armë nukleare dhe ndërtimi i centraleve bërthamore.
Në vitin 1934, vajza e Marie Curie, Irene Joliot-Curie dhe burri i saj Frédéric Joliot-Curie zbuluan zbërthimin e pozitronit. Në këtë proces, një nga protonet e bërthamës shndërrohet në një neutron dhe një antielektron (pozitron) - një grimcë me të njëjtën masë, por të ngarkuar pozitivisht; në të njëjtën kohë, një neutrino fluturon nga bërthama: p → n + e + + 238. Masa e bërthamës nuk ndryshon, por zhvendosja ndodh, ndryshe nga β - prishja, në të majtë, β + prishja është karakteristike të bërthamave me një tepricë të protoneve (të ashtuquajturat bërthama me mungesë neutron ). Pra, izotopet e rënda të oksigjenit 19 O, 20 O dhe 21 O β - janë aktive, dhe izotopet e tij të lehta 14 O dhe 15 O β + janë aktive, për shembull: 14 O → 14 N + e + + 238. Si antigrimca, pozitronet shkatërrohen (asgjësohen) menjëherë kur takohen me elektrone me formimin e dy kuanteve γ. Prishja e pozitronit shpesh konkurron me kapjen e K.
Në vitin 1982, u zbulua radioaktiviteti i protonit: emetimi i një protoni nga një bërthamë (kjo është e mundur vetëm për disa bërthama të marra artificialisht që kanë energji të tepërt). Në vitin 1960, kimisti fizik Vitaly Iosifovich Gol'danskii (1923-2001) parashikoi teorikisht radioaktivitetin me dy proton: nxjerrjen e dy protoneve me rrotullime të çiftëzuara nga bërthama. Është vërejtur për herë të parë në vitin 1970. Radioaktiviteti me dy neutrone gjithashtu vërehet shumë rrallë (zbuluar në 1979).
Në vitin 1984, u zbulua radioaktiviteti i grumbullimit (nga grupi anglez - tufë, tufë). Në këtë rast, në ndryshim nga ndarja spontane, bërthama zbërthehet në fragmente me masa shumë të ndryshme, për shembull, bërthamat me masa nga 14 deri në 34 fluturojnë nga një bërthamë e rëndë. Shkatërrimi i grupimeve gjithashtu vërehet shumë rrallë dhe kjo e vështirësoi atë. për të zbuluar për një kohë të gjatë.
Disa bërthama janë në gjendje të kalbet në drejtime të ndryshme. Për shembull, 221 Rn zbërthehet me 80% me emetimin e grimcave α dhe 20% nga grimcat β, shumë izotope të elementeve të rralla të tokës (137 Pr, 141 Nd, 141 Pm, 142 Sm, etj.) prishen ose nga elektroni kapja ose me emetimin e një pozitroni. Lloje te ndryshme emetimet radioaktive shoqërohen shpesh (por jo gjithmonë) nga rrezatimi γ. Kjo ndodh sepse bërthama që rezulton mund të ketë energji të tepërt, nga e cila lëshohet duke lëshuar rreze gama. Energjia e rrezatimit γ shtrihet në një diapazon të gjerë, kështu që, gjatë zbërthimit prej 226 Ra, është e barabartë me 0,186 MeV, dhe gjatë zbërthimit të 11 Be ajo arrin 8 MeV.
Pothuajse 90% e 2500 bërthamave atomike të njohura janë të paqëndrueshme. Një bërthamë e paqëndrueshme shndërrohet në mënyrë spontane në bërthama të tjera me emetimin e grimcave. Kjo veti e bërthamave quhet radioaktivitet. Për bërthamat e mëdha, paqëndrueshmëria lind për shkak të konkurrencës midis tërheqjes së nukleoneve nga forcat bërthamore dhe zmbrapsjes së Kulonit të protoneve. Nuk ka bërthama të qëndrueshme me numër ngarkese Z > 83 dhe numër masiv A > 209. Por bërthamat atomike me numra Z dhe A dukshëm më të ulët mund të rezultojnë gjithashtu radioaktive. Nëse bërthama përmban dukshëm më shumë protone sesa neutrone, atëherë paqëndrueshmëria është shkaktuar nga një tepricë e energjisë së ndërveprimit të Kulombit. Bërthamat, të cilat do të përmbajnë një tepricë të madhe të neutroneve mbi numrin e protoneve, janë të paqëndrueshme për faktin se masa e neutronit tejkalon masën e protonit. Një rritje në masën e bërthamës çon në një rritje të energjisë së saj.
Fenomeni i radioaktivitetit u zbulua në vitin 1896 nga fizikani francez A. Becquerel, i cili zbuloi se kripërat e uraniumit lëshojnë rrezatim të panjohur që mund të depërtojë përmes barrierave që janë të errëta ndaj dritës dhe të shkaktojnë nxirje të emulsionit fotografik. Dy vjet më vonë, fizikanët francezë M. dhe P. Curie zbuluan radioaktivitetin e toriumit dhe zbuluan dy elementë të rinj radioaktivë - polonium dhe radium.
Në vitet pasuese, shumë fizikanë, duke përfshirë E. Rutherford dhe studentët e tij, u angazhuan në studimin e natyrës së rrezatimit radioaktiv. U zbulua se bërthamat radioaktive mund të lëshojnë grimca të tre llojeve: të ngarkuara pozitivisht dhe negativisht dhe neutrale. Këto tre lloje rrezatimi quheshin rrezatim α-, β- dhe γ. Këto tre lloje të rrezatimit radioaktiv ndryshojnë shumë nga njëri-tjetri në aftësinë e tyre për të jonizuar atomet e materies dhe, rrjedhimisht, në fuqinë e tyre depërtuese. Rrezatimi α ka fuqinë më të vogël depërtuese. Në ajër, në kushte normale, rrezet α udhëtojnë në një distancë prej disa centimetrash. Rrezet β absorbohen shumë më pak nga materia. Ata janë në gjendje të kalojnë nëpër një shtresë alumini disa milimetra të trashë. Rrezet γ kanë fuqinë më të madhe depërtuese, duke qenë në gjendje të kalojnë përmes një shtrese plumbi 5-10 cm të trashë.
Në dekadën e dytë të shekullit të 20-të, pas zbulimit nga E. Rutherford të strukturës bërthamore të atomeve, u vërtetua me vendosmëri se radioaktiviteti është një veti e bërthamave atomike. Studimet kanë treguar se rrezet α përfaqësojnë një rrymë grimcash α - bërthamat e heliumit, rrezet β janë një rrymë elektronesh, rrezet γ janë rrezatim elektromagnetik me valë të shkurtër me një gjatësi vale jashtëzakonisht të shkurtër λ.< 10 –10 м и вследствие этого – ярко выраженными vetitë korpuskulare, d.m.th. është një rrjedhë grimcash - γ-kuanta.
3. Kalbja alfa
Prishja alfa është shndërrimi spontan i një bërthame atomike me numrin e protoneve Z dhe neutroneve N në një bërthamë tjetër (bijë) që përmban numrin e protoneve Z - 2 dhe neutroneve N - 2. Në këtë rast, një grimcë α lëshohet - bërthama e një atomi heliumi. Një shembull i një procesi të tillë është α-prishja e radiumit: ![]() Grimcat alfa të emetuara nga bërthamat e atomeve të radiumit u përdorën nga Rutherford në eksperimentet mbi shpërndarjen nga bërthamat e elementeve të rënda. Shpejtësia e grimcave α të emetuara gjatë kalbjes α të bërthamave të radiumit, e matur përgjatë lakimit të trajektores në një fushë magnetike, është afërsisht e barabartë me 1,5 10 7 m/s, dhe energjia kinetike korresponduese është rreth 7,5 10 -13 J (afërsisht 4. 8 MeV). Kjo vlerë mund të përcaktohet lehtësisht nga vlerat e njohura të masave të bërthamave prindërore dhe bijës dhe bërthamës së heliumit. Megjithëse shpejtësia e grimcës α të hedhur është e madhe, ajo është ende vetëm 5% e shpejtësisë së dritës, kështu që shprehja jo-relativiste për energjinë kinetike mund të përdoret në llogaritje. Studimet kanë treguar se një substancë radioaktive mund të lëshojë grimca α me disa vlera diskrete të energjisë. Kjo shpjegohet me faktin se bërthamat mund të jenë, si atomet, në gjendje të ndryshme të ngacmuara. Një bërthamë bijë mund të jetë në një nga këto gjendje të ngacmuara gjatë kalbjes α.
Grimcat alfa të emetuara nga bërthamat e atomeve të radiumit u përdorën nga Rutherford në eksperimentet mbi shpërndarjen nga bërthamat e elementeve të rënda. Shpejtësia e grimcave α të emetuara gjatë kalbjes α të bërthamave të radiumit, e matur përgjatë lakimit të trajektores në një fushë magnetike, është afërsisht e barabartë me 1,5 10 7 m/s, dhe energjia kinetike korresponduese është rreth 7,5 10 -13 J (afërsisht 4. 8 MeV). Kjo vlerë mund të përcaktohet lehtësisht nga vlerat e njohura të masave të bërthamave prindërore dhe bijës dhe bërthamës së heliumit. Megjithëse shpejtësia e grimcës α të hedhur është e madhe, ajo është ende vetëm 5% e shpejtësisë së dritës, kështu që shprehja jo-relativiste për energjinë kinetike mund të përdoret në llogaritje. Studimet kanë treguar se një substancë radioaktive mund të lëshojë grimca α me disa vlera diskrete të energjisë. Kjo shpjegohet me faktin se bërthamat mund të jenë, si atomet, në gjendje të ndryshme të ngacmuara. Një bërthamë bijë mund të jetë në një nga këto gjendje të ngacmuara gjatë kalbjes α.
Gjatë kalimit të mëvonshëm të kësaj bërthame në gjendjen bazë, lëshohet një γ-kuant. Skema e zbërthimit α të radiumit me emetimin e grimcave α me dy vlera energjitë kinetike treguar në Fig.2. Kështu, kalbja α e bërthamave shoqërohet në shumë raste me rrezatim γ.
Në teorinë e kalbjes α, supozohet se brenda bërthamave mund të formohen grupe që përbëhen nga dy protone dhe dy neutrone, d.m.th. α-grimcë. Bërthama mëmë është një pus potencial për grimcat α, i cili kufizohet nga një pengesë potenciale. Energjia e grimcës α në bërthamë është e pamjaftueshme për të kapërcyer këtë pengesë (Fig. 3). Ikja e një grimce α nga bërthama është e mundur vetëm për shkak të një fenomeni kuanto-mekanik të quajtur efekti i tunelit. Sipas Mekanika kuantike, ekziston një probabilitet jo zero që grimca të kalojë nën barrierën potenciale. Fenomeni i tunelimit ka karakter probabilistik.
4. Zbërthimi beta
Në zbërthimin beta, një elektron emetohet nga bërthama. Elektronet nuk mund të ekzistojnë brenda bërthamave, ato lindin gjatë zbërthimit β si rezultat i shndërrimit të një neutroni në një proton. Ky proces mund të ndodhë jo vetëm brenda bërthamës, por edhe me neutronet e lira. Jetëgjatësia mesatare e një neutroni të lirë është rreth 15 minuta. Kur një neutron zbërthehet në një proton dhe një elektron
Matjet treguan se në këtë proces ka një shkelje të dukshme të ligjit të ruajtjes së energjisë, pasi energjia totale e protonit dhe elektronit që lind nga prishja e neutronit është më e vogël se energjia e neutronit. Në vitin 1931, W. Pauli sugjeroi që gjatë zbërthimit të një neutroni, një grimcë tjetër me masë dhe ngarkesë zero lirohet, e cila merr një pjesë të energjisë me të. Grimca e re u emërua neutrino (neutron i vogël). Për shkak të mungesës së ngarkesës dhe masës në një neutrino, kjo grimcë ndërvepron shumë dobët me atomet e materies, kështu që është jashtëzakonisht e vështirë ta zbulosh atë në një eksperiment. Aftësia jonizuese e neutrinos është aq e vogël sa një akt jonizimi në ajër bie në afërsisht 500 km të shtegut. Kjo grimcë u zbulua vetëm në vitin 1953. Aktualisht, dihet se ekzistojnë disa lloje të neutrinos. Në procesin e zbërthimit të neutronit, formohet një grimcë, e cila quhet një antineutrino elektronike. Është shënuar me një simbol. Prandaj, reaksioni i zbërthimit të neutronit shkruhet si
Një proces i ngjashëm ndodh brenda bërthamave gjatë kalbjes β. Një elektron i formuar si rezultat i prishjes së një prej neutroneve bërthamore nxirret menjëherë nga "shtëpia mëmë" (bërthama) me një shpejtësi të jashtëzakonshme, e cila mund të ndryshojë nga shpejtësia e dritës vetëm me një pjesë të përqindjes. Meqenëse shpërndarja e energjisë së lëshuar gjatë zbërthimit β midis një elektroni, një neutrine dhe një bërthame bijë është e rastësishme, β-elektronet mund të kenë shpejtësi të ndryshme në një gamë të gjerë.
Në β-zbërthim numri i tarifës Z rritet me një, ndërsa numri masiv A mbetet i pandryshuar. Bërthama bijë rezulton të jetë bërthama e njërit prej izotopeve të elementit, numri serial i të cilit në tabelën periodike është një më i lartë se numri serial i bërthamës origjinale. Një shembull tipik i zbërthimit β është shndërrimi i izotonit të toriumit që lind nga kalbja α i uraniumit në paladium.
5. Kalbja e gamës
Ndryshe nga radioaktiviteti α- dhe β, radioaktiviteti γ i bërthamave nuk shoqërohet me një ndryshim në strukturën e brendshme të bërthamës dhe nuk shoqërohet me një ndryshim në numrin e ngarkesës ose masës. Si në kalbjen α- dhe në β, bërthama e bijës mund të jetë në një gjendje të ngacmuar dhe të ketë energji të tepërt. Kalimi i bërthamës nga gjendja e ngacmuar në gjendjen bazë shoqërohet me emetimin e një ose disa kuanteve γ, energjia e të cilave mund të arrijë disa MeV.
6. Ligji i zbërthimit radioaktiv
Çdo mostër e materialit radioaktiv përmban një numër të madh atomesh radioaktive. Meqenëse zbërthimi radioaktiv është i rastësishëm dhe nuk varet nga kushtet e jashtme, ligji i zvogëlimit të numrit N(t) të k të pashkatërruar momenti aktual bërthamat e kohës t mund të shërbejnë si një e rëndësishme karakteristikë statistikore procesi i kalbjes radioaktive.
Lëreni që numri i bërthamave të pazbërthyera N(t) të ndryshojë me ΔN gjatë një periudhe të shkurtër kohore Δt< 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt:
Koeficienti i proporcionalitetit λ është probabiliteti i zbërthimit të bërthamës në kohën Δt = 1 s. Kjo formulë do të thotë se shpejtësia e ndryshimit të funksionit N(t) është drejtpërdrejt proporcionale me vetë funksionin.
ku N 0 është numri fillestar i bërthamave radioaktive në t = 0. Gjatë kohës τ = 1 / λ, numri i bërthamave të pazbërthyera do të ulet me e ≈ 2,7 herë. Vlera τ quhet jetëgjatësia mesatare e një bërthame radioaktive.
Për përdorim praktik, është e përshtatshme të shkruani ligjin e zbërthimit radioaktiv në një formë tjetër, duke përdorur numrin 2 si bazë, dhe jo e:
Vlera e T quhet gjysma e jetës. Gjatë kohës T, gjysma e numrit fillestar të bërthamave radioaktive kalbet. Vlerat e T dhe τ lidhen nga relacioni
Gjysma e jetës është sasia kryesore që karakterizon shkallën e zbërthimit radioaktiv. Sa më e shkurtër të jetë gjysma e jetës, aq më intensiv është prishja. Kështu, për uraniumin T ≈ 4.5 miliardë vjet, dhe për radiumin T ≈ 1600 vjet. Prandaj, aktiviteti i radiumit është shumë më i lartë se ai i uraniumit. Ka elementë radioaktivë me gjysmë jetëgjatësi prej një fraksioni të sekondës.
Gjatë kalbjes α- dhe β-radioaktive, bërthama e bijës mund të jetë gjithashtu e paqëndrueshme. Prandaj, janë të mundshme një sërë zbërthimesh radioaktive të njëpasnjëshme, të cilat përfundojnë në formimin e bërthamave të qëndrueshme. Në natyrë, ka disa seri të tilla. Më e gjata është një seri e përbërë nga 14 prishje të njëpasnjëshme (8 - kalbje alfa dhe 6 prishje beta). Kjo seri përfundon me një izotop të qëndrueshëm të plumbit (Fig. 5).
Në natyrë, ka disa seri më radioaktive, të ngjashme me seritë. Ekziston edhe një seri që fillon me neptunium që nuk gjendet në kushte natyrore dhe përfundon me bismut. Kjo seri zbërthimesh radioaktive ndodh në reaktorët bërthamorë.
rregulli i zhvendosjes. Rregulli i zhvendosjes specifikon saktësisht se çfarë lloj transformimesh pëson një element kimik kur lëshon rrezatim radioaktiv.
7. Rreshtat radioaktive
Rregulli i zhvendosjes bëri të mundur gjurmimin e transformimeve të elementeve radioaktive natyrore dhe ndërtimin e tre pemëve gjenealogjike prej tyre, paraardhësit e të cilave janë uraniumi-238, uraniumi-235 dhe toriumi-232. Çdo familje fillon me një element radioaktiv jashtëzakonisht jetëgjatë. Familja e uraniumit, për shembull, drejtohet nga uraniumi me një numër masiv prej 238 dhe një gjysmë jetëgjatësi prej 4,5·10 9 vjet (në Tabelën 1, në përputhje me emrin origjinal, është caktuar si uranium I).
| Tabela 1. Familja radioaktive e uraniumit | |||||
| element radioaktiv | Z | Element kimik | POR | Lloji i rrezatimit |
Gjysem jete |
| Urani I | 92 | Urani | 238 | | 4.510 9 vjet |
| Urani X 1 | 90 | Thorium | 234 | | 24.1 ditë |
| Urani X 2 Urani Z |
Protaktinium Protaktinium |
–
(99,88%) (0,12%) |
|||
| Urani II | 92 | Urani | 234 | | 2.510 5 vjet |
| Jonium | 90 | Thorium | 230 | | 810 4 vjet |
| Radiumi | 88 | Radiumi | 226 | | 1620 vjet |
| Radoni | 86 | Radoni | 222 | | 3.8 ditë |
| Radiumi A | 84 | Poloniumi | 218 | | 3.05 min |
| Radiumi B | 82 | Plumbi | 214 | | 26.8 min |
| 83 83 |
Bismut Bismut |
214 214 |
(99,96%) (0,04%) |
||
| Radiumi C | 84 | Poloniumi | 214 | | 1,610 -4 s |
| Radiumi C | 81 | Taliumi | 210 | | 1.3 min |
| Radiumi D | 82 | Plumbi | 210 | | 25 vjet |
| Radiumi E | 83 | Bismut | 210 | | 4.85 ditë |
| Radiumi F | 84 | Poloniumi | 210 | | 138 ditë |
| Radiumi G | 82 | Plumbi | 206 | të qëndrueshme | |
familja e uraniumit. Shumica e vetive të transformimeve radioaktive të diskutuara më sipër mund të gjurmohen tek elementët e familjes së uraniumit. Kështu, për shembull, anëtari i tretë i familjes ka izomerizëm bërthamor. Uraniumi X 2, duke lëshuar grimca beta, kthehet në uranium II (T = 1,14 min). Kjo korrespondon me zbërthimin beta të gjendjes së ngacmuar të protaktinium-234. Megjithatë, në 0.12% të rasteve, protaktinium-234 i ngacmuar (uranium X 2) lëshon një kuantë gama dhe shkon në gjendjen bazë (uranium Z). Zbërthimi beta i uraniumit Z, i cili gjithashtu çon në formimin e uraniumit II, ndodh në 6.7 orë.
Radiumi C është interesant sepse mund të kalbet në dy mënyra: duke emetuar një grimcë alfa ose beta. Këto procese konkurrojnë me njëra-tjetrën, por në 99,96% të rasteve ndodh prishja beta me formimin e radiumit C. Në 0.04% të rasteve, radiumi C lëshon një grimcë alfa dhe kthehet në radium C (RaC). Nga ana tjetër, RaC dhe RaC shndërrohen në radium D nga emetimi i grimcave alfa dhe beta, përkatësisht.
Izotopet. Midis anëtarëve të familjes së uraniumit, ka nga ata atomet e të cilëve kanë të njëjtin numër atomik ( të njëjtën pagesë bërthama) dhe numra të ndryshëm masiv. Ato janë identike në vetitë kimike, por ndryshojnë në natyrën e radioaktivitetit. Për shembull, radiumi B, radiumi D dhe radiumi G, të cilët kanë të njëjtin numër atomik prej 82 si plumbi, janë të ngjashëm në sjelljen kimike me plumbin. Natyrisht, vetitë kimike nuk varen nga numri masiv; ato përcaktohen nga struktura e predhave elektronike të atomit (prandaj dhe Z). Nga ana tjetër, numri i masës është kritik për stabilitetin bërthamor të vetive radioaktive të atomit. Atomet me të njëjtin numër atomik dhe numra të ndryshëm në masë quhen izotope. Izotopet e elementeve radioaktive u zbuluan nga F. Soddy në vitin 1913, por shpejt F. Aston vërtetoi me ndihmën e spektroskopisë masive se shumë elementë të qëndrueshëm kanë edhe izotope.
8. Efekti i rrezatimit radioaktiv te njerëzit
Rrezatimi radioaktiv i të gjitha llojeve (alfa, beta, gama, neutronet), si dhe rrezatimi elektromagnetik (rrezatimi me rreze X) kanë një efekt biologjik shumë të fortë në organizmat e gjallë, i cili konsiston në proceset e ngacmimit dhe jonizimit të atomeve dhe molekulave që përbëjnë qelizat e gjalla. Nën veprimin e rrezatimit jonizues, shkatërrohen molekulat komplekse dhe strukturat qelizore, gjë që çon në dëmtimin e trupit nga rrezatimi. Prandaj, kur punoni me çdo burim rrezatimi, është e nevojshme të merren të gjitha masat për mbrojtjen nga rrezatimi të njerëzve që mund të bien në zonën e rrezatimit.
Sidoqoftë, një person mund të ekspozohet ndaj rrezatimit jonizues në kushte shtëpiake. Një gaz radioaktiv inert, i pangjyrë, radoni mund të përbëjë një rrezik serioz për shëndetin e njeriut.Siç mund të shihet nga diagrami i paraqitur në figurën 5, radoni është produkt i kalbjes α të radiumit dhe ka një gjysmë jete T = 3,82 ditë. Radiumi gjendet në sasi të vogla në tokë, në gurë dhe në struktura të ndryshme ndërtimi. Megjithë jetëgjatësinë relativisht të shkurtër, përqendrimi i radonit plotësohet vazhdimisht për shkak të prishjeve të reja të bërthamave të radiumit, kështu që radoni mund të grumbullohet në hapësira të mbyllura. Duke hyrë në mushkëri, radoni lëshon grimca α dhe shndërrohet në polonium, i cili nuk është një substancë kimikisht inerte. Kjo pasohet nga një zinxhir transformimesh radioaktive të serisë së uraniumit (Fig. 5). Sipas Komisionit Amerikan për Sigurinë dhe Kontrollin e Rrezatimit, një person mesatar merr 55% të rrezatimit jonizues nga radoni dhe vetëm 11% nga kujdesi mjekësor. Kontributi i rrezeve kozmike është afërsisht 8%. Doza totale e rrezatimit që merr një person gjatë gjithë jetës është shumë herë më e vogël se doza maksimale e lejuar (MAD), e cila përcaktohet për njerëzit e profesioneve të caktuara që janë të ekspozuar ndaj ekspozimit shtesë ndaj rrezatimit jonizues.
9. Përdorimi i izotopeve radioaktive
Një nga studimet më të spikatura të kryera me ndihmën e "atomeve të etiketuara" ishte studimi i metabolizmit në organizma. Është vërtetuar se në një kohë relativisht të shkurtër trupi i nënshtrohet një rinovimi pothuajse të plotë. Atomet përbërëse të tij zëvendësohen me të reja. Vetëm hekuri, siç kanë treguar eksperimentet në studimin izotopik të gjakut, është një përjashtim nga ky rregull. Hekuri është pjesë e hemoglobinës në qelizat e kuqe të gjakut. Kur atomet e hekurit radioaktiv u futën në ushqim, u zbulua se oksigjeni i lirë i çliruar gjatë fotosintezës fillimisht ishte pjesë e ujit dhe jo dioksidi i karbonit. Izotopet radioaktive përdoren në mjekësi si për qëllime diagnostikuese ashtu edhe për qëllime terapeutike. Natriumi radioaktiv, i futur në sasi të vogla në gjak, përdoret për të studiuar qarkullimin e gjakut, jodi depozitohet intensivisht në gjëndrën tiroide, veçanërisht në sëmundjen e Graves. Duke monitoruar depozitimin e jodit radioaktiv me një numërues, diagnoza mund të bëhet shpejt. Doza të mëdha të jodit radioaktiv shkaktojnë shkatërrim të pjesshëm të indeve në zhvillim jonormal, dhe për këtë arsye jodi radioaktiv përdoret për trajtimin e sëmundjes së Graves. Rrezatimi intensiv gama i kobaltit përdoret në trajtimin e kancerit (pistoleta kobalt).
Jo më pak të gjera janë aplikimet e izotopeve radioaktive në industri. Një shembull i kësaj është metoda e mëposhtme për monitorimin e konsumimit të unazës së pistonit në motorët me djegie të brendshme. Duke rrezatuar unazën e pistonit me neutrone, ato shkaktojnë reaksione bërthamore në të dhe e bëjnë atë radioaktive. Kur motori është në punë, grimcat e materialit të unazës hyjnë në vajin lubrifikues. Duke ekzaminuar nivelin e radioaktivitetit të vajit pas një kohe të caktuar të funksionimit të motorit, përcaktohet veshja e unazës. Izotopet radioaktive bëjnë të mundur gjykimin e difuzionit të metaleve, proceseve në furrat e shpërthimit etj.
Rrezatimi i fuqishëm gama i preparateve radioaktive përdoret për të studiuar strukturën e brendshme të derdhjeve metalike për të zbuluar defektet në to.
Gjithnjë e më shumë, izotopet radioaktive po përdoren në bujqësia. Rrezatimi i farave të bimëve (pambuku, lakra, rrepka etj.) me doza të vogla të rrezeve gama nga preparatet radioaktive çon në një rritje të dukshme të rendimentit. Dozat e mëdha të "rrezatimit shkaktojnë mutacione në bimë dhe mikroorganizma, gjë që në disa raste çon në shfaqjen e mutantëve me veti të reja të vlefshme (radioselektimi). Kështu, janë edukuar varietete të vlefshme gruri, fasule dhe kultura të tjera dhe janë përdorur mikroorganizma shumë produktivë. në prodhimin e antibiotikëve janë marrë.Rrezatimi gama nga izotopet radioaktive përdoret gjithashtu për të kontrolluar insektet e dëmshme dhe për konservim produkte ushqimore. "Atomet e etiketuara" përdoren gjerësisht në teknologjinë bujqësore. Për shembull, për të zbuluar se cili nga plehrat fosfat absorbohet më mirë nga bima, plehra të ndryshëm etiketohen me fosfor radioaktiv 15 32P. Duke ekzaminuar bimët për radioaktivitet, mund të përcaktohet sasia e fosforit të përthithur prej tyre nga varietete të ndryshme të plehrave.
Një aplikim interesant i radioaktivitetit është metoda e datimit të gjetjeve arkeologjike dhe gjeologjike nga përqendrimi i izotopeve radioaktive. Metoda më e përdorur është datimi me radiokarbon. Një izotop i paqëndrueshëm i karbonit ndodh në atmosferë për shkak të reaksionet bërthamore shkaktuar nga rrezet kozmike. Një përqindje e vogël e këtij izotopi gjendet në ajër së bashku me izotopin e zakonshëm të qëndrueshëm.Bimët dhe organizmat e tjerë konsumojnë karbonin nga ajri dhe ato i grumbullojnë të dy izotopet në të njëjtin proporcion si në ajër. Pasi bimët vdesin, ato ndalojnë konsumimin e karbonit dhe si rezultat i kalbjes β, izotopi i paqëndrueshëm shndërrohet gradualisht në azot me një gjysmë jetëgjatësi prej 5730 vjetësh. Duke matur me saktësi përqendrimin relativ të karbonit radioaktiv në mbetjet e organizmave të lashtë, është e mundur të përcaktohet koha e vdekjes së tyre.
Lista e literaturës së përdorur
1. Doktrina e radioaktivitetit. Historia dhe moderniteti. M. Nauka, 1973 2. Rrezatimi bërthamor në shkencë dhe teknologji. M. Nauka, 1984 Furman VI 3. Zbërthimi alfa dhe reaksionet bërthamore të lidhura me to. M. Shkencë, 1985
4. Landsberg G.S. Libër shkollor fillor i fizikës. Vëllimi III. - M.: Nauka, 19865. Seleznev Yu. A. Bazat e fizikës elementare. –M.: Nauka, 1964.6. CD ROM Enciklopedia e Madhe Cyril dhe Metodius, 1997.
7. M. Curie, Radioaktiviteti, përkth. nga frëngjishtja, botimi i dytë, M. - L., 1960
8. A. N. Murin, Hyrje në radioaktivitet, L., 1955
9. A. S. Davydov, Teoria e bërthamës atomike, Moskë, 1958
10. Gaisinsky M.N., Kimia bërthamore dhe aplikimet e saj, përkth. nga frëngjishtja, Moskë, 1961
11. Fizikë Bërthamore Eksperimentale, bot. E. Segre, përkth. nga anglishtja, vëll.3, M., 1961; Mjetet e rrjetit INTERNET
ISOTOPS- varietete të të njëjtit element kimik, të ngjashëm në vetitë e tyre fizike dhe kimike, por që kanë masa atomike të ndryshme. Emri "izotope" u propozua në vitin 1912 nga radiokimisti anglez Frederick Soddy, i cili e formoi atë nga dy fjalë greke: isos - i njëjti dhe topos - vend. Izotopët zënë të njëjtin vend në qelizën e sistemit periodik të elementeve të Mendelejevit.
Një atom i çdo elementi kimik përbëhet nga një bërthamë e ngarkuar pozitivisht dhe një re e elektroneve të ngarkuar negativisht që e rrethojnë atë. Pozicioni i një elementi kimik në sistemin periodik të Mendelejevit (numri i tij serial) përcaktohet nga ngarkesa e bërthamës së atomeve të tij. izotopet quhen prandaj varietete të të njëjtit element kimik, atomet e të cilëve kanë të njëjtën ngarkesë bërthamore (dhe për rrjedhojë pothuajse të njëjtë predha elektronike), por ndryshojnë në vlerat e masës së bërthamës. Sipas shprehjes figurative të F. Soddy, atomet e izotopeve janë të njëjtë "jashtë", por të ndryshëm "brenda".
Neutroni u zbulua në vitin 1932 - një grimcë që nuk ka ngarkesë, me një masë afër masës së bërthamës së një atomi hidrogjeni - një proton , dhe krijoi modeli proton-neutron i bërthamës. Si rezultat në shkencë, është vendosur përkufizimi përfundimtar modern i konceptit të izotopeve: izotopet janë substanca, bërthamat atomike të të cilave përbëhen nga i njëjti numër protonesh dhe ndryshojnë vetëm në numrin e neutroneve në bërthamë. . Çdo izotop zakonisht shënohet me një grup simbolesh, ku X është simboli i një elementi kimik, Z është ngarkesa e bërthamës atomike (numri i protoneve), A është numri masiv i izotopit ( numri total nukleonet - protonet dhe neutronet në bërthamë, A = Z + N). Meqenëse ngarkesa e bërthamës lidhet pa mëdyshje me simbolin e elementit kimik, shpesh shënimi A X përdoret thjesht për shkurtim.
Nga të gjithë izotopët e njohur për ne, vetëm izotopet e hidrogjenit kanë emrat e tyre. Kështu, izotopet 2 H dhe 3 H quhen deuterium dhe tritium dhe emërtohen përkatësisht D dhe T (izotopi 1 H nganjëherë quhet protium).
Ato ndodhin natyrshëm si izotopë të qëndrueshëm. , dhe e paqëndrueshme - radioaktive, bërthamat e atomeve të të cilave i nënshtrohen shndërrimit spontan në bërthama të tjera me emetimin e grimcave të ndryshme (ose proceset e të ashtuquajturit zbërthim radioaktiv). Tani njihen rreth 270 izotopë të qëndrueshëm dhe izotopë të qëndrueshëm gjenden vetëm në elementët me numër atomik Z Ј 83. Numri i izotopeve të paqëndrueshme i kalon 2000, shumica dërrmuese e tyre janë marrë artificialisht si rezultat i reaksioneve të ndryshme bërthamore. Numri i izotopeve radioaktive në shumë elementë është shumë i madh dhe mund të kalojë dy duzina. Numri i izotopeve stabile është shumë më i vogël.Disa elementë kimikë përbëhen nga vetëm një izotop i qëndrueshëm (beriliumi, fluori, natriumi, alumini, fosfori, mangani, ari dhe një sërë elementësh të tjerë). Numri më i madh izotopet e qëndrueshme - 10 që gjenden në kallaj, në hekur, për shembull, ato janë 4, në merkur - 7.
Zbulimi i izotopeve, sfond historik.
Në 1808, natyralisti anglez John Dalton prezantoi për herë të parë përkufizimin e një elementi kimik si një substancë e përbërë nga atome të një lloji. Në 1869, kimisti DIMendeleev zbuloi ligjin periodik të elementeve kimike. Një nga vështirësitë në vërtetimin e konceptit të një elementi si një substancë që zë një vend të caktuar në qelizën e sistemit periodik ishin peshat atomike jo të plota të vëzhguara eksperimentalisht të elementeve. Në 1866, fizikani dhe kimisti anglez - Sir William Crookes parashtroi hipotezën se çdo element kimik natyror është një përzierje e substancave që janë identike në vetitë e tyre, por kanë masa të ndryshme atomike, por në atë kohë ky supozim nuk kishte ende eksperimente. konfirmim dhe prandaj pak kaloi.
Një hap i rëndësishëm drejt zbulimit të izotopeve ishte zbulimi i fenomenit të radioaktivitetit dhe hipoteza e zbërthimit radioaktiv të formuluar nga Ernst Rutherford dhe Frederick Soddy: radioaktiviteti nuk është gjë tjetër veçse zbërthimi i një atomi në një grimcë të ngarkuar dhe një atom të një elementi tjetër. , e cila ndryshon në vetitë e saj kimike nga ajo origjinale. Si rezultat, lindi koncepti i serive radioaktive ose familjeve radioaktive. , në fillim të të cilit gjendet elementi i parë prind, i cili është radioaktiv, dhe në fund - elementi i fundit i qëndrueshëm. Një analizë e zinxhirëve të transformimeve tregoi se në rrjedhën e tyre një dhe i njëjti element radioaktiv, që ndryshojnë vetëm në masa atomike, mund të shfaqen në një qelizë të sistemit periodik. Në fakt, kjo nënkuptonte futjen e konceptit të izotopeve.
Konfirmimi i pavarur i ekzistencës së izotopeve të qëndrueshme të elementeve kimike u mor më pas në eksperimentet e J. J. Thomson dhe Aston në 1912-1920 me rrezet e grimcave të ngarkuara pozitivisht (ose të ashtuquajturat rreze kanali ) që del nga tubi i shkarkimit.
Në vitin 1919 Aston krijoi një instrument të quajtur spektrograf masiv. (ose spektrometri i masës) . Tubi i shkarkimit u përdor ende si burim jonesh, por Aston gjeti një mënyrë në të cilën devijimi i njëpasnjëshëm i rrezes së grimcave në elektrike dhe fusha magnetikeçoi në fokusimin e grimcave me të njëjtin raport ngarkese ndaj masës (pavarësisht shpejtësisë së tyre) në të njëjtën pikë të ekranit. Së bashku me Aston, një spektrometër masiv me një dizajn paksa të ndryshëm u krijua në të njëjtat vite nga Dempster Amerikan. Si rezultat i përdorimit dhe përmirësimit të mëvonshëm të spektrometrit të masës nga përpjekjet e shumë studiuesve, deri në vitin 1935 u përpilua një tabelë pothuajse e plotë e përbërjeve izotopike të të gjithë elementëve kimikë të njohur deri në atë kohë.
Metodat e ndarjes së izotopeve.
Për të studiuar vetitë e izotopeve dhe veçanërisht për t'i përdorur ato për qëllime shkencore dhe aplikative, është e nevojshme të merren ato në sasi pak a shumë të dukshme. Në spektrometrat e masës konvencionale, arrihet ndarja pothuajse e plotë e izotopeve, por numri i tyre është i papërfillshëm. Prandaj, përpjekjet e shkencëtarëve dhe inxhinierëve u drejtuan në kërkimin e metodave të tjera të mundshme të ndarjes së izotopeve. Para së gjithash, u përvetësuan metodat e ndarjes fizike dhe kimike, bazuar në ndryshimet në vetitë e tilla të izotopeve të të njëjtit element si ritmet e avullimit, konstantat e ekuilibrit, ritmet reaksionet kimike etj. Më efektive midis tyre ishin metodat e korrigjimit dhe shkëmbimit izotopik, të cilat përdoren gjerësisht në prodhimin industrial të izotopeve të elementeve të lehta: hidrogjen, litium, bor, karbon, oksigjen dhe azot.
Një grup tjetër metodash formohet nga të ashtuquajturat metoda molekulare-kinetike: difuzioni i gaztë, difuzioni termik, difuzioni në masë (difuzioni në një rrymë avulli) dhe centrifugimi. Metodat difuzioni i gazit, bazuar në shkallë të ndryshme të difuzionit të komponentëve izotopikë në media poroze shumë të shpërndara, u përdorën gjatë Luftës së Dytë Botërore për të organizuar prodhimit industrial ndarja e izotopeve të uraniumit në Shtetet e Bashkuara në kuadrin e të ashtuquajturit projekti Manhattan për të krijuar Bombë atomike. Për të marrë sasitë e nevojshme të uraniumit, të pasuruar deri në 90% me izotopin e lehtë 235 U - përbërësi kryesor "i djegshëm" i bombës atomike, u ndërtuan impiante që zinin një sipërfaqe prej rreth katër mijë hektarësh. Më shumë se 2 miliardë dollarë u ndanë për krijimin e një qendre atomike me impiante për prodhimin e uraniumit të pasuruar.Pas luftës u zhvilluan dhe u ndërtuan impiante për prodhimin e uraniumit të pasuruar për qëllime ushtarake, bazuar edhe në metodën e ndarjes së difuzionit. në BRSS. AT vitet e fundit kjo metodë i ka lënë vendin një metode centrifugimi më efikase dhe më pak të kushtueshme. Në këtë metodë, efekti i ndarjes së përzierjes së izotopeve arrihet për shkak të veprimit të ndryshëm të forcave centrifugale në përbërësit e përzierjes së izotopit që mbush rotorin e centrifugës, i cili është një cilindër me mure të hollë të kufizuar nga lart dhe poshtë, që rrotullohet në një shpejtësi shumë e lartë në një dhomë vakum. Qindra mijëra centrifuga të lidhura në kaskada, rotori i secilës prej të cilave bën më shumë se një mijë rrotullime në sekondë, aktualisht përdoren në impiantet moderne të ndarjes si në Rusi ashtu edhe në vendet e tjera të zhvilluara të botës. Centrifugat përdoren për më shumë sesa thjesht për të marrë uraniumin e pasuruar që nevojitet për të funksionuar reaktorët bërthamorë centralet bërthamore, por edhe për prodhimin e izotopeve të rreth tridhjetë elementeve kimike të pjesës së mesme të tabelës periodike. Për ndarjen e izotopeve të ndryshme përdoren gjithashtu instalime të ndarjes elektromagnetike me burime të fuqishme jonesh; vitet e fundit janë përhapur edhe metodat e ndarjes me lazer.
Efekti i rrezatimit radioaktiv tek njerëzit
Rrezatimi radioaktiv i të gjitha llojeve (alfa, beta, gama, neutronet), si dhe rrezatimi elektromagnetik (rrezatimi me rreze X) kanë një efekt biologjik shumë të fortë në organizmat e gjallë, i cili konsiston në proceset e ngacmimit dhe jonizimit të atomeve dhe molekulave që përbëjnë qelizat e gjalla. Nën ndikimin e rrezatimit jonizues, shkatërrohen molekulat komplekse dhe strukturat qelizore, gjë që çon në dëmtimi i trupit nga rrezatimi. Prandaj, kur punoni me çdo burim rrezatimi, është e nevojshme të merren të gjitha masat për mbrojtjen nga rrezatimi të njerëzve që mund të bien në zonën e rrezatimit.
Sidoqoftë, një person mund të ekspozohet ndaj rrezatimit jonizues në kushte shtëpiake. Një gaz radioaktiv inert, i pangjyrë, radoni mund të përbëjë një rrezik serioz për shëndetin e njeriut.Ai është produkt i kalbjes së radiumit dhe ka një gjysmë jete T = 3,82 ditë. Radiumi gjendet në sasi të vogla në tokë, në gurë dhe në struktura të ndryshme ndërtimi. Megjithë jetëgjatësinë relativisht të shkurtër, përqendrimi i radonit plotësohet vazhdimisht për shkak të prishjeve të reja të bërthamave të radiumit, kështu që radoni mund të grumbullohet në hapësira të mbyllura. Duke hyrë në mushkëri, radoni lëshon grimca dhe shndërrohet në polonium, i cili nuk është një substancë kimikisht inerte. Kjo pasohet nga një zinxhir transformimesh radioaktive të serisë së uraniumit. Sipas Komisionit Amerikan për Sigurinë dhe Kontrollin e Rrezatimit, një person mesatar merr 55% të rrezatimit jonizues nga radoni dhe vetëm 11% nga kujdesi mjekësor. Kontributi i rrezeve kozmike është afërsisht 8%. Doza totale e rrezatimit që një person merr gjatë gjithë jetës është shumë herë më e vogël doza maksimale e lejuar(SDA), e cila është krijuar për njerëzit e profesioneve të caktuara të ekspozuar ndaj ekspozimit shtesë ndaj rrezatimit jonizues.
Përdorimi i izotopeve radioaktive
Një nga studimet më të spikatura të kryera me ndihmën e "atomeve të etiketuara" ishte studimi i metabolizmit në organizma. Është vërtetuar se në një kohë relativisht të shkurtër trupi i nënshtrohet një rinovimi pothuajse të plotë. Atomet përbërëse të tij zëvendësohen me të reja. Vetëm hekuri, siç kanë treguar eksperimentet në studimin izotopik të gjakut, është një përjashtim nga ky rregull. Hekuri është pjesë e hemoglobinës në qelizat e kuqe të gjakut. Kur atomet e hekurit radioaktiv u futën në ushqim, u zbulua se oksigjeni i lirë i çliruar gjatë fotosintezës fillimisht ishte pjesë e ujit dhe jo dioksidi i karbonit. Izotopet radioaktive përdoren në mjekësi si për qëllime diagnostikuese ashtu edhe për qëllime terapeutike. Natriumi radioaktiv, i futur në sasi të vogla në gjak, përdoret për të studiuar qarkullimin e gjakut, jodi depozitohet intensivisht në gjëndrën tiroide, veçanërisht në sëmundjen e Graves. Duke monitoruar depozitimin e jodit radioaktiv me një numërues, diagnoza mund të bëhet shpejt. Doza të mëdha të jodit radioaktiv shkaktojnë shkatërrim të pjesshëm të indeve në zhvillim jonormal, dhe për këtë arsye jodi radioaktiv përdoret për trajtimin e sëmundjes së Graves. Rrezatimi intensiv gama i kobaltit përdoret në trajtimin e kancerit (pistoleta kobalt).
Jo më pak të gjera janë aplikimet e izotopeve radioaktive në industri. Një shembull i kësaj është metoda e mëposhtme për monitorimin e konsumimit të unazës së pistonit në motorët me djegie të brendshme. Duke rrezatuar unazën e pistonit me neutrone, ato shkaktojnë reaksione bërthamore në të dhe e bëjnë atë radioaktive. Kur motori është në punë, grimcat e materialit të unazës hyjnë në vajin lubrifikues. Duke ekzaminuar nivelin e radioaktivitetit të vajit pas një kohe të caktuar të funksionimit të motorit, përcaktohet veshja e unazës. Izotopet radioaktive bëjnë të mundur gjykimin e difuzionit të metaleve, proceseve në furrat e shpërthimit etj.
Rrezatimi i fuqishëm gama i preparateve radioaktive përdoret për të studiuar strukturën e brendshme të derdhjeve metalike për të zbuluar defektet në to.
Izotopet radioaktive po përdoren gjithnjë e më gjerësisht në bujqësi. Rrezatimi i farave të bimëve (pambuku, lakra, rrepka etj.) me doza të vogla të rrezeve gama nga preparatet radioaktive çon në një rritje të dukshme të rendimentit. Dozat e mëdha të "rrezatimit shkaktojnë mutacione në bimë dhe mikroorganizma, gjë që në disa raste çon në shfaqjen e mutantëve me veti të reja të vlefshme (radioselektimi). Kështu, janë edukuar varietete të vlefshme gruri, fasule dhe kultura të tjera dhe janë përdorur mikroorganizma shumë produktivë. janë marrë në prodhimin e antibiotikëve.Rrezatimi gama nga izotopet radioaktive përdoret gjithashtu për të kontrolluar insektet e dëmshme dhe për të ruajtur ushqimin. "Atomet e etiketuara" përdoren gjerësisht në teknologjinë bujqësore. Për shembull, për të gjetur se cili nga plehrat e fosforit është më i mirë. absorbohen nga bima, plehra të ndryshëm etiketohen me fosfor radioaktiv 15 32 P. pastaj bimët për radioaktivitet, mund të përcaktoni sasinë e fosforit të përthithur prej tyre nga varietete të ndryshme të plehrave.Një aplikim interesant i radioaktivitetit është metoda e datimit të gjetjeve arkeologjike dhe gjeologjike nga përqendrimi i izotopeve radioaktive. Metoda më e përdorur e datimit të radiokarbonit. E paqëndrueshme dhe një izotop i karbonit ndodh në atmosferë për shkak të reaksioneve bërthamore të shkaktuara nga rrezet kozmike. Një përqindje e vogël e këtij izotopi gjendet në ajër së bashku me izotopin e zakonshëm të qëndrueshëm.Bimët dhe organizmat e tjerë konsumojnë karbonin nga ajri dhe i grumbullojnë të dy izotopet në të njëjtën proporcion si në ajër. Pas vdekjes së bimëve, ato pushojnë së konsumuari karbonin dhe izotopi i paqëndrueshëm, si pasojë e kalbjes, gradualisht kthehet në azot me një gjysmë jetëgjatësi prej 5730 vjetësh. Duke matur me saktësi përqendrimin relativ të karbonit radioaktiv në mbetjet e organizmave të lashtë, është e mundur të përcaktohet koha e vdekjes së tyre.
Përdorimi i radioaktivitetit.
1. Veprimet biologjike. Rrezatimi radioaktiv ka një efekt katastrofik në qelizat e gjalla. Mekanizmi i këtij veprimi shoqërohet me jonizimin e atomeve dhe dekompozimin e molekulave brenda qelizave gjatë kalimit të grimcave të ngarkuara shpejt. Qelizat që janë në gjendje të rritjes dhe riprodhimit të shpejtë janë veçanërisht të ndjeshme ndaj efekteve të rrezatimit. Kjo rrethanë përdoret për trajtimin e tumoreve kancerogjene.
Për qëllime terapie përdoren preparate radioaktive që lëshojnë rrezatim g, pasi këto të fundit depërtojnë në trup pa dobësim të dukshëm. Në doza jo shumë të larta të rrezatimit, qelizat kancerogjene vdesin, ndërsa trupi i pacientit nuk pëson dëmtime të konsiderueshme. Duhet të theksohet se radioterapia e kancerit, si terapia me rreze X, nuk është aspak një ilaç universal që çon gjithmonë në një kurë.
Doza tepër të larta të rrezatimit radioaktiv shkaktojnë sëmundje të rënda te kafshët dhe njerëzit (të ashtuquajturat sëmundje nga rrezatimi) dhe mund të çojnë në vdekje. Në doza shumë të vogla, rrezatimi radioaktiv, kryesisht rrezatimi a, përkundrazi, ka një efekt stimulues në organizëm. I lidhur me këtë është edhe efekti shërues i ujërave minerale radioaktivë që përmbajnë sasi të vogla të radiumit ose radonit.
2. Përbërjet ndriçuese Substancat ndriçuese shkëlqejnë nën veprimin e rrezatimit radioaktiv (krh. § 213). Duke shtuar një sasi shumë të vogël të kripës së radiumit në një substancë ndriçuese (për shembull, sulfidi i zinkut), përgatiten bojëra me shkëlqim të përhershëm. Këto bojëra, kur aplikohen në numrat dhe akrepat e orëve, pamjeve, etj., i bëjnë ato të dukshme në errësirë.
3. Përcaktimi i moshës së Tokës. Masa atomike i plumbit të zakonshëm, i nxjerrë nga xehet që nuk përmbajnë elemente radioaktive, është 207.2; këto minerale në momentin e formimit (kristalizimi nga shkrirja ose tretësira) nuk kanë pasur plumb; i gjithë plumbi i disponueshëm në këto minerale është grumbulluar si rezultat i kalbjes së uraniumit. Duke përdorur ligjin e zbërthimit radioaktiv, është e mundur të përcaktohet mosha e tij nga raporti i sasive të plumbit dhe uraniumit në një mineral.
Mosha e mineraleve me origjinë të ndryshme që përmbajnë uranium, e përcaktuar me këtë metodë, matet në qindra miliona vjet. Mineralet më të vjetra janë mbi 1.5 miliardë vjet të vjetra.
Izotopet, veçanërisht ato radioaktive, kanë përdorime të shumta. Në tabelë. 1.13 tregon shembuj të përzgjedhur të disa prej aplikimeve industriale të izotopeve. Çdo teknikë e përmendur në këtë tabelë përdoret gjithashtu në industri të tjera. Për shembull, përdoret teknika për përcaktimin e rrjedhjes së një lënde duke përdorur radioizotope: në industrinë e pijeve për të përcaktuar rrjedhjen nga rezervuarët e magazinimit dhe tubacionet; në ndërtimin e strukturave inxhinierike për
Tabela 1.13. Disa aplikime të radioizotopeve
përcaktimi i rrjedhjeve nga kanalet nëntokësore; në industrinë e energjisë për të zbuluar rrjedhjet nga shkëmbyesit e nxehtësisë në termocentrale; në industrinë e naftës për të përcaktuar rrjedhjen nga tubacionet nëntokësore; në shërbim të kontrollit të mbetjeve dhe ujërave të zeza për të përcaktuar rrjedhjet nga kolektorët kryesorë.
Izotopet përdoren gjithashtu gjerësisht në kërkimin shkencor. Në veçanti, ato përdoren për të përcaktuar mekanizmat e reaksioneve kimike. Si shembull, merrni parasysh përdorimin e ujit të etiketuar me izotop të qëndrueshëm të oksigjenit 180 për të studiuar hidrolizën e estereve si acetati etil (shih gjithashtu seksionin 19.3). Duke përdorur spektrometrinë e masës për të zbuluar izotopin 180, u zbulua se gjatë hidrolizës, atomi i oksigjenit nga molekula e ujit shkon në acid acetik dhe jo në etanol.
Radioizotopet përdoren gjerësisht si atome të etiketuara në kërkimet biologjike. Për të gjurmuar rrugët metabolike në sistemet e gjalla, përdoren radioizotopet karbon-14, tritium, fosfor-32 dhe squfur-35. Për shembull, thithja e fosforit nga bimët nga toka e plehëruar mund të monitorohet duke përdorur plehra që përmbajnë një përzierje të fosforit-32.
terapi me rrezatim.
Rrezatimi jonizues mund të shkatërrojë indet e gjalla. Indet e tumoreve malinje janë më të ndjeshme ndaj rrezatimit sesa indet e shëndetshme. Kjo bën të mundur trajtimin e kancerit me rreze γ të emetuara nga një burim, që është izotopi radioaktiv kobalt-60. Rrezatimi drejtohet në zonën e trupit të pacientit të prekur nga tumori; Seanca e trajtimit zgjat disa minuta dhe përsëritet çdo ditë për 2-6 javë. Gjatë seancës, të gjitha pjesët e tjera të trupit të pacientit duhet të mbulohen me kujdes me material të papërshkueshëm nga rrezatimi për të parandaluar shkatërrimin e indeve të shëndetshme.
Përcaktimi i moshës së mostrave duke përdorur radiokarbon.
Një pjesë e vogël e dioksidit të karbonit që ndodhet në atmosferë përmban një izotop radioaktiv. Bimët e thithin këtë izotop gjatë fotosintezës. Prandaj, indet e të gjithëve
bimët dhe kafshët gjithashtu përmbajnë këtë izotop. Indet e gjalla kanë një nivel konstant radioaktiviteti, sepse rënia e tij për shkak të kalbjes radioaktive kompensohet nga furnizimi i vazhdueshëm i radiokarbonit nga atmosfera. Megjithatë, sapo të ndodhë vdekja e një bime ose kafshe, rrjedha e radiokarbonit në indet e saj ndalet. Kjo çon në një ulje graduale të nivelit të radioaktivitetit të indeve të vdekura.
Radioaktiviteti i izotopit është për shkak të -zbërthimit
![]()
Metoda radiokarbonike e gjeokronologjisë u zhvillua në vitin 1946 nga W.F. Libby, i cili mori për të Çmimi Nobël në Kimi në vitin 1960. Kjo metodë tani përdoret gjerësisht nga arkeologët, antropologët dhe gjeologët deri në ekzemplarët e vjetër deri në 35,000 vjet. Saktësia e kësaj metode është afërsisht 300 vjet. Rezultatet më të mira merren me përcaktimin e moshës së leshit, farave, guaskave dhe kockave. Për të përcaktuar moshën e një kampioni, aktiviteti i rrezatimit p (zbërthimi në minutë) matet për 1 g karbon që përmbahet në të. Kjo lejon që mosha e kampionit të përcaktohet duke përdorur lakoren e zbërthimit radioaktiv për izotopin.
Gjysma e jetës është 5700 vjet. Indet e gjalla në kontakt aktiv me atmosferën kanë një aktivitet prej 15.3 shpërhapje/min për 1 g karbon. Këto të dhëna kërkojnë:
a) përcaktoni konstantën e zbërthimit për
b) ndërtoni një kurbë zbërthimi për
c) llogarit moshën e kraterit të liqenit Oregon në SHBA), i cili është me origjinë vullkanike. Është vërtetuar se një pemë është kthyer përmbys gjatë
Shpërthimi që rezultoi në formimin e liqenit ka një aktivitet prej 6.5 shpërndarje/min për 1 g karbon.
a) Konstanta e zbërthimit mund të gjendet nga ekuacioni
![]()
b) Kurba e zbërthimit është një grafik i aktivitetit kundrejt kohës. Të dhënat e nevojshme për vizatimin e kësaj kurbë mund të llogariten nga gjysma e jetës dhe aktiviteti fillestar i kampionit (aktiviteti i indit të gjallë); këto të dhëna janë dhënë në tabelë. 1.14. Kurba e kalbjes është paraqitur në fig. 1.32.
c) Mosha e liqenit mund të përcaktohet duke përdorur kurbën e kalbjes (shih vijat e ndërprera në Fig. 1.32). Kjo moshë është 7000 vjet.
Tabela 1.14. Të dhënat për ndërtimin e një kurbë të zbërthimit radioaktiv të karbonit të përdorura në përcaktimin e moshës së mostrave
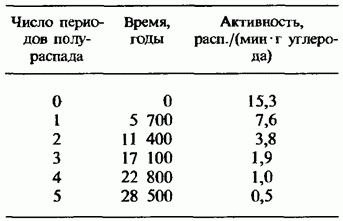
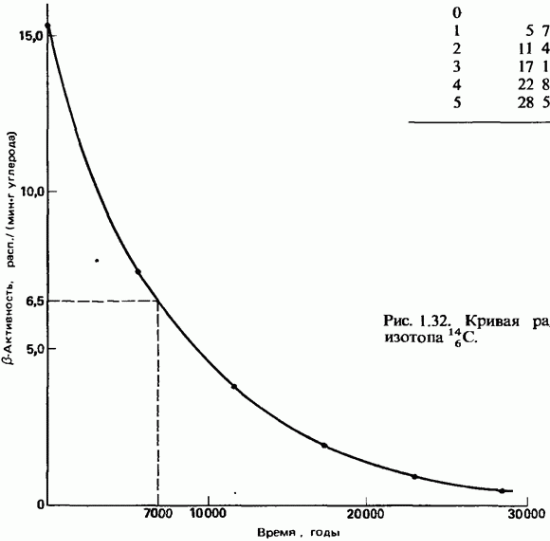
Oriz. 1.32. Kurba e zbërthimit të izotopit radioaktiv
Shumë shkëmbinj në Tokë dhe në Hënë përmbajnë radioizotope me gjysmë jetësh në rendin e viteve. Duke matur dhe krahasuar përmbajtjen relative të këtyre radioizotopeve me përmbajtjen relative të produkteve të tyre të kalbjes në mostrat e formacioneve të tilla shkëmbore, mund të përcaktohet mosha e tyre. Tre metodat më të rëndësishme të gjeokronologjisë bazohen në përcaktimin e bollëkut relativ të izotopeve (vitet e gjysmës së jetës). (vitet e gjysmës së jetës) dhe (vitet e gjysmës së jetës).
Metoda e datimit me kalium dhe argon.
Mineralet si mika dhe disa lloje feldspat përmbajnë sasi të vogla të radioizotopit kalium-40. Ai prishet, i nënshtrohet kapjes së elektroneve dhe shndërrohet në argon-40:
![]()
Mosha e kampionit përcaktohet në bazë të llogaritjeve që përdorin të dhëna për përmbajtjen relative të kaliumit-40 në kampion në krahasim me argon-40.
Metoda e datimit me rubidium dhe stroncium.
Disa nga shkëmbinjtë më të vjetër në tokë, të tilla si granitet në bregun perëndimor të Grenlandës, përmbajnë rubidium. Përafërsisht një e treta e të gjithë atomeve të rubidiumit janë rubidium-87 radioaktiv. Ky radioizotop zbërthehet në izotop të qëndrueshëm stroncium-87. Llogaritjet e bazuara në përdorimin e të dhënave për përmbajtjen relative të izotopeve të rubidiumit dhe stronciumit në mostra bëjnë të mundur përcaktimin e moshës së shkëmbinjve të tillë.
Metoda e takimit për uraniumin dhe plumbin.
Izotopet e uraniumit kalbet në izotope plumbi. Mosha e mineraleve si apatiti, që përmbajnë papastërti të uraniumit, mund të përcaktohet duke krahasuar përmbajtjen në mostrat e tyre të disa izotopeve të uraniumit dhe plumbit.
Të tre metodat e përshkruara janë përdorur për datën e shkëmbinjve tokësorë. Të dhënat që rezultojnë tregojnë se mosha e Tokës është vite. Këto metoda u përdorën gjithashtu për të përcaktuar moshën e shkëmbinjve hënorë të sjellë në Tokë nga misionet hapësinore. Mosha e këtyre racave është nga 3.2 në vjet.






