Vijat spektrale të atomit të hidrogjenit. Procedura për kryerjen e punës laboratorike. Sekuenca izoelektronike e hidrogjenit
Në kohën kur u shfaq teoria e Bohr-it, atomi i hidrogjenit ishte studiuar mjaft mirë. Është më i thjeshti nga atomet. Një elektron i vetëm rrotullohet rreth bërthamës së tij. Spektri i linjës së hidrogjenit është gjithashtu i thjeshtë. Prandaj, u mor përshkrimi i tij para përshkrimeve spektrat e atomeve të tjera.
Spektrat molekularë vërehen kur një molekulë i nënshtrohet thithjes ose emetimit rrezatimi elektromagnetik si rezultat i rritjes ose uljes së energjisë. Ka kufizime të vendosura nga ligjet mbi të cilat avujt mund të marrin pjesë në ndryshimet e energjisë dhe në masën në të cilën rrezatimi absorbohet ose emetohet. Këto dy dukuri referohen si përthithje e induktuar dhe, përkatësisht. Gjithashtu, një molekulë në një gjendje energjie të ngacmuar mund të lëshojë spontanisht rrezatim elektromagnetik, duke u rikthyer në një nivel më të ulët energjie pa praninë e rrezatimit nxitës.
Sipas postulatit të parë të Bohr-it, në një atom, elektronet rreth bërthamës mund të rrotullohen jo në asnjë, por vetëm në orbita të caktuara të palëvizshme, të cilat quhen "të lejuara". Në këtë rast, energjia as nuk emetohet dhe as nuk absorbohet nga atomi. Çdo orbitë e tillë korrespondon me një të caktuar niveli i energjisë atom. Energjia e një atomi ndryshon vetëm kur elektroni lëviz në një orbitë tjetër ose në një nivel tjetër energjie. Kur kjo ndodh, thithja ose çlirimi i një sasie energjie.
Ju keni mësuar tashmë për strukturën e atomit. Elektronet përreth bërthama atomike, janë rregulluar në një seri nivelesh në rritje të energjisë. Çdo element ka një numër unik elektronesh në një konfigurim unik, kështu që çdo element ka grupin e vet të niveleve të energjisë. Ky rregullim i niveleve të energjisë shërben si një gjurmë unike e atomit.
Megjithatë, një gaz i ndezur në temperatura të ngjashme do të lëshonte dritë vetëm në gjatësi vale të caktuara. Arsyeja e këtij vëzhgimi nuk u kuptua në atë kohë. Shkencëtarët e kanë studiuar këtë efekt duke përdorur një tub shkarkimi. Tubi i rrjedhës është një tub qelqi i mbushur me gaz me një pllakë metalike në të dy skajet. Nëse ka një diferencë mjaft të madhe të tensionit midis dy pllakave metalike, atomet e gazit brenda tubit do të thithin energji të mjaftueshme për të bërë që disa nga elektronet e tyre të shkëputen, d.m.th. atomet e gazit do të jonizohen.
Atomi i hidrogjenit në teorinë e Bohr-it
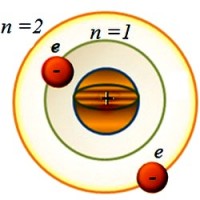
Atomi i hidrogjenit sipas Bohr
Në teorinë e tij, Bohr supozoi se bërthama e një atomi është e palëvizshme dhe elektroni rrotullohet rreth tij në një orbitë rrethore. Por shkenca moderne dihet se orbita e lejuar përgjatë së cilës lëviz elektroni nuk është fare një vijë rrethore fikse. Në fakt, ky është një rajon i caktuar i hapësirës, një shtresë e hollë koncentrike në formën e një topi, qendra e së cilës është bërthama e një atomi dhe në të cilën ka më shumë gjasa shfaqja e një elektroni. Ky rajon quhet shtresa elektronike e atomit, ose orbitale.
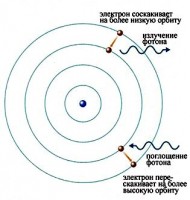
Këto elektrone fillojnë të lëvizin nëpër gaz dhe krijojnë një rrymë që ngre disa nga elektronet në atome të tjera në nivele më të larta të energjisë. Pastaj, kur elektronet në atome bien prapa, ato lëshojnë rrezatim elektromagnetik. Sasia e dritës së emetuar në gjatësi vale të ndryshme, e quajtur spektri i emetimit, tregohet për një tub të shkarkuar të mbushur me gaz hidrogjeni më poshtë. Vërehen vetëm gjatësi vale të caktuara të dritës, siç tregojnë vijat në figurë.
Në fund, shkencëtarët kuptuan se këto linja vijnë nga fotone të një energjie të caktuar të emetuar nga elektronet duke bërë kalime midis niveleve specifike të energjisë së atomit. Figura tregon një shembull të kësaj. Kur një elektron në një atom bie nga një nivel më i lartë energjie në një nivel më të ulët energjie, ai lëshon një foton për të hequr energjinë shtesë.
Një atom mund të ketë predha të shumta elektronike. Secila prej tyre karakterizohet numri kuantik kryesor n . Ai merr vlera të plota 1, 2, 3, ..., 7, ..., tregon numrin e nivelit të energjisë dhe përcakton energjinë e elektroneve të vendosura në orbitën e caktuar. Sa më e madhe të jetë vlera n , sa më larg të jetë elektroni nga bërthama dhe aq më shumë energji ka. në fizikë predha elektronike më shpesh shënohet me shkronja K, L, M, N, O, P, Q . Më afër bërthamës është te -guaskë. Për të n = 1. Elektroni që ndodhet mbi të ka vlerën më të ulët të energjisë. Për shembull, për një guaskë L n = 2, etj.
Siç kemi diskutuar më parë, frekuenca e një fotoni lidhet me energjinë e tij përmes një ekuacioni. Meqenëse një frekuencë specifike fotoni na jep një ngjyrë specifike, ne mund të shohim se si çdo linjë ngjyrash shoqërohet me një tranzicion specifik. Drita e dukshme nuk është i vetmi lloj emetuar rrezatim elektromagnetik. Tranzicionet më energjike ose më pak energjike mund të prodhojnë rrezatim ultravjollcë ose infra të kuqe. Megjithatë, duke qenë se çdo atom ka grupin e vet të niveleve të energjisë, çdo atom ka spektrin e vet të emetimit.
Atomet jo vetëm që lëshojnë fotone; ato gjithashtu thithin fotone. Nëse një foton godet një atom dhe energjia e fotonit përputhet me hendekun midis dy niveleve energjetike të elektroneve në atom, atëherë elektroni në nivelin më të ulët të energjisë mund të thithë fotonin dhe të hidhet në nivelin më të lartë të energjisë. Nëse energjia e fotonit nuk korrespondon me ndryshimin midis dy niveleve të energjisë, atëherë fotoni nuk do të absorbohet.
Por, si Bohr, le ta thjeshtojmë problemin dhe të supozojmë se elektroni rrotullohet rreth bërthamës në një orbitë rrethore. Nëse elektroni është në orbitën e parë ( n =1), atëherë quhet kjo gjendje e atomit kryesore. Ky është një gjendje e qëndrueshme. Dhe energjia e saj në këtë rast ka një vlerë minimale.
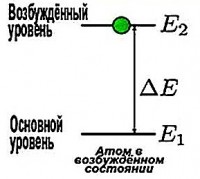
Dhe çfarë i nevojitet një elektroni për të lëvizur në një orbitë më të largët? Për ta bërë këtë, ai duhet të kapërcejë tërheqjen e një bërthame të ngarkuar pozitivisht. Dhe kjo është e mundur kur ai merr energji shtesë nga jashtë. Dhe pastaj do të jetë në orbitë me numrin n ˃ 1 (n = 2, 3, 4, ...). Në këtë rast, energjia e atomit rritet. Dhe ai shkon në një gjendje të quajtur i emocionuar.
Duke përdorur këtë efekt, nëse kemi një burim fotonesh me energji të ndryshme, mund të marrim spektra absorbimi për materiale të ndryshme. Për të marrë një spektër absorbues, thjesht ndriçoni dritën e bardhë në një mostër të materialit që ju intereson. Drita e bardhë përbëhet nga të gjitha gjatësitë e valëve të ndryshme dritë e dukshme mbledhur së bashku. Do të ketë boshllëqe në spektrin e absorbimit. Boshllëqet korrespondojnë me energjitë për të cilat ka një ndryshim përkatës në nivelet e energjisë për një element të caktuar.
Fotonet e absorbuara shfaqen si vija të zeza sepse fotonet e këtyre gjatësive valore absorbohen dhe nuk shfaqen. Për shkak të kësaj, spektri i përthithjes është reciprok i saktë i spektrit të emetimit. Shikoni dy figurat më poshtë. Në figurë mund të shihni spektrin e emetimit të linjës së hidrogjenit. Figura tregon spektrin e përthithjes. Kjo është saktësisht e kundërta e spektrit të rrezatimit! Si metodat e emetimit ashtu edhe ato të absorbimit mund të përdoren për të marrë të njëjtin informacion rreth niveleve të energjisë së një atomi.
Edhe Max Planck e kuptoi se atomet thithin ose lëshojnë energji në pjesë të përcaktuara rreptësisht, të cilat ai i quajti kuante. Dhe madhësia e kësaj energjie është proporcionale me frekuencën e dridhjeve të dritës.
Ε = ħ· ѵ ,
Vijat e errëta korrespondojnë me frekuencat e dritës që janë përthithur nga gazi. Kur fotonet e dritës absorbohen nga elektronet, elektronet lëvizin në nivele më të larta të energjisë. Ky është procesi i kundërt i rrezatimit. Linjat e errëta, linjat e absorbimit, korrespondojnë me frekuencat e spektrit të emetimit të të njëjtit element. Sasia e energjisë së absorbuar nga një elektron për të lëvizur në më shumë nivel të lartë, përkon me sasinë e energjisë së çliruar kur kthehet në nivelin fillestar të energjisë.
Kam një gaz të panjohur në një enë qelqi. Kam një parandjenjë se gazi mund të jetë hidrogjen. Çfarë jepet dhe çfarë duhet bërë? Ne kemi një linjë absorbimi në 642 nm. Kjo do të thotë se substanca në enën e qelqit thith fotone me një gjatësi vale prej 642 nm. Duhet të llogarisim se cilat 2 nivele energjetike të hidrogjenit i korrespondojnë këtij tranzicioni. Pra, ne duhet të dimë se sa energji thithën fotonet.
ku ѵ - frekuenca rrezatimi kuantik,
ħ është konstante e Planck-ut.
Dhe kur një elektron lëviz nga një orbitë e largët në një orbitë më afër bërthamës, lëshohet një kuant energjetik.
Meqenëse atomi i hidrogjenit ka vetëm një elektron, ai më së shpeshti është në gjendje të qëndrueshme në tokë ( n =1), në të cilin mund të qëndrojë për një kohë mjaft të gjatë, pa lëshuar asgjë në të njëjtën kohë. Por kjo vazhdon derisa ai të marrë një sasi shtesë energjie. Dhe pasi e ka marrë atë, elektroni hidhet në një orbitë tjetër të lejuar me një rreze më të madhe, dhe atomi shkon në një gjendje të ngacmuar. Megjithatë, ai nuk mund të qëndrojë në këtë gjendje për një kohë të gjatë. Duke u kthyer në gjendjen bazë, atomi lëshon një foton (kuantum drite). Energjia e kësaj kuantike është e barabartë me diferencën midis energjive të gjendjes së ngacmuar dhe asaj bazë.
Llogaritni energjinë e fotoneve të përthithur. Fotonet e absorbuara kishin një energji prej 3.1 × 10 -19 J. Gjeni energjinë e tranzicionit që çon në rrezatim në gjatësi vale të dukshme. Figura tregon tranzicione të ndryshme të nivelit të energjisë. Tranzicionet e lidhura me gjatësi vale të dukshme janë etiketuar si tranzicione që fillojnë ose mbarojnë në nivelin e energjisë. Le të gjejmë energjinë e këtyre tranzicioneve dhe ta krahasojmë atë me energjinë e fotoneve të përthithur, të cilën sapo e kemi llogaritur.
Energjia e kalimit nga niveli 2 i energjisë në nivelin 3. 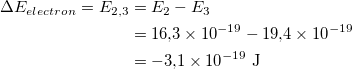
Prandaj, energjia e një fotoni që një elektron duhet të thithë për të shkuar nga niveli i energjisë 2 në nivelin e energjisë 3 është 3.1 × 10 -19 J. Kjo është e njëjta energji si fotonet e përthithur nga gazi në enë! Prandaj, meqenëse kalimet e të gjithë elementëve janë unike, mund të thuhet se gazi në enë është hidrogjen. Tranzicioni është thithja e një fotoni midis nivelit të energjisë 2 dhe nivelit të energjisë.
Pse është i rreshtuar spektri i atomit të hidrogjenit
Spektri i emetimit të një atomi hidrogjeni
Që në fillim të shekullit të 19-të, u konstatua se spektri i atomit të hidrogjenit në pjesën e dukshme përbëhet nga 4 vija të veçanta: e kuqe, jeshile, blu dhe vjollcë. Si mund të shpjegohet kjo? Në fund të fundit, ai ka vetëm një elektron.
Gjë është se kur rrezaton, një elektron mund të kërcejë, për shembull, nga orbita e katërt jo vetëm në të tretën, por edhe në të dytën dhe të parën, si dhe nga e treta në të dytën, etj.
Zbatimi i spektrave të emetimit dhe absorbimit
Energjia e një fotoni nuk korrespondon me energjinë e një niveli energjetik, ajo korrespondon me ndryshimin në energji midis dy niveleve të energjisë. Studimi i spektrave të yjeve dhe galaktikave në astronomi quhet spektroskop. Spektroskopia është një mjet i përdorur gjerësisht në astronomi për të zbuluar gjëra të ndryshme rreth objekteve astronomike.
Identifikimi i elementeve në objektet astronomike duke përdorur spektrat e tyre
Matja e spektrit të dritës nga një yll mund t'u tregojë astronomëve se nga është krijuar një yll. Për shkak se çdo element lëshon ose thith dritë vetëm në gjatësi vale të caktuara, astronomët mund të identifikojnë se cilët elementë janë në yje nga linjat në spektrat e tyre. Nga studimi i spektrave të shumë yjeve, ne e dimë se ka shumë tipe te ndryshme yje që përmbajnë elementë të ndryshëm dhe në sasi të ndryshme.
Le të supozojmë se elektroni është në orbitën e dytë. Pasi ka thithur një foton, ai lëviz në orbitën e tretë. Dhe vlera e energjisë së fotonit të zhytur është e barabartë me diferencën midis energjive të këtyre niveleve.
Ε = E 3 – E 2
Përcaktimi i shpejtësive të galaktikave duke përdorur spektroskopinë
Ju keni mësuar tashmë në Kapitullin 9 për efektin Doppler dhe se si ndryshon frekuenca. valët e zërit në varësi të faktit nëse objekti që lëshon zë po lëviz drejt ose larg jush. E njëjta gjë ndodh me rrezatimin elektromagnetik. Nëse një objekt që lëshon dritë po lëviz drejt nesh, atëherë gjatësia e valës së dritës është më e shkurtër. Nëse një objekt largohet nga ne, atëherë gjatësia e valës së dritës së tij zgjatet.
Efekti Doppler ndikon në spektrat e objekteve në hapësirë në varësi të lëvizjes së tyre në lidhje me ne në Tokë. Për shembull, drita nga një galaktikë e largët që largohet prej nesh me një shpejtësi të caktuar do të jetë e kuqe. Kjo do të thotë se linjat e emetimit dhe thithjes në spektrin e galaktikës do të zhvendosen në një gjatësi vale më të madhe. Njohja se ku do të ishte zakonisht secila linjë në spektër nëse galaktika nuk do të lëvizte dhe krahasimi i saj me pozicionin e saj të zhvendosur në të kuqe i lejon astronomët të matin me saktësi shpejtësinë e galaktikës në raport me Tokën.
Por ndryshimi i energjisë midis niveleve fqinje të energjisë nuk është vlerë konstante. Sa më larg bërthamës të jetë një elektron, aq më i vogël është ai. Prandaj, energjia e fotoneve të emetuara dhe frekuenca e rrezatimit të lëkundjeve elektromagnetike do të jenë të ndryshme. Vlera e saj mund të përcaktohet duke përdorur rregullin e frekuencës, ose postulatin e dytë të Bohr-it.
Ngrohja globale dhe gazrat serrë
Dielli lëshon rrezatim në një varg gjatësi vale, të cilat janë kryesisht në pjesën e dukshme të spektrit. Rrezatimi në këto gjatësi vale udhëton nëpër gazrat e atmosferës për të ngrohur tokën dhe oqeanet poshtë. Ajri i ngrohtë më pas e rrezaton këtë nxehtësi në gjatësi vale të gjata infra të kuqe. Dioksidi i karbonit në atmosferë ka nivele energjie që korrespondojnë me gjatësi vale infra të kuqe që e lejojnë atë të thithë rrezatimin infra të kuqe. Ai pastaj rrezaton në gjatësi vale infra të kuqe në të gjitha drejtimet.
Kur një elektron lëviz nga një orbitë m në orbitë n emetohet një sasi energjie, vlera e së cilës llogaritet nga relacioni:
Ε = ħ· ѵ = E m – E n , m ˃ n ;
ku ѵ - Frekuenca e rrezatimit kuantik,
ħ është konstante e Planck-ut.
Nga këtu ѵ = (E m – E n)/ ħ
Siç mund ta shohim, frekuenca e rrezatimit varet nga diferenca e energjisë në orbitat midis të cilave ka ndodhur kalimi. Dhe çdo frekuencë korrespondon me një vijë në spektrin e emetimit të një atomi. Kjo shpjegon praninë e linjave individuale në spektrin e atomit të hidrogjenit.
Ky efekt ndalon një sasi të madhe të rrezatimit infra të kuq që të largohet nga atmosfera, gjë që shkakton ngrohjen e atmosferës dhe tokës. Më shumë rrezatim hyn sesa kthehet. Ekuacioni i Rydberg, gjendjet kuantike, strukturë elektronike. Drita përcaktohet nga ngjyra, gjatësia e valës ose frekuenca e saj - ndonjë nga këto tre cilësi përcakton strukturën bazë të një valë drite. Valët e dritës kërcejnë rreth nesh, duke kërcyer nga miliona sipërfaqe, duke rezultuar në një numër të pafund ngjyrash. drita kalon nëpër një grilë refraktive, prizëm ose re re, drita ndahet në të gjitha ngjyrat e ylberit.
Spektri i plotë i atomit të hidrogjenit
Seria spektrale e atomit të hidrogjenit
Duhet thënë se në spektrin e emetimit të çdo gazi vërehen vija individuale spektrale ose grupe vijash të ndara ngushtë. Dhe këto rreshta nuk janë rregulluar rastësisht, por në një rend të caktuar.
Por drita që vjen nga brenda një atomi është shumë e ndryshme nga drita e reflektuar. Ne zbulojmë se drita përmban vetëm shumë pak gjatësi vale. Drita e emetuar nga atomet dhe vetitë e saj unike na japin një ide për strukturën e atomit nga i cili ai shpëton.
Në këtë eksperiment, ju do të përdorni një spektrometër për të ekzaminuar dritën e emetuar nga heliumi i ngacmuar dhe më pas nga atomet e hidrogjenit. Do të shihni se si drita e emetuar nga një element është e ndryshme nga drita natyrore përreth nesh dhe ndryshe nga drita e emetuar nga një element tjetër. Ju do të kalibroni spektrometrin tuaj me gaz helium dhe më pas përdorni spektrometrin për të matur emetimet e hidrogjenit. Ju do të llogaritni nivelet e disponueshme të energjisë në atomin e hidrogjenit dhe më pas do të përcaktoni se cilat kalime ndërmjet këtyre niveleve të kuantizuara të energjisë korrespondojnë me secilën linjë, çdo gjatësi vale, në spektrin e hidrogjenit që matni.
Përshkrimi matematikor i vendndodhjes vijat spektrale atomi i hidrogjenit është bërë nga një shkencëtar zviceran Johann Jacob Balmer në 1855

Johann Jacob Balmer
Balmer ishte një matematikan dhe besonte se kombinime të ndryshme të numrave të plotë mund të shpjegonin lidhjen e shumë dukuritë fizike. Ata thonë se një mik i Balmerit, një fizikan zviceran, ishte përfshirë në shfaqjen e një formule që ju lejon të llogaritni gjatësinë e valës së secilës prej katër linjave të dukshme të spektrit të hidrogjenit. Eduard Hagenbach-Bischoff, i cili e sfidoi atë të përshkruante linjat e kuqe, jeshile, blu dhe vjollcë të spektrit të hidrogjenit. Dhe Balmer nxori në mënyrë empirike formulën e mëposhtme:
![]()
ku λ - gjatësia e valës;
n = 3, 4, 5, 6 (kryesore numër kuantik niveli fillestar i energjisë);
b = 3645,6 Å (angstrom).
Kuptimi fizik i formulës së Balmerit në atë kohë nuk mund të shpjegohej nga askush. Dhe vetëm në vitin 1913, Niels Bohr kuptoi se numrat e plotë në formulë janë orbitat e lejuara, dhe linjat spektrale janë rezultat i kalimeve të elektroneve nga një orbitë në tjetrën.
Por doli që seritë spektrale në spektrin e rrezatimit të atomit të hidrogjenit ekzistojnë jo vetëm në pjesën e dukshme. Më vonë ato u gjetën në zonat ultravjollcë dhe infra të kuqe.
Gjatësia e valës së emetuar nga një atom hidrogjeni në intervale të ndryshme mund të llogaritet me formulën, e cila është nxjerrë në 1889 nga fizikani suedez Johannes Rydberg:
![]() ,
,
ku R ≈ 109737.3157 cm–1 (konstanta Rydberg për atomin e hidrogjenit);
λ - gjatësia e valës;
n - numri i plotë;
n" është numri i serisë spektrale, dhe n" < n .

Johannes Rydberg
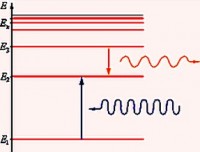
Në spektrin e emisioneve Seria Balmer vërehet gjatë kalimit të elektroneve nga nivelet e energjisë së ngacmuar në n ˃ 2 (n = 3, 4, 5,…) në nivelin e dytë të energjisë ( n" = 2). Në spektrin e absorbimit, ai formohet gjatë kalimit të elektroneve nga niveli i dytë në nivelet më të larta të energjisë.
Formula Rydberg në këtë rast merr formën:
![]()
Seria që gjendet në pjesën ultravjollcë të spektrit quhet Seriali Lyman. Ajo u zbulua në vitin 1906 nga një fizikan amerikan Theodore Lyman. Në spektrin e emetimit, kjo seri formohet gjatë kalimit të elektroneve nga nivelet e energjisë së ngacmuar në atë të parën dhe në spektrin e absorbimit, gjatë kalimit nga niveli i parë në atë më të lartë.
Formula e Rydberg për serinë Lyman:
![]()
n" = 1;
n = 2, 3, 4…
Dhe në rangun infra të kuqe, u zbuluan 4 seri: Seri Paschen, seri Bracket, seri Pfund dhe Seriali Humphrey.
Seria Paschen u zbulua në vitin 1908 nga një fizikan austriak Friedrich Paschen.
Formula Rydberg për serinë Paschen:
![]()
ku n" = 3;
n = 4, 5, 6, …
Seria e radhës u hap nga një fizikan amerikan Frederick Sumner Brackett në vitin 1922. I përgjigjet formulës Rydberg për n' = 4 dhe n = 5, 6, 7…
Seria Pfund u zbulua nga një fizikan amerikan August Hermann Pfund në vitin 1924. Për këtë seri n' = 5 dhe n = 6, 7, 8, …
Për serinë Humphrey, e hapur në 1953. fizikan amerikan Curtis Humphrey, n' = 6 dhe n = 7, 8, 9, …:
Zëvendësimi i vlerave përkatëse në formulën Rydberg n" dhe n , marrim formula për të gjitha seritë e spektrit të atomit të hidrogjenit.
Teoria e Bohr-it shpjegon modelin e linjës së spektrit të atomit të hidrogjenit dhe spektrave të atomeve të ngjashme me hidrogjenin, të cilat përfshijnë izotopet e rënda të deuteriumit dhe tritiumit, si dhe çdo jon që ka vetëm një elektron të mbetur, për shembull, një helium të jonizuar. atom. Por, për fat të keq, nuk mund të aplikohet në atome më komplekse.
Objektiv:
1. Eksploroni pjesën e dukshme të spektrit të atomit të hidrogjenit.
2. Përcaktoni konstantën e Rydbergut dhe energjinë e jonizimit të atomit të hidrogjenit.
Dispozitat kryesore teorike të veprës.
Ligjet e fizikës klasike përshkruajnë procese të vazhdueshme. Një atom i përbërë nga një bërthamë e ngarkuar pozitivisht dhe elektronet që e rrethojnë atë, sipas këtyre ligjeve, do të jetë në ekuilibër vetëm nëse elektronet lëvizin vazhdimisht rreth bërthamës në orbita të caktuara. Por nga pikëpamja e elektrodinamikës klasike, elektronet që lëvizin me nxitim rrezatojnë valë elektromagnetike, si rezultat i të cilave humbasin energjinë dhe gradualisht bien në bërthamë. Në këto kushte, frekuenca e rrotullimit të elektronit ndryshon vazhdimisht dhe spektri i emetimit të atomit duhet të jetë i vazhdueshëm. Kur një elektron godet bërthamën, atomi pushon së ekzistuari.
Me llogaritjet e thjeshta, mund të sigurohet që intervali kohor pas të cilit elektroni bie në bërthamë është 10 -11 s. Eksperimenti tregon se spektrat atomike përbëhen nga linja individuale ose grupe vijash. E gjithë kjo tregon se proceset në të cilat përfshihen mikro-objektet karakterizohen nga mosvazhdimësi (diskrete), dhe metodat e fizikës klasike, në përgjithësi, nuk janë të zbatueshme për përshkrimin e lëvizjeve brendaatomike.
Në vitin 1913, N. Bohr arriti të ndërtojë një teori konsistente që shpjegonte me sukses strukturën e atomit të hidrogjenit. Bohr zgjeroi postulatin e M. Planck (1900) mbi ekzistencën e gjendjeve stacionare të qëndrueshme të oshilatorëve (që është një parakusht i domosdoshëm për derivimin formula e saktë rrezatimi i trupit të zi) në çdo sistem atomik. Teoria e Bohr-it bazohet në dy postulate:
1. Një atom dhe sistemet atomike mund të qëndrojnë për një kohë të gjatë vetëm në gjendje të caktuara (të palëvizshme), në të cilat, pavarësisht lëvizjeve të grimcave të ngarkuara që ndodhin në to, ato nuk lëshojnë ose thithin energji. Në këto gjendje, sistemet atomike kanë energji që formojnë një seri diskrete: E 1 , E 2 , ..., E n . Këto gjendje karakterizohen nga qëndrueshmëria e tyre: çdo ndryshim i energjisë si rezultat i thithjes ose emetimit të rrezatimit elektromagnetik ose si rezultat i një përplasjeje mund të ndodhë vetëm me një kalim të plotë (kërcim) nga një gjendje në tjetrën.
2. Gjatë kalimit nga një gjendje në tjetrën, atomet lëshojnë (ose thithin) rrezatim vetëm me një frekuencë të përcaktuar rreptësisht. Rrezatimi i emetuar (ose i absorbuar) gjatë kalimit nga një gjendje me energji E m në një gjendje E n është monokromatike dhe frekuenca e tij përcaktohet nga gjendja
Të dy postulatet kundërshtojnë kërkesat e elektrodinamikës klasike. Postulati i parë thotë se atomet nuk rrezatojnë, megjithëse elektronet që e formojnë atë bëjnë lëvizje të përshpejtuar (qarkullim në orbita të mbyllura). Sipas postulatit të dytë, frekuencat e emetuara nuk kanë asnjë lidhje me frekuencat e lëvizjeve periodike të elektroneve.
Spektri i emetimit të një substance është karakteristika e tij e rëndësishme, e cila ju lejon të përcaktoni përbërjen e saj, disa karakteristika të strukturës së saj, vetitë e atomeve dhe molekulave.
Atomet e gazit lëshojnë spektra të linjës që përbëhen nga grupe të linjave individuale spektrale të quajtura seri spektrale. Spektri më i thjeshtë është ai i atomit të hidrogjenit. Tashmë në 1885, Balmer tregoi se gjatësitë e valëve të katër linjave që shtrihen në pjesën e dukshme të spektrit mund të përfaqësohen me shumë saktësi nga formula empirike
ku n = 3, 4, 5, 6,…, V është një konstante empirike.
Rregullsia e shprehur nga kjo formulë bëhet veçanërisht e dukshme nëse paraqitet në formën në të cilën përdoret zakonisht në kohën e tanishme:
![]() (3)
(3)
Sasia nganjëherë shënohet dhe quhet numri i valës spektroskopike. Konstanta quhet konstanta Rydberg. Kështu, më në fund arrijmë
![]() . (4)
. (4)
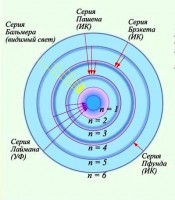
Ndërsa numri i linjës n rritet, intensiteti i linjës zvogëlohet. Diferenca midis numrave valor të linjave ngjitur gjithashtu zvogëlohet. Për n = ∞, fitohet një vlerë konstante =. Nëse paraqesim skematikisht vendndodhjen e vijave spektrale të përcaktuara nga (4) dhe përshkruajmë me kusht intensitetin e tyre me gjatësinë e vijës, marrim figurën e treguar në Fig. 1.
Bashkësia e vijave spektrale që zbulojnë në sekuencën dhe shpërndarjen e intensitetit të tyre rregullsinë e treguar në figurën 1 quhet seri spektrale. Quhet gjatësia e valës kufizuese rreth së cilës vijat trashen si n → ∞ kufiri i serisë. Seria e përshkruar me formulën (4) quhet seria Balmer.
Së bashku me serinë Balmer, një sërë serish të tjera u gjetën në spektrin e atomit të hidrogjenit, të përfaqësuara nga formula krejtësisht analoge.
Në rajonin ultravjollcë, u gjet seria Lyman:
![]() (5)
(5)
Në rajonin infra të kuqe të spektrit u gjetën
Seria Paschen
![]() (6)
(6)
Seria e kllapave
![]() (7)
(7)
Seria Pfund
![]() (8)
(8)
Seriali Humphrey
![]() (9)
(9)
Kështu, të gjitha seritë e njohura të hidrogjenit atomik mund të përfaqësohen nga të ashtuquajturat me formulën e përgjithësuar Balmer:
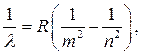 (10)
(10)
ku m në çdo seri ka një vlerë konstante, dhe n është një seri vlerash të plota duke filluar nga m+1.
Kërko sensi fizik formulat (10) çuan në krijimin teoria kuantike një atom hidrogjeni. Ekuacioni i Shrodingerit për të shkruhet si:
![]() (11)
(11)
ku Ψ(r) është funksioni valor që përshkruan gjendjen e elektronit në atom, E është energjia totale e elektronit.
Zgjidhja e këtij ekuacioni është spektri i vlerave të mundshme plot energji atomi i hidrogjenit:
![]() (12)
(12)
Sipas (1), frekuenca e kalimit ndërmjet shteteve përcaktohet nga
Nga ana tjetër, sipas formulës së njohur
Duke kombinuar (12), (13) dhe (14), marrim:
![]() (15)
(15)
përkon me formulën e përgjithësuar Balmer.
Vlera teorike e konstantës Rydberg (16) ende ndryshon ndjeshëm nga vlera eksperimentale e marrë nga matjet spektroskopike. Kjo për faktin se gjatë nxjerrjes së formulës (16), bëhen dy supozime: a) masa e bërthamës së një atomi është pafundësisht e madhe në krahasim me masën e një elektroni (prandaj simboli "∞" në përcaktimin e a konstante) dhe b) bërthama është e palëvizshme. Në realitet, për shembull, për një atom hidrogjeni, masa e bërthamës është vetëm 1836.1 herë më e madhe se masa e elektronit. Kontabilizimi për këtë rrethanë çon në formulën e mëposhtme:
ku M është masa e bërthamës atomike. Në këtë përafrim, konstanta Rydberg varet nga masa e bërthamës, dhe për këtë arsye vlerat e saj për atome të ndryshme të ngjashme me hidrogjenin ndryshojnë nga njëra-tjetra (Fig. 2).
Fig.2 Fig.3
Për të marrë të gjithë grupin e informacionit rreth atomit, është e përshtatshme të përdoret diagrami i nivelit të energjisë (Fig. 3). Vijat e drejta horizontale korrespondojnë me gjendje të ndryshme energjetike të atomit të hidrogjenit. Ndërsa numri i shtetit rritet, distanca midis niveleve fqinje zvogëlohet dhe zhduket në kufi. Mbi pikën e bashkimit është një rajon i vazhdueshëm i energjive pozitive jo të kuantizuara. Niveli zero i energjisë merret energjia e nivelit me n = ∞. Nën këtë vlerë, nivelet e energjisë janë diskrete. Ato korrespondojnë me vlerat negative të energjisë totale të atomit. Kjo rrethanë tregon se energjia e një elektroni në gjendje të tilla është më e vogël se energjia e tij në rastin kur ai ndahet nga atomi dhe qëndron në pafundësi. distancë e madhe, pra që elektroni është në gjendje të lidhur.
Prania e elektroneve të palidhura bën të mundur kalimet kuantike midis gjendjeve të spektrit të vazhdueshëm të energjisë, si dhe midis gjendjeve të tilla dhe gjendjeve të spektrit diskret të energjisë. Kjo manifestohet në formë spektri i vazhdueshëm emetimi ose thithja e mbivendosur në spektri i linjës atom. Prandaj, spektri nuk ndalet në kufirin e serisë, por vazhdon përtej tij drejt gjatësive valore më të shkurtra, ku bëhet i vazhdueshëm. Kalimet nga gjendjet e spektrit të vazhdueshëm (ato gjendje në të cilat atomi jonizohet) në gjendjet e spektrit diskret shoqërohen nga rikombinimi i një elektroni dhe jon pozitiv. Rrezatimi që rezulton quhet rikombinim.
Kalimi i një atomi nga gjendja normale në një nivel më të lartë energjie të spektrit diskret është ngacmimi i atomit. Kalimi i një atomi nga një nga nivelet e spektrit diskret në rajonin e spektrit të vazhdueshëm e kthen atomin në një sistem të palidhur. Është një proces jonizimi i atomit. Energjia që korrespondon me numrin e valës së fillimit të spektrit të vazhdueshëm nga ana e valëve të gjata (numri i valës së kufirit të serisë) duhet të jetë i barabartë me energjia e jonizimit, domethënë energjia e nevojshme për të ndarë një elektron nga një atom dhe për ta hequr atë në një distancë të pafundme. Kështu, numri i valës së kufirit të serisë Lyman jep energjinë e jonizimit të atomit të hidrogjenit në gjendjen më të qëndrueshme të tokës.
Në këtë punim, ne studiojmë katër rreshtat e parë të serisë Balmer, të cilat kanë përcaktimet e mëposhtme:
Vija e kuqe (n = 3),
Blu - linjë blu (n = 4),
Vija blu (n=5),
Vija vjollce (n = 6).






