Gjatësia valore e vijave spektrale të hidrogjenit. Minimumi absolut. Si e shpjegon teoria kuantike botën tonë
Postulatet e paraqitura nga Bohr bënë të mundur llogaritjen e spektrit të atomit të hidrogjenit dhe sisteme të ngjashme me hidrogjenin- sisteme të përbëra nga një bërthamë me ngarkesë Ze dhe një elektron (për shembull, jonet He +, Li 2+), si dhe teorikisht llogaritni konstantën e Rydberg.
Duke ndjekur Bohr-in, le të shqyrtojmë lëvizjen e një elektroni në një sistem të ngjashëm me hidrogjenin, duke u kufizuar në orbita të palëvizshme rrethore. Duke zgjidhur së bashku ekuacionin (208.1) m e v 2 /r=Zе 2 /(4 0 r 2) të propozuar nga Rutherford dhe ekuacioni (210.1), marrim një shprehje për rrezen e orbitës së palëvizshme n-të:
ku n=1, 2, 3, ... . Nga shprehja (212.1) rezulton se rrezet e orbitave rriten në raport me katrorët e numrave të plotë.
Për një atom hidrogjeni (Z=1), rrezja e orbitës së parë të elektronit në n=1, e quajtur rrezja e parë e Bohr-it(a), e barabartë

që i përgjigjet llogaritjeve të bazuara në teorinë kinetike të gazeve. Meqenëse rrezet e orbitave të palëvizshme nuk mund të maten, për të testuar teorinë është e nevojshme t'i drejtohemi sasive të tilla që mund të maten eksperimentalisht. Kjo sasi është energjia e emetuar dhe e përthithur nga atomet e hidrogjenit.
Energjia totale e një elektroni në një sistem të ngjashëm me hidrogjenin është shuma e energjisë së tij kinetike (m e v 2/2) dhe energji potenciale në fushën elektrostatike të bërthamës (-Ze 2 / (4 0 r)):

(kemi marrë parasysh që m e v 2 /2 = 1 / 2 Ze2(4 0 r) (shih.
(208.1)). Duke marrë parasysh vlerat (212.1) të kuantizuara për rrezen e orbitës së n-të të palëvizshme, marrim se energjia e elektronit mund të marrë vetëm vlerat e mëposhtme të lejuara diskrete:

ku shenja minus do të thotë që elektroni është në gjendje të lidhur.
Nga formula (212.3) rezulton se gjendjet energjetike të një atomi formojnë një sekuencë të niveleve të energjisë që ndryshojnë në varësi të vlerës P. Numër i plotë n në shprehjen (212.3), e cila përcakton nivelet e energjisë së një atomi, quhet numri kuantik kryesor. Gjendja energjetike me n=1 është bazë (normale) shteti; gjendjet me /r > 1 janë i emocionuar. Niveli i energjisë që korrespondon me gjendjen bazë të një atomi quhet bazë (normale) niveli; të gjitha nivelet e tjera janë i emocionuar.
Dhënia n vlera të plota të ndryshme, marrim për atomin e hidrogjenit

(Z=1), sipas formulës (212.3), nivelet e mundshme të energjisë, të paraqitura skematikisht në fig. 294. Energjia e atomit të hidrogjenit me rritje n rritet (vlera e saj negative zvogëlohet) dhe nivelet e energjisë i afrohen kufirit që i përgjigjet vlerës n= . Kështu, atomi i hidrogjenit ka energjinë më të ulët (E 1 = - 13,55 eV) në n= 1 dhe maksimumi (E 1 \u003d 0) në n \u003d (kur një elektron hiqet nga një atom). Prandaj, vlera E =0 korrespondon me jonizimi atom (shqyer një elektron prej tij).
Sipas postulatit të dytë të Bohr-it (shih (210.2)), gjatë kalimit të atomit të hidrogjenit (Z=1) nga gjendja e palëvizshme nMe energji më e lartë në gjendje të palëvizshme m me energji më të ulët emetohet një kuant
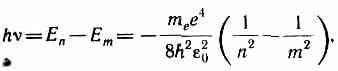
prej nga vjen frekuenca e rrezatimit

R=m e e 4 / (8 orë 3 2 0 ).
Duke përdorur në llogaritjen R vlerat moderne të konstantave universale, marrim një vlerë që përkon me vlerën eksperimentale të konstantës Rydberg në formulat empirike për atomin e hidrogjenit (shih §209). Kjo rastësi vërteton bindshëm korrektësinë e formulës së marrë nga Bohr
(212.3) për nivelet e energjisë të një sistemi të ngjashëm me hidrogjenin.
Zëvendësimi, për shembull, në formulë
(212.4) m=1 dhe n=2, 3, 4, ..., marrim një grup vijash që formojnë serinë Lyman (shih § 209) dhe që korrespondojnë me kalimet e elektroneve nga nivelet e ngacmuara (n=2, 3, 4, .. .) në atë kryesore (m=1). Në mënyrë të ngjashme, kur zëvendësohet m=2, 3, 4, 5,
6 dhe vlerat e tyre përkatëse n ne marrim serinë e Balmer, Paschen, Bracket, Pfund dhe Humphrey (disa prej tyre janë paraqitur në mënyrë skematike në Fig. 294), të përshkruara në § 209. Prandaj, sipas teorisë së Bohr-it, e cila shpjegoi në mënyrë sasiore spektrin e atomit të hidrogjenit, seritë spektrale korrespondojnë me rrezatimin që rezulton nga kalimi i atomit në një gjendje të caktuar nga gjendjet e ngacmuara të vendosura mbi atë të dhënë.
Spektri i absorbimit të atomit të hidrogjenit është i ngjashëm me vijën, por përmban vetëm serinë Lyman. Shpjegohet edhe nga teoria e Bohr-it. Meqenëse atomet e lirë të hidrogjenit janë zakonisht në gjendjen bazë (gjendje stacionare me energjinë më të ulët në n= 1), atëherë kur atomeve u jepet një energji e caktuar nga jashtë, mund të vërehen vetëm kalime
atomet nga gjendja bazë në ato të ngacmuara (lind seria Lyman).
Teoria e Bohr-it ishte një hap i madh në zhvillimin e fizikës atomike dhe ishte një hap i rëndësishëm në krijimin e mekanikës kuantike. Megjithatë, kjo teori ka kontradikta të brendshme (nga njëra anë, ajo zbaton ligjet e fizikës klasike, dhe nga ana tjetër, ajo bazohet në postulatet kuantike). Ajo ekzaminoi spektrat e atomit të hidrogjenit dhe sistemeve të ngjashme me hidrogjenin dhe llogariti frekuencat vijat spektrale, megjithatë, nuk mund të shpjegonte intensitetin e tyre dhe t'i përgjigjej pyetjes: pse ndodhin disa tranzicione? Një mangësi serioze e teorisë së Bohr-it ishte pamundësia e përdorimit të saj për të përshkruar spektrin e atomit të heliumit, një nga atomet më të thjeshtë menjëherë pas atomit të hidrogjenit.
pyetjet e testit
Pse dështoi modeli bërthamor i atomit?
Pse seria Balmer ishte e para që u studiua midis serive të ndryshme të linjave spektrale të atomit të hidrogjenit?
Cili është kuptimi i numrave m dhe n në formulën e përgjithësuar Balmer?
Sa është frekuenca e rrezatimit të atomit të hidrogjenit që korrespondon me kufirin me gjatësi vale të shkurtër të serisë Bracket?
Shpjegoni kuptimin e postulateve të Bohr-it. Si e shpjegojnë spektri i linjës atom? Në cilat pjesë të kurbës në Fig. 293 janë elastike dhe në cilat përplasje joelastike të elektroneve me atomet vërehen?
Cilat janë të dhënat kryesore që mund të nxirren nga eksperimentet e Frank dhe Hertz? Duke përdorur modelin Bohr, tregoni linjat spektrale që mund të shfaqen kur një atom hidrogjeni kalon në gjendje me n=3 dhe n=4.
Vizatoni në shkallën e gjatësisë valore tre rreshta të secilës prej dy serive të para spektrale të atomit të hidrogjenit.
Pse spektri i absorbimit të atomit të hidrogjenit përmban vetëm serinë Lyman? Tregoni se formula (212.3) mund të shkruhet si E n =-13.55/n 2, ku E shprehet në elektron volt.
Detyrat
27.1. Përcaktoni energjinë maksimale dhe minimale të fotonit në serinë ultravjollcë të spektrit të atomit të hidrogjenit (seri Lyman).
27.2. Përcaktoni gjatësinë e valës që korrespondon me kufirin e serisë Balmer.
27.3. Duke përdorur teorinë e Bohr-it, përcaktoni momentin magnetik orbital të një elektroni që lëviz përgjatë orbitës së dytë të një atomi hidrogjeni.
27.4. Duke përdorur teorinë e Bohr-it, përcaktoni ndryshimin e momentit mekanik orbital të një elektroni gjatë kalimit të tij nga gjendja e ngacmuar (n=2) në gjendjen bazë me emetimin e një fotoni me gjatësi vale =1,212 10 -7 m. L = h=1,05 10 -3 4 J s]
27.5. Përcaktoni potencialin jonizues të atomit të hidrogjenit.
27.6. Bazuar në faktin se energjia e jonizimit të atomit të hidrogjenit E i \u003d 13.6 eV, përcaktoj potencialin e dytë të ngacmimit të këtij atomi.
27.7 . Bazuar në faktin se energjia e jonizimit të atomit të hidrogjenit është £" = 13,6 eV, përcaktoni në elektron volt energjinë e fotonit që i korrespondon vijës së gjatësisë valore më të gjatë të serisë Lyman.
* I. Rydberg (1854-1919) - shkencëtar suedez, specialist në fushën e spektroskopisë.
Studimet e spektrave të emetimit të gazeve të rralluar (d.m.th., spektrat e emetimit të atomeve individuale) kanë treguar se çdo gaz ka një spektër linjash të përcaktuar mirë, i përbërë nga linja spektrale individuale ose grupe vijash të ndara ngushtë. Më i studiuari është spektri i atomit më të thjeshtë - atomi i hidrogjenit.
Shkencëtari zviceran I. Balmer (1825-1898) zgjodhi një formulë empirike që përshkruan të gjitha linjat spektrale të atomit të hidrogjenit të njohura në atë kohë në zona e dukshme e spektrit:
ku R "= 1,10 10 7 m -1 - konstanteRydberg . Meqenëse v = c/, atëherë formula
(209.1) mund të rishkruhet për frekuencat:

ku R \u003d R "c \u003d 3.29 10 15 s -1 është gjithashtu konstanta Rydberg.
Nga shprehjet (209.1) dhe (209.2) rezulton se linjat spektrale ndryshojnë në vlera të ndryshme n, formojnë një grup ose seri rreshtash të quajtur Seria Balmer. Me rritjen n linjat e serialit po afrohen; kuptimi n= përcakton kufiri i serisë, me të cilin spektri i vazhdueshëm ngjitet nga ana e frekuencave të larta.
Më vonë (në fillim të shekullit të 20-të), disa seri të tjera u zbuluan në spektrin e atomit të hidrogjenit. AT rajoni ultravjollcë i spektrit e vendosur Seriali Lyman:

AT spektri infra të kuqe u gjetën gjithashtu: Seriali Paschen
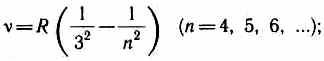
Seria e kllapave
Seria Pfund

Seriali Humphrey

Të gjitha seritë e mësipërme në spektrin e atomit të hidrogjenit mund të përshkruhen me një formulë të vetme, të quajtur me formulën e përgjithësuar Balmer:

ku m ka një vlerë konstante në secilën seri të dhënë, m= 1, 2, 3, 4, 5, 6 (përcakton serinë), n merr vlera të plota duke filluar nga m+1 (përcakton linjat individuale të kësaj serie).
Studimi i spektrave më komplekse - spektri i avujve të metaleve alkali (për shembull, Li, Na, K) - tregoi se ato përfaqësohen nga një grup linjash të rregulluara në mënyrë të parregullt. Rydberg arriti t'i ndajë ato në tre seri, secila prej të cilave është e vendosur si linjat e serisë Balmer.
Formulat serike të mësipërme u zgjodhën në mënyrë empirike dhe për një kohë të gjatë nuk kishin justifikim teorik, megjithëse u vërtetuan eksperimentalisht me saktësi shumë të lartë. Forma e mësipërme e formulave serike, përsëritja mahnitëse e numrave të plotë në to, universaliteti i konstantës Rydberg dëshmojnë për një të thellë sensi fizik gjeti rregullsi, të cilat ishte e pamundur të zbuloheshin në kuadrin e fizikës klasike.
§210. Postulatet e Bohr-it
Përpjekja e parë për të ndërtuar një teori cilësisht të re - kuantike - të atomit u bë në vitin 1913 nga fizikani danez Niels Bohr (1885-1962). Ai i vuri vetes synimin për të lidhur në një tërësi të vetme ligjet empirike të spektrave të linjës, modelin bërthamor të atomit të Radhërfordit dhe natyrën kuantike të emetimit dhe përthithjes së dritës. Bohr e bazoi teorinë e tij në dy postulate.
Postulati i parë i Bohr-it (postulati i gjendjes së palëvizshme): në një atom, ka gjendje stacionare (që nuk ndryshojnë me kalimin e kohës) në të cilat ai nuk rrezaton energji. Gjendjet stacionare të një atomi korrespondojnë me orbitat e palëvizshme përgjatë të cilave lëvizin elektronet. Lëvizja e elektroneve në orbita të palëvizshme nuk shoqërohet me emetimin e valëve elektromagnetike.
Në gjendjen e palëvizshme të një atomi, një elektron që lëviz përgjatë një orbite rrethore duhet të ketë vlera diskrete të kuantizuara të momentit këndor që plotësojnë kushtin
m e vr n = h(n= 1, 2, 3, ...), (210.1)
ku m e është masa e elektronit, v- shpejtësia e tij përgjatë orbitës së n-të të rrezes r n , h=h/(2). Postulati i dytë i Bohr-it (rregulli i frekuencës): kur një elektron lëviz nga një orbitë e palëvizshme në tjetrën, një foton emetohet (përthithet) me energji
h =E n -E m , (210.2)
e barabartë me diferencën energjetike të gjendjeve stacionare përkatëse ( E n dhe E m - përkatësisht energjitë e gjendjeve stacionare të atomit para dhe pas rrezatimit (thithjes)). Në E m < E n emetohet një foton (kalimi i një atomi nga një gjendje me energji më të lartë në një gjendje me energji më të ulët, d.m.th., kalimi i një elektroni nga një orbitë më e largët nga bërthama në një më të afërt), në E m > E n- përthithja e tij (kalimi i një atomi në një gjendje me një energji më të lartë, d.m.th., kalimi i një elektroni në një orbitë më të largët nga bërthama). Bashkësia e frekuencave të mundshme diskrete v = = (E n -E m )/h kalimet kuantike dhe përcakton spektrin e linjës së atomit.
Seritë e tij spektrale janë më të studiuarat. Ata i binden mirë formulës së Rydberg:
1 λ = R (1 n ′ 2 − 1 n 2) (\displaystyle (\frac (1)(\lambda ))=R\left((\frac (1)((n")^(2))) -(\frac (1)(n^(2)))\djathtas)),ku R= 109 677 cm −1është konstanta e Rydberg për hidrogjenin, n'- niveli kryesor i serisë.
Vijat spektrale që shfaqen gjatë kalimeve në nivelin kryesor të energjisë quhen rezonante, te tjera - vartëse.
Fizika e Serive spektrale
Atomi i hidrogjenit përbëhet nga një elektron që rrotullohet rreth bërthamës. Forca elektromagnetike midis elektronit dhe protonit të bërthamës shkakton praninë e një grupi gjendjet kuantike elektron, secila prej të cilave ka energjinë e vet. Këto gjendje përshkruhen në modelin Bohr si orbita të veçanta të elektroneve. Çdo orbitë ose gjendje korrespondon me një numër të plotë n.
Emetimi spektral ndodh kur një elektron ndryshon nga një gjendje energjie më e lartë në një gjendje më të ulët. Gjendja më e ulët e energjisë shënohet n′ dhe gjendja më e lartë e energjisë n. Energjia e fotonit të emetuar korrespondon me ndryshimin midis dy gjendjeve. Meqenëse energjia e secilës gjendje është gjithmonë e njëjtë, ndryshimi midis tyre është gjithashtu gjithmonë i njëjtë, dhe tranzicioni gjithmonë do të lëshojë një foton me energji konstante.
Vijat spektrale grupohen në seri me n'. Linjat emërtohen në mënyrë sekuenciale nga frekuenca më e ulët me shkronja greke. Për shembull, linja 2 → 1 quhet linja Lyman-alfa (Ly-α), dhe 7 → 3 Paschen-delta (Pa-δ).
Hidrogjeni ka vija që nuk hyjnë në këto seri, siç është vija 21 centimetra. Këto linja korrespondojnë me procese më të rralla në atom, siç janë tranzicionet hiperfine. Struktura e imët përfshin gjithashtu linja spektrale uniforme që shfaqen si dy ose më shumë vija të imta të grumbulluara ngushtë për shkak të efekteve relativiste.
Seriali Lyman
hapur T. Lyman në vitin 1906. Të gjitha linjat e serisë janë në rangun ultravjollcë. Seria korrespondon me formulën Rydberg për n' = 1 dhe n = 2, 3, 4, … ; linja L α = 1216 Å është vija e rezonancës së hidrogjenit. Kufiri i serisë është 911,8 Å.
Seria Balmer
Zbuluar nga I. Ya. Balmer në 1885. Katër linjat e para të serisë janë në diapazonin e dukshëm dhe ishin të njohura shumë kohë përpara Balmerit, i cili propozoi një formulë empirike për gjatësitë e tyre valore dhe mbi bazën e saj parashikoi ekzistencën e linjave të tjera të kësaj serie në rajonin ultravjollcë. Seria korrespondon me formulën Rydberg për n' = 2 dhe n = 3, 4, 5, … ; rreshti H α = 6565 Å, kufiri i serisë - 3647 Å.
Seria Paschen
Seria Brackett
Zbuluar nga F.S. Bracket në 1922. Të gjitha linjat e serisë janë në rrezen e afërt infra të kuqe. Seria korrespondon me formulën Rydberg për n' = 4 dhe n = 5, 6, 7, … ; rreshti B α = 40 522 Å. Kufiri i serisë është 14,588 Å.
Seria Pfund
Zbuluar nga A. G. Pfund në 1924. Linjat e serisë janë në intervalin e afërt (pjesë të mesit) infra të kuqe. Seria korrespondon me formulën Rydberg për n' = 5 dhe n = 6, 7, 8, … ; drejtëza Pf α = 74 598 Å . Kufiri i serisë është 22,794 Å.
Linjat spektrale të hidrogjenit
Përpjekja e parë për të shpjeguar spektrin e linjës së hidrogjenit në intervalin e dukshëm u bë në 1885 nga mësuesi i shkollës dhe matematikani Johann Balmer (1825-1898). Balmer vuri re se frekuencat f këto vija në pjesën e dukshme të spektrit mund të përshkruhen me formulë
f ~(1/2 2)-(1/n 2).
Simboli ~ do të thotë proporcional, domethënë tregon praninë e një faktori konstant, i cili diskutohet më poshtë. Në këtë ekuacion n - një numër i plotë më i madh se 2, pra 3, 4, 5, etj.
Këto vija në pjesën e dukshme të spektrit quhen seria Balmer. Më vonë, linjat u zbuluan në pjesët ultravjollcë dhe infra të kuqe të spektrit. Ata u emëruan përkatësisht seritë Lyman dhe Paschen, sipas zbuluesve të tyre - fizikan amerikan dhe spektroskopisti Theodor Lyman (1874–1954) dhe fizikani gjerman Louis Carl Heinrich Friedrich Paschen (1865–1947). Në 1888, fizikani dhe spektroskopisti suedez Johannes Rydberg (1854–1919) publikoi një formulë që përshkruante të gjitha linjat spektrale të dukshme në emetimin e një llambë me hark hidrogjeni dhe në spektrat e absorbimit të dritës diellore dhe yjore. Formula e Rydberg për frekuencën e vijave spektrale të hidrogjenit ka formën
f =R H [(1/ n 1 2)-(1/n 2 2)],
ku n 1 janë numra të plotë duke filluar nga 1, dhe n 2 - numra të tjerë të plotë që duhet të jenë më të mëdhenj n një. Kuptimi n 1 = 1 jep serinë Lyman, n 1 \u003d 2 - Balmer, n 1 \u003d 3 - Seriali i Pashen.
Konstante R H quhet konstanta Rydberg për atomin e hidrogjenit. Vlera e saj është R H=109677.6 cm-1 dhe shprehet me numrin e valëve ( cm-një). Kur përdorni këtë vlerë në formulën Rydberg, frekuencat e linjave spektrale, të përcaktuara me numra të plotë n 1 dhe n 2 shprehen me numra valorë. Për ta përkthyer rezultatin në herc, duhet të shumëzoni vlerën që rezulton me shpejtësinë e dritës, domethënë me 3 10 10 cm/sek. Për të gjetur gjatësinë e valës së një linje spektrale, duhet të merret reciproku i frekuencës së shprehur në numrin e valëve, domethënë të ndajmë një me frekuencën e shprehur në numrin e valëve. Për shembull, nëse n 1 = 2, dhe n 2 = 3, atëherë
f =R H[(1/2 2)-(1/3 2)] = R H[(1/4)-(1/9)] = 1,52 10 4 cm -1
është frekuenca e shprehur si numër i valëve. Reciproku i këtij numri është 6.56 10 -5 cm = 656 10 -9 m = = 656 nm. Pra, gjatësia e valës është 656 nmështë vija e kuqe në serinë Balmer e paraqitur në Fig. 9.2.
Kur diskutohet Fig. 8.7 është diskutuar tashmë në lidhje me diskretitetin e tranzicioneve optike midis niveleve të energjisë kuantike për një grimcë në një kuti. Në fig. 8.7 tregon kalimet ndërmjet gjendjeve të një grimce në një kuti, në të cilën n =1 kthehet në n =2 dhe n =1 kthehet në n =3. Në këtë drejtim, nuk duhet të jetë befasi e madhe që tranzicionet optike në atomin e hidrogjenit mund të korrespondojnë me një grup diskrete frekuencash që varen nga numrat e plotë. Megjithatë, në 1888, kur u përftua formula e Rydberg, kishin mbetur edhe 12 vjet përpara se ideja e kuantizimit të niveleve të energjisë, të cilat janë të lidhura me anë të numrave të plotë sipas formulës Rydberg, mund të kuptohet si kalime optike midis energjisë diskrete. nivelet e lidhura me atomin e hidrogjenit.
Oriz. 9.3. Diagramet e disa niveleve të energjisë që gjenerojnë seritë Lyman dhe Balmer të linjave të emetimit të hidrogjenit. Shigjetat poshtë tregojnë se si drita emetohet nga hidrogjeni, si për shembull në një llambë harku. Pas përthithjes, e cila jep vija të errëta në Fig. 9.2, shigjetat do të drejtoheshin lart. Intervalet ndërmjet niveleve tregohen në mënyrë konvencionale, jo në shkallë.
Disa nga nivelet e energjisë që krijojnë seritë Lyman dhe Balmer janë paraqitur në Fig. 9.3. Këtu, shigjetat që tregojnë poshtë korrespondojnë me linjat e emetimit që vërehen në një llambë me hark hidrogjeni. Atomi i hidrogjenit, i cili fillimisht është në një nivel më të lartë energjie, përfundimisht kalon në një nivel më të ulët. Energjia ruhet përmes emetimit të një fotoni. Për të ruajtur energjinë, një foton duhet të mbajë një energji të barabartë me diferencën midis origjinalit, më të lartë niveli i energjisë dhe një nivel më të ulët të energjisë përfundimtare. Vlera më e vogël e mundshme n 1 në formulën Rydberg është e barabartë me 1, dhe n 2 duhet të jetë më shumë n një. Shigjeta e etiketuar 2–1 korrespondon me emetimin nga niveli n = 2 për nivel n =1.
Energjia tjetër më e madhe e rrezatimit në serinë Lyman merret duke shkuar nga niveli n =3 për nivel n =1. Në formulën Rydberg, vlera tjetër e mundshme për n 1 është 2 dhe n 2 duhet të jetë më shumë n një. Prandaj, energjia më e ulët e linjës së emetimit në serinë Balmer është shënuar si 3–2. Kur një atom hidrogjeni është në nivel n =3, shkon në nivel n =2, ruajtja e energjisë sigurohet nga emetimi i një fotoni me një gjatësi vale 656 nm. Kur drita bie mbi atomet e hidrogjenit, ndodh thithja, e cila mund të përshkruhet në të njëjtin diagram me shigjeta të drejtuara lart.






