Fizika molekulare. Çifte të ngopura dhe të pangopura. Objektet e avullit dhe kondensatës së avullit të ndërmarrjes
Tabela tregon vetitë termofizike të avullit të ujit në vijën e ngopjes në varësi të temperaturës. Karakteristikat e avullit janë dhënë në tabelë në intervalin e temperaturës nga 0,01 deri në 370°C.
Çdo temperaturë korrespondon me presionin në të cilin avulli i ujit është në një gjendje të ngopjes. Për shembull, në një temperaturë të avullit të ujit prej 200°C, presioni i tij do të jetë 1.555 MPa, ose rreth 15.3 atm.
Kapaciteti termik specifik i avullit, përçueshmëria termike dhe rritja e tij me rritjen e temperaturës. Dendësia e avullit të ujit gjithashtu rritet. Avulli i ujit bëhet i nxehtë, i rëndë dhe viskoz, me një kapacitet të lartë specifik të nxehtësisë, gjë që ndikon pozitivisht në zgjedhjen e avullit si bartës nxehtësie në disa lloje të shkëmbyesve të nxehtësisë.
Për shembull, sipas tabelës, ngrohje specifike avujt e ujit Cp në një temperaturë prej 20°C është e barabartë me 1877 J/(kg deg), dhe kur nxehet në 370°C, kapaciteti i nxehtësisë së avullit rritet në një vlerë prej 56520 J/(kg deg).
Tabela jep vetitë termofizike të mëposhtme të avullit të ujit në vijën e ngopjes:
- presioni i avullit në një temperaturë të caktuar f 10 -5, Pa;
- dendësia e avullit ρ″ , kg / m 3;
- entalpi specifike (masive). h″, kJ/kg;
- nxehtësia e avullimit r, kJ/kg;
- kapaciteti specifik i nxehtësisë së avullit Cp, kJ/(kg deg);
- koeficienti i përçueshmërisë termike λ 10 2, W/(m deg);
- difuziviteti termik a 10 6, m2/s;
- viskoziteti dinamik μ 10 6, Pa s;
- viskoziteti kinematik v 10 6, m2/s;
- Numri Prandtl Pr.
Nxehtësia specifike e avullimit, entalpia, difuziviteti termik dhe viskoziteti kinematik i avullit të ujit zvogëlohen me rritjen e temperaturës. Viskoziteti dinamik dhe numri Prandtl i avullit rriten në këtë rast.
Bej kujdes! Përçueshmëria termike në tabelë jepet në fuqinë 10 2 . Mos harroni të pjesëtoni me 100! Për shembull, përçueshmëria termike e avullit në një temperaturë prej 100°C është 0,02372 W/(m deg).
Përçueshmëria termike e avullit të ujit në temperatura dhe presione të ndryshme
Tabela tregon vlerat e përçueshmërisë termike të ujit dhe avullit në temperatura nga 0 në 700 ° C dhe presion nga 0,1 në 500 atm. Njësia e përçueshmërisë termike është W/(m deg).
Linja poshtë vlerave në tabelë nënkupton kalimin fazor të ujit në avull, domethënë, numrat poshtë vijës i referohen avullit, dhe sipër tij, ujit. Sipas tabelës, shihet se vlera e koeficientit dhe avullit të ujit rritet me rritjen e presionit.
Shënim: përçueshmëria termike në tabelë jepet me fuqinë 10 3 . Mos harroni të pjesëtoni me 1000!
Përçueshmëria termike e avullit të ujit në temperatura të larta
Tabela tregon vlerat e përçueshmërisë termike të avullit të ujit të disociuar në W/(m deg) në temperatura nga 1400 në 6000 K dhe presion nga 0,1 në 100 atm.
Sipas tabelës, përçueshmëria termike e avullit të ujit në temperaturat e larta rritet ndjeshëm në rajonin 3000...5000 K. Në presione të larta, koeficienti maksimal i përçueshmërisë termike arrihet në temperatura më të larta.
Bej kujdes! Përçueshmëria termike në tabelë jepet në fuqinë 10 3 . Mos harroni të pjesëtoni me 1000!
Tema “Çifte të ngopura. Lagështia ”për nxënësit e shkollës është mjaft e ndërlikuar. Pak vëmendje i kushtohet asaj në mësime, dhe fenomenet e konsideruara të ndërveprimit ndërfaqesor të lëngut-avullit janë të pazakonta.
Baza për zgjidhjen e problemeve të dhëna është ideja se lëngu dhe avulli i tij i ngopur janë në një gjendje ekuilibri dinamik, kur shpejtësitë e avullimit dhe kondensimit janë të njëjta. Presioni dhe përqendrimi i molekulave avull i ngopur varet vetëm nga temperatura e tij. Gjithashtu, për të llogaritur karakteristikat e avullit të ngopur, mund të përdorni ekuacionin Mendeleev-Claiperon.
Zakonisht në provim, detyra të tilla janë të rralla. Sidoqoftë, detyrat janë shumë interesante dhe ju lejojnë të ndjeni dallimet midis sjelljes gazet ideale dhe avujt e ngopur. Sipas mendimit tonë, pasi të keni kuptuar zgjidhjen e tyre, nuk do të keni më vështirësi në të kuptuarit e kësaj teme.
Detyra numër 1. Presioni, numri i molekulave të avullit të ngopur në një enë të mbyllur (pjesa A, niveli bazë)
Zgjidhja:
Një situatë tipike: në një vëllim të mbyllur, avulli dhe lëngu janë në ekuilibër. Edhe pa një tregues të drejtpërdrejtë në tekstin e problemit, është e qartë se avulli është i ngopur. Temperatura nuk ndryshon, që do të thotë se përqendrimi i molekulave të avullit është konstant, numri dhe masa e molekulave janë proporcionale me vëllimin. Nëse vëllimi zvogëlohet me 3 herë, numri i molekulave gjithashtu do të ulet me 3 herë.
Përgjigja numër 4.
Detyra numër 2. Presioni, masa, përqendrimi i molekulave të avullit të ngopur në një enë të mbyllur (pjesa A, niveli bazë)

Në fakt, i njëjti problem në një formulim tjetër.
Detyra numër 3. Leximet e psikrometrit (Pjesa A, vija bazë)

Zgjidhja:
Detyra është në fakt punë laboratorike për të matur lagështinë me një psikrometër, ju duhet vetëm të parashikoni leximin e llambës së lagësht.
Për të zgjidhur, lexojmë leximet e termometrave: i thatë - 23, i lagësht -16 gradë Celsius. Sipas tabelës, ne përcaktojmë se kjo korrespondon me 48% lagështi. Nëse lagështia rritet me 7% (deri në 55%), atëherë (e gjejmë në të njëjtën linjë të tabelës, në të majtë) diferenca në leximet e termometrave do të bëhet 6 gradë. Prandaj lagështia do të tregojë 23-6=17 gradë. Përgjigja numër 3.
Detyra numër 4. Presioni i avullit të ngopur në një enë të mbyllur (Pjesa A, Niveli i ngritur)

Zgjidhja:
Në një vëllim të mbyllur, avulli dhe lëngu janë në ekuilibër, prandaj, avulli është i ngopur. Ndërsa vëllimi rritet, uji do të avullojë dhe avulli do të mbetet i ngopur për aq kohë sa të jetë e mundur. Natyrisht, i gjithë uji do të avullojë dhe avulli do të mbetet i ngopur derisa vëllimi të dyfishohet (pasi masa e lëngut fillimisht është e barabartë me masën e avullit). Në këtë rast, presioni nuk ndryshon.
Me një rritje të mëtejshme të vëllimit të avullit do të pushojë së qeni i ngopur, parametrat e tij mund të përshkruhen në termat e një procesi izotermik. Një rritje e vëllimit me 2 herë të tjera do të çojë në një ulje të dyfishtë të presionit.
Në total, me një rritje të vëllimit me 4 herë në këtë sistem, presioni do të ulet me 2 herë.
Përgjigja numër 2.
Në opsionin nr. 2 të testimit provë, kishte një problem të anasjelltë, por ai mund të zgjidhej vetëm duke ditur se në 100 gradë Celsius, presioni i avullit është 100 kPa (1 atm), i cili përdoret në zgjidhjen e problemit nr.6. Kjo vlerë presioni është e lehtë për t'u mbajtur mend, duke ditur se zierja e një lëngu fillon në një temperaturë në të cilën presioni i avullit të tij të ngopur bëhet i barabartë me presionin e jashtëm.
Detyra numër 5. Varësia e presionit nga vëllimi për të ngopur dhe avujt e pangopur(pjesa C, niveli i avancuar)

Detyra numër 6. Niveli i ujit në një tub të mbyllur me avuj të ngopur (pjesa C, niveli i ngritur)
Një tub i gjerë qelqi rreth gjysmë metri i gjatë, i mbyllur në njërin skaj, mbushet plotësisht me ujë dhe vendoset vertikalisht me skajin e hapur poshtë, duke zhytur pjesën e poshtme të tubit disa centimetra në një legen me ujë. Në temperaturën e dhomës, tubi mbetet plotësisht i mbushur me ujë. Uji në legen nxehet ngadalë. Ku do të vendoset niveli i ujit në tub kur uji në legen të fillojë të vlojë? Shpjegoni përgjigjen tuaj duke përdorur ligjet fizike.
Zgjidhje.
Në temperaturën e dhomës, uji zë të gjithë vëllimin e tubit dhe nuk derdhet prej tij, sepse presioni i avullit të ujit të ngopur në temperaturën e dhomës është shumë i ulët dhe një "zbrazëti torricellian" e mbushur me avuj uji të ngopur do të shfaqet vetëm mbi ujë. nëse lartësia e kolonës së ujit është rreth 10 metra.
Ndërsa temperatura e ujit rritet, presioni i avullit të tij të ngopur rritet derisa në pikën e vlimit të barazohet me presionin e jashtëm atmosferik.
Kur temperatura i afrohet pikës së vlimit, mbi ujë do të shfaqet një zonë e mbushur me avuj uji të ngopur. Ndërsa temperatura rritet më tej, niveli i ujit në tub do të ulet. Në pikën e vlimit, presioni i avullit të ujit të ngopur në tub është i barabartë dhe presioni atmosferik, kështu që niveli i ujit në tub dhe në legen do të jetë i njëjtë.
Detyra numër 7. Masa e avullit të ngopur (pjesa A, vija bazë)

Zgjidhja:
Problemi zgjidhet lehtësisht duke përdorur ekuacionin Mendeleev-Claiperon, duke pasur parasysh se presioni i avullit të ngopur në një temperaturë të caktuar është i barabartë me atë atmosferik
Gjatë avullimit, njëkohësisht me kalimin e molekulave nga lëngu në avull, ndodh edhe procesi i kundërt. Duke lëvizur rastësisht mbi sipërfaqen e lëngut, disa nga molekulat që e lanë atë kthehen përsëri në lëng.
Presioni i avullit të ngopur.
Kur kompresohet avulli i ngopur, temperatura e të cilit mbahet konstante, fillimisht do të fillojë të prishet ekuilibri: dendësia e avullit do të rritet dhe si rezultat, më shumë molekula do të kalojnë nga gazi në lëng sesa nga lëngu në gaz; kjo do të vazhdojë derisa përqendrimi i avullit në vëllimin e ri të bëhet i njëjtë, që korrespondon me përqendrimin e avullit të ngopur në një temperaturë të caktuar (dhe të rivendoset ekuilibri). Kjo shpjegohet me faktin se numri i molekulave që largohen nga lëngu për njësi të kohës varet vetëm nga temperatura.
Pra, përqendrimi i molekulave të avullit të ngopur në temperaturë konstante nuk varet nga vëllimi i tij.
Meqenëse presioni i një gazi është proporcional me përqendrimin e molekulave të tij, presioni i një avulli të ngopur nuk varet nga vëllimi që ai zë. Presioni p 0, në të cilën lëngu është në ekuilibër me avujt e tij, quhet presioni i avullit të ngopur.
Kur avulli i ngopur kompresohet, pjesa më e madhe e tij shndërrohet në gjendje e lëngët. Një lëng zë një vëllim më të vogël se një avull me të njëjtën masë. Si rezultat, vëllimi i avullit me një densitet konstant zvogëlohet.
Varësia e presionit të avullit të ngopur nga temperatura.
Për një gaz ideal, varësia lineare presioni kundrejt temperaturës në vëllim konstant. Aplikohet në avull të ngopur me presion p 0 kjo varësi shprehet me barazinë:
p 0 =nkT.
Meqenëse presioni i avullit të ngopur nuk varet nga vëllimi, atëherë, prandaj, varet vetëm nga temperatura.
Varësia e përcaktuar eksperimentalisht p 0 (T) ndryshe nga varësia ( p 0 =nkT) për gaz ideal.
Me rritjen e temperaturës, presioni i avullit të ngopur rritet më shpejt se presioni i një gazi ideal (seksioni i kurbës AB në imazh). Kjo bëhet veçanërisht e dukshme nëse vizatojmë një izokore përmes pikës A(vija e nderprere). Kjo ndodh sepse kur lëngu nxehet, një pjesë e tij kthehet në avull dhe densiteti i avullit rritet. Prandaj, sipas formulës ( p 0 =nkT), presioni i avullit të ngopur rritet jo vetëm si rezultat i rritjes së temperaturës së lëngut, por edhe për shkak të rritjes së përqendrimit të molekulave (densitetit) të avullit. Dallimi kryesor në sjelljen e një gazi ideal dhe avullit të ngopur është ndryshimi në masën e avullit me një ndryshim të temperaturës në një vëllim konstant (në një enë të mbyllur) ose me një ndryshim në vëllim në një temperaturë konstante. Asgjë e tillë nuk mund të ndodhë me një gaz ideal (teoria molekulare-kinetike e një gazi ideal nuk parashikon tranzicioni fazor gaz në lëng).
Pas avullimit të të gjithë lëngut, sjellja e avullit do të korrespondojë me sjelljen e një gazi ideal (seksioni dielli kurba në figurën e mësipërme).
avulli i pangopur.
Nëse në një hapësirë që përmban avullin e një lëngu, mund të ndodhë avullimi i mëtejshëm i këtij lëngu, atëherë avulli në këtë hapësirë është të pangopura.
Një avull që nuk është në ekuilibër me lëngun e tij quhet i pangopur.
Avulli i pangopur mund të shndërrohet në një lëng me anë të ngjeshjes së thjeshtë. Pasi të ketë filluar ky transformim, avulli në ekuilibër me lëngun bëhet i ngopur.
Faqja 1 nga 5
7.1. Tabela 8 jep presionin e avullit të ujit që ngop hapësirën në temperatura të ndryshme. Si të bëni një tabelë nga këto të dhëna m masat e avullit të ujit në vëllim V \u003d 1 m 3 ajri i ngopur me avujt e ujit në temperatura të ndryshme Për shembull, zgjidhni problemin në një temperaturë t\u003d 50 ° C.
7.2. Gjeni densitetin p dhe avujt e ujit të ngopur në temperaturë t=50°C.

7.3. Sa herë dendësia fq dhe avujt e ujit të ngopur në një temperaturë t= 16°C më pak densitet fq ujë.

7.4. Sa densitet të ndryshëm p dhe 1 avujt e ujit të ngopur në një temperaturë t 1 \u003d 200 ° C është më i madh se dendësia p n2 avujt e ujit të ngopur në një temperaturë t 1 \u003d 100 ° C?

7.5. Çfarë është masa m avujt e ujit që përmbahen në vëllim V\u003d 1m 3 ajër në një ditë vere në një temperaturë prej t \u003d 30 ° C dhe lagështi relative w = 0,75 ?

7.6. Në një hapësirë të mbyllur V= 1 m 3 lageshtia relative ajri w = 0.6 në temperaturë t\u003d 20 ° C. Sa është masa d m uji duhet ende të avullohet nga ky vëllim në mënyrë që avulli i ujit të ngopet?

7.7. Temperatura e dhomës / g = 18 ° C, lagështia relative bashkë = 0.5 . Në një kazan metalik u hodh ujë i ftohtë, sa është temperatura tz ujë, në të cilin kazani do të ndalojë mjegullimin?


7.8. Gjeni një numër n molekulat e avullit të ujit të ngopur të përmbajtura në një njësi vëllimi në një temperaturë t 1 = 30 ° C.

7.9. Masa m=0,5 g avull uji zë vëllimin V 1\u003d 10 l në një temperaturë prej t \u003d 50 ° C, sa është lagështia relative w? Çfarë mase dm avulli do të kondensohet nëse vëllimi zvogëlohet në mënyrë izotermale nga V 1 në V 2 \u003d V 1 / 2?


7.10. Një dhomë re me një vëllim K = 1 litër përmban ajër të ngopur me avull uji. Temperatura fillestare dhoma r = 20 ° C. Kur pistoni lëvizte, vëllimi i dhomës u rrit në
V 2 = 1.25 mijë,. Zgjerimi konsiderohet adiabatik, dhe eksponenti adiabatik është 1.4. Gjeni: a) presionin e avullit të ujit përpara zgjerimit; b) masë m 1 avujt e ujit në dhomë para zgjerimit; c) dendësia p 1 e avullit të ujit përpara zgjerimit; d) temperatura t2 avulli pas zgjerimit (neglizhoni ndryshimet e temperaturës për shkak të lëshimit të nxehtësisë gjatë kondensimit të avullit); e) masë dm avull i kondensuar; f) dendësia p2 avujt e ujit
pas kondensimit; g) shkalla e mbingopjes, d.m.th. raporti i densitetit të avullit të ujit pas zgjerimit (por para kondensimit) me densitetin e avullit të ujit që ngop hapësirën në temperaturën e vendosur pas kondensimit


7.11. Gjeni vëllimin specifik v të ujit në gjendje të lëngshme dhe të avullit në kushte normale.
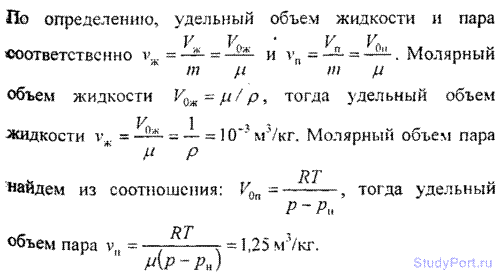
7.12. Duke përdorur ligjin e parë të termodinamikës dhe të dhënat në tabelën 7 dhe 8, gjeni nxehtësinë specifike të avullimit r ujë në t = 200 ° C. Për ujin, temperatura kritike T të= 647 K, presion kritik fq= 22 MPa. Kontrolloni korrektësinë e rezultatit të marrë sipas tabelës 9.
7.13. Cila pjesë e nxehtësisë së avullimit të ujit në një temperaturë prej t \u003d 100 ° C shkon në rritje energjia e brendshme sistemet?

7.14. Nxehtësia specifike e avullimit të benzenit (C 6 H 6) në një temperaturë t \u003d 77 ° C është e barabartë me r = 398 kJ/kg. Gjeni ndryshimin e energjisë së brendshme d W gjatë avullimit të masës dm = 20 g benzen.

7.15. Duke përdorur ekuacionin Clausius-Clapeyron dhe të dhënat në tabelën 8, gjeni nxehtësinë specifike të avullimit r
ujë në një temperaturë t = 5 ° C. Kontrolloni korrektësinë e rezultatit të marrë sipas tabelës 9.


7.16. Presioni i avullit të merkurit të ngopur në temperatura t 1 \u003d 100 ° C dhe t 2 = 120 ° C janë p 1 \u003d 37,3 Pa dhe p 2 \u003d 101,3 Pa.
Gjeni mesataren ngrohje specifike avullim r merkur në intervalin e specifikuar të temperaturës.


7.17. Pika e vlimit të benzenit (C 6 H 6) në një presion p \u003d 0,1 MPa është t k \u003d 80,2 ° C. Gjeni presionin fq avujt e ngopur të benzenit në një temperaturë t = 15,6° C. Vlera mesatare e nxehtësisë specifike të avullimit të benzenit në këtë interval të temperaturës merret e barabartë me r = 0,4 MJ/kg.

7.18. Presioni i avullit të ngopur të alkoolit etilik (C 2 H 5 OH) në temperaturat t 1 \u003d 40 ° C dhe t 2 \u003d 60 ° C janë të barabarta
p 1 =17,7 kPa dhe p 2 =67,9 kPa. Gjeni ndryshimin e entropisë dS gjatë avullimit të masës d m = 1 G alkool etilik në një temperaturë t\u003d 50 ° C.

7.19. Ndryshimi i entropisë gjatë avullimit të sasisë dv \u003d 1 mol të disa lëngjeve në një temperaturë prej t 1 \u003d 50 ° C është dS \u003d 133J / K. Presioni i avullit të ngopur në një temperaturë t 1 = 50 ° C është p 1 = 12,33 kPa. Nga sa ndryshon presioni i avullit të ngopur të një lëngu me ndryshimin e temperaturës nga t 1 = 50°C deri t1\u003d 51 0 C?


7.20. Deri në çfarë kufiri presioni fq a mund të evakuohet anija duke përdorur një pompë difuzioni të merkurit që funksionon pa një kurth merkuri nëse temperatura e xhaketës së ujit të pompës është t = 15°C? Presioni i avullit të ngopur të merkurit në një temperaturë t 0 \u003d 0 ° C është p0\u003d 0,021 Pa, vlera mesatare e nxehtësisë specifike të avullimit të merkurit në këtë interval të temperaturës merret e barabartë me r = 10,08 MJ/kt.
PËRKUFIZIM
avujt e ujit- kjo është gjendje e gaztë ujë.
Nuk ka ngjyrë, shije, erë. Uji është substanca më e zakonshme në natyrë. Përveç ekzistimit si gaz, ai mund të jetë edhe në gjendje të lëngët ose të ngurtë (akulli), secila prej të cilave përcaktohet nga temperatura dhe presioni (Fig. 1).
Oriz. 1. Diagrami i gjendjes së ujit.
Kurba AO korrespondon me ekuilibrin në sistemin e avullit të akullit, DO - me ekuilibrin në sistemin e avullit të tepërt të ftohtë, kurba OC - me ekuilibrin në sistemin ujë-avull, dhe kurba OB - me ekuilibrin në sistemi i ujit me akull. Në pikën O, të gjitha kthesat kryqëzohen. Kjo pikë quhet pikë e trefishtë dhe korrespondon me ekuilibrin në sistemin akull-ujë-avull.
Formula empirike e avullit të ujit përkon me formulën empirike të ujit dhe ka formën 2 O. Siç dihet, pesha molekulare e një molekule është e barabartë me shumën e masat atomike atomet që përbëjnë molekulën (vlerat e masave atomike relative të marra nga Tabela Periodike e D.I. Mendeleev janë të rrumbullakosura në numra të plotë).
Mr(H2O) = 2×Ar(H) + Ar(O);
Mr(H 2 O) \u003d 2 × 1 + 16 \u003d 2 + 16 \u003d 18.
Masa molare (M) është masa e 1 mol të një substance.Është e lehtë të tregohet se vlerat numerike të masës molare M dhe masës molekulare relative Mr janë të barabarta, megjithatë, vlera e parë ka dimensionin [M] = g/mol, dhe e dyta është pa dimension:
M = N A × m (1 molekulë) = N A × M r × 1 a.m.u. = (N A ×1 amu) × M r = × M r .
Do të thotë se masë molare avulli i ujit është 18 g/mol.
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Sa gram zink kanë reaguar me acid klorhidrik nëse krijohen 0,5 g gaz hidrogjen? |
| Zgjidhje | Shkruajmë ekuacionin e reaksionit për bashkëveprimin e zinkut me acidin klorhidrik: Zn + 2HCl \u003d ZnCl 2 + H 2. Le të gjejmë masën molare të hidrogjenit molekular (vlera e masës atomike relative, e marrë nga Tabela Periodike e D.I. Mendeleev, do të rrumbullakoset në një numër të plotë). Dihet se M \u003d Mr, që do të thotë (H 2) \u003d 2 × Ar (H) \u003d 2 × 1 \u003d 2 g / mol. Llogaritni sasinë e substancës së hidrogjenit: n(H)=m(H)/ M(H); n (H) \u003d 0,5 / 2 \u003d 1 mol. Sipas ekuacionit të reaksionit n (H 2) : n (Zn) \u003d 1: 1, që do të thotë se n (Zn) \u003d 1 mol. Le të gjejmë masën molare të zinkut (vlera e masës atomike relative, marrë nga Tabela Periodike e D.I. Mendeleev, e rrumbullakosur në një numër të plotë). Dihet se M = Mr, që do të thotë (Zn) = 65 g/mol. Përcaktoni masën e zinkut: m(Zn) = n (Zn) × M (Zn); m(Zn) = 1 × 65 = 65 g. |
| Përgjigju | Masa e zinkut është 65 g. |
SHEMBULL 2
| Ushtrimi | Sa masë e oksidit të bakrit (II) nevojitet për të marrë 128 g bakër prej tij kur reduktohet me hidrogjen? |
| Zgjidhje | Ne shkruajmë ekuacionin për reduktimin e oksidit të bakrit (II) me hidrogjen: CuO + H 2 \u003d Cu + H 2 O. Le të gjejmë masën molare të bakrit (vlera e masës atomike relative, marrë nga Tabela Periodike e D.I. Mendeleev, e rrumbullakosur në një numër të plotë). Dihet se M = Mr, që do të thotë (Cu) = 64 g/mol. Llogaritni sasinë e substancës së bakrit: n(Cu)= m(Cu)/M(Cu); n (Cu) \u003d 128/ 64 \u003d 2 mol. Sipas ekuacionit të reaksionit n(Cu) :n(CuO) = 1: 1, pra n(CuO) = 2 mol. Le të gjejmë masën molare të oksidit të bakrit (II) (vlerat e masave atomike relative të marra nga Tabela Periodike e D.I. Mendeleev janë të rrumbullakosura në numra të plotë). Siç dihet, masa molare e një molekule është e barabartë me shumën e masave atomike relative të atomeve që përbëjnë molekulën (M = Mr): M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 g/mol. Le të përcaktojmë masën e oksidit të bakrit (II): m(CuO) = n(CuO) × M(CuO); m(CuO) \u003d 2 × 80 \u003d 160 g. |
| Përgjigju | Masa e oksidit të bakrit (II) është 160 g |






