Gaz la solid. Structura corpurilor solide, lichide și gazoase - Knowledge Hypermarket
Stabilirea unei ordini ideale în aranjarea atomilor, adică formarea unui corp solid, este împiedicată de mișcările termice, caracteristica principală care este, după cum știm, aleatorie, dezordine. Prin urmare, pentru ca o substanță să fie în stare solidă, temperatura ei trebuie să fie suficient de scăzută - atât de scăzută încât energia mișcărilor termice să fie mai mică decât energie potențială interacțiunile atomilor.
Un cristal complet ideal, în care toți atomii sunt în echilibru și au o energie minimă, corpul poate fi doar atunci când zero absolut. De fapt, toate substanțele devin solide cu mult mai mult temperaturi mari. Singura excepție este heliul, care rămâne lichid chiar și la zero absolut, dar acest lucru se datorează unor efecte cuantice, pe care le vom discuta pe scurt mai jos.
O substanță se poate schimba din stare lichidă în stare solidă, precum și din stare gazoasă. În ambele cazuri, o astfel de tranziție este o tranziție de la o stare lipsită de simetrie la o stare în care există simetrie (aceasta, în orice caz, se referă la ordinea pe distanță lungă care există în cristale, dar nu există nici în lichid, nici în substanțe gazoase) . Prin urmare, trecerea la starea solidă trebuie să aibă loc brusc, adică la o anumită temperatură, spre deosebire de tranziția gaz-lichid, care, după cum știm, poate avea loc și continuu.
Luați în considerare mai întâi transformarea lichidului- solid. Procesul de formare a unui corp solid în timpul răcirii unui lichid este procesul de formare a cristalului (cristalizarea), (și are loc la o anumită temperatură, temperatura de cristalizare sau solidificare. Deoarece energia scade în timpul unei astfel de transformări, este însoțită de eliberarea de energie sub formă de căldură latentă de cristalizare.Transformarea inversă este topirea - are loc și brusc la aceeași temperatură și este însoțită de absorbția de energie sub formă
căldura de fuziune egală ca mărime cu căldura de cristalizare.
Acest lucru se vede clar din graficul temperaturii lichidului de răcire în funcție de timp, prezentat în Fig. 179 (curba a). Secțiunea 1 a curbei a oferă cursul unei scăderi monotone a temperaturii lichidului datorită eliminării căldurii din acesta. Secțiunea orizontală 2 arată că, la o anumită temperatură, scăderea acesteia se oprește, în ciuda faptului că îndepărtarea căldurii continuă. După un timp, temperatura începe să scadă din nou (secțiunea 3). Temperatura corespunzătoare secțiunii 2 este temperatura de cristalizare. Căldura degajată în timpul cristalizării compensează îndepărtarea căldurii din substanță și, prin urmare, scăderea temperaturii se oprește temporar. După încheierea procesului de cristalizare, temperatura, acum a unui corp solid, începe din nou să scadă.
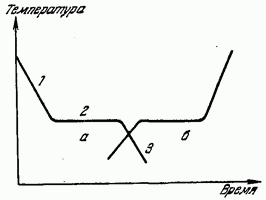
Un astfel de curs al graficului de scădere a temperaturii este tipic pentru corpuri cristaline. La răcirea lichidelor care nu cristalizează (substanțe amorfe), căldură latentă nu iese in evidenta iar curba de racire este o curba monotona fara a opri racirea.
În procesul invers al tranziției unei substanțe din stare solidăîn lichid (topire) pe curba de încălzire, există și o oprire a creșterii temperaturii, datorită absorbției căldurii latente de topire - căldură, din cauza căreia rețeaua cristalină este distrusă (curba din Fig. 179). ).
Pentru a începe cristalizarea, este necesară prezența unui centru sau centrelor de cristalizare. Astfel de centre ar putea fi acumulări aleatorii de particule lichide lipite unele de altele, la care s-ar putea alătura tot mai multe particule, până când întregul lichid s-a transformat într-un corp solid. Cu toate acestea, formarea unor astfel de acumulări în lichidul însuși este împiedicată de mișcările termice, care le distrug chiar înainte de a avea timp să dobândească dimensiuni vizibile. Cristalizarea este mult facilitată dacă în lichid sunt prezente încă de la început particule solide suficient de mari sub formă de particule de praf și corpuri, care devin centre de cristalizare.
Formarea centrelor de cristalizare în lichidul însuși este facilitată, desigur, odată cu scăderea temperaturii. Prin urmare, cristalizarea unui lichid pur, lipsit de formațiuni străine,
începe de obicei la o temperatură ceva mai mică decât temperatura reală de cristalizare. În condiții normale, într-un lichid de cristalizare există multe centre de cristalizare, astfel încât multe cristale cresc împreună în lichid, iar substanța solidificată se dovedește a fi policristalină.
Numai în condiții speciale, care sunt de obicei dificil de furnizat, se poate obține un singur cristal - un singur cristal care crește dintr-un singur centru de cristalizare. Dacă, în acest caz, sunt prevăzute aceleași condiții pentru acumularea particulelor pentru toate direcțiile, atunci cristalul este obținut corect fațetat în funcție de proprietățile sale de simetrie.
Tranziția lichid-solid, precum și transformarea inversă, este o tranziție de fază, deoarece starea lichidă și solidă pot fi considerate ca două faze ale unei substanțe. Ambele faze la temperatura de cristalizare (topire) pot intra in contact una cu cealalta, fiind in echilibru (gheata, de exemplu, poate pluti in apa fara sa se topeasca), la fel ca un lichid si vaporii sai saturati pot fi in echilibru.
Așa cum punctul de fierbere depinde de presiune, temperatura de cristalizare (și punctul său de topire echivalent) depinde și de presiune, de obicei crescând odată cu creșterea presiunii. Crește deoarece presiunea externă aduce atomii împreună, iar pentru a distruge rețeaua cristalină în timpul topirii, atomii trebuie îndepărtați unul de celălalt: la mai multa presiune aceasta necesită o energie mai mare a mișcărilor termice, adică o temperatură mai mare.
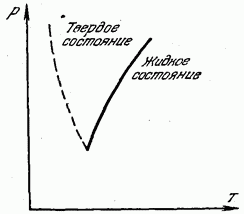
Pe fig. 180 prezintă o curbă a temperaturii de topire (cristalizare) în funcție de presiune. Curba solidă împarte întreaga regiune în două părți. Zona din stânga curbei corespunde stării solide, iar zona din dreapta curbei corespunde stării lichide. Orice punct situat pe curba de topire în sine corespunde echilibrului fazelor solide și lichide: la aceste presiuni și temperaturi, substanța în stare lichidă și solidă este în echilibru, în contact una cu cealaltă, iar lichidul nu se întărește, iar solidul nu se topește.
Linia punctată din fig. 180 prezintă curba de topire pentru acele câteva substanțe (bismut, antimoniu, gheață, germaniu) în care, în timpul solidificării, volumul nu scade, ci crește. Astfel de
substanțelor, desigur, punctul de topire scade odată cu creșterea presiunii.
Modificarea punctului de topire este legată de modificarea presiunii prin relația Clausius-Clapeyron:
![]()
Aici, este temperatura de topire (cristalizare) și sunt, respectiv, volumele molare ale fazelor lichide și solide și căldura molară de fuziune.
Această formulă este valabilă și pentru alte tranziții de fază. În special, pentru cazul evaporării și condensării, formula Clausius-Clapeyron a fost derivată în Cap. VII [vezi (105,6)].
Din formula Clapeyron-Clausius, se poate observa că semnul modificării temperaturii de topire cu o modificare a presiunii este determinat de care dintre cele două valori sau mai multe. Abruptul curbei depinde și de valoarea căldurii latente de tranziție; cu cât temperatura este mai mică, cu atât temperatura de topire se schimbă mai puțin cu presiunea. În tabel. 20 arată valorile căldurii de fuziune specifice (adică pe unitatea de masă) pentru unele substanțe.
Tabelul 20 (vezi scanare) Căldura specifică topirea unor substante
Ecuația Clausius-Clapeyron poate fi scrisă și sub această formă:
![]()
Această ecuație arată modul în care presiunea sub care se află ambele faze de echilibru se modifică odată cu temperatura.
Un solid poate fi format nu numai prin cristalizarea unui lichid, ci și prin condensarea unui gaz (vapor) într-un cristal, ocolind faza lichidă. În acest caz, se eliberează și căldura latentă de tranziție, care, totuși, este întotdeauna mai mare decât căldura latentă de fuziune. La urma urmei, formarea unui solid la o anumită temperatură și presiune poate avea loc atât direct din starea gazoasă, cât și prin lichefiere preliminară, în ambele
cazuri, stările inițiale și finale sunt aceleași. Înseamnă că diferența de energie a acestor stări este aceeași. Între timp, în al doilea caz, în primul rând, căldura latentă de condensare este eliberată în timpul trecerii de la starea gazoasă la starea lichidă și, în al doilea rând, căldura latentă de cristalizare în timpul trecerii de la starea lichidă la starea solidă. Rezultă că căldura latentă în formarea directă a unui solid din faza gazoasă trebuie să fie egală cu suma căldurilor de condensare și cristalizare din lichid. Acest lucru se aplică numai căldurilor măsurate la punctul de topire. La temperaturi mai scăzute, căldura de condensare din gaz crește.
Procesul invers de evaporare a unui solid se numește de obicei sublimare sau sublimare. Evaporarea particulelor dintr-un solid formează vapori deasupra acestuia, exact în același mod ca și când se evaporă un lichid. La anumite presiuni și temperaturi, vaporii și solidul pot fi în echilibru. Vaporii aflati in echilibru cu un solid se mai numesc abur saturat. Ca și în cazul unui lichid, elasticitate abur saturat deasupra unui solid depinde de temperatură, scăzând rapid odată cu scăderea temperaturii, astfel încât pentru multe solide la temperaturi obișnuite presiunea vaporilor saturați este neglijabilă.
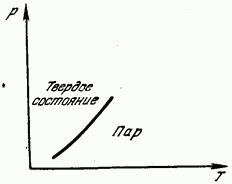
Pe fig. 181 arată curba presiunii vaporilor saturați în funcție de temperatură. Această curbă este linia de echilibru dintre faza solidă și cea gazoasă. Regiunea din stânga curbei corespunde stării solide, din dreapta acesteia, stării gazoase. Sublimarea, precum și topirea, sunt asociate cu distrugerea rețelei și necesită cheltuirea energiei necesare pentru aceasta. Această energie se manifestă ca căldură latentă de sublimare (sublimare), egală, desigur, cu căldura latentă de condensare.Căldura de sublimare este deci egală cu suma căldurilor de topire și vaporizare.
Majoritatea substanțelor care pot rămâne în trei 
stări: lichid, solid și gazos. Aceste stări se numesc stări agregate.
 O substanță trece de la o stare la alta atunci când este încălzită sau răcită, precum și atunci când presiunea se schimbă.
O substanță trece de la o stare la alta atunci când este încălzită sau răcită, precum și atunci când presiunea se schimbă.
Știți deja că dacă încălzești apă până la punctul de fierbere, se va transforma în aburi. Adică va merge la stare gazoasă. Există o teorie care explică proprietățile tuturor celor trei stări.
Se numește cinetică și se bazează pe afirmația că particulele se mișcă în compoziția materiei.
Teoria cinetică.
 Majoritatea ipotezelor din știință nu sunt acceptate până când nu sunt dovedite, ci sunt considerate adevărate doar pentru că explică anumite fenomene. Explicați proprietățile solide, lichide și corpuri gazoase, pe baza energiei particulelor care se află în compoziția lor, dă teoria cinetică. Particulele unui corp solid sunt situate foarte aproape unele de altele, sunt legate de forța de atracție și nu pot fi eliberate. Ele oscilează doar în jurul centrului. Dar de îndată ce începem să încălzim corpul, energia particulelor sale va începe să crească. Atunci se pot desprinde unul de celălalt. Solidul începe să se topească și să curgă. Particulele de gaz au și mai multă energie și sunt situate la o distanță și mai mare unele de altele. Încălzirea vă permite să creșteți energia particulelor, acestea se mișcă mai repede și corpul trece în altul starea de agregare.
Majoritatea ipotezelor din știință nu sunt acceptate până când nu sunt dovedite, ci sunt considerate adevărate doar pentru că explică anumite fenomene. Explicați proprietățile solide, lichide și corpuri gazoase, pe baza energiei particulelor care se află în compoziția lor, dă teoria cinetică. Particulele unui corp solid sunt situate foarte aproape unele de altele, sunt legate de forța de atracție și nu pot fi eliberate. Ele oscilează doar în jurul centrului. Dar de îndată ce începem să încălzim corpul, energia particulelor sale va începe să crească. Atunci se pot desprinde unul de celălalt. Solidul începe să se topească și să curgă. Particulele de gaz au și mai multă energie și sunt situate la o distanță și mai mare unele de altele. Încălzirea vă permite să creșteți energia particulelor, acestea se mișcă mai repede și corpul trece în altul starea de agregare.
Mișcarea browniană.
 Biologul englez Robert Brown a examinat în 1927 particulele de polen plasate într-un lichid la microscop.
Biologul englez Robert Brown a examinat în 1927 particulele de polen plasate într-un lichid la microscop.
A observat că se mișcau în zig-zag, dar nu și-a putut explica.
Această mișcare aleatorie a moleculelor se numește mișcare bruniană. Explicația a fost dată mai târziu de Albert Einstein.
El a afirmat că particulele plasate într-un lichid se mișcă din cauza ciocnirii unor molecule în mișcare, dar invizibile.
 Schimbarea de stat.
Schimbarea de stat.
Pe măsură ce temperatura crește, energia particulelor corpului crește și atinge punctul de topire.Apoi există o rupere a legăturilor dintre particule și corpul se topește.
De exemplu, parafină dintr-o lumânare. Când este încălzit, curge în jos, în timp ce se răcește, se solidifică din nou în stare solidă.
Cu o încălzire suplimentară, punctul de fierbere este atins, iar particulele sunt complet eliberate de legătura reciprocă, iar lichidul se transformă în vapori.
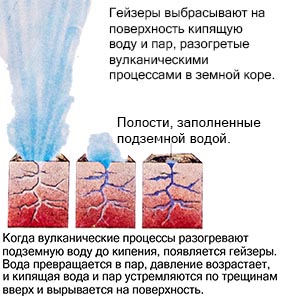 Un exemplu este un gheizer, care, încălzit prin procese vulcanice, ejectează apă clocotită și abur la suprafață. Dar când se răcește, are loc procesul invers. Gazul se condensează și devine lichid, iar lichidul, răcindu-se mai departe, îngheață, transformându-se într-un solid.
Un exemplu este un gheizer, care, încălzit prin procese vulcanice, ejectează apă clocotită și abur la suprafață. Dar când se răcește, are loc procesul invers. Gazul se condensează și devine lichid, iar lichidul, răcindu-se mai departe, îngheață, transformându-se într-un solid.
Dioxidul de carbon se poate schimba de la starea solidă la starea gazoasă, ocolind starea lichidă.
Lipsa apei pe Marte se explică prin presiunea atmosferică neglijabilă.
Apa de acolo fierbe imediat și se evaporă. Pentru diferite substanțe, trecerea la o altă stare are loc la temperaturi diferite.
De asemenea, puteți modifica punctul de topire și de fierbere prin adăugarea unor impurități la substanță sau prin modificarea presiunii.
Numim presiunea atmosferei pământului presiune atmosferică.
 |
 |
 Tensiune de suprafata.
Tensiune de suprafata.
Ai văzut cum pășătorii de apă merg calm pe suprafața rezervorului.
Nu se scufundă și se pot mișca pe suprafața apei atât cât doresc.
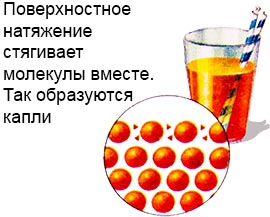 Acest lucru este posibil deoarece lichidul are un strat de tensiune superficială.
Acest lucru este posibil deoarece lichidul are un strat de tensiune superficială.
Moleculele acestui strat sunt mult mai puternic legate decât în adâncimea lichidului.
Acest lucru creează un fel de peliculă pe suprafața lichidului și, de asemenea, formează picături.
Iar greutatea striderului de apă pur și simplu nu este suficientă pentru a-l sparge.
Evaporare.
 Lichidul se evaporă în mod constant, chiar și atunci când nu este încălzit. Acest lucru se datorează faptului că energia moleculelor de la stratul de suprafață este mult mai mare și acest lucru permite moleculelor să se desprindă de suprafață, adică să se evapore.
Lichidul se evaporă în mod constant, chiar și atunci când nu este încălzit. Acest lucru se datorează faptului că energia moleculelor de la stratul de suprafață este mult mai mare și acest lucru permite moleculelor să se desprindă de suprafață, adică să se evapore.
Pe măsură ce se evaporă, temperatura lichidului scade. Acest lucru este valabil mai ales atunci când o persoană transpiră.
Picăturile de apă de pe piele se evaporă, iar pielea se răcește.
Gaze.
 Un gaz este o substanță care nu are volum sau formă fixă. Conform teoriei cinematice, energia moleculelor de gaz este suficientă pentru a rupe legăturile și, zburând separat, umple întregul volum din jurul lor.
Un gaz este o substanță care nu are volum sau formă fixă. Conform teoriei cinematice, energia moleculelor de gaz este suficientă pentru a rupe legăturile și, zburând separat, umple întregul volum din jurul lor.
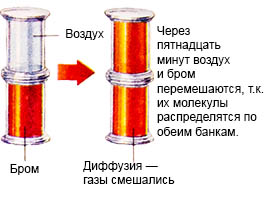
Acest proces se numește difuzie.
Cantitatea de presiune a gazului depinde de cât de puternic lovesc moleculele de gaz pereții vasului. Dacă, fără modificarea temperaturii, volumul gazului este redus prin reducerea volumului vasului, atunci presiunea acestuia va crește, deoarece moleculele de gaz vor lovi mai des pereții vasului.Sau dacă pompați o nouă porție de gaz.
Când sunt încălzite, moleculele de gaz se mișcă mai repede și mai departe, gazul se extinde și devine mai puțin dens. Dacă, prin încălzirea unui gaz, pentru a-i limita volumul, atunci presiunea va începe să crească.
 |
 |
Volumul, masa și densitatea.
Volumul este cantitatea de spațiu pe care o ocupă un corp lichid sau solid. Volumul se măsoară în metri cubi. Pentru a afla volumul de lichid, trebuie să-l turnați într-un recipient de măsurare. Volumul unui corp solid forma corectă sunt recunoscute după volumul de lichid deplasat de acesta din vas. Volumul unui corp solid de forma corectă - conform formulei.
Pe o parte a cântarului așezăm corpul de cântărit, pe cealaltă - un corp cu o masă cunoscută. Masa unui corp solid, lichid sau gazos ne spune câtă materie conține. Masa se măsoară în kilograme și grame. Este necesar să înțelegem diferența dintre masă și greutate - mărimea forței gravitaționale care acționează asupra corpului.
 |
 |
 După densitate, putem judeca cât de strâns sunt „asamblate” particulele care alcătuiesc corpul. De exemplu, moleculele de metal sunt mai apropiate între ele decât moleculele de hârtie.
După densitate, putem judeca cât de strâns sunt „asamblate” particulele care alcătuiesc corpul. De exemplu, moleculele de metal sunt mai apropiate între ele decât moleculele de hârtie.
Aceasta înseamnă că densitatea metalului este mai mare. Densitatea se calculează prin împărțirea masei unui corp la volumul său și se măsoară în kilograme pe metru cub (kg/m3).
Există un dispozitiv pentru măsurarea densității unui lichid - un hidrometru. Într-un lichid dens, plutește aproape de suprafață, deoarece greutatea sa poate deplasa doar un volum mic de lichid.
COMBINA UTILUL CU PLACUTUL!
 Acest experiment arată efectul forței de tensiune superficială. Turnați bou pur într-o farfurie și adăugați puțină pudră, cum ar fi talcul.
Acest experiment arată efectul forței de tensiune superficială. Turnați bou pur într-o farfurie și adăugați puțină pudră, cum ar fi talcul.
Picurați săpun lichid în mijloc. Ce se întâmplă?
Săpunul distruge tensiune de suprafata, adică forță de atracție între molecule. Moleculele situate în apropierea pereților sunt mai strâns legate între ele, astfel încât toată pulberea din farfurie s-a adunat în lateral.
Combustibilii minerali din scoarța terestră sunt concentrați sub formă de acumulări de carbon (diferiți cărbuni și șist) și hidrocarburi (zăcăminte de petrol și gaze). În știință și practică, ideea este ferm stabilită că acumulări de hidrocarburi cu o greutate moleculară mai mare de 60 se află în scoarța terestră în stare lichida, iar cele mai ușoare - în gaze.
Cu toate acestea, oamenii de știință sovietici academicianul A. A. Trofimuk, membru corespondent al Academiei de Științe a URSS N. V. Chersky, doctor stiinte tehnice F. A. Trebin, Yu. F. Makogon, candidat la științe tehnice și V. G. Vasiliev, candidat la geologie și mineralogie conditii termodinamice trec în scoarța terestră în stare solidă și formează depozite de hidrat de gaz și cu o concentrație incomparabil mai mare de gaz pe unitate de volum a mediului poros decât în depozitele de gaz obișnuite.
Gazul trece în stare solidă în scoarța terestră, conectându-se cu apa de formare la presiuni hidrostatice și temperaturi relativ scăzute - până la +25°. Studii experimentale a arătat că, la aceleași presiuni, un depozit de hidrat de gaz conține de câteva ori mai mult gaz decât un depozit de gaz convențional cu volum egal, deoarece un volum de apă, atunci când trece în stare de hidrat, leagă până la 220 de volume de gaz, în timp ce cel obișnuit solubilitatea gazului în apă nu depășește două până la patru volume, iar pentru gheață este și mai mică.
Caracteristicile fizice ale unui rezervor de hidrat de gaz sunt foarte diferite de caracteristicile fizice ale unui rezervor de gaz convențional. Conductivitatea electrică a unui astfel de zăcământ este mult mai mică decât cea a unui zăcământ convențional, ceea ce face posibilă dezvoltarea de noi metode de interpretare a caracteristicilor geofizice pentru a identifica depozitele de hidrat de gaz din scoarța terestră, precum și utilizarea acestor proprietăți pentru a crea noi procese (separarea gazelor, stocarea unor volume mari de gaz la presiuni joase etc.).
Procesul de formare a unui depozit de hidrat de gaz poate fi însoțit de o scădere semnificativă a presiunii rezervorului (sub hidrostatică), o reducere a dimensiunii zăcământului și, în prezența afluxului de gaz și apă, o creștere semnificativă a rezervelor de gaze în depozitul.
Zonele de depozite de hidrați de gaz sunt concentrate în principal în zonele de permafrost și zona comuna, unde se pot găsi astfel de zăcăminte, este mai mult de 50% din teritoriu Uniunea Sovietică, aproximativ un sfert din pământul planetei noastre și mai mult de 90% din oceane.
Unul dintre cercetători, șeful Departamentului de Geologie al Ministerului Industriei Gazelor din URSS, V. G. Vasiliev, a spus: „Aceasta este o rezervă importantă de gaze naturale care va multiplica resursele energetice și chimice ale țării noastre. , se presupune că sub fundul Oceanului Mondial există și zăcăminte de gaze în stare.Logica raționamentului oamenilor de știință este următoarea: fundul oceanului se află sub presiunea apei cu o presiune de 300-500 atm, iar la o astfel de presiune, temperaturile scăzute din interiorul Yakutian nu mai sunt necesare pentru formarea hidraților.Deoarece oceanul acoperă cea mai mare parte a planetei, iar permafrostul ocupă o parte semnificativă a pământului, atunci se poate presupune că starea solidă a gazului nu este o excepție, ci o regulă.
În ce mod pot fi extrași hidrații din subteran fără a construi mine? Cercetătorii au propus să transfere metanul dintr-o stare solidă într-o stare gazoasă direct în rezervor, apoi să-l „selecteze” folosind puțuri convenționale. Există mai multe moduri de a face acest lucru. Dacă presiunea din puț este redusă artificial sau temperatura din rezervor este crescută, acest lucru va face ca hidratul să se descompună, iar gazul liber se va ridica prin conducte. Dar cel mai promițător, cred oamenii de știință, este să acționeze asupra apei cu un catalizator care accelerează eliberarea moleculelor de gaz din strânsoarea puternică a moleculelor de apă. Concentrația de gaz în rezervor este prea mare, iar această forță titanică trebuie eliberată cu grijă.
Este posibil să vorbim astăzi despre exploatarea industrială a zăcămintelor de hidrați de gaz? Membru corespondent al Academiei de Științe a URSS N. V. Chersky răspunde la această întrebare: „Multe sute de mii de metri cubi de gaz extrași din formațiunile de hidrați de gaz ale câmpului Messoyakhskoye din Arctica”, spune el, „au ajuns deja la mineritul Norilsk. și combinatul metalurgic. Costul gazului este aproximativ același. Ca de obicei, au fost deja descoperite peste 30 de zăcăminte de gaz solid. Oamenii de știință de la Moscova, Novosibirsk și Yakutsk lucrează la problemele dezvoltării și utilizării lor raționale."
>>Structura corpurilor solide, lichide și gazoase
Trimis de cititorii de pe site-uri de internet
bibliotecă de fizică, lecții de fizică, program de fizică, rezumate ale lecțiilor de fizică, manuale de fizică, teme gata făcute
Conținutul lecției rezumatul lecției suport cadru prezentarea lecției metode accelerative tehnologii interactive Practică sarcini și exerciții ateliere de autoexaminare, traininguri, cazuri, quest-uri teme pentru acasă întrebări discuții întrebări retorice de la elevi Ilustrații audio, clipuri video și multimedia fotografii, imagini grafice, tabele, scheme umor, anecdote, glume, benzi desenate, pilde, proverbe, cuvinte încrucișate, citate Suplimente rezumate articole jetoane pentru curioase cheat sheets manuale de bază și glosar suplimentar de termeni altele Îmbunătățirea manualelor și lecțiilorcorectarea erorilor din manual actualizarea unui fragment din manualul elementelor de inovare la lecție înlocuirea cunoștințelor învechite cu altele noi Doar pentru profesori lecții perfecte planul calendaristic pentru anul instrucțiuni programe de discuții Lecții integrateStarea de agregare a unei substanțe se numește de obicei capacitatea sa de a-și menține forma și volumul. O caracteristică suplimentară o reprezintă modalitățile prin care o substanță trece de la o stare de agregare la alta. Pe baza acesteia, se disting trei stări de agregare: solid, lichid și gazos. Proprietățile lor vizibile sunt următoarele:
Un corp solid își păstrează atât forma, cât și volumul. Poate trece atât într-un lichid prin topire, cât și direct într-un gaz prin sublimare.
- Lichid - pastreaza volumul, dar nu forma, adica are fluiditate. Lichidul vărsat tinde să se răspândească la infinit pe suprafața pe care este turnat. Un lichid poate trece într-un solid prin cristalizare și într-un gaz prin evaporare.
- Gaz - nu păstrează nici formă, nici volum. Gazul din afara oricărui container tinde să se extindă la nesfârșit în toate direcțiile. Numai gravitația îl poate împiedica să facă acest lucru, datorită căruia atmosfera pământului nu se risipește în spațiu. Un gaz trece într-un lichid prin condensare, iar direct într-un solid poate trece prin precipitare.
Tranziții de fază
Tranziția unei substanțe de la o stare de agregare la alta se numește tranziție de fază, deoarece sinonimul științific pentru starea de agregare este faza materiei. De exemplu, apa poate exista în fază solidă (gheață), lichidă (apa obișnuită) și gazoasă (abur).
Exemplul apei demonstrează bine și sublimarea. Rufele agățate în curte pentru a se usuca într-o zi geroasă fără vânt îngheață imediat, dar după un timp se dovedește a fi uscată: gheața se sublimează, transformându-se direct în vapori de apă.
De regulă, tranziția de fază de la solid la lichid și gaz necesită încălzire, dar temperatura mediului nu crește: energie termală merge să rupă legăturile interne din substanță. Aceasta este așa-numita căldură latentă de tranziție de fază. Când invers tranziții de fază(condensare, cristalizare) se eliberează această căldură.
De aceea arsurile cu abur sunt atât de periculoase. Când vine în contact cu pielea, se condensează. Căldura latentă de evaporare/condens a apei este foarte mare: în acest sens, apa este o substanță anormală; De aceea viața pe Pământ este posibilă. În timpul unei arsuri cu abur, căldura latentă a condensului apei „opărește” foarte profund locul ars, iar consecințele unei arsuri cu abur sunt mult mai severe decât cele de la o flacără pe aceeași zonă a corpului.
Pseudofaze
Fluiditatea fazei lichide a unei substanțe este determinată de vâscozitatea acesteia, iar vâscozitatea este determinată de natura legăturilor interne, cărora le este dedicată următoarea secțiune. Vâscozitatea unui lichid poate fi foarte mare, iar un astfel de lichid poate curge imperceptibil către ochi.
Exemplul clasic este sticla. Nu este un solid, ci un lichid foarte vâscos. Vă rugăm să rețineți că foile de sticlă din depozite nu sunt niciodată depozitate sprijinite oblic de perete. În câteva zile, se vor lăsa sub propria greutate și vor deveni inutilizabile.
Alte exemple de corpuri pseudo-solide sunt pasul de pantofi și bitumul de construcție. Dacă uiți bucata unghiulară de bitum de pe acoperiș, peste vară se va întinde într-o prăjitură și se va lipi de bază. Corpurile pseudo-solide se pot distinge de cele reale prin natura topirii: cele reale fie își păstrează forma până când se răspândesc dintr-o dată (lipire la lipire), fie plutesc, dând afară bălți și pâraie (gheață). Și lichidele foarte vâscoase se înmoaie treptat, ca aceeași smoală sau bitum.
Lichidele extrem de vâscoase, a căror fluiditate nu este vizibilă de mulți ani și decenii, sunt materiale plastice. Capacitatea lor ridicată de a-și păstra forma este oferită de greutatea moleculară uriașă a polimerilor, multe mii și milioane de atomi de hidrogen.
Structura fazelor materiei
În faza gazoasă, moleculele sau atomii unei substanțe sunt foarte îndepărtate, de multe ori mai mari decât distanța dintre ele. Ele interacționează între ele ocazional și neregulat, doar în timpul coliziunilor. Interacțiunea în sine este elastică: s-au ciocnit ca niște mingi dure și s-au împrăștiat imediat.
Într-un lichid, moleculele/atomii „se simt” în mod constant unul pe altul datorită legăturilor foarte slabe de natură chimică. Aceste legături se rup tot timpul și sunt imediat restaurate din nou, moleculele lichidului se mișcă în mod constant unele față de altele și, prin urmare, lichidul curge. Dar pentru a-l transforma într-un gaz, trebuie să rupeți toate legăturile deodată, iar acest lucru necesită multă energie, motiv pentru care lichidul își păstrează volumul.
În acest sens, apa diferă de alte substanțe prin faptul că moleculele sale dintr-un lichid sunt conectate prin așa-numitele legături de hidrogen, care sunt destul de puternice. Prin urmare, apa poate fi un lichid la o temperatură normală pentru viață. Multe substanțe cu o greutate moleculară de zeci și sute de ori mai mare decât cea a apei, în condiții normale, sunt gaze, ca cel puțin gazul obișnuit de uz casnic.
Într-un solid, toate moleculele sale sunt ferm pe loc datorită puternicului legături chimiceîntre ele, formând o rețea cristalină. Cristalele de forma corectă necesită condiții speciale pentru creșterea lor și, prin urmare, se găsesc rar în natură. Majoritatea solidelor sunt conglomerate de cristale mici și minuscule - cristalite, strâns legate prin forțe de natură mecanică și electrică.
Dacă cititorul a văzut, de exemplu, o semiosie crăpată a unei mașini sau un grătar din fontă, atunci boabele de cristalite de pe resturi sunt vizibile cu un simplu ochi. Iar pe fragmente de porțelan spart sau vase de faianță, acestea pot fi observate sub lupă.
Plasma
Fizicienii disting, de asemenea, a patra stare agregată a materiei - plasma. Într-o plasmă, electronii sunt desprinși din nuclee atomiceși este un amestec de particule încărcate electric. Plasma poate fi foarte densă. De exemplu, un centimetru cub de plasmă din interiorul stelelor pitice albe cântărește zeci și sute de tone.
Plasma este izolată într-o stare separată de agregare, deoarece interacționează activ cu câmpuri electromagnetice deoarece particulele sale sunt încărcate. LA spatiu liber plasma tinde să se extindă, răcindu-se și transformându-se într-un gaz. Dar sub influența câmpurilor electromagnetice, își poate păstra forma și volumul în afara vasului, ca un corp solid. Această proprietate a plasmei este utilizată în reactoarele de putere termonucleare - prototipuri ale centralelor electrice ale viitorului.






