Descoperirea protonului. Modelul proton-electronic al nucleului
Fig.131
Unitatea de expunere a ratei dozei în SI coulomb pe kilogram pe secundă.
Unitate în afara sistemului - radiografie pe oră. 1 R ç
h = 7,17 C ç
kg s. Rata dozei de expunere 1 Р ç
h corespunde ratei de doză absorbită 8,77 10 -3 Gy ç
3600 s \u003d 2,44 10 - -6 Gy ç
Cu.
9. Efectul biologic al radiațiilor radioactive a fost descoperit și a început să fie studiat deja în primii ani de la descoperirea radioactivității. Odată cu începutul utilizării armelor atomice în 1945, și apoi utilizarea pașnică a energiei atomice, aceste studii au devenit deosebit de intensive. Principalele caracteristici ale acțiunii biologice a radiațiilor sunt următoarele:
A.Tulburările profunde ale activității vitale sunt cauzate de cantități neglijabile de energie. Deci, energia absorbită de corpul unui mamifer sau al unei persoane atunci când este iradiată cu o doză letală, dacă ar fi transformată în căldură, ar duce la încălzirea corpului cu doar 0,001 ° C.
b.Radiațiile dăunează aparatului ereditar, efectul său afectează nu numai individul iradiat, ci și urmașii acestuia.
în. Daunele cauzate de radiații sunt latente (ascunse) în natură . Nu apare imediat, ci după ceva timp.
Interacțiunea radiațiilor cu un obiect biologic se caracterizează prin doza echivalenta
D e = kD, Unde D- doza absorbita k- așa-zisul factor de calitate. Valoare k cu atât mai periculos această specie radiații pentru un organism viu. Pentru β
- și
g-razele k= 1, pentru neutroni lenți k= 3, pentru neutroni și protoni rapizi k= 10, pentru fragmente de fisiune nucleară k = 20.
Unitatea de doză echivalentă în SI sievert(Sv), 1 Sv = 1 J ç kg.
Până de curând, doza echivalentă era măsurată în termeni de rems. Baer este o abreviere a expresiei echivalentul biologic al rad. 1 rem = 0,01 Sv, 1 Sv = 100 rem.
§optsprezece. Problema structurii nucleului atomic
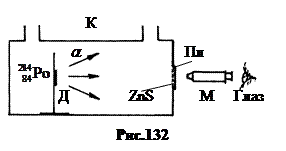 1. Descoperirea protonului .
În 1919 Ernst Rutherford a fost pionier în conversia artificială a nucleelor de azot. Schema de instalare este prezentată în Fig.132. Preparatul de poloniu alfa-activ a fost aplicat pe suportul D din interiorul cuvei K. Scintilații A-particulele au putut fi observate pe o placă de sticlă Pl cu pulbere de ZnS printr-un microscop M. Particulele alfa au o energie de 7,58 MeV și o cale liberă în aer la presiune normală de aproximativ 7 cm.presiunea gazului în celulă A-particulele ar putea ajunge pe placa Pl si sa provoace scintilatii pe aceasta. La presiune normală și ridicată A-particulele nu au ajuns pe placa Pl.
1. Descoperirea protonului .
În 1919 Ernst Rutherford a fost pionier în conversia artificială a nucleelor de azot. Schema de instalare este prezentată în Fig.132. Preparatul de poloniu alfa-activ a fost aplicat pe suportul D din interiorul cuvei K. Scintilații A-particulele au putut fi observate pe o placă de sticlă Pl cu pulbere de ZnS printr-un microscop M. Particulele alfa au o energie de 7,58 MeV și o cale liberă în aer la presiune normală de aproximativ 7 cm.presiunea gazului în celulă A-particulele ar putea ajunge pe placa Pl si sa provoace scintilatii pe aceasta. La presiune normală și ridicată A-particulele nu au ajuns pe placa Pl.
Cuva a fost umplută cu diferite gaze, după care s-au observat scintilații A-particulele la presiuni joase si disparitia lor odata cu cresterea presiunii.
Când cuva a fost umplută cu azot N2, s-au observat scintilații pe placa de Pl chiar și la presiuni mai mari decât cea limitativă. Pentru că A-particulele nu au putut ajunge la fosfor, a rămas să se facă presupunerea că în procesul de interacțiune A-particule cu nuclee de azot s-au născut alte particule ionizante.
Impunerea câmpurilor electrice și magnetice a făcut posibilă stabilirea faptului că o nouă particulă care se naște are sarcină pozitivă, egală în valoare absolută cu sarcina electronului și o masă aproximativ egală cu masa hidrogenului. Evident, acesta este nucleul unui atom de hidrogen, ca A-particulă - nucleul unui atom de heliu.
În anii 1910, a fost propusă ideea că nucleele tuturor elementelor chimice constau din nuclee de hidrogen - adică nucleele celui mai simplu, primul element din tabel. Prin urmare, Rutherford a numit noua particulă "proton", din greaca. protos- primul. (Chiar mai devreme, în 1815, o idee similară cu privire la compoziția elementelor chimice a fost exprimată de chimistul William Prout).
Patrick Blackett a continuat în 1925 experimentele cu azot folosind o cameră cu nori îmbunătățită de el (vezi p. 132). El a automatizat filmarea urmelor cețoase de particule ionizante cu două camere simultan din direcții diferite. Acest lucru a făcut posibilă reconstruirea formei spațiale a traiectoriilor particulelor. După ce a revizuit 23.000 de fotografii, a stabilit că A-particula din ciocnire este absorbită de nucleul de azot, după care acest nou nucleu ejectează un proton. Luând în considerare conservarea sarcinii și a masei, o reacție nucleară poate fi scrisă după cum urmează: ![]() Rutherford, 1919 Descoperirea protonului (18.1)
Rutherford, 1919 Descoperirea protonului (18.1)
Energia protonilor în experimentele lui Rutherford a fost de aproximativ 6 MeV, iar lungimea căii a fost de 28 cm.
2. Proprietăţile protonului. Proton în stare liberă - grajd particulă elementară , nucleul unui atom de hidrogen. În reacțiile nucleare, este adesea notat cu simbolul . masa de protoni m p de aproape 2000 de ori masa unui electron pe mine, m p = 1836pe mine\u003d 1,67239 10 -27 kg.
Învârti, adică propriul moment unghiular un proton este la fel cu un electron. Proiecția sa pe axa fizică poate lua doar două valori, L sz =±ћ/ 2. Învârtiți număr cuantic s un proton, ca un electron, este un număr întreg, . Prin urmare, sistemul de protoni, ca și sistemul de electroni, este descris Statistica Fermi-Dirac.
Momentul de spin magnetic al protonului. După cum sa menționat deja în §2, în teoria lui Bohr despre atomul de hidrogen, momentul magnetic orbital al unui electron în starea de energie cea mai scăzută ( n= 1) este egal cu J ç Tl (vezi f. 2.18). La un nivel de energie mai ridicat, momentul magnetic intră n ori mai mult unde n– numărul nivelului, M n = n M unu . Se numește valoarea minimă a momentului magnetic magneton Bohr. Acesta este momentul magnetic minim din fizica învelișurilor de electroni ale atomilor. Prin urmare, magnetonul Bohr este folosit ca unitate de măsură pentru momentele magnetice ale electronilor.
Din experimentele lui Stern și Gerlach privind divizarea fasciculelor atomice într-un câmp magnetic neomogen, a rezultat că momentul magnetic de spin al unui electron este egal cu magnetonul Bohr. Prin urmare, după descoperirea protonului, a fost firesc să presupunem că momentul magnetic de spin al protonului este determinat de formula magnetonului Bohr, în care în loc de masa electronului pe mine ar trebui să stea masa de protoni m p. ![]() J ç
Tl. (18,2)
J ç
Tl. (18,2)
valoarea M Eu chem magneton nuclear. Este de 1836 de ori mai mic decât magnetonul Bohr și este folosit ca unitate de măsură pentru momentele magnetice în fizica nucleară.
Dar măsurătorile au arătat că momentul magnetic de spin al protonului este de 2,79 ori mai mare decât magnetonul nuclear și este ![]() J ç
Tl. (18,3)
J ç
Tl. (18,3)
3. Reacții nucleare cu emisie de protoni observate mai târziu în timpul bombardării A-particule de bor, fluor, sodiu, aluminiu si fosfor.
observa asta A-particulele pot interactiona eficient doar cu nucleele usoare. Pentru a depăși repulsia electrică a nucleului, A-particula trebuie să aibă energie cinetică E, nu mai puțin decât energia potențială necesară pentru reacția de apropiere de nucleu. ![]() (18.4)
(18.4)
De aici puteți găsi numărul maxim Z element al cărui nucleu este disponibil pentru
A-particule cu energie E. ![]() . (18.5)
. (18.5)
Raza miezului m. Pentru A-particule cu energie E≈ 10 MeV, obținem
Acesta este un număr supraestimat. După cum arată experimentele, interacțiunea eficientă
A-particulele cu nuclee este reală numai pentru elementele cu Z≤ 20, adică până la calciu.
4. Descoperirea neutronului. Până în 1930, s-a dovedit că unele elemente, de exemplu, Be, Li, O 2, atunci când sunt arse A-particulele nu emit protoni. Prin urmare, a apărut întrebarea: ce se întâmplă atunci când sunt bombardate A-particule nucleul nu emite un proton?
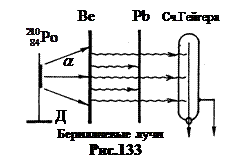 În 1930 Walter Bothe și Hans Becker stabiliți un experiment, a cărui schemă este prezentată în Fig. 133. Pe suportul D a fost plasat A- medicament activ. Particularitatea sa este că a experimentat A- dezintegrarea nucleului poloniului -210 se transformă în nucleul unui izotop stabil de plumb. Prin urmare, prepararea poloniului-210 nu dă nicio altă radiație. Energie A-particulele y este mai mică decât y, este de 5,25 MeV. Dar pentru a pătrunde în nucleele beriliului ușor ales pentru experimente, care are Z= 4, a fost suficient.
În 1930 Walter Bothe și Hans Becker stabiliți un experiment, a cărui schemă este prezentată în Fig. 133. Pe suportul D a fost plasat A- medicament activ. Particularitatea sa este că a experimentat A- dezintegrarea nucleului poloniului -210 se transformă în nucleul unui izotop stabil de plumb. Prin urmare, prepararea poloniului-210 nu dă nicio altă radiație. Energie A-particulele y este mai mică decât y, este de 5,25 MeV. Dar pentru a pătrunde în nucleele beriliului ușor ales pentru experimente, care are Z= 4, a fost suficient.
Se temea că nucleele care nu emit protoni emit alte radiații care nu dau fulgerări în sulfură de zinc ZnS. Prin urmare, ecranul cu sulfură de zinc a fost înlocuit cu un contor Geiger. Acțiunea sa se bazează pe faptul că o particulă nucleară care zboară în contor ionizează gazul din ea. Ca urmare, în circuitul contorului apare un impuls de curent (pentru mai multe detalii despre contorul Geiger, vezi p. 130).
Când este iradiat A-particule de plăci din beriliu, bor, litiu, după cum a arătat experiența, apar un fel de radiație, care provoacă descărcări slabe ale contorului Geiger. Beriliul a dat radiații deosebit de puternice. Aceste beriliu razele au avut un efect de penetrare extraordinar: o placă de plumb de 2 cm grosime le-a redus intensitatea cu doar 14%.
Amândoi și Becker au sugerat că razele de beriliu sunt foarte dure g-quanta. Prin absorbția în plumb, s-a constatat că energia lor este de 7 MeV. Dar energie A-particulele a fost de 5,25 MeV. De unde a venit impulsul de energie?
În 1931, Irene și Frederic Joliot-Curie. Plasând foi de parafină în loc de plăci de plumb, ei au descoperit că protonii erau emiși din parafină sub acțiunea razelor de beriliu, a căror gamă maximă în aer era de 26 cm. Acest interval corespundea unei energii protonice de 4,5 MeV.
Parafinele sunt hidrocarburi saturate cu formula generala CnH2n+2. În ele număr mare atomi de hidrogen. Apariția protonilor în timpul iradierii parafinei cu raze de beriliu a fost interpretată de Curies ca urmare a împrăștiere Compton g-quanta pe protoni - nucleele atomilor de hidrogen. Protonul de recul se deplasează înainte când este împrăștiat g cuantumul este reflectat înapoi, θ
= π
. De aici ![]() Unde m p este masa protonului, λ
0 este lungimea de undă a beriliului g-quanta. Energie E a protonului eliminat ar trebui să fie egal cu pierderea de energie g-cuantică, (18,6)
Unde m p este masa protonului, λ
0 este lungimea de undă a beriliului g-quanta. Energie E a protonului eliminat ar trebui să fie egal cu pierderea de energie g-cuantică, (18,6)
Să presupunem că 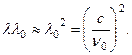 Apoi
Apoi 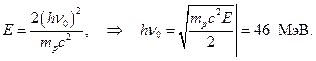
Deci, energia beriliului g-quanta, calculată din absorbția în plumb, 7 MeV, din energia protonilor scoși din parafină - 46-48 MeV. Mai mult, se dovedește că α -particulele cu o energie de 5,25 MeV sunt eliminate g-cuantică cu energie 46-48 MeV!
În 1932, a fost inclus în studiul naturii razelor de beriliu. James Chadwick. Schema instalării sale nu era practic diferită de schema lui Bothe și Becker, doar că în locul contorului Geiger, el, ca și Curie, a folosit o cameră de ionizare. Chadwick a investigat împrăștierea razelor de beriliu nu numai de către parafină, ci și de către alte substanțe. Energie g-cuantele măsurate din energia nucleelor de recul de azot s-au dovedit a fi egale cu hν= 150 MeV.
Deci, ipoteza conform căreia sunt razele de beriliu g-quanta, a dus la rezultate contradictorii. În funcție de metoda de măsurare, energia g-quanta a fost diferită și s-a ridicat la 7, 48, 150 MeV. Aceasta a dovedit incorectitudinea acestei ipoteze.
În același 1932, Chadwick a ajuns la concluzia că radiația de beriliu este flux de particule neutre pe care l-a chemat neutroni. Simbolul pentru neutroni este . Reacția nucleară de producție de neutroni poate fi scrisă după cum urmează:
![]() Reacția de descoperire a neutronilor, 1930-32 .
(18.7)
Reacția de descoperire a neutronilor, 1930-32 .
(18.7)
Chadwick a făcut și primele măsurători ale masei neutronului. S-a dovedit că masa neutronului este aproape de masa protonului. Valoarea exactă a masei neutronilor a fost obținută din bilanțul de masă al diferitelor reacții nucleare care implică neutroni.
5. Proprietăţile neutronului. neutroni liberi - particulă elementară instabilă, care se descompune într-un proton, un electron și un electron antineutrin. ![]() (18.8)
(18.8)
Durata medie de viață a neutronilor τ ≈ 16 minute. Masa unui neutron este ceva mai mare decât masa unui proton și este m n = 1838 pe mine\u003d 1,6760 10 -27 kg. Spinul neutronilor este ħç 2. Prin urmare, neutronii, precum electronii și protonii, sunt descriși Statistica Fermi-Dirac.
Raportul dintre momentele magnetice de spin ale protonului și neutronului este
M p cM n = - 3ç
2. „Minus” înseamnă că direcțiile momentelor intrinseci mecanice și magnetice ale neutronului sunt opuse.
Puterea mare de penetrare a neutronilor se datorează lipsei lor de sarcină electrică. Neutronii practic nu interacționează cu învelișurile de electroni ale atomilor și, spre deosebire de aceasta A-particulele si protonii nu se resping din nuclee. Prin urmare, chiar și la energii scăzute, neutronii se pot apropia de nucleele atomice și pot fi capturați de aceștia.
Pentru înregistrarea neutronilor rapizi se folosesc ciocnirile elastice ale acestora cu nucleele de hidrogen. Datorită egalității practice a maselor protonului și neutronului, în timpul impactului elastic al unui neutron cu un proton staționar, cea mai mare parte a energiei cinetice a neutronului este transferată acestuia din urmă. Ca urmare, neutronul se oprește practic, iar protonul se mișcă în aceeași direcție cu o energie apropiată de energia inițială a neutronului. Pe parcurs, protonul produce ionizare intensă și, prin urmare, poate fi înregistrat de o cameră de ionizare, un contor Geiger sau o cameră cu nori.
După mai multe ciocniri succesive cu nucleele atomice, neutronii rapizi renunță la excesul de energie și efectuează ulterior o mișcare haotică cu viteze termice. Pentru astfel de neutroni termici, metoda de înregistrare descrisă mai sus prin împrăștiere pe nucleele atomilor de hidrogen este nepotrivită. În acest caz, se folosesc reacții nucleare, în care un neutron, pătrunzând în nucleu, duce la o evadare din acesta din urmă. A particule de înaltă energie. De exemplu, ![]() (18.10)
(18.10)
6. Problema structurii nucleului. Până la începutul anilor 30 ai secolului XX. Au fost descoperite următoarele elemente structurale ale atomului: electron, 1897, Thomson; proton, 1919 Rutherford;
neutroni, 1932 Chadwick. Descoperirea radioactivității și observarea primelor reacții nucleare au făcut urgentă întrebarea: cum este aranjat nucleul atomic?
În primul rând, a devenit evident că nucleul unui atom nu poate fi reprezentat ca o minge formată din niște cărămizi nucleare imobile. Nucleul unui atom este foarte un volum mic de spațiu în care elementele nucleare se mișcă. Adică, este un sistem de obiecte nucleare care se mișcă și interacționează conform unor legi încă necunoscute.
În primul rând, a fost necesar să se răspundă la întrebarea: din ce particule este format nucleul. Din punct de vedere istoric, au fost luate în considerare două opțiuni: nuclee proton-electron și proton-neutron.
A.Nucleu proton-electron. Înainte de descoperirea neutronului în 1930 Paul Dirac a analizat ideea lui Prout că toate elementele chimice sunt compuse din hidrogen. Aplicată la problema structurii nucleului, această idee s-a rezumat la faptul că toate nucleele elementelor constau din nucleele atomului de hidrogen, adică din protoni. (Izotopul hidrogenului deuteriu a fost descoperit doar 2 ani mai târziu). Dar aceasta înseamnă că numărul de serie al elementului din tabelul periodic trebuie să fie egal cu numărul său de masă. Dar nu există astfel de elemente în tabel. Helium are deja un număr de serie Z= 2 și numărul de masă DAR= 4. Ca și cum din 4 protoni din nucleu, 2 sunt neutralizați. Se poate presupune că nucleul de heliu conține 4 protoni și 2 electroni. Dar în acest caz, există contradicții cu principiul incertitudinii Heisenberg. Într-adevăr, incertitudinea impulsului în nucleu, exprimată din relația de incertitudine pentru impulsul coordonate este: (18.11)
Dar incertitudinea coordonatei Δ X nu poate fi mai mare decât raza miezului, cel puțin Δ X≈ r 0 . Din experimentele lui Rutherford din 1909 r 0 ≈ 10 –15 m. Impulsul unui electron din nucleu nu poate fi mai mic decât incertitudinea impulsului, ![]() și viteza sa minimă din formula relativistă (18.12)
și viteza sa minimă din formula relativistă (18.12)
Aici pe mine este masa în repaus a electronului. După calcule, obținem v = 0,99998c, Unde Cu este viteza luminii. Calculat prin formula relativistă energie kinetică electronul din nucleu este 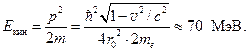
Dar electronii emiși din nucleu la β -dezintegrare, au o energie în 10 MeV. O astfel de discrepanță izbitoare este foarte greu de găsit o explicație convingătoare.
A doua dificultate a modelului proton-electron al nucleului se numește catastrofa azotului. Esența sa este următoarea.
Din divizarea hiperfină a spectrelor atomice, a fost posibil să se calculeze momentul magnetic nuclee atomice. S-a dovedit a fi de aproximativ 1000 de ori mai mic decât momentul magnetic de spin al electronului. Dacă în nucleu există un număr par de electroni, atunci un moment magnetic atât de mic al nucleului poate fi explicat prin faptul că electronii din nucleu formează perechi cu spini opuși, deci momentul magnetic al nucleului este alcătuit din momentele protonilor. Iar momentul magnetic al protonului este de 658 de ori mai mic decât momentul electronului.
Dar în nucleul unui atom de azot trebuie să existe 14 protoni și 7 electroni. Dacă 6 electroni formează perechi cu spini opuși, atunci un electron rămâne nepereche. Acest electron nepereche ar trebui să furnizeze nucleului de azot același moment magnetic pe care îl are, adică de 1000 de ori mai mult decât nucleele cu un număr par de electroni. Dar asta nu este. Momentul magnetic al nucleului de azot este de același ordin cu cel al altor nuclee.
b.Nucleul proton-neutron. La mai puțin de șase luni de la descoperirea neutronului, aproape simultan și independent unul de celălalt Dmitri Ivanenko și Werner Heisenberg sugerat proton-neutron compoziția miezului. Modelul proton-neutron al nucleului dezvoltat mai târziu este în acord excelent cu experimentul și este acum general acceptat. Conform acestui model, nucleul unui atom conține Z protoni şi A-Z neutroni. Aici Z- numărul de serie al elementului din tabelul periodic. Taxa de bază q= Ze +, deci numărul Z sunat des numărul de taxare. valoarea DAR numit numar de masa. Acesta este un număr întreg egal cu masa atomică a elementului exprimat în unități de carbon și rotunjit la cel mai apropiat număr întreg. Protonii și neutronii din nucleu se numesc nucleonii(din lat. nucleu- nucleu). Acest lucru subliniază faptul că protonul și neutronul din compoziția nucleului sunt una și aceeași particulă în stări diferite. Numar de masa DAR este numărul de nucleoni din nucleu. În funcție de raportul dintre numărul de protoni și neutroni din nuclee, există izotopi, izobareși izotone.
izotopi(din greaca isos - egal, topos - loc) - nuclee care contin acelasi numar de protoni, adica avand acelasi numar Z, și un număr diferit de neutroni. Toți izotopii sunt plasați într-o celulă a tabelului periodic și sunt varietăți de una element chimic. Izotopii diferă ca număr N neutroni din nucleu. De exemplu, izotopii hidrogenului:
Protium, , nucleu-proton, Z = 1, A = 1, N = A–Z= 0, nu există neutroni.
Deuteriu, , nucleu-deuteron, Z = 1, A = 2, N= 1, un neutron.
Tritiu, nucleu de triton, Z = 1, A = 3, N= 2, doi neutroni.
Izotopi de heliu:
, Z= 2 (doi protoni), A = 3, N= 1 (un neutron), stabil.
, Z = 2, A = 4, N= 2 (doi neutroni), stabil.
, Z = 2, A = 6, N= 4 (patru neutroni), instabil.
, Z = 2, A = 8, N= 6 (șase neutroni), instabil.
Elementele cunoscute în prezent au un număr Z ajunge la aproximativ 105. Acest număr de elemente reprezintă aproximativ 1500 de izotopi cunoscuți. Media pe articol
14 izotopi. Din care 1 ç
5 - stabil și 4 ç
5 - instabil.
Izotopii aceluiași element chimic au aceeași substanță chimică și aproape identice proprietăți fizice. Prin urmare, separarea izotopilor este o problemă fizico-chimică complexă. Izotopii de hidrogen diferă cel mai mult.
izobare(din isos-și greacă baros- gravitație) - nuclee cu același număr de masă DAR. De exemplu, tritiu și heliu. Au 3 nucleoni, dar raportul dintre protoni și neutroni este diferit. tritiu Z = 1, N= 2, pentru heliu Z = 2, N = 1.
izotonii sunt nuclee cu același număr de neutroni. La fel ca izobarele, izotonele sunt nuclee ale diferitelor elemente chimice. De exemplu, nucleele și conțin 3 neutroni.
Cuvintele izobareși izotone folosit mult mai rar decât cuvântul izotopi.
1. Dimensiunile nucleului determinată în trei moduri: prin împrăștiere pe nucleele electronilor rapizi, prin studierea spectrelor mezoatomiși difracția prin nuclee de neutroni.
A. Răspândirea pe nucleele electronilor rapizi vă permite să determinați raza electrică a nucleului R e-mail Electronii, a căror energie trebuie să fie de cel puțin 100 MeV, experimentează interacțiune electromagnetică, dar nu nucleară, cu nucleul. Prin urmare, pe baza împrăștierii lor, se poate judeca de fapt doar distribuția protonilor în nucleu.
b. Spectrele mezoatomilor , adică atomi în care unul dintre electroni este înlocuit muon. Muon µ - particulă elementară, sarcina ei egal cu taxa electron, iar masa este de 207 ori mai mare, m= 207pe mine. La fel ca electronul, muonul nu participă la interacțiunile nucleare. Spectrele mezoatomilor oferă mai multe informații despre structura nucleului decât spectrele atomilor obișnuiți, deoarece muonul, datorită masei sale mai mari, se mișcă de 207 ori mai aproape de nucleu decât electronul. Muonul petrece un timp relativ vizibil chiar și în interiorul nucleului.
în. Difracția prin nuclee de neutroni cu o energie de ordinul a 20 MeV are avantajul pe care îl experimentează neutronii nuclear interacțiunea cu nucleul. Raza acestei interacțiuni este foarte mică. Prin urmare, neutronii difractează în mod vizibil pe nucleu, adică se abat de la mișcarea rectilinie, zburând doar foarte aproape de nucleu și în interiorul nucleului însuși. Din lățimea maximului de difracție, care este format din neutroni care au trecut atât în exteriorul, cât și în interiorul nucleului, se poate estima atât dimensiunea, cât și gradul de transparență al nucleului pentru neutroni.
Difracția neutronilor pe nuclee face posibilă determinarea razei regiunii în care acționează forțele nucleare de atracție. De fapt, aceasta este zona în care sunt concentrați nucleonii nucleului. Din experimente rezultă că raza nucleului este proporțională cu rădăcina cubă a numărului A al nucleonilor conținuți în el, ![]() m. (19,1)
m. (19,1)
Să calculăm concentrația de nucleoni în nucleu. Pentru aceasta, numărul de masă A trebuie împărțit la volumul nucleului. .
Înmulțirea cu masa unui nucleon m p= 1,67·10 -27 kg, se obține densitatea medie ρ a substanței nucleare. .
Densitatea materiei nucleare nu depinde de numărul de nucleoni din nucleu. Este același în toate nucleele și este o valoare gigantică. Un milimetru cub dintr-o astfel de substanță ar avea o masă de 200.000 de tone. Că densitatea ρ a materiei nucleare este constantă, indică faptul că nucleonii din nucleu în sensul de împachetare sunt similari cu moleculele lichide. Volumul mediu pe nucleon dintr-un nucleu nu depinde de dimensiunea nucleului, la fel cum volumul mediu pe moleculă dintr-un lichid nu depinde de dimensiunea picăturii.
2. Forțele nucleare. Experimentele lui Rutherford din 1909. prin dispersie A-particulele au arătat că legea lui Coulomb este îndeplinită în microcosmos până la dimensiunea nucleelor. Dar asta înseamnă că forțe uriașe de respingere trebuie să acționeze între protonii din nucleu. Să aflăm mărimea acestor forțe pentru doi protoni dintr-un nucleu de heliu. Numărul de nucleoni dintr-un nucleu de heliu. Din formula (19.1) raza nucleului de heliu R\u003d 1,25 10 -15 4 1/3 \u003d 2 10 -15 m. Presupunem că protonii sunt la capetele diametrului nucleului 2 R= 4 10 -15 m. Atunci forța de respingere dintre ele este:
De ce nucleul, în ciuda unei atât de mari respingeri reciproce a protonilor, nu se împrăștie în părțile sale componente?
Stabilitatea observată experimental a nucleelor înseamnă că pe lângă forte electrice respingerea între particulele nucleare, există și forțe de atracție. Nu poate fi putere atracție gravitațională. Lor energie potențială
– Gmp/2R= – 6,7 10 -11 (1,7 10 -27) 2 /4 10 -15 = – 5 10 -50 J, în timp ce energia potențială a respingerii protonilor este (1/4 πε
0)/(e 2 /2R) ≈ 6 10 -14 J! Aceasta este cu 36 de ordine de mărime mai mare.
În consecință, în cazul nucleelor atomice, ne confruntăm cu un tip nou, special de interacțiune. Această interacțiune se numește puternicși forțele care răspund la aceasta - nuclear. Teorie completă forte nucleare nu a fost încă construit, deși a obținut un mare succes în explicarea și prezicerea multor fapte experimentale. Principalele idei moderne despre forțele nucleare sunt următoarele:
A. Existența unui câmp nuclear . La fel cum forțele electrice sunt condiționate de existența materialului câmp electromagnetic, forțele nucleare se datorează existenței unui câmp nuclear material. Sursele câmpului EM sunt orice particule de materie încărcate electric - electroni, protoni etc. Sursele câmpului nuclear sunt nucleonii - protoni și neutroni. Nucleonii au un specific sarcina nucleara.
b. Independența încărcării forțelor nucleare . sarcina nucleara nucleonii este același ca mărime și semn. Nu depinde dacă nucleonul are sarcină electrică (proton) sau nu (neutron). Cu ajutorul forțelor nucleare, un neutron cu un neutron, un neutron cu un proton și doi protoni interacționează în același mod.
în. Forțe nucleare cu rază scurtă de acțiune. În comparație cu forțele Coulomb și gravitaționale, care scad proporțional cu pătratul distanței dintre sursele punctuale (sarcini, mase), forțele nucleare scad mult mai repede. Sunt foarte mari la distanțe de ordinul diametrului nucleului, dar deja la o distanță de trei diametre sunt practic invizibile. Când nucleonii se apropie unul de altul, atracția este înlocuită cu repulsie.
G. Forțele nucleare nu sunt centrale. câmp electric în jur taxă punctuală iar câmpul gravitațional din jurul maselor punctuale este simetric central. Câmpul nuclear al unui nucleon individual nu are simetrie centrală. Acest lucru se datorează prezenței momentelor mecanice și magnetice de spin în nucleoni. Interacțiunea dintre nucleoni depinde de orientarea spinurilor lor. De exemplu, un neutron și un proton sunt ținute împreună în nucleul hidrogenului greu - deutronul - numai dacă spinurile lor mecanice sunt paralele între ele.
d. Proprietatea de saturație a forțelor nucleare. După cum se știe, energia de interacțiune a două sarcini electrice nu depinde de prezența unei a treia ( principiul suprapunerii). Odată cu introducerea fiecărei sarcini ulterioare, energia sistemului crește proporțional cu cantitatea de sarcină introdusă. Fiecare sarcină electrică poate interacționa cu un număr nelimitat de alte sarcini. Nu există saturație a forțelor electrice.
Saturația forțelor nucleare este că fiecare nucleon din nucleu poate interacționa cu un număr limitat de nucleoni. Aceasta este oarecum similară cu valența chimică a elementelor. De exemplu, un atom de carbon C se poate combina cu patru atomi de hidrogen H pentru a forma o moleculă de metan CH4, cu doi atomi de oxigen (CO2) și așa mai departe. Nu există o astfel de diversitate între nucleoni ca printre elementele chimice. Prin urmare, saturația forțelor nucleare se manifestă prin faptul că energie de legare specifică(energia pe nucleon) din nucleu nu crește odată cu creșterea numărului de nucleoni din nucleu, ci rămâne aproximativ constantă.
3. Masa nucleului diferă de masa unui atom de elemente chimice doar prin valoarea masei învelișului de electroni. În tabelul periodic, masele atomilor sunt exprimate în unități de masă atomică a.m.u. Una a.m.u. este egal cu 1 ç 12 mase ale unui atom de carbon, 1 amu = 1,66 10 -27 kg. Deoarece există 12 nucleoni în miezul izotopului principal de carbon (99% pe pământ), este clar că a.m.u. aproape de masa unui nucleon.
Masa unui electron pe mine= 5,5 10 -4 amu Raportul de masă al învelișului de electroni Zme la masa unui atom este pentru hidrogen pe mine/m() = 5,5 10 -4 ç 1,008 = 0,0005, adică 0,05%. Pentru alți atomi, acest raport este și mai mic, deoarece numărul de nucleoni din nucleu crește mai repede decât numărul de electroni din atom. în atomul de uraniu Zme/m() = 0,0002 (0,02%). Prin urmare, în cazurile în care calculele necesită o precizie de cel mult patru cifre, masa unui atom al unui element chimic din tabelul periodic poate fi luată drept masa nucleului.
Dupa cum fizica nucleara izotopi necunoscuți anterior, inclusiv cei care nu existau în natură, au fost descoperiți și sintetizați prin reacții nucleare.
Metode de măsurare chimică mase atomice izotopii artificiali s-au dovedit puțin eficienți. În 1919 Francis Aston constructe spectrograf de masă- un dispozitiv capabil să separe ionii în funcție de masele lor cu mare precizie.
 Orice spectrograf de masă include trei părți principale: sursă de ioni, analizor și receptor. Ionii se formează în sursa de ioni și se formează un fascicul slab divergent. În analizor, fasciculul este împărțit în mai multe fascicule, care diferă în mase ionice și sunt concentrate pe suprafața dispozitivului receptor - o placă fotografică. Figura 134 prezintă o diagramă a unuia dintre aceste spectrografe de masă. Jetul de abur al elementului studiat intră în gaura 1 a sursei de ioni și este ionizat de fasciculul de electroni care trage prin acesta. Ionii rezultați sunt accelerați și colimați de diafragmele 2.
Orice spectrograf de masă include trei părți principale: sursă de ioni, analizor și receptor. Ionii se formează în sursa de ioni și se formează un fascicul slab divergent. În analizor, fasciculul este împărțit în mai multe fascicule, care diferă în mase ionice și sunt concentrate pe suprafața dispozitivului receptor - o placă fotografică. Figura 134 prezintă o diagramă a unuia dintre aceste spectrografe de masă. Jetul de abur al elementului studiat intră în gaura 1 a sursei de ioni și este ionizat de fasciculul de electroni care trage prin acesta. Ionii rezultați sunt accelerați și colimați de diafragmele 2.
Analizorul este un câmp magnetic sectorial LAîndreptată perpendicular pe planul figurii. În acest câmp magnetic, ionii emiși de la sursă în unghiuri ușor diferite sunt deviați și focalizați. Raza cercului de-a lungul căruia ionul se mișcă în sector este cu atât mai mare, cu atât sarcina sa specifică este mai mică, ![]() . (19.2)
. (19.2)
(Vezi Electricitate, §14). Aici v este viteza ionului, e/m este taxa sa specifică.
Ca urmare, ionii aceluiași izotop cad în același loc pe placa fotografică Фп, formând pe ea o linie îngustă, perpendiculară pe planul imaginii. Spectrografele de masă fac posibilă măsurarea maselor izotopilor cu o eroare relativă de 10 -5 ¸10 -6 .
Dacă înlocuim placa fotografică cu o cupă Faraday și măsurăm curentul ionic, putem determina intensitatea fasciculelor de ioni și putem găsi abundența relativă a izotopilor din amestecul de ioni. Un astfel de dispozitiv este numit spectrometru de masă.
4 . Defect de masă și energie nucleară de legare. Masa miezului m i este întotdeauna mai mic decât masele nucleonilor săi constitutivi Zm p+ (A-Z)m n.Valoare D m = Zm p + (A-Z)m n –m i (19,3)
 numit defect de masă. Aici m p,m n,mși i sunt masele de rest ale protonului, neutronului și nucleului.
numit defect de masă. Aici m p,m n,mși i sunt masele de rest ale protonului, neutronului și nucleului.
Faptul este că atunci când nucleonii liberi se combină, energia este eliberată sub formă de cuante de radiație EM, care transportă masa Δ m. Energie legată E numărul de nucleoni dintr-un nucleu se calculează prin formula E sv = D mc 2 , (19.4)
Unde c este viteza luminii în vid. Pentru a distruge nucleul, adică pentru a-l împărți în nucleoni, este necesar să se transmită energie E, nu mai puțin decât energia de legare, E≥ E Sf.
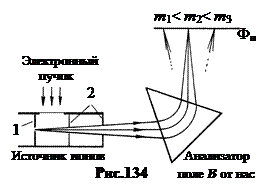
Indicativ pentru aprecierea stabilității nucleelor energie de legare specifică E Sf. cA, adică energia pe 1 nucleon. Figura 135 arată dependența experimentală a modulului său de numărul de masă A nuclee stabile în MeV/nucleon. Punctele negre se referă la nucleele pare-pare, în care numărul de protoni Zși numărul de neutroni A-Z- numere pare. Cruci drepte - la nuclee cu un impar A. Încrucișările oblice se referă la nuclee impar-impare.
Inset-ul arată energia specifică de legare pentru nucleele ușoare, începând cu deuteriu ( A= 2) și se termină cu neon ( A = 20).
În prima aproximare, energia specifică de legare variază de la 7,4 MeV ç nucleon în deuteriu până la 8,8 MeV ç nucleon la fier, adică în aproximativ 1,4 MeV ê nucleon. Dar natura schimbării este orientativă. De la deuteriu la fier, magnitudine E Sf. cA crește, atingând un maxim la A= 56, adică în regiunea nucleelor de fier. După călcare cu creștere A energia de legare specifică scade la 7,5 MeV ç nucleon la sfârșitul tabelului periodic.
Maximul curbei corespunde celor mai stabile nuclee. Acestea includ nuclee E Sf. cA> 8,6 MeV ç nucleon care începe cu calciu par-par și se termină cu plumb par-par cu E Sf. cA= 7,9 MeV ç nucleon. Cele mai ușoare nuclee cu A < 20 энергетически выгодно сливаться друг с другом в более тяжёлые с выделением energie de fuziune. Pentru cele mai grele nuclee cu A> 207, dimpotrivă, este benefic procesul de fisiune în fragmente, care continuă cu eliberarea de energie, care se numește atomic.
Interesant este că nucleele unor elemente din Fig. 135 sunt ușor mai înalte decât cursul curbei. Acestea sunt nuclee în care numărul de protoni Z sau numărul de neutroni N=A-Z egală cu așa-zisa numere magice: 2, 8, 20, 28, 50, 82, 126. Aceste miezuri au o rezistență crescută în comparație cu vecinii lor. Nucleele dublu magice sunt deosebit de puternice Dintre acestea, nucleul este atât de puternic încât chiar și în timpul dezintegrarii nucleelor grele zboară intact ( A-particulă).
5 . Învârtirile nucleelor. După cum sa menționat deja în §18, protonii și neutronii au momente mecanice de spin, la fel ca cele ale electronilor. În proiecția pe axa fizică, momentele mecanice de spin ale protonului, neutronului și electronului pot prelua valorile L sz = ± ћç 2.
Toate metodele de determinare experimentală a momentelor de spin Ls protonii, neutronii și nucleele se bazează pe conexiunea momentelor mecanice de spin Ls cu momente de rotație magnetică Domnișoară. Cunoscând relația dintre Lsși Domnișoară pentru aceste particule, în funcție de mărimea și caracteristicile momentului magnetic M s, este posibil să se stabilească Ls.
cel mai devreme metode experimentale determinarea momentelor de spin magnetic M s-au bazat pe studiul structurii hiperfine a spectrelor optice de hidrogen (spin de proton), deuteriu (spin nuclear proton + neutron → spin neutron) și alți atomi. Mai târziu, au început să studieze comportamentul nucleelor într-un câmp magnetic prin radiospectroscopie. Spiriurile nucleelor izotopilor cu viață scurtă sunt determinate de reactii nucleare pe baza legilor de conservare, spinurile nucleelor excitate - în funcție de emisia lor g-radiații.
Experimentele arată că momentele de spin ale nucleului (mecanic și respectiv magnetic) sunt egale cu sumele geometrice ale momentelor nucleonilor care alcătuiesc nucleul. Trebuie avut în vedere faptul că impulsul total al fiecărui nucleon este suma momentelor spin și orbitale (adică asociate cu mișcarea nucleonului de-a lungul unei anumite „orbite” a nucleului). Momentul mecanic orbital al unui nucleon dintr-un nucleu, spre deosebire de momentul de spin, poate lua numai valori întregi. În cazul în care un L sz= ± ћç 2, atunci L lz =± nћ, Unde n este un număr întreg. Să enumerăm principalele fapte experimentale despre spinurile nucleare.
A. Rotiți momentele mecanice ale nucleelor cu par A este întotdeauna întreg, cu A impar - jumătate întreg . De exemplu, rotația deuteronului L sz = ± ( ћç 2+ћç 2) = ± ћ . Spiriile unui neutron și ale unui proton dintr-un nucleu de deuteriu sunt paralele.
b. Momentele mecanice de spin ale tuturor nucleelor pare-pare din stările fundamentale sunt egale cu zero . Deoarece spinurile din perechea proton-neutron de deuteriu sunt paralele, rămâne de concluzionat că rotiri antiparalele pot fi doar în perechi cu același nume, adică pentru proton-proton și neutron-neutron.
în. Momentele mecanice de spin ale nucleelor stabile rămase nu depășesc 9ћç 2, adică sunt foarte mici în comparație cu suma valorilor absolute ale spinului și momentelor orbitale ale tuturor particulelor care intră în nucleu. Acest lucru sugerează că cei mai mulți dintre nucleoni sunt puternic legați în învelișuri închise care au impuls total zero și nu participă la crearea spinului nuclear.
6. Momentele magnetice ale nucleelor. Fiecare nucleu cu spin diferit de zero are un moment magnetic M care caracterizează interacţiunea nucleului cu un câmp magnetic extern uniform B . Direcția momentului magnetic M microparticulele coincide cu direcția momentului mecanic de spin Ls până să semneze. M s = g Ls (19.5)
Aici g – raportul giromagnetic. Este pozitiv pentru proton (vectori Domnișoară și Ls coincid, pentru neutron este negativ (vectori Domnișoară și Ls sunt opuse). Există multe metode pentru determinarea momentelor magnetice ale nucleilor și nucleonilor. Să luăm în considerare trei dintre ele.
A. Studiul structurii hiperfine a spectrelor optice. Această metodă a fost deja menționată în paragraful anterior. Adăugăm doar că în acest fel s-a putut stabili că momentele magnetice nucleare sunt cu trei ordine de mărime mai mici decât momentul magnetic de spin al electronului și au ordinul magneton nuclear M i = eћç 2m p= 5,05 10 -27 J ç Tl. De aceea despicare hiperfină linii spectrale cu trei ordine de mărime mai puțin structură fină, datorită interacțiunii momentului de spin al electronului cu cel orbital.
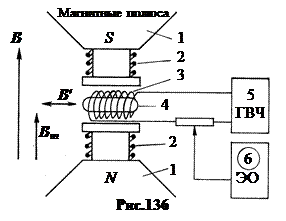 b. Metoda rezonanței magnetice nucleare
constă în faptul că spinul unui nucleu situat într-un câmp magnetic puternic constant se poate „răsturna” sub acțiunea unui câmp slab de înaltă frecvență de o anumită frecvență de rezonanță. Schema de instalare este prezentată în Fig.136.
b. Metoda rezonanței magnetice nucleare
constă în faptul că spinul unui nucleu situat într-un câmp magnetic puternic constant se poate „răsturna” sub acțiunea unui câmp slab de înaltă frecvență de o anumită frecvență de rezonanță. Schema de instalare este prezentată în Fig.136.
 Trei campuri magnetice. În primul rând, un câmp magnetic permanent puternic B≈ 1 T creat de magneți 1. Scopul câmpului magnetic B
este ruperea conexiunii dintre momentul magnetic nuclear si învelișul de electroni, crearea divizării Zeeman hiperfină a nivelurilor nucleare. În al doilea rând, câmpul de înaltă frecvență creat de bobina 3 de la generatorul 5 B
"
, îndreptat perpendicular B
. Frecvența câmpului B
"
s-ar putea schimba. Scopul acestui câmp este ruperea rezonantă a spinului nuclear. În al treilea rând, câmpul variabil modulator creat de bobinele 2 B
m, îndreptată paralel B
și având o frecvență constantă scăzută de 50 Hz. Scopul acestui câmp este de a repeta inversarea spinului nuclear de 50 de ori pe secundă pentru a obține o imagine staționară pe osciloscopul 6 la rezonanță. Prin măsurarea energiei absorbite la rezonanță de probă, inducerea unui câmp magnetic puternic B
si frecventa generatorului, se poate determina momentul magnetic al nucleelor pe instalatii moderne cu o precizie de 6 zecimale.
Trei campuri magnetice. În primul rând, un câmp magnetic permanent puternic B≈ 1 T creat de magneți 1. Scopul câmpului magnetic B
este ruperea conexiunii dintre momentul magnetic nuclear si învelișul de electroni, crearea divizării Zeeman hiperfină a nivelurilor nucleare. În al doilea rând, câmpul de înaltă frecvență creat de bobina 3 de la generatorul 5 B
"
, îndreptat perpendicular B
. Frecvența câmpului B
"
s-ar putea schimba. Scopul acestui câmp este ruperea rezonantă a spinului nuclear. În al treilea rând, câmpul variabil modulator creat de bobinele 2 B
m, îndreptată paralel B
și având o frecvență constantă scăzută de 50 Hz. Scopul acestui câmp este de a repeta inversarea spinului nuclear de 50 de ori pe secundă pentru a obține o imagine staționară pe osciloscopul 6 la rezonanță. Prin măsurarea energiei absorbite la rezonanță de probă, inducerea unui câmp magnetic puternic B
si frecventa generatorului, se poate determina momentul magnetic al nucleelor pe instalatii moderne cu o precizie de 6 zecimale.
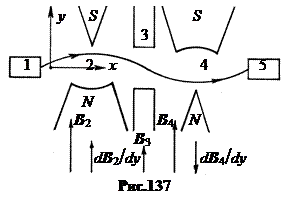
în. metoda Isidor Rabi, 1937 Metoda rezonanței magnetice nucleare nu poate măsura momentul magnetic al unui neutron, deoarece neutronii nu sunt ținuți într-o fiolă, ei există doar în fascicule. Schema metodei Rabi este prezentată în Fig. 137. Fascicul de neutroni de la sursa 1 trece succesiv prin două câmpuri magnetice foarte neomogene 2 și 4 cu gradienți direcționați opus dBcdy. Într-un câmp magnetic neomogen, traiectoria unei particule cu un moment magnetic de spin este curbată de-a lungul sau împotriva gradientului, în funcție de orientarea momentului magnetic. Primul câmp magnetic 2 îndoaie traiectoria neutronilor, al doilea câmp 4 îi concentrează pe detectorul 5. Dacă acum, în decalajul 3 dintre câmpuri, includem o combinație de câmpuri magnetice de înaltă frecvență, constante, puternice, omogene și slabe, de la schema anterioară, atunci spinul neutronilor se va întoarce la rezonanță. Ca urmare, acești neutroni nu vor fi focalizați de al doilea câmp neomogen 4 și nu vor cădea în detectorul 5. Prin urmare, va exista o scădere bruscă a graficului intensității de numărare în detector, în funcție de frecvența intensității de numărare. -câmp de frecvență la rezonanță. Poziția sa va determina mărimea momentului magnetic al neutronului.
Metoda Rabi poate folosi și fascicule moleculare și poate determina momentele magnetice ale nucleelor.
Să enumerăm principalele fapte experimentale privind momentele magnetice ale nucleonilor și nucleelor atomice.
A. Momentele de spin magnetice ale protonului Mpși neutroni M n sunteți: Mp= 2,79 M i, M n = –1,91 M i. Aici M i = ehç 2m p= 5,05 10 -27 J ç Tl este magnetonul nuclear.
b . Momentele magnetice ale nucleelor cu spin zero sunt zero.
în . Momentele magnetice ale nucleelor cu spin diferit de zero sunt de ordinul magnetonului nuclear.
G. Momentele magnetice de rotație ale nucleonilor nu sunt aditive. De exemplu, deuteronul este format dintr-un proton și un neutron cu spin paralel. Momentul magnetic total al deuteronului ar trebui să fie M d = M p + M n= 2,79 M i – 1,91 M i = 0,88 M i. Dar experiența dă M d = 0,86 M i. Această non-aditivitate este legată de non-centralitatea forțelor care acționează între nucleoni.
7 . Modele ale nucleului atomic. O teorie consistentă a nucleului nu a fost încă construită din cauza a două dificultăți principale: cunoașterea insuficientă a forțelor care acționează între nucleoni și greutatea. problema cuantică multe corpuri. La urma urmei, un nucleu cu un număr de masă A trebuie descris de un sistem format din cel puţin A ecuații. Aceste dificultăți pot fi depășite parțial prin crearea unor modele nucleare care să permită descrierea cu ajutorul ecuațiilor simple a unui anumit set de proprietăți ale nucleului.
Au fost dezvoltate aproximativ o duzină de modele, fiecare dintre acestea descriindu-și propriul set de proprietăți nucleare și propria sa gamă de fenomene. Să luăm în considerare două dintre ele.
A. model de picurare. Ea a fost oferită Yakov Frenkelîn 1937. Nucleul din acest model este asemănat cu o picătură de lichid, nucleul excitat este asemănat cu o picătură încălzită. Dacă E este energia unui nucleu excitat cu numărul de nucleoni A, apoi, având atribuite 3 grade de libertate nucleonilor, obținem:
![]() . (19.6)
. (19.6)
La E = 10 MeV T≈ 10 9 K. Emisia de neutroni, protoni si A-particulele dintr-un astfel de model pot fi interpretate ca evaporarea miezului picăturii.
Baza modelului de picătură a fost acțiunea pe distanță scurtă a forțelor nucleare și independența densității față de numărul de masă A. Modelul de picătură a făcut posibilă derivarea unei formule semi-empirice pentru energia de legare a particulelor dintr-un nucleu și descrierea procesul de fisiune a nucleelor grele.
b. Model Shell. A fost propusă în 1951. Maria Goeppert-Mayer. Baza modelului învelișului a fost faptul existenței unor nuclee deosebit de stabile, așa-numitele magic și dublu magic.
În acest model, se consideră că nucleonii se mișcă independent unul de celălalt în câmp mediu simetric central. Se presupune că, la fel ca în atom, nucleul are niveluri discrete, umplut cu nucleoni, ținând cont de principiul Pauli. Aceste niveluri sunt grupate în scoici, dintre care fiecare poate conține un anumit număr de nucleoni. O coajă complet umplută formează un miez stabil.
Din faptul experimental al existenței nucleelor magice și dublu magice, rezultă că cochiliile umplute conțin numărul magic de nucleoni 2, 8, 20, 28, 50, 82, 126. Multe nuclee magice sunt mai frecvente în Univers decât vecinii lor non-magici. În plus față de de două ori magic (cu excepția), aceasta include
Modelul învelișului este bine dezvoltat din punct de vedere matematic și permite explicarea proprietăților nucleelor magice și ale nucleelor vecine care diferă cu 1 nucleon (lipsă sau exces). În acest model, forțele reale care acționează între nucleoni sunt înlocuite cu un câmp auto-consecvent în care nucleonii se mișcă independent unul de celălalt. Schema de construire a cochiliilor amintește oarecum de completarea tabelului periodic, dar inferioară acestuia ca severitate.
Experimentele lui Rutherford au demonstrat că un atom este format dintr-un mic nucleu încărcat pozitiv și electroni care se rotesc în jurul lui. S-a dovedit că, în comparație cu dimensiunea atomului în sine, nucleul este extrem de mic. Nucleul este de 100.000 de ori mai mic decât un atom.
Dacă nucleul atomic este mărit la dimensiunea unui bob de mazăre, atunci diametrul atomului va fi egal cu înălțimea turnului Ostankino.
Studii ulterioare au arătat că sarcina nucleului atomic este egală cu produsul numărului de serie Z al elementului din tabelul periodic al lui D.I. Mendeleev mai departe sarcina elementara. Acesta este numărul atomic Z determină numărul de electroni dintr-un atom, numărul de protoni din nucleu.

Dacă nucleul ar fi format numai din protoni, atunci masa nucleului oricărui element chimic ar fi egală cu masa Z a protonilor. Dar, de fapt, masa nucleelor tuturor elementelor este mult mai mare. Prin urmare, în 1920, Rutherford a sugerat existența unei particule neutre din punct de vedere electric. Această particulă a fost descoperită ulterior experimental. Au sunat-o neutroni.
În 1932 au propus modelul proton-neutron nucleul atomic. Se numesc protoni și neutroni nucleonii.
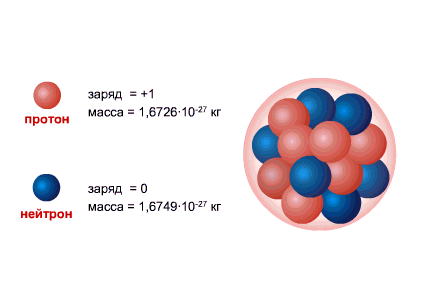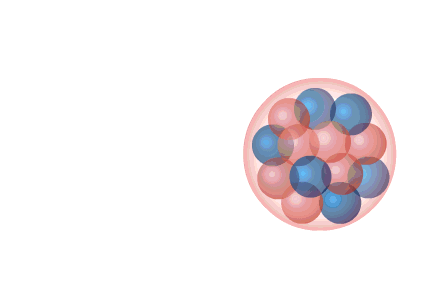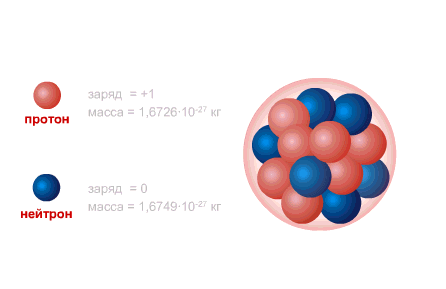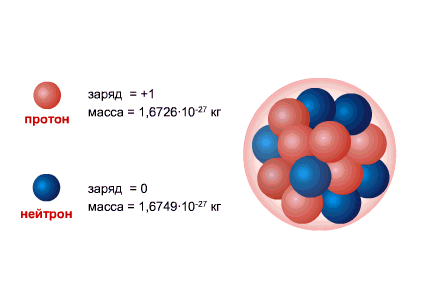
Numărul total de nucleoni (protoni + neutroni) se numește numărul de masă A. În prezent, sunt acceptate următoarele denumiri pentru atomii elementelor chimice:
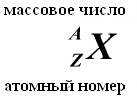

Stabilitatea miezului
De ce este stabil nucleul? Între protoni din interiorul nucleului acţionează forţe de respingere coulomb de o magnitudine enormă, de aproximativ 230 N. Dar nucleul nu se destramă! Motivul stabilității este prezența unor forțe de altă natură, ele sunt numite interacțiuni puternice.
Aceste forțe sunt de 100 de ori mai mari decât forțele de respingere Coulomb. Apar doar la distante de ordinul a 10 -15 m. Sunt doar forte de atractie.
Masa miezului
Masele tuturor nucleelor (cu excepția hidrogenului) sunt mai mici decât masele protonilor și neutronilor liberi care le formează. Se numește diferența de masă defect de masă.
Descoperirea neutronului a dus imediat la o schimbare în ideea structurii nucleului atomic. Ipoteza că nucleul conține protoni și electroni, care existau înainte de descoperirea neutronului, nu a fost susținută de majoritatea oamenilor de știință. În 1932, surprinzător de prolific pentru descoperiri remarcabile, omul de știință rus Dmitri Dmitrievich Ivanenko a prezentat o ipoteză despre modelul proton-neutron al nucleului, electronii din modelul său nu făceau parte din nucleu. Ceva mai târziu, Heisenberg a exprimat un model similar al nucleului. Trebuie spus că acest model a fost acceptat cu scepticism de mulți oameni de știință. Li s-a părut că contrazice emisia de electroni în timpul dezintegrarii P. Heisenberg a amintit că „a fost puternic criticat de cei mai eminenți fizicieni”. Ivanenko a depus mult efort atât pentru a convinge oamenii de știință de corectitudinea descoperirii sale, cât și pentru a-și apăra prioritatea. Curând modelul proton-neutron al nucleului a fost recunoscut și a devenit general acceptat, deși nucleul atomului conține încă multe secrete. Să spunem câteva cuvinte despre particulele care alcătuiesc nucleul unui atom. (Trebuie amintit că atât protonii, cât și neutronii, conform mecanicii cuantice, au și proprietăți de undă).
PROTON este nucleul atomului de hidrogen, sarcina acestuia este egală cu sarcina electronului ca mărime și opusă în semn (+e = 1,6 x 10-19 C.), iar masa (mp = 1,6726485 ± 0,0000086) x 10- 27 kg.
NEUTRONUL are o sarcină egală cu zero și o masă practic egală cu masa unui proton (mm = 1,674954 ± 0,000009) x 10-27 kg. 1, Neutroni și protoni primiți denumirea comună nucleonii. Numărul total de nucleoni din nucleu, adică numărul de protoni și neutroni din nucleu, se numește număr de masă și se notează cu litera A. Numărul de protoni din nucleu se notează cu Z. Se numește număr atomic și este, de asemenea, egal cu numărul de electroni în învelișul exterior al atomului. Numărul de neutroni din nucleu N = A - Z.
Elementele chimice, la sugestia soților Joliot-Curie, sunt desemnate cu doi indici în stânga desemnării elementului: indicele superior indică numărul de masă, indicele inferior indică numărul de protoni, de exemplu, 13 Al, 11 H. În nucleele aceluiași element chimic, numărul de neutroni poate fi diferit, iar numărul de protoni este același. Astfel de nuclee, care au același număr de protoni dar un număr diferit de neutroni, se numesc izotopi. Unii izotopi nu se găsesc în natură, dar pot fi obținuți în laboratoarele oamenilor de știință ca urmare a reacțiilor nucleare.
Nucleul atomic- Partea centrală atom, în care principalul său greutate(peste 99,9%). Nucleul este încărcat pozitiv, sarcina nucleului determină element chimic căruia îi aparține atomul. Dimensiunile nucleelor diferiților atomi sunt mai multe femtometre, care este de peste 10 mii de ori mai mică decât dimensiunea atomului însuși.
Studii de nuclee atomice fizica nucleara.
Nucleul atomic este alcătuit din nucleonii- incarcat pozitiv protoniși neutru neutroni, care sunt interconectate prin intermediul interacțiune puternică. Protonul și neutronul au propriul moment unghiular ( înapoi), egal cu [sn 1]și înrudite moment magnetic. Singurul atom care nu conține neutron în nucleu este hidrogenul ușor ( protium).
Nucleul atomic, considerat ca o clasă de particule cu un anumit număr de protoni și neutroni, este numit în mod obișnuit nuclidul .
Numărul de protoni dintr-un nucleu se numește al său numărul de taxare- acest număr este egal cu numărul de serie element căruia îi aparține atomul tabel (sistem periodic de elemente) Mendeleev. Numărul de protoni din nucleu determină structura învelișul de electroni atom neutru şi astfel Proprietăți chimice elementul corespunzător. Numărul de neutroni dintr-un nucleu se numește acestuia număr izotopic. Se numesc nuclee cu același număr de protoni și numere diferite de neutroni izotopi. Se numesc nuclee cu același număr de neutroni, dar cu numere diferite de protoni izotone. Termenii izotop și izotonă sunt folosiți și în legătură cu atomii care conțin nucleele indicate, precum și pentru a caracteriza varietățile nechimice ale unui element chimic. Numărul total de nucleoni dintr-un nucleu se numește al său numar de masa() și este aproximativ egală cu masa medie a unui atom, indicată în tabelul periodic. Se numesc nuclizi cu același număr de masă, dar compoziție proton-neutron diferită izobare.
Ca orice sistem cuantic, nucleele pot fi într-o stare excitată metastabilă și, în unele cazuri durata de viață această stare se calculează în ani. Astfel de stări excitate ale nucleelor sunt numite izomeri nucleari .
Experimentele lui Rutherford au demonstrat că un atom este format dintr-un mic nucleu încărcat pozitiv și electroni care se rotesc în jurul lui. S-a dovedit că, în comparație cu dimensiunea atomului în sine, nucleul este extrem de mic. Nucleul este de 100.000 de ori mai mic decât un atom.
Dacă nucleul atomic este mărit la dimensiunea unui bob de mazăre, atunci diametrul atomului va fi egal cu înălțimea turnului Ostankino.
Studii ulterioare au arătat că sarcina nucleului atomic este egală cu produsul numărului de serie Z al elementului din tabelul periodic al lui D.I. Mendeleev despre sarcina elementară. Acesta este numărul atomic Z determină numărul de electroni dintr-un atom, numărul de protoni din nucleu.

Dacă nucleul ar fi format numai din protoni, atunci masa nucleului oricărui element chimic ar fi egală cu masa Z a protonilor. Dar, de fapt, masa nucleelor tuturor elementelor este mult mai mare. Prin urmare, în 1920, Rutherford a sugerat existența unei particule neutre din punct de vedere electric. Această particulă a fost descoperită ulterior experimental. Au sunat-o neutroni.
În 1932 au propus modelul proton-neutron nucleul atomic. Se numesc protoni și neutroni nucleonii.

Numărul total de nucleoni (protoni + neutroni) se numește numărul de masă A. În prezent, sunt acceptate următoarele denumiri pentru atomii elementelor chimice:
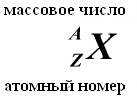

Stabilitatea miezului
De ce este stabil nucleul? Între protoni din interiorul nucleului acţionează forţe de respingere coulomb de o magnitudine enormă, de aproximativ 230 N. Dar nucleul nu se destramă! Motivul stabilității este prezența unor forțe de altă natură, ele sunt numite interacțiuni puternice.
Aceste forțe sunt de 100 de ori mai mari decât forțele de respingere Coulomb. Apar doar la distante de ordinul a 10 -15 m. Sunt doar forte de atractie.
„Structura nucleului atomic” - Ernest Rutherford (structura atomului). Poți muri din cauza invizibilului. Becquerel Antoine Henri - 1897 „Erou cu brațe scurte” Defect de masă?m ENERGIE!!! Igor Vasilievici Kurchatov. Structura atomului. efect biologic asupra organismului. Structura nucleului atomic. Radioactivitate - radiații spontane (acțiunea sărurilor de uraniu pe o placă fotografică).
„Structura nucleului atomului” - Reactor nuclear. Transformarea radioactivă a nucleelor atomice. Numerele de masă elemente chimice. Structura atomului. Nucleele de uraniu sunt bombardate cu neutroni. Modelul Rutherford al atomului. Folie din metalul investigat. Compoziția nucleului atomic. Experimentele lui Rutherford 1. Un grăunte de radiu a fost plasat într-un vas de plumb cu pereți groși.
„„Structura nucleului” a fizicii” - Proactinius. Modelul proton-neutron al nucleului atomic. Jumătate de viață. Aflați despre istoria descoperirii neutronului. Numărul de taxare. radiatii. Câți nucleoni conțin nucleele. Structura nucleului atomic. Produs necunoscut. Dispozitiv. Izotopi. Particulă. Neutroni. Radiația. Structura atomului. Miez de heliu. Element nou.
„Structura atomului și a nucleului atomic” - Nivel de energie(strat electronic). Scrieți o formulă electronică. Distribuția electronilor pe subniveluri. Compoziția atomului. Exemple de formule electronice ale atomilor. Goluri. Diagrama grafică electronică a atomului de azot. Găsirea unui electron într-un atom. Deschiderea miezului. Imaginea orbitalilor electronilor. Reguli de distribuție a electronilor la nivel de energie.
„Compoziția nucleului atomic” – FORȚE NUCLARE – forțe atractive care leagă protonii și neutronii din nucleu. Numărul de sarcină este egal cu sarcina nucleului, exprimat în elementar sarcini electrice. Numărul de încărcare este egal cu numărul ordinal al elementului chimic. Sarcini. Nu depinde de prezența unei taxe. Planul lecției. Forma generală denumiri de bază. Compoziția nucleului atomic.
„Compoziția nucleului atomului” - Dimensiunile nucleelor atomice. Compoziția nucleului unui atom. Taxa de bază. Modelul proton-neutron al nucleului. Nucleul unui atom al unui element chimic. Proton și neutron. Nucleul unui atom. Radioactivitate. Graficul legăturii specifice a nucleonilor din nucleu. Schema experimentelor lui Rutherford. Numărul de taxare. Proprietățile forțelor nucleare. Numărul de neutroni din nucleul unui atom. Descoperirea neutronului.
În total sunt 7 prezentări în subiect






