1 nucleu atomic compoziția sa. Nucleul atomic. Momentul cvadrupol electric
Dezintegrarea clusterului
Nucleul atomic- partea centrală a atomului, în care se concentrează masa sa principală (mai mult de 99,9%). Nucleul este încărcat pozitiv, sarcina nucleului determină elementul chimic căruia îi este atribuit atomul. Dimensiunile nucleelor diferiților atomi sunt de câteva femtometre, care este de peste 10 mii de ori mai mică decât dimensiunea atomului însuși.
O alta fapt interesant este că pentru elementele mai mari, raportul dintre neutroni și protoni este de obicei în jur de 5, dar nu mai mare. Acest lucru indică faptul că, dacă protonii și neutronii lor ar fi distribuite uniform de-a lungul lanțului, atunci ar exista unul sau doi neutroni între o pereche de protoni, dar niciodată trei neutroni la rând.
Așa ar arăta doi și trei neutroni prinși între protoni. După cum se poate observa, atunci când există doi neutroni, se pare că protonii se pot atașa de sarcinile lor negative exterioare, menținându-le astfel stabili. Când există trei neutroni, neutronul mediu este dificil de furnizat și există, de asemenea, un număr mare de sarcini negative apropiate. Prin urmare, este puțin probabil ca situația cu trei neutroni să fie stabilă.
Nucleul atomic, considerat ca o clasă de particule cu un anumit număr de protoni și neutroni, este numit în mod obișnuit nuclidul.
Numărul de protoni din nucleu se numește numărul său de sarcină - acest număr este egal cu numărul ordinal al elementului căruia îi aparține atomul, din tabelul periodic. Numărul de protoni din nucleu determină structura învelișului de electroni a unui atom neutru și, prin urmare, proprietățile chimice ale elementului corespunzător. Numărul de neutroni dintr-un nucleu se numește acestuia număr izotopic. Nucleii cu același număr de protoni și numere diferite de neutroni se numesc izotopi. Nucleii cu același număr de neutroni dar cu un număr diferit de protoni se numesc izotone. Termenii izotop și izotonă sunt folosiți și în relație cu atomii care conțin nucleele indicate, precum și pentru a caracteriza varietățile nechimice ale unui element chimic. Numărul total de nucleoni dintr-un nucleu se numește numărul său de masă () și este aproximativ egal cu masa medie a unui atom, indicată în tabelul periodic. Nuclizi cu același numar de masa, dar diferite compoziții protoni-neutroni se numesc izobare.
Anumite reguli par să guverneze formarea izotopilor stabili.
- Un proton nu poate fi atașat direct de un alt proton la capătul lanțului.
- Neutronul nu poate fi la capătul lanțului.
- Nu pot exista mai mult de doi neutroni într-o secvență.
- Articole mari necesită mai mulți neutroniși respectați regula.
Ca orice sistem cuantic, nucleele pot fi într-o stare excitată metastabilă, iar în unele cazuri durata de viață a unei astfel de stări este calculată în ani. Astfel de stări excitate ale nucleelor se numesc izomeri nucleari.
Scurtă istorie a descoperirii
Imprăștirea particulelor încărcate poate fi explicată presupunând un atom care constă dintr-o sarcină electrică centrală concentrată într-un punct și înconjurat de o distribuție sferică uniformă a electricității opuse. dimensiune egală. Cu o astfel de structură a atomului, particulele α și β, când trec prin ele distanta scurta de la centrul atomului, experimentați abateri mari, deși probabilitatea unei astfel de abateri este mică.
Proprietățile forțelor nucleare, descrierea și originea lor
Hidrogenul-3 încalcă regula 2, deoarece este practic stabil. Această stabilitate este posibilă deoarece expansiunea protonică a heliului-3 este suficientă pentru un electron. În ceea ce privește regula 1, aceasta se aplică numai protonilor de la sfârșitul lanțului, nu și lanțului, deoarece o pereche de protoni poate fi protejată de neutronii din jur.
Adăugând la regula 3, acești doi neutroni din secvență nu ar trebui să fie aproape de sfârșitul lanțului, deoarece nu există destui protoni de protoni pentru a-i menține pe loc. Adică, neutronii secvenționați trebuie să fie încorporați în lanț. Acest lucru indică de ce elementelor mai mici nu li se permite să aibă neutroni secvenționați, deoarece lanțul lor nu este suficient de lung.
Astfel, Rutherford a descoperit nucleul atomic, din acel moment a început fizica nucleară, studiind structura și proprietățile nucleelor atomice.
După descoperirea izotopilor stabili ai elementelor, nucleului celui mai ușor atom i s-a atribuit rolul unei particule structurale a tuturor nucleelor. Din 1920, nucleul atomului de hidrogen are un termen oficial - proton. După teoria proton-electron intermediar a structurii nucleului, care a avut multe neajunsuri evidente, în primul rând, a contrazis rezultatele experimentale ale măsurătorilor spinilor și momentelor magnetice ale nucleelor, în 1932 James Chadwick a descoperit o nouă particulă neutră electric. , numit neutron. În același an, Ivanenko și, în mod independent, Heisenberg au prezentat o ipoteză despre structura proton-neutron a nucleului. Această ipoteză a fost pe deplin confirmată de întregul curs ulterior de dezvoltare a fizicii nucleare și aplicațiile sale.
Observațiile anterioare nu explică pe deplin toți izotopii. De exemplu, heliul-8 este mai stabil decât heliul-7, iar litiul-11 este mai stabil decât litiul. În ambele cazuri, izotopul mai mare are mai mulți neutroni și ne așteptăm la o stabilitate mai mică. În cazul litiului, un studiu interesant a constatat că nucleele de litiu-11 și litiu-12 erau mult mai mari decât litiul. Este posibil ca neutronii suplimentari să fie cumva separați de restul lanțului și să plutească la o anumită distanță. De exemplu, litiu-11 poate fi făcut din litiu-9 și doi neutroni ținuți la o anumită distanță.
Fizica nucleara
Pentru prima dată, încărcările nucleelor atomice au fost determinate de Henry Moseley în 1913. Al lor observatii experimentale Omul de știință a interpretat dependența lungimii de undă a razelor X de o anumită constantă, care se schimbă cu una de la un element la altul și este egală cu una pentru hidrogen:
Cum s-ar putea întâmpla acest lucru nu este clar. teorii modele atomice: John Dalton Materia este formată din atomi indivizibili, sunt indestructibili. Toți atomii unui element dat sunt identici în proprietățile lor fizice și chimice. Atomii diferitelor elemente diferă fizic și proprietăți chimice. Atomii diferitelor elemente sunt combinați în rapoarte simple între numere întregi și formează molecule. reacții chimice constau intr-o combinatie de separare sau rearanjare a atomilor. Limitări: El nu a putut explica de ce și cum atomii se unesc pentru a forma atomi complecși. Natura forțelor care țin atomii împreună în atomii compușilor. De ce atomii nu pot exista în stare liberă și de ce atomii de compuși pot exista liber. Se pare că înghețata cu ciocolată s-a dovedit mai târziu a fi greșită. Limitări: El nu a putut explica rezultatul experimentului de împrăștiere explicat de experimentul lui Rutherford. Nu avea nicio dovadă experimentală în sprijinul ei. Pe această bază, au fost explicate radiația termoionică, radiația fotoelectrică și ionizarea. Acest lucru se datorează împrăștierii particulelor α de către atomii de folie. În ceea ce privește stabilitatea atomului Electronii care se rotesc în jurul nucleului au accelerație centripetă. Conform electrodinamicii, particulele încărcate accelerate radiază energie sub formă de unde electromagnetice. Prin urmare, undele electromagnetice trebuie emise continuu de electroni care se rotesc. Datorită acestei pierderi continue de energie a electronilor, razele orbitelor lor trebuie să scadă constant, iar în cele din urmă electronul trebuie să cadă în nucleu. Astfel, atomul nu poate rămâne stabil. De asemenea, modelul lui Rutherford nu a explicat spectrul liniei. Dezavantajele modelului Rutherford Niels Teorii modelului atomic David Bohr: Teoria lui Bohr Orbite circulare fixe: Electronii se deplasează în jurul nucleului pe orbite circulare concentrice. Când se rotesc pe orbite stabile, electronii nu radiază energie, în ciuda accelerației lor către centrul orbitei. Fiecare dintre orbitele fixe este asociată cu o anumită cantitate de energie, numită energie staționară. Săritura unui electron de la un nivel de energie la altul. Nicio explicație pentru efectul Zeeman și Stark: influența câmpurilor electrice și magnetice asupra atomi spectrali. Când un câmp magnetic este aplicat unui atom, liniile spectrale observate în mod obișnuit se împart. Acest efect este cunoscut sub numele de efectul Zeeman. Liniile spectrale de asemenea divizat în prezența unui câmp electric. Acest efect este cunoscut sub numele de efectul Stark. Clasificarea atomilor: Izomerii sunt molecule cu aceeași formulă moleculară, dar cu structuri chimice diferite. Această regulă este mai precisă pentru nucleele mai mari. Pentru toți izotopii cunoscuți ai elementelor naturale, doar 250 dintre ei sunt stabili . Toți acești izotopi stabili au numar atomicîntre 1 și . Masa nucleului va fi mai mică decât masa tuturor protonilor și neutronilor care îl alcătuiesc. Diferența se numește defect de masă, care este convertit în energie dacă nucleul este distrus. Cantitatea de energie care ține împreună nucleonii se numește energie de legare. Această cantitate de energie este mai mare pentru nucleele care sunt stabile decât pentru nucleele instabile. Masa atomică și unitățile de energie. Localizarea electronilor în orbiti.
- Fiecare materie este alcătuită din obiecte de bază numite elemente.
- Nucleul este format din protoni și neutroni, care se numesc nucleoni.
- Cea mai mare parte a masei unui atom aparține nucleului.
Și - permanent.
Din care Moseley a concluzionat că constanta atomică găsită în experimentele sale, care determină lungimea de undă a radiației caracteristice de raze X și coincide cu numărul de serie al elementului, nu poate fi decât o sarcină. nucleul atomic care a devenit cunoscut ca legea lui Moseley .
Greutate
Datorită diferenței de număr de neutroni, izotopii unui element au mase diferite, ceea ce este o caracteristică importantă a nucleului. LA fizica nucleara masa nucleelor este de obicei măsurată în unități de masă atomică ( A. mânca.), pentru unul a. e. m. luați 1/12 din masa nuclidului de 12 C. Trebuie remarcat faptul că masa standard care este de obicei dată pentru un nuclid este masa unui atom neutru. Pentru a determina masa nucleului, este necesar să scădem suma maselor tuturor electronilor din masa atomului (se va obține o valoare mai precisă dacă luăm în considerare și energia de legare a electronilor cu nucleul) .
Dar în atomi, electronii sunt chiar acolo, lângă protonii din nucleu. De ce electronii nu se ascund direct în nucleu și nu se lipesc de protoni? Electronii trebuie să cadă în nucleu. Oricine a stat vreodată în clasa a patra știe că atunci când freci un balon pe păr sau pe pulover, îl poți lipi de perete. Puteți face acest lucru deoarece frecarea a făcut ca balonul să acumuleze o mulțime de electroni. Electronii sunt atrași de protoni și respinși de alți electroni, așa că atunci când balonul este împins lângă perete, electronii din perete se repetă, lăsând protoni expuși.
În plus, echivalentul energetic al masei este adesea folosit în fizica nucleară. Conform relației Einstein, fiecărei valori de masă îi corespunde energie totală:
, unde este viteza luminii în vid.Raportul dintre a. e.m. și echivalentul său de energie în jouli:
Acești protoni pe jumătate goi erau irezistibili pentru electronii din balon, iar electronii alergau spre protoni, luând balonul cu ei. Întrebarea este de ce s-au mutat acești electroni din părul tău în balon în primul rând? Dacă ar fi atât de uimiți de protoni, ar avea mulți dintre ei chiar în părul tău. Atomii neîncărcați ai perechii sunt egali cu numărul de electroni și protoni. Electronii trebuie să se apropie de nucleul atomic.
În fizica clasică, electronii trebuie să cadă în nucleu, chiar dacă nu sunt atrași de sarcina protonului. Modelele timpurii de atomi aveau electroni care se învârteau în jurul nucleului, la fel ca o planetă se învârte în jurul soarelui. Orbitarea într-un cerc înseamnă crearea unei multe schimbări de direcție, ceea ce înseamnă accelerație. Când incarcare electrica supusă accelerației, emite radiații electromagnetice. Radiatie electromagnetica este energie, iar un electron poate pierde unul dintre cele două tipuri de energie: energie cinetică sau energie potențială.
Rază
Analiza dezintegrarii nucleelor grele a rafinat estimarea lui Rutherford și a legat raza nucleului de numărul de masă printr-o relație simplă:
,unde este o constantă.
Deoarece raza nucleului nu este o caracteristică pur geometrică și este asociată în primul rând cu raza de acțiune a forțelor nucleare, valoarea depinde de proces, în timpul analizei căruia s-a obținut valoarea, valoarea medie m, deci raza a nucleului în metri:
Oricum, se va prăbuși în miez. Soluție de energie cinetică și potențială. Să luăm în considerare un electronic care plutește în spațiu. Cum îi măsurăm energia cinetică și potențială? Începeți prin a vă imagina un proton, departe. Împreună se pot combina și forma un atom de hidrogen. Când le măsurăm progresul unul față de celălalt, în termeni de energie, vom vedea mult din ceea ce vedem în fizica clasică.
Un electron care se apropie de un proton va avea energie cinetică și energie potențială. Când este departe, va avea o cantitate relativ mare energie potențială, la fel ca obiectele ridicate deasupra solului au o cantitate uriașă de energie potențială. Pe măsură ce se deplasează spre proton, pierde o parte din acea energie potențială. Unele dintre ele radiază sub formă de energie electromagnetică. Unele dintre ele sunt transformate în energie cinetică. Energia cinetică reține saltul de electroni și îl împiedică să rămână în nucleu și să se combine cu protonul.
Momentele nucleului
La fel ca nucleonii care îl alcătuiesc, nucleul are propriile momente.
A învârti
Deoarece nucleonii au propriul lor moment mecanic, sau spin, egal cu , atunci nucleii trebuie să aibă și momente mecanice. În plus, nucleonii participă la nucleu în mișcare orbitală, care este, de asemenea, caracterizată printr-un anumit moment unghiular al fiecărui nucleon. Momentele orbitale iau doar valori întregi (constanta lui Dirac). Toate momentele mecanice ale nucleonilor, atât spinurile cât și orbitale, sunt însumate algebric și constituie spinul nucleului.
Aici, unde puntea este puțin pliată în favoarea electronilor care nu sunt combinați cu protoni. Energia cinetică, dacă electronul se află în nucleu, este infinită. Energia potențială, dacă electronul se află în nucleu, este infinit negativ. dacă doriți să calculați energia cinetică în orice moment, aceasta este jumătate din energia potențială. Cu alte cuvinte, energia cinetică are mai multă greutate, iar electronul rămâne în afara nucleului.
Există o problemă în a gândi electronii ca bucăți mici de materie care se rotesc în jurul unei bucăți mari de materie. De fapt, ei nu se comportă așa. Electronul nu poate fi gândit ca o planetă și, în schimb, ar trebui gândit ca un fel de nor de probabilitate. Și nu în sensul că acesta este cel mai util mod de a gândi la asta - asta este cu adevărat un electron. Pentru a înțelege comportamentul unui electron, trebuie să ne gândim unde va fi mai dens acest nor sau unde cel mai probabil electron, sau unde există o sarcină negativă maximă.
În ciuda faptului că numărul de nucleoni dintr-un nucleu poate fi foarte mare, spinurile nucleilor sunt de obicei mici și nu se ridică la mai mult de câțiva, ceea ce se explică prin particularitatea interacțiunii nucleonilor cu același nume. Toți protonii și neutronii perechi interacționează numai în așa fel încât spinurile lor să se anuleze reciproc, adică perechile interacționează întotdeauna cu spinurile antiparalele. Momentul orbital total al unei perechi este, de asemenea, întotdeauna zero. Ca urmare, nucleele formate dintr-un număr par de protoni și un număr par de neutroni nu au un impuls mecanic. Spiri non-zero există numai pentru nucleele care au nucleoni nepereche în compoziția lor, spin-ul unui astfel de nucleon este adăugat la propriul său impuls orbital și are o valoare jumătate întreagă: 1/2, 3/2, 5/2. Nucleele de compoziție impar-impar au spinuri întregi: 1, 2, 3 etc.
fisiunea nucleelor atomice
Să ne uităm din nou la călătoria către miezul proton-hidrogen, cu excepția faptului că ai face-o dacă ai măsura fiecare volum mic de spațiu cu un metru probabilist. Departe de nucleu, un contor probabilist nu ar înregistra practic nicio probabilitate de încărcare negativă. Pe măsură ce vă apropiați încet, contorul crește și crește până înregistrează cea mai mare probabilitate pe miez. Acest lucru pare să contrazică ceea ce tocmai am înțeles mai sus și realitatea.
Trucul aici este să înțelegeți că o cantitate mică de spațiu pe o linie la o anumită distanță de miez nu este cel mai bun mod măsurarea probabilității ca un electron să se afle într-un anumit volum al spațiului. Nu ne interesează dacă electronul este deasupra, dedesubt, la stânga sau la dreapta nucleului. Vrem doar să fie la ceva distanță. Aceasta înseamnă că ar putea fi oriunde pe „coaja” sferică din jurul nucleului. Ceea ce ne dorim este volumul acestei carcasi.
Moment magnetic
Măsurătorile de rotație au fost posibile prin prezența momentelor magnetice direct legate. Se măsoară în magnetoni și pentru diferite nuclee sunt de la -2 la +5 magnetoni nucleari. Datorită masei relativ mari a nucleonilor, momentele magnetice ale nucleilor sunt foarte mici în comparație cu cele ale electronilor, astfel încât măsurarea lor este mult mai dificilă. La fel ca spinurile, momentele magnetice sunt măsurate prin metode spectroscopice, cea mai precisă fiind metoda rezonanței magnetice nucleare.
Momentul magnetic al perechilor pare-pare, ca și spinul, este egal cu zero. Momentele magnetice ale nucleilor cu nucleoni neperechi sunt formate din momentele intrinseci ale acestor nucleoni și momentul asociat cu mișcarea orbitală a protonului nepereche.
Momentul cvadrupol electric
Nucleele atomice cu un spin mai mare sau egal cu unitatea au momente cvadrupolare diferite de zero, ceea ce indică faptul că nu sunt tocmai sferici. Momentul cvadrupol are un semn plus dacă nucleul este extins de-a lungul axei de spin (corp fusiform) și un semn minus dacă nucleul este întins într-un plan perpendicular pe axa de spin (corp lenticular). Sunt cunoscuți nuclei cu momente quadrupol pozitive și negative. Absența simetriei sferice în câmpul electric creat de un nucleu cu un moment cvadrupol diferit de zero duce la formarea unor niveluri suplimentare de energie ale electronilor atomici și la apariția liniilor de structură hiperfine în spectrele atomilor, distanța dintre care depind de momentul cvadrupol. .
Energie legată
Stabilitatea miezului
Din faptul că energia de legare medie scade pentru nuclizii cu numere de masă mai mari sau mai mici de 50-60, rezultă că pentru nucleele cu cele mici, procesul de fuziune este favorabil energetic - fuziunea termonucleară, ducând la o creștere a numărului de masă, iar pentru nucleele cu mari – procesul de fisiune. În prezent, ambele procese care conduc la eliberarea energiei au fost realizate, cel din urmă fiind baza energiei nucleare moderne, iar primul fiind în curs de dezvoltare.
Studii detaliate au arătat că stabilitatea nucleelor depinde în mod semnificativ și de parametrul - raportul dintre numărul de neutroni și protoni. În medie, pentru nucleele cele mai stabile, prin urmare, nucleele nuclizilor ușoare sunt cele mai stabile la , iar odată cu creșterea numărului de masă, repulsia electrostatică dintre protoni devine din ce în ce mai vizibilă, iar regiunea de stabilitate se deplasează către ( vezi figura explicativă).
Dacă luăm în considerare tabelul nuclizilor stabili care apar în natură, putem acorda atenție distribuției lor în funcție de valorile pare și impare și . Toate nucleele cu valori pare ale acestor marimi sunt nuclee de nuclizi usori , , , . Dintre izobarele cu A impar, de regulă, doar unul este stabil. În cazul celor pare, există adesea două, trei sau mai multe izobare stabile, prin urmare, cele pare-pare sunt cele mai stabile, cele mai puțin - cele impar-impare. Acest fenomen indică faptul că atât neutronii, cât și protonii tind să se grupeze în perechi antiparalele.
Până în anii 20 ai secolului XX, fizicienii nu se mai îndoiau că nucleele atomice descoperite de E. Rutherford în 1911, precum și atomii înșiși, au o structură complexă. Ei au fost convinși de acest lucru de numeroasele fapte experimentale acumulate până atunci: descoperirea radioactivității, demonstrarea experimentală a modelului nuclear al nucleului, măsurarea raportului e/m pentru electron, particule α și pentru so- numită H-particulă - nucleul atomului de hidrogen, descoperirea radioactivității artificiale și reactii nucleare, măsurarea sarcinilor nucleelor atomice etc. Acum este bine stabilit că acele nuclee atomice diverse elemente Ele sunt formate din două particule, protoni și neutroni.
Prima dintre aceste particule este un atom de hidrogen din care a fost îndepărtat un singur electron. Această particulă a fost deja observată în experimentele lui J. Thomson (1907), care a reușit să măsoare raportul e/m în ea. În 1919, E. Rutherford a descoperit nucleele atomului de hidrogen din produsele de fisiune ale nucleelor atomilor multor elemente. Rutherford a numit această particulă proton. El a sugerat că protonii fac parte din toate nucleele atomice. Schema experimentelor lui Rutherford este prezentată în fig. unsprezece.
Dispozitivul lui Rutherford a constat dintr-o cameră evacuată în care a fost plasat un container K cu o sursă de particule α. Fereastra camerei a fost acoperită cu folie metalică Ф, a cărei grosime a fost aleasă astfel încât particulele α să nu poată pătrunde prin ea. În afara ferestrei era paravanul E, acoperit cu sulfură de zinc. Folosind microscopul M, a fost posibil să se observe scintilații în punctele în care particulele încărcate grele lovesc ecranul. Când camera a fost umplută cu azot la presiune scăzută, pe ecran au apărut fulgerări ușoare, indicând apariția unui flux de particule capabile să pătrundă prin folia F, care a blocat aproape complet fluxul de particule α.
Îndepărtând ecranul E de fereastra camerei, a măsurat Rutherford înseamnă cale liberă particulele observate în aer. S-a dovedit a fi aproximativ egală cu 28 cm, ceea ce a coincis cu estimarea lungimii drumului particulelor de H observată mai devreme de J. Thomson. Studiile privind efectul asupra particulelor scoase din nucleele de azot de câmpurile electrice și magnetice au arătat că aceste particule au o sarcină elementară pozitivă și masa lor este egală cu masa nucleului unui atom de hidrogen. Ulterior, experimentul a fost efectuat cu o serie de alte substanțe gazoase. În toate cazurile, s-a constatat că particulele α elimină particulele H sau protonii din nucleele acestor substanțe. Conform măsurătorilor moderne, sarcină pozitivă protonul este exact egal cu sarcina elementară e = 1,60217733 10 –19 C, adică este egal în modul sarcina negativa electron. În prezent, egalitatea sarcinilor protonilor și electronilor a fost verificată cu o precizie de 10-22. O astfel de coincidență a sarcinilor a două particule diferite este surprinzătoare și rămâne unul dintre misterele fundamentale ale fizicii moderne.
Figura 11. Schema experimentelor lui Rutherford pentru a detecta protoni în produsele de fisiune nucleară. K - recipient de plumb cu o sursă radioactivă de particule α, F - folie metalică, E - ecran acoperit cu sulfură de zinc, M - microscop.
masa de protoni, conform măsurătorilor moderne, este egal cu mp = 1,67262 10 -27 kg. În fizica nucleară, masa unei particule este adesea exprimată în unități de masă atomică (a.m.u.) egale cu 1/12 din masa unui atom de carbon cu un număr de masă de 12:1 a.u. e.m. = 1,66057 10 -27 kg.
Prin urmare, m p \u003d 1,007276 a. e. m. În multe cazuri, este convenabil să se exprime masa unei particule în valori echivalente de energie în conformitate cu formula E = mc 2 . Deoarece 1 eV = 1,60218 10 -19 J, în unități de energie masa protonului este de 938,272331 MeV. Astfel, în experimentul lui Rutherford, a fost descoperit fenomenul de scindare a nucleelor de azot și a altor elemente în timpul impactului particulelor α rapide și s-a demonstrat că protonii fac parte din nucleele atomilor. După descoperirea protonului, s-a sugerat că nucleele atomilor constau numai din protoni. Cu toate acestea, această ipoteză s-a dovedit a fi insuportabilă, deoarece raportul dintre sarcina nucleului și masa sa nu rămâne constant pentru diferite nuclee, așa cum ar fi dacă numai protonii ar fi incluși în compoziția nucleelor. Pentru nucleele mai grele, acest raport se dovedește a fi mai mic decât pentru cele ușoare, adică atunci când treceți la nuclee mai grele, masa nucleului crește mai repede decât sarcina. În 1920, Rutherford a emis ipoteza existenței unei perechi compacte proton-electron legate rigid în compoziția nucleelor, care este o formațiune neutră din punct de vedere electric - o particulă cu o masă aproximativ egală cu masa unui proton. A venit chiar și cu un nume pentru această particulă ipotetică - neutroni.
A fost o idee foarte frumoasă, dar, după cum sa dovedit mai târziu, eronată. Un electron nu poate face parte dintr-un nucleu. Calculul mecanic-cuantic bazat pe relația de incertitudine arată că un electron localizat în nucleu, adică o regiune cu dimensiunea R ≈ 10–13 cm, trebuie să aibă un colosal. energie kinetică, care este cu multe ordine de mărime mai mare decât energie nucleară de legare pe particulă. Ideea existenței unei particule neutre grele i s-a părut atât de atractivă pentru Rutherford, încât a invitat imediat un grup de studenți, condus de James Chadwick, să caute o astfel de particule. Doisprezece ani mai târziu, în 1932, Chadwick a investigat experimental radiația care apare atunci când beriliul este iradiat cu particule α și a descoperit că această radiație este un flux de particule neutre cu o masă aproximativ egală cu cea a unui proton. Așa a fost descoperit neutronul. Pe fig. 12 prezintă o diagramă simplificată a configurației pentru detectarea neutronilor.
Atunci când beriliul este bombardat cu particule α emise de poloniul radioactiv, ia naștere o radiație puternică penetrantă care poate depăși un astfel de obstacol precum un strat de plumb de 10-20 cm grosime.Această radiație a fost observată aproape simultan cu Chadwick de către soții Joliot-Curie Irene și Frederic (Irene este fiica lui și Pierre Curie), dar au presupus că acestea sunt raze γ de înaltă energie. Ei au descoperit că, dacă o placă de parafină este plasată în calea radiației de beriliu, atunci puterea de ionizare a acestei radiații crește brusc. Ei au demonstrat că radiațiile de beriliu elimină protonii din parafină, care sunt prezenți în cantități mari în această substanță care conține hidrogen. Pe baza drumului liber al protonilor în aer, ei au estimat energia γ-quantilor capabile să imprime viteza necesară protonilor într-o coliziune.
S-a dovedit a fi uriaș - aproximativ 50 MeV. J. Chadwick a efectuat în 1932 o serie de experimente privind un studiu cuprinzător al proprietăților radiațiilor rezultate din iradierea beriliului cu particule α. În experimentele sale, Chadwick a folosit diverse metode pentru studierea radiațiilor ionizante. Pe fig. 12 prezintă un contor Geiger conceput pentru a detecta particulele încărcate. Este alcătuit dintr-un tub de sticlă acoperit la interior cu un strat de metal (catod) și un fir subțire care trece de-a lungul axei tubului (anod). Tubul este umplut cu un gaz inert (de obicei argon) la presiune scăzută. O particulă încărcată care zboară printr-un gaz provoacă ionizarea moleculelor. Electronii liberi produși ca urmare a ionizării sunt accelerați câmp electricîntre anod și catod până la energiile la care începe ionizarea de impact. Apare o avalanșă de ioni și un scurt impuls de curent de descărcare trece prin contor. Un alt instrument important pentru studierea particulelor este așa-numita cameră cu nori, în care o particulă încărcată rapid lasă o urmă (urmă). Traiectoria particulelor poate fi observată direct sau fotografiată.
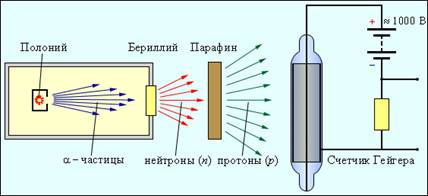
Figura 12. Schema de configurare pentru detectarea neutronilor.
Acțiunea camerei cu nori, creată în 1912, se bazează pe condensarea vaporilor suprasaturați pe ionii formați în volumul de lucru al camerei de-a lungul traiectoriei unei particule încărcate. Folosind o cameră cu nori, se poate observa curbura traiectoriei unei particule încărcate în electric și campuri magnetice. J. Chadwick, în experimentele sale, a observat în camera cu nori urme ale nucleelor de azot care au experimentat o coliziune cu radiația de beriliu. Pe baza acestor experimente, el a făcut o estimare a energiei cuanticei γ, care este capabilă să informeze nucleii de azot cu privire la viteza observată în experiment. S-a dovedit a fi egal cu 100–150 MeV. O astfel de energie uriașă nu ar putea avea γ-quanta emise de beriliu. Pe această bază, Chadwick a concluzionat că din beriliu, sub acțiunea particulelor α, nu zboară γ-quanta fără masă, ci mai degrabă particule grele.
Deoarece aceste particule erau foarte penetrante și nu ionizau direct gazul din contorul Geiger, ele erau prin urmare neutre din punct de vedere electric. Așa s-a dovedit existența. neutroni- particule prezise de Rutherford cu mai mult de 10 ani înainte de experimentele lui Chadwick. Neutronul este particulă elementară. Nu ar trebui să fie reprezentat ca o pereche compactă proton-electron, așa cum a sugerat inițial de către Rutherford. Conform măsurătorilor moderne, masa neutronilor m n \u003d 1,67493 10 -27 kg \u003d 1,008665 a.u. e. m. În unități de energie, masa neutronilor este de 939,56563 MeV. Masa unui neutron este cu aproximativ două mase de electroni mai mare decât masa unui proton. Imediat după descoperirea neutronului, omul de știință rus D. D. Ivanenko și fizicianul german V. Heisenberg au prezentat o ipoteză despre structura proton-neutron a nucleelor atomice, care a fost pe deplin confirmată de studiile ulterioare.
Se numesc protoni și neutroni nucleonii. Sunt introduse o serie de notații pentru a caracteriza nucleele atomice. Numărul de protoni care formează nucleul atomic este notat cu simbolul Z și se numește numărul de taxare sau numărul atomic (acesta este numărul de serie din tabelul periodic al lui Mendeleev). Sarcina nucleară este Ze, unde e sarcina elementara. Numărul de neutroni este notat cu simbolul N. Numărul total nucleonii (adică protonii și neutronii) se numesc numar de masa A: A=Z+N.
Nucleele elementelor chimice sunt notate cu simbolul , unde X este simbolul chimic al elementului. De exemplu, - hidrogen, - heliu, - oxigen, - carbon, - uraniu. Nucleele aceluiași element chimic pot diferi în ceea ce privește numărul de neutroni. Astfel de nuclee se numesc izotopi. Majoritatea elementelor chimice au mai mulți izotopi. De exemplu, hidrogenul are trei izotopi: - hidrogen obișnuit, - deuteriu și - tritiu. Carbonul are 6 izotopi, oxigenul are 3. Elemente chimiceîn conditii naturale de obicei un amestec de izotopi. Prezența izotopilor determină valoarea masei atomice a unui element natural din tabelul periodic al lui Mendeleev. Deci, de exemplu, relativ masă atomică carbonul natural este 12.011.






