Numărul de masă al neutronului este același. Marea enciclopedie a petrolului și gazelor
Fizica clasa a 9-a
Tema: Structura atomului și a nucleului atomic. Utilizarea energiei nucleelor atomice
Lecția 56 Numar de masa. Încărca
număr. forte nucleare
Yeryutkin Evgheni Sergheevici
Profesor de fizică cea mai înaltă categorie GOU SOSH №1360
Moscova
Salut! Lecția de astăzi va fi dedicată unei întrebări legate de discuția despre structura nucleului atomic, numărul de sarcină, numărul de masă, vom vorbi și despre ce este forte nucleare. Lecția noastră este o rezumare a unor rezultate intermediare pe toate problemele studiate anterior. Aș dori să spun că am studiat întrebări legate de structura atomului și structura nucleului. Prin urmare, astăzi vom vorbi despre asta. Câteva rezumate ale subiectelor anterioare, întrebări anterioare. Înainte de a ajunge la prima întrebare, vom vorbi despre asta. În lecția anterioară, am spus că Rutherford în experimentele sale a stabilit că există o astfel de particule precum un proton. Ceva mai târziu, în 1932, Chadwick a stabilit că mai exista o particulă numită neutron. După această descoperire, independent unul de celălalt, doi oameni, omul de știință rus Ivanenko și omul de știință german Heisenberg, au propus un model proton-neutron pentru structura nucleului atomic. Conform acestei teorii Ivanenko-Heisenberg, nucleul oricărui atom conține protoni și neutroni. Acești protoni și neutroni împreună, cei care se află în nucleul unui atom, s-a decis să se numească nucleoni. În acest fel, „nucleon” (din latină „nucleus”) - nume comun pentru protoni și neutroni. Acele particule care au o sarcină și acele particule care nu au sarcină, neutroni, toate aceste particule împreună se numesc nucleoni. Hai sa vorbim despre altceva. Ideea unei încărcături nucleare a fost prezentată pentru prima dată în 1913 de omul de știință englez Henry Moseley. El a sugerat că, deoarece atomul este neutru din punct de vedere electric, ordinalul numărul elementului, înmulțit cu elementul incarcare electrica, aceasta este sarcina nucleului. Cum a ajuns Moseley la această concluzie? Faptul este că numărul de electroni dintr-un atom corespunde numărului de serie. Aceasta înseamnă că sarcina tuturor electronilor este produsul dintre numărul de serie și sarcina unui electron. Deoarece nucleul este concentrat sarcină pozitivă, deci același lucru se poate spune despre nucleu. Să aruncăm o privire la cum a apărut Moseley exact la ceea ce numim numărul de taxare. Uite:
qeu = Z . | e|
qeu- sarcina nucleara
e - sarcina electronilor
Zeste numărul de protoni din nucleu, numărul de sarcină
Sarcina unui număr, conform acestei afirmații, este definită ca produsul dintre numărul de serie și sarcina electrică elementară. În acest caz e - aceasta este sarcina electronului, se numește sarcină electrică elementară și se ia modulo, deoarece este clar că sarcina nucleului este pozitivă. În acest caz, numărul de serie a început să fie numit numărul de încărcare, numărul de serie este numărul corespunzător numărului de protoni din nucleu. Astfel, atunci când vorbim despre numărul de serie, putem vorbi despre numărul de protoni din nucleu. Următorul număr despre care să vorbim este numărul de masă. Acesta, acest număr, este notat cu litera A, iar același număr este luat din tabelul periodic și rotunjit la numere întregi. Apoi putem vorbi despre ecuație, care se numește ecuația Ivanenko-Heisenberg în întreaga lume. Această ecuație constă din trei numere: numărul de masă, numărul de încărcare și numărul de neutroni. Să vedem cum este scris și cum sunt notate aceste mărimi.
Ecuația Ivanenko-Heisenberg
A =Z + N
A este numărul de masă
Zeste numărul elementului,
Neste numărul de neutroni din nucleu
Uite: numărul de masă A spune cât nucleonii intră în miez. Sa dovedit că, conform tabelului periodic, se determină numărul de masă element chimic, determinăm numărul de nucleoni din nucleul unui atom.
Z, așa cum am spus, va fi numărul de serie și numărul de protoni din nucleu. N în acest caz este numărul de neutroni. Astfel, putem determina numărul de neutroni, numărul de protoni din această ecuație, cunoscând numărul de masă și numărul de serie. Aici este necesar să rețineți un punct important. Cert este că, în 1913, un alt om de știință Soddy (vă amintiți că acest om a lucrat cu Rutherford) a stabilit un lucru interesant. S-a constatat că există elemente chimice cu exact aceleași proprietăți chimice, dar numere de masă diferite. Elemente care au la fel Proprietăți chimice, dar cu numere de masă diferite, au devenit cunoscuți ca izotopi. Izotopi - Acestea sunt elemente chimice cu aceleași proprietăți chimice, dar cu greutate diferită nuclee atomice.
De asemenea, trebuie adăugat că izotopii au radioactivitate diferită. Toate acestea împreună au condus la studiul acestei probleme. Prezintă izotopi ai elementelor chimice ușoare și grele. Sa vedem. Am ales diferite zone ale tabelului periodic pentru a arăta că aproape toate elementele chimice au izotopi.
Izotopi:
H - protiumU
H - deuteriuU
H - tritiu
Hidrogenul are trei dintre acești izotopi. Primul izotop H se numește protium. Vă rugăm să rețineți că numărul de serie este plasat dedesubt, acesta este numărul Z, iar numărul de masă este scris deasupra - acesta este numărul A. Deasupra A, dedesubt Z, și dacă înțelegem că asta înseamnă că în nucleul atomul de protium cel mai simplu element chimic, cel mai răspândit în univers. Există doar 1 proton și nu există neutroni în acest nucleu. Există un al doilea tip de hidrogen - este deuteriu. Probabil că mulți au auzit acest cuvânt. Vă rugăm să rețineți: numărul de serie este 1, iar numărul de masă este 2. Deci nucleul de deuteriu este format deja din 1 proton și un neutron. Și există un alt izotop al hidrogenului. Se numește tritiu. Tritiul este doar (numărul de serie unu), iar numărul de masă indică faptul că există 2 neutroni în nucleul acestui izotop. Și un alt element este uraniul. Destul de cealaltă parte a tabelului periodic. Acestea sunt deja elemente grele. Uraniul are 2 izotopi comuni. Acesta este uraniul 235. Numărul de serie este 92, iar numărul de masă este 235. Puteți vorbi imediat despre cum diferă nucleul unui element de altul. Al doilea izotop: de asemenea, numărul de serie 92 și numărul de masă 238. Foarte des, când în cauză despre izotopi, în special uraniu, nu spuneți niciodată numărul de serie. Ei spun doar „uraniu”, numesc elementul chimic și spun că numărul său de masă este 238. Sau uraniu 235. Discutăm această problemă din simplul motiv că știm cât de important este astăzi acest element chimic pentru energia țării noastre și în general pentru energia mondială în ansamblu.
Următoarea întrebare pe care trebuie să o atingem rezultă din cele spuse. Cum sunt aceste particule, acești nucleoni, ținute în interiorul nucleului? Am numit diferite elemente chimice, diferiți izotopi, în special pentru elementele grele, unde nucleonii, i.e. protoni și neutroni, mulți. Cum, cum sunt păstrate în interiorul nucleului? Știm că într-un nucleu la distanță mică, dimensiunea nucleului este foarte, foarte mică, un număr mare de particule de nucleon pot fi colectate. Cum sunt acești nucleoni acolo atât de dens, strâns ținuți de ce forțe? Într-adevăr, din cauza repulsiei electrostatice, aceste particule trebuie să se dezintegreze foarte repede, să se împrăștie. Știm că numai sarcini opuse se atrag, particulele încărcate cu sarcini opuse. Dacă particulele sunt încărcate cu același nume, este clar că trebuie să se respingă. În interiorul nucleului se află protoni. Sunt încărcate pozitiv. Dimensiunea nucleului este foarte mică. În același nucleu există și neutroni, ceea ce înseamnă că trebuie să existe forțe care să țină împreună acele și alte particule. Chiar aceste forțe se numesc forțe nucleare. Forțele nucleare sunt forțe atractive care acționează între nucleoni. Putem spune că aceste forțe au proprietățile lor speciale.
Prima proprietate despre care trebuie să vorbim este aceea forțele nucleare trebuie să depășească forțele de repulsie electrostatică.Și așa este, când a fost posibil să le determine, s-a dovedit că sunt de 100 de ori mai mari decât forțele de repulsie electrostatică. O altă notă foarte importantă este că forțele nucleare operează la o distanță scurtă. De exemplu, 10 -15 m - acesta este diametrul miezului, aceste forțe acționează. Dar de îndată ce dimensiunea nucleului crește la 10 -14, ceea ce părea a fi destul de puțin, acest lucru duce la faptul că nucleul se va descompune în mod necesar. La această distanță, forțele nucleare nu mai sunt active. Și forțele de repulsie electrostatică continuă să acționeze, iar ele sunt responsabile pentru faptul că nucleul se descompune.
Un alt lucru de spus despre forțele nucleare este că nu sunt centrale, adică ele nu acționează de-a lungul liniei drepte care leagă aceste particule. Și faptul că forțele nucleare nu depind de faptul dacă particula are o sarcină sau nu, deoarece atât protonii, cât și neutronii intră în nucleu. Aceste particule sunt împreună. Astfel, concluzia este: aceste particule, nucleoni, sunt reținute în nucleu datorită forțelor nucleare, iar aceste forțe acționează numai în nucleu. De asemenea, se poate observa că forțele nucleare sunt importante în ceea ce privește stabilitatea nucleară. Responsabil pentru longevitatea existenței acestui element. În concluzie, mai putem observa un lucru: când vorbim despre energie, tocmai aici forțele nucleare vor juca rolul principal. Vom vorbi despre asta în lecțiile următoare. La revedere.
Sarcina pentru lecție.
1. Determinați compoziția nucleonilor nucleelor de fier(numărul de nucleoni, protoni, neutroni).
2. Există 22 de protoni și 26 de neutroni în nucleul unui atom al unui element chimic. Denumiți acest element chimic.
3. Estimați puterea interacțiunii gravitaționale dintre doi neutroni din nucleu. Masa unui neutron este aproximativ egală cu 1,7 * 10 -27 kg, luați distanța dintre neutroni egală cu 10 -15 m, valoarea constantei gravitaționale este 6,67 * 10-11 (N * m 2) / kg 2.
Numar de masa
Cunoașterea numărului de masă vă permite să estimați masa nucleului și a atomului. Dacă numărul de masă este cunoscut, atunci masa M un atom și nucleul său se estimează din următoarea relație M ≈ A m N, Unde m N ≈ 1,67 10 −27 kg este masa unui nucleon, adică a unui proton sau a unui neutron. De exemplu, un atom de aluminiu-27 și nucleul său conțin 27 de nucleoni (13 protoni și 14 neutroni). Masa sa este aproximativ egală cu 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg. Dacă este necesar să se obțină masa nucleului cu o precizie mai mare, atunci trebuie luat în considerare faptul că nucleonii din nucleu sunt legați de forțele de atracție nucleară și, prin urmare, în conformitate cu relația E=mc 2 masa nucleului scade. Masa totală a electronilor pe orbite în jurul nucleului ar trebui, de asemenea, adăugată la masa unui atom. Cu toate acestea, toate aceste corecții nu depășesc 1%.
| 238 92 U | → | 234 90 Th | + | 4 2 El |
în partea stângă, numărul de masă al nucleului inițial este 238, în partea dreaptă a reacției sunt două nuclee cu numerele de masă 234 și 4, ceea ce dă un total de 238. Având în vedere că numărul de masă al unei particule alfa (nucleul de heliu-4) este 4, dezintegrarea alfa reduce numărul de masă al nucleului în descompunere cu 4 unități. Orice tipuri de dezintegrare beta (dezintegrarea beta minus, dezintegrarea pozitronilor, captarea electronilor, toate tipurile de desintegrare dublă beta) nu modifică numărul de masă, deoarece în acest proces doar transformarea unor nucleoni ai nucleului de la un tip la altul (protoni). în neutroni sau înapoi). De asemenea, tranziția izomeră nu modifică masa numărul de bază.
Note
Vezi si
Fundația Wikimedia. 2010 .
Vedeți ce este „numărul de masă” în alte dicționare:
- (numar de nucleoni, simbol A), numarul total de NUCLEONI (NEUTRONI si PROTONI) din NUCLEARUL ATOMULUI. De obicei, este scris ca un superscript înaintea simbolului chimic al elementului. Astfel, cel mai ușor element, hidrogenul, are un singur proton în nucleu și ... ... Dicționar enciclopedic științific și tehnic
Numărul total de nucleoni (neutroni și protoni) în at. miez. Diferit pentru izotopii aceleiași substanțe chimice. element. Dicţionar enciclopedic fizic. M.: Enciclopedia Sovietică. Redactor-șef A. M. Prokhorov. 1983. NUMĂR DE MASĂ ... Enciclopedia fizică
Numărul de nucleoni dintr-un nucleu atomic. De obicei, este indicat în partea din stânga sus a simbolului unui element chimic (de exemplu, 10V) ... Dicţionar enciclopedic mare
NUMAR DE MASA- numărul total de nucleoni (protoni și neutroni) din nucleul atomic, notat cu A și indicat prin indicele din stânga sus a simbolului elementului corespunzător, de exemplu. 32S înseamnă un izotop de sulf cu un număr de masă de 32 (A = 32). Masa izotopului este egală cu întregul ...... Marea Enciclopedie Politehnică
numar de masa- — [Ya.N. Luginsky, M.S. Fezi Zhilinskaya, Yu.S. Kabirov. Dicționar englez rus de inginerie electrică și inginerie energetică, Moscova] Subiecte de inginerie electrică, concepte de bază EN număr de masă ... Manualul Traducătorului Tehnic
Numărul de nucleoni dintr-un nucleu atomic. Indicat de obicei în partea stângă sus a simbolului unui element chimic (de exemplu, 10V). * * * NUMĂR DE MASĂ NUMĂR DE MASĂ, numărul de nucleoni dintr-un nucleu atomic. Indicat de obicei în partea stângă sus a simbolului elementului chimic ...... Dicţionar enciclopedic
numar de masa- masės skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: engl. numar de masa; numărul nuclear; numărul de nucleon vok. Massenzahl, f; Nukleonenzahl, f rus. numărul de masă, n; număr… … Penkiakalbis aiskinamasis metrologijos terminų žodynas
numar de masa- masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: engl. numar de masa; numărul nuclear; numărul nucleonilor ing. numar de masa... Chemijos terminų aiskinamasis žodynas
numar de masa- masės skaičius statusas T sritis fizika atitikmenys: angl. numar de masa; numărul nuclear; numărul de nucleon vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. număr de masă, n pranc. nombre de masse, m; nombre de nucléons, m … Fizikos terminų žodynas
Numărul de nucleoni (protoni și neutroni) dintr-un nucleu atomic; notat cu litera A și este de obicei indicat în stânga sus, lângă simbolul elementului, de exemplu, 32S înseamnă un izotop de sulf cu A \u003d 32. M. h. Și sarcina nucleară Z, exprimată în unități elementare ... Marea Enciclopedie Sovietică
Centrul unui atom conține cea mai mare parte a masei sale și toată sarcina sa pozitivă. Această regiune a atomului se numește nucleu.
Dimensiunile unui atom sunt m, iar dimensiunile nucleului 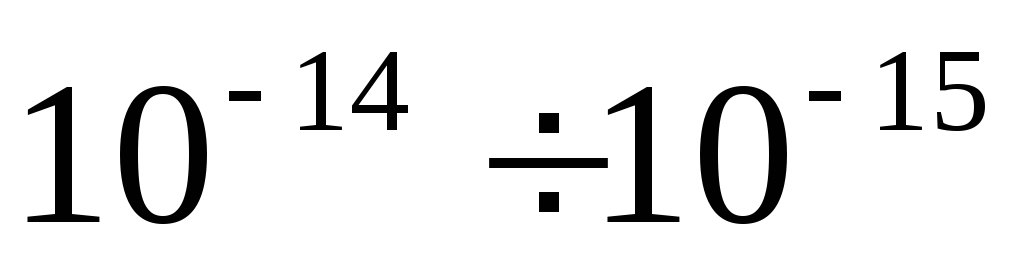 m masa nucleului este de 99,95% din masa atomului. Într-un atom neutru Z electroni. Sarcina nucleară este pozitivă și un multiplu al sarcinii elementare
m masa nucleului este de 99,95% din masa atomului. Într-un atom neutru Z electroni. Sarcina nucleară este pozitivă și un multiplu al sarcinii elementare 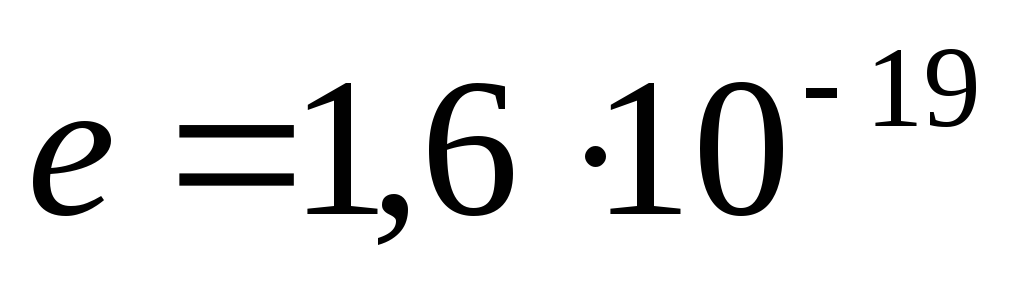 Cl. Sarcina nucleară poate fi reprezentată ca
Cl. Sarcina nucleară poate fi reprezentată ca 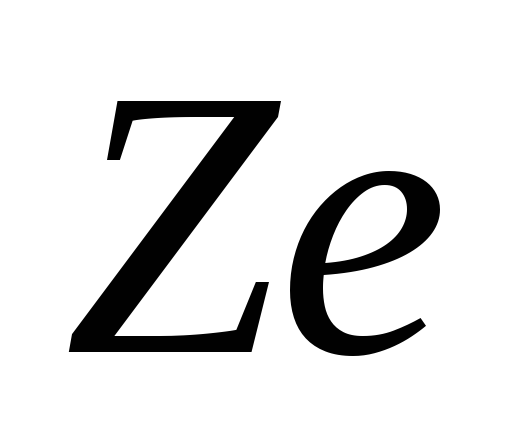 , Unde Z- numărul de sarcină, coincide cu numărul chimic al tabelului periodic și este egal cu numărul de protoni care intră în nucleu.
, Unde Z- numărul de sarcină, coincide cu numărul chimic al tabelului periodic și este egal cu numărul de protoni care intră în nucleu.
A doua cea mai importantă caracteristică a nucleului este masa sa. Masa nucleului s-a dovedit a fi mai mare decât suma maselor protonilor care intră în nucleu.
S-a sugerat că nucleul conține particule neutre. În 1932, Chadwig a descoperit neutronii. Ivanenko și Heisenberg au propus teoria proton-neutron a nucleului. Nucleul se împarte în protoni și neutroni. Se numesc nucleoni. Numărul total nucleonii din nucleu numit număr de masăA
.
Numărul total de neutroni este N=A-Z. Masa în repaus a unui proton este 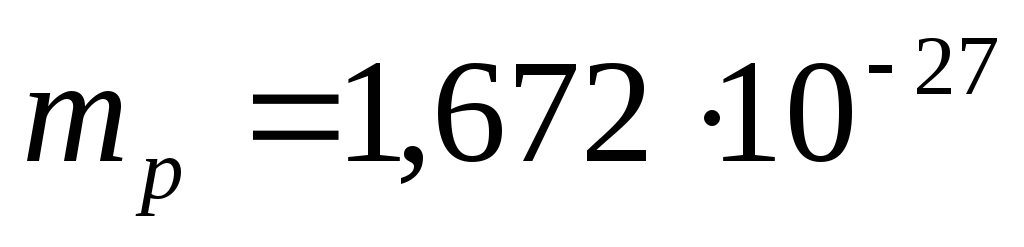 kg, masa neutronilor este
kg, masa neutronilor este 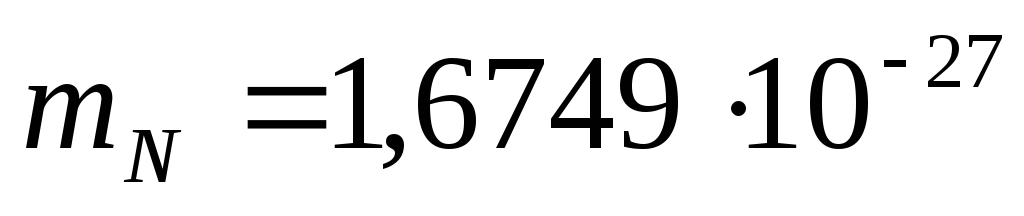 kg.
kg.
Nucleul unui element chimic este notat cu același simbol ca atomul neutru. 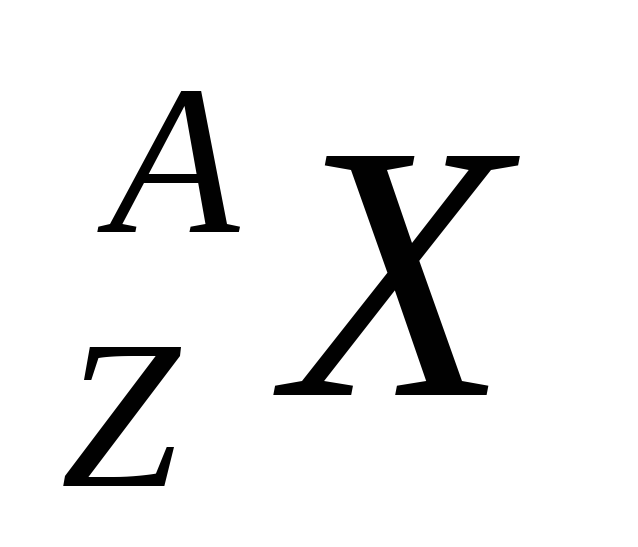 , Unde Z- numărul atomic (sarcină nucleară), A- numărul de masă (numărul de nucleoni din nucleu). Nucleii cu același număr de sarcină dar cu mase diferite se numesc izotopi (izotopii diferă prin numărul de neutroni). Nucleii cu același număr de masă dar cu sarcini diferite se numesc izobare.
, Unde Z- numărul atomic (sarcină nucleară), A- numărul de masă (numărul de nucleoni din nucleu). Nucleii cu același număr de sarcină dar cu mase diferite se numesc izotopi (izotopii diferă prin numărul de neutroni). Nucleii cu același număr de masă dar cu sarcini diferite se numesc izobare.
28. Proprietăţile forţelor nucleare.
Caracteristicile forțelor nucleare:
29. Radioactivitate. Dezintegrarea alfa și beta. Reguli de deplasare.
Se numește radioactivitate transformarea izotopilor instabili ai unui element chimic în izotopi ai altui element, însoțită de emisia anumitor particule. Radioactivitatea naturală se referă la radioactivitatea observată în izotopii instabili naturali. Radioactivitatea artificială se numește radioactivitatea izotopilor obținuți ca urmare a reacțiilor nucleare.
Radiațiile radioactive au o compoziție complexă. Într-un câmp magnetic, un fascicul îngust de radiație radioactivă este împărțit în trei componente:

 - particule -
flux de nuclee de heliu cu o sarcină Z=2
eși numărul de masă A=4
(
- particule -
flux de nuclee de heliu cu o sarcină Z=2
eși numărul de masă A=4
(![]() ). Viteză
). Viteză  -particule este egală cu
-particule este egală cu 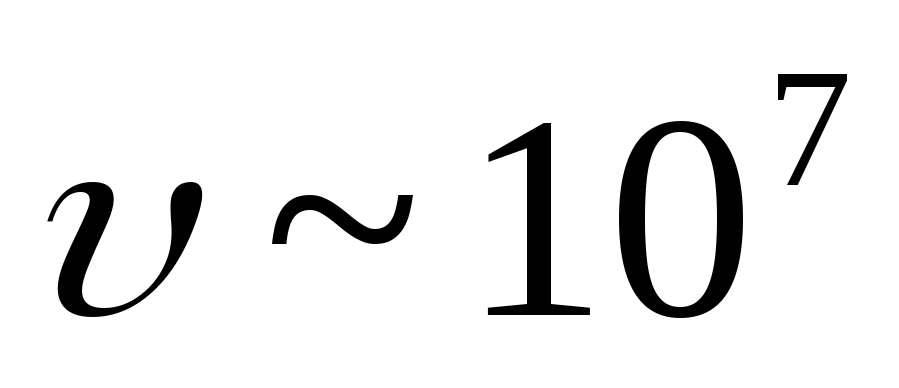 Domnișoară. Intrarea în substanță
Domnișoară. Intrarea în substanță  -particulele interacționează activ cu atomii și moleculele, îl ionizează și îl excită. Când energia
-particulele interacționează activ cu atomii și moleculele, îl ionizează și îl excită. Când energia  -particula este redusă la mișcare termică, captează doi electroni și se transformă într-un atom de heliu ( El). Înainte de asta, ea trece printr-o potecă numită alergare. Din cauza interacțiunii puternice cu materia, raza de acțiune este scurtă. O foaie de hârtie sau haine țin sus
-particula este redusă la mișcare termică, captează doi electroni și se transformă într-un atom de heliu ( El). Înainte de asta, ea trece printr-o potecă numită alergare. Din cauza interacțiunii puternice cu materia, raza de acțiune este scurtă. O foaie de hârtie sau haine țin sus  -particule. Foaia de aluminiu de 0,05 mm grosime, de asemenea, intarzie
-particule. Foaia de aluminiu de 0,05 mm grosime, de asemenea, intarzie  -particule. Capacitate de ionizare
-particule. Capacitate de ionizare  -particulele sunt mari si egale
-particulele sunt mari si egale 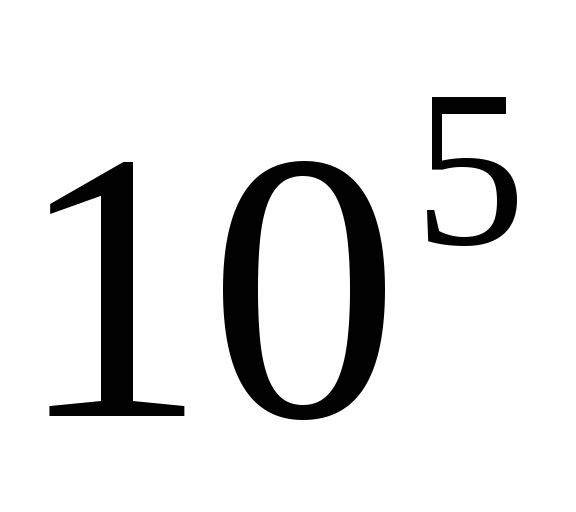 abur peste fugă.
abur peste fugă.
 -particule
este un flux de electroni care iese din nuclee cu o viteză
-particule
este un flux de electroni care iese din nuclee cu o viteză 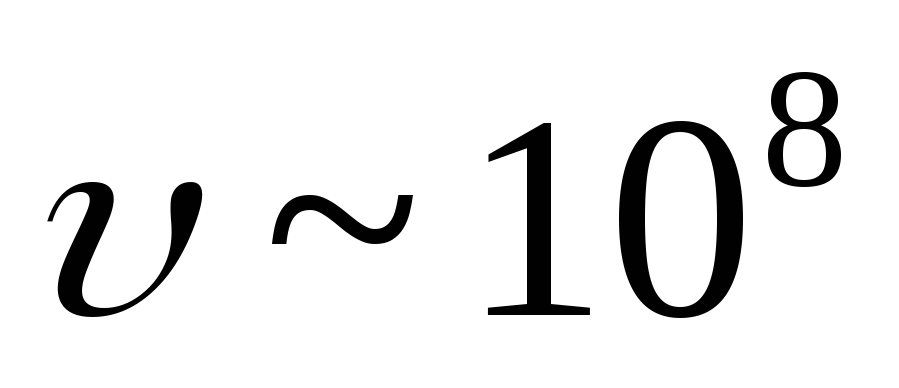 Domnișoară. Nucleul emite un electron atunci când un neutron devine proton:
Domnișoară. Nucleul emite un electron atunci când un neutron devine proton:
Unde  - simbolul electronului,
- simbolul electronului, 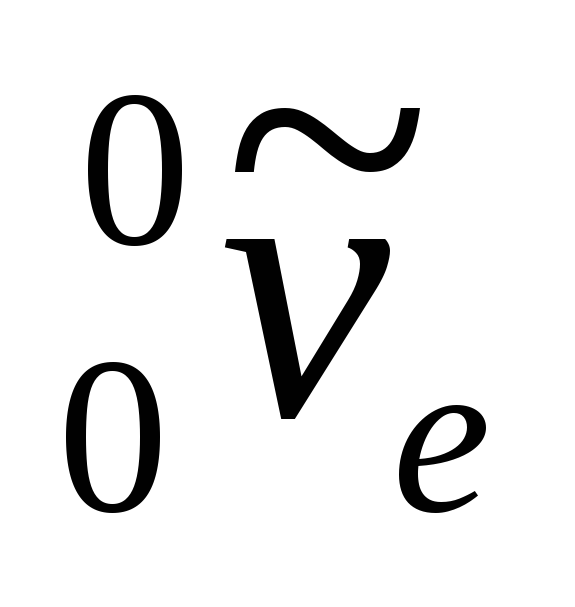 - antineutrino electronic.
- antineutrino electronic.
Capacitate de ionizare  particule de sute de ori mai mici decât
particule de sute de ori mai mici decât  -particule, iar puterea de penetrare este mai mare.
-particule, iar puterea de penetrare este mai mare.  - radiatia este intarziata de un strat de aluminiu de 2 mm grosime.
- radiatia este intarziata de un strat de aluminiu de 2 mm grosime.
Studiul nucleelor atomice a început după stabilirea următoarelor fapte experimentale: 1) descoperirea în 1896 de către omul de știință francez Henri Becquerel a radioactivității naturale; 2) descoperirea în 1910 de către omul de știință englez Soddy a izotopiei elementelor chimice; 3) modelul nuclear al atomului, propus în 1911 de marele fizician englez Ernest Rutherford.
Rutherford, investigând radioactivitatea, a ajuns în 1908 la concluzia că în timpul dezintegrarii radioactive are loc transformarea atomilor unor elemente chimice în atomi ai altor elemente. Mai târziu, în timp ce studia trecerea particulelor a cu o energie de câțiva megaelectroni-volți prin pelicule subțiri de aur, Rutherford a descoperit modelul nuclear al atomului, după care a devenit clar că în timpul radioactivității, nucleele unor elemente sunt transformate în nucleele altor elemente.
Descoperirea izotopiei a jucat un rol suplimentar. Greutăți atomice, adică masele atomilor elementelor pure chimic, de regulă, sunt exprimate în a.m.u. numere care nu sunt foarte apropiate de numere întregi. De exemplu, greutatea atomică a borului (B) este 10,82; Ne - 20,183; CI - 35,457; Fe -56,85;… . Odată cu descoperirea izotopiei, s-a stabilit opinia că un element chimic pur este un amestec de izotopi care diferă între ei în greutate atomică. Greutățile atomice ale izotopilor s-au dovedit a fi mai apropiate de numere întregi decât greutățile atomice ale elementelor și, cu cât mai aproape, cu atât izotopul este mai ușor, de exemplu. cu atât greutatea atomică este mai mică. Acest lucru i-a condus pe oamenii de știință la ideea că nucleul este format din particule ale căror greutăți atomice sunt apropiate de unitate. Această condiție este bine îndeplinită de nucleul atomului de hidrogen - un proton, a cărui greutate atomică este aproape de unitate (1,008). În plus, deoarece sarcina protonului este pozitivă, a apărut ideea că compoziția nucleului trebuie să includă în mod necesar protoni. Alte particule constitutive ale nucleului au avut nevoie de mult timp pentru a le descoperi. Fenomenul β-activității naturale părea să indice faptul că electronii au fost incluși în compoziția nucleului. Prin urmare, a fost propus un model proton-electron al nucleului. Cu toate acestea, modelul proton-electron s-a dovedit a fi insuportabil. Conform acestui model, spinul unui nucleu format dintr-un număr par de protoni și electroni trebuie să fie întreg (spinul unui proton, ca și spinul unui electron, este ½ ħ), iar în practică, numere semiîntregi sunt de asemenea observate. Modelul nu a explicat de ce momentul magnetic al nucleului este de 2000 de ori mai mic decât momentul magnetic al electronului. În cele din urmă, modelul proton-electron s-a dovedit a fi în conflict cu principiul Heisenberg. Cunoscând dimensiunea nucleului, este posibil să se estimeze mărimea impulsului electronului, care face parte din nucleu, și, în consecință, mărimea energiei sale. Astfel de estimări arată că energia unui electron dintr-un nucleu este de aproximativ 200 MeV. Conform experimentului, energia de legare a unei particule din nucleu este de 7 - 8 MeV. În plus, energia de 200 MeV este de multe ori mai mare decât energia electronilor emiși de nucleu în timpul dezintegrarii β.
O cale de ieșire din dificultate a fost găsită după ce în 1932, angajatul lui Rutherford, Chadwick, a descoperit un nou particulă elementară- neutroni. Masa unui neutron este aproximativ egală cu masa unui proton, depășind-o ușor, iar sarcina electrică este 0. La scurt timp după descoperirea neutronului, în 1934, fizicianul sovietic D.D. Ivanenko a înaintat o ipoteză despre proton- structura neutronică a nucleului. Aceeași ipoteză a fost propusă independent de Heisenberg.
În prezent structura proton-neutron a nucleului este universal recunoscut și stă la baza ideilor moderne despre nucleu și întreaga fizică nucleară.
Conform datelor moderne, protonul (p) are o sarcină pozitivă, egal cu taxa electrod qp= 1,6. 10 -19 C și masa de repaus m p= (1,0075957 ±0,000001) amu = (1836,09±0,01) pe mine.
Neutron (n) - particulă neutră cu masă în repaus m n= (1,008982 ±0,000003)a.m.u. = (1838,63 ± 0,01) pe mine, unde 1amu = 1,667 . 10 -27 kg - 1/12 din masa atomului de C 12;
pe mine= 9,106. 10 -31 kg – masa în repaus a unui electron.
În fizica modernă, se crede că protonul și neutronul sunt două stări de încărcare ale aceleiași particule, care sunt numite nucleon(din lat. nucleu - miez). Deci, protonul este starea protonică a nucleonului, neutronul este starea neutronică a nucleonului. Numărul total de nucleoni dintr-un nucleu atomic se numește numărul de masă A.
Nucleul atomic este caracterizat de sarcina Ze , Unde Z este numărul de încărcare al nucleului, egal cu numărul de protoni din nucleu și care coincide cu numărul de serie al elementului chimic din sistemul periodic de elemente al lui Mendeleev. Cele 107 elemente cunoscute în prezent ale tabelului periodic au numere de încărcare ale nucleelor de la Z = 1 la Z = 107. Deoarece Z este egal cu numărul de protoni din nucleu, numărul de neutroni din nucleu este: N = A - Z . fizica nucleara se obișnuiește să se desemneze nucleul cu același simbol cu atomul neutru: , unde X- simbol
element chimic, Z- numărul atomic (numărul de protoni din nucleu), DAR- numărul de masă (numărul de nucleoni din nucleu).
Deoarece atomul este neutru, sarcina nucleului determină numărul de electroni din atom. Numărul de electroni determină distribuția lor în stările atomului, care, la rândul său, determină proprietățile chimice ale atomului. În consecință, sarcina nucleară determină specificul unui element chimic dat, adică determină numărul de electroni dintr-un atom, configurația acestora învelișuri de electroni, magnitudinea și natura câmpului electric intraatomic.
Kernel-uri cu același Z, dar diferit DAR(adică, cu numere diferite de neutroni) se numesc izotopi, iar nucleele cu același DAR, dar diferite izobare Z. De exemplu, hidrogenul ( Z= 1) are trei izotopi; - protium ( Z =1, N= 0) ; - deuteriu, ( Z =1, N= 1); - tritiu ( Z =1, N= 2).În marea majoritate a cazurilor, izotopii aceluiași element chimic au aceeași substanță chimică și aproape identice proprietăți fizice(excepția sunt izotopii de hidrogen), care sunt determinați în principal de structura învelișurilor de electroni, care este aceeași pentru toți izotopii unui element dat.
Următoarele nuclee pot servi ca exemplu de nuclee izobare: , , . În prezent, se cunosc peste 2500 de nuclee care diferă Z, sau A, sau amândouă.
Rutherford a arătat asta nuclee atomice au dimensiuni de aproximativ 10 -14 - 10 -15 m (pentru comparație, dimensiunile liniare ale atomului sunt de aproximativ 10-10 m). Raza miezului - dată prin formula empirică R = R0 A 1/3 unde R0= (1,3 ÷ 1,7) 10 -15 m. Cu toate acestea, atunci când se folosește acest concept, trebuie avut grijă din cauza ambiguității sale, de exemplu, din cauza estompării limitei nucleului. Volumul nucleului este proporțional cu numărul de nucleoni din nucleu. În consecință, densitatea materiei nucleare este aproximativ aceeași pentru toate nucleele: ρ » 10 17 kg/m 3 .
Numar de masa
Cunoașterea numărului de masă vă permite să estimați masa nucleului și a atomului. Dacă numărul de masă este cunoscut, atunci masa M un atom și nucleul său se estimează din următoarea relație M ≈ A m N, Unde m N ≈ 1,67 10 −27 kg este masa unui nucleon, adică a unui proton sau a unui neutron. De exemplu, un atom de aluminiu-27 și nucleul său conțin 27 de nucleoni (13 protoni și 14 neutroni). Masa sa este aproximativ egală cu 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg. Dacă este necesar să se obțină masa nucleului cu o precizie mai mare, atunci trebuie luat în considerare faptul că nucleonii din nucleu sunt legați de forțele de atracție nucleară și, prin urmare, în conformitate cu relația E=mc 2 masa nucleului scade. Masa totală a electronilor pe orbite în jurul nucleului ar trebui, de asemenea, adăugată la masa unui atom. Cu toate acestea, toate aceste corecții nu depășesc 1%.
92 238 U → 90 234 T h + 2 4 H e (\displaystyle (\mathsf (_(92)^(238)U\rightarrow _(90)^(234)Th+_(2)^(4)El )))În partea stângă, numărul de masă al nucleului inițial este 238, în partea dreaptă a reacției sunt două nuclee cu numerele de masă 234 și 4, care în total dă 238. Ținând cont de faptul că numărul de masă al unui particula alfa (nucleul de heliu-4) este 4, dezintegrarea alfa reduce numărul de masă al nucleului în descompunere cu 4 unități. Orice tipuri






